474
www.postepybiochemii.pl
Elżbieta Karczmarewicz
*
Edyta Czekuć-Kryśkiewicz
Roman S. Lorenc
1
Zakład Biochemii i Medycyny Doświadczal-
nej, Instytut „Pomnik - Centrum Zdrowia
Dziecka”, Al. Dzieci Polskich 20, 04-730 War-
szawa
*
Zakład
Biochemii
i
Medycyny
Doświadczalnej, Instytut „Pomnik - Centrum
Zdrowia Dziecka”, Al. Dzieci Polskich 20, 04-
730 Warszawa; tel.: (22) 815 17 76, faks: (22) 815
17 89, e-mail: biochemia@czd.pl
Artykuł otrzymano 5 listopada 2012 r.
Artykuł zaakceptowano 7 listopada 2012 r.
Słowa kluczowe: witamina D, PTH, FGF-23,
PChN, Klotho, CYP24A, kość, nerka
Wykaz skrótów: 25(OH)D — kalcydiol, me-
tabolit witaminy D; 1,25(OH)
2
D — 1,25-di-
hydroksywitamina D, kalcytriol, aktywny
biologicznie metabolit witaminy D; FGF-23
(ang. fibroblast growth factor 23) — 23. czynnik
wzrostowy fibroblastów; PChN — przewlekła
choroba nerek; PTH — parathromon; RAS —
układ renina-angiotensyna; VDR (ang. vitamin
D receptor) — jądrowy receptor witaminy D
Patologie związane z gospodarką wapniowo-fosforanową
StRESzCzEniE
O
gromny postęp w badaniach nad regulacją gospodarki fosforanowej oraz metaboli-
zmem witaminy D otworzył nowe perspektywy w leczeniu przewlekłej choroby nerek
(PChn) — najpoważniejszej i coraz powszechniejszej patologii gospodarki wapniowo-fos-
foranowej człowieka. zwiększenie ładunku fosforanów transportowanego przez nefrony
jest czynnikiem indukującym szereg patologicznych procesów, które powodują, że układ
regulacyjny wpada w przypominającą błędne koło spiralę regulacyjną obniżenia stężenia
białka Klotho, zwiększenia stężenia FGF-23, obniżenia stężenia 1,25(OH)
2
D i podwyższenia
stężenia parathormonu (PtH). Podstawową interwencją jest więc ograniczenie podaży fos-
foranów z diety lub leczenie farmakologiczne preparatami wiążącymi fosforany. Właściwa
suplementacja witaminą D zabezpieczająca właściwą podaż substratu do lokalnej syntezy
1,25(OH)
2
D, którym jest 25(OH)D, indukuje syntezę Klotho, hamuje wydzielanie PtH oraz
obniża poziom 23. czynnika wzrostowego fibroblastów (FGF-23) poprzez proanaboliczne
działanie na kość. Właściwe zaopatrzenie ustroju w witaminę D wpływa korzystnie na Klo-
tho poprzez hamowanie układu renina-angiotensyna (RAS), podobnie jak rozyglitazon i in-
hibitory enzymu konwertującego angiotensynę. Prowadzone są badania nad nowoczesnymi
terapiami PChn, wśród których wymienia się inhibitory CYP24A, enzymu szlaku katabo-
licznego 1,25(OH)
2
D oraz przeciwciała skierowane przeciwko FGF-23.
WPROWADzEniE
Postęp w badaniach nad regulacją gospodarki wapniowo-fosforanowej orga-
nizmu dokonał się na dwóch ważnych polach. Odkrycie FGF-23, jako głównego
czynnika regulacji gospodarki fosforanowej, umiejscowiło kość wśród innych
organów endokrynnych, takich jak nerka czy przytarczyce [1-10]. Wykazanie
lokalnego, wielonarządowego, pozanerkowego działania 1,25(OH)
2
D w prawie
wszystkich tkankach organizmu zmieniło zasady suplementacji witaminą D i
ujawniło jej rolę w regulacji gospodarki fosforanowej [11-20].
CzYnniKi REGuLACYjnE GOSPODARKi WAPniOWO-FOSFORAnOWEj
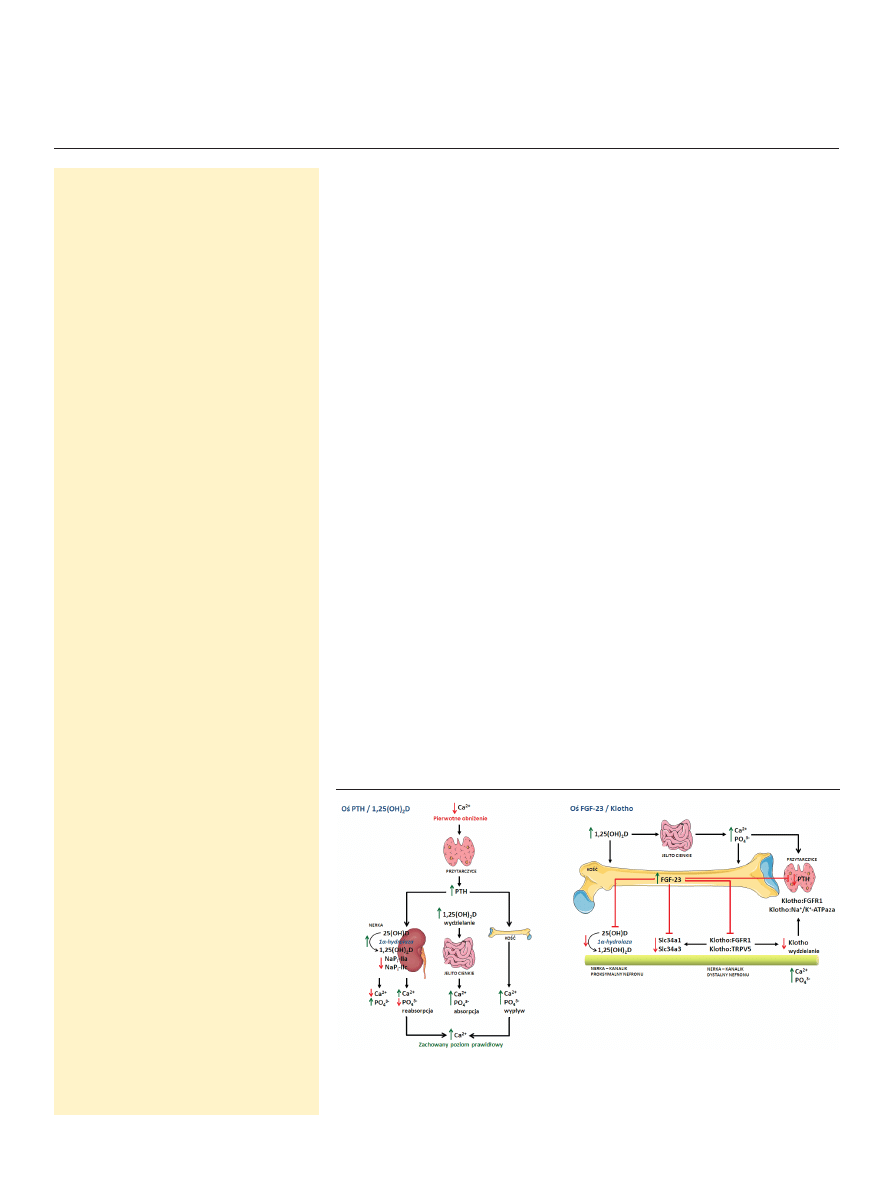
Homeostaza mineralna organizmu utrzymywana jest dzięki współdziałaniu
czterech hormonów: 23. czynnika wzrostowego fibroblastów (FGF-23, ang. fi-
broblast growth factor 23), parathormonu (PTH), aktywnego hormonalnie meta-
bolitu witaminy D — 1,25-dihydroksywitaminy D (1,25(OH)
2
D) i białka Klotho
(Ryc. 1) oraz trzech głównych organów: przytarczyc, nerek i kości [1-4]. PTH i
1,25(OH)
2
D regulują homeostazę wapniowo-fosforanową. Spadek stężenia wap-
nia w surowicy stymuluje wydzielanie przez przytarczyce PTH, który redukuje
kalciurię, pobudza aktywność 1α-hydroksylazy 25(OH)D, zwiększa fosfaturię
Rycina 1. Współdziałanie pomiędzy FGF-23, PTH, 1,25(OH)
2
D i Klotho w regulacji gospodarki wapniowo-
-fosforanowej (PTG — przytarczyce); opracowano na podstawie [2].
Postępy Biochemii 58 (4) 2012
475
w moczu oraz pobudza uwalnianie wapnia i fosforanów z
tkanki kostnej. Podwyższone stężenie 1,25(OH)
2
D pobudza
jelito do zwiększonej absorpcji wapnia z diety, a to zwrot-
nie obniża wydzielanie PTH. Wchodzący w skład drugiej
pary hormonów FGF-23 wytwarzany jest przez komórki
kostne, osteocyty, w odpowiedzi na podwyższone stęże-
nie 1,25(OH)
2
D i fosforanów. Jego receptor, który stanowi
kompleks FGFR1 z białkiem Klotho, zlokalizowany jest na
powierzchni błony części dystalnej kanalików nerkowych.
Wynikiem działania FGF-23 jest przede wszystkim obniże-
nie stężenia fosforanów i 1,25(OH)
2
D w surowicy poprzez
hamowanie reabsorpcji fosforanów w nerce i aktywno-
ści 1α-hydroksylazy 25(OH)D (CYP27B1) oraz stymulację
24-hydroksylazy 25(OH)D (CYP24A1). FGF-23 zmniejsza
również ekspresję genu Klotho w nerce, co prowadzi do ob-
niżenia kanalikowej reabsorpcji wapnia, ponieważ Klotho
jest jednym z regulatorów liczebności kanałów transportu-
jących jony wapnia zależnych od potencjału, takich jak re-
ceptor waniloidowy typu V (TRPV5). Czynnikami stymulu-
jącymi syntezę FGF-23 w kości są 1,25(OH)
2
D, podwyższo-
ny metabolizm kostny oraz obniżona mineralizacja tkanki
kostnej [8,9,15].
POzAnERKOWA LOKALnA AKtYWnOść
WiELOnARząDOWA WitAminY D
Analiza prac opublikowanych w ostatnich latach suge-
ruje, że właściwe zaopatrzenie ustroju w witaminę D nie
jest w swej istocie problemem żywieniowym, lecz proble-
mem z zakresu endokrynologii [11,13,19]. Aktywną biolo-
gicznie formą witaminy D w organizmie jest jej metabolit
— 1,25(OH)
2
D (kalcytriol). Należy on do nadrodziny hor-
monów bezpośrednio modulujących aktywność wielu ge-
nów. Kalcytriol poprzez wiązanie się z jądrowym recepto-
rem VDR (ang. vitamin D receptor), a potem bezpośrednie
wiązanie z DNA reguluje aktywność około 5% ludzkiego
genomu (500 genów), co wskazuje na działanie wielonarzą-
dowe i plejotropowe tego hormonu [13]. Oprócz tkanek i
narządów odpowiadających za utrzymanie homeostazy
wapniowo-fosforowej (jelito cienkie, tkanka kostna, nerki,
przytarczyce) receptor VDR został dotychczas zidentyfiko-
wany w 36 organach i tkankach organizmu człowieka, m.in.
w mięśniu sercowym, mięśniach gładkich, limfocytach
B i T, gruczołach dokrewnych, mózgu. Ponadto obecność
1α-hydroksylazy, enzymu przekształcającego 25(OH)D do
aktywnej formy — 1α,25(OH)
2
D, stwierdzono nie tylko w
nerkach, ale także w innych organach i tkankach. Aktyw-
ność 1α-hydroksylazy zaobserwowano m.in. w komórkach
śródbłonka komórkach mięśni gładkich naczyń krwiono-
śnych, aktywnych makrofagach. Są to tzw. hydroksyla-
zy obwodowe, którym przypisuje się coraz większe zna-
czenie w oddziaływaniu witaminy D na organizm ludzki
[13,16,19].
W odróżnieniu od innych hormonów bezpośrednio mo-
dulujących aktywność wielu genów (glukokortykosteroidy,
mineralokortykosteroidy, progesteron, androgeny, estro-
geny) synteza 1,25(OH)
2
D jest bezpośrednio ograniczana
dostępnością substratu, jakim jest 25(OH)D (kalcydiol), me-
tabolit syntetyzowany w wątrobie z natywnej witaminy D.
Dlatego też celem właściwej suplementacji witaminy D jest
zapewnienie wystarczającej ilości substratu (czyli 25(OH)
D), do syntezy 1,25(OH)
2
D (aktywnego hormonalnie meta-
bolitu witaminy D) we wszystkich tkankach, gdzie mani-
festowana jest jej szeroka aktywność biologiczna. Przyjmu-
je się dzisiaj, że dla optymalizacji wszystkich aktywności
biologicznych witaminy D stężenie 25(OH)D w surowicy
powinno wynosić 30–60 ng/ml. Takie stężenie uzyskuje się
przy suplementacji dzieci i dorosłych dawką 1000–4000 IU
witaminy D (formy natywnej) na dzień [19].
PRzEWLEKłA CHORObA nEREK (PCHn)
Przewlekła choroba nerek (PChN, ang. chronic kidney
disease, CKD) jest definiowana jako schorzenie trwające co
najmniej 3 miesiące, wywołane strukturalną anomalią lub
czynnościowymi zaburzeniami układu moczowego, prze-
biegające z lub bez obniżenia przesączania kłębuszkowego
(GFR, ang. glomerular filtration rate), manifestujące się obec-
nością jawnej patologii albo obecnością wskaźników uszko-
dzenia nerek. PChN klasyfikowana jest w 5 stadiach: od
przewlekłej choroby nerek z prawidłową filtracją do schył-
kowej niewydolności wymagającej terapii nerkozastępczej.
Dotychczas uważano, że w PChN główną konsekwencją
jest upośledzenie syntezy 1,25(OH)
2
D, co prowadzi do
nadczynności przytarczyc, a w rezultacie do ich przerostu,
której towarzyszą patologie kostne związane z podwyższe-
niem metabolicznego obrotu kostnego [20].
Według najnowszych badań we wczesnych stadiach
PChN nie obserwuje się rzeczywistego braku syntezy
1,25(OH)
2
D [2,8,12]. Obniżenie stężenia 1,25(OH)
2
D (głów-
nie poprzez stymulację jego katabolizmu przez 24-hydrok-
sylazę, CYP24A) jest wynikiem adaptacyjnej odpowiedzi
organizmu, zapewniającej obronę przed hiperfostemią,
poprzez redukcję indukowanej przez 1,25(OH)
2
D absorb-
cji jelitowej fosforanów oraz przez podwyższenie poziomu
PTH, który razem z FGF-23 stymuluje wydalanie fosfora-
nów (działanie fosfatemiczne). Z drugiej strony, w późnych
stadiach PChN (stadium 4–5) oraz w schyłkowej niewydol-
ności nerek (ESRD, ang. end stage renal disease) dominującym
czynnikiem stymulacji wydzielania FGF-23 jest podwyższo-
ny metabolizm kostny [8,17]. Nie wydaje się wiec słuszne
leczenie pacjentów na wczesnych etapach choroby prepa-
ratami 1,25(OH)
2
D, który dodatkowo zwiększa wydzielanie
FGF-23. Terapie ukierunkowane powinny być na zmianę
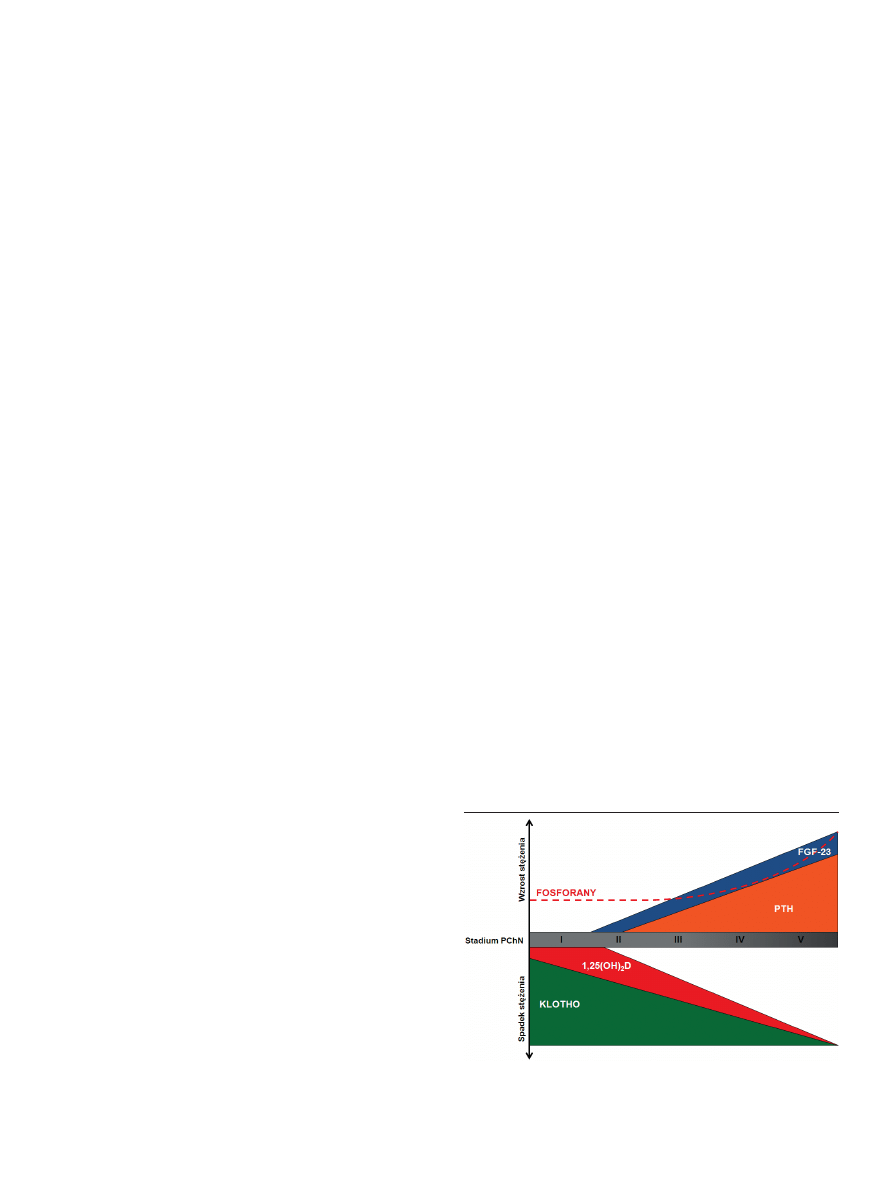
Rycina 2. Zmiany stężeń FGF-23,Klotho, PTH, 1,25(OH)
2
D i fosforanów w czasie
progresji PChN od stadium 1 do 5; opracowano na podstawie [8].

476
www.postepybiochemii.pl
lokalnych czynników, które mogą jak najwcześniej zahamo-
wać wzmożoną syntezę FGF-23 zapobiegając indukcji CY-
P24A, enzymu, który degraduje nie tylko 1,25(OH)
2
D, ale
także 25(OH)D.
Dynamikę patologicznych zmian w rozwoju PChN od
stadium 1 do 5 przedstawia rycina 2. Pierwszym czynni-
kiem, którego obniżenie obserwuje się w PChN już w 1.
stadium choroby jest Klotho [8]. Spadek stężenia Klotho i
1,25(OH)
2
D oraz wzrost stężenia PTH poprzedza objawy
hyperfosfatemii w trakcie progresji PChN. Deficyt Klotho
skutkuje brakiem odpowiedzi nerki na FGF-23, co indukuje
syntezę tego hormonu w celu utrzymania właściwej home-
ostazy fosforanowej. Jednak wzrost stężenia FGF-23 powo-
duje obniżenie poziomu 1,25(OH)
2
D, naturalnego stymula-
tora syntezy Klotho, co tym bardziej wzmaga szybkość jego
utraty w organizmie. Ponadto niskie stężenie 1,25(OH)
2
D
dodatkowo podnosi stężenie PTH, a PTH w dodatnim
sprzężeniu zwrotnym stymuluje wzrost stężenia FGF-23. W
końcowych stadiach rozwoju choroby podwyższone stęże-
nie fosforanów wzmacnia patologie w obrębie wszystkich
czterech czynników regulacyjnych [2-10].
nOWE mEtODY LECzEniA PCHn
Wczesna profilaktyka rozwoju PChN powinna skupiać
się na zapobieganiu utracie Klotho. Takie działanie wyka-
zuje 1,25(OH)
2
D przy prawidłowym zaopatrzeniu ustroju w
witaminę D gwarantującym właściwy poziom 25(OH)D do
lokalnej jego syntezy zarówno w nerkach, jak i przytarczy-
cach. 1,25(OH)
2
D poprzez genomowe działanie VDR pro-
wadzi do ekspresji genu Klotho. Stężenie białka Klotho jest
odwrotnie proporcjonalne do aktywności układu renina-an-
giotensyna (RAS) i dlatego czynniki obniżające aktywność
RAS, takie jak rozyglitazon oraz właściwa podaż witaminy
D, działają profilaktycznie zapobiegając rozwojowi PChN.
Zwiększenie stężenia Klotho w nerkach podnosi ich czu-
łość na FGF-23 i obniża jego poziom w surowicy, natomiast
w przytarczycach - zwiększa zdolność supresji PTH przez
FGF-23 [9,17,18,20].
Duże nadzieje wiąże się z badaniami nad związkiem ha-
mującym CYP24A1. CTA018 jest inhibitorem CYP24A1 oraz
agonistą VDR indukującym geny zależne od witaminy D.
W badaniach na zwierzętach związek ten skutecznie obni-
ża stężenie PTH. CTA018 znajduje się obecnie w drugiej fa-
zie badań klinicznych u pacjentów z zaawansowaną PChN
oraz wtórną nadczynnością przytarczyc [12].
Wymuszenie spadku poziomu aktywnego FGF-23 w
surowicy krwi może mieć efekt terapeutyczny np. w przy-
padku krzywicy/osteomalacji hipofosfatemicznej. Badania
przeprowadzone na modelu mysim wykazały, że już jedno
wstrzyknięcie przeciwciał skierowanych przeciwko FGF-23
wyrównywało hipofosfatemię i podwyższało zbyt niskie
poziomy 1,25(OH)
2
D. Stwierdzano przy tym wzrost eks-
presji genu kotransportera sodowo-fosforanowego typu 2a
oraz 1α-hydroksylazy 25(OH)D przy równoczesnym spad-
ku ekspresji genu 24-hydroksylazy [6].
Leki nowej generacji, kalcymimetyki, aktywują receptory
wapniowe komórek przytarczyc, co prowadzi do obniżenia
syntezy i wydzielania PTH, a w konsekwencji do spadku
stężenia wapnia i fosforanów we krwi, a także FGF-23 [2].
Dobre wyniki otrzymano stosując także dietę niskofosfora-
nową oraz leki wiążące fosforany [2,8].
Aktywne metabolity witaminy D, to jest 1,25(OH)
2
D i
1α(OH)D, ze względu na stymulację FGF-23 nie powinny
być stosowane w leczeniu PChN [8].
PODSumOWAniE
Właściwe zaopatrzenie organizmu w witaminę D (stę-
żenie 25(OH)D w surowicy krwi wynoszące 30-60 ng/ml)
zapewnia stabilizację gospodarki wapniowo-fosforanowej
poprzez: (a) bezpośrednie hamowanie przez 25(OH)D wy-
dzielania PTH przez przytarczyce oraz (b) proanaboliczne
działanie na tkankę kostną zapobiegające patologicznemu
wzrostowi stężenia FGF-23, a także (c) ochronę Klotho
wskutek supresji układu renina-angiotensyna przez 25(OH)
D w nerce i stymulacji syntezy Klotho w przytarczycach.
Ograniczone spożycie fosforanów zapobiega natomiast pa-
tologicznemu wzrostowi stężenia FGF-23 poprzez korzyst-
ny wpływ na transport ładunku fosforanów w nerce.
PiśmiEnniCtWO
1. Kuro-o M (2008) Endocrine FGFs and Klothos: emerging concepts.
Trends Endocrinol Metab 19: 239-245
2. Quarles LD (2008) Endocrine functions of bone in mineral metabolism
regulation. J Clin Invest 118: 3820-3828
3. Kim HS, Chung W, Kim S (2011) Vitamin D and kidney disease. Elec-
trolyte Blood Press 9: 1-6
4. Quarles LD (2012) Role of FGF23 in vitamin D and phosphate metabo-
lism: implications in chronic kidney disease. Exp Cell Res 318: 1040-
1048
5. Larsson TE (2010) The role of FGF-23 in CKD-MBD and cardiovascu-
lar disease: friend or foe? Nephrol Dial Transplant 25: 1376-1381
6. Juppner H, Wolf M, Salusky IB (2010) FGF-23: more than a regular of
renal phosphate handling? J Bone Min Res 25: 2091-2097
7. Quarles LD (2012) Skeletal secretion of FGF-23 regulates phosphate
and vitamin D metabolism. Nat Rev Rev Endocrinol 8: 276-286
8. Martin A, David V, Quarles LD (2012) Regulation and function of the
FGF23/klotho endocrine pathways. Physiol Rev 92: 131-155
9. De Borst MH, Velvloet MG, Ter Wee PM, Navis G (2011) Cross talk be-
tween the rennin-angiotensin-aldosterone system and vitamin D-FGF-
23-klotho in chronic kidney disease. J Am Soc Nephrol 22: 1603-1609
10. Łukaszkiewicz J, Lorenc R (2010) Regulacja metabolizmu fosforanów
przez kość. Rola czynnika wzrostowego fibroblastów. Polskie Archi-
wum Medycyny Wewnętrznej 120: 48-54
11. Christakos S, DeLuca HF (2011) Vitamin D: is there a role extraskeletal
health? Endocrinology 152: 2930-2936
12. Petkovich M, Jones G (2011) CYP24A1 and kidney disease. Curr Opin
Nephrol Hypertens. 20: 337-344
13. Haussler MR, Whitfield K, Kaneko I Forster R, Saini R, Hsieh JC,
Haussler CA, Jurutka PW (2012) The role of vitamin D in the FGF23,
klotho, and phosphate bone-kidney endocrine axis. Rev Endocr Metab
Disord 13: 57-69
14. Lishmanov A, Dorairajan S, Pak Y, Chaudhary K, Chockalingam A
(2011) Treatment of 25-0H vitamin D deficiency in older men with
chronic kidney disease stages 3 and 4 is associated with reduction in
cardiovascular events. Am J Ther, doi: 10.1097/MJT.0b013e3182211b3b
15. Turner AG, Anderson PH, Morris HA (2012) Vitamin D and bone
health. Scand J Clin Lab Invest 72: 65-72
16. Cianferotti L, Marcoccci C (2012) Subclinical vitamin D deficiency.
Best Pract Res Clin Endocrinol Metab 26: 523-537

Postępy Biochemii 58 (4) 2012
477
Pathologies of calcium-phosphate homeostasis
Elżbieta Karczmarewicz
*
, Edyta Czekuć-Kryśkiewicz, Roman S. Lorenc
Department of Biochemistry and Experimental Medicine, The Children’s Memorial Health Institute, Warsaw, Poland
*
e-mail: biochemia@czd.pl
Key words: vitamin D, PTH, FGF-23, CKD, Klotho, bone, CYP24A, kidney
AbStRACt
the colossal progress in understanding of vitamin D and phosphate metabolism introduces new perspectives in chronic kidney disease
(CKD) therapy. increasing demand for phosphate excretion per nephron triggers the vicious cycle that leads to increase in FGF-23 and PtH
and decrease in vitamin D and Klotho. Restriction of dietary phosphate intake (low phosphate diet) and administration of phosphate binder
can be regarded as the most important interventions in this case. because the vicious cycle is likely activated long before hyperphosphatemia
occurs during CKD progression, phosphate restriction would have been more effective if started before serum phosphate levels increased,
perhaps as soon as serum FGF-23 levels rose. Phosphate restriction alleviates phosphate overload per nephron and can disrupt the vicious
cycle: phosphate restriction can reduce serum FGF-23 levels and increase vitamin D, which in turn increase Klotho expression in kidney and
parathyroid glands. inhibitors of rennin-angiotensin system (rosiglitazone, angiotensin-converting enzyme inhibitors) and proper vitamin
D supplementation may also up-regulate Klotho expression. increased Klotho in the kidney may improve FGF-23 sensitivity, which further
reduce the amount of FGF-23 required for excreting a given amount of phosphate. increased Klotho in parathyroid may improve the ability
of FGF-23 to suppress PtH. Proper supplementation with vitamin D increase the concentration of substrate for local 1,25(OH)2D synthesis -
25(OH)D, which directly suppress PtH, increase Klotho, and decrease FGF-23 by proanabolic action on bone. improving vitamin D status by
inhibition of CYP24A is also under evaluation, as well as antibodies against FGF-23, as modern therapies in CKD.
17. Nakano C, Hamano T, Fuji N, Matsui I, Tomida K, Mikami S, Inoue K,
Obi Y, Okada N, Tsubakihara Y, Isaka Y, Rakugi H (2012) Combined
use of vitamin D status and FGF23 for risk stratification of renal out-
come. Clin J Am Soc Nephrol 7: 810-819
18. Urena-Torres P, Metzger M, Haymann JP, Karras A, Boffa JJ, Flamant
M, Vrtovsnik F, Gauci C, Froissart M, Houillier P, Stengel B (2011)
Association of kidney function, vitamin D deficiency, and circulating
markers of mineral and bone disorders in CKD. Am J Kidney Dis 58:
544-553
19. Lorenc R, Karczmarewicz E, Kryśkiewicz E, Płudowski P (2012) Zasa-
dy suplementacji i standardy oceny zaopatrzenia organizmu w wita-
minę D w świetle jej działania plejotropowego. Standardy Medyczne
(Pediatria) 5: 595-605
20. Grenda R (2012) Witamina D w przewlekłej chorobie nerek w wieku
rozwojowym, Standardy Medyczne (Pediatria) 5: 665-670
Wyszukiwarka
Podobne podstrony:
477 id 39059 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron