
WPROWADZENIE
Cytokiny s¹ to bia³ka wydzielane przez komórki uk³a-
du odpornociowego, które reguluj¹ wiele czynnoci ko-
mórek tego uk³adu. Cytokiny mo¿na podzieliæ wed³ug ich
funkcji na 3 g³ówne grupy: regulatory odpornoci wrodzo-
nej, regulatory odpornoci nabytej (adaptacyjnej) i regu-
latory hematopoezy (1). Niektóre cytokiny mog¹ uczest-
niczyæ zarówno w odpowiedzi wrodzonej, jak i nabytej,
dlatego te¿ podzia³ ten nie jest wykluczaj¹cy. Cytokiny
maj¹ specyficzne w³aciwoci:
mog¹ wywo³aæ efekt w komórce tylko pod warun-
kiem obecnoci receptora dla tej cytokiny, a na skutek po-
³¹czenia cytokiny z receptorem uruchomione zostaj¹ szla-
ki sygnalizacyjne. Wywo³ana zostaje tak¿e aktywnoæ
transkrypcyjna odpowiednich genów, co oznacza zwykle
zmianê czynnoci komórki i(lub) proliferacjê;
dzia³anie niektórych cytokin jest wielokierunkowe,
tzw. plejotropowe jedna cytokina mo¿e wywo³ywaæ
ró¿ne efekty(np. IL-1 czy IL-7);
dzia³anie niektórych cytokin ma charakter synergi-
styczny, np. IL-7 i IL-15 w utrzymaniu homeostazy lim-
focytów T czy IL-12 i IL-18 w procesie ró¿nicowania lim-
focytów T CD4+ w subpopulacje Th1 i Th2;
dzia³anie cytokin mo¿e byæ: 1) autokrynne (efekt na-
stêpuje w komórce, która wytwarza tê cytokinê, 2) para-
krynne efekt powstaje w komórce s¹siedniej i 3) dzia³a-
nie typu endokrynnego, jeli w obiegu krwi pojawi siê
du¿a iloæ cytokiny, co umo¿liwia powstanie efektu
w miejscu oddalonym od ród³a jej wytworzenia;
cytokiny powstaj¹ de novo po procesie aktywacji,
nie s¹ magazynowane w komórce.
Cytokiny maj¹ zdolnoæ wi¹zania siê z substancjami
pozakomórkowymi, w tym z ró¿nego rodzaju w³óknami
podcieliska szpiku, grasicy czy tkanek objêtych proce-
sem zapalnym. Wed³ug zebranych danych IL-2 i TNF-=
wi¹¿¹ siê z fibrynogenem i laminin¹, IL-4 i IFN-C z he-
paranem, a IL-7 z fibrynogenem i laminin¹ oraz z hepa-
ranem (2). Substancja pozakomórkowa s³u¿y zatem jako
depozyt cytokin, gotowych do dzia³ania na odpowiednie
komórki docelowe, jednak¿e dopiero po uwolnieniu
z kompleksu cytokinaelement substancji pozakomórko-
wej. W procesie uwalniania cytokin zasadnicz¹ rolê pe³-
ni¹ bia³ka enzymatyczne elastazy i metaloproteinazy, wy-
dzielane przez leukocyty.
Cytokiny odgrywaj¹ kluczow¹ rolê w regulacji odpo-
wiedzi immunologicznej, ³¹cznie z rozwojem komórek
immunologicznie kompetentnych, ich procesami ró¿nico-
wania, homeostaz¹ i utrzymaniem tolerancji immunolo-
gicznej. Homeostaza populacji limfocytów utrzymywana
jest dziêki precyzyjnej równowadze miêdzy proliferacj¹
i prze¿yciem tych komórek a ich apoptoz¹, za co jest od-
powiedzialny szereg cytokin, m.in. IL-7 i IL-15 (3).
Do cytokin zaliczamy wszystkie interleukiny, interfe-
rony, czynnik martwiczy nowotworu (TNF) oraz czynni-
217
Onkol. Pol. 2005, 8, 4: 217-222
ISSN 1505-6732
Prace pogl¹dowe
Cytokiny w procesach odpornociowych
Cytokines in immunity
Joanna Kopeæ-Szlêzak
Zak³ad Cytobiologii Hematologicznej Instytutu Hematologii i Transfuzjologii w Warszawie
STRESZCZENIE
W artykule omówiono zasady dzia³ania cytokin, g³ównie interleukin, w procesach wrodzonej
i adaptacyjnej odpornoci, z uwzglêdnieniem ostatnio opisanych cytokin. Przedstawiono tak-
¿e nowe dane na temat wczeniej znanych interleukin oraz przytoczono przyk³ady ich zasto-
sowania w immunoterapii nowotworów.
S£OWA KLUCZE:
cytokiny, interleukiny, odpornoæ, immunoterapia
ABSTRACT
The paper describes principles cytokine functions in innate and adaptative immunity together
with the role of new cytokines. In the article showed also data from last years about earlier
known cytokines and noted examples of cytokine advantage in cancer immunotherapy.
KEY WORDS:
cytokines, interleukines, immunity, immunotherapy
5OP4_03P.QXD 2/10/06 12:02 AM Page 217

ki wzrostu i chemokiny cytokiny o w³asnociach chemo-
taktycznych (tab. I).
UDZIA£ CYTOKIN
W REGULACJI ODPOWIEDZI ODPORNOCIOWEJ
Odpornoæ zwykle dzieli siê na wrodzon¹ (inaczej
nieswoist¹) oraz nabyt¹ (adaptacyjn¹). Odpornoæ wro-
dzona jest filogenetycznie starsza, a adaptacyjna m³od-
sza, a w jej przebiegu wyró¿nia siê etap aktywacji i etap
efektorowy.
1. ODPORNOÆ WRODZONA
Odpornoæ wrodzona jest pierwsz¹ lini¹ obrony orga-
nizmu przed mikroorganizmami. F³ówne elementy tego
systemu to bariera nab³onkowa, komórki o w³asnociach
fagocytarnych i cytolitycznych, tj. neutrofile, makrofagi
i komórki NK kr¹¿¹ce w krwi oraz bia³ka komplementu,
bia³ko C-reaktywne i cytokiny. Sporód cytokin nale¿y
wymieniæ interleukiny: IL-1, IL-12, IL-10, IL-15, IL-18,
IL-23 oraz interferon IFN-C, a tak¿e czynniki zwi¹zane
z procesem zapalnym, tj. czynnik martwiczy nowotworu
TNF-= i czynnik transformuj¹cy wzrostu TGF-> oraz
chemokiny (1, 6).
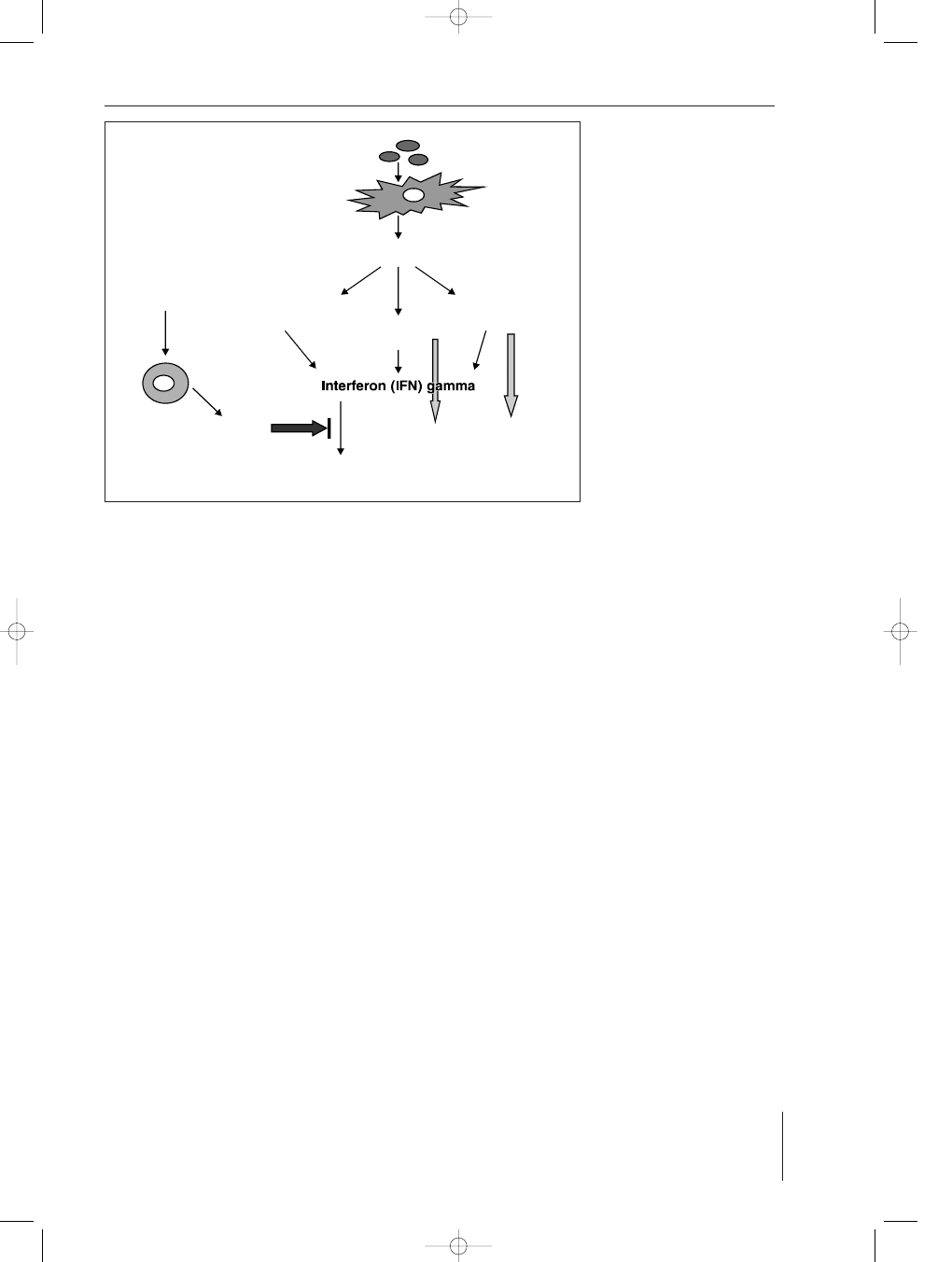
Obecnie uwa¿a siê, ¿e IL-12 jest zasadniczym media-
torem odpowiedzi wrodzonej, a tak¿e istotnym czynni-
kiem indukcyjnym odpowiedzi adaptacyjnej (ryc. 1).
Spektrum dzia³ania interleukiny IL-12 jest wielokierunko-
we (7):
stymulacja produkcji IFN-C przez komórki NK i lim-
focyty T,
zwiêkszenie ró¿nicowania limfocytów T CD4+
w kierunku Th1,
zwiêkszenie funkcji cytolitycznych komórek NK
i limfocytów T CD8+.
IL-23 dzia³a na limfocyty T pobudzaj¹c je do prolife-
racji. IL-15 jest okrelana jako g³ówny czynnik wzrosto-
wy komórek NK, a jej brak skutkuje powa¿nym niedo-
borem liczby komórek NK (8). IL-18 przede wszystkim
stymuluje syntezê IFN-C w limfocytach T i komórkach
NK i charakteryzuje j¹ synergizm dzia³ania z IL-12 (9).
218
Onkol. Pol. 2005, 8, 4: 217-222
ISSN 1505-6732
Cytokines in immunity
Kopeæ-Szlêzak J.
TABELA I. Wa¿niejsze cytokiny w reakcjach odpornoci: ich pochodzenie i funkcja lub komórki docelowe (wg 1)
TABLE I.
Cytokines in innate and adaptative immunity (acc. 1)
ród³o cytokiny
Cytokine source
Limfocyty T / T lymphocytes
Limfocyty T CD4+ / T CD4+ lymphocytes
Limfocyty T pamiêci
Memory T lymphocytes
Th1
Th2
Limfocyty B / B lymphocytes
Monocyty/Makrofagi / Monocytes/Macrophages
Komórki dendrytyczne / Dendritic cells
Cytokina
Cytokine
IL-2
IL-19
IL-21
IL-22
TNF-=
TGF->
IL-26
IFN-C
IL-4
IL-5
IL-10
IL-25
IL-12
IL-10
TNF-=
IFN-=
IL-15
IL-18
IL-7
IL-12
IL-23
IL-27
IL-28, IL-29
Funkcja i(lub) komórka docelowa
Function and(or) target cell
Stymulacja proliferacji limfocytów T i B / Stimulation of T and B cells proliferation
Stymulacja dojrzewania limfocytów T / T cell maturing stimulation
Proliferacja i ró¿nicowanie komórek dendrytycznych, NK, T i B / Dendritic cells, T cell and NK cells proliferation and diffe-
rentiation
Indukcja cytokin z rodziny IL-10, hamowanie wydzielania IL-4 / IL-10 cytokine family induction, IL-4 cytokine inhibition
Aktywacja neutrofili, apoptoza komórek / Neutrophil activation, cell apoptosis
Hamowanie proliferacji limfocytów B i T / Inhibition of T and B cells proliferation
Zmiana fenotypu limfocytów T po infekcji wirusem / T cell phenotype change after virus infection
Ró¿nicowanie limfocytów Th1, aktywacja makrofagów / Th1 cell differentiation, macrophage activation
Aktywacja limfocytów B / B cells activation
Stymulacja proliferacji limfocytów B / Stimulation B cell proliferation
Hamowanie aktywnoci IL-12 i IFN-C / IL-12 and IFN-
C inhibition
Indukcja syntezy IL-4 i IL-5 / IL-4 nad IL-5 synthesis induction
Ró¿nicowanie limfocytów Th1 i stymulacja komórek NK / Th1 cell differentiation, NK cells stimulation
Hamowanie aktywnoci IL-12 i IFN-C / Inhibition of IL-12 and IFN-
C activation
Aktywacja neutrofili, apoptoza komórek / Neutrophil actovation, cell apoptosis
Aktywacja komórek NK / NK cells activation
Proliferacja limfocytów T CD8 pamiêci i komórek NK / T CD8+ and NK cells proliferation
Indukcja limfocytów T CD4+ w kierunku Th1 lub Th2 / CD4+ T cells in Th1 and Th2 differentiation
Dojrzewanie limfocytów T i B / T and B cells maturing
Ró¿nicowanie Th1, stymulacja komórek NK / Th1 cell differentiation, NK cells stimulation
Stymulacja komórek NK i limfocytów T pamiêci / NK cells and T memory cells stimulation
Indukcja proliferacji limfocytów Th1 i ekspresji IL-12R / Th1 cells proliferation, IL-12 expression induction
Aktywnoæ przeciwwirusowa / Antiviral activity
5OP4_03P.QXD 2/10/06 12:02 AM Page 218
IL-10 ma zasadnicze dzia³anie inhibitorowe wobec
syntezy IL-12 w makrofagach i komórkach dendrytycz-
nych i w konsekwencji wstrzymuje syntezê IFN-C. IL-10
hamuje równie¿ aktywacjê limfocytów T oraz obni¿a eks-
presjê moleku³ klasy II MHC na komórkach prezentuj¹-
cych antygen, reguluje zatem w sposób negatywny rozwój
reakcji odpornociowej typu wrodzonego na infekcjê. In-
teresuj¹ce jest, ¿e wirus Epsteina-Barra zawiera gen ho-
mologiczny do genu ludzkiej IL-10 i w zwi¹zku z tym wi-
rus ten wykazuje analogiczne dzia³anie w reakcjach
odpornociowych jak IL-10 (10).
IFN-C jest wytwarzany w komórkach NK, limfocytach
CD4+ Th1 i CD8+. Komórki NK syntetyzuj¹ IFN w od-
powiedzi na stymulacjê IL-12. IFN-C jest g³ówn¹ cytoki-
n¹ aktywuj¹c¹ makrofagi, w których zwiêksza aktywnoæ
antybakteryjn¹ przez stymulacjê syntezy aktywnego tlenu
i tlenku azotu.
W odpornoci wrodzonej ród³em cytokin s¹ komórki
NK i makrofagi, stymulowane przez endotoksyny bakte-
ryjne lub IFN-C z limfocytów T. Objêtoæ wytworzonych
cytokin mo¿e byæ du¿a, ³atwo wykrywalna w surowicy
krwi, a efekt ich dzia³ania jest nie tylko lokalny.
2. ODPORNOÆ NABYTA (ADAPTACYJNA)
W tym rodzaju odpornoci cytokiny s¹ mediatorami
proliferacji i ró¿nicowania limfocytów po rozpoznaniu an-
tygenów w fazie wstêpnej (aktywacyjnej) odpowiedzi im-
munologicznej i aktywuj¹ specyficzne komórki efektoro-
we w fazie drugiej efektorowej. W odpowiedzi adapta-
cyjnej uczestnicz¹ g³ównie limfocyty T i B.
W rozwoju limfocytów T i B istotn¹ rolê pe³ni IL-7,
która jest czynnikiem warunkuj¹cym prze¿ycie i ekspan-
sjê progenitorowych komórek limfoidalnych (common
lymphoid progenitor CLP) (11). Jest ona wytwarzana
przez komórki podcieliska szpiku, komórki dendrytycz-
ne, prawid³owe i nowotworowe limfocyty B i T i ma
dzia³anie plejotropowe na homeostazê i prze¿ycie dojrza-
³ych limfocytów T: naiwnych i pamiêci.
Wytwarzanie cytokin w odpornoci adaptacyjnej jest
g³ówn¹ odpowiedzi¹ limfocytów T na rozpoznanie anty-
genów, limfocyty T s¹ bowiem zasadniczym ród³em
wielu interleukin, istotnych w kooperacji z limfocytami B.
G³ówne cytokiny wydzielane przez limfocyty Th1 to IL-
2 i IFN-C (pochodz¹cy równie¿ z komórek NK), aktywu-
j¹ce makrofagi i komórki cytotoksyczne. IL-2 jest odpo-
wiedzialna za ekspansjê limfocytów T po rozpoznaniu
antygenu i jest wytwarzana przez te same komórki, na
które dzia³a nazywana bywa autokrynnym czynnikiem
wzrostu dla limfocytów T (12). IL-4, wytwarzana przez
limfocyty T CD4+, powoduje ró¿nicowanie limfocytów
Th2, a z kolei limfocyty Th2 syntetyzuj¹ IL-5, indukuj¹-
c¹ proliferacjê limfocytów B.
Zasadnicza rola cytokin polega na regulowaniu koope-
racji miêdzy komórk¹ prezentuj¹c¹ antygen a limfocytem
T; wra¿liwoæ limfocytów na dzia³anie cytokin jest jednak
uzale¿niona od wczenejszego rozpoznania antygenu
zwi¹zanego z komórk¹ prezentuj¹c¹ antygen (APC)
i TCR limfocytu T. Cytokiny dzia³aj¹ zatem wybiórczo
tylko na takie komórki, które rozpozna³y antygen i mog¹
kontynuowaæ proces adaptacyjnej odpowiedzi odporno-
ciowej przechodz¹c do etapu efektorowego. Przestrzeñ
miêdzy komórk¹ APC a limfocytem T nazywana jest sy-
naps¹ immunologiczn¹ i w zasadzie tylko w niej stê¿enie
interleukin jest odpowiednio wysokie.
W odpornoci adaptacyjnej cytokiny maj¹ za zadanie
utrzymanie równowagi miêdzy procesami aktywacyjnymi
i hamuj¹cymi funkcje komórek, czyli pe³ni¹ funkcje regu-
lacyjne (1).
219
Onkol. Pol. 2005, 8, 4: 217-222
ISSN 1505-6732
Cytokiny w procesach odpornociowych
Kopeæ-Szlêzak J.
IL-12
limfocyt T naiwny
naive T lymphocyte
komórka NK
NK cell
limfocyt T Cd8+
T CD8+ lymphocyte
Aktywacja makrofagów i fagocytoza bakterii
Macrophage activation and microbe phagocytosis
Wzrost
aktywnoci cytolitycznej
komórek NK i TCD8+
T CD8+ and NK cells
cytolytic activity increase
makrofag i(lub) komórka dendrytyczna
macrophage and(or) dendritic cell
bakterie, antygeny
microbes, antigens
IL-2
limfocyt Th2
Th2 lymphocyte
IL-10
RYCINA 1. Dzia³anie IL-12 w odporno-
ci wrodzonej i adaptacyj-
nej (zmienione wg 1)
FIGURE 1. Interleukine IL-12 func-
tions in innate and adapta-
tive immunity (acc. 1
changed)
5OP4_03P.QXD 2/10/06 12:02 AM Page 219
RECEPTORY INTERLEUKIN
Dla cytokin wyró¿nia siê 5 rodzajów receptorów,
z których pierwsze 3 to receptory interleukin, typ IV to
receptory dla TNF, a typ V dla chemokin. Kryterium
podzia³u stanowi struktura zewn¹trzkomórkowych do-
men tych receptorów.
Typ I receptora charakteryzuje immunoglobulinopo-
dobna struktura zewn¹trzb³onowej domeny; nale¿¹ do
niego receptory dla IL-1, IL-16 i IL-18. Typ II wykazuje
obecnoæ cysteiny w domenie pozakomórkowej oraz tryp-
tofanu i seryny (typ II A) oraz dodatkowo domeny immu-
noglobulinopodobnej (typ II B). Do typu II A nale¿¹ m.in.
receptory dla IL-2, IL-3, IL-4, IL-5, IL-7, IL-15 oraz IL-21,
a do typu II B receptory dla IL-6 i IL-12. Typ III recep-
torów interleukin cechuje taka sama struktura, jak w typie
II, ale bez udzia³u tryptofanu i seryny; nale¿y do niego re-
ceptor dla IL-10, a tak¿e receptory dla IFN-= i IFN-C (1).
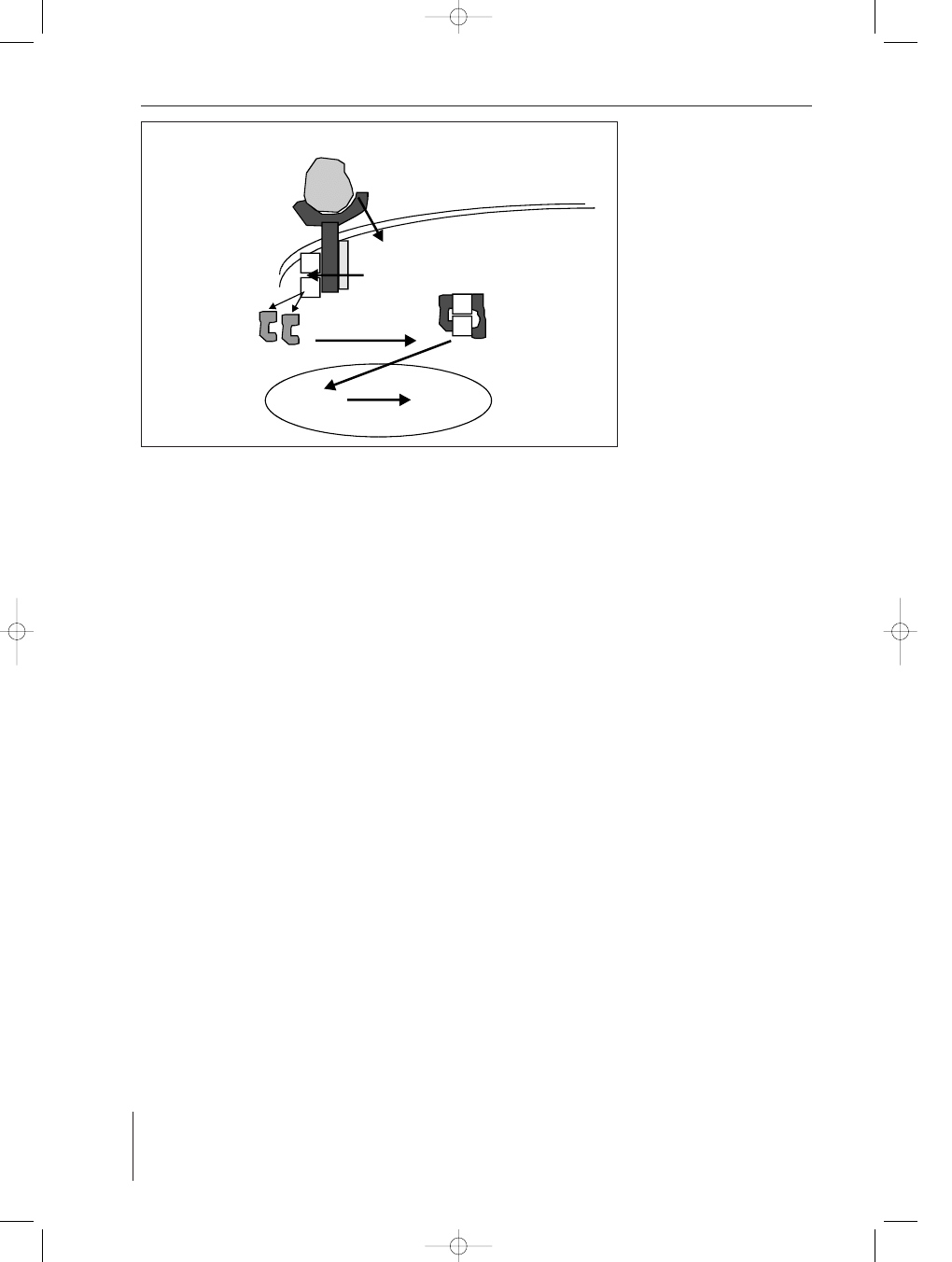
Zwi¹zanie cytokiny z odpowiednim receptorem urucha-
mia odpowiednie szlaki sygnalizacyjne wewn¹trz komór-
ki, a w efekcie koñcowym aktywizuje odpowiednie geny
w DNA, czego konsekwencj¹ jest zmiana w funkcjonowa-
niu komórki i np. wejcie w cykl komórkowy (proliferacja)
lub synteza bia³ek, zmieniaj¹cych stopieñ dojrza³oci ko-
mórki. Interleukiny po przy³¹czeniu do receptora zwykle
aktywuj¹ szlak sygnalizacyjny okrelany jako JAK/STAT.
Skrótem JAK oznacza siê kinazê Janusow¹ (od Janusa
rzymskiego bóstwa wrót), która uczestniczy w przenosze-
niu aktywacyjnych grup fosforowych na spoczynkowe bia³-
ko STAT (signal transducer and activator transcription
Stymulator transdukcji i aktywator transkrypcji); obecnie
wyró¿nia siê 6 rodzajów tego bia³ka. Uaktywniony STAT
dzia³a jak j¹drowy czynnik transkrypcyjny, przenosi bo-
wiem informacjê do j¹dra komórkowego, wi¹¿¹c odpowie-
dnie fragmenty DNA, co powoduje z kolei aktywnoæ
transkrypcyjn¹ odpowiednich genów (13) (ryc. 2).
Limfocyty T, B i komórki NK oraz makrofagi i komór-
ki dendrytyczne wykazuj¹ obecnoæ receptorów dla inter-
leukin w zale¿noci od linii komórkowej, stopnia dojrza-
³oci, czynników rodowiska (np. wp³ywu antygenów)
oraz od aktywacji komórki.
Receptorem dla IL-16 jest moleku³a CD4 o strukturze
immunoglobulinopodobnej (cilej jej 3 i 4 domena),
która wyznacza subpopulacjê limfocytów T pomocni-
czych. Niektóre receptory mog¹ wi¹zaæ wiêcej ni¿ jedn¹
interleukinê, np. ³añcuch > receptora dla interleukiny 2
(IL-2R>-CD122) wi¹¿e tak¿e IL-15. Receptory dla innych
cytokin mog¹ tworzyæ kompleksy, np. receptor IL-
24R jest z³o¿ony z IL-20R i IL-22 R, a heterodimeryczny
IL-26 R to kompleks dwóch elementów: receptora IL-
20R1 i IL-10R2 (14, 15).
Ekspresja receptora ³añcucha = dla IL-2 (CD25) wy-
znacza subpopulacjê limfocytów regulatorowych T CD4+
jest to przyk³ad tzw. ekspresji konstytutywnej receptora
interleukiny. Limfocyty T pomocnicze Th1 wykazuj¹ moc-
n¹ ekspresjê receptorów dla IL-12 i IL-18, podczas gdy na
limfocytach Th2 ekspresja taka nie wystêpuje; pozwala to
wyró¿niæ te subpopulacje limfocytów T CD4+ (16).
Ekspresja receptora dla IL-7 (CD127) wystêpuje na
progenitorowych komórkach limfocytów T i B, na które
IL-7 ma m.in. wp³yw antyapototyczny przez indukcjê syn-
tezy bia³ka Bcl-2 (11, 17). Ekspresja receptora dla IL-12
jest charakterystyczna tylko dla limfocytów B naiw-
nych (7).
W oparciu o strukturê receptorów wyró¿niono nastê-
puj¹ce rodziny interleukin: rodzinê IL-2, która obejmuje
równie¿ IL-4, IL-7, IL-9, IL-15 i IL-21, a receptory tych
interleukin maj¹ wspóln¹ podjednostkê oznaczon¹ C -c.
Ponadto interleukiny te ³¹czy udzia³ w utrzymywaniu ho-
meostazy limfocytów T. Rodzina IL-10 obejmuje interleu-
kiny IL-19, IL-22, IL-24, IL-26, IL-28 i IL-29, które wi¹-
¿¹ siê z receptorami typu II (Zdanov04), a do rodziny
IL-12 nale¿y IL-23 i IL-27 (19).
Niektóre receptory cytokin, tzw. soluble receptors,
mog¹ wystêpowaæ w postaci niezwi¹zanej z b³on¹ komór-
kow¹. Postaæ rozpuszczalna receptorów powstaje na sku-
220
Onkol. Pol. 2005, 8, 4: 217-222
ISSN 1505-6732
Cytokines in immunity
Kopeæ-Szlêzak J.
cytokina
cytokine
receptor cytokiny
cytokine receptor
P
P
kinaza Jak
Janus kinase
nieaktywny STAT
nonactive STAT
aktywny STAT
active STAT
gen promotor
transkrypcja
transcription
j¹dro komórkowe
cell nucleus
b³ona komórkowa
cell membrane
Jak-mediated
phosphorylation
P
P
RYCINA 2. Schemat szlaku sygnaliza-
cyjnego z udzia³em kinazy
JAK i bia³ka STAT (czynni-
ka transportuj¹cego i trans-
krypcyjnego) w komórce
po po³¹czeniu cytokiny
z jej receptorem (uproszcz-
one wg 1)
FIGURE 2. Cytokine signaling by the
kinase JAK and STAT after
cytokine-induced receptor
(acc. 1 modificated)
5OP4_03P.QXD 2/10/06 12:02 AM Page 220

tek aktywnoci enzymów proteolitycznych lub w wyniku
zmiany m.-RNA, a efektem tego jest synteza niepe³nej
moleku³y receptora: bez domeny transb³onowej i cytopla-
zmatycznej, ale ze zdolnoci¹ wi¹zania interleukiny, np.
IL-2. Stwierdzono, ¿e w chorobach o pod³o¿u autoimmu-
nologicznym oraz w ch³oniakach Hodgkina i w NHL stê-
¿enie ³añcucha = receptora IL-2 (CD25) w surowicy by-
³o wy¿sze, ni¿ u dawców krwi. Parametr ten mo¿e okazaæ
siê czynnikiem rokowniczym w tych chorobach hemato-
logicznych, bowiem uwolnienie du¿ych iloci sCD25
oznacza wzrost aktywnoci mitotycznej komórek (20).
Postaæ rozpuszczalna receptora dla IL-15 (sIL-15R) by³a
ju¿ nawet stosowana terapeutycznie w stanach zapalnych
podczas chorób o pod³o¿u autoimmunologicznym, w celu
zwi¹zania IL-15, której poziom ulega zaburzeniom (21).
INTERLEUKINY
W PATOGENEZIE I TERAPII NOWOTWORÓW
W przebiegu niektórych chorób nowotworowych ob-
serwowane s¹ zmiany zawartoci interleukin w surowicy
b¹d zmiany w ekspresji receptorów na komórkach nowo-
tworowych. Ostatnio stwierdzono, ¿e w rozwoju ludzkiej
bia³aczki z komórek T, wywo³ywanej przez wirusa typu
I (HLTV-1), uczestniczy interleukina IL-21. Komórki
bia³aczkowe T wykazywa³y mocn¹ ekspresjê aktywnego
receptora dla IL-21, a IL-21 in vitro ma w³asnoci indu-
kuj¹ce proliferacjê komórek ATL-43T linii klonalnych
pochodz¹cych od komórek bia³aczkowych T (22).
W rozwoju GVHD (graft versus host disease) proble-
mem s¹ zaburzenia gospodarki cytokin limfocyty
T pochodz¹ce od dawcy wydzielaj¹ IL-2, która zwiêksza
ekspansjê limfocytów cytotoksycznych T CD8+ i ko-
mórek NK, które niszcz¹ na drodze cytolizy przeszczepio-
ne komórki i tkanki (23). Z tego wzglêdu próbowano sto-
sowaæ terapiê skierowan¹ przeciw cytokinom (24).
W immunoterapii nowotworów do niedawna najczê-
ciej u¿ywano IL-2, zw³aszcza w ch³oniakach NHL z li-
nii B, które charakteryzuje s³aba odpornoæ, która mo¿e
przyczyniaæ siê do progresji choroby. IL-15 zwiêksza tak¿e
zdolnoæ proliferacyjn¹ limfocytów T, podobnie jak IL-2,
i obecnie próbuje siê stosowaæ IL-2 ³¹cznie z IL-15 (25).
Ponadto w ch³oniakach NHL z linii B stosowano tak¿e
z pozytywnym skutkiem IL-2 oraz rutiximab, za inni au-
torzy podawali z dobrym skutkiem IL-2 z komórkami NK
(26).
IL-7 stosowana na modelu dowiadczalnego raka p³uc
u myszy powodowa³a regresjê nowotworu przez mecha-
nizm dzia³ania komórek dendrytycznych oraz wykaza³a
hamuj¹cy wp³yw na czynnik TGF->, który obni¿a odpor-
noæ komórkow¹, natomiast opinie dotycz¹ce celowoci
zastosowania IL-10, jako elementu immunoterapii w prze-
wlek³ej chorobie GVH s¹ niejednoznaczne (27, 28).
Podzcas prób klinicznych podawano tak¿e IL-12, jed-
nak immunoterapia t¹ interleukin¹ obci¹¿ona jest du¿ymi
skutkami niepo¿¹danymi. (7). Stosowana w dowiadczal-
nym raku jelita grubego u myszy IL-27 nie wywo³ywa³a
tak silnych reakcji ubocznych, jak IL-12, a ogranicza³a
wzrost nowotworu i nawet chroni³a przed wznow¹ (29).
Dotychczas opisano 29 interleukin, ale wci¹¿ aktual-
ne jest pytanie: czy jest ich wiêcej? (30). Mo¿na powie-
dzieæ, ¿e w takich procesach, jak rozwój i ró¿nicowanie
limfocytów, homeostaza, tolerancja i pamiêæ immunolo-
giczna oraz odpornoæ organizmu interleukiny odgrywa-
j¹ rolê kluczow¹. Nowopoznane interleukiny, b¹d jako
oddzielny czynnik b¹d w po³¹czeniu z przeciwcia³ami
monoklonalnymi (np. CD20) lub te¿ z komórkami NK czy
komórkami dendrytycznymi, s¹ analizowane pod k¹tem
ich przydatnoci w immunoterapii nowotworów.
221
Onkol. Pol. 2005, 8, 4: 217-222
ISSN 1505-6732
Cytokiny w procesach odpornociowych
Kopeæ-Szlêzak J.
Pimiennictwo
1. Abbas A., Lichtman A.: Cytokines. [w:] Cellular
and molecular immunology. Elsevier Sannders,
Philadelphia 2005, 243-274.
2. Vaday G.G., Lider O.: Extracellular matrix mo-
ieties, cytokines, and enzymes: dynamic ef-
fect on immune cell behavior and inflammation.
J. Leukoc. Biol. 2000, 67, 149-159
3. Kopeæ-Szlêzak J.: Subpopulacje limfocytów T.
Onkol. Pol. 2005, 8, 17-20.
4. Bolander F.F.: Molecular endocrinology. Acad.
Press Elsevier, Amsterdam 2004.
5. Kang J., Der S.D.: Cytokine functions in the for-
mative stages of a lymphocytes life. Curr.
Opin. Immunol. 2004, 16, 180-190.
6. Reddy P.: IL-18: recent advances. Curr. Opin.
Hematol. 2004, 11, 405-410.
7. Watford W.T., Moriguchi M., Morinobu A.,
OShea J.J.: The biology of IL-12: coordinating
innate and adaptive immune responses. Cyto-
kine Growth Factor Rev. 2003, 14, 361-368.
8. Langrish C.L., McKenzie B.S., Wilson N.J.
i wsp.: IL-12 and IL-23: master regulators of in-
nate and adaptive immunity. Immunol. Rev.
2004, 202, 96-105.
9. Fal M., Gocicka T.: Interleukina 18. Post.
Hig. Med. Dow. 2003, 57, 685-609.
10. Conti P., Kempuraj D., Frydas S. i wsp.: T.C.:
IL-10 subfamily members: IL-19, IL-20, IL-22,
IL-24 and IL-26. Immunol. Lett. 2003, 88, 171-
-174.
11. Dias S., Silva H. Jr, Cumano A., Vieira P.: In-
terleukin-7 is necessary to maintain the B cell
potential in common lymphoid progenitors. J.
Exp. Med. 2005, 201, 971-979.
12. Benczik M., Gaffen S.L.: The interleukin (IL)-2
family cytokines: survival and proliferation si-
gnaling pathways in T lymphocytes. Immunol.
Invest. 2004, 33, 109-142.
13. Ivashkiv L.B.: Jak-STAT signaling pathways
in cells of the immune system. Rev. Immuno-
genet. 2000, 2, 220-230.
14. Wang M., Liang P.: Interleukin-24 and its re-
ceptors. Immunology 2005, 114, 166-171.
15. Sheikh F., Baurin V.V., Lewis-Antes A. i wsp.:
IL-26 signals through a novel receptor com-
plex composed of IL-20 receptor 1 and IL-10
receptor 2. J. Immunol. 2004, 172, 2006-
-2010.
16. Schluns K.S., Lefrancois L.: Cytokine control
of memory T-cell development and survival.
Nature Rev. Immunol. 2003, 3, 269-279.
17. Fuller M.J., Hildeman D.A., Sabbaj S. i wsp.:
Cutting edge: emergence of CD127high func-
tionaly competent memory T cells is compro-
mised by high viral loads and inadequate
T cell help. J. Immunol. 2005, 15, 5926-5930.
18. Zdanov A.: Structural features of the interleu-
kin-10 family of cytokines. Curr. Pharm. Des.
2004, 10, 3873-3884.
19. Lucas S., Ghilardi N., Li J., de Sauvage F.J.:
IL-27 regulates IL-12 responsiveness of nati-
ve CD4+ T cells through Stat1-dependent and
-independent mechanisms. Proc. Natl. Acad.
Sci. USA 2003, 100, 15047-15052.
20. Bieñ E., Balcerska E.: Interleukin-2 receptor
the structure, function and clinical significan-
ce in malignant diseases of adults and chil-
dren. Post. Med. Hig. 2003, 57, 669-683.
21. Waldmann T.A.: Targeting the IL-15/IL-
15R system in inflammantory autoimmune di-
seases. Arthritis. Res. Ther. 2004, 6, 174-
-177.
5OP4_03P.QXD 2/10/06 12:02 AM Page 221

Cytokines in immunity
Kopeæ-Szlêzak J.
22. Ueda M., Imada K., Imura A. i wsp.: Expres-
sion of functional interleukin-21 receptor on
adult T-cell leukaemia cells. Br. J. Haematol.
2005, 128, 169-176.
23. Vu M.D, Li X.C.: The common gamma-cyto-
kines and transplantation tolerance. Arch. Im-
munol. Ther. Exp. 2004, 52, 267-273.
24. Jacobsohn D.A., Vogelsang G.B.: Anti-cytoki-
ne therapy for the treatment of graft-versus-
host disease. Curr. Pharm. Des. 2004, 10,
1195-1205.
25. Spaner D.E., Hammond C., Mena J., Yon-
ghong S.: Effect of IL-2R
b
-binding cytokines
on costimulatory properties of chronic lym-
phocytic leukaemia cells: implications for im-
munotherapy. Br. J. Haematol. 2004, 127,
531-542.
26. Lotze M.T., Herberman R.B.: NK cells are
central to the immune response and immuno-
therapy of patients with cancer. Enhancer
2004, 2, 2-8.
27. Al-Rawi M.A., Mansel R.E., Jiang W.G.: Inter-
leukin-7 (IL-7) and receptor (IL-7R) signalling
complex in human solid tumors. Histol. Histo-
pathol. 2003, 18, 911-923.
28. Lee S.J.: New approaches for preventing and
treating chronic graft versus host disease.
Blood 2005, 105, 4200-4206.
29. Cordoba-Rodriguez R., Frucht D.M.: IL-23
and IL-27: new members of the growing fami-
ly of IL-12-related cytokines with important
implications for therapeutics. Exp. Opin. Biol.
Ther. 2003, 3, 715-723.
30. Gadina M., Ferguson P.R., Johnston J.A.:
New interleukins: are there any more? Curr.
Opin. Infect. Dis. 2003, 16, 211-217.
Adres do korespondencji:
Prof. dr hab. n. med. Joanna Kopeæ-Szlêzak
Instytut Hematologii i Transfuzjologii
Zak³ad Cytobiologii Hematologicznej
ul. Chocimska 5
00-957 Warszawa
e-mail: facsiht@ihit.waw.pl
Praca wp³ynê³a do Redakcji: 20.10.2005 r.
5OP4_03P.QXD 2/10/06 12:02 AM Page 222
Wyszukiwarka
Podobne podstrony:
Zaburzenia procesów odpornościowych w przebiegu infekcji wirusem HIV
W4 Proces wytwórczy oprogramowania
WEWNĘTRZNE PROCESY RZEŹBIĄCE ZIEMIE
Proces tworzenia oprogramowania
Proces pielęgnowania Dokumentacja procesu
Odpornosc swoista i nieswoista
19 Mikroinżynieria przestrzenna procesy technologiczne,
4 socjalizacja jako podstawowy proces spoeczny
TEMAT 9 hormony a odporność
modelowanie procesˇw transportowych
Odporność swoista
patofizjologia układu odpornościowego
Proces wdrazania i monitoringu strategii rozwoju
więcej podobnych podstron