
WYKŁAD 1
1. Informacje wstępne
Woda jest najbardziej rozpowszechnioną substancja chemiczna. Mówi się że 21 wiek będzie
wiekiem wody. Wiążą się z nią problemy dwojakiego rodzaju:
a) Jakościowe
b) Ilościowe
Ok. ¾ planety pokryta jest wodą. Jednak większośd osób cierpi na problem z pozyskiwaniem
wody i ten stan się pogłębia. Powszechnośd wody przyczyniła się do braku nawyków oszczędzana
i szanowania. W dzisiejszych czasach znów mamy zwrot ku wodzie – wykorzystywaniu i
oszczędzaniu. Stąd wiek wody. Woda jest substancją biogenna. Dzięki niej mamy pod każdym
względem (biol., chem., fiz., ekonomicznym) Zycie na ziemi. Nie Istnieje sektor życia który mógłby
bez wody przetrwad.
Wody w hydrosferze jest ok. 1,4 mld m^3. Problem w tym, że z tej całej masy tylko niewielki
procent można wykorzystad. Z całych zasobów 2,5% to woda słodka (zdatna do wykorzystania)
ale ¾ z tego stanowi woda w postaci stałej (lód) w kołach podbiegunowych i w wodach
podziemnych. Widzimy że do wykorzystania mamy kilka tysięcznych procenta wód zebranych w
wodach pow. , zbiornikach stojących i płytkich zalegających powierzchniowych.
Woda na świecie umieszczona jest bardzo nierównomiernie. Ponad 1 miliard ludzi nie ma
bezpośredniego (tj około 200m) dostępu do wody. Toteż dużo osób umiera na choroby ukł.
Pokarmowego wynikające ze zlej jakości wody.
Woda zawarta jest w opadach. Ogólnie na świecie są jednak obszary o bardzo dużych i małych
opadach. Koniecznością jest wiec racjonalizowanie wody i jej oszczędzanie !!!
Istnieją prace nad gromadzeniem wody jednak jest to głęboka ingerencja w naturę!!! Przykładem
jest nieostrożne gospodarowanie w jez. Azalskam(??????nie mam pojęcia jak na cos wpadniecie
to mi powiedzcie :PPP nie znam takiego jeziora) – poziom spadł o 15m.
Wzrost przyrostu populacji przemysłu powoduje znaczny wzrost w zużyciu wody. Wskaźnik
zużycia wody staje się więc wskaźnikiem uprzemysłowienia regionu. W Europie mieszkaniec
zużywa średnio 200l/dobę. Pobór wody jednak stale wzrasta co w 20 lat zużycie wody średnio się
podwaja.
O jakości wody decyduje jej skład chemiczny. Woda jest w jest w większym lub mniejszym
stopniu zanieczyszczona i powraca do otoczenia. W EC woda jest wykorzystywana również w
celach chłodniczych więc jest „zanieczyszczona cieplnie” a podgrzewanie wody może wpłynąc
niekorzystnie na mikroklimat.
Wodę powinno się oszczędzad i obchodzid się w stosunku do niej z szacunkiem. Oszczędzanie
może byd osiągnięte instalowaniem liczników wody gdzie za każdy litr płacimy.

W stosunku do innych substancji, woda jest niezastąpiona. Wody nie da się niczym zastąpid, poza
tym z ekonomicznego pkt. widzenia nie można ograniczyd dostępu do wody dla obywateli.
Woda stanowi problem ogólnoświatowy ze szczególnymi akcentami tam, gdzie jej break.
Cechy wody:
-najmniejsza cząstka z związków 3 atomowych
-jedyny ze swojej klasy związek występujący w stanie ciekłym
-specyficzny czynnik termodynamiczny
-duże Cwł, Cspal, Ctopnienia
-dzięki tym własnościom możliwa jest termoregulacja, Woda jest także akumulatorem ciepła i
wpływa na klimat. Organizm dzięki wodzie utrzymuje stałocieplnośd
-zmiana gęstości z temperaturą: tmaleje gęstośd rośnie, wiec tmaleje gęstośd
maleje(roftl!!!!!) czyli lód lżejszy od wody!!! (zbiorniki nie zamarzają więc do kooca w dolnych
partiach umożliwia życie, pyzatym zmiana gęstości powoduje stałą cyrkulacje napowietrzając
zbiornik)
-Duże wartości stałej dialektycznej około 40(decyduje o solach przyciąganie wewnętrzne
cząsteczki)
Wodę i w wodzie można wszystko rozpuścid toteż praktycznie nie występuje czysta woda tylko jest
zawsze jakimś roztworem. Na przykład czysta woda nie przewodzi prąd a woda jako roztwór- tak.
-tren i wodór jako cząstka posiadają zdolnośd przyłączenia dzięki istnieniu „wiązao wodorowych”
Te cechy wyróżniają wodę i sprawiają, że mogą istnied znane nam zjawiska środowiskowe.
Pomimo wielu znanych aspektów wody, istnieje wiele zjawisk, które nie maja odpowiedzi, np.
występowanie osadu, itd.
Istnieje wiele nauk zajmujących się wodą są to: Fizyka, Chemia, Hydrogeologia, gospodarstwo wodne,
hydrostatyka, technologia wody i ścieków, hydromechanika.
Znaczenie wody w rejonach życia
a) Woda dla org. Żywych
Woda jako czynnik biogeniczny umożliwia wytwarzanie materii- Jest składnikiem organizmów
rozpuszczalnikiem protoplazmy. Wykorzystuje się ją do transportu substancji odżywczych
(odżywianie – rozprowadzanie po organizmie). Jest czynnikiem termoregulacyjnym
(utrzymanie temperatury potrzebnej do procesów życiowych). Woda reguluje ciśnienie
osmoteryczne, jest amortyzatorem warstw zewnętrznych i.t.d.
-Najbardziej fundamentalną cecha jest powstawanie życia. Jest niezbędna do
zapoczątkowania procesów życiowych. Warto dodad że w organizmie człowieka jest około
65% wody. Dzięki wodzie możliwe są zapłodnienia.
-Dzięki wodzie poprzez trawienie substancji odżywcze mogą byd w stanie roztworu wodnego
dostarczone do krwi i dalej po organizmie ludzkim.

-Dzięki termoregulacyjnej cesze wody jesteśmy w stanie utrzymad stała temperaturę.
Regulujemy ją poprzez pot podczas wysiłków fizycznych. Nie dopuszcza to do uszkodzenia
organizmu ludzkiego e.c.t.
*Wpływ utraty wody:
-6% omdlenia
-10% halucynacje
-12% konieczna pomoc lekarska krew tak gęsta że nie może byd pompowana
*zawartośd wody w organizmach żywych: 2.1,2.2,2.3
*woda w organizmie człowieka może byd w dwóch postaciach albo związany albo wolny.
Niedostatek wody organizm sygnalizuje uczuciem pragnienia.
Bilans wody w organizmie musi byd zachowany!!!
b) Dla procesu fotosyntezy
Fotosynteza to zamiana energii słonecznej na energie chemiczną. Można ją zapisad jako:
6CO
2
+12H
2
0+energia=C
6
H
12
O
6
+6H
2
O+6O
2
Woda jest niezbędna dla procesu by wytworzyd niezbędny do życia tlen. Jest to tzw. „tlen
cesgmilacyjny(nie mam pojęcia)” i stanowi 70% tlenu dostarczanego do atmosfery.
c) Dla procesu transportu(to chyba nie to :()
Jest to proces związany z wyparowywaniem wody i do atmosfery(obieg), Ma to wpływ na klimat i
zjawiska meteorologiczne. Dorosły dąb może wyparowad około 300 m^3 wody w postaci pary w
ciągu 1 doby.
WYKŁAD 2
*Znaczenie wody dla przyrody nieożywionej
a) Dla procesów geologicznych
b) wpływ na klimat
c) środek transportu
d) formowanie środowiska
a) dla procesów geologicznych- oddziaływanie chemiczne i geochemiczne. Bierze udział w procesach
magmowych e.c.t. W magmie występuje jako para nasycona substancjami. Wędruje w górę i po
ostygnięciu występuje jako złoże minerów. Abrazja – podmywanie brzegów falami morskimi.

Hydratacja – uwalnianie minerałów. Do soli doczepiają się cząstki wody. Powstają hydraty. Hydroliza
– wody z solami, minerałami. Lodowce – podczas ich ruchu następuje rzeźbienie terenu.
b) Wpływ na klimat –oddziaływanie w:
- cyklu dobowym – pochłanianie promieniowania i oddawanie go ciepła w ciągu nocy.
- cykl roczny –zmiany pór roku
c) transport materiałów – będąc dobrym rozpuszczalnikiem transportuje mat odżywcze dla
organizmów. Około 2.7 mld ton rozpuszczonych materiałów jest transportowanych przez wodę.
Istnieją też materiały nierozpuszczalne w wodzie tkz unosiny woda wpływająca do dużych zbiorników
wody wpływa na zamulenie.
d) kształtowanie krajobrazu – ośrodki wypoczynkowe w pobliżu wód ??? (wtf co ten koles bredzi)
* Woda w sektorze komunalnym
Duże ośrodki zawsze były usytuowane nad wodą. Transportowano w niej surowce były podstawa do
rozwoju handlu między ośrodkami przemysłowymi.
Woda w przesyle może byd jako:
a) Surowiec – źródło substancji lub w procesach produkcyjnych (prod. Gazu wodnego)
b) Środowisko (reagent) katalizatora –używane w wielu przypadkach ze względu na łatwośd
rozpuszczania (dzięki temu łatwośd reagowania reagentów)
c) Rozpuszczalnik – w różnych gałęziach przemysłu
d) Wymiennik ciepła – przenoszenie ciepła, odparowanie nadmiaru ciepła
e) E) środek myjący i czyszczący
f) Hydrotransport – np. w elektrowniach celem wydalania odpadów ze spalania węgla, bo nie
powoduje palenia.
g) Przy pracach hydrotechnicznych- cele obronne (armatki) albo mycie ciśnieniowe
h) Destylacja, filtrowanie, płukanie, rozcieoczanie, flotacje
Woda w gospodarstwach komunalnych
a) Środek higieny miast, osiedli, domów
b) Baseny, turystyka
c) Środek leczniczy – leczenie oddziaływanie znane już od czasów starożytnego Egiptu.
Wodolecznictwo rozpoczął Hipokrates. Dziś istnieje SPA – samat per Aqua – zabiegi z użyciem
wody w szczególności hydroterapia. Często stosuje się w celu leczenia dolegliwości
mięśniowo- stawnych. Popularne stają się zabiegi flotacyjne gdzie leży się w wodzie z
ograniczeniem bodźców zewnętrznych ( światła, dźwięku). Inne zabiegi to talessoterapie –
wykorzystanie wód morskich i kąpiele w morzach + baseny z wodą morska i różnymi
substancjami mineralnymi. Lecznicze jest także picie odpowiedniej wody. Wody lecznicze
pozyskuje się z odwiertów taka woda powinna się cechowad stałym składem chemicznym
takim jak u źródła.
*Zagrożenia płynące z wody
a)wezbranie i powodzie

b) działanie erozyjne – podmywanie brzegów i skał
c) działają szkodliwie na maszyny gdyż zawierają magnetyczne substancje rozpuszczalne
d) zanieczyszczenie atmosferyczne są pochłaniane przez wodę i dostają się do wód gruntownych
e)wody podziemne mogą zalewad wąwoziska i kopalnie
Największym zagrożeniem są powodzie ponad 170 tys ludzi zginęło i ponad 2 mld ludzi cierpiało na
skutek powodzi na przełomie ostatnich lat. Wraz z biegiem czasu skutki są mniejsze wraz ze
wzrostem wiedzy na temat powodzi i systemów zapobiegających. W Polsce powodzie są zjawiskiem
częstym i prawie co 2 lata jest duża powódź. Powodując zawsze milionowe straty. Zjawisko to jest
bardzo trudne do przezwyciężenia można walczyd przez regulacje rzek i budowanie zbiorników
retencyjnych. Jest to jednak głęboka ingerencja w środowisko naturalne.
*Zasoby, zużycie, czystośd i koszty wody
Zasoby- na świecie jest 1.4 mld km^3 wody. Są to zasoby całkowite w hydrosferze: podziemia,
powierzchnia, w atmosferze. Woda pokrywa 74% powierzchni ziemi w tej ilości jest 2.5% wody
słodkiej (35 mln km^3) ale większośd z nich jest niedostępna lub trudno dostępna(wody Antarktydy,
Grenlandii…)
Granice słoności pow 18/m^3 soli
Ważną rolę w przyrodzie i obiegu wody odgrywają opady. Docierają do ziemi rozpływają się po
powierzchni ¾ opadów spada na obszar gdzie jest 1/3 populacji. Ważnym wskaźnikiem jest globalny
roczny odpływ wody/1 mieszkaoca. Polska jest krajem hydrologicznie zamkniętym- mały
wpływ/odpływ wód z kraju.
Zużycie- aktualnie zużywane są około 54% odpływów(wtf? Jak dla mnie opadów). Zużycie jest
największe w dużych miastach i w rolnictwie. Nawadnianie pól to około 70% światowego zużycia
wody. Na globie jest około 300 mln hektarów pól uprawnych.
Polska 70% przemysł, 20% gospodarstwa komunalne
84% w pow, 14% w podziemiu 2 % w kopalniach.
Zużycie jest zróżnicowane w zależności od tego do czego jest wykorzystywana ta woda. W zależności
od struktury przemysłowej różne ilości wody wykorzystywane do procesów.
W gosp komunalnej standardem jest zużycie rzędu 50l/dzien
Czystośd- Ten parametr określa jej skład chemiczny. Od jakości wody zależy proces technologiczny.
Czystośd tj. nie zawiera zanieczyszczeo pow. Osad, nie działa korozyjnie i nie zawiera zanieczyszczeo
dla procesu.
Osad powoduje-
-Wzrost chropowatości
- straty przepływowe

Woda jako czynnik zawiera tlen który oddziaływuje na korozje i jej rozwój odpowiednia jakośd
materiałów powoduje zabezpieczenie przed korozją.
Wodę do odpowiednich procesów może byd pozbawiona odpowiednich, zależnie od procesu,
związków, zanieczyszczeo.
Zanieczyszczenie wody dla zastosowao komunalnych są inne niż w zastosowaniu technicznym. Na
przykład wiele związków w kotle gdzie na 140stopcni Celsjusza przestaje istnied.
Odnotowujemy stopniowy spadek jakości wody. Istnieją środki poprawiające jakośd wody, sztuczne
uzdatnianie. Czystośd wody wymagana jest w mikrotechnice – zagęszczenie mikropro...czegoś
wymaga bardzo czystego pomieszczenia. W elektrowni woda, która powodowała by
wytrącanie osadu doprowadziła by do awarii. Mamy wzrost zapotrzebowania na czystą wodę.
Metody czyszczenia wody:
–
fizyczne (odwrotna osmoza)
–
chemiczne (destylacje)
Dzięki temu można uzyskad wodę o zwiększonej czystości. W medycynie: 2xdestylacje +
przepuszczenie
<ZDJĘCIE NIECZYTELNE>
by wyeliminowad przetrwalniki. Aktualnie czystą wodę
otrzymujemy przez syntezę czystego tlenu i wodoru.
Woda zupełnie czysta posiada cechy:
–
można wysoko przegrzad i przechłodzid (-40)
–
niezdrowa, pozbawiona mikroelementów i innych związków
Czystośd wody stale jest zagrożona przez:
–
rolnictwo
–
ścieki
–
zanieczyszczenia z atmosfery
Woda zanieczyszczona jest pożywką dla glonów jest to proces eutrofizacji. Najgorszą wodę ma Belgia.
Przemysł zanieczyścił rzeki podziemne. Najczystszą wodę ma Nowa Zelandia. Ważnym procesem jest
oczyszczanie. Jest to cykl procesów biologicznych i fizycznych. Woda może się sama oczyścid przy
pomocy tlenu, rozkładowi związków nieorganicznych na organiczne. Samooczyszczanie i jego
intensywnośd zależy od ruchów wody i dostępu do tlenu.
Koszty wody są zróżnicowane. Wodę zaczyna się uważad za obiekt strategiczny.
Cena zależy od:
–
opadów
–
uwarunkowao politycznych

WYKŁAD 3
SEKTORY GDZIE WODA JEST UŻYWANA I RACJONALIZOWANA.
Rolnictwo – rozwija się sied kanałów nawadniających, rozszerzenie terenów upraw gdzie opady są
wystarczające, poprawia się stopniowo efektywnośd wykorzystywanej wody. Kanały nawadniające to
sposób grawitacyjny jednak to metoda stratna: parowanie, zamulanie. Nowszą metodą jest budowa
deszczowni dzięki nim od razu można z wodą prowadzid nawożenie. Znalazło to zastosowanie w
ogrodnictwie, oszczędności wody wynoszą do 40%. To kierunek przyszłościowy.
Gospodarstwa komunalne – istnieją szerokie wymagania stawiane wodzie używanej w
gospodarstwach komunalnych. Wykorzystuję się powszechnie wody do przemysłu często o sporej
czystości, co nie jest potrzebne. Konieczne jest więc umiejętne właściwe wykorzystanie, rozdzielenie i
rozgraniczenie. Planuje się i już stosuję wykorzystanie wód kopalnianych. Są one w prawdzie
zanieczyszczone i zasolone, możne jednak je oczyścid chociażby do przemysłu. Na dzieo dzisiejszy
wykorzystuje się zaledwie 20% z tego. Inną metodą jest korzystanie z wody opadowej. Znajdują się
tam też inne substancję, które mogą byd czasem użyte jako surowiec. Można też wykorzystywad
ścieki po bardzo dobrym oczyszczeniu. Są już takie metody, które ze ścieków mogą zrobid wodę
zdatną do picia.
Wyrównywanie braków wody:
●
spektakularną czynnością jest przerzut wody – transport wody z regionów gdzie jest tam
gdzie jest niedomiar. Powodem może byd rozwój rolnictwa, urbanizacja, zanieczyszczenie
rodzimych źródeł. Można to czynid poprzez: rzeki, zapory, kanały, rurociągi (na terenach
różnych wysokości lub poprzecinanych innymi przeszkodami), zbiornikowce (pobieranie
wody i kierowanie w różne strony świata, np. Izrael) stosuję się zbiornikowce o v=0,5 mln
BRT, cysterny samochodowe (zapotrzebowanie w wodę regionów podczas skażenia lub
awarii). Przerzuty wody cechują się jednak pewnymi kosztami w zależności od metody.
●
Kolejną metodą do oszczędzania wody jest zamykanie obiegów. Jest to jak na razie najlepszy
sposób na oszczędzanie. Musi byd jednak odpowiednio przeprowadzony i przygotowany do
obiegu po użyciu. Zamknięcie może byd czynione przez zamknięcie bezpośrednie lub jako
system jezior.
Każda z tych technologii wiąże się z ingerencją w system środowiskowy. Każdorazowe ingerowanie
wymaga analizy, co będzie się działo i w jakiej skali z ekosystemem. Szczególnie dyskusyjne jest
budowanie tam lub przekształcanie koryta rzeki. Każdorazowa zmiana wiąże się z szeregiem zmian.
Często trzeba regulowad brzegi, prędkości etc. Ważnym problemem jest stwierdzenie zaburzenia
procesów samooczyszczeniowych, często nawet zahamowanie. Największe ingerencje to zapory i
zbiorniki retencyjne. Zapory powyżej 15m to zapory duże. Plusy i minusy: kartki I (5.2 i 5.3). Każda
zapora to ogromne zakłócenie w każdym aspekcie życia środowiska.
Skrajne przypadki:
–
jezioro Aralskie – nieprzemyślana ingerencja człowieka, nie zostały przewidziane skutki przez co
zmieniono wielki akwen wodny w Azji centralnej (kartka I 5.4), wykorzystując rzeki budowano
systemy nawodnieniowe, ale nie były one w stanie zapewnid dobrego nawodnienia upraw.
Szybko tam zaczęto hodowad w większości bawełnę. Jest uprawą wymagającą wiele wody więc
rozbudowano system oparty o te rzeki. Po podziale republik każdy chciał wykorzystywad system

rzeczny bez oglądania się na innych, przez co powstały spadki w dostawach wody.(5.5) Poziom
wody w jeziorze Aralski drastycznie malał (o ¾) w związku z tym, że było mniej wody, ponownie
spowodowało duży wzrost zasolenia. To z kolei wyniszczyło tarłowiska ryb, a brzegi pokryły się
solnymi odpadami co uniemożliwiło zagospodarowanie. Ograniczono błędne formy systemów
nawadniających. Przeeksploatowano zasoby wodne
<ZDJĘCIE NIECZYTELNE>
można było dostad
w tych warunkach. Nie zorganizowano właściwego odpływu do wód gruntowych, były
<ZDJĘCIE
NIECZYTELNE>
i niestosownie tworzone kanały i brak deszczowni.
–
Jezioro Salton w USA – zagospodarowanie turystyczne jeziora: ośrodki, sporty wodne. Ośrodki
kupowały wodę od terenów rolniczych, które uzupełniały ją z tegoż jeziora. Spowodowało to
spadek poziomu wody, wzrost zasolenia, dewastacje rybołówstwa.
–
Zapora na rzece Jangcy – nowe inwestycje utworzono tam główny ośrodek żeglugowy. Często
jednak szczególnie w poprzednich miała tendencję do wylewania. Zrobiono więc regulację przez
zaporę trzech przełomów. Chciano uzyskad ochronę przeciwpowodziową, pozyskanie energii
wodnej, tor żeglugowy. Wybudowano ogromny zbiornik retencyjny. Zapora jest największa na
świecie. 2330 m długości 170 m wysokości. Skutki wybudowania były następujące: koniecznośd
przesiedlenia dużej liczby ludności, dużej ingerencji w krajobrazie, ok 300 ważnych kulturowych
zostało zalanych, zniszczono też 4,5 tys wiosek. Teren zapory narażony jest na trzęsienia ziemi,
problem jest też z zamuleniem.
–
●
Kolejnym sposobem zagospodarowania wody są: uzyskiwanie wody, np z lodowców,
odsalanie. Odsalanie wymaga dużej ilości energii. Na to mogą pozwolid sobie więc paostwa
posiadające duże ilości paliw kopalnych. Istnieje dużo zakładów zamieniających wodę słoną
(ocean) na słodką, ale opłaca się tylko w przypadku wody pitnej. Istnieją dwie metody:
destylacji (jedna lub wielokrotna), odwróconej osmozy (przepływ przez błonę
półprzepuszczalną oddzielającą roztwory w różnych stężeniach, różnych ciśnieo...). Jest to
metoda bardzo perspektywiczna. Istnieje ok 10 tys zakładów odsalających wodę. Jest to
technologia dośd przyszłościowa i coraz szerzej wykorzystywana. Innym ogromnym źródłem
pozyskiwania wody jest ilośd ogromnych zasobów w lodowcach i górach. Przewiduje także
takie rozwiązanie jak użycie basenów celem rozpuszczenia. Potrzeba jednak dużej elektrowni.
Można więc na kawałki holowad by je rozpuścid, albo sypad drzewem/węglem drzewnym
celem zwiększenia temperatury. W górach lodowych (ok 40 tys) w każdej jest ok 100 tys
wody. Największa góra miała 13 km wysokości.6 km długości, miała 9 mld tony wody!
●
W wyrównywaniu stosuję się wywoływanie deszczy. Są to różne środki rozpylane w
chmurach powodujące zaczątki kondensacji, np suchy lód. Nie jest to stosowane na szeroką
skalę ze względu na niemożliwośd kontrolowania.
●
Innym sposobem zagospodarowania jest zbieranie wody z mgieł i opadów. Na szeroką skalę
stosuję się to w Indiach.
●
Następnym sposobem jest sztuczne wytwarzanie wody słodkiej ze słonej poprzez bakterie
żywiące się solą lub poprzez zjawiska chemiczne oraz fizyczne polegające na podgrzewaniu i
grawitacyjnym odciąganiu soli.
GŁÓWNE ZADANIA NAUKOWCÓW
–
nowe technologie dla rolnictwa
–
programowanie pogody
–
techniczne możliwości gospodarowania wodą
–
racjonalizacja wody i sposoby pozyskania
–
lepsze regulacje prawne

WYKŁAD 4
Zapasy wody w hydrosferze są wystarczające. Trzeba je jednak racjonalnie wykorzystywad. Wody do
naszej dyspozycji są to wody naturalne (nie zostały poddane czynnikom antropogenicznym – dział.
człowieka prowadzące do zanieczyszczenia).
Wody można poklasyfikowad wg wielu kryteriów:
–
pochodzenie
–
temperatury
–
stopieo mineralizacji
–
skład chemiczny
–
skład gazowy
–
obecnośd czynników promieniotwórczych
–
oddziaływanie na żywe organizmy
●
Temperatura – (rys. 2.1) ze względu na temp może byd b zimna, zimna, ciepła, gorąca, b
gorąca, wrząca. Temp wody zależy od klimatu. Ma znaczenie przy wykorzystaniu wody do
celów produkcyjnych.
●
Stopieo mineralizacji – zawartośd minerałów. Występuje z reguły w postaci zjonizowanej
(kationy, aniony). Istnieje wyszczególnienie: wody słodkie, zmineralizowane, słone. Wodę
słodką od słonej wyznacza granica zawartości soli 1 g/m3. Wody mineralizowane zwane są
często „JAKOŚ”.
●
Skład chemiczny
●
Przeznaczenie – w zal od przeznaczenia stawiane są jej odpowiednie wymagania: pitna,
rolnicza, chłodząca, dla innych celów (poza rolnictwem), produkcyjne (wytwarzanie
konkretnych produktów), zasilające kotły parowe (podst surowiec w produkcji en
elektrycznej. Musi byd odpowiednio czysta, nie może zostawiad osadów).
●
Pochodzenie – z ziemi(stojące i płynące wody powierzchniowe), z nad ziemi(atmosfera,
opadowe), z podziemi(podskórne, wgłębne -do 10m, głębinowe- pow 100 - źródlane i
artezyjskie).
–
wody opadowe są to wody z atmosfery, kropel, chmur, mgieł przedostające się do atmosfery w
proc parowania dzięki en słooca i geotermii. Wody w chmurach są to „hydrometeory” - z nich się
biorą opady. Chmury pojawiają się do ok 2 km. Z opadów w skali rocznej ok 100 000 m3 na lądy.
Do niedawna wody opadowe uważane były za najczystsze. Dziś czym większe uprzemysłowienie
tym większe zanieczyszczenie (tl siarki, azotu, ołów, amoniak). Skład wód opadowych zmienia się
po zetknięciu z ziemią. Potem jest infiltracja – wsiąkanie. Jest ona dalej zanieczyszczana przez
nieczystości w glebie, ale dzięki naturalnej filtracji od razu czyszczona. Wody opadowe są gł
źródłem azotu dla procesów biochemicznych.
–
Wody powierzchniowe – wody stojące lub płynące lub w fazie stałej (nietopniejące lody i śniegi).
Osobne dziedziny nauki zajmują się każdą z form pochodzenia. Jakośd zależy od pory roku,
klimatu, powodzi, charakterystyki geologicznej, zlewni (obszaru z którego woda spływa). Wody te
na ogół nie nadają się do bezpośredniego wykorzystania. Na jakośd wpływa rodzaj zasilenia
(powierzchniowe, gruntowe – wody podziemne), parowanie, klimat (zmienia się z zal od pory
roku). Ważną rolę w czystości odgrywa proces samooczyszczania. Wody stojące, a właściwie ich
jakośd, zależy także od sposobu zasilenia. Tu pojawia się stratyfikacja, zmiana składu
chemicznego na głębokości. Następuje rozwarstwienie się ze względu na temp i ciśnienia. Na
jakośd szczególny wpływ mają organizmy żywe, plankton (żyje w stanie zawieszonym) i bentos

(przy dnie). Woda morska gromadzi spływy w dużych ilościach. Cechuje się sporym
zanieczyszczeniem. (1.3) – skład wody morskiej pierwiastkowej. Gęstośd ze względu na zasolenie
większe od morskich. Temp powierzchniowe zależy od klimatu. Woda morska ulega często
zanieczyszczeniu produktami ropopochodnymi (ropa z dna morskiego wydobywana poprzez
nieszczelności transportu). Te zanieczyszczenie należy do najgorszych, bo powoduje m. in.
niedotlenienie wody oraz powoduje „oklejanie” tego co na dnie.
–
Wody podziemne – zasilane gł wodami opadowymi poprzez infiltracje. W zal od warstw przez
jakie opady przenikają zależy ich skład chemiczny i czystośd. Ogromne wody podziemne są pod
Sacharą.
–
Wody podskórne zalegające nad pierwszą nieprzenikalną warstwą. Są to wody dostarczające
roślinom pożywienie. Są mocno zanieczyszczone i temp zal od warunków.
–
Wody gruntowe - pod pierwszą warstwą nieprzepuszczalną 8-10m, wody dośd czyste, zasilają
studnie, zdatne do picia.
–
Wody głebinowe – pow 100-200 m ich kształt zal od warstw nieprzepuszczalnych. W zależności
od wydobycia mogą byd źródlane i artezyjskie. Cechuje je stała temp, obecnośd minerałów i
substancji leczniczych.
–
Wody mineralne - stałej jakości i stężenia składników. Działanie lecznicze. Najważniejsze
składniki CO2, siarkowodorki, Na, Fe, Br, jod,) w Polsce istnieje szereg zdrojów wodnych.
Balneologia – dziedzina wiedzy zajmująca się wodami leczniczymi.
Wodami naturalnymi zajmuje się hydrologia. Celem jej jest opis hydrosfery (rodzaj powłoki kuli
ziemskiej, atmosfera + litosfera + biosfera; wym. masę energii). Podstawą egzystencji hydrosfery jest
en słoneczna, decyduje o obiegu wody, etc. Hydrologia zajmuje sie procesami fizycznymi,
chemicznymi, biologicznymi w wodzie, składem, ruchem mas wody itd.
Zasoby hydrosfery to wody naturalne.
Wyróżniamy trzy części:
a) częśd oceaniczną – jednorodnośd, słona powłoka geosfery
b) częśd lądową – nie tworzy ciągłej powłoki, ciągły obieg wody
c) częśd kriosfery – nieznikające lody
Zasoby wodne hydrosfery (2.2 i 2.3)
Ważnym czynnikiem jest obieg wody. Możliwy jest dzięki temu proces
<ZDJĘCIE NIECZYTELNE>
Istnieją dwa procesy:
a) parowania
b) kondensacji
To co spadnie na ziemię idzie spływem powierzchniowym (zasilanie wód powierzchniowych) oraz
infiltruje (zasilanie wód podziemnych).
Odparowanie możliwe dzięki dostarczonej energii może byd odparowanie powierzchniowe z
powierzchni wód i transpiracja czyli, parowanie z roślinności, potem następuje kondensacja i tworzą
się opady (2.4)

Mamy stałe krążenie wody w przyrodzie jest to proces ciągły, a w ciągu niego następuje stale ciągła
zmiana składu wody. Dokłada się też czynnik antropogeniczny (ludzki) jako wpływ na
zanieczyszczenie. Każda cząstka wody przebywa w różnym czasie i miejscu
<ZDJĘCIE NIECZYTELNE>
W
ciągu roku woda wymienia się całkowicie 17 razy
Istnieją podcykle w ramach cyklu obiegu wody. W odniesieniu do roślin będzie to transpiracja.
Procesy biochemiczne dostosowały się do warunków wody. Są one ścisłe i dokładne. Jakiekolwiek
niekontrolowane zmiany będą miały wpływ na całe życie.
Wymiana wody w przyrodzie to efekt nieustannego ruchu. Każda cząstka w ciągu kondensuje
w przybliżeniu 43 razy, a cała woda wymienia się mniej więcej raz na 4000 lat.
Podstawowe pojęcia hydrologii:
-
Spływ jednostkowy, parametr hydrologiczny danego obszaru wyrażający stosunek przepływu
do pola zlewni, z której wody są w tym miejscu odprowadzane. Jest wyrażany w l/ s · km-2.
-
Odpływ, termin hydrologiczny o kilku znaczeniach:
1) odpływ jednostkowy - ilośd wody (mierzona w l/ s), która odpływa średnio z 1 km2 dorzecza
rzeki, np. dla Wisły odpływ jednostkowy jest równy 5,3 l/ s/ km2, dla Brahmaputry - 24, a dla Nilu
- 0,55.
2) odpływ podziemny - woda z opadów atmosferycznych, która wsiąka w grunt i stamtąd
przedostaje się do zbiorników wód podziemnych, by następnie zasilid źródła, rzeki, itp.
3) odpływ powierzchniowy - woda z opadów atmosferycznych, która nie mogąc wsiąknąd w grunt
(wskutek jego nasycenia wodą podczas opadu) spływa po jego powierzchni bezpośrednio do rzek,
erodując przy tym podłoże, co powoduje, że zawiera duże ilości materiału skalnego.
4) odpływ rzeki - ilośd wody (mierzona w l, m3 lub km3) odpływająca przez przekrój poprzeczny
koryta rzeki u jej ujścia w ciągu roku, największy odpływ roczny ma Amazonka, 3800 km3/rok, dla
porównania Wisła - 30 km3/rok.
5) odpływ wód morskich - okresowe obniżanie się poziomu wód morskich, związane ze wspólnym
ruchem obrotowym Księżyca i Ziemi.
-
Przepływ: objętośd wody przepływająca w jednostce czasu m
3
/sek.
-
Retencja wodna, naturalne zjawisko okresowego magazynowania wody opadowej,
opóźniające jej odpływ z danego terenu.
Rozróżnia się: retencję wodną powierzchniową, czyli zatrzymanie wody w dolinach rzek,
jeziorach, zbiornikach retencyjnych, bagnach, a także w postaci lodu i śniegu, oraz retencję
wodną podziemną, czyli występującą w skałach podłoża, gdzie tworzą się zbiorniki wody
podziemnej, które sprzyjają powstawaniu wód mineralnych, gdyż woda uwięziona w podłożu,
często przez wiele lat, podlega mineralizacji, rozpuszczając skały, w których krąży.

Retencja wodna jest ważnym elementem w gospodarce wodnej. Współczesne działania
człowieka, np. nadmierne wycinanie lasów powodują zmniejszenie retencji wodnej, co wywołuje
niekorzystne skutki, jak wzrost zagrożenia powodziowego.
W zależności od rodzaju magazynowania występują następujące rodzaje retencji
-
dodatnia (dopływ > odpływ)
-
ujemna (dopływ <odpływ)
Inny podział retencji:
-
śniegowe
-
lodowcowe
-
jeziorowe/zbiornikowe
-
koryt rzecznych
-
powierzchniowe (retencja na nierównościach terenu)
-
Gruntowe (gromadzenie wody w glebie)
Retencje ze względu na skutki można podzielid na:
-
korzystne (spadki wahao przepływu)
-
niekorzystne (wzrost wahao przepływu, powodzie)
Powszechną metodą retencjonowania jest budowanie zbiorników retencyjnych. Retencyjny
zbiornik, jezioro zaporowe, sztuczne jezioro, akwen utworzony przez człowieka, sztuczny obiekt
wodny, powstały wskutek przegrodzenia doliny rzecznej zaporą lub przez podpiętrzenie jeziora.
Zbiorniki retencyjne nizinne charakteryzują się zazwyczaj znaczną powierzchnią i niewielką
głębokością, górskie zaś - małą powierzchnią, ale dużą głębokośd. Głównym celem zbiornika
retencyjnego jest wyrównanie odpływu rzecznego i zgromadzenie wody w okresach jej nadmiaru
(retencja), w celu wykorzystania w czasie niedoboru.
Ze względu na przeznaczenie wyróżnia się zbiorniki retencyjne: przeciwpowodziowe (ochrona
dolin rzek przed powodzią poprzez zatrzymanie wód powodziowych w zbiorniku), energetyczne
(wykorzystanie spiętrzenia wód do napędzania turbin elektrowni wodnej), żeglugowe
(zapewnienie odpowiedniej głębokości rzeki do żeglugi), komunalno-przemysłowe
(magazynowanie wody pitnej i do celów przemysłowych dla ośrodków miejskich) i
wielozadaniowe.
Podstawowym parametrem zbiornika retencyjnego jest pojemnośd, przy czym wyróżnia się
pojemnośd całkowitą i użytkową, czyli taką, którą można wykorzystad do celów gospodarczych.

Zbiornikiem retencyjnym o największej pojemności jest Jezioro Brackie na Angarze w Rosji, o
pojemności całkowitej 169 km3, użytkowej 48 km3. Zbiornik retencyjny o największej
powierzchni jest Wolta na rzece Wolta w Ghanie, o powierzchni 8,5 tys. km2.
WYKŁAD 5
BILANS WODNY
Jest to zestawienie zysków i strat w skali lokalnej, krajowej i globalnej.
Po stronie zysków są:
-
zasoby z poprzedniego okresu bilansowego
-
opady
-
dopływy z sąsiednich obszarów
Po stronie strat są:
-
parowanie
-
odpływy (powierzchniowe i podziemne)
-
zasoby pozostawione na następny okres
Typowym wskaźnikiem bilansu jest różnica retencji zasobów wodnych z poprzedniego okresu. Gdy:
-
różnica 0 – bilans zrównoważony
-
retencja > - bilans dodatni
-
retencja < - bilans ujemny
Bilans wodny podajemy w:
-
jednostkach objętości *m
3
]
-
wymiarze liniowym [mm]
O Polsce mówi się, że jest obszarem zamkniętym hydrologicznie – dopływy z zagranicy są pomijalne.
Ocena zasobów wody:
-
zasób wody: wody dostępne (lub łatwe do pozyskania) na danym obszarze o określonej ilości i
jakości w ciągu danego okresu.
Cechy zasobów:
1) odnawialnośd – jest to surowiec odnawialny
2) losowośd – zasoby są rozmieszczone losowo, nie wiadomo do kooca z jakimi zasobami mamy
do czynienia

Nie wszystko to, co dałoby się wykorzystad możliwe jest do wykorzystania, stąd zasoby:
-
brutto – ilośd wody przepływającej np. przez koryto
-
netto – ilośd wody do wykorzystania bez naruszenia równowagi biologicznej, zasoby netto
szacowane są między 0,2 a 0,4 całkowitego przepływu
-
przepływ dyspozycyjny = przepływ brutto – przepływ netto
Średni roczny zasób na mieszkaoca: wskaźnik ilości wody na mieszkaoca. Skrajnie mały to < 1000m
3
,
skrajnie duży to > 50000m
3
.
MAGAZYNOWANIE WODY
-
zbiorniki retencyjne – możliwośd regulacji ale kosztem wodnej ingerencji w ekosystem, w
Polsce jest 140 zbiorników retencyjnych, w sumie 2,6 km
3
(3.15)
CHEMIST WÓD NATURALNYCH
-
chemist – skład chemiczny, determinuje skład chemiczny z jakim mamy do czynienia, zależy od
czynników antropogenicznych (przemysł, miasta, rolnictwo) z glebą, etc.
Woda jest niejednorodną mieszaniną różnych składników które mogą się dostad w sposób
naturalny lub sztuczny.
Aby ocenid jakośd wody używa się wskaźników:
-
fizycznych
-
chemicznych
-
biologicznych
-
sanitarnych
-
organoleptycznych
Składniki w wodzie określają wartośd wskaźników. Składniki sklasyfikowano na:
-
w zależności od pochodzenia:
naturalne (wymywanie)
sztuczne ( spływy)
-
w zależności od rodzaju:
organiczne
nieorganiczne
-
w zależności od stężenia
makroskładniki
mikroskładniki
ultraskłdniki

-
w zależności od postaci występowania (w zależności od tego stosujemy różne metody
oczyszczania)
zawieszone (piasek)
rozpuszczone (usuwanie: metody strąceniowe, metody membranowe, metody destylacji)
pośrednie (roztwór koloidalny: twór pośredni w cząstkach pomiędzy wymiarem molekularnym
a wymiarem stałym)
Skład chemiczny zależy od substancji rozpuszczonych:
a) rozpuszczania
b) wydzielania się substancji (o różnym charakterze np. jonowym)
c) mineralizacji
d) procesów biochemicznych (oddychanie roślin)
e) procesów czysto fizycznych
Procesy w wodach powierzchniowych i naziemnych są podobne.
Skład chemiczny wody:
1) Grupę rozpuszczonych gazów
Podstawowym źródłem gazów jest atmosfera. Gaz może byd pochłaniany lub wydzielany. W
zależności od ciśnienia jest różnoraki stopieo nasycenia. Ilośd gazów zależy od:
o Temperatury
o Ciśnienia
o Składu
Procesy związane z wydzielaniem gazów:
a) rozkład wodorowy glonów (pochłanianie/wydzielanie CO
2
)
b) procesy związane z rozkładem związków organicznych na drodze tlenowej i
beztlenowej
Najważniejsze gazy w wodzie:
o tlen
o dwutlenek węgla
o azot (znaczenie dla rozwoju życia organicznego)
tlen – w postaci rozpuszczonej lub w związkach organicznych. Umożliwia oddychanie organizmów
żywych, w biochemicznym rozkładzie bierze udział w utlenianiu.
Biochemiczny rozkład substancji chemicznych to proces samooczyszczania wód. Czym woda czystsza,
nasycenie tlenem jest większe. Dla czystych wód nasycenie jest rzędu 100%. Przy nasyceniu 40%
woda zanieczyszczona, 30% obumieranie życia, 20% zanikanie życia.
Pobór z atmosfery zależy od:
o nasycenia
o powierzchni kontaktu
o temperatury, ciśnienia
Przenikanie tlenu to nowy //wymyślili go dopiero??// proces dyfuzji. Występuje jednak stosunkowo
wolno więc ważny przy natlenianiu jest ruch powierzchni wody. Innym istotnym procesem jest
fotosynteza, jednak pochodzi z niej mniej tlenu niż z dyfuzji.

Wody podziemne są mniej natlenowane niż powierzchniowe, a natlenowanie maleje z głębokością.
Jest to wynikiem głównie oddziaływao promieniującego lub radiologicznego //i ilości gości na weselu
Kachny, ale tak tam było napisane (czyt. nabazgrolone)//.
Obecnośd tlenu w wodzie działa korozyjnie. Proces ten jest najsilniejszy przy oddziaływaniu na czysty
metal.
Dwutlenek węgla – w wodzie może występowad jako:
- pobierany z powietrza
- wymywany
- z rozkładu substancji organicznych
- z procesów metabolicznych (oddychanie) zwierząt wodnych
Procesy powstawania CO
2
w wodzie:
CO
2
+H
2
O H
2
CO
3
H
2
CO
3
H
+
+ HCO
3
-
HCO
3
H
+
+ CO
3
-
Częśd CO
2
wiąże się w jony tworząc CO
2
związany. Wiązanie może byd w jonach wodorowych lub
węglowych.
<ZDJĘCIE NIECZYTELNE>
Gdy CO
2
spada układ dążąc do równowagi będzie chciał straty wyrównad, reakcja. Gdy CO
2
rośnie,
to nastąpi wiązanie z dwutlenkiem wapnia, reakcja .
Ilośd CO
2
ponad równowagę zwie się CO
2
AGRESYWNY.
FORMY CO
2
W WODZIE
-
wolny
o rozpuszczony
o agresywny
-
związany
o Jony węglanowe
o Jony wodorowęglanowe
Przeciętnie CO
2
stanowi 20-40 g/m
3
, w wodzie mineralnej jest setki razy większe. W znacznym
stopniu wpływa na smak. Jednak w przemyśle CO
2
jest niepożądane bo w obecności tlenu zwiększa
właściwości korozyjne.
Siarkowodór – cechą jest to, że występuje gdy mamy do czynienia z procesami beztlenowymi. Jest
charakterystycznym wskaźnikiem bo jest wyczuwalny. W nieco większych stężeniach oddziałuje
korozyjnie.

2) Grupa związków ulegających dysocjacji.
Decydują o stopniu mineralizacji wody. Są to jony:
-
wapnia
-
magnezu
-
chlorki, siarczany
-
metale alkaliczne
Chlorki – z wymywania z gleby luz ze ścieków. Są głównie odpadowe. Chlorki pochodzenia
naturalnego mówią o stopniu zanieczyszczenia. Zwiększają korozyjnośd wody. Duże ilości
chlorków powodują tworzenie nietrwałych podtlenków soli.
Siarczany – oddziałują korozyjnie. Przy wysoko zasiarczonych wodach konieczne są specjalne
instalacje. Najgroźniejsze są siarczany wapienne i magnezowe – skład kamienia kotłowego
(działają przeczyszczająco).
Wapo, magnez – ze ścieków, ługowanie, wymywanie. Stanowią o twardości wody (skłonności
kamieniotwórcze).
Metale alkaliczne – miedź, stal, potas, cez
3) Substancje biogenne – niezbędne do życia i rozwoju organizmów żywych: cez (uczestniczy w
tworzeniu się błonnika, rozwój życia roślinnego, EUTROFIZACJA), fosfor mangan ( powoduje
wzrost roślin, stosowany w nawozach, czasami stosuje się do zmniejszenia twardości wód),
żelazo (zmienia smak wody, związek barwiący)
Krzemionka – źródło powstawania krzemianowego kamienia kotłowego, ma najmniejszy
współczynnik lambda, przy wysokich parametrach rozpuszcza się w parze, szczególnie
niebezpieczna w zespołach kocioł – turbina.
4) Makroelementy – są katalizatorem w procesach przemiany materii, zbyt duże lub zbyt małe
stężenie może szkodliwie wpływad na organizm ludzki.
5) Metale ciężkie – w zależności od źródła zanieczyszczenia są ich różne ilości. One są wydalone
przez organizm – po znalezieniu się w organizmie, następuje bioeleminacja i działanie
szkodliwe (np. wchłoniecie ołowiu chorobę ołowianą). Oprócz ołowiu będzie to rtęd.
6) Substancje radioaktywne – w stanie nietrwałym nie są one groźne bo występują w skrajnym
rozproszeniu. Obecnie coraz więcej związków wykorzystuje się pierwiastków radioaktywnych
które w ściekach dostają się do organizmu.
7) Grupa substancji organicznych – wszystkie związki pochodzenia naturalnego, syntetycznego.
Cząstki rozpuszczone są na ogół bardzo trwałe, często się trudno rozpadają. Kłopotliwa jest
także biodegradacja – często nawet przez stulecia mogą egzystowad w postaci trwałej. Często
są także toksyczne, co może prowadzid do zachwiania procesu oczyszczania
Ze względu na właściwości dzielimy:

-
pestycydy, herbicydy
-
substancje humusowe
-
detergenty
-
środki powierzchniowe czynne
-
pochodne ropy naftowej (smary, oleje)
związki humusowe – związki wielocząstkowe o dużych masach atomowych, wykorzystywane są
do usuwania osadów, kamienia.
Pestycydy – stosowane w rolnictwie do usuwania organizmów żywych. Spławione z deszczem
do gleby i wody
DDT – związek o silnych właściwościach trujących w stosunku do owadów i gryzoni.
Powszechne użyci prowadzi do odkładania się w organizmach ludzkich powodując choroby. Stał
się nieskuteczny – przyzwyczajenie!
Detergenty – główne działanie to obniżenie napięcia powierzchniowego, dzięki czemu woda
łatwiej wnika w budowę substancji i łatwiej ją usunąd.
Fenole – uciążliwe ze względu na szkodliwe oddziaływanie, woda nabiera trwałego zapachu i
smak, skażone rośliny i ryby.
Substancje ropopochodne – wynikają z rektyfikacji ropy naftowej. Często związane z awariami
frachtowców (wycieki do wody). Bardzo szybko się rozprzestrzenia, tworzą się cienkie a duże
błony. Utrudnia dostęp tlenu, oblepiają cząstki opadając na dno tworząc zacieki denne.
Tabele 4.7!
Zagrożenia dla maszyn energetycznych:
a) Korozje – usuwamy odgazowywaczem
b) Kamieo – zabezpieczamy się przygotowując wodę e zbiorniku jonitowym
c) Pienienie się wody – piana powoduje przedostanie się kropel wody do pary,
przedostają się zanieczyszczenia
d) Blokowanie jonitów – związki żelaza które dostały się do wymienników jonitowych
powodują niemożliwośd och regenerowania.
To co jest obce w wodzie wpływa na jej jakośd, Składniki dzieli się na:
-
obojętne
-
szkodliwe
-
korzystne
Jakośd wody w każdym aspekcie wpływa na urządzenie w którym się znajduje (uzdatnienie, remonty),
na rośliny. Zła jakośd może prowadzid do pogorszenia jakości produktu koocowego.
JAKOŚD WODY – klasyfikacja według:

-
zanieczyszczenie z punktu widzenia pochodne (biologiczne, fizyczne, chemiczne)
-
łatwośd usunięcia zanieczyszczeo (rozpuszczone, mieszane, koloidalne)
-
względy sanitarne (obojętne, trujące, pozytywne)
Zanieczyszczeni:
bakteriologiczne
fizyczne
Zanieczyszczenie ze względu na pochodzenie – powodowane przez organizmy pochodzenia
zwierzęcego, roślinnego. Koniecznośd oceny sanitarnej wody nieznanego pochodzenia.
Istnieją metody pozwalające na ocenę pod względem sanitarnym – pod względem grupy coli.
Łatwośd usunięcia – zanieczyszczenia fizyczne, radiologiczne, techniczne. Chemiczne występują w
postaci zdysocjonowanej lub nie.
układ dyspersyjny- u. wielofazowy, w którym występuje faza rozpraszająca i
rozproszona
Rozróżniane są układy dyspersyjne: (wg. stopnia dyspersji):
-faza rozproszona to cząstki stałe >500nm->zawiesina (można go łatwo rozdzielid
prostymi metodami fizycznymi: filtrowanie, sedymentacja)
-faza rozpuszczona to cząstki <1nm (wymiary molekuł)->roztwór (odseparowanie :
destylacja, odczynniki chemiczne)
-faza rozpuszczona między 1 a 500nm-> układy koloidalne- w celu rozdzielenia faz
stosuje się koagulację
Poważnym problemem są zanieczyszczenia termiczne, szczególnie w sektorze
energetycznym, zwłaszcza w elektrowniach jądrowych, gdzie występują niższe parametry
pary i w celu uzyskania tej porównywalnej mocy potrzebna jest większa efektywnośd
chłodzenia, a zatem większa ilośd wody.
Obieg chłodzący trzeba zabezpieczad przez śluzy, ujścia, etc, aby uniemożliwid wpłynięcie
zwierząt.
Elektrownie otrzymują również *pozwolenie+ na maksymalny podgrzew wody (2stC).

WYKŁAD 6
OCENA JAKOŚDI WODY
Ocenia się ze wzgl. na sposób wykorzystania.
Wskaźniki jakości wody:
-fizyczne: temperatura, barwa, smak, przeźroczystośd, mętnośd
-chemiczne: odczyn (pH), twardośd, zasadowośd, kwasowośd, korozyjnośd,
utlenialnośd, sucha pozostałośd
-tlenowe: BZT5, CHZT
-biologiczne
-indeksy
Odczyn- określa charakter roztworu- kwasowy zasadowy lub obojętny. Od pH zależy
bytowanie organizmów i przebieg reakcji chemicznych.
dysocjacja: H2O-><-H+ +OH-
H+ +H2O->H3O+ uwodniony jon wodorowy
stała dysocjacji wody:
k=[H+]*[OH-+/*H2O+ zależy od temperatury
pH= -lg*H++ zależy od temperatury
odczyn obojętny *H++=*OH-]=10^(-7)-> pH=7
kwaśny *H++>10^(-7) pH>7
zasadowy- pozostały przypadek
Wyznaczanie pH:
-potencjometryczne- wzgl. zależnośd potencjału elektrody wodorowej w zależności
od pH wody
-wskaźnikowe- związkami chemicznymi zmieniającymi barwę pod wpływem pH
(lakmus, oranż metylowy, fenoloftaleina, fafarafa, chuju-muju-dzikie-węże, itp.)
Twardośd- określa zdolności kamieniotwórcze. Decyduje zawartośd kationów wapniowych,
magnezowych i węglanowych.

twardośd ogólna: suma zawartości jonów wapnia i magnezu we wszystkich kombinacjach
tw. ogólna=tw. wapniowa+tw. magnezowa=tw. węglanowa+tw. niewęglanowa
Inny podział twardości- przemijająca-znika po przygotowaniu, trwała- nie.
Miary twardości:
-stopieo niemiecki 1(st)n=10mgCaO/1l
-st. francuski 1(st)f=10mgCaCO3/!l
-angielski [brak danych]
-1mval/dm3
Działanie twardości:
-pogarsza pracę mydła
-powoduje powstawanie kamienia na powierzchniach zbiorników, rur...
Najmikciejszą wodą jest deszczówka
Twardośd eliminuje się w procesach zmiękczania.
zasadowośd/kwasowośd- ocena pod względem buforowości, czyli odporności na dodawanie
kwasów/zasad
Korozyjnośd- agresywne działanie na metale. Przyczyną jest O2 rozpuszczony w wodzie.
Oddziaływanie zależy od czystości i gładkości powierzchni oraz prędkości przepływu.
Najbardziej narażone są metale czyste. Wskazane jest wstępne pokrycie powierzchni
warstwą tlenków nieprzepuszczających tlenu do właściwej powierzchni.
stabilnośd *bezedura+- zdolnośd do wytrącania węglanów wapniowych
Utlenialnośd- mówi o szybkości *?+ i ilości związków utlenialnych
Sucha pozostałośd- materia pozostała po odparowaniu próbki w temp. 105stC. Świadczy o
mineralizacji próbki
Przewodnictwo elektryczne- określa zawartośd soli (czyli jonów po zdysocjowaniu) w próbce
BZT- biologiczne zapotrzebowanie tlenu, 5-dniowe- ilośd tlenu konieczna do utlenienia
związków organicznych w próbce przez 5 dni
CHZT[mg/dm3]-chemiczne zapotrzebowanie tlenu- ilośd tlenu potrzebna do utlenienia zw.
Organicznych za pomocą solnych utleniaczy

Wskaźniki biologiczne- określone są przez mikroorganizmy o działaniu szkodliwym i
nieszkodliwym:
-szkodliwe: pierwotniaki, bakterie oraz wirusy
bakterie-sprawdzane pod względem bakteriologicznym jest niemożliwe. W ocenie sanitarnej
przyjęto najreprezentatywniejsze bakterie:
-grupa bakterii coli- zawarte w wodzie stanowią poważne zagrożenie
wirusy-charakteryzują się wysoką przeżywalnością
pierwotniaki- pochodzenie zwierzęce- w naszej strefie *klimatycznej+ nie są specjalnie groźne
Wskaźniki fizyczne:
temperatura-wskaźnik zmienny, zależy od pory dnia, roku, klimatu, ścieków, bliskości
zakładów przemysłowych. Wody gruntowe, podziemne utrzymują stałą temperaturę.
Temperatura rośnie o 1stC/ 80m głębokości.
mętnośd/przeźroczystośd- właściwośd optyczna polega na rozpraszaniu/absorbowaniu
*światła?+ przez cząstki zawieszone. Np. woda w czystym jeziorze- widocznośd 15-18m.
Barwa- zależy od substancji rozpuszczonych:
-naturalna- zółto-zielona
-nadana przez substancje zawieszone
Zmiana barwy może byd spowodowana rozwojem glonów i flory wodnej
Zapach/smak wytwarzają gazy pochodzące z substancji organicznych. Istnieją zapachy:
roślinny, gnilny. specyficzny. Inną skalą jest intensywnośd zapachu: 1-5. Pomiar może byd na
zimno lub na gorąco.
Smaki: słony, słodki, gorzki, kwaśny. Kombinacje smaków tworzą posmak. Skala
intensywności: 1-5.
<ZDJĘCIE NIECZYTELNE>
Do celów przemysłowych stosuje się wskaźniki chemiczne, dla wody pitnej fizyczne,
biologiczne i tlenowe do oceny sanitarnej.
Metody oceny wody
1. badanie niektórych wskaźników
2. metody biologiczne (posługiwanie się organizmami wskaźnikowymi, które rozwijają
się w wodzie o określonej czystości): saprofity- w środ. wód niezanieczyszczonych,
???- w środowisku wód zanieczyszczonych
Skażenie wody, zanieczyszczenia, zatrucia:
-skażenie- woda zawiera substancje nie występujące w stanie naturalnym
(chemiczne, termiczne, biologiczne)
-zanieczyszczenie- zawiera substancje powodujące niezdatnośd do danego celu
-zatrucie- zawartośd substancji uniemożliwiających podtrzymanie życia organicznego
WYKŁAD 7
Własności wody jako związku chemicznego
<ZDJĘCIE NIECZYTELNE>

Badanie prowadzi się najczęściej postulując istnienie uporządkowanych lecz niestabilnych
stanów, tzw. Struktury quasi-krystaliczne
Parowanie- intensyfikowane przez podmuch. Częśd cząstek odparowuje, a częśd powraca.
Ważnym parametrem jest tu ciśnienie nasycenia. Inaczej przebiega….
parowanie w (zamkniętym) otwartym zbiorniku gdzie
To zjawisko można wytłumaczyd gazowym modelem cieczy.
Bardzo powoli grzejąc/chłodząc można wodę przegrzad/przechłodzid. Jest to jednak stan niestabilny i
może doprowadzid do gwałtownego odparowania/zamarznięcia.
Z własności ściśliwości i rozszerzalności – zmiana objętości pod wpływem ciśnienia.
Ści
śli
wo
śd
p
k
v
v
0
k – współczynnik ściśliwości izotermicznej
)
(
0
0
0
p
p
k
v
v
v
0
0
0
0
0
1
)
(
p
p
k
v
v
p
p
k
v
v
v
N
m
k
2
10
3
10
10
Aby o 1% zmienid objętoścd musimy działad ciśnieniem rzędu
2
8
7
10
10
m
N
można uznad iż ciecze
są NIEŚCIŚLIWE.
Ro
zsz
eżal
n
o
śd
T
v
v
0
0
0
1
T
T
v
v
Woda i jej gęstośd ma swoje „zachwiania” w pobliżu T=0°C

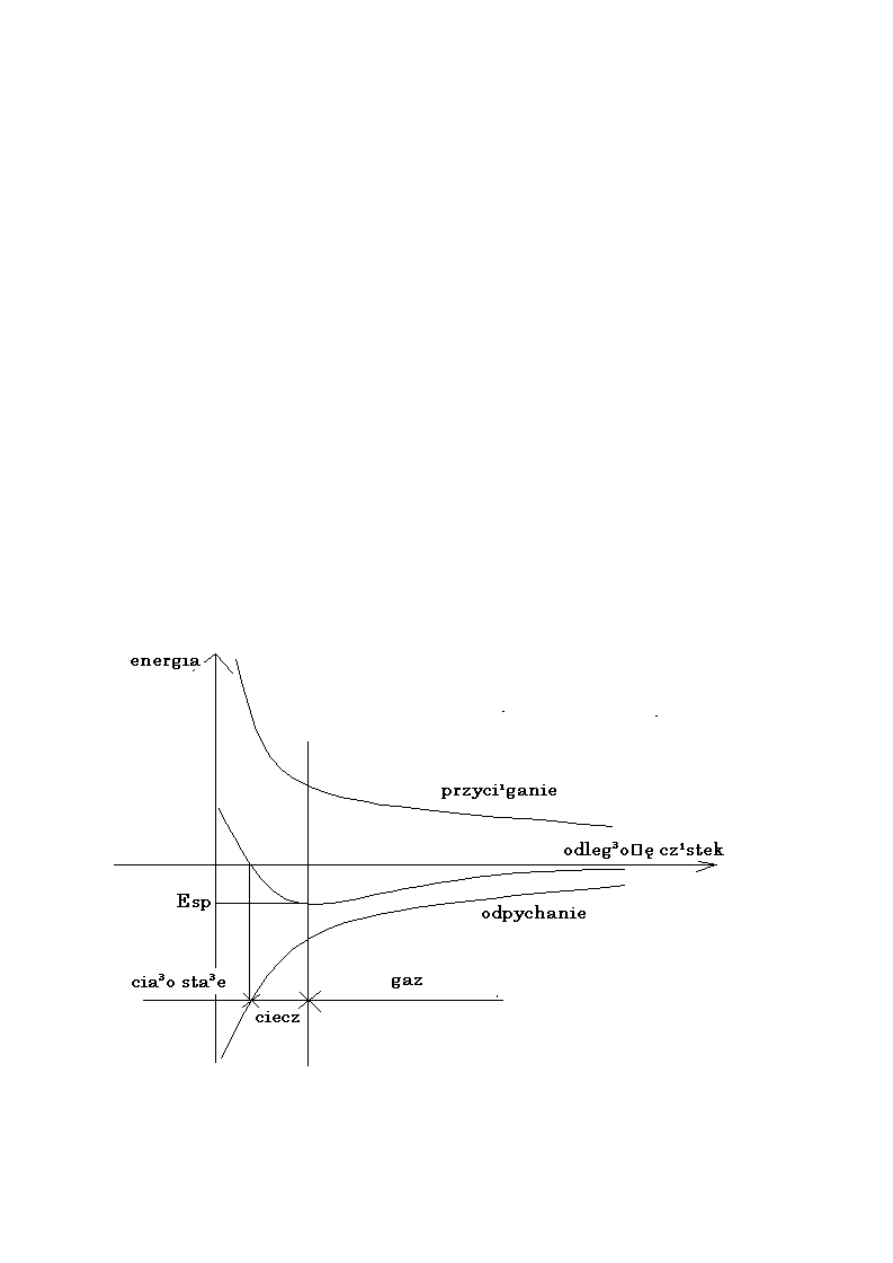
Kształt powierzchni swobodnej – każdy układ dąży do tego by energia wewnętrzna była możliwie
mała. Składniki energii wewnętrznej zależne od powierzchni podzielid można na:
- energię powierzchniową
- energię grawitacji (położenie środka ciężkości)
Każda ciecz przybierad będzie taki kształt aby E→min.
Objętośd rośnie z 3-cią potęgą wymiaru liniowego a powierzchnia z 2-gą potęgą wymiaru liniowego,
tak więc mamy ścisłą zależnośd od wymiarów liniowych.
Dla danych objętości kształtem o najmniejszej powierzchni jest kształt kuli. W próżni możliwy do
ośiągnięcia. Gdy pominiemy energię powierzchniową (tylko grawitacji)
Kształtem optymalnym będzie kształt poziomy – nisko położony środek ciężkości.
3 własności:
Napięcie powierzchniowe – każda ciecz zachowuje sie jakby na powierzchni była sprężysta błona. Siły
potrzebne do zwiękrzenia tej powierzchni to siły napięcia powierzchniowego (siły potrzebne do
przeciwdziałaniu „rozciąganiu błonki”)
Zwiększanie napięcia powierzchniowego – konieczne jest włożenie pracy o wartości
s
W
. Jest
to praca potrzebna do zwiększenia o x (m) powierzchni.

m
N
m
m
N
s
W
2
Napięcie powierzchniowe odgrywa ważną rolę. Na przykład:
- impregnacja – zwiększanie napięcia powierzchniowego celem uszczelnienia i zabezpieczenia przed
przenikaniem wody.
-pranie – duże napięcie powierzchniowe utrudnia wymywanie brudu. Napięcie obniżamy poprzez
detergenty. Pozwala to na wnikanie środka myjącego pomiędzy tkaninę a brud.
- składowanie odpadów – konieczne duże napięcie podłoża, zapobiega wnikaniu odpadów podczas
opadów.
Napięcie powierzchniowe wpływa na menisk.
Czynniki wpływające na napięcie powierzchniowe:
- rodzaj cieczy
- temperatura
Wiele stworzeo wodnych wykorzystuje napięcie powierzchniowe.
Przyleganie – determinuje siły spójności pomiędzy cząstkami cieczy i ciała stałego.
Miarą przylegania jest praca konieczna do włożenia by oderwad 1m² cieczy.
Przyleganie może zależec od:
- cieczy
- powierzchni
O tym co jest zwilżane a co nie decyduje:
- gdy
a
przylegani
spojnosci
F
F
- ciecz zwilżająca
- gdy
a
przylegani
spojnosci
F
F
- ciecz niezwilżająca
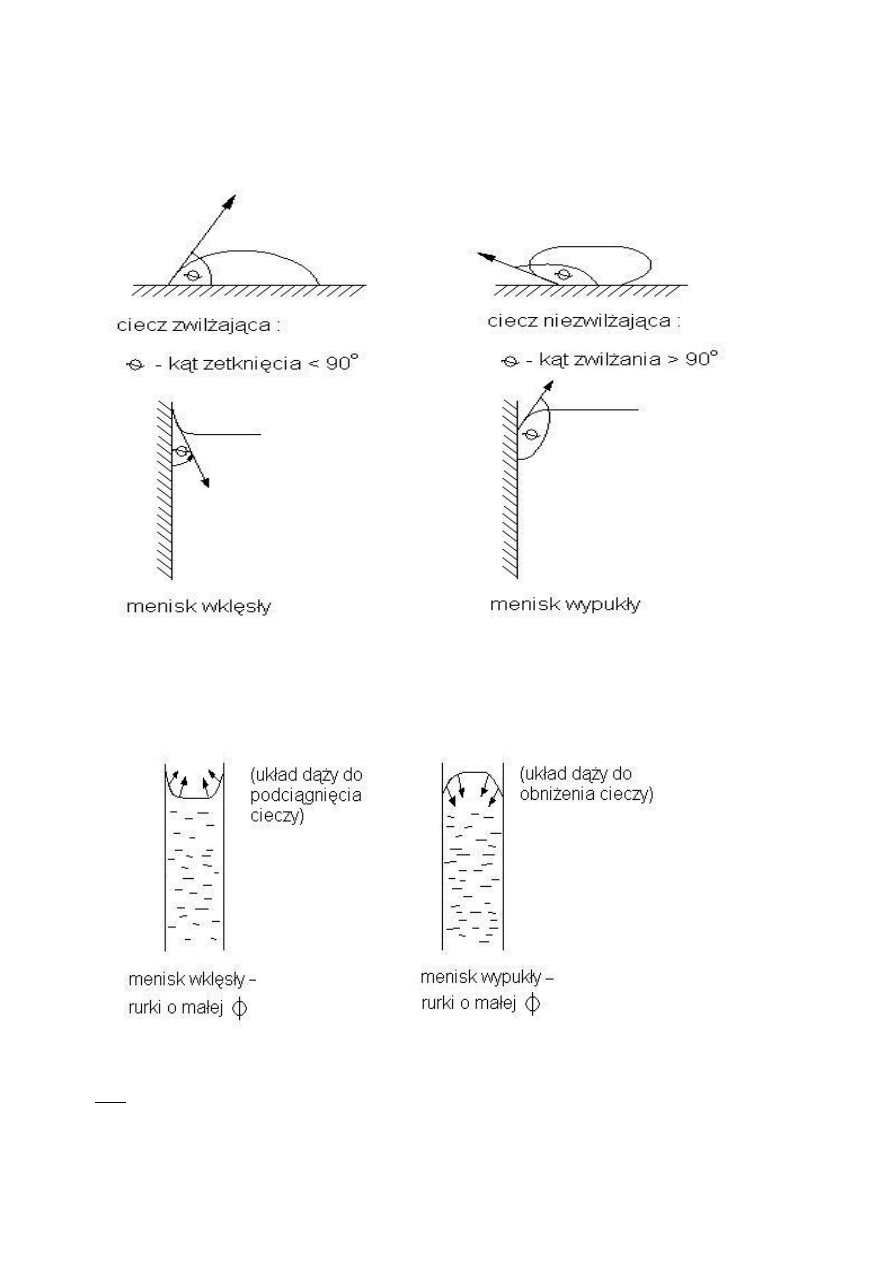
WYKŁAD 8
R
p
2
gdzie R – promieo półkuli tworzącej menisk
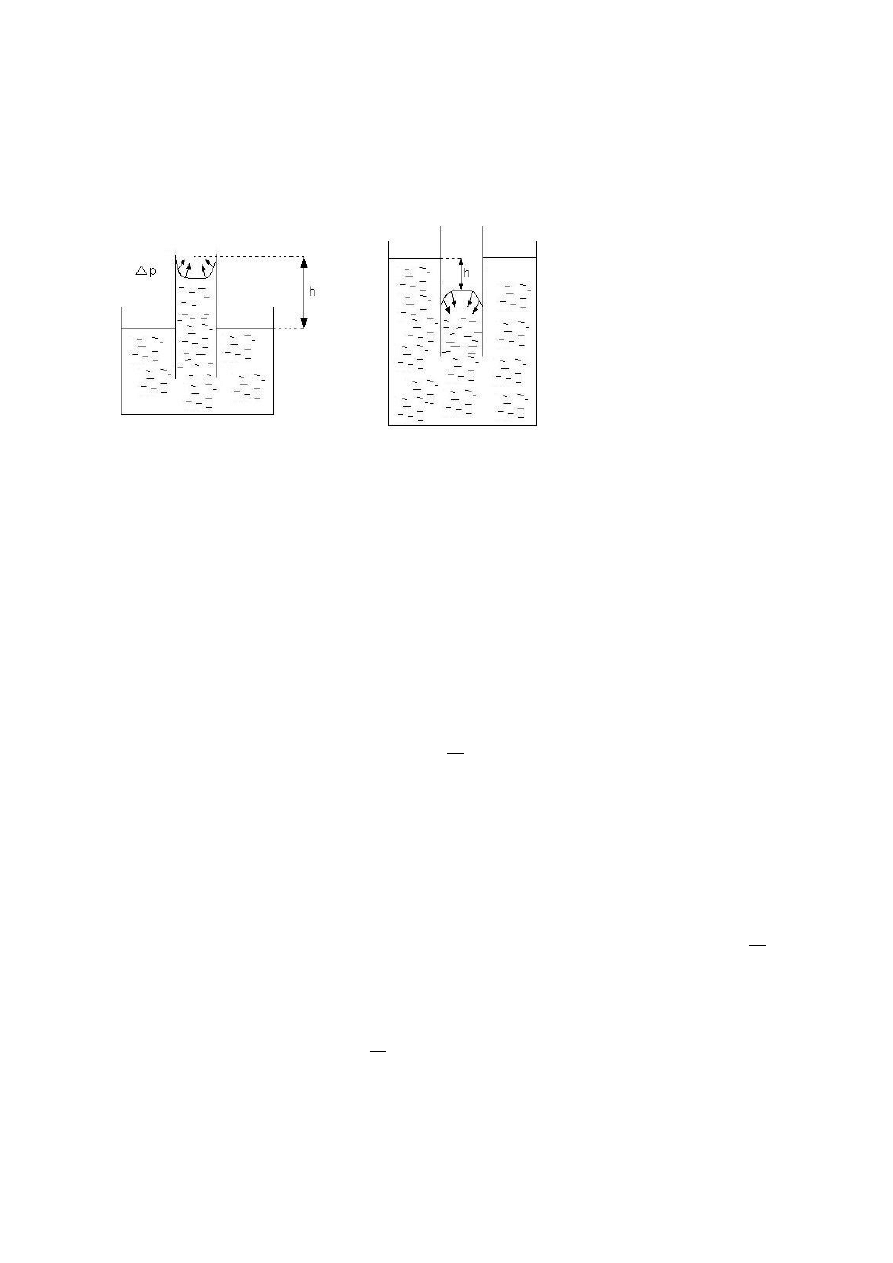
Ważną cechą wody jest włoskowatośd. Jest to transport przez niewielką średnicę. Szczególnym
wykorzystaniem są rośliny – transport wzdłuż łodygi.
PRZYKŁADY:
!
1) Jaką pracę należy wykonad przeciw siłom napięcia powierzchniowego aby wydmuchad baokę
mydlaną o R=6cm jeśli napięcie powierzchniowe
m
N
04
,
0
s
W
J
R
W
R
s
3
2
2
2
10
8
,
1
04
,
0
06
,
0
14
,
3
4
4
4
!
2) Jakiej trzeba energii na rozbicie kropli wody o m=2g na mał kropelki o d=
5
10
cm?
m
N
073
,
0
Dane:
m=2g , ρ=1000 kg/m³ , d=
m
7
10
,
m
N
073
,
0

3
3
2
0
2
3
0
0
0
4
3
3
4
4
4
3
4
m
R
R
m
r
s
R
s
r
m
v
m
m
m
n
s
s
n
s
s
E
gdzie; s-pow. Wyjściowej kropli,
0
s
- pow. Nowej kropli, n
– liczba nowych kropel
J
R
r
r
m
s
s
n
s
s
n
s
E
76
,
8
4
4
3
4
2
2
3
0
0
4 WŁASNOŚCI :
Zjawisko transportu i unoszenia – z transportem związane jest: lepkośd, przewodnictwo cieplne. Z
transportem cieczy związane są:
Dyfuzja
Transport przez membrany
Osmoza
Odwrotna osmoza
Dializa
Elektroliza
→dyfuzja – przemieszanie się masy na skutek bezwładnego ruchu cząstek. Dzięki temu wywiązują się m.in.
stężenia.
Zawsze istnieje siła napędowa w postaci gradientu (ciśnienia, temperatury, pola sił zewnętrznych). W
zależności od tegoż gradientu mamy dyfuzję stężeniową, ciśnieniową, temperaturową, wymuszoną...
Najczęściecj obserwowana jest dyfuzja stężeniowa. Podstawowym parametrem dyfuzji jest prędkośd. Zależy
ona od.
- gradientu
- temperatury
- lepkości
- stanu wody
Mówiąc o szybkości dyfuzji trzeba wspomnied o prawie FICNA
dt
dc
s
D
dV
Gdzie V – szybkośd dyfuzji, s – powierzchnia, D – współczynnik dyfuzji,
dt
dc
- gradient stężenia.
Dyfuzja jest wykorzystywana w wielu dziedzinach, np:
- azotowanie, nawęglanie
- separacja rud uranowych
- dzięki temu zjawisku mamy wyrównaną atmosferę
→Zjawisko związane z dyfuzją to przepływ przez przegrody półprzepuszczalne. Dążąc do wyrównania
ciśnienia następuje przepływ przez błonę. Jest to osmoza. Będzie to grupa procesów membranowych
Procesy membranowe – w obu częściach przedzielonych membraną są roztwory o różnych stężeniach. Muszą
byd spełnione:
-obecnośd dwóch przestrzeni z roztworami o różnych stężeniach
różne potencjały chemiczne (siła
napędowa)
-obecnośd membrany z możliwością selekcyjnego przepuszczania określonych cząstek, zatrzymywania innych
Mogą wystąpid oddziaływania mechaniczne oraz inne (absorbcje, szybkośd dyfuzji, zjawiska chemiczne)
Wpływające na odpowiednie działanie membrany. W odróżnieniu od procesów filtracji, gdzie o
przepuszczeniu decyduje rozmiar cząstki, tutaj decydują również inne kryteria (np.ładunek)
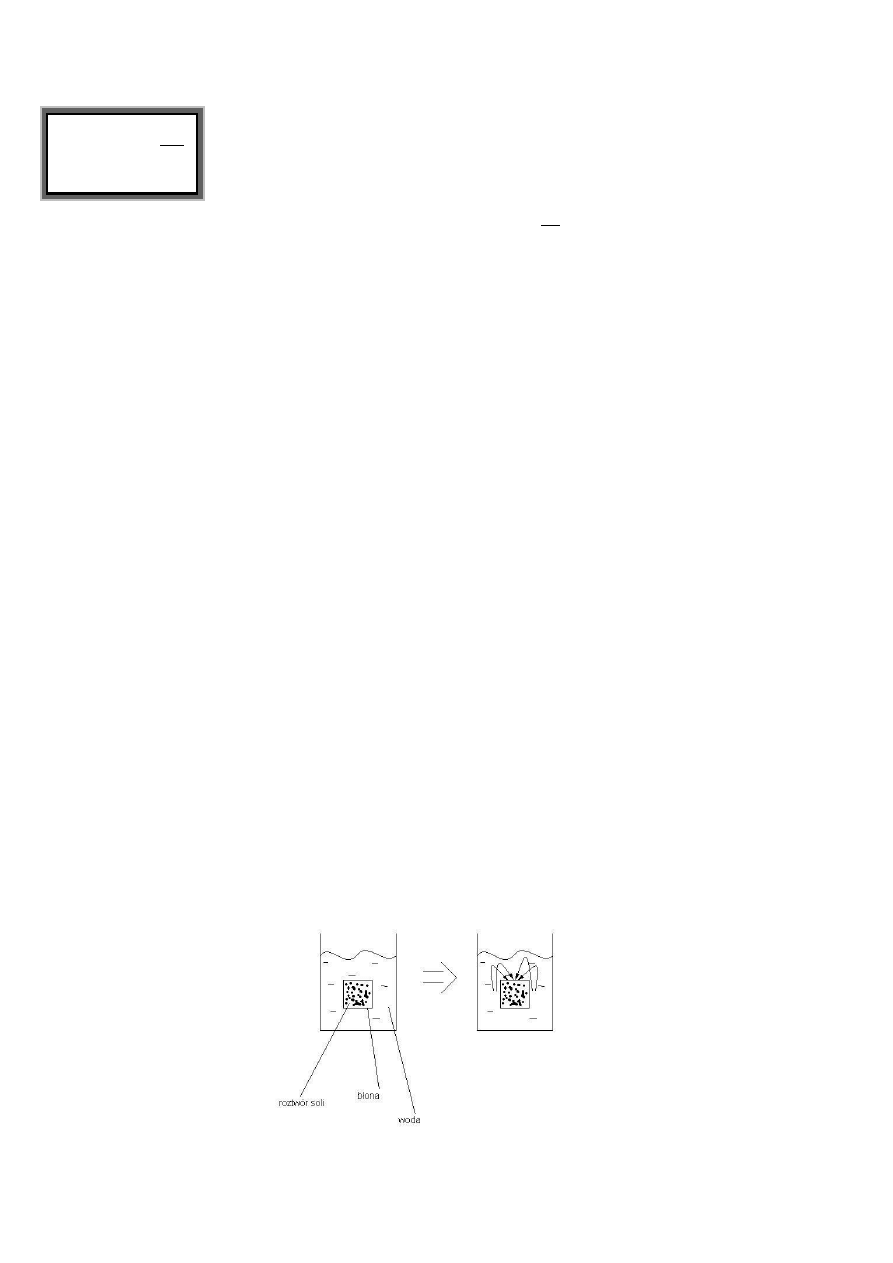
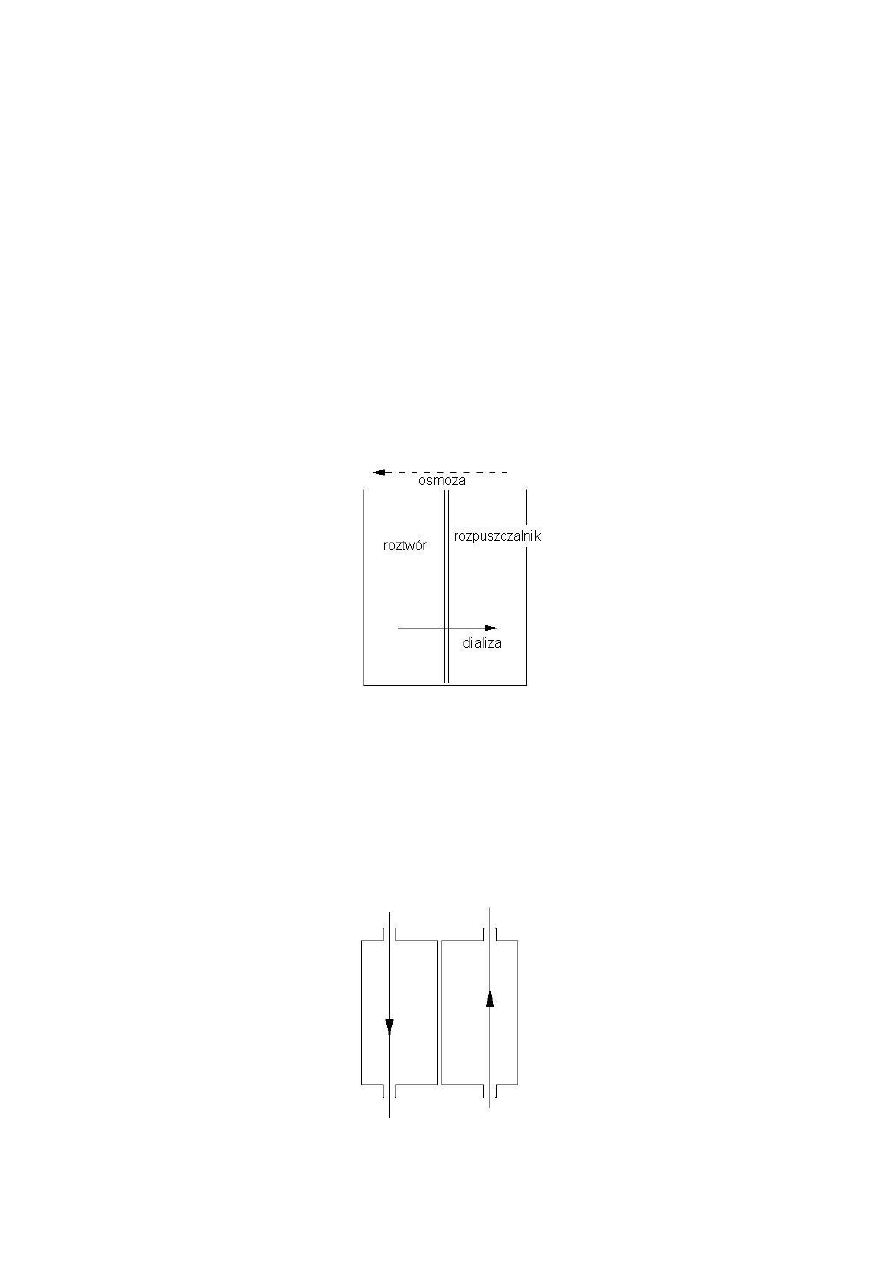
Osmoza – wyrównywanie różnic stężeo, samoistne przenikanie substancji przez błonę
półprzepuszczalną z roztworu o mniejszym stężeniu do większego stężenia. Jest procesem
istotnym i powszechnym. Procesy osmotyczne decydują bowiem o tym, co dostaje się lub jest
wydalane z organizmu.
Klasyczne doświadczenie:

Proces przebiega tak, że czysty rozpuszczalni wnika do roztworu ρ↑, p↓, rośnie ilośd cząsteczek (?) i
gdy osiągniete zostanie p
ret
, proces zanika. Ciśnienie przy którym samorzutny proces zanika nazywa
się ciśnieniem osmotycznym. Pomiar ciśnienia osmotycznego można dokonad przez układ:
Ciśnienie osmotyczne jest tylko dla układu dwóch płynów –
ciśnienie względne jednego względem drugiego!
Ciśnienie to oznacza się liczbowo jak :
T
R
v
n
, gdzie n-
liczba moli obj. Roztworu.
p
osmotyczne
jest własnością która zależy od stężenia a nie od
tego jakiego typu są te cząstki! Taka właściwośd nazywa się
właściwością KOLIGATYWNĄ (zal. od liczby cząstek)
DEF: p
osmotyczne
– równe jest p jakie w tej samej temperaturze
wywierałyby cząstki substancji rozpuszczonej gdyby w stanie
gazowym zawierały tę samą liczbę cząstek co roztwór.
Znaczenie procesu osmozy:
-błony komórek są „membranami półprzepuszczalnymi”. Dzięki czemu może następowad wymiana:
Gdy p
osm1
=p
osm2
– roztwór izotoniczny.
Gdy p
osm1
>p
osm2
– roztwór hipotoniczny
Gdy p
osm1
<p
osm2
– roztwór hipertoniczny
W zależności od tego woda → zalewa komórkę lub na odwrót
- w każdej komórce jest błona plazmatyczna powodując prężnośd rośkin. Gdy p
osm
↓ to błona jest
słabo dociskana, roślina więdnie (plazmoliza). Gdy mamy odwrotne zjawisko, roślina staje się zbyt
sztywna i też ulega zniszczeniu.
- konserwacje żywności np. mięso w roztworze hipertonicznym spowoduje że na skutek
osmotycznego działania przedostają się substancje niszczące bakterie gnilne.
Odwrócona osmoza – sztuczne wywieranie ciśnienia powyżej p
osmotycznego
i wypłynięcie substancji
do roztworu o mniejszym stężeniu. Jest powszechnie wykorzystywana do odseparowywania.
Przykładem zastosowania jest otrzymywanie z wody morskiej wody pitnej. Jest to proces
efektywny, usuwający ok 99% zanieczyszczeo. Często wykorzystuje się jako koocowy etap
oczyszczania wody (doczyszczanie). W przeciwieostwie do destylacji nie wymaga wysokiej
temperatury. Są to procesy wysokociśnieniowe. Nadwyżka p nad p
osm
winna byd ok 1Mpa.
Wady procesów osmozy i odwrotnej osmozy:
- wysokie koszty membran
- urządzenia bardzo wrażliwe na zanieczyszczenia mechaniczne.
Metody powszechnie stosowane w energetyce zawodowej do oczyszczania wody zasilającej.
Dializa – najstarszy proces membranowy, podobny do osmozy (obecnośd 2 przestrzeni i
membrany) lecz selekcja przepływu działa na innej zasadzie. Mechanizmem jest tu szybkośd
dyfuzji. Różnie się też kierunek przpływu. Wykorzystany do oddzielania roztworów
małocząsteczkowych z roztworów koloidalnych. Przegroda nie jest nigdy przegrodą idealną i
następuje w niewielkim stopniu osmoza która osłabia proces dializy.
Możliwy jest tak zwany układ przepływowy takiego procesu którego schemat jest:

Pozwala prowadzid dializę w sposób ciągły.
Zastosowanie w medycynie nazywa się – chemiodializa. Oczyszcza krew ze szkodliwych substancji w
niej zawartych przy złym funkcjonowaniu nerek. Przy mniejszym uszkodzeniu nerek stosuje się dializę
wewnętrznoustrojową – wykorzystuje się otrzewną w jamie brzusznej i wprowadza płyn dializujący.
Elektrodializa – opiera się o 2 membrany kationitową i anionitową. Po podłączeniu napięcia do
lewej strony będą przedostawał się aniony, do prawej kationy a w środku mamy czysty roztwór.
Elektrodializa jest wielostopniowa i by sprawniej działała trzeba podawad większe napięcie (80-
220V). Stosuje się do przemysłowego oczyszczania wody.
WYKŁAD 9
STRUKTURA WODY
Budowa atomu – budowa kwantowo-falowa. Atom może w różnych przypadkach mied własności
cząsteczkowe, w innych falowe.
Zasada nieokreśloności – nie jest możliwe jednoczesne dokładne określenie pędu i położenia
atomów. Wprowadzamy orbital na którym mamy prawdopodobieostwo natknięcia się.
Stan kwantowy definiowany przez 5 liczb kwantowych:
- spinowa liczba = ½
- ilośd powłok
- ilośd podpowłok
- stan orbitali
- (?)
–
numer powłoki np. M to n=3
–
n=3 – mamy 3 powłoki
–
na każdej powłoce są orbitale
Elektrony walencyjne decydują o:

–
ilości możliwych wiązao ( tyle ile nie sparowanych e
-
)
Wiązanie – atom tworzy wiązanie chemiczne wynikające z ilości niesparowanych e
-
Przy tworzeniu się wiązao atomy kierują sie do oktetu czyli dążą do konfiguracji najbliżej
gazów szlachetnych.
Rodzaje wiązao:
–
jonowe ( Istotą tego wiązania jest elektrostatyczne oddziaływanie między jonami o
różnoimiennych ładunkach, jeden oddaje e
-
drugi pobiera dążąc do oktetu, ten co oddaje
jon
+
ten co pobiera jon
-
)
–
kowalencyjne (takie same elektroujemności, podstawą jest uwspólnienie elektronów dążąc do
oktetu:
- trwałe
konfiguracje
–
kowalencyjne spolaryzowane ( łączą sie pierwiastki o elektroujemnościach podobnych
lecz nie identycznych: ten bardziej elektroujemny przyciąga wspólną parę bliżej siebie
- + ładunek
To układ dipolowy – nierównomierny rozkład ładunku.
–
wodorowe ( polega głównie na przyciąganiu elektrostatycznym między atomem wodoru i
atomem elektroujemnym zawierającym wolne pary elektronowe. Klasyczne wiązanie
wodorowe powstaje, gdy atom wodoru jest połączony wiązaniem kowalencyjnym z
innym atomem o dużej elektroujemności (np. tlenem, fluorem, azotem).
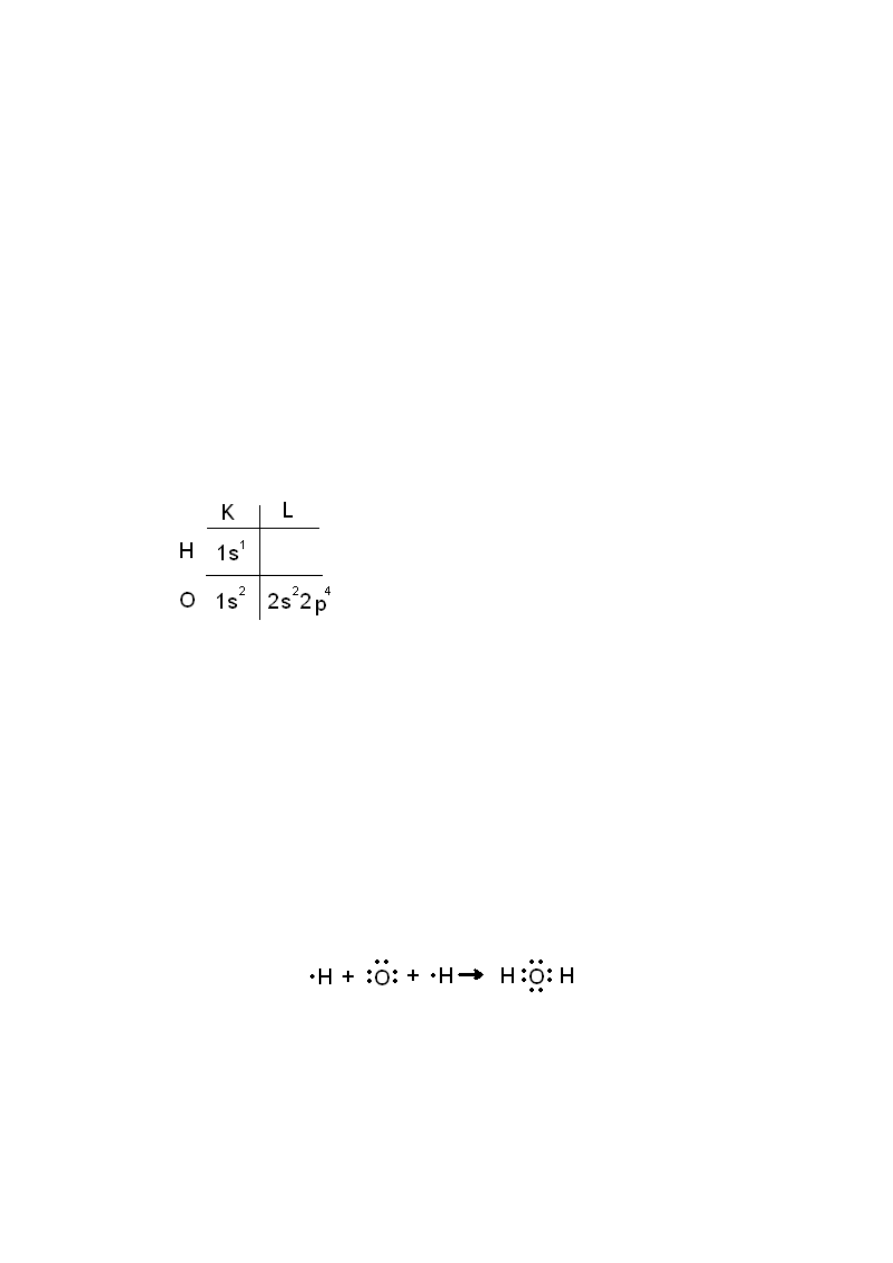
Cząstka H
2
O jest najmniejszą ze znanych cząstek 3 atomowych o masie atomowej 18. Skład
11,9% wodoru, reszta tlen. Istnieje wiele cząstek 3 atomowych ale tylko woda może
występowad w 3 stanach skupienia. W normalnej temperaturze jako jedyny z wodorków
występuje w stanie ciekłym. Wynika to z budowy samej cząstki wody.
Struktura elektronowa składników wody:
1
1
H 16
8
O
Liczba atomowa będzie określała liczbę protonów a w za tym idzie i neutronów w jądrze.
Atom wodoru i tlenu
O właściwościach decyduje ile elektronów znajduje sie na ostatniej powłoce. Niesparowane
elektrony decydują ile wiązao możliwe jest do wykonania i decydują o wartościowości
pierwiastka. W związku wodoru i tlenu który powstaje dzięki wiązaniom nie może
zastosowad reguły helowca (każdy związek dąży do uzyskania oktetu elektronowego).
W przypadku różnych elektroujemności mamy albo możliwości wiązania kowalencyjnego
albo jonowego.
Mamy układ w którym tlen uzyskuje trwałą powłokę oktetu elektronowego a wodór osiąga
dublet elektronowy.
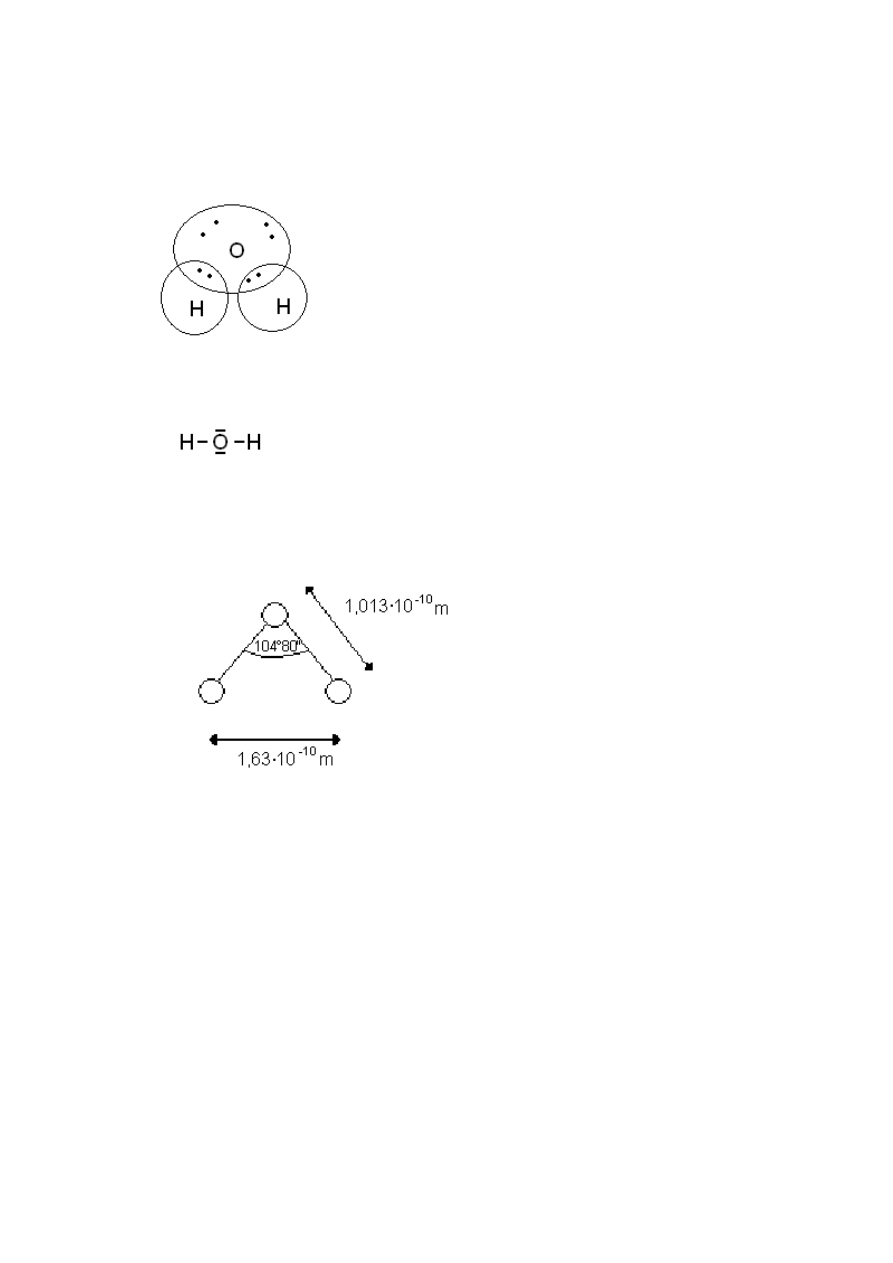
Występują 4 pary elektronowe:
●
2 pary wiążą atom tlenu z wodorem
●
2 pary wolne ( swobodne) – mogą byd
wykorzystane do przyłączenia. Mogą
tworzyd się wiązania koordynacyjne albo
wiązania wodorowe – tworzenie mostków z
atomami wodorów innych cząsteczek. Mogą
się łączyd dzięki nim w większe ugrupowania.
W postaci strukturalnej można zapisad:
Jest to zapis symboliczny w praktyce cząstki nie są prostoliniowe względem siebie.
W wyniku różnych elektroujemności silniejsze przyciąganie e
-
wodoru przez tlen. Można
spotkad częściej e
-
w pobliżu tlenu niż wodoru. Przy wodorze mamy większą gęstośd
ładunków + , w pobliżu tlenu większą gęstośd ładunków – (ładunki cząstkowe). Pojawia się
dipol i moment dipolowy wynikający z braku równowagi elektroujemności.
l - odległość H-O
1D = 0.33 * 10
-29
A*s*m
Przy symetrii byłoby:
równowaga
Przy braku symetrii:
Wypadkowy moment dipolowy
= 1,84D
Wiązanie (orbitale) cząstkowe mogą powstawad gdy:
●
mamy połączenia 2 orbitali s
e
-
orbital s
ss
sp
sp
sp

–
mamy połączenia orbitali s z p
s p
sp
–
mamy połączenia 2 orbitale p
p p
pp
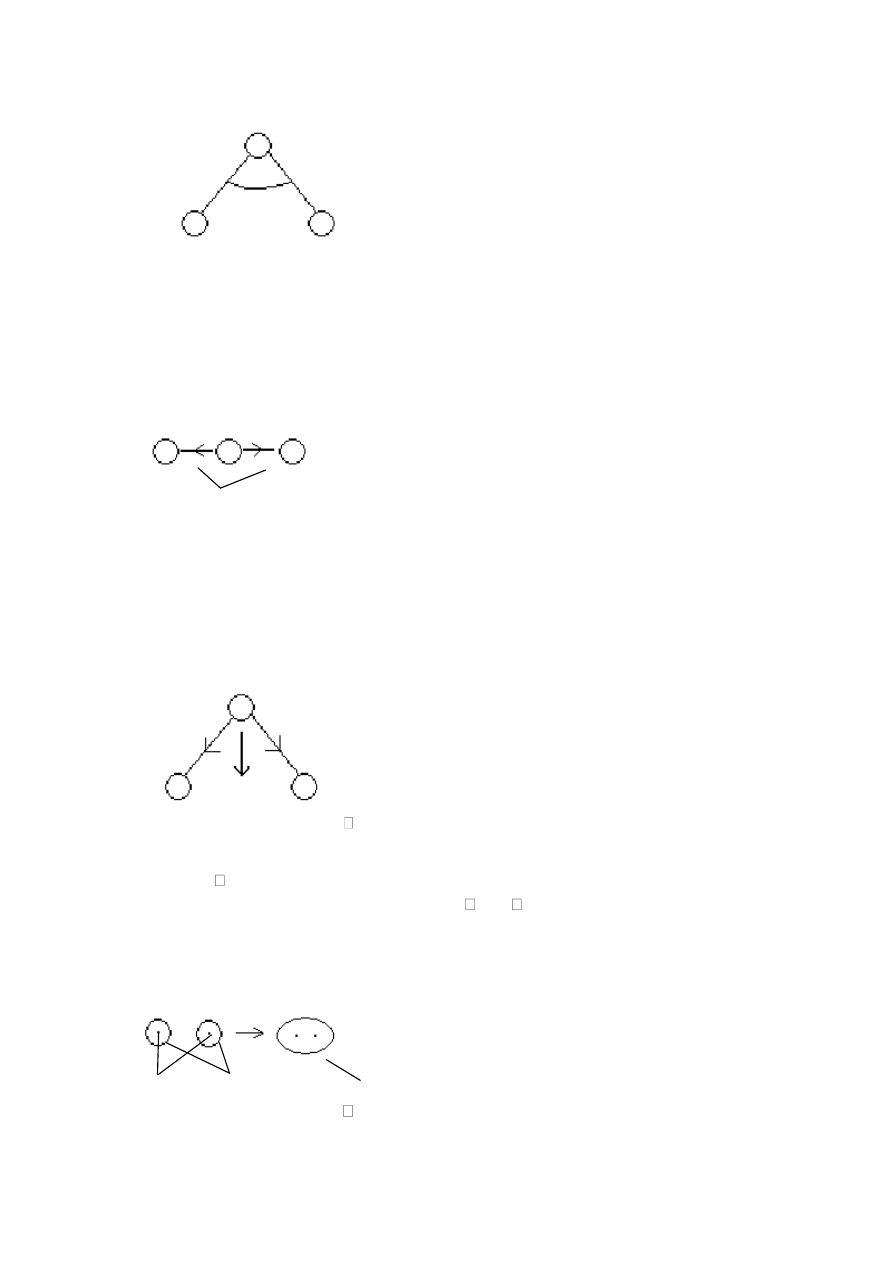
Rozróżniamy:
●
atom centralny (tu atom tlenu)
●
ligandy (otoczenie atomu centralnego)
Jest to jedynie płaski model cząstki wody. W rzeczywistości model przestrzenny opracowuje
sie o metodę V SEPR uwzględniającą odpychanie par elektronów. Określa siłę działającą na
cząsteczke. Między parami są siły odpychania elektrostatycznego. Cząstki dążą do
minimalizacji sił międzycząsteczkowych czyli będzie tak gdy odległości będą dążyd do jak
największych. Określa sie liczbę przestrzenną determinującą punkty w przestrzeni położenie
par by odległości były maksymalne. Za obiekt modelowy przyjmujemy liczbę :
L
p
= L
wp
+ m + n
L
wp
– swobodne pary e
-
m – liczba atomów wodoru
n – liczba ligandów
L
p
=2+2+0=4 – u nas
“4” mówi o rozkładzie tetraedrycznym

atom centralny
Kąt reakcyjny – między wiązaniami walencyjnymi.
Istnieją różnice między teoretycznym założeniem kąta (104 i 99). Istnieją hipotezy:
–
uwzględniające siły odpychania – różna w stosunku do różnych par, stąd geometria 4-
scianu jest zakłócona
–
układ ulega zmianom w stosunku do tlenu. Następnie wymieszane e na orbitalach i
pozostają 4 orbitale “zhybrydyzowane”. Pozostały z 1 orbitalu s i 3 orbitalach p – sp
3
sp
3
Jest to układ korzystny, pozwala na uzyskanie silniejszych wiązao.
Struktura wody polega na związywaniu cząsteczek przez:
biegunowośd (dipole)
wiązania wodorowe
Wiązania wodorowe
Są to oddziaływania które mogą występowad gdy mamy atom A i B silnie elektroujemne.
Jeden z nich połączonych wiązaniem kowalencyjnym z wodorem, drugi ma wolną parę e.
Wspólna para e jest bliska A stosunkowo łatwo może dojśd do związania z ujemnym
biegunem wolnej pary e ze strony B.
Mostek wodorowy
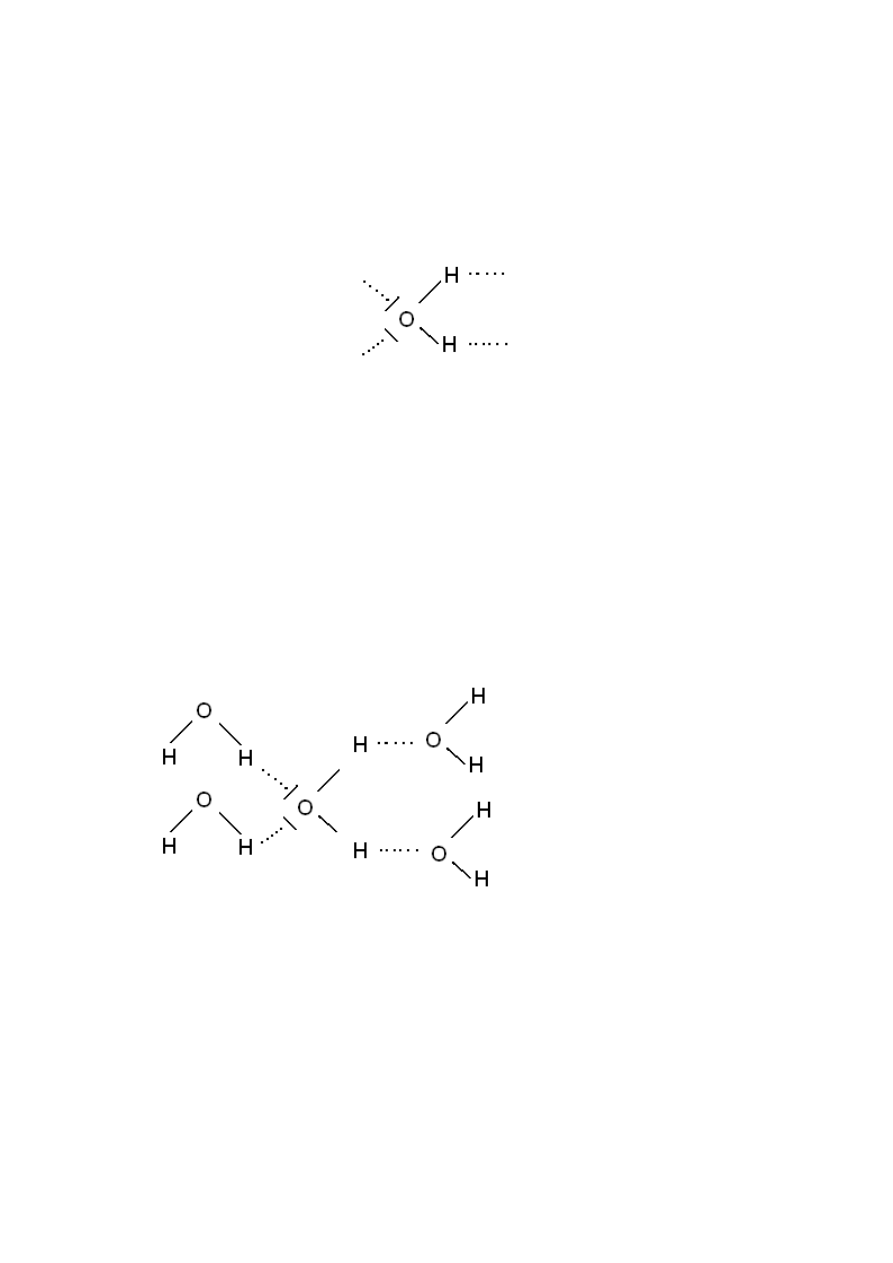
Pierwiastki które mogą uczestniczyd to : N, F, O, C. Daje to możliwośd procesów asocjacji i
hydratyzacji. Można więc tworzyd skupiska pierwiastków połączonych wiązaniem
wodorowym.
Mostek
Mostek
Mostek
Mostek
Wiązanie wodorowe wpływa na:
zakresy temperatur (każdorazowe przejście fazowe, duże ciepła przemian)
zjawisko przylegania
zjawisko nietypowej rozszerzalności temperaturowej
Zjawisko asocjacji.
Asocjacja – łączenie cząstek danego rodzaju w większe ugrupowania. Działanie może byd
przyciągające. W przypadku wody mamy oddziaływania:
elektrostatyczne (woda jako dipol)
x H
2
O – (H
2
O)
x
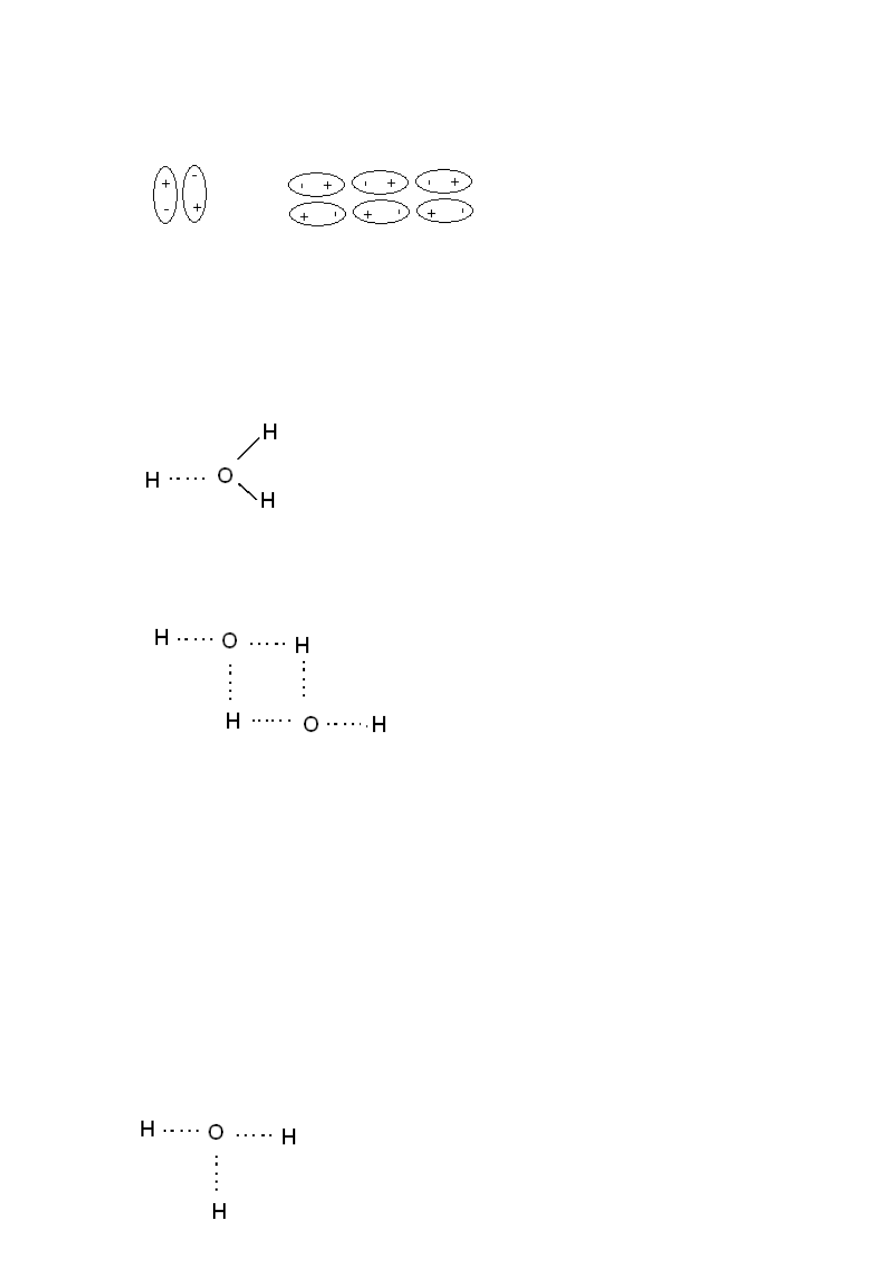
(H
2
O)
2
(H
2
O)
6
występowanie mostków wodorowych
Podwójne wiązania wodorowe
WYKŁAD 10
Hydratacja - uwodnienie – otaczanie jonów cząstkami wody albo innych ładunków
dodatnich jak i ujemnych. Cząstki podlegające hydratacji nazywamy cząstkami/ związkami
uwodnionymi. Ilośd cząstek wody tworzy powłokę hydratacyjną a ich liczbę to liczba
hydratacyjna. W większości przypadków mamy do czynienia z oddziaływaniem
elektrostatycznym który związany jest z biegunowością cząsteczki.
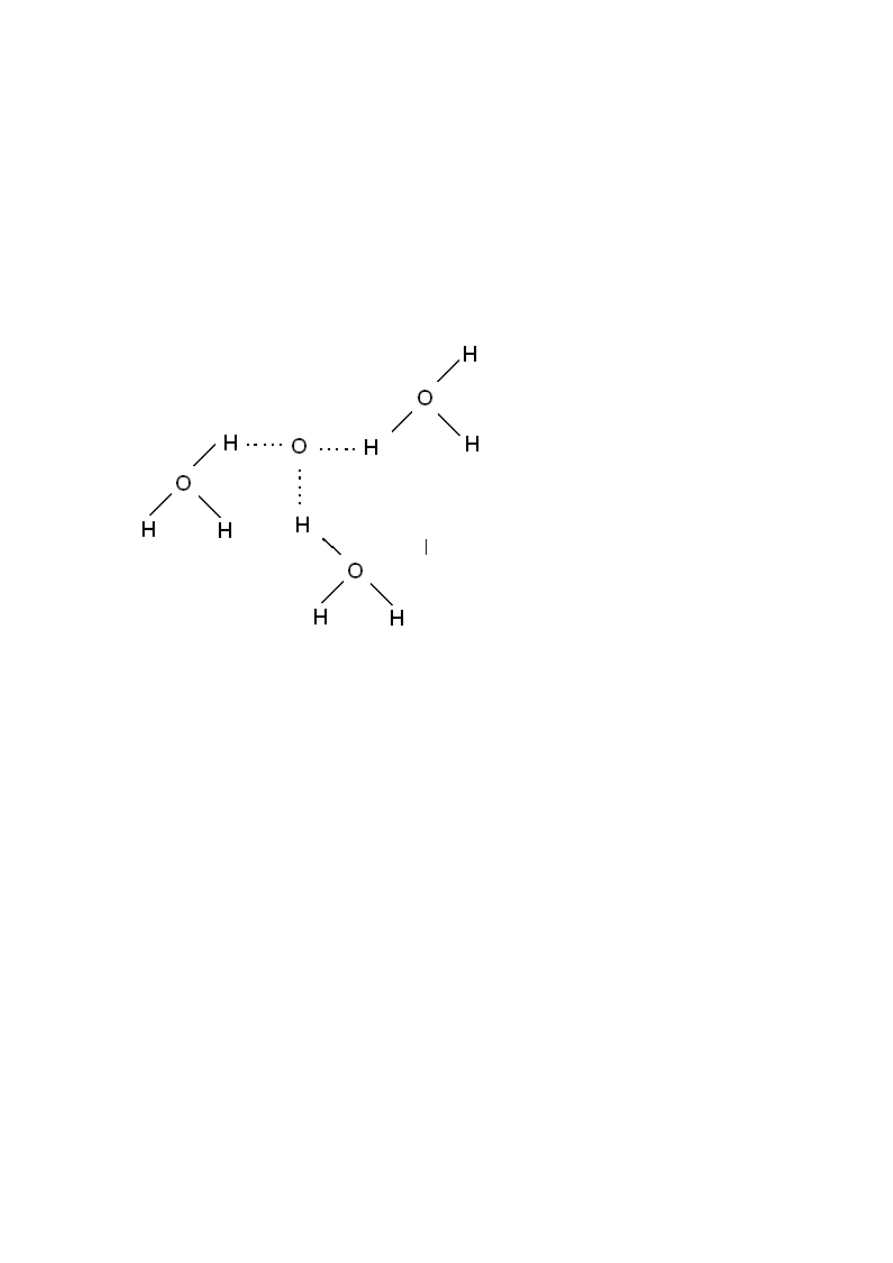
H
3
O
Przy tworzeniu sie minerałów uwodnionych w z związku z dipolowością może pełnid funkcję
rozpuszczalnika.
Przykładem jest rozpuszczanie substancji jonowej (kryształów połączeo sieci krystalicznej).
Kryształ dobrze rozpuszcza się w wodzie, dzięki siłom elektrostatycznym nastąpi niszczenie sił
krystalicznych i dwie cząstki(jony) są natychmiast hydratyzowane.
Woda posiada dużą stałą dielektryczną co powoduje, że wiązanie sieci krystalicznej
substancji rozpuszczonej są znacznie osłabione.
Woda w postaci stałej
Woda w stanie stałym występuje z reguły pod postacią lodu. Lód jako ciało stałe może byd
badane metodami takimi jak dyfrakcja, stąd można dośd dokładnie wniknąd w strukturę.
Woda i lód różnią się w strukturze stopniem uporządkowania. Lód ma niższą energię
wewnętrzną niż ciecz.
Struktura lodu to struktura tetraedryczna. Jest to struktura oparta na bazie 4-scianu
foremnego który bierze się z wiązao wodorowych.
<ZDJĘCIE NIECZYTELNE>
W okresie zimowym więc woda ciężka to woda cieplejsza czyli będzie przy dnie. Zimniejsza będzie
przy wierzchu.
2x w roku całkowicie wymienia się woda w akwenie co powoduje w miarę równomierne jej
natlenienie. Podczas zamarzania woda ulega rozszerzeniu. Rozszerzająca się woda wywiera ponadto
duże siły.
** Temperatury przemian fazowych
4,5 i cw 6 – wykres temp wrzenia i krzepnięcia
Aby
…
przemiany fazowe
… … …
ilości ciepła ze względu na wiązanie wodorowe.
**stała dielektryczna
Siła przyciąganie ładunków F=e1*e2/epsilon/r gdzie epsilon to stała dielektryczna. Ze wzrostem stałej
dielektrycznej rośnie oddziaływanie między cząstkami. Woda jest dzięki sporej stałej dielektrycznej
dobrym przewodnikiem.
**Lepkośd – stała z jaką trzeba działad na powierzchnię 1m2 na drugą taką samą warstwę oddaloną o
1m by uzyskad przesunięcie rzędu 1m/s. Jest to lepkośd dynamiczna.
(innym pojęciem jest
…
mi *Ns/m2???+, ale wody jest rzędu 1,789kNs/m2
**Własności elektryczne – zgodnie z prawem Ohma I=U/R, gdzie 1/R – kondunktancja ; woda jest
złym przewodnikiem, rezystancja chwilowa cząstki wody jest ogromna. Przy przekroju 1cm2 a
…
na
taką rezystancją w miedziany przewód 1cm2 ale h=4*R kuli ziemskiej.
Ponieważ własności elektryczne zależą od ilości prądonośnych elementów – jonów
Woda destylowana: 0,5*10-4 – 20*10-4 1/omometr

Woda naturalna: 0,5 – 5,0???
Woda b czysta: 1,3*10-8
Są zależne od ilości jonów które się w wodzie znajdują. Mnożąc wszystko *0,55 – 0,75 można określid
ilośd substancji … mg/dm3
**Oddziaływanie pola magnetycznego na wodę
Realizuje się na zasadzie filtrów magnetycznych. Woda nabiera charakterystycznych właściwości, np:
- przy namagnesowanej wodzie wziętej do produkcji ceramiki, trwalsze
- woda namagnesowana charakteryzuje się malejącym osadzaniem kamienia kotłowego.
(prawdopodobnie jest to wynikiem krystalizacji)
**Przejście fazowe
Układ – wyodrębniona częśd przestrzeni
Składnik układu – określone substancje chemiczne bez względu na stan skupienia
Faza – jednorodna fizycznie częśd układu oddzielona od innych fazą rozdziału na którym następuje
składowa miara …
Może byd:
- układ 1 składnikowy
- układ wieloskładnikowy
- układ 1 fazowy (homogeniczny)
- układ wielofazowy (heterogeniczny)
- rozproszenie molekularne
- rozproszenie makroskopowe
- rozproszenie ???
Przemiany fazowe – jedna faza na skutek … zmienia fazę
Składowa niezależna (liczba) – minimalna liczba substancji chemicznej potrzebna do określenia
układu
Stopieo swobody (liczba) – liczba … … fiz. które mogą byd dowolnie mierzone bez … … fazowych i
powstających nowych faz

Zmiana fazy – następuje w wyniku odprowadzenia lub doprowadzenia ciepła.
Gdy od dużego uporządkowania dążymy do mniejszego uporządkowania, dostarczamy ciepło.
Odwrotnie odprowadzamy ciepło. Energia doprowadzona do układu gdzie prawie w całości na
zmianę stopni uporządkowania.
Równowaga fazowa – równowaga ustalająca się między 2 lub 3 fazami układu wielofazowego w
którym nie zachodzą reakcje chemiczne
Dla każdej z faz mamy 2 stopnie swobody bo można zmienid 2 parametry. Wyjątkiem są przemiany
fazowe np. topnienie czy … które zachodzą przy ustalonym parametrze i mamy 1 st. swobody.
Stopnie swobody opisuje reguła faz Gibbsa
Z=s-f+2
z-ilośd stopni swobody s-ilośd składników f-ilośd faz
w punkcie w którym ciało stałe , ciecz i gaz mamy 0 stopni swobody i jest to punkt potrójny
**Topnienie – każda przemiana musi przebiegad przy odpowiedniej ilości ciepła. Przy topnieniu
parametrem jest … ilośd energii … … Wraz z doprowadzaniem energii … … …. …. Amplituda zbyt duża
to ulegają … Podczas topnienia można rozważyd sytuację:
A-ze wzrostem ciśnienia temp maleje
B-ze wzrostem ciśnienia temp rośnie
Dostarcza się do punktu
przy p=const t=const, drugą pośrednią
Ten opis jest dla ciał krystalicznych. Trudnośd opisu rośnie ze wzrostem lepkości
Wyszukiwarka
Podobne podstrony:
biłyk,Chemia wody, opracowanie zagadnień
CHEMIA WODY opracowanie notatek
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
biłyk,Chemia wody, Eutrofizacja wód
Chemia wody egzamin
Jasiorski, chemia ogólna, Opracowane zagadninia na kolowium
temat 12, chemia wody-w-
UBOCZNE PRODUKTY, Chemia wody - (A. Biłyk)
instrukcja cw 1, II rok, II semestr, Chemia wody i powietrza
chemia wody zaliczenie
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZENIE TLENU W WODZIE
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZANIE CHLORKÓW I SIARCZANÓW
kwicińska,CHEMIA WODY I POWIETRZA,ODCZYN
Biłyk,chemia wody, Właściwości chemiczne wody
Chemia wody pytania cz
Chemia wody i powietrza sprawozdanie 2
ćwiczeniee 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opraco
więcej podobnych podstron