
ELEMENTY TERMODYNAMIKI

Podstawowe pojęcia termodynamiki
P.Łukowski, 2
Termodynamika bada zmiany energii układów w czasie
przemian chemicznych i fizycznych.
Układ termodynamiczny – wydzielona część środowiska,
będąca przedmiotem badań termodynamicznych.
Otoczenie – pozostała część środowiska, nie wchodząca w
skład układu termodynamicznego.
Rodzaj układu
termodynamicznego
Wymiana energii
z otoczeniem
Wymiana masy
z otoczeniem
Otwarty
+
+
Zamknięty
+
-
Izolowany
-
-

P.Łukowski, 3
Podstawowe pojęcia termodynamiki
Parametr układu – wielkość fizyczna opisująca stan układu,
którą można wyznaczyć przez bezpośredni pomiar.
Parametry intensywne – niezależne od wielkości układu:
- temperatura,
- ciśnienie,
- stężenia składników.
Parametry ekstensywne – zależne od wielkości układu:
- masa,
- objętość.

Podstawowe pojęcia termodynamiki
P.Łukowski, 4
Funkcja termodynamiczna – wielkość definiująca stan
energetyczny układu, której nie można bezpośrednio
zmierzyć, a jedynie obliczyć na podstawie parametrów układu.
Funkcje termodynamiczne są funkcjami stanu, a nie
funkcjami procesu, tzn. zależą tylko od stanu początkowego i
końcowego układu, a nie od sposobu realizacji przemiany.
Przemiana izotermiczna ⇒ T = const
Przemiana izobaryczna ⇒ p = const
Przemiana izochoryczna ⇒ V = const

Funkcje termodynamiczne
P.Łukowski, 5
1. Energia wewnętrzna, U
Sens fizyczny: całkowita energia układu, czyli suma wszystkich
oddziaływań w układzie i między układem a otoczeniem.
2. Entalpia, H = U + pV
Sens fizyczny: energia wewnętrzna układu + praca, jaką
należy wykonać nad otoczeniem, by w danych warunkach
uzyskać miejsce na ten układ (pV ≡ praca zmiany objętości).

P.Łukowski, 6
Funkcje termodynamiczne
3. Entropia, ∆
∆
∆
∆
S = ∆
∆
∆
∆
Q/T
Sens fizyczny: miara stopnia nieuporządkowania układu,
określająca kierunek przemian samorzutnych.
W termodynamice statystycznej entropia odpowiada liczbie
możliwości, na jakie może być zrealizowany dany stan
makroskopowy układu, tzn. jest miarą prawdopodobieństwa
zaistnienia tego stanu.
Obie interpretacje prowadza do wniosku, że
entropia
układu w czasie przemian samorzutnych zawsze
wzrasta
(druga zasada termodynamiki).

P.Łukowski, 7
Funkcje termodynamiczne
4. Energia swobodna, F = U – TS
Sens fizyczny: część energii wewnętrznej układu, która może
być w danym procesie uwolniona w formie pracy lub ciepła przy
stałej temperaturze i objętości (przemiana izotermiczna,
izochoryczna).
W przemianie samorzutnej w warunkach izochorycznych ∆
∆
∆
∆
F ≤
≤
≤
≤
0.
5. Entalpia swobodna (potencjał termodynamiczny Gibbsa),
G = H – TS
Sens fizyczny: część entalpii układu, która może być w danym
procesie uwolniona w formie pracy nieobjętościowej (np.
elektrycznej).
W przemianie samorzutnej w warunkach izobarycznych ∆
∆
∆
∆
G ≤
≤
≤
≤
0.

Egzergia, B
P.Łukowski, 8
Maksymalna praca, jaką układ może wykonać na otoczeniu.
Sens fizyczny: zdolność do wykonania pracy użytecznej
w otoczeniu naturalnym, tzn. miara „jakości” lub „użyteczności”
energii.
Egzergia nie podlega prawom zachowania!
Zasady termodynamiki
P.Łukowski, 9
I Zasada – zasada zachowania energii
W układzie izolowanym suma wszystkich rodzajów energii
jest stała.
∆
U = Q + W
Q – energia przekazana do układu na sposób ciepła
W – energia przekazana do układu na sposób pracy
Energia nie może być ani utworzona, ani zniszczona,
może jedynie zmieniać formę.
Przykład: spalanie paliwa w pojeździe:
Energia
chemiczna
Energia mechaniczna – użyteczna, zamieniana na ruch
Energia cieplna – bezużyteczna, rozpraszana w otoczeniu
E
ch
= E
m
+ E
c
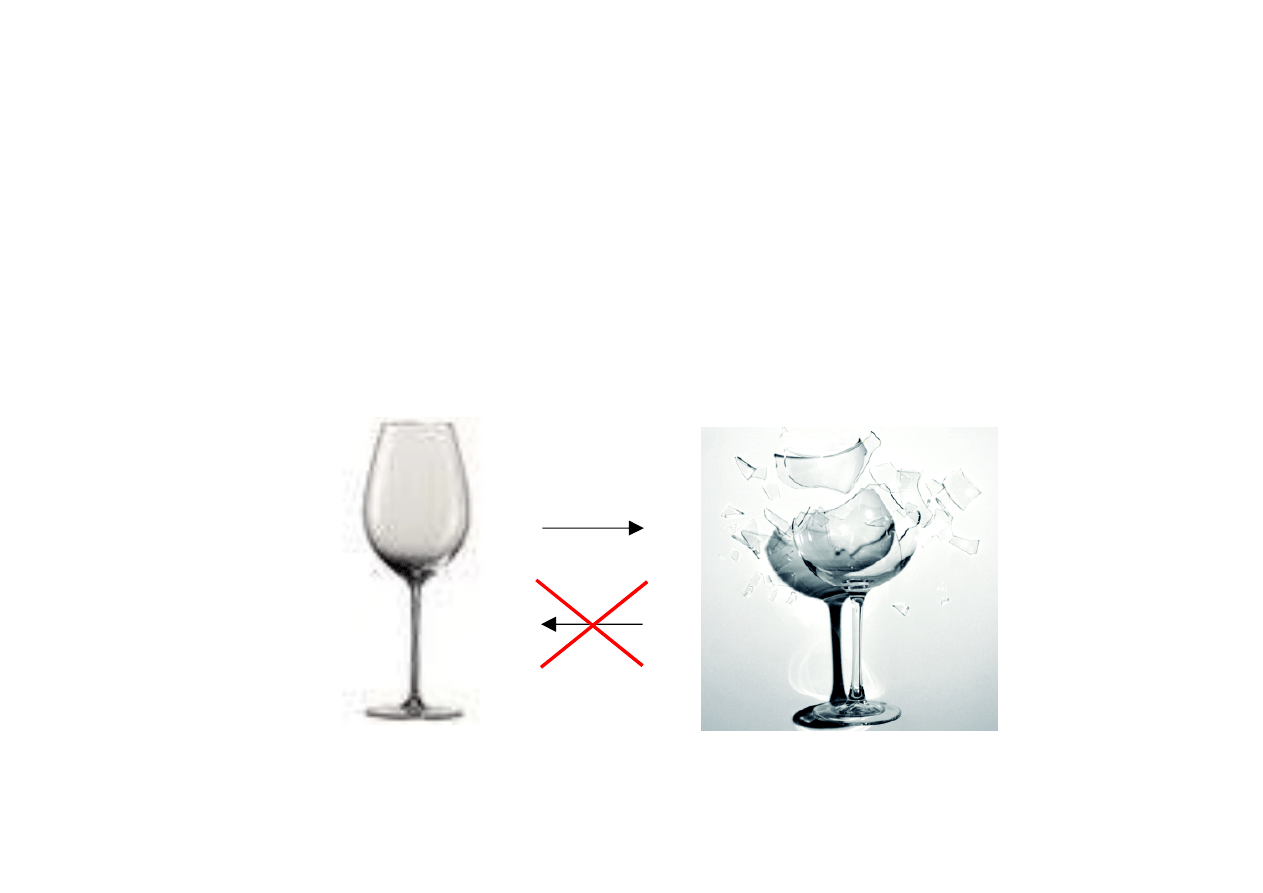
P.Łukowski, 10
Zasady termodynamiki
II Zasada – zasada wzrostu entropii
W układzie izolowanym w dowolnym procesie samorzutnym
entropia nigdy nie maleje.
∆
S ≥ 0
Jeżeli Wszechświat jest układem izolowanym, to w końcu
osiągnie stan całkowitej równowagi termodynamicznej, w
którym nie będą możliwe żadne przemiany.
Stan maksymalnej entropii
oznacza równowagę
termodynamiczną układu.
Hipoteza śmierci cieplnej Wszechświata
W układzie izolowanym
entropia nieuchronnie
wzrasta.
Jeżeli... ☺
P.Łukowski, 11

P.Łukowski, 12
Zasady termodynamiki
III Zasada
W krysztale doskonałym w temperaturze zera bezwzględnego
wartość entropii wynosiłaby 0.
Kryształy doskonałe nie istnieją (i nie mogą istnieć)!
Postulat Nernsta: nie da się osiągnąć temperatury zera
bezwzględnego.
Prawa termochemiczne
P.Łukowski, 13
Prawo Lavoisiera-Laplace’a:
Q rozkładu związku chemicznego = Q syntezy tego związku
Prawo Hessa:
Σ
Q wymieniona przez układ z otoczeniem zależy tylko od
stanu początkowego i końcowego układu, a nie zależy od
stanów pośrednich.
Σ
Q = Q(E) – Q(A)
B
C
D
E
Q
A
Q (E)
Q (A)
B
C
D
E
Q
A
Q (E)
Q (A)
Prawo Kirchhoffa: ∆H
reakcji
= f(T)
Wyszukiwarka
Podobne podstrony:
Prawo dewizowe 2010 09 id 38648 Nieznany
2000 09 Szkola konstruktorowid Nieznany (2)
cwiczenia 09 id 124345 Nieznany
09 Programowanie w srodowisku j Nieznany
09 wykladid 8098 Nieznany
2002 09 Osla laczka Nieznany (2)
gal08 09 id 185722 Nieznany
84 Nw 09 Wzmacniacz operacyjny Nieznany (2)
07 termodynamikaid 6984 Nieznany (2)
B 09 x id 74805 Nieznany (2)
09 6id 7711 Nieznany (2)
acad 09 id 50516 Nieznany (2)
E1 Teoria 2008 09 id 149145 Nieznany
I CSK 166 09 1 id 208206 Nieznany
potencjaly termodynamiczne id 3 Nieznany (2)
Fizjologia Cwiczenia 09 id 1743 Nieznany
09 11id 7696 Nieznany (2)
311[10] Z1 09 Wykonywanie pomia Nieznany (2)
26429 09 id 31508 Nieznany (2)
więcej podobnych podstron