
Ćwiczenia 13 9.01.2013
T : Testy lekowrażliwości drobnoustrojów.
ANTYBIOGRAM :
badanie laboratoryjne, mające na celu określenie wrażliwości obecnych w próbce bakterii na
antybiotyki. Bakterie z pobranych wydzielin, np. z plwociny, hoduje się na specjalnych pożywkach
i bada się ich wzrost w obecności różnych antybiotyków. Antybiogramy wykonuje się przy ciężkich
lub nawracających infekcjach. Coraz więcej szczepów bakterii jest odpornych na niektóre
antybiotyki, wskutek często niepotrzebnego ich stosowania.
Antybiogram ---> opis wrażliwości określonego gatunku drobnoustroju na działanie określonych
antybiogramów i/lub chemioterapeutyków.
METODY OKREŚLANIA WRAŻLIWOŚCI :
a) metoda dyfuzyjno-krążkowa
b) metoda rozcieńczeniowa
c) E-test
ad.a) metoda dyfuzyjno-krążkowa
tzw. metoda Kirby-Bauera. Najczęściej używana metoda testowania lekooporności. Oparta jest na
dyfuzji zawartego w krążku do podłoża. Antybiotyk dyfunduje promieniście, tworząc gradient
stężeń. Największa jego koncentracja występuje przy brzegach krążka i spada wraz z odległością od
krążka. Większość strefy zahamowania wzrostu bakterii jest wprost proporcjonalna do stopnia
wrażliwości bakterii na antybiotyk - im większa jest strefa zahamowania, tym bakteria jest bardziej
wrażliwa. W zależności od wielkości strefy, bakterie określa się jako: wrażliwe lub oporne na
podstawie przyjętych standardów (rekomendacji). Jest to metoda dobrze wystandaryzowana,
powtarzalna, relatywnie tania.
Wrażliwy "S"---> wrażliwość drobnoustroju na standardowe dawki leku, wysokie prawdopodobień-
-stwo sukcesu klinicznego.
Średnio wrażliwy "I" ---> szczepy w zakresie MIC pomiędzy wrażliwym a opornym, sukces
terapeutyczny niepewny, może być osiągnięty, gdy lek jest zagęszczany
(np. drogi moczowe) lub może być stosowany w większej dawce
(np. przy niskiej toksyczności).
Oporny "R" ---> wysokie prawdopodobieństwo niepowodzenia terapeutycznego, niezależnie od
dawki leku i lokalizacji infekcji.
Oznaczenie lekooporności metodą krążkowo-dyfuzyjną:
* Materiały :
- podłoże agar Mueler-Hinton (MHA)
- 1 ml jałowej 0,85% soli fizjologicznej (NaCl)
- krążki bibułowe z antybiotykiem
- zawiesina bakteryjna
- wzorzec skali - jałowe wymazówki

* Wykonanie :
1. Przygotować inoculum - kilka tych samych kolonii bakterii ze świeżej, 18-godz. hodowli
bakterii zawiesić w jałowym fizjologicznym roztworze NaCl (0,85%) celem uzyskania zawiesiny o
gęstości 0,5 w skali McFarlanda, co w przybliżeniu odpowiada liczbie od
1-2 10
8
c.f.u./ml.
Gęstość
zawiesiny oznaczyć nefelometrycznie przy użyciu kolorymetru
2. W ciągu 15 min. zanurzyć w inoculum jałową wymazówkę. Usunąć nadmiar zawiesiny,
obracając i przyciskając wymazówkę mocno do ściany probówki powyżej poziomu płynu.
Zawiesinę trzykrotnie rozprowadzić na całej powierzchni podłoża, przekręcając płytkę za każdym
razem o 60°C
3. Po wyschnięciu (do 15 min.) na posiane podłoże nałożyć krążki z antybiotykami (za pomocą
sterylnej pęsety lub z zastosowaniem szablonu, co ułatwia równomierne rozmieszczenie krążków).
Każdy krążek należy delikatnie przycisnąć, zapewniając równomierny kontakt z podłożem.
4. W ciągu 15 min. płytki wstawić do cieplarki, inkubować w warunkach tlenowych 16-18 godzin,
w temp. 35C.
5. Zmierzyć średnicę każdej strefy zahamowania wzrostu drobnoustroju (wliczając średnicę krążka)
i zanotować odczyt w mm. Pomiaru stref można dokonać za pomocą linijki lub suwmiarki.
6. Interpretacja wyniku - wg rekomendacji.
Czynniki wpływające na wielkość strefy zahamowania wzrostu w metodzie krążkowo-dyfuzyjnej :
Gęstość inoculum
w przypadku zbyt małej gęstości inoculum strefa zahamowania, niezależnie od wrażliwości
mikroorganizmu będzie mniejsza - oporne szczepy mogą zostać opisane jako wrażliwe. Przy zbyt
dużej gęstości inoculum, wielkość uzyskanej strefy będzie mniejsza - szczepy wrażliwe mogą
zostać opisane jako oporne.
Czas nałożenia krążków
na posianych płytkach pozostawionych w temperaturze pokojowej dłużej niż podano, przed
nałożeniem krążków dochodzi do namnażania szczepów – w efekcie strefy zahamowania wzrostu
mogą być mniejsze i szczepy mogą zostać opisane jako oporne.
Temperatura inkubacji
w celu otrzymania optymalnego wzrostu, podłoża z antybiogramem należy inkubować w 35°C.
Jeśli temperatura jest niższa, wydłuża się czas inkubacji, a uzyskane strefy są większe.
Czas inkubacji
większość metod uwzględnia 16-18 godzinny okres inkubacji. W wyjątkowych sytuacjach wstępny
wynik może być odczytany po 6 godzinach, nie mniej wynik należy potwierdzić po odpowiednim
czasie inkubacji.
Rozmiar płytek, grubość warstwy podłoża agarowego i rozmieszczenie krążków z antybiogramem
na płytkach o średnicy 9-10 cm umieszcza się nie więcej niż 5 krążków. Na bardzo cienkich
podłożach może wytwarzać się większa strefa zahamowania, odwrotnie przy zbyt grubym podłożu.
Właściwe rozmieszczenie krążków zapobiega nakładaniu się stref zahamowania lub powstawaniu
zniekształceń przy brzegach płytki.
Stężenie antybiotyków w krążkach
średnica strefy zahamowania zależy od zawartości antybiotyku w krążku. Krążki wymagają
odpowiedniego przechowywania, zgodnie z instrukcją.

Skład podłoża
jest ściśle ustalony; podłoże wpływa na wielkość strefy, decydując o stopniu wzrostu,
współczynniku dyfuzji i aktywności leku.
KONTROLA JAKOŚCI
Precyzja i dokładność metody powinny być monitorowane za pomocą programu kontroli jakości.
Okresowo (raz w miesiącu, przy nowej serii krążków) przeprowadza się kontrole wrażliwości dla
szczepów kontrolnych o znanej lekowrażliwości. Uzyskiwanie wyników, które nie mieszczą się w
określonym zakresie, jest przypuszczalnie efektem błędu technicznego lub użycia niewłaściwych
odczynników. Należy sprawdzić każdy odczynnik i etap testu, odnaleźć i wyeliminować błąd.
ad.b) metody rozcieńczeniowe
pozwalają na określenie minimalnego stężenia antybiotyku (MIC – minimum inhibitory
concetration) hamującego wzrost bakterii. Seryjne rozcieńczenia antybiotyku przygotowuje się w
podłożu płynnym lub podłożu agarowym, do których następnie dodaje się odpowiednie inoculum i
inkubuje. Metody pracochłonne, wykorzystywane głównie w badaniach naukowych.
W niektórych gotowych systemach (ręczne, automatyczne) stosowane są metody półilościowe.
Określa się w nich hamowanie wzrostu bakterii na 2 lub 3 stężenia krytyczne (ang. breakpoint –
wartość graniczna - określona wartość MIC lub wartość strefy zahamowania wzrostu wokół
antybiotykiem kwalifikująca szczep jako: S, I, R) dla stopni wrażliwości S, I, R.
Metodę dodawania leku do pożywki (można przygotować jedno lub dwa stężenia) wykorzystuje się
do określenia wrażliwości na antybiotyki i chemioterapeutyki drobnoustrojów wolno rosnących na
podłożach sztucznych np. prątki gruźlicy.
ad.c) E-test
łączy dyfuzję antybiotyku w agarze i ilościowe określenie stężenia hamującego – MIC.
Wykorzystuje się paski nasycone antybiotykiem w gradiencie stężeń.
----------------------------------------------------------------------------------------------
PRZYGOTOWAĆ PROJEKT :
1) czy to są antybiotyki czy chemoterapeutyki
2) jakie spectrum jest jego działania
3) czy dany lek może być zastosowany
---------------------------------------------------------------------------------------
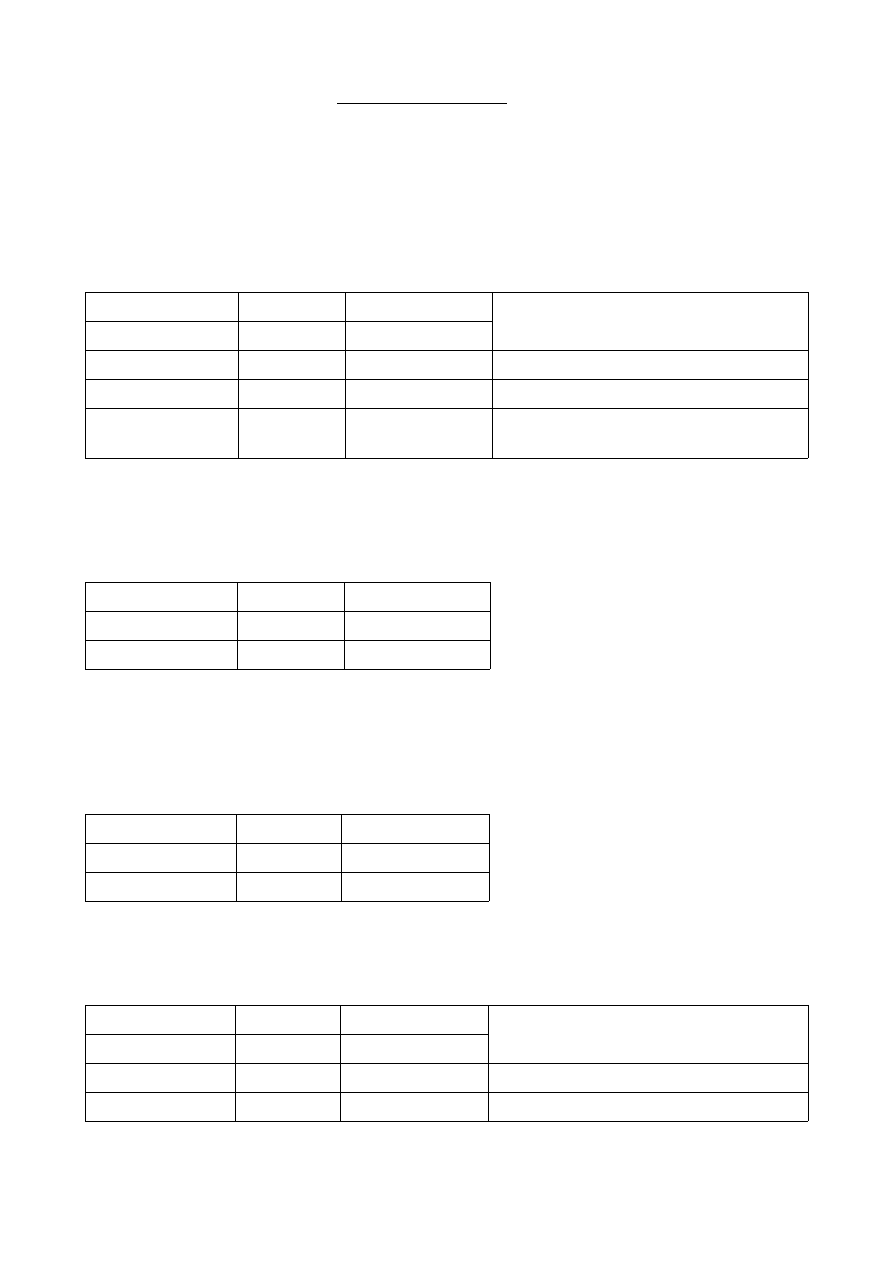
Wybrałam sobie Staphylococcus aureus
Antybiogram i strefa zahamowania antybiotyków lub chemioproteotyków
* P10 ---> Penicylina,
I gen.,
Strefa zahamowania wzrostu (mm) :
R
I
S
Bakterie
poniżej lub równe
równe lub powyżej
28
29
Staphylococcus spp.
14
15
enterokoki
19
20-27
28
Streptococcus spp. z wyjątkiem
Streptococcus pneumoniae
U mnie strefa zahamowania wynosi 28 mm, więc należy do Oporny "R"
* CN10 ---> Gentamycyna,
aminoglikozyd
R
I
S
poniżej lub równe
równe lub powyżej
12
13-14
15
U mnie strefa zahamowania równa 15 mm, więc należy do Wrażliwy "S"
* KZ30 ---> Cefazolina
cefalosporyny
I gen.
R
I
S
poniżej lub równe
równe lub powyżej
14
15-17
18
U mnie strefa zahamowania wynosi 18 mm, więc należy do Wrażliwy "S"
* AMC30 ---> Amoksycyklina/kwas klawulonowy
R
I
S
Bakterie
poniżej lub równe
równe lub powyżej
19
20
Staphylococcus spp.
13
14-17
18
inne bakterie
U mnie strefa zahamowania wynosi 19 mm, więc należy do Oporny "R"
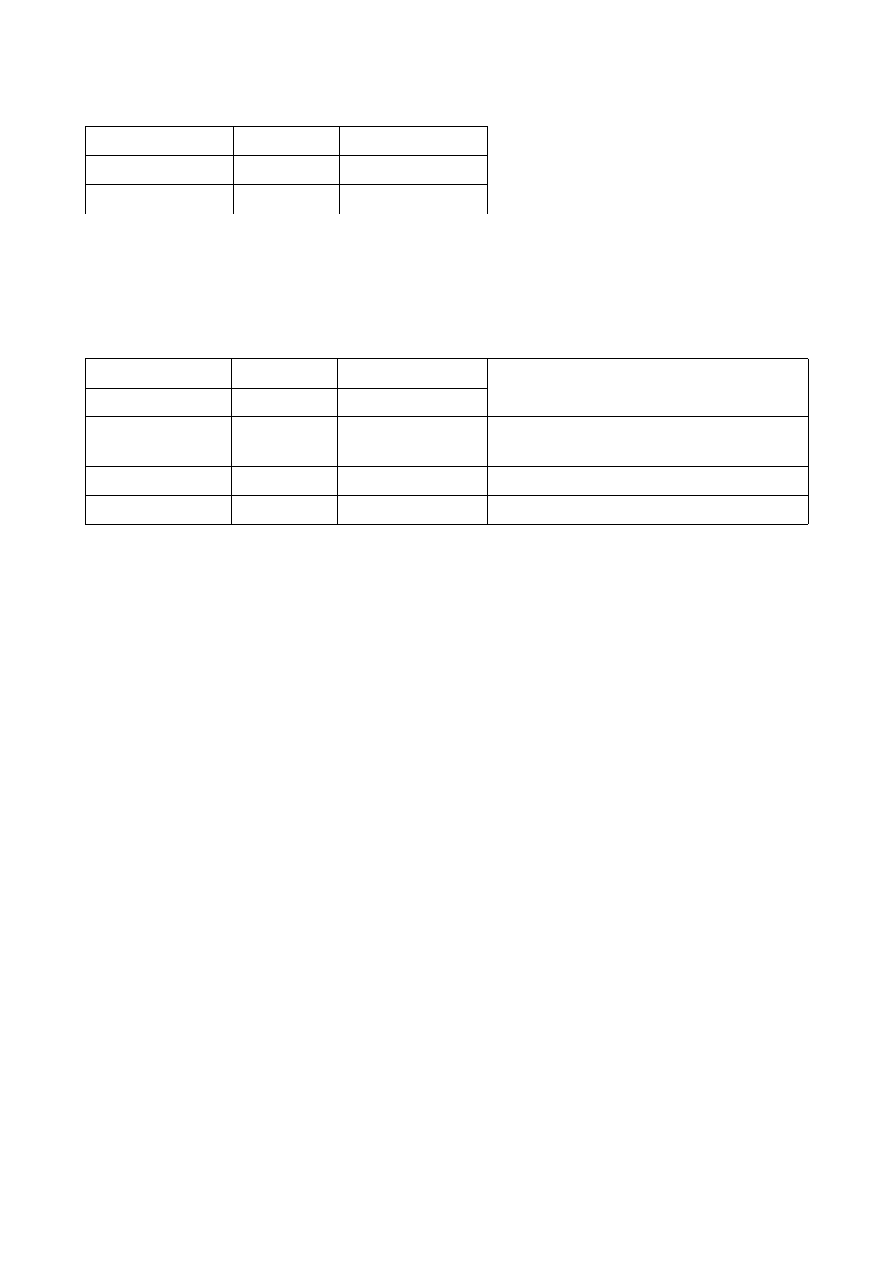
* TOB10 ---> Tobramycyna
R
I
S
poniżej lub równy
równy lub powyżej
12
13-14
15
U mnie strefa zahamowania równa się 19 mm, więc zaliczamy do Wrażliwy "S"
* FOX30 ---> Cefoksytyna
cefalosporyny
II gen.
R
I
S
Bakterie
poniżej lub równy
równy lub poniżej
21
22
Staphylococcus aureus i
Staphylococcus lugdunensis
24
25
koagulazo-ujemne
14
15-17
18
gronkowce, rodzina Enterobacteriaceae
U mnie strefa zahamowania wynosi 22 mm, więc zaliczamy do Wrażliwy "S"
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE WICZ 13 NEW, sgsp, Hydromechanika, HYDROMECHANIKA 1
Åwiczenie 13 doc
Stany nieustalone w obwodach RL, RC, RLC, ˙wiczenie II-13
13 ZMIANY WSTECZNE (2)id 14517 ppt
13 zakrzepowo zatorowa
Zatrucia 13
pz wyklad 13
13 ALUid 14602 ppt
pz wyklad 13
Rozrˇd Šwiczenia nowe
ZARZ SRODOWISKIEM wyklad 13
Biotechnologia zamkniete użycie (2012 13)
Prezentacja 13 Dojrzewanie 2
SEM odcinek szyjny kregoslupa gr 13 pdg 1
w 13 III rok VI sem
Wykład 13 UKS
więcej podobnych podstron