
Prof. nadzw. dr hab. Andrzej Misiołek
WYKŁAD PIERWSZY
1.
Formy dydaktyczne i zasady zaliczenia przedmiotu Chemia.
2.
Literatura:
Literatura podstawowa:
1.
Przemysław Masztalerz: Elementarna chemia nieorganiczna,
Wydawnictwo Chemiczne, Wrocław, 1997
2.
Przemysław Masztalerz: Elementarna chemia organiczna,
Wydawnictwo Chemiczne, Wrocław, 1998
3.
Loretta Jones, Peter Atkins: Chemia ogólna, Wydawnictwo Naukowe
PWN, Warszawa 2004
4.
Adam Bielański: Podstawy chemii nieorganicznej, Wydawnictwo
Naukowe PWN, Warszawa 2002
5.
Zenon Sarbak: Chemia nieorganiczna dla studiów licencjackich,
Wydawnictwo Oświatowe FOSZE, Rzeszów 2009
Literatura zalecana:
1.
P.A. Cox: Chemia nieorganiczna-krótkie wykłady, Wydawnictwo
Naukowe PWN, Warszawa 2006
2.
Graham Patrick: Chemia organiczna-krótkie wykłady, Wydawnictwo
Naukowe PWN, Warszawa 2002
3.
A.G. Whittaker, A.R. Mount, M.R. Heal: Chemia fizyczna-krótkie
wykłady, Wydawnictwo Naukowe PWN, Warszawa 2006
4.
D. Kealey, P.J. Haines: Chemia analityczna-krótkie wykłady,
Wydawnictwo Naukowe PWN, Warszawa 2009
5.
John McMurry: Chemia organiczna, Wydawnictwo PWN, Warszawa
2000
6.
Peter William Atkins: Chemia fizyczna, Wydawnictwo PWN,
Warszawa 2001
7.
W. Bekas, B. Just-Grochowska, A. Jóźwiak-Kot, B. Kot, Z. Kruszewski:
Zadania z chemii, Wydawnictwo SGGW, Warszawa 2000
8.
Wojciech Mniszek: Chemia ogólna Skrypt Nr 1, WSZOP, Katowice
2003

3.
Czym jest chemia? Jakie jest jej miejsce wśród nauk?
4.
Podstawowe pojęcia, wielkości, definicje i prawa chemiczne.
Materia, substancje, substancje proste, metale i niemetale,
substancje złożone, substancje czyste, mieszaniny, mieszaniny
jednorodne, mieszaniny niejednorodne, mieszaniny koloidowe,
roztwory, stężenia roztworów. Zjawiska fizyczne i przemiany
chemiczne, właściwości fizyczne substancji i właściwości
chemiczne substancji. Nazwy pierwiastków ich symbole, nazwy
i wzory związków chemicznych, sumaryczne i strukturalne.
Równania reakcji chemicznych. Atomy, cząsteczki, molekuły,
cząstki elementarne. Jednostka masy atomowej, masa atomowa i
masa cząsteczkowa. Jednostki policzalne i niepoliczalne, mol,
masa molowa, liczba Avogadra. Stany skupienia materii,
przemiany fazowe. Stan gazowy, objętość molowa gazów,
równanie Clapeyrona, gazy rzeczywiste i gazy doskonałe, prawa
gazowe.
Najważniejsze różnice między mieszaniną a związkiem chemicznym
Mieszanina
Związek chemiczny
Można otrzymać przez mechaniczne
zmieszanie składników.
Można otrzymać tylko w wyniku
reakcji chemicznej.
Skład można zmienić przez dodanie
składnika lub jego częściowe
usunięcie.
Nie można zmienić składu.
Czasem można rozróżnić składniki
wzrokowo.
Nigdy nie można rozróżnić składników
wzrokowo.
Można rozdzielić na składniki
metodami fizycznymi (przez
segregację, dekantację, destylację,
krystalizację, chromatografię,
sedymentację).
Można rozdzielić na składniki tylko w
wyniku reakcji chemicznej.
Składniki zachowują swoje
indywidualne właściwości.
Składniki nie zachowują swoich
indywidualnych właściwości.
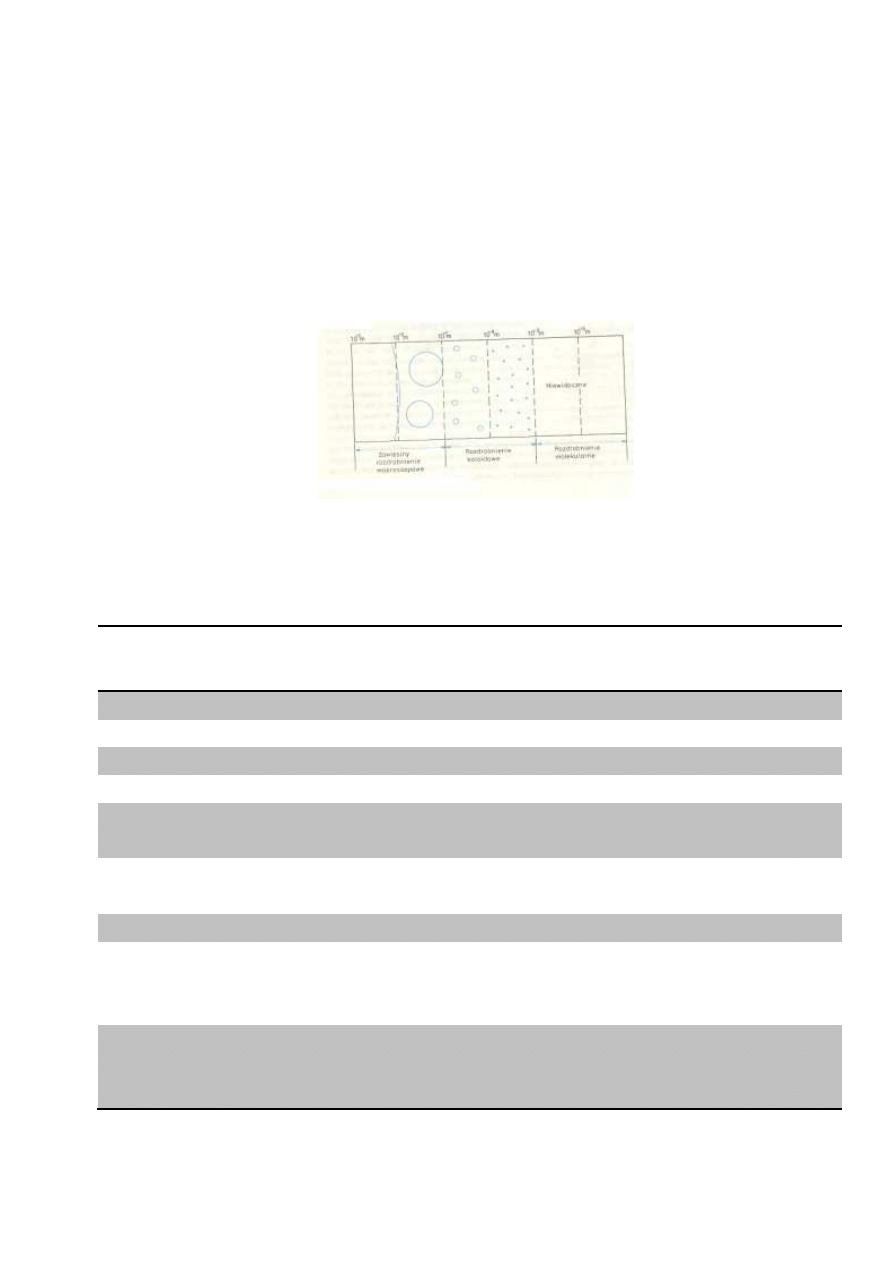
Koloidy (roztwory koloidalne) stanowią szczególny przypadek
roztworów. Są to układy rozproszone, w których rozmiary
cząstek fazy rozproszonej mieszczą się w orientacyjnych
granicach od 1 do 500 nm (1nm = 10
-9
m). Znane są koloidy
ciekłe, gazowe i stałe.
Model stopni rozdrobnienia materii
Klasyfikacja koloidów
Ośrodek
rozpraszający
Faza
rozproszona
Nazwa
Przykłady
gaz
gaz
-
-
gaz
ciecz
aerozole ciekłe mgła, lakier w sprayu
gaz
ciało stałe
aerozole stałe
dym
ciecz
gaz
piany
piany
ciecz
ciecz
emulsje
mleko, majonez,
kremy
ciecz
ciało stałe
zol lub żel
atrament, farba
malarska
ciało stałe
gaz
stałe pianki
pianka izolacyjna
ciało stałe
ciecz
stałe emulsje
bitumiczne
nawierzchnie dróg,
lody
ciało stałe
ciało stałe
stałe dyspersje
(zole stałe)
barwione szkła (np.
szkło rubinowe Au w
szkle), niektóre stopy

Proces przejścia koloidu w koagulat, zwany koagulacją, polega
na łączeniu się cząstek koloidalnych w wielkie agregaty
tworzące nieregularną sieć przenikającą cały układ.
Proces przejścia koagulatu w koloid jest nazywany peptyzacją.
koagulacja
→
Koloid
(np. zol)
koagulat
(np. żel)
←
peptyzacja
Efekt Tyndalla
Koloidy składają się z cząstek substancji rozproszonych innym
medium. Cząstki są zbyt małe, aby były widoczne pod
mikroskopem, lecz wystarczająco duże by rozpraszać światło.
Wybrane właściwości cząstek elementarnych
Cząstka
Symbol
Ładunek
Masa [u]
Masa [g]
Proton
p
+1
1,602 x 10
-19
C
1,0073
1,673 x 10
-24
Neutron
n
0
1,0087
1,675 x 10
-24
Elektron
e
-
-1
1,602 x 10
-19
C
0,00055
1/1840
9,109 x 10
-28
Atomowa jednostka masy: 1u = 1/6,02x10
23
= 1,66x10
-24
g ;
jest 602 miliardy bilionów (czyli 6,02x10
23
) razy mniejsza od grama
Masa atomu wodoru=1,008u= 0,000 000 000 000 000 000 000 001 66g

Mol definiuje się jako liczbę atomów zawartą w 12 gramach węgla
(izotopu-12 ;
12
C). Wynosi ona 6,02x10
23
atomów
12
C i nazywana jest
liczbą Avogadra.
Liczba Avogadra: 1 mol = 6,02x10
23
elementów
Odważając dokładnie 12 gramów węgla (izotopu-12 ;
12
C), otrzymujemy dokładnie 1
mol atomów węgla. Odpowiada to dokładnie liczbie Avogadra atomów.
Ułożenie atomów tego samego pierwiastka w trzech stanach skupienia
Termin faza oznacza fizyczną postać materii i odnosi się nie tylko do
trzech stanów skupienia, lecz również do różnych odmian tych stanów.
Przemianę jednej fazy w inną, np. topnienie lodu, parowanie wody czy
przekształcanie grafitu w diament, nazywa się przemianą fazową.
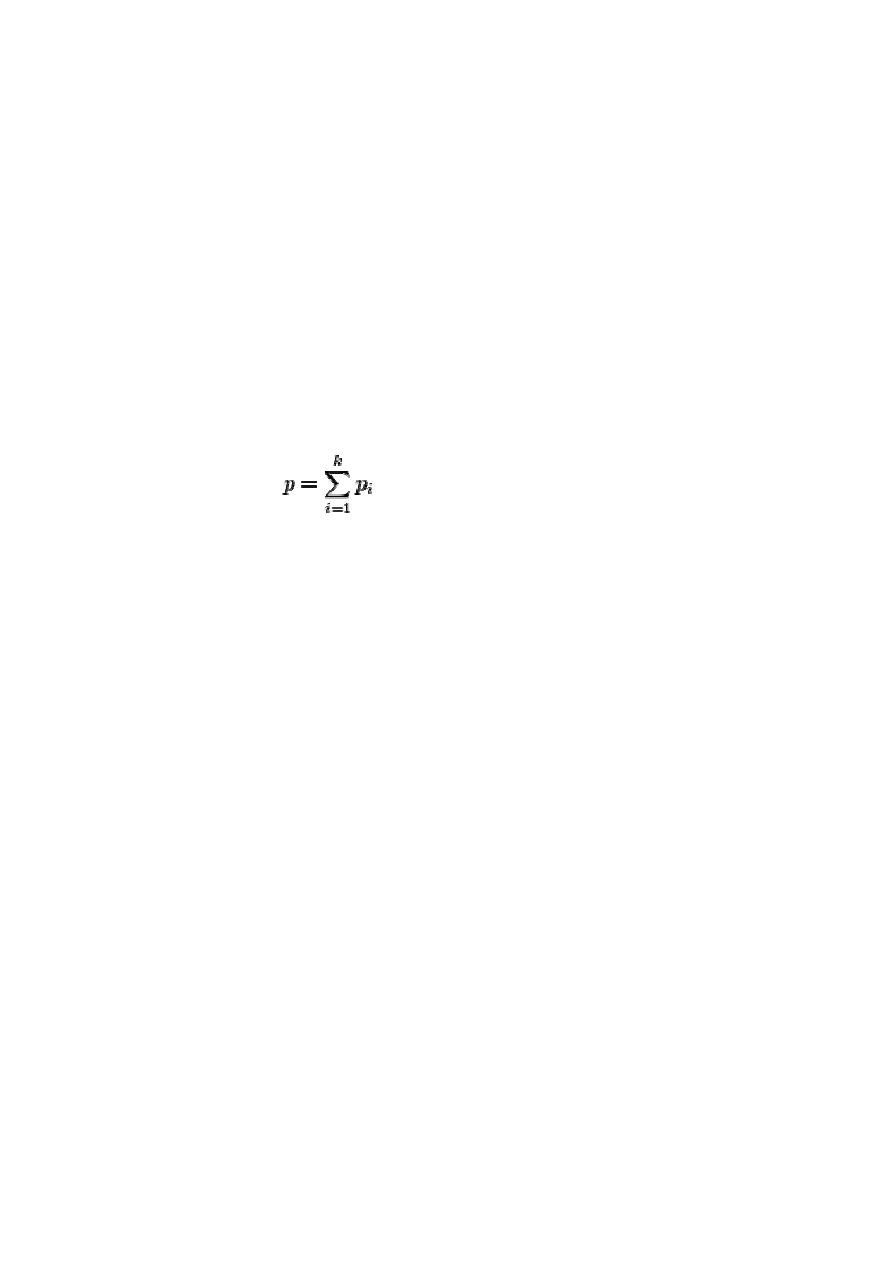
Prawo Avogadra: W równych objętościach różnych gazów, w tych
samych
warunkach
ciśnienia
i
temperatury
znajdują się jednakowe liczby cząsteczek.
Konsekwencją tego prawa jest stała objętość molowa gazów w
warunkach normalnych [T=273K (0ºC) ; p=1013hPa], która wynosi
22,4dm
3
.
Prawo Daltona: Ciśnienie całkowite mieszaniny gazów jest równe
sumie ciśnień cząstkowych składników mieszaniny.
p
c
= p
1
+ p
2
+ p
3
+ … lub
Równanie Clapeyrona: pV = nRT ; gdzie R = 8,31 J/mol•K = 83,1
hPa•dm
3
/mol•K
Prawo Boyle’a: Ciśnienie stałej ilości gazu w stałej temperaturze jest
odwrotnie proporcjonalne do objętości. (T=const)
P = const/V lub pV = const
Prawo Charlesa: Pod stałym ciśnieniem objętość stałej ilości gazu
zmienia się liniowo z temperaturą. (p=const)
V = const • T
Prawo Gay-Lussaca: W stałej objętości gazu ciśnienie zmienia się
liniowo z temperaturą. (V=const)
p = const • T
Wyszukiwarka
Podobne podstrony:
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia procesu widzenia
Chemia R cje chemiczne
Chemia materiałów V
Wykład 9 CHEMIA ORGANICZNA
CHEMIA NIEORGANICZNA 2
więcej podobnych podstron