
1
Enzymatyczna hydroliza skrobi
1.1
Podstawy katalizy
Reakcje chemiczne charakteryzują się różnymi szybkościami (stałymi szybkości) a co za tym
idzie różną dynamiką procesu. Wartość stałej szybkości reakcji chemicznej zależy między
innymi od stężenia substratów i temperatury. W wielu przypadkach procesów zarówno o
znaczeniu technicznym jak i laboratoryjnym, nie istnieje praktyczna możliwość zwiększania
dynamiki reakcji poprzez zwiększenie temperatury (ze względu na np. degradację substra-
tów/produktów). Procesy chemiczne mogą również charakteryzować się niewielką wartością
stałej równowagi (procesy odwracalne), wysoką energią aktywacji i wieloma innymi, nieko-
rzystnymi z punktu widzenia efektywności procesu, parametrami. W przypadkach takich, roz-
wiązaniem problemu zwiększenia wydajności i selektywności reakcji oraz skrócenia jej czasu
jest zastosowanie katalizatora.
Jak wiadomo z termodynamiki procesy chemiczne będą przebiegać samorzutnie tylko
wtedy, gdy zmiana energii swobodnej reakcji ∆G (∆G = G
2
0
- G
1
0
; G
2
0
- energia swobodna
produktów, G
1
0
- energia swobodna substratów) będzie mniejsza od zera. Za zmiany energii
swobodnej zgodnie z Równaniem 1
∆G = ∆H − T ∆S
(1)
odpowiada bądź to zmiana entalpii procesu (∆H) bądź też zmiana uporządkowania układu
(zmiana entropii, ∆S).
Dodatkowo jednym z najistotniejszych czynników limitujących przebieg reakcji jest wyso-
kość bariery aktywacji (energii aktywacji) zgodnie z równaniem Arrheniusa (Równanie 2).
k = A · e
−
Ea
RT
(2)
gdzie:
• k - stała szybkości reakcji,
• A - tzw. współczynnik przedekspotencjalny,
• R - stała gazowa,
• E
a
- energia aktywacji,
1

• T - temperatura.
Zastosowanie właściwego katalizatora umożliwia zwiększenie szybkości reakcji chemicznej i/lub
skierowanie jej na jedną z kilku możliwych termodynamicznie dróg prowadzących do różnych
produktów. Substancje będąca katalizatorem, tworząc nietrwałe połączenia przejściowe (kom-
pleksy przejściowe), nie są źużywane”w reakcji i nie występują w jej równaniu stechiometrycz-
nym. Katalizator nie zmienia przy tym położenia równowagi chemicznej, wpływa jedynie na
szybkość dochodzenia układu do tego stanu poprzez zmniejszenie energii aktywacji. Mecha-
nizm działania katalizatora polega na zastąpieniu reakcji z równania 3
S
1
+ S
2
= P
(3)
Procesem:
S
1
+ K = S
1
K
(4)
S
1
K + S
2
= P + K
(5)
Gdzie:
• S
1
,S
2
- substraty
• P - produkt
• K - katalizator
• S
1
K - kompleks przejściowy
Jeżeli dla reakcji (3) energia aktywacji wynosi E
N
to dla procesu katalizowanego wynosi ona
odpowiednio E
k
1
(dla reakcji 4) i E
k
2
(dla reakcji 5). Zmiany energii aktywacji procesu katali-
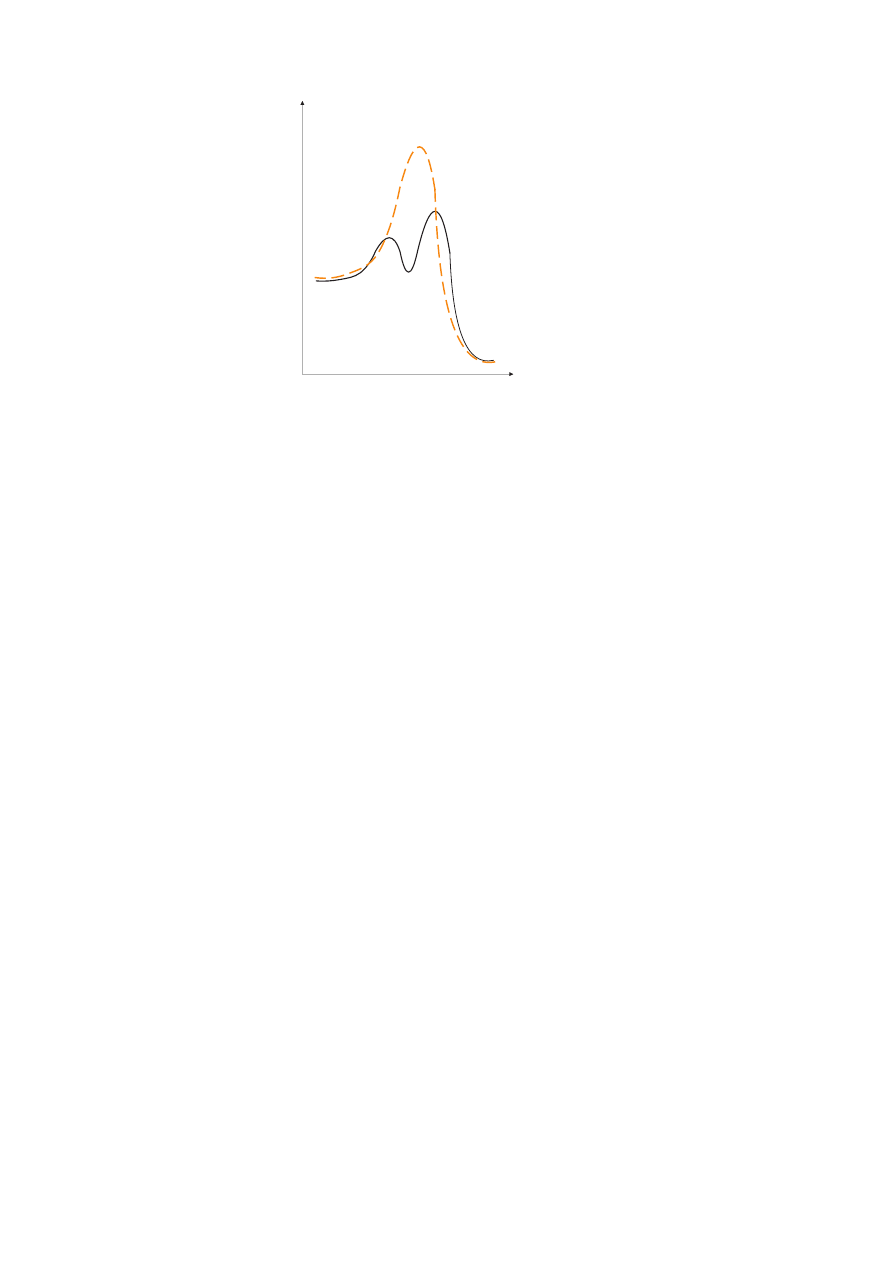
tycznego obrazuje Rysunek 1.
1.2
Enzymy
Specyficznymi katalizatorami reakcji chemicznych są enzymy, grupa białek działających w
komórkach i płynach ustrojowych żywych organizmów i biorących udział w procesach syntezy
lub rozkładu istotnych z biochemicznego punktu widzenia substancji organicznych.
Enzymy rzadko zbudowane są z samego białka (np. trypsyna). W znakomitej większości
składają się one z części białkowej (tzw. apoenzym) oraz niebiałkowej, grup prostetycznych i
2
S
1
+ S
2
+ K
P + K
S 1 - - S 2
S
1
K
S
1
- - K
S
1
K - - S
2
E n e r g i a
P o s t ê p r e a k c j i
E
k 1
E
N
E
k 2
Rysunek 1: Przemiany energetyczne podczas zachodzące podczas procesów chemicznych (S
1
–S
2
-
kompleks aktywny reakcji niekatalizowanej; S
1
–K, S
1
–K–S
2
- kompleksy aktywne poszczególnych
etapów reakcji katalizowanej.
koenzymów (małocząsteczkowe związki nieorganiczne, atomy metali). Niebiałkowe części en-
zymu pełnią, w reakcjach enzymatycznych, funkcję przenośników elektronów, określonych ato-
mów lub ich ugrupowań w trakcie katalizowanych procesów. Biorą one udział w cyklu reakcji
enzymatycznych: w pierwszej jego fazie umożliwiają dysocjację określonych wiązań substratu
oraz ich związanie z enzymem. W fazie drugiej następuje natomiast związanie atomów pocho-
dzących od substratu w produkt, oraz odtworzenie części niebiałkowej w pierwotnej postaci, po
czym proces się powtarza. Połączenie koenzymów z przenoszoną grupą funkcyjnąą odznacza
się dużą reaktywnością. Dzięki cykliczności procesu przenoszenia, koenzymy mogą występo-
wać w żywej komórce w ilościach równoważnych ilościom enzymów, choć reagują z substratami
stechiometrycznie. Trwałość połączenia apoenzymu w koenzymami jest różna; jeśli koenzym
łatwo dysocjuje, reakcje przenoszenia grup chemicznych na koenzymy i z koenzymów katalizuje
układ złożony z 2 enzymów o wspólnym koenzymie; jeśli koenzym jest związany z enzymem
trwale, enzym ten katalizuje kolejno obie reakcje.
Część białkowa odpowiada natomiast za konfigurację przestrzenną enzymu oraz za zmiany
hydrofobowości centrum aktywnego. Budowa taka powoduje że enzymy zawierające tą samą
grupę prostetyczną ale różne części białkowe bedą katalizować różne reakcje jednostkowe.
Zgodnie z równaniami 4 i 5 podstawą reakcji enzymatycznej jest wytworzenie odwracalnego
3

kompleksu pomiędzy enzymem i substratem reakcji. Kompleks ten ulega następnie nieodwra-
calnej przemianie z odtworzeniem enzymu oraz wytworzeniem finalnego produktu. Tak jak w
przypadku większości katalizatorów stężenie enzymów w trakcie procesu jest znacząco mniej-
sze niz stężenie substratów. Wynika stąd iż można przyjąć, że stężenie kompleksu S
1
K jest
stałe w czasie i zależy tylko od stężenia enzymu.
Szybkość reakcji enzymatycznej zależna jest także od wielu innych czynników (pH, tempe-
ratura, stężenie koenzymów itp.), w tym przede wszystkim od stężenia substratu. Zależność
szybkości procesu od tego stężenia opisuje równanie Michaelisa-Menten’a:
v =
v
max
· [S]
K
m
+ [S]
(6)
Gdzie:
• v - chwilowa szybkość reakcji
• v
max
- maksymalna szybkość reakcji
• [S] - stężenie substratu
• K
m
- stała Michaelisa-Menten’a
Stała Michaelisa-Menten’a jest to takie stężenie substratu (wyrażone w mol/dm
3
), przy którym
szybkość reakcji osiąga połowę szybkości maksymalnej.
Innym wskażnikiem aktywności enzymu są tzw. jednostki aktywności na przykład tzw. jed-
nostka międzynarodowa (ilość enzymu, która zdolna jest wytworzyć 1 mmol produktu w temp.
30
◦
C i w optymalnych dla enzymu pozostałych warunkach reakcyjnych), katal (aktywność en-
zymu zdolnego do przekształcenia 1mol substratu w czasie 1s w temp. 30
◦
C i w optymalnych
dla enzymu pozostałych warunkach reakcyjnych lub tzw. ilość obrotów (liczba moli substratu
która może przereagować w ciągu 1min z 1 molem centrum aktywnego enzymu w temp. 30
◦
C
i w optymalnych dla enzymu pozostałych warunkach reakcyjnych).
Liczba znanych dotychczas enzymów znacznie przekracza 3000, stąd też wprowadzona jest
ich klasyfikacja (wprowadzona przez Komisję Enzymową IUB). Wszystkie enzymy podzielone
zostały na sześć klas głównych (1. Oksyreduktazy, 2. Transferazy, 3. Hydrolazy, 4. Liazy, 5.
Izomerazy, 6. Ligazy.) W czteroliczbowej klasyfikacji enzymów kolejne liczby oznaczają klasy,
podklasy, podpodklasy oraz numer enzymu w podpodklasie.
4
1.3
Enzymy hydrolizujące skrobię
Oprócz celulozy skrobia jest głównym polisacharydem pochodzenia roślinnego. Z przemysło-
wego punktu widzenia istotne znaczenie mają przede wszystkim produkty jej hydrolizy umoż-
liwiające produkcję syropów glukozowych, dekstryn, cyklodekstryn, glukozy (krystalicznej i
zestalonej) i innych produktów wykorzystywanych głównie w przemyśle spożywczym. Stoso-
wana do niedawna kwasowa hydroliza skrobi wraz z postępem w dziedzinie biotechnologii coraz
częściej ustępuje miejsca procesom enzymatycznym. Enzymy stosowane do hydrolizy skrobi
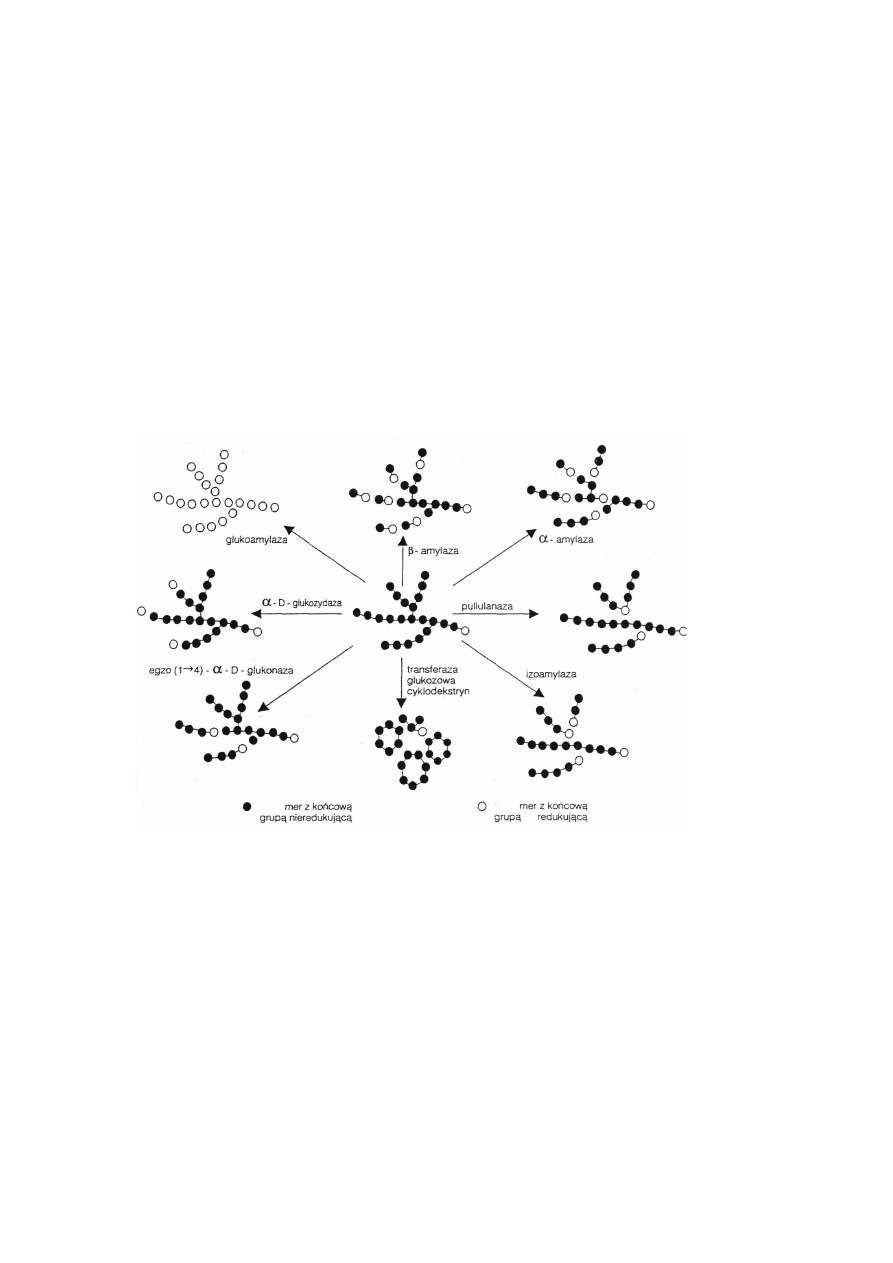
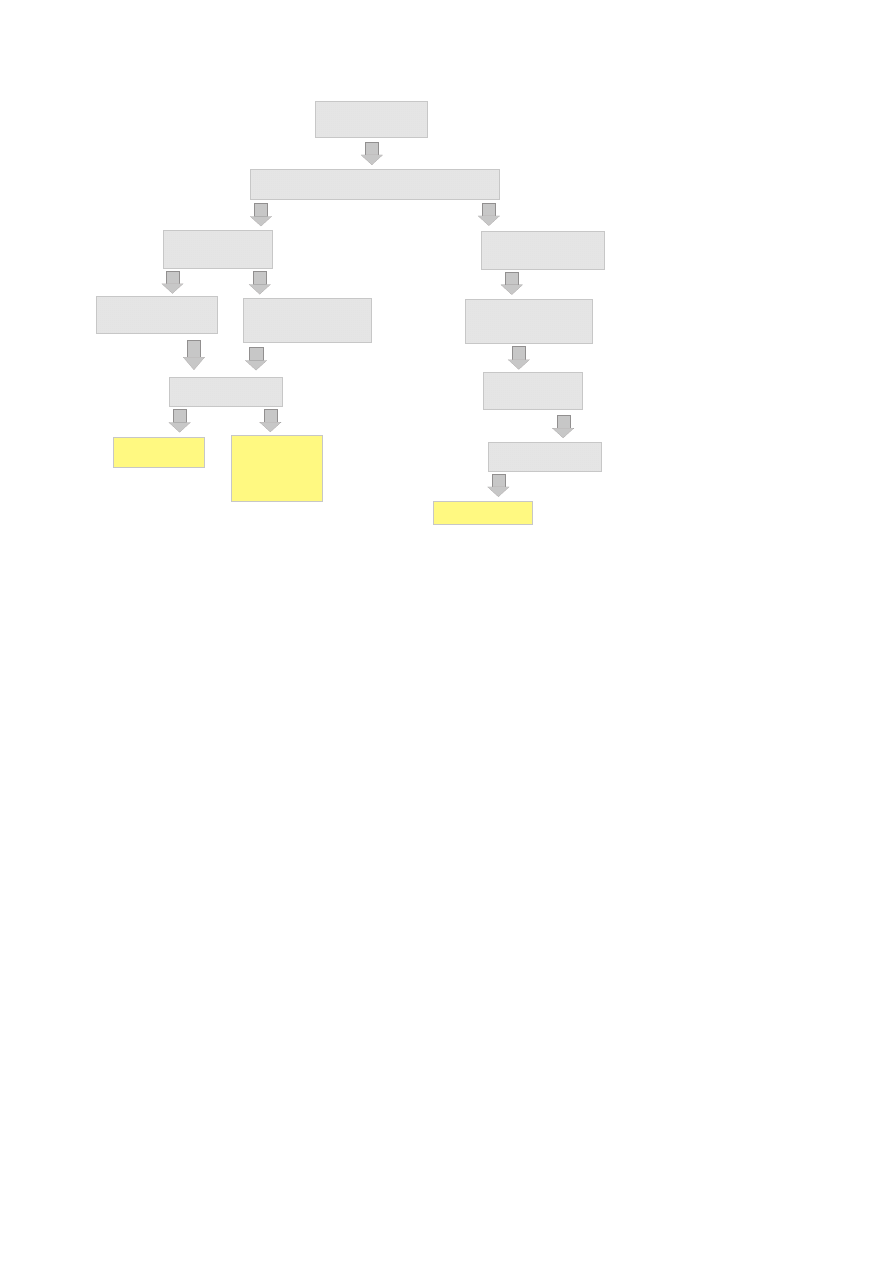
podzielić można na 5 grup: endoamylazy, egzoamylazy, enzymy usuwające rozgałęzienia, izo-
merazy oraz glikozylotransferazy cyklodekstryn (Rysunek 1.3).
Rysunek 2: Najczęściej stosowane enzymy hydrolizujące skrobię
1.3.1
Endoamylazy
α-amylaza, 4-glukanohydrolaza-α-1,4-glukanu - EC 3.2.1.1
Enzymy z tej grupy umożliwiają hydrolizę wiązań α-1,4-glikozydowych zarówno w amylozie
jak amylopektynie a nie są aktywne w stosunku do wiązań α-1,6- (np. w amylopektynie). Pro-
duktami hydrolizy w tym przypadku są oligosacharydy posiadające konfiguracje α przy węglu
5

C1. Enzymy te działają w środku łańcucha polimerowego co powoduje gwałtowny spadek lep-
kości hydrolizowanego kleiku skrobiowego. Znane są dwa rodzaje α-amylazy: termostabilna i
termolabilna. α-amylaza termostabilna jest enzymem pochodzenia bakteryjnego. Enzym ten
w przypadku pochodzenia ze szczepu Bacillus subtilis wykazuje optimum temperaturowe po-
między 65 a 70
◦
C w obecności jonów wapnia, i ze względu na swoją niską stabilność nie jest
stosowana w zastosowaniach komercyjnych. α-amylaza pochodząca ze szczepu Bacillus liche-
niformis (Rysunek 1.3.1) jest natomiast aktywna i stabilna w temperaturach powyżej 90
◦
C, a
dodatkowo jej aktywność w znacznie mniejszym stopniu zależny od obecności jonów Ca
2+
oraz
stosowanego
pH.
Rysunek 3: α-amylaza ze
szczepu Bacillus licheniformis
Działanie opisywanego enzymu sprowadza się głównie do gene-
rowania z łańcucha polisacharydowego jednostek zawierających
5 jednostek glukozowych. Powoduje to, że szybkość hydrolizy
jest bardzo wysoka na początku procesu a potem wraz z postę-
pem reakcji spada. Na dalszych etapach procesu generowane są
jednostki o mniejszej liczbie merów. Termolabilne α-amylazy są
enzymami pochodznie grzybowego. Produktami hydrolizy skrobi
w tym przypadku są: maltoza i maltotrioza. Enzymy pochodze-
nia grzybowego wykazują większą w porównaniu do swoich bak-
teryjnych odpowiednikow odporność na zmiany pH środowiska
reakcji. Znane są też αamylazy immobilzowane (osadzane) na
nośnikach. Taki proces heterogenizacji enzymu umożliwia przynajmniej częściowe odzyski-
wanie katalizatora oraz możliwość ponownego jego użycia co istotne jest z punktu widzeni
ekonomiki procesu. Enzymy immobilizowane na nośnikach wykazują jednak z niższa aktyw-
ność, a to ze względu na utrudnione warunki dyfuzji pomiędzy katalizatorem w fazie stałej a
rozpuszczonymi/skleikowanymi łańcuchami polisacharydowymi.
1.3.2
Egzoamylazy
Enzymy z grupy egzoamylaz dziela się na układy działające z wytworzeniem glukozy lub
maltozy.
6

γ-amylaza, 4-glukanoglukohydrolaza-α-1,4-glukanu, glukoamylaza; EC 3.2.1.3
Glukoamylaza zwana także γ-amylazą umożliwia wysoce efektywną reakcję hydrolizy wiązań
α-1,4-glikozydowych
z
wytworzenim
glukozy
jako
produktu
końcowego.
Rysunek 4: γ-amylaza ze
szczepu Aspergillus niger
Atak enzymu rozpoczyna się na nieredukującym końcu łańcu-
cha polimerowego a powstająca glukoza posiada konfigurację
β. Enzym ten działa na skrobię odcinając po jedenej jednostce
glukozowej, aż do miejsca rozgałęzienia. Hydroliza wiązań 1,6-
glikozydowych z udziałem glukoamylazy również jest możliwa
choć proces ten przebiega z bardzo niską szybkością. W przy-
padku wysokich stężeń glukozy lub enzymu możliwa jest także
podobnie jak w przypadku hydrolizy kwasowej reakcja repolime-
ryzacji (rewersji) glukozy z wytworzeniem maltozy i izomaltozy.
Glukoamylaza charakteryzuje się dużą odpornością na zmiany
pH (stabilność w zakresie 1,8-8,8 dla enzymu z Aspergillus niger oraz 1,8-10,5 dla układu
pochodzącego z Aspergillus awamori). Enzym ten najwyższą aktywność przejawia przy pH z
zakresu 4,0-5,6 w temperaturze 40-65
◦
C. Odwrotnie niż w przypadku α-amylazy jony Ca
2+
wykazują inhibicyjne działanie na proces enzymatycznej hydrolizy z udziałem glukoamylazy.
Rysunek 5: β-amylaza z Hor-
deum vulgare
β-amylaza, maltohydrolaza-α-1,4-glukanu; EC 3.2.1.2
β-amylaza jest enzymem działającym na skrobię z wytwo-
rzeniem maltozy jako produktu finalnego. Głównym źródłem
tego enzymu są zboża takie jak: pszenica i jęczmień oraz
soja. Znane są jednak także bakteryjne źródła β-amylazy. β-
amylaza umożliwia degradację łańcuchów amylozy i amylo-
pektyny poprzez hydrolizę wiązań α-1-4- glikozydowych po-
między drugą a trzecią jednostką glukozową licząc od niere-
dukującego końca łańcucha. Wytworzona w ten sposób mal-
toza jest beta-anomerem. Ponieważ enzym ten nie umożli-
wia hydrolizy wiązań 1,6-glikozydowych produktami hydro-
lizy skrobi z jego udziałem są maltoza (w przypadku amylozy) oraz mieszanina oligosachary-
dów o różnym stopniu rozgałęzienia, tzw. dekstryny graniczne (dla amylopektyny). Optimum
7

kwasowości środowiska reakcji dla tego enzymu wynosi około 5 a optymalna temperatura
działania 55 - 60
◦
C. Jeśli chodzi o budowę enzymu to w odróżnieniu od innych enzymów hy-
drolitycznych skrobi beta-amylaza nie zawiera w centrum aktywnym jonów metali a jedynie
grupy merkaptanowe (-SH). Wszystkie beta-amylazy tracą swoją aktywność w obecności takich
związków jak HgCl
2
, AgNO
3
oraz jodu. Oba opisywane rodzaje egzoenzymów mogą być im-
mobilizowane na nośnikach aczkolwiek tak jak w przypadku α-amylazy obniża to efektywność
działania enzymów ze względów kinetycznych.
1.4
Enzymy usuwające rozgałęzienia
α, β i γ - amylazy to enzymy które bądź to są nieaktywne w stosunku do wiązań 1,6-
glikozydowych bądź też reakcja hydrolizy tych wiązań zachodzi przy ich udziale z niezoda-
walająca szybkością. Enzymy usuwające rozgałęzienia działają natomiast selektywnie właśnie
na wiązania α-1,6 glikozydowe w łańcuchach polisacharydowych, umożliwiając pełniejszą hy-
drolizę skrobi. Najważniejszymi przedstawicielami tej grupy są pullulanaza oraz izoamylaza.
1.4.1
Izoamylaza; glikogen 6-glukanohydrolaza; EC 3.2.1.68
Rysunek 6: Izomylaza ze szczepu
Pseudomonas amyloderamosa
Izoamylaza podobnie jak opisywana wyżej pullulanaza
jest enzymem umożliwiającycm hydrolizę rozgalęzień
łańcuchów polisacharydowych oraz dtam ekstryn gra-
nicznych wszędzie tam, gdzie występują wiązania 1,6-
glikozydowe. W odróżnieniu od pullulanazy izoamylaza
nie hydrolizuje jednak wiązań 1,6- w pullulanie lecz w
glikogenie. Enzym ten nie jest aktywny w stosunku do
polisacharydów liniowych, nierozgałęzionych. Najczęściej
enzym ten pozyskuje sie z takich szczepół nakterii jak:
Bacillius amyloliquefaciens, Escherichia coli, Flavobac-
terium odoratum, Pectobacterium chrysanthemi, Pseudo-
monas amylodermosa
8

1.4.2
Pullulanaza, pullulan-6-glukanohydrolaza; EC 3.2.1.41
Enzym ten umożliwia usunięcie rozgałęzień zarówno amylopektyny jak i amylozy. Efektem
finalnym jego działania są oligo- i poli- sacharydy o stopniu polimeryzacji z zakresu 115 -
2300. Enzym ten jest z reguły stosowany w kombinacji z α, β lub γ - amylazami. Optimum
temperaturowe dla pullulanazy wynosi ok 60
◦
C. Chociaż enzym ten zidentyfikowano w takich
roślinach jak: bawełna, ryż i szpinak to jednak w celach przemysłowych izoluje się go głów-
nie ze szczepów bakterii (np. Bacillus stearothermophilus). Pullulanaza umożliwia hydrolizę
wiązań 1,6- glikozydowych jedynie gdy wiązanie to scala łańcuchy polisacharydowe połączone
wiązaniem 1,4-glikozydowym (np. w pullulanie stąd nazwa). W zależności od zdolności pollu-
lanazy do hydrolizy oprócz wiązań 1,6-, także układów 1,4- rozróżnia się dwa typy pollulanaz:
I (nieaktywne w hydrolizie wiązań 1,4-) i II (aktywne w hydrolizie wiązań 1,4-). Działanie obu
wymienionych anymów na skrobię (amylopektynę) jest natomiast zbliżone. Opisane enzymy
nie wyczerpuja wszystkich możliwości enzymatycznej hydrolizy skrobi. Jednak to α, β i γ
amylaza wraz z pullulanazą i izoamylazą mają największe znaczenie przymysłowe.
1.5
Pomiar degradacji skrobi
Stopień hydrolizy a więc rozłożenia skrobi mierzy sie z reguły przy pomocy metod fizycznych
lub chemicznych.
Metody fizyczne obejmują przede wszystkim pomiary zwiazane z okresleniem średnich mas
cząsteczkowych polimeru oraz rozrzutu mas cząsteczkowych (najczęściej w formie tzw. RCC
czyli różniczkowego rozrzutu mas cząsteczkowych. Do metod takich należą:
1. pomiary wiskozymetryczne: lepkość graniczna roztworów polimerów związana jest ze
średnią masą cząsteczkową równaniem Marka-Houwinka
η = K · M
α
(7)
gdzie K i α są stałymi empirycznymi dla danego polimeru.
2. turbidymetryczne: wykorzystanie zjawiska rozproszenia światła widzialnego przez cząstki
bardzo rozcieńczonej zawiesiny lub roztworu koloidalnego (układu dyspersyjnego). Do-
9

konując pomiarów w wiązce promieniowania przechodzącego przez układ dyspersyjny,
otrzymuje się wielkość charakteryzującą rozproszenie (tzw. turbidancję), która jest pro-
porcjonalna do stężenia cząstek zawiesiny. Pomiary mogą być wykonane za pomocą
zwykłych spektrofotometrów.
3. nefelometryczne: na podstawie pomiaru natężenia światła rozproszonego przez zawiesinę,
pod określonym (różnym od 180◦) kątem względem wiązki padającej, oznacza się stężenie
tej zawiesiny lub rozmiary tworzących ją cząstek.
4. osmometryczne: wykorzystując osmometrię parową
5. kriometryczne: obniżenie temperatury krzepnięcia rozpuszczalnika w roztworze polimeru.
6. jodometryczne: helisy skrobi o długości powyżej 20 DP, tworzą z jonami polijodkowymi
kompleksy inkluzyjne o zabarwieniu niebieskim. Intensywność barwy tych kompleksów
wzrasta z długością łańcuchów amylozy i zależy od temperatury i pH. Wadą metody jest
brak jednoznacznego związku mierzonej absorbancji ze stężeniem produktów o określo-
nym DP.
7. spektroskopowe: widmo skrobi w podczerwieni ulega zmianom podczas hydrolizy za po-
mocą glukoamylazy. Najwyraźniejsze różnice obserwuje się przy liczbie falowej 1078
cm
−1
, gdzie następuje znaczący wzrost absorpcji, jak również przy 1020 cm
−1
, gdzie
obserwowane jest zmniejszenie jej intensywności. Pierwsza zmiana związana jest z po-
wstawaniem β-D-glukozy, druga natomiast z rozerwaniem wiązania α-1,4, które blokuje
drgania sąsiednich wiązań C-O oraz C-C .
Do metod chemicznych należy przede wszystkim oznaczanie wytworzonych cukrów redu-
kujących.
Bezpośrednią metodą oznaczania aktywności enzymów amylolitycznych jest pomiar szyb-
kości tworzenia produktów hydrolizy. Ponieważ podczas amylolizy tworzą się grupy redukujące,
w oparciu o ich oznaczenie można wnioskować o ilości powstałych cukrów. Wykorzystuje sie
oznaczenia:
1. z heksacyjanożelazianem(III) potasu (redukuje się do heksacyjanożelazianu(II) potasu)
10

2. Somogyi-Nelsona (jony miedzi(II) redukują się do miedzi(I), dając barwną reakcję z
arsenomolibdenianem)
3. z DNS (kwas 3,5-dinitrosalicylowy jest redukowany do kwasu 3-amino-5-nitrosalicylowego)
4. z CuSO
4
i bichinoliną (jony miedzi(II) redukują się do miedzi(I), dając barwną reakcję
z 4,4’-dikarboksy-2,2’-bichinoliną
Oznaczanie produktów hydrolizy skrobi możliwe jest także przy użyciu nowoczesnych me-
tod instrumentalnych, głównie chromatograficznych. W szczególności należy wymienić tutaj:
1. TLC - chromatografię cienkowarstwową
2. HPLC - wysokosprawną chromatografię cieczową wraz z jej odmiana chromatografią
żelową (GPC)
3. HPAE-PAD - wysokosprawną chromatografię jonowymienną z impulsową detekcją am-
perometryczną
1.6
Przemysłowe zastosowanie hydrolizy enzymatycznej skrobi.
Metoda enzymatycznej hydrolizy skrobi umożliwia otrzymywanie szerokiej gamy modyfikatów
skrobiowych z dużą wydajnością i efektywnością. Spośród produktów o największym tonażu
wyróżnia się produkcję: syropów skrobiowych, maltodekstryn, syropu glukozowego i glukozy
krystalicznej oraz syropów maltozowych a po dalszej przeróbce także takich nowoczesnych
produktów jak syropy o wysokiej zawartości fruktozy (High-Fructose Corn Syrup; HFCS)
1.6.1
Produkcja maltodekstryn.
Produkcja maltodekstryn przebiega zgodnie ze Rysunkiem 1.6.1. Przygotowana suspensja
skrobi w wodzie jest zakwaszana do pH odpowiedniego dla zastosowanego enzymu a następnie
uzupełniana o jony wapnia oraz pierwszą porcję enzymu. Tak otrzymana zawiesina poddawana
jest działaniu wysokiej temperatury, co z jednej strony ułatwia szybkie skleikowanie skrobi z
drugiej jednak powoduje inaktywację części dodanego enzymu. Po skleikowaniu mieszanina re-
akcyjna jest ochładzana do właściwej temperatury pracy enzymu oraz uzupełniana o kolejną
11
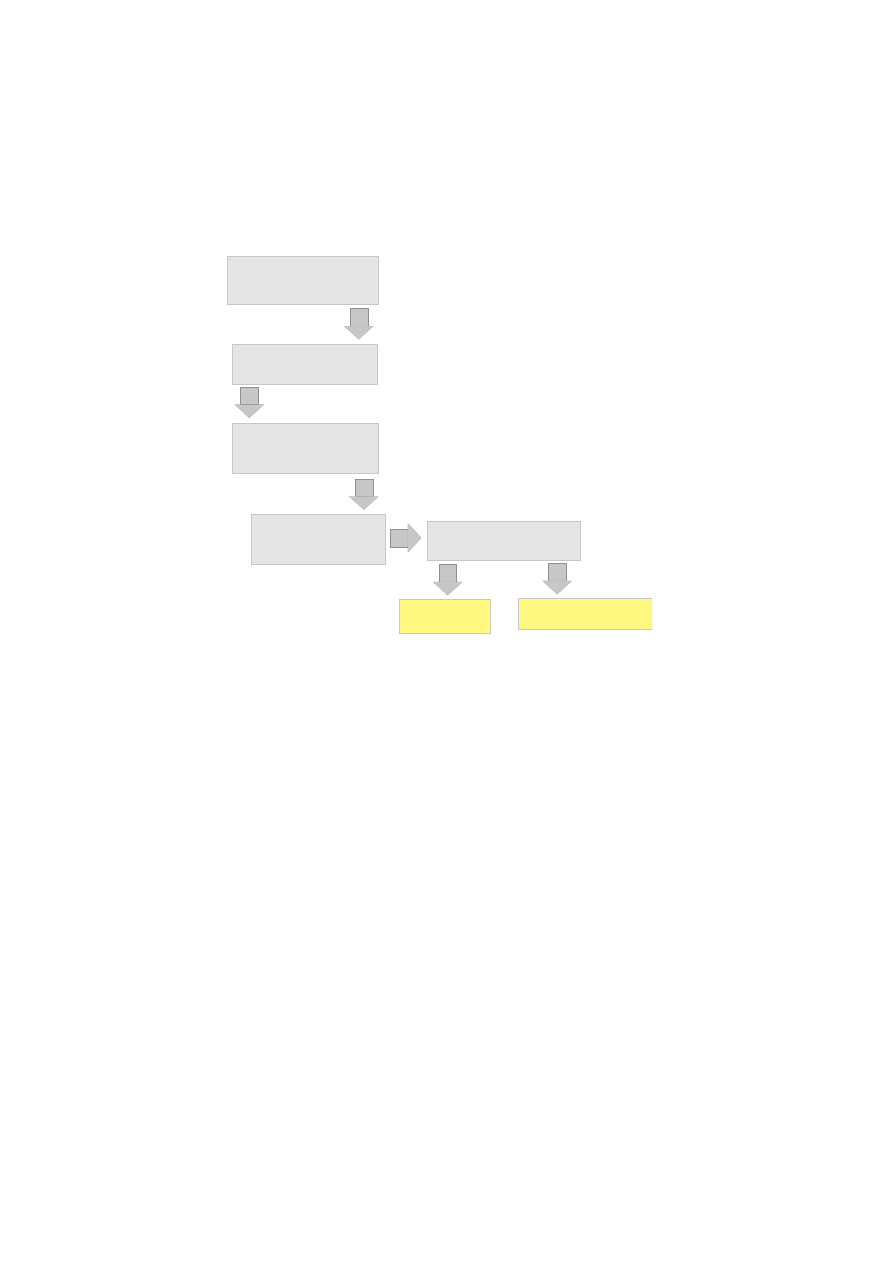
jego porcję. Po zakończeniu procesu, czyli osiagnięciu wartości DE 20-40 w zależności od za-
kładanego stopnia hydrolizy enzym jest inaktywowany poprzez zakwaszenie środowiska oraz
podwyższenie temperatury a otrzymany syrop poddawany filtracji i oczyszczaniu na węglu
aktywnym.
w o d n a z a w i e s i n a s k r o b i
( 3 0 - 4 0 % w / v ; p H 6 . 5
C a 2 + ; a - a m y l a z a )
k l e i k o w a n i e
1 1 0 - 1 4 0 d e g ; 5 - 1 0 m i n
h y d r o l i z a
( a - a m y l a z a ; 9 0 - 9 5 d e g
9 0 - 1 2 0 m i n )
f i l t r a c j a i o c z y s z c z a n i e
( w ê g i e l a k t y w n y )
i n a k t y w a c j a e n z y m u
( p H 3 - 5 ; 1 0 0 d e g ;
5 m i n )
S Y R O P
S K R O B I O W Y
M A L T O D E K S T R Y N Y
Rysunek 7: Enzymatyczna produkcja maltodekstryn
Otrzymane w ten sposób maltodekstryny posiadają następujący średni skład: 0,3-1,6% glu-
kozy, 0,9-5,8% maltozy, 4-11% maltotriozy i 1,4-6,1% maltotetraozy. Resztę stanowią poli- i
oligo-sacharydy o DP ¿ 4. Maltodekstryny charakteryzują się między innymi takimi właści-
wościami jak: niska higroskopijność, wysoka lepkość, a także bardzo niska słodkość (w sensie
sensorycznym) oraz własności hamujące wzrost kryszatłów w takich substancjach spożyw-
czych jak lody. Implikuje to ich szerokie zastosowanie w przemyśle spożywczym (produkcja
lodów i cukierków) i farmaceutycznym (powlekanie tabletek i produkcja syropów). Ponadto
ze względu na skłonność do kapsułkowania aromatów wykorzystywane być mogą do ochrony
związków małocząsteczkowych (np. aromatów żywności, składników leków itp.) przed utle-
nianiem. Nowoczesne zastosowania maltodekstryn w przemyśle spożywczym skupiają się na
stosowaniu ich jako zamienników tłuszczy, odżywkach dla sportowców oraz środkach spożyw-
czych dla niemowląt.
12
1.6.2
Produkcja syropów glukozowych/glukozy krystalicznej
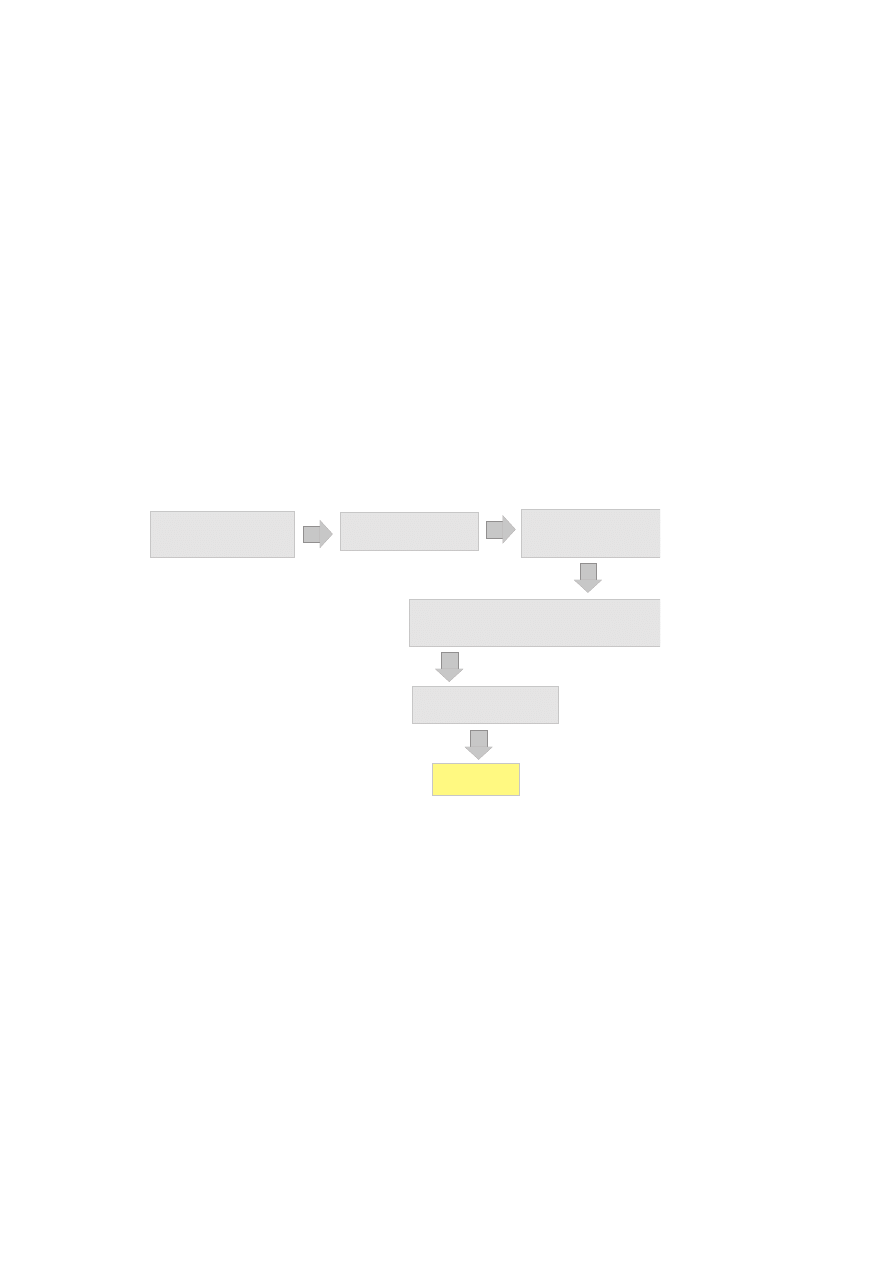
Produkcja syropów glukozowych metodą enzymatyczną jest procesem wielostopniowym (Ry-
sunek 1.6.2). Etapy wstępne, a więc otrzymywanie suspensji skrobi oraz jej kleikowanie są
identyczne z procesem otrzymywania maltodekstryn podobnie jak wstępne upłynnienie kle-
iku skrobiowego przy użyciu α-amylazy. Kolejnym etapem procesu jest w przypadku syro-
pów glukozowych scukrzanie upłynnionej skrobi aż do wartości DE ok 95 w celu otrzymania
maksymalnej wydajności glukozy. Wartość graniczna DE = ok. 95 wynika z możliwej reakcji
repolimeryzacji glukozy przy wysokich jej stężeniach w obecności amyloglukozydazy. Kolejne
etapy procesu obejmują oczyszczanie produktu (usuwanie białek i tłuszczy), dekoloryzację (na
węglu aktywnym) oraz usuwanie składników mineralnych (kolumny jonowymienne).
w o d n a z a w i e s i n a s k r o b i
( 3 0 - 4 0 % w / v ; p H 6 . 5
C a 2 + ; a - a m y l a z a )
k l e i k o w a n i e
1 1 0 - 1 4 0 d e g ; 5 - 1 0 m i n
h y d r o l i z a
( a - a m y l a z a ; 9 0 - 9 5 d e g
D E < 1 5 )
f i l t r a c j a i o c z y s z c z a n i e
( w ê g i e l a k t y w n y )
s c u k r z a n i e
( D E > 9 6 ; a m y l o g l u k o z y d a z a , p u l l u n a l a z a ;
p H 4 . 5 ; 5 5 - 6 0 d e g ; 4 8 - 9 6 h
S Y R O P
G L U K O Z O W Y
Rysunek 8: Produkcja syropu glukozowego.
Syropy glukozowe produkowane metodą enzymatyczną zawierają 94-98% glukozy, 1-3% mal-
tozy, 0,3-0,5% maltotriozy i do 2% wyższych polisacharydów. Syropy te wykorzystywane są
w procesach biotechnologicznych bez udziału drożdży (produkty farmaceutyczne, synteza or-
ganiczna, produkcja witamin), do produkcji glukozy krystalicznej oraz syropów fruktozowych
(np. HFCS). Z glukozy otrzymuje się też tzw. polidekstrozę o niskiej kaloryczności oraz sorbi-
tol.
13
w o d n a z a w i e s i n a s k r o b i
( 3 0 - 4 0 % w / v ; p H 6 . 5
C a 2 + ; a - a m y l a z a )
k l e i k o w a n i e
1 1 0 - 1 4 0 d e g ; 5 - 1 0 m i n
h y d r o l i z a D E 5 - 1 0
( a - a m y l a z a ; 9 0 - 9 5 d e g
9 0 - 1 2 0 m i n )
f i l t r a c j a i o c z y s z c z a n i e
( w ê g i e l a k t y w n y )
i n a k t y w a c j a e n z y m u
( 8 0 - 8 5 d e g ;
1 5 m i n )
S Y R O P
M A L T O Z O W Y
O W Y S O K I E J
Z A W A R T O C I
M A L T O Z Y
( 7 0 - 8 5 % )
h y d r o l i z a D E 3 8 - 4 0
( a - a m y l a z a ; r o d . k w a n e )
s c u k r z a n i e D E > 9 6 ;
( a - m y l a z a l u b b - a m y l a z a ;
p H 5 . 0 - 5 . 5 ; 5 0 - 5 5 d e g )
s c u k r z a n i e D E 4 5 - 6 0
( a - m y l a z a l u b b - a m y l a z a ;
p u l l u l a n a z a l u b i z o a m y l a z a
p H 6 . 0 ; 5 0 - 5 5 d e g )
f i l t r a c j a i o c z y s z c z a n i e
( w ê g i e l a k t y w n y )
s c u k r z a n i e D E 6 0 - 7 0
( a - m y l a z a l u b b - a m y l a z a ;
a m y l o g l u k o z y d a z a
p H 6 . 0 ; 7 5 d e g )
S Y R O P
M A L T O Z O W Y
S Y R O P
W Y S O K O S C U K R Z O N Y
Rysunek 9: Proces otrzymywania syropu wysokoscukrzonego i syropów maltozowych.
1.6.3
Produkcja syropów maltozowych i syropu wysokoscukrzonego.
Zarówno syropy maltozowe jak i syrop wysokoscukrzony produkowane są metodą enzyma-
tyczną dwustopniową. W pierwszym etapie po otrzymaniu suspensji skrobiowej poddaje się
ją kleikowaniu a następnie upłynnieniu (do DE max. 10 w przypadku syropów maltozowych i
DE = 38-40 w przypadku syropu wysokoscukrzonego). Drugi etap procesu polega zwykle na
procesie scukrzania enzymatycznego i de facto prowadzi do otrzymania właściwego końcowego
produktu. W przypadku syropów maltozowych proces ten prowadzić można na dwa sposoby
(Rysunek 1.6.3) stosując różne enzymy i warunki prowadzenia procesu otrzymując syropy
o różnej zawartości maltozy. Zastosowanie enzymów usuwających rozgałęzienia (pullulanaza
lub izoamylaza) umożliwia pełną hydrolizę zarówno amylozy jak i amylopektyny, co skutkuje
wysoką zawartością związków niskocząsteczkowych (zwłaszcza maltozy). W produkcji syropu
wysokoscukrzonego również stosuje się mieszaninę enzymów (α-amylaza i amyloglukozydaza)
w celu zwiększenia stopnia konwersji. Syropy maltozowe otrzymywane metodą enzymatyczną
znajdują zastosowanie w piwowarstwie, produkcji napojów, konserw i wyrobów cukierniczych.
Ich dodatek do żywności ułatwia kontrolę wodochłonności. Syropy te stosuje się także jako
14

wypełniacze i stabilizatory żywności przetworzonej. Można je, podobnie jak maltodekstryny,
stosować do opóźniania wzrostu kryształów. Dodatkowo z syropu o wysokiej zawartości mal-
tozy produkuje się maltozę krystaliczną wykorzystywaną do w produkcji leków jako zamiennik
glukozy dla diabetyków, maltitolu, maltulozy. Syropy te charakteryzują się niską lepkością w
roztworach, niską higroskopijnością oraz stabilnością w podwyższonych temperaturach.
1.6.4
Inne zastosowania
Wytwarzanie polialkoholi Cukry otrzymywane w syropiarniach mogą być poddawane
katalicznemu uwodornieniu, połączonemu z rozdziałem chromatograficznym. Umożliwia to w
miare efektywną produkcję polialkoholi, takich jak sorbitol, ksylitol, maltitol i erytritol.
Produkcja kwasów organicznych
Kwas cytrynowy jest najważniejszym kwasem organicznym, produkowanym w dużych
ilościach i wykorzystywanym w przemyśle spożywczym i farmaceutycznym. Większa część
produkcji opiera się na Aspergillus niger. Źródłem węgla mogą być między innymi hydrolizaty
skrobiowe i inne pożywki oparte na skrobi
Kwas mlekowy produkowany jest głównie w oparciu o maltozę i glukozę. Bezpośrednia
hydroliza skrobi jest możliwa przy udziale bakterii kwasu mlekowego: Lactobacillus thermo-
phillus oraz Lactobacillus amylophillus.
Inne kwasy organiczne produkowane w syropiarniach to kwas itakonowy (do produk-
cji tworzyw sztucznych, farb i lakierów) i glukonowy (prepearaty do czyszczenia, glukoniany
wapnia, magnezu i żelaza wykorzystywane są jako dodatki wzbogacające produkty spożywcze
w odpowiednie sole mineralne).
Piekarstwo Preparaty amylolityczne są wykorzystywane przy produkcji pieczywa w celu
zwiększenia zawartości cukrów w cieście, zintensyfikowania fermentacji, a co za tym idzie
zwiększenia objętości miękiszu i porowatości, poprawy koloru skórki, oraz polepszenia smaku
i zapachu pieczywa. Powstające w wyniku działania α-amylazy niskocząsteczkowe dekstryny
15

wpływają na przedłużenie trwałości pieczywa, gdyż utrudniają powstawanie połączeń pomię-
dzy skrobią i glutenem oraz spowalniają retrogradację skrobi.
Gorzelnictwo i browarnictwo Źródłem skrobi do produkcji etanolu mogą być różne ro-
śliny, np. kukurydza, pszenica, ziemniaki, maniok. Ponieważ drożdże zazwyczaj nie są zdolne
do hydrolizy skrobi, używa się do tego celu preparatów enzymatycznych. Duże ilości prepara-
tów amylolitycznych zużywane są także przez browary, przy produkcji piwa, podczas zacierania
(przy stosowaniu surowców niesłodowanych) i klarowania. Zastosowanie w browarnictwie su-
rowców niesłodowanych i preparatów enzymatycznych zwiększa wydajność warzelni i obniża
koszty związane z budową i eksploatacją słodowni.
Produkcja acetonu i butanolu W roku 1914 Chaim Weizmann wyizolował Clostridium
acetobutylicum, bakterię zdolną do przetwarzania skrobi w aceton i butanol. Ze względu na
znaczenie militarne (produkcja nitrocelulozy) proces Weizmanna został szybko wdrożony i był
powszechnie wykorzystywany do końca drugiej wojny światowej. Obecnie (2003) technologia
ta stosowana jest jeszcze w niektórych zakładach na terenie Federacji Rosyjskiej. Ze względów
ekologicznych technologia ta ma pewne szanse na powtórne wprowadzenie w innych krajach.
Produkcja pasz Dodatek odpowiednich enzymów do pasz może poprawiać ich przyswa-
jalność, co obniża wskaźnik zużycia pasz na przyrost ciężaru ciała. Do produkcji preparatów
dla celów paszowych szczególnie nadaje się Aspergillus oryzae, wytwarzający enzymy amyloli-
tyczne i proteolityczne. Preparaty enzymatyczne mogą być stosowane w procesie ich produkcji
lub jako bezpośredni dodatek do gotowych mieszanek paszowych.
Biodegradacja α-Amylaza jest wykorzystywana jako dodatek przyspieszający biodegra-
dację na składowiskach odpadów oraz w oczyszczalniach ścieków.
Usuwanie zanieczyszczeń skrobiowych Zanieczyszczenia skrobiowe mogą być usuwane
z różnego rodzaju produktów spożywczych i niespożywczych. Glukoamylaza jest wykorzysty-
wana do klarowania wina i soków owocowych. Wytłoki jabłkowe, używane jako surowiec w
produkcji pektyny zawierają pewne ilości skrobi. Ich obecność powoduje silne zmętnienie soku
pektynowego i wpływają niekorzystnie na proces filtracji. Usuwanie skrobi można przepro-
16

wadzać różnymi metodami, (samosklarowanie, dodatek taniny, oziębianie, filtracja), jednak
najkorzystniejsze jest użycie do tego celu α-amylazy o optimum pH 3–4.
W przemyśle włókienniczym używa się substancji sklejających osnowę zawierających skrobię
lub jej hydrolizaty. W procesie odklejania tkanin konieczne jest dokładne usunięcie klejonki,
która przeszkadza w dalszych etapach technologicznych (bielenie, farbowanie, tłoczenie). W
tym celu używa się preparatów α-amylazy. Podobne preparaty mogą być używane także do
innych celów (oczyszczanie papieru, mycie naczyń, proszki do prania itp.).
Zastosowania analityczne Badanie produktów hydrolizy skrobi ma istotne znaczenie w po-
znaniu budowy ziarenek skrobiowych, jak i wewnętrznej struktury amylopektyny. Najczęściej
wykorzystywane są w tym celu egzoamylazy, głównie β-amylaza, bowiem pozostające po ich
działaniu dekstryny graniczne dostarczają istotnych informacji na temat rozgałęzień. Przykła-
dem zastosowania skrobi pozbawionej rozgałęzień do celów analitycznych jest wykorzystanie
jej jako wzorca do kalibracji mas cząsteczkowych w chromatografii żelowej. α-Amylaza wy-
korzystywana jest także przy oznaczaniu niestrawnego błonnika pokarmowego (non-digestible
fiber)
17

1.7
Ćwiczenia laboratoryjne
1.7.1
Oznaczenie suchej masy
Do wysuszonych do stałej masy i zważonych naczynek wagowych odważyć ok. 0,1g skrobi
z dokładnością do 0,0001 g. Naczynka z próbkami suszyć w temperaturze 130◦C przez 1
godz. Następnie przenieść próbkę do eksykatora i po ostygnięciu ponownie zważyć. Z różnicy
mas próbki przed i po suszeniu obliczyć zawartość suchej substancji. Wynik przedstawić z
dokładnością do 0,1%.
1.7.2
Przeprowadzenie hydrolizy
Na wadze analitycznej odważyć 1,75g skrobi w przeliczeniu na suchą masę (założyć zawartość
wody równą 20% a po określeniu suchej masy uwzględnić odpowiednią poprawkę). Odważoną
skrobię przenieść ilościowo do wytarowanej kolby stożkowej o poj. 300cm
3
. Zawartość uzu-
pełnić wodą destylowaną do masy 200g. Kolbę umieścić na wrzącej łaźni wodnej na okres 5
minut intensywnie mieszając zawartość (w celu otrzymania homogenicznego kleiku). Następ-
nie otrzymany kleik gotować (stosując palnik gazowy) pod chłodnicą zwrotną przez kolejne
5minut. Całość schłodzić do temperatury 60◦C (50◦C lub 40◦C w zależnosci od grupy) i po
wytarciu kolby z zewnątrz uzupełnić ewentualne ubytki wody do całkowitej masy miesza-
niny 200g. Całość starannie wymieszać i pobrać próbkę zerową do oznaczenia redukcyjności
(5 cm
3
). Do pozostałej próbki dodać 0,5 cm
3
roztworu enzymu i zawartość intensywnie wy-
mieszać. Hydrolizę prowadzić w temperaturach 60◦C 50◦C i 40◦C (zależnie od grupy). Przed
każdorazowym pobraniem próbki zawartość kolby wymieszać. Próbki do badań pobrać po 2,
5, 8 15, 25, 45, 65, 80 i 90 minutach.
1.7.3
Wykonanie oznaczenia redukcyjności
W badaniach posłużyć się krzywą wzorcową otrzymaną w trakcie ćwiczeń nt. hydrolizy kwa-
sowej. Do próbówek odmierzyć 5 cm
3
mieszaniny płynów Fehlinga, 5 cm
3
próbki oraz 15 cm
3
wody. Próbkę ogrzewać na wrzącej łaźni przez 5min, przenieść do probówek wirówkowych i
odwirować (2 min, 5000 rpm). Przeprowadzić pomiar spektrofotometryczny jak opisano to
dla krzywej wzorcowej w ćwiczeniu nt hydrolizy kwasowej. Określić wartość DE dla kolejnych
próbek i sporządzić wykres jego wartości w zależności od czasu.
18

1.7.4
Sprawozdanie
Sprawozdanie powinno zawierać zwięzły opis wykonania ćwiczenia wraz z uwagami, wyniki
badań, wykres zależności DE od czasu. Wszystkie otrzymane dane należy skomentować i wy-
ciągnąć wnioski. Porównać także dynamikę zmian DE w zależności od rodzaju hydrolizy (kwa-
sowa, enzymatyczna) oraz temperatury.
19
Wyszukiwarka
Podobne podstrony:
Hydroliza enzymatyczna skrobi
(), Biochemia L, sprawozdanie Hydroliza enzymatyczna białka (ćw H)(1)
Hydroliza enzymatyczna OTŻ
Hydroliza lipidów mleka za pomocą lipazy trzustkowej, Biotechnologia Enzymatyczna
instrukcja kinetyka enzymatyczna - inwertaza, [1] Hydroliza sacharozy
cwiczenie 2 hydrolazy czynniki wplywajace na szybkosc reakcji enzymatycznych 15 05 2014
Enzymatyczna hydroliza pektyn poprawione
Enzymatyczna hydroliza tłuszczów
Charakterystyka mleka pasteryzowanego poddanego enzymatycznej hydrolizie laktozy
Enzymatic hydrolysis of microcrystalline cellulose in reverse micelles
Hydrologia cwiczenia 9 i 10
więcej podobnych podstron