10.05.21
1
Hydroliza enzymatyczna
skrobi
10.05.21
2
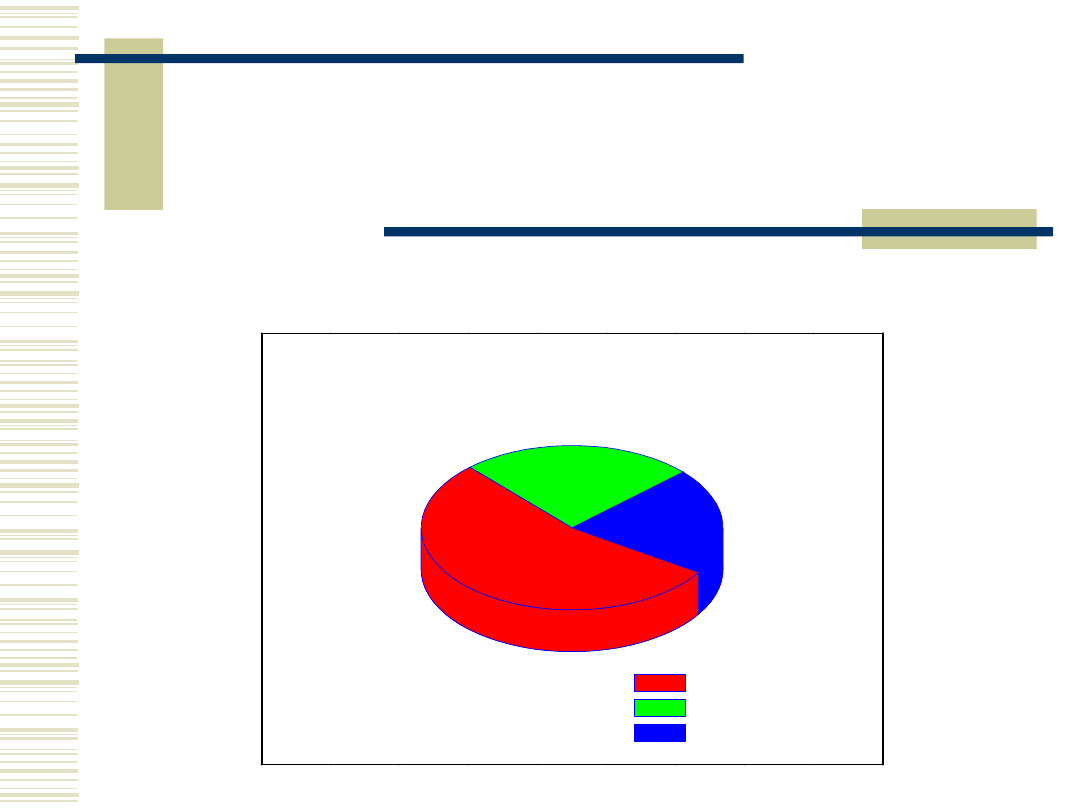
Kierunki przerobu skrobi
Podzial produkcji skrobi w UE 2000r.
21%
25%
54%
produkty hydrolizy
skrobia natywna
modyfikaty
10.05.21
3
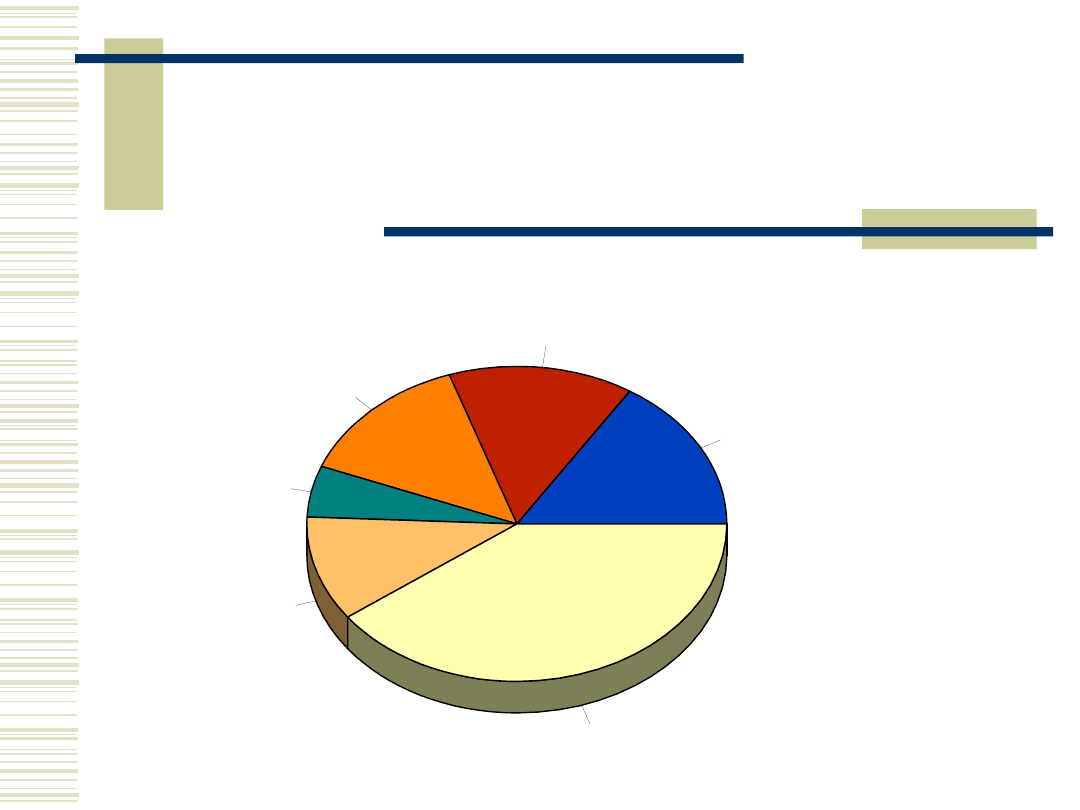
Kierunki przerobu skrobi
food
16,0%
paper
14,1%
textile
14,0%
drilling
5,2%
foundry
10,7%
others
40,0%
10.05.21
4
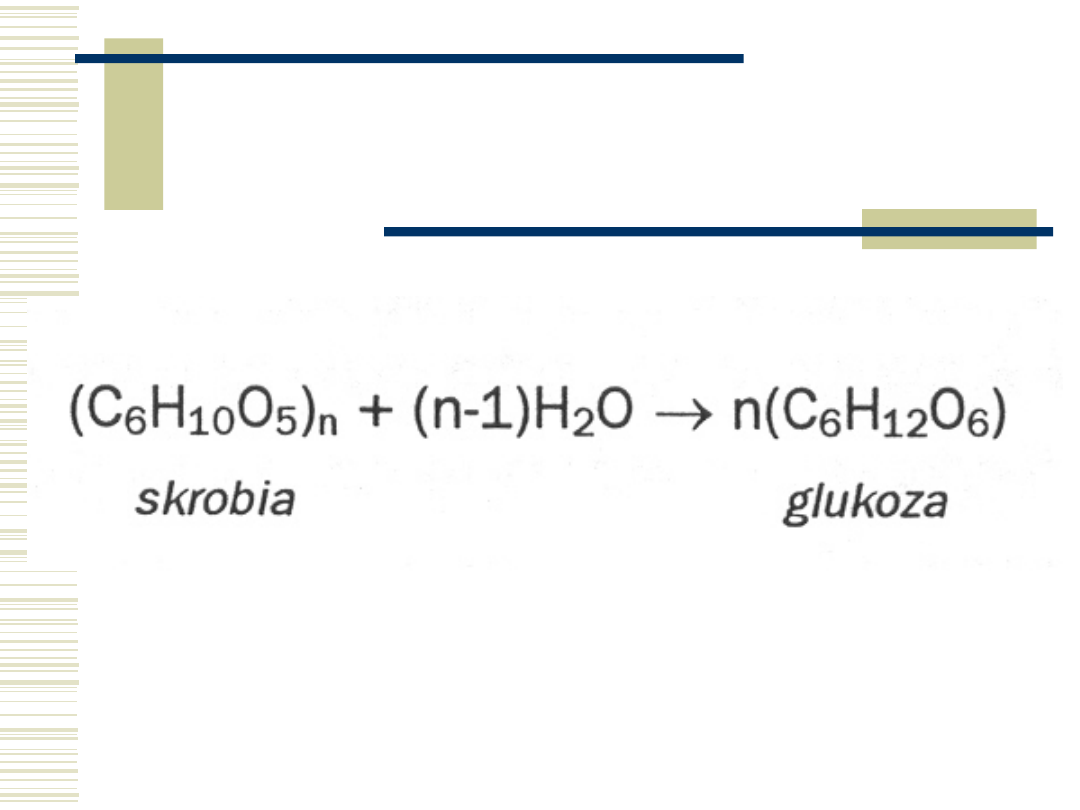
Hydroliza skrobi
10.05.21
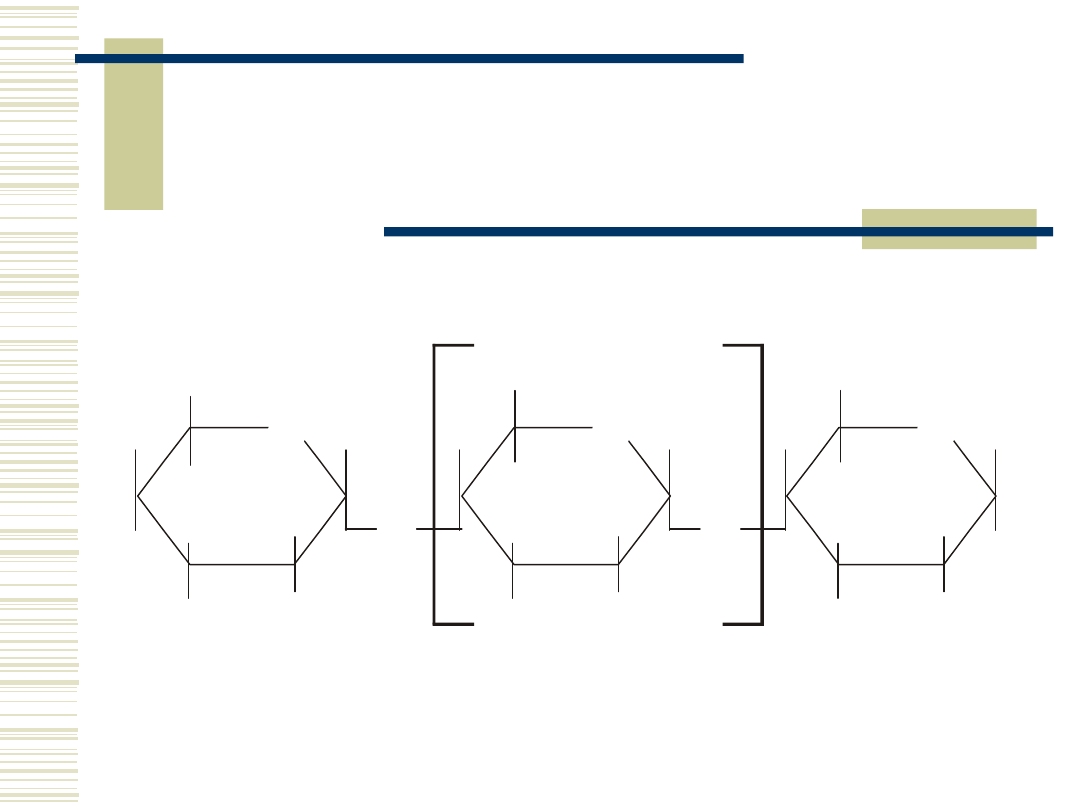
5
Amyloza
C H O H
2
C H O H
2
O H
O H
O
O
O H
O H
C H O H
2
O H
O
n
OH
O H
O H
O H
O
O
10.05.21
6
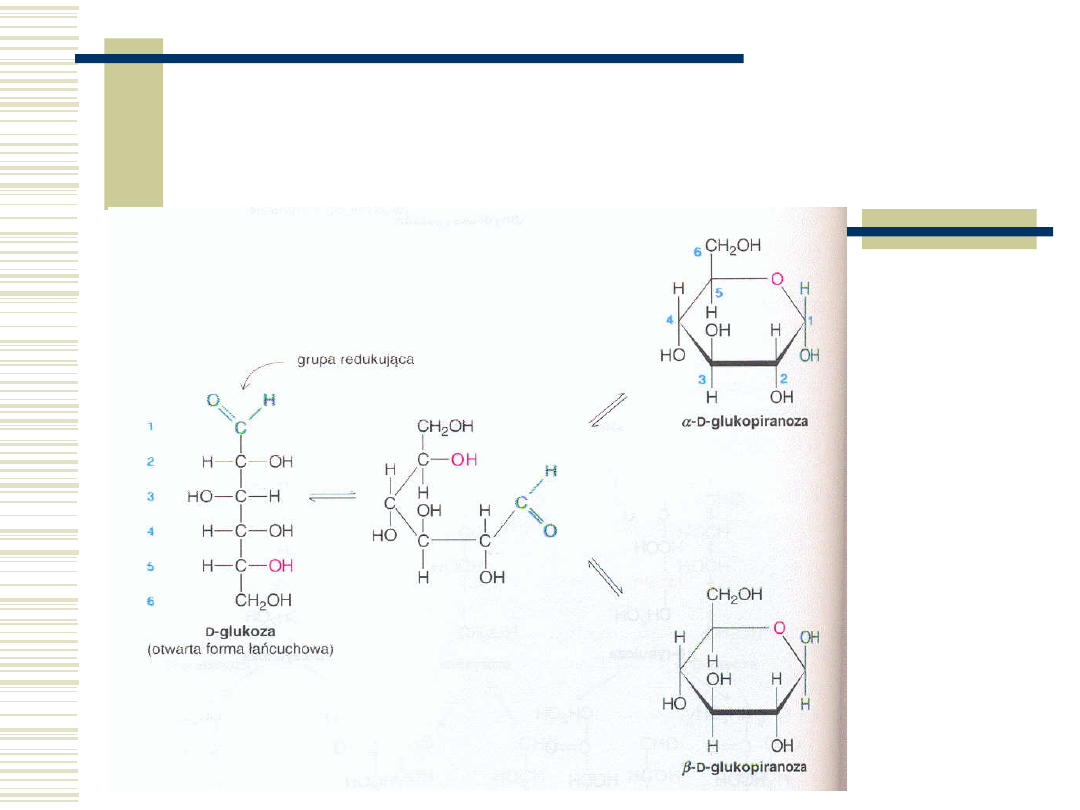
Tworzenie półacetalu –
ugrupowanie redukujące
10.05.21
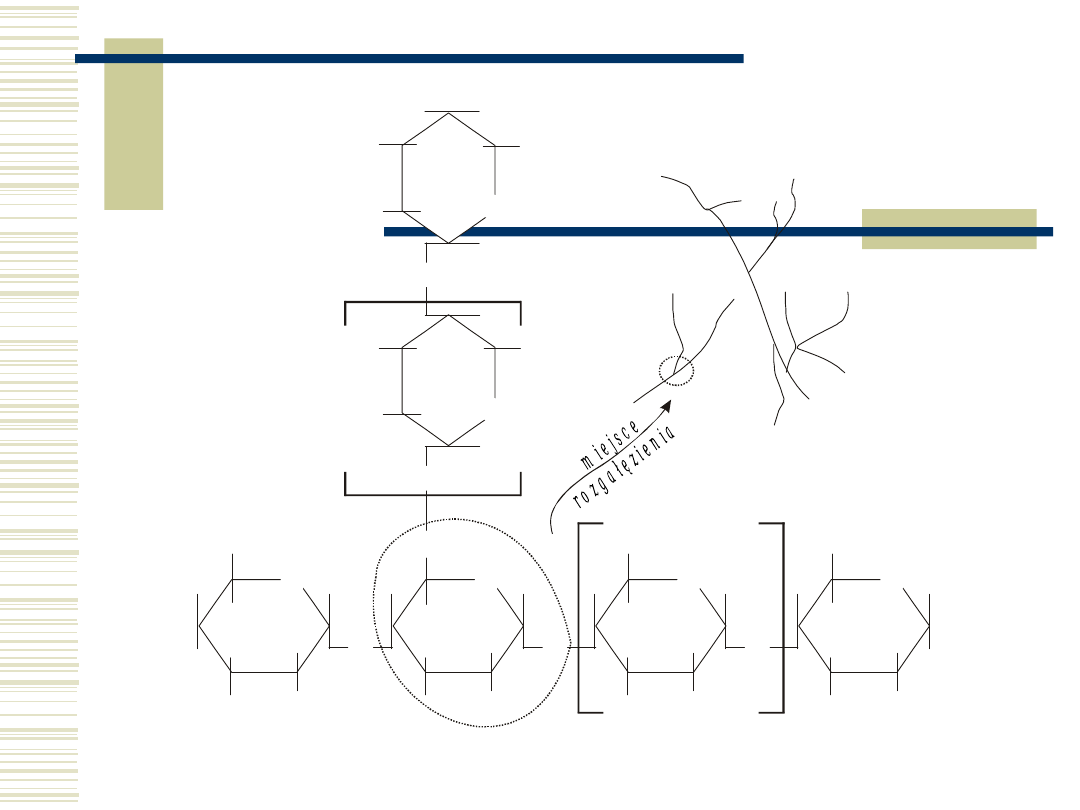
7
Amylopektyna
OH
C H O H
2
O H
O
O
O H
C H O H
2
O H
O H
O
O
O H
O H
C H O H
2
O H
O
m
n
C H O H
2
OH
OH
OH
O H
O
O
O
O
C H O H
2
O H
O H
O H
O
O
C H
2
O H
10.05.21
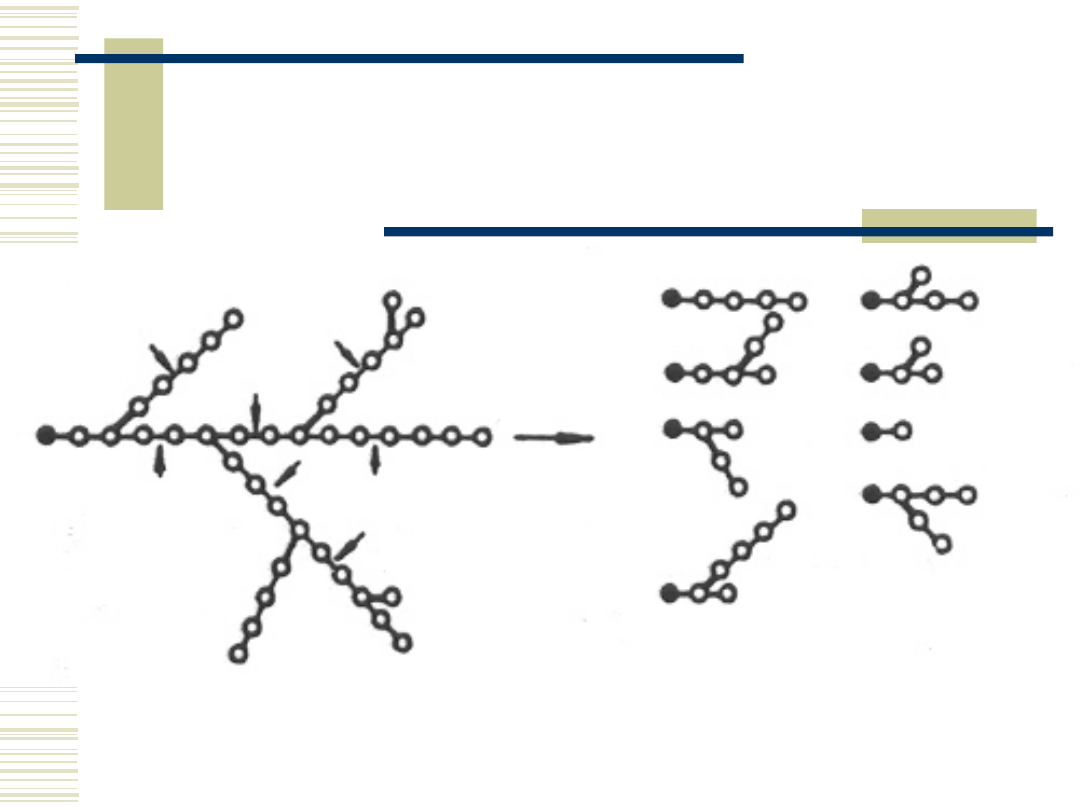
8
Schemat działania α-
amylaz na amylopektynę
10.05.21
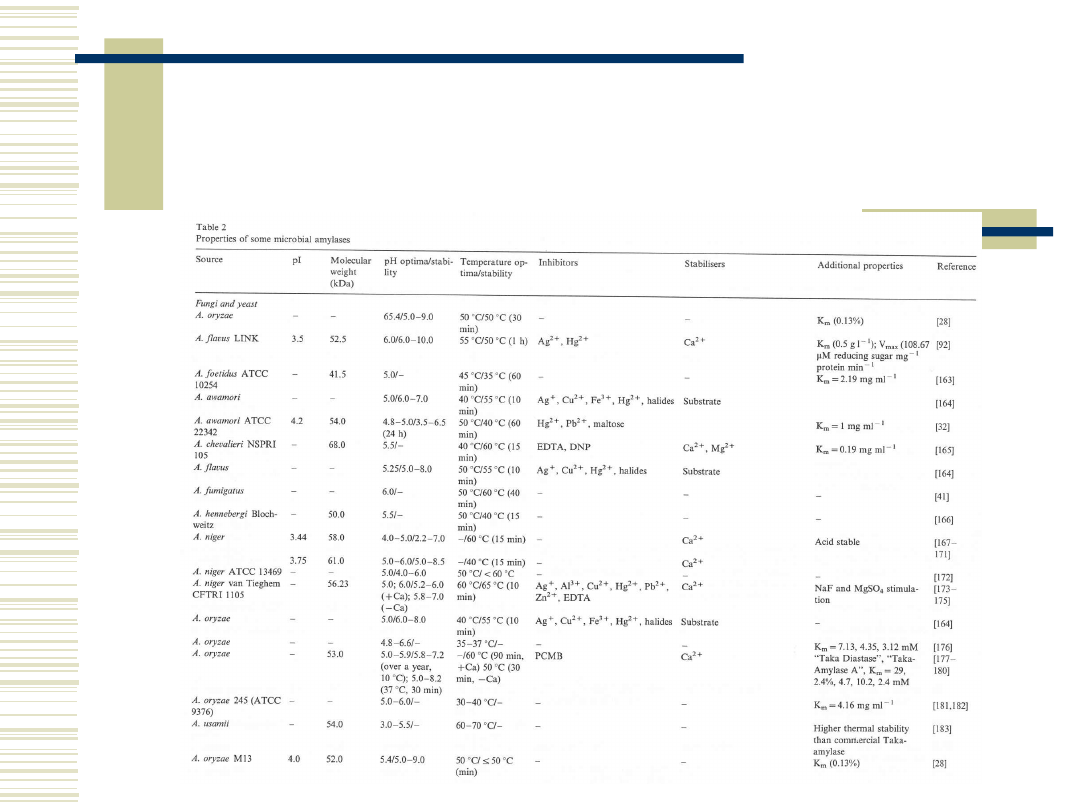
9
Właściwości biochemiczne α-
amylaz pochodzenia
mikrobiologicznego c.d.
10.05.21
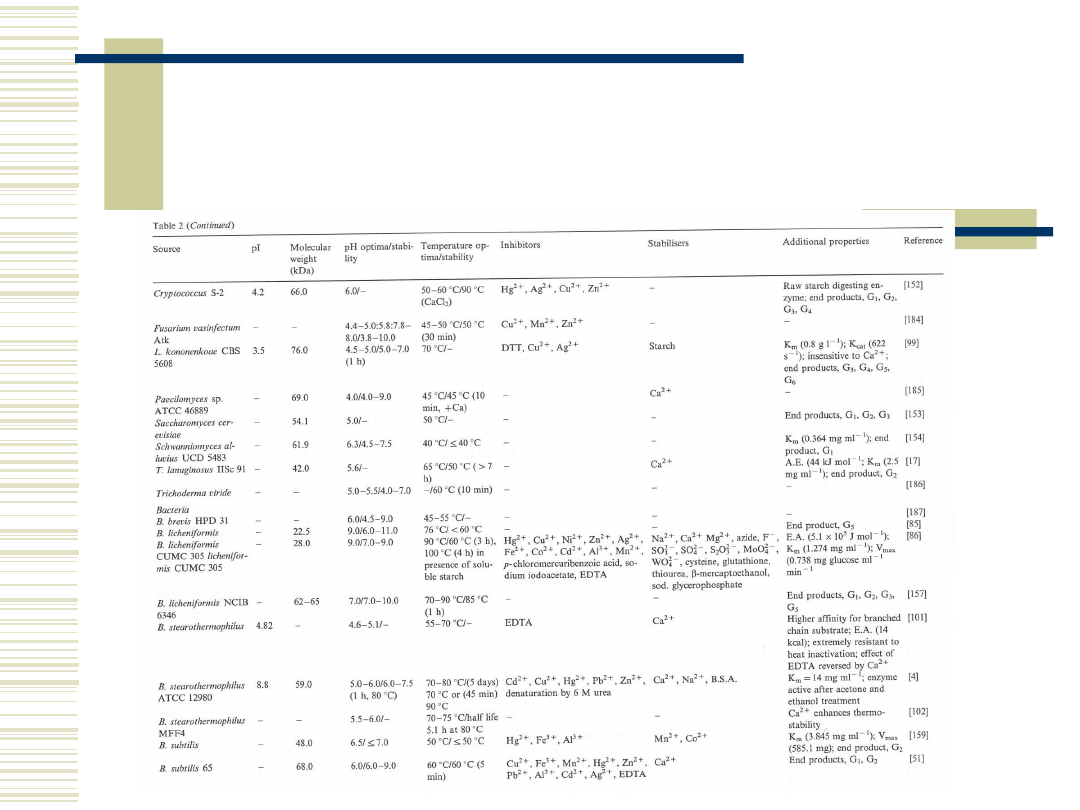
10
Właściwości biochemiczne α-
amylaz pochodzenia
mikrobiologicznego c.d.
10.05.21
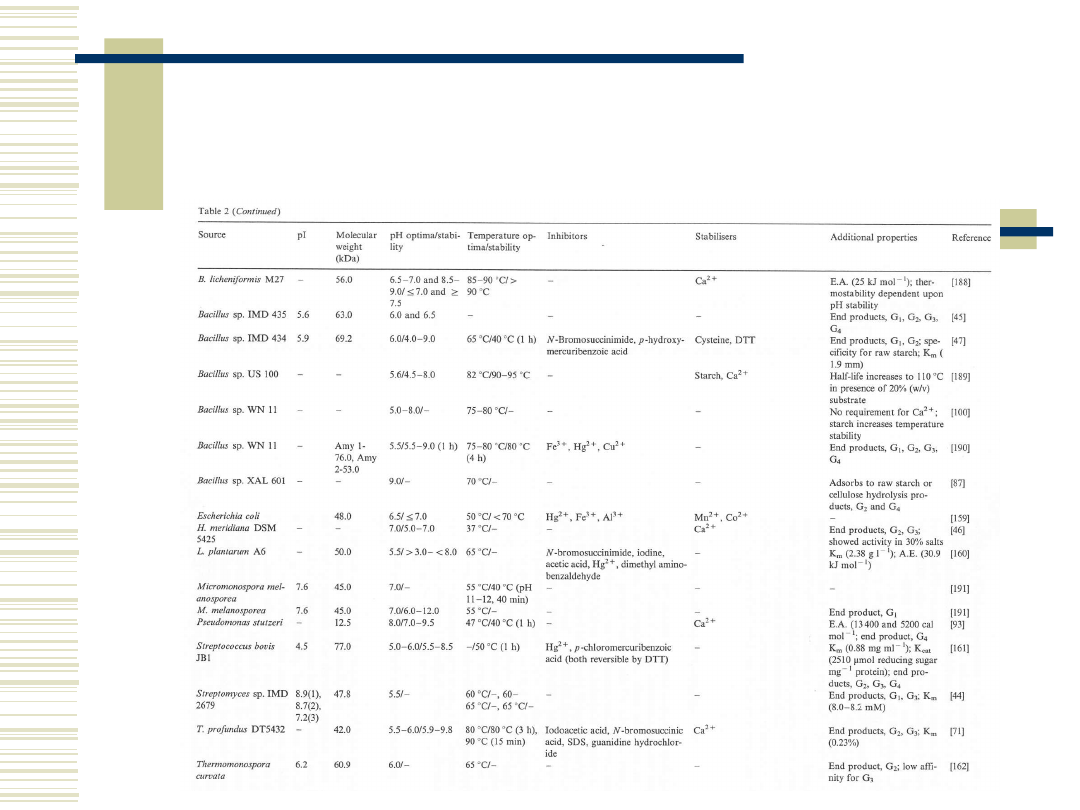
11
Właściwości biochemiczne α-
amylaz pochodzenia
mikrobiologicznego c.d.

10.05.21
12
Właściwości biochemiczne α-
amylaz pochodzenia
mikrobiologicznego c.d.
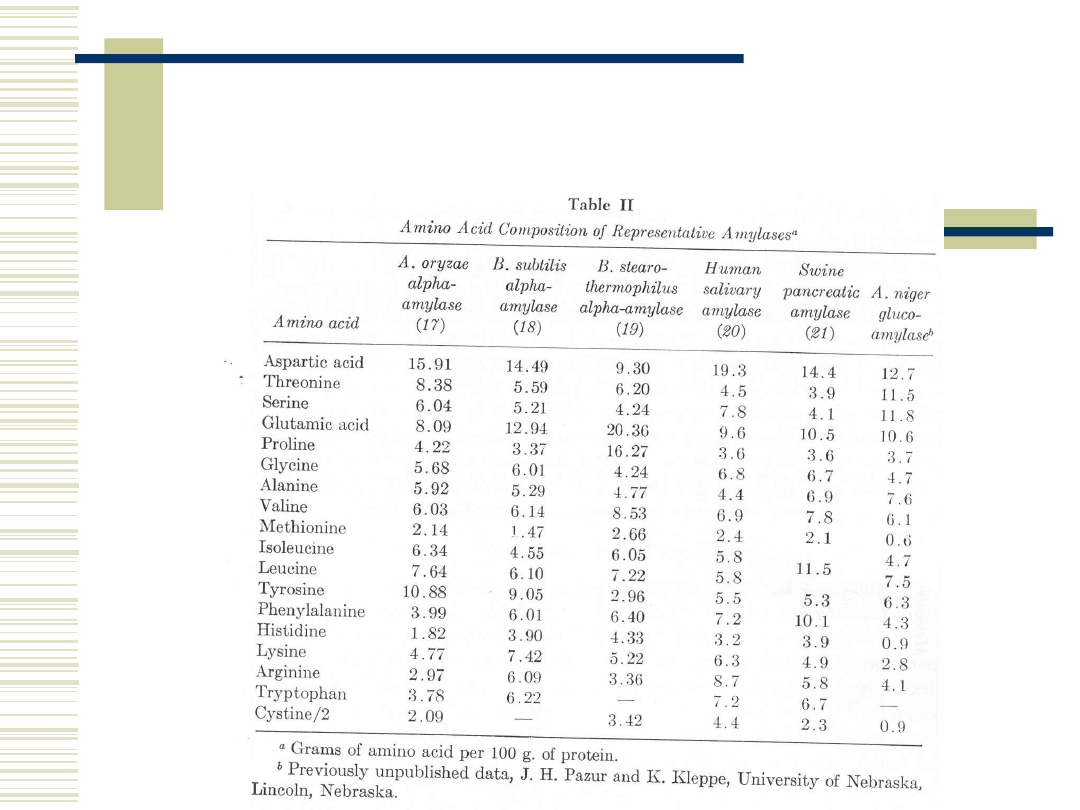
10.05.21
13
Bioróżnorodność α-
amylaz

10.05.21
14
Dekstryny graniczne
powstające w wyniku
działania
α
-amylaz
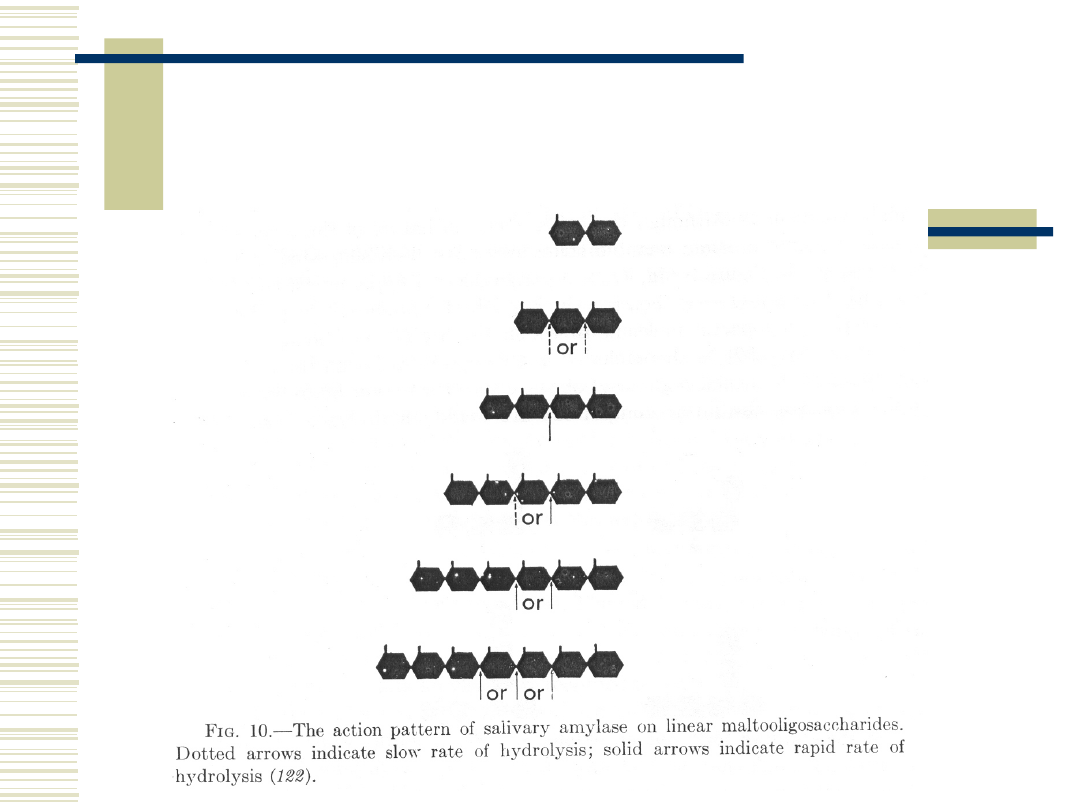
10.05.21
15
Aktywność
α
-amylaz w
stosunku do różnych wiązań
α
-1-4
10.05.21
16
Schemat działania β-
amylaz na amylopektynę

10.05.21
17
Dekstryny graniczne
powstające w wyniku
działania
β
-amylaz
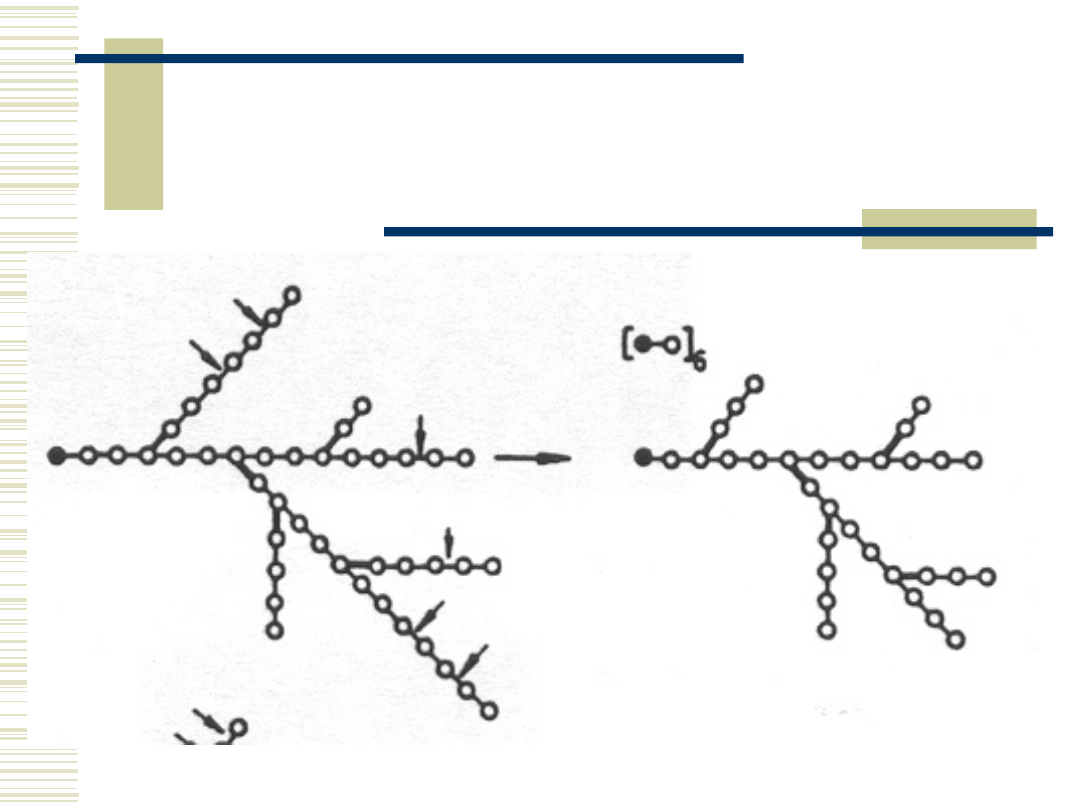
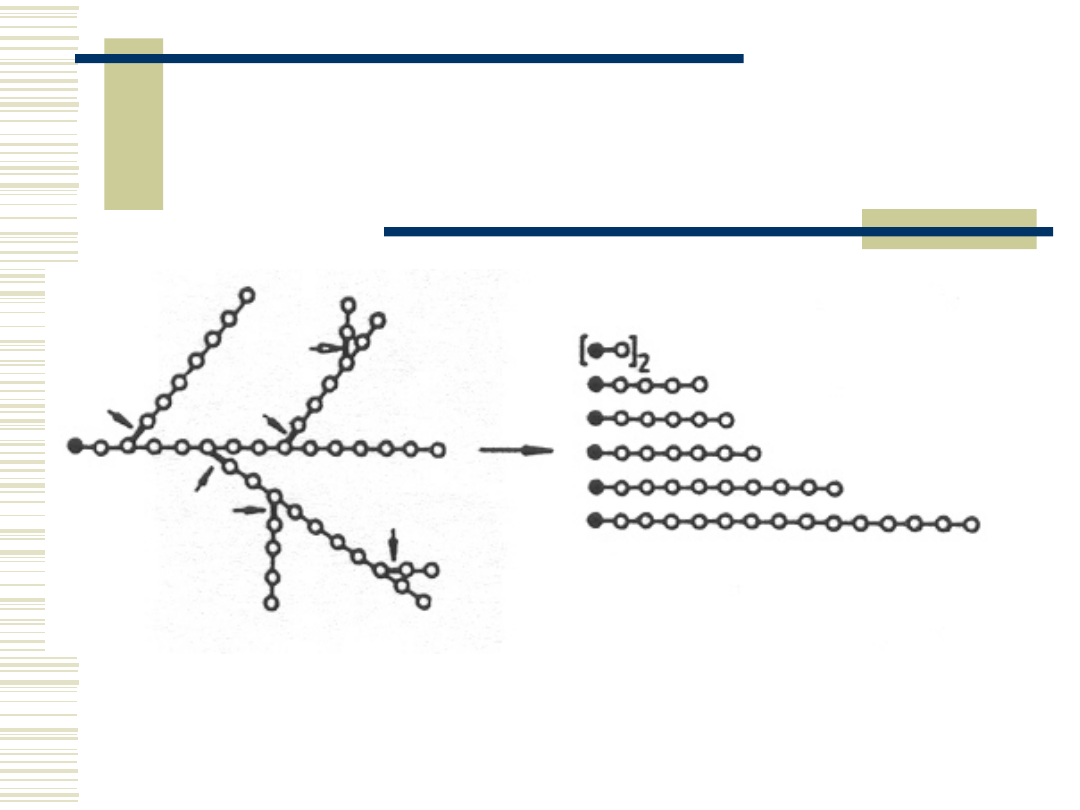
10.05.21
18
Schemat działania
glukoamylaz na
amylopektynę
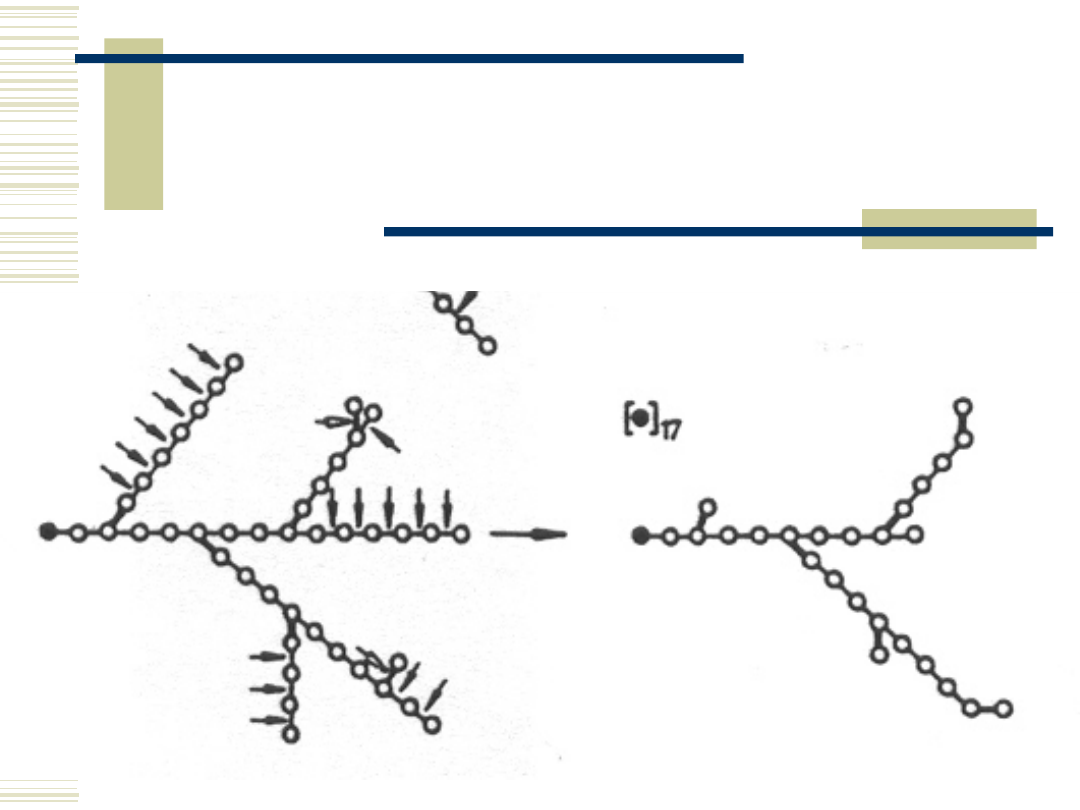
10.05.21
19
Schemat działania na
amylopektynę enzymów
znoszących rozgałęzienia
10.05.21
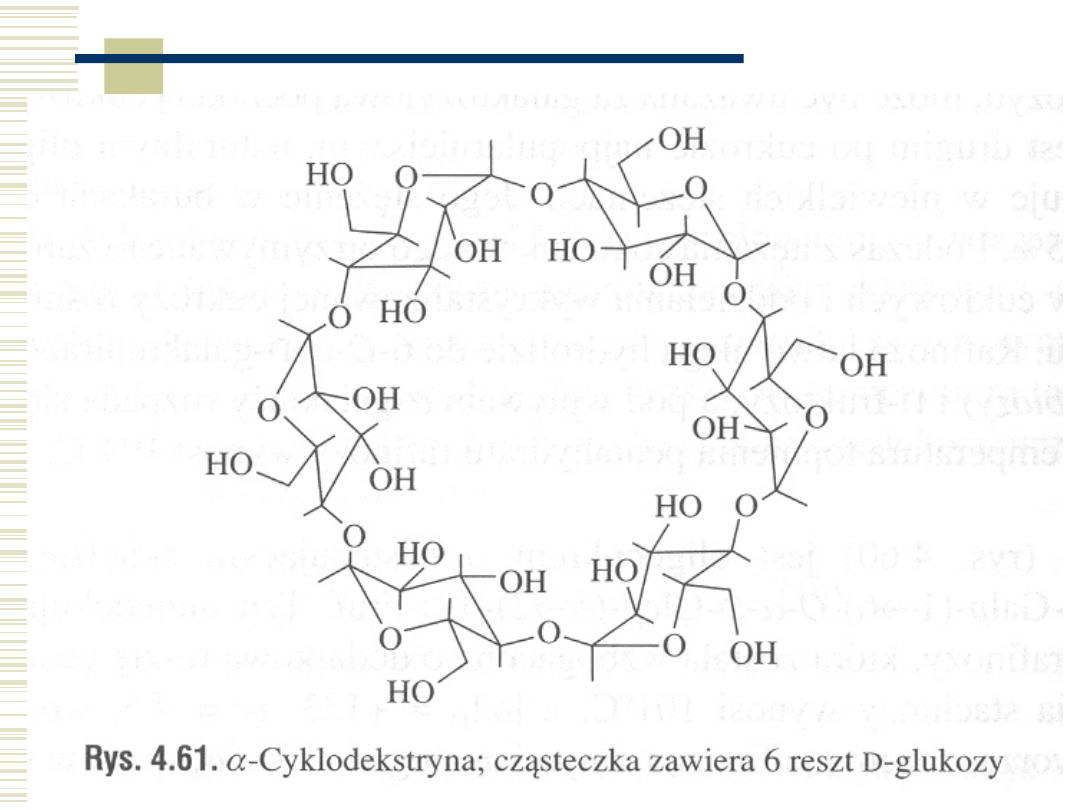
20
α-cyklodekstryna
10.05.21
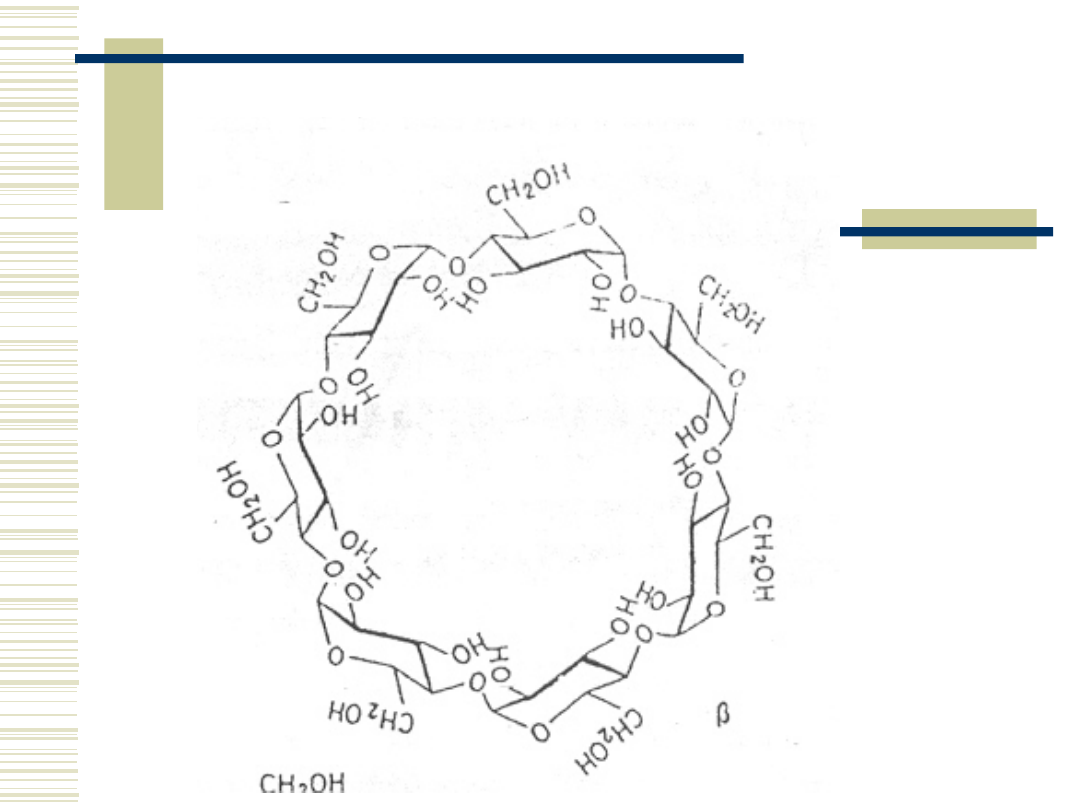
21
β-cyklodekstryna
10.05.21
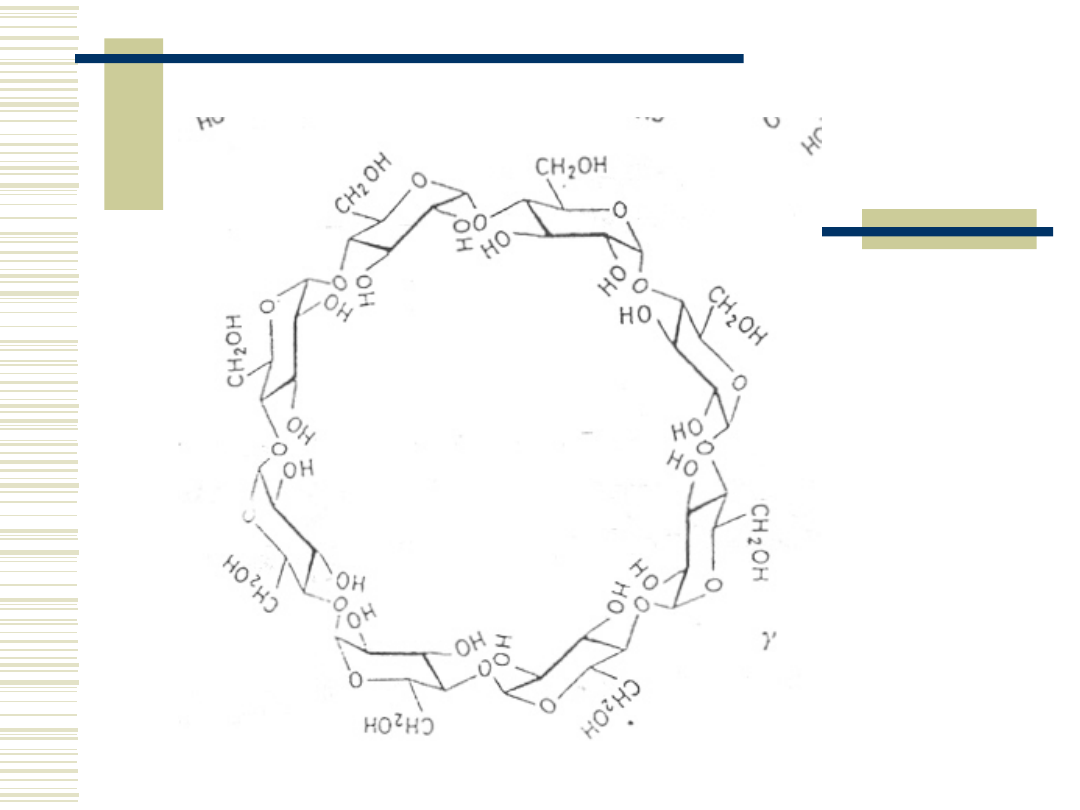
22
γ- cyklodekstryna
10.05.21
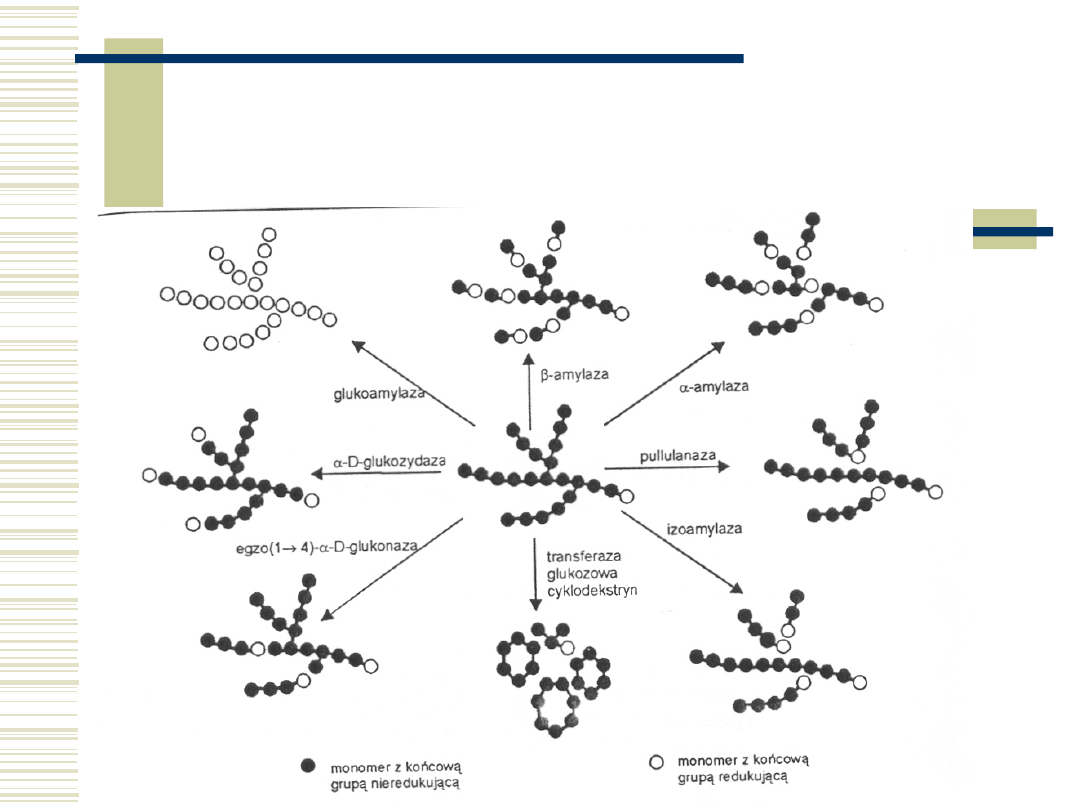
23
Schemat działania
enzymów amylolitycznych
10.05.21
24
Równoważnik glukozowy
DE
Równoważnik glukozowy = Dextrose
Equivalent
Ilość rozczepionych wiązań
glikozydowych
DE = 100 --------------------------------------
Początkowa ilość wiązań glikozydowych
Zawartość cukrów redukujących (
wyrażonych jako glukoza
)
DE = 100 --------------------------------------
Całkowita zawartość cukrów
(
wyrażonych jako glukoza
)
10.05.21
25
Równoważnik glukozowy
DE
100
DE = ----
DP
glukoza DE = 100
maltoza DE = 50
maltotetraoza DE = 25
Hydroliza skrobi
Oznaczanie zawartości cukrów
redukujących
Zasada pomiaru
o Oznaczenie zawartości cukrów
redukujących polega na określeniu
ilości grup aldehydowych zdolnych do
redukcji jonów miedzi Cu
+2
do Cu
+1
.
o Oznaczenie prowadzimy wg
procedury opisanej w normie PN-
78/A-74701
Zasada pomiaru c.d.
o Oznaczenie obejmuje z następujące etapy:
o
zadanie roztworu badanej substancji
(maltodekstryny) nadmiarem roztworu miedzi
Cu
+2
(roztwór Fehlinga) i przeprowadzenie
procesu utlenienia grup aldehydowych
maltodekstryny do karboksylowych, któremu
towarzyszy redukcja jonów miedzi Cu
+2
do Cu
+1
o
jodometrycznie oznaczenie nadmiaru
odczynnika Fehlinga
Redukcja jonów Cu
+2
RC
+1
HO - 2e
-
-> RC
+3
OOH
2Cu
+2
+ 2e
-
-> 2Cu
+1
RC
+1
HO + 2Cu
+2
SO
4
+ 2NaOH ->
RC
+3
OOH + Cu
+12
O + Na
2
SO
4
Jodometria
o Dział ilościowej analizy chemicznej objętościowej
obejmujący oznaczenia substancji utleniających i
redukujących.
o W przypadku oznaczania zawartości utleniaczy
(utleniaczem są występujące w nadmiarze jony
miedzi Cu
+2
):
o
do roztworu substancji oznaczanej dodaje się znaną
ilość jodku potasowego, który ulega utlenieniu do jodu.
o
po dodaniu skrobi jako wskaźnika (tworzy z jodem
ciemnoniebieskie zabarwienie) prowadzi się
miareczkowanie tiosiarcząnem sodu
Redukcja nadmiaru
jonów miedzi
Cu
+2
+ e
-
-> Cu
+1
J
-
- e
-
-> J
0
2CuSO
4
+ 2KJ + H
2
SO
4
->
2Cu(HSO
4
) + J
2
+ K
2
SO
4
tworzy się granatowy kompleks skrobi
z jodem J
2
Jodometria c.d.
Tiosiarczan redukuje jod do jodków
zgodnie z równaniem:
2S
2
O
3
2-
+ J
2
-> S
4
O
6
2-
+ 2J
-
Odczynniki
o Roztwór Fehlinga A:
o
34,6g krystalicznego siarczanu miedziowego
(CuSO
4
* 5 H
2
O) cz.d.a. rozpuścić w wodzie
destylowanej i dopełnić w kolbie pomiarowej do
500 cm³.
o Roztwór Fehlinga B:
o
173g winianu sodowo potasowego cz.d.a. i 50g
wodorotlenku sodowego cz.d.a. rozpuścić w
wodzie destylowanej i dopełnić w kolbie
pomiarowej do 500 cm³.
Odczynniki c.d.
o Kwas siarkowy cz.d.a., roztwór
25%
o Tiosiarczan sodowy, roztwór 0,1N
o Jodek potasowy cz.d.a., roztwór
30%
o Skrobia rozpuszczalna, roztwór 1%
Wykonanie oznaczenia
o Do kolby stożkowej o pojemności 250 cm³
odmierzamy z biurety 10 cm³ roztworu
Fehlinga A, 10 cm³ roztworu Fehlinga B,
dodajemy 10 cm³ roztworu badanego
produktu i 20 cm³ wody destylowanej.
o Tak przygotowaną mieszaninę
doprowadzamy do wrzenia w ciągu 3 minut
i dalej gotujemy jeszcze przez 2 minuty.
o
tworzy się ciemnobordowe zabarwienie
pochodzące od Cu
2
O
Rola odczynnika
Fehlinga B
o Siarczan miedzi w środowisku
alkalicznym ulega wytrąceniu w
postaci wodorotlenku
o Winian sodowo-potasowy utrzymuje
jony Cu
+2
w roztworze dzięki
utworzeniu kompleksu
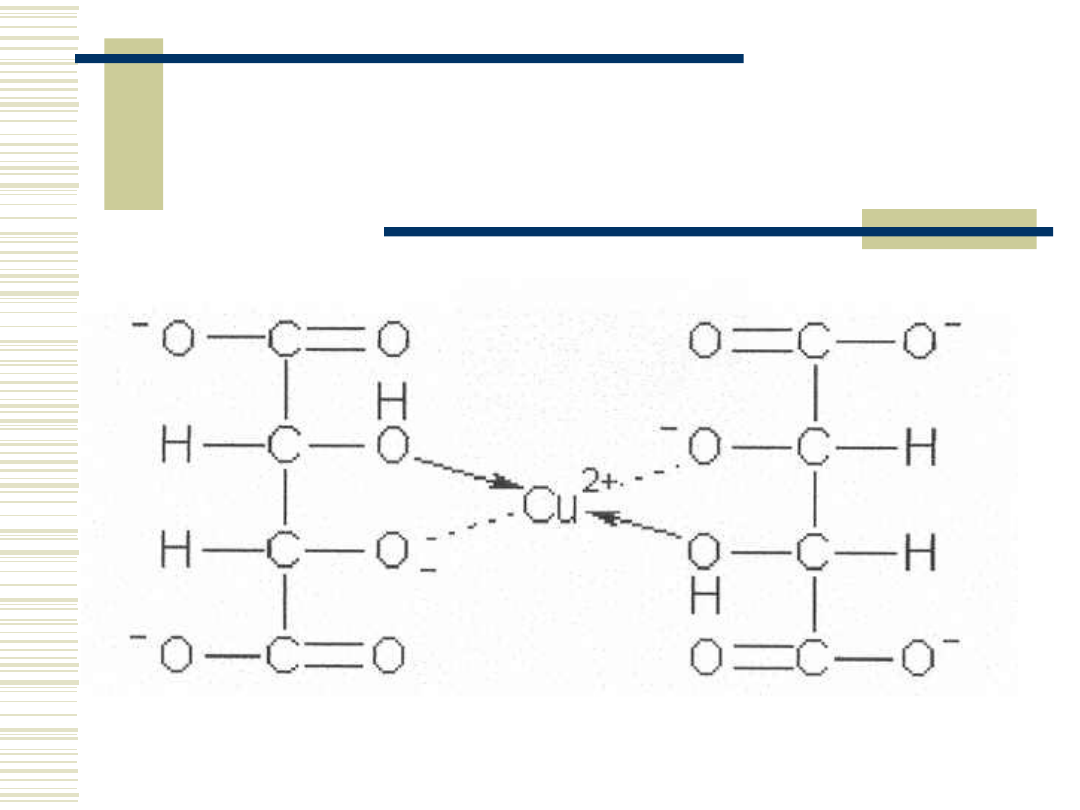
Struktura kompleksu
Cu
+2
- winian
Wykonanie oznaczenia
c.d.
o Roztwór chłodzimy do temperatury
pokojowej. Następnie dodajemy z biurety
10 cm³ roztworu KJ, 10 cm³ H
2
SO
4,
5 cm³
roztworu skrobi rozpuszczalnej.
o
tworzy się ciemnobrunatne lub czarne
zabarwienie pochodzące od kompleksu skrobi z
jodem
o Całość miareczkujemy 0,1 N Na
2
S
2
O
3
aż do
zaniku powstałego ciemnego zabarwienia.
Odmiareczkowanie
powstałego jodu
2Na
2
S
2
O
3
+ J
2
-> Na
2
S
4
O
6
+ 2NaJ
Próba zerowa
Równolegle wykonujemy próbę
zerową, stosując wodę destylowaną
zamiast roztworu badanego
Obliczenia
o Z różnicy między ilością tiosiarczanu
sodowego zużytego w próbie zerowej i
próbie właściwej, odczytujemy z tabl. 4
w normie PN-78/A-74701 ilość cukrów
redukujących wyrażonych jako glukoza
o Wartość tę stosujemy do obliczenia
wartości DE
Obliczenia dla oznaczeń
z roztworu o znanym
stężeniu
a*10
DE = ---------
C*V
gdzie:
a - wartość odczytana z tablicy
C - stężenie roztworu skrobi [%]
V - objętość pobranej próbki [ml]
Obliczenia dla oznaczeń
produktów w postaci
proszku
10 a
DE = ---------
m*S
gdzie:
a - wartość odczytana z tablicy
m – naważka maltodekstryny [g]
S - zawartość s.s. w maltodekstrynie [%]
Uwagi ogólne
o Opisaną metodą można oznaczyć
również zawartość fruktozy bądź
sacharozy, tak jak gdyby były one
cukrami redukującymi
o
jest to możliwe wskutek reakcji
epimeryzacji, która zachodzi w
warunkach oznaczenia
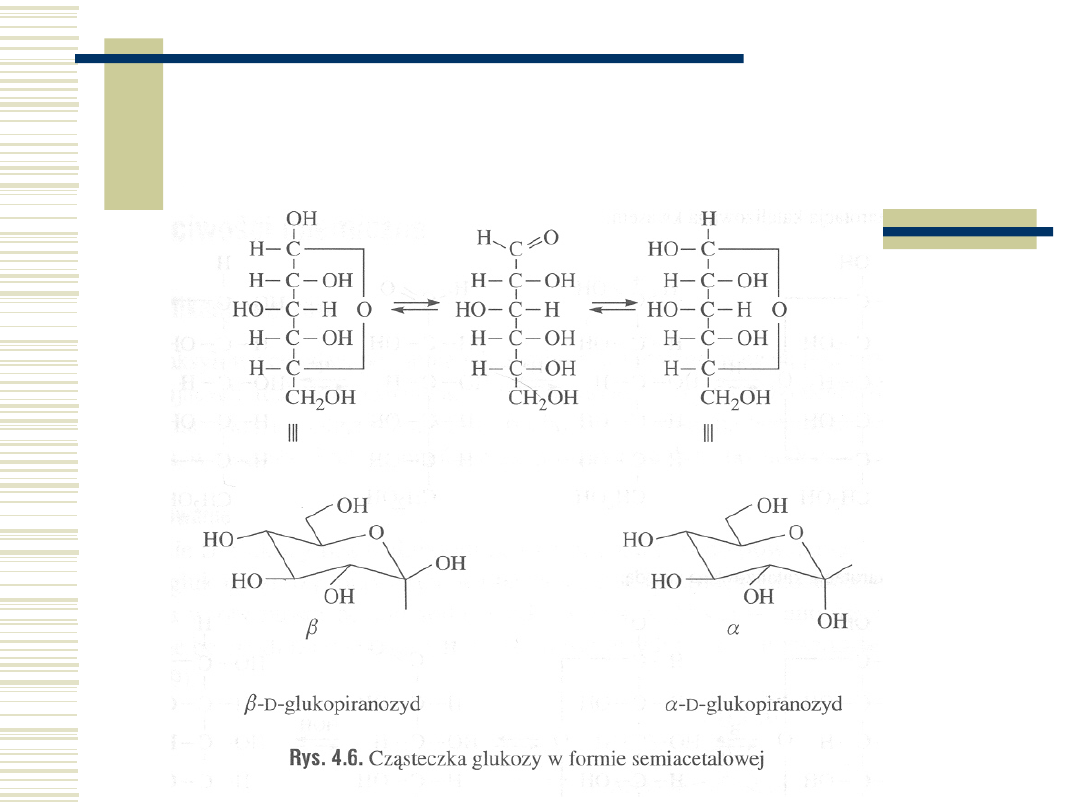
10.05.21
45
Mutarotacja cukrów
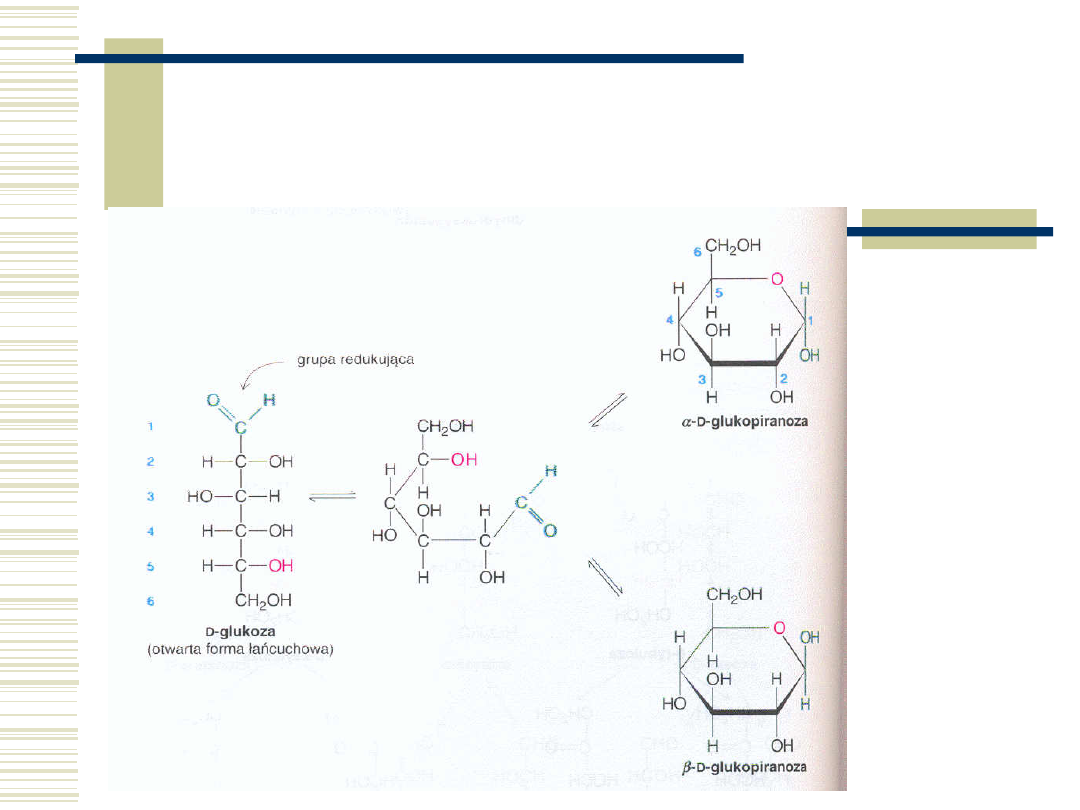
10.05.21
46
Mutarotacja cukrów c.d.
10.05.21
47
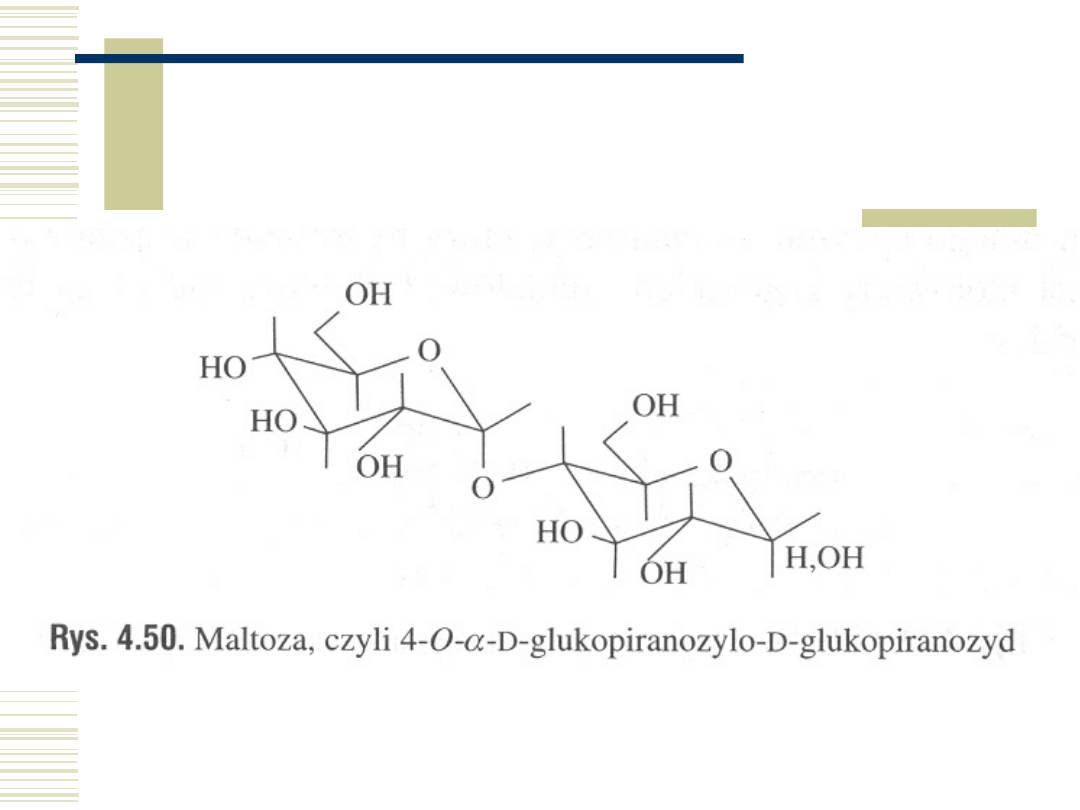
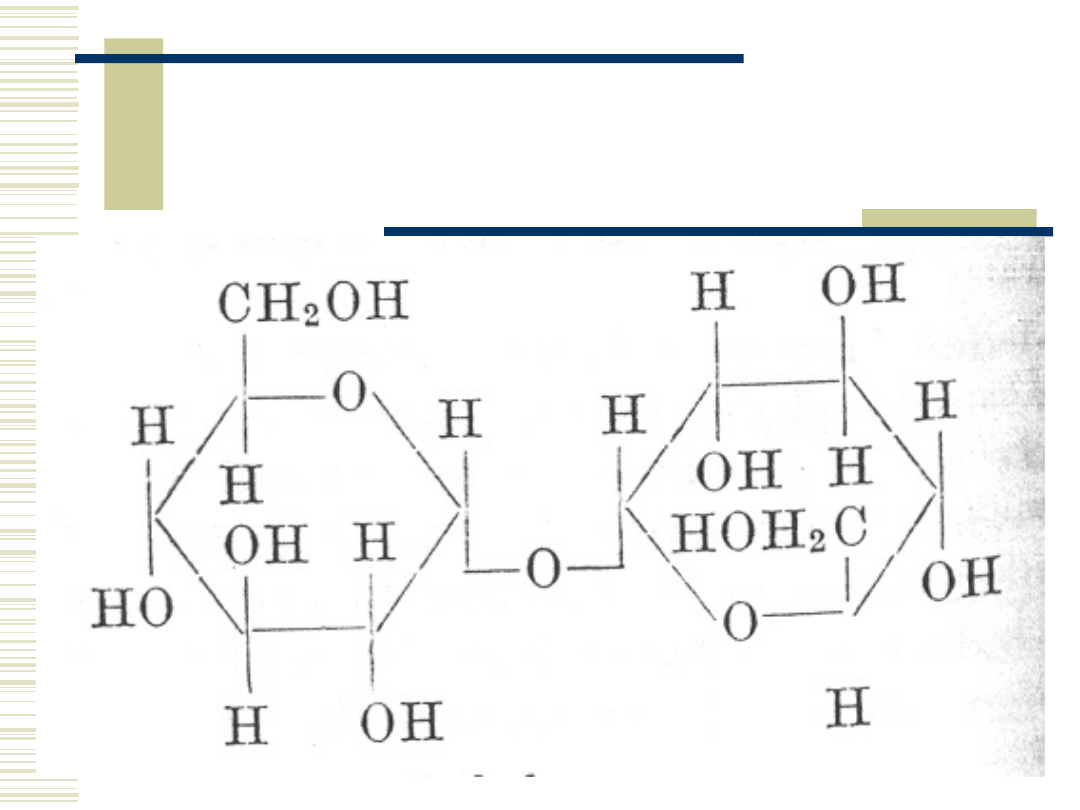
Maltoza
10.05.21
48
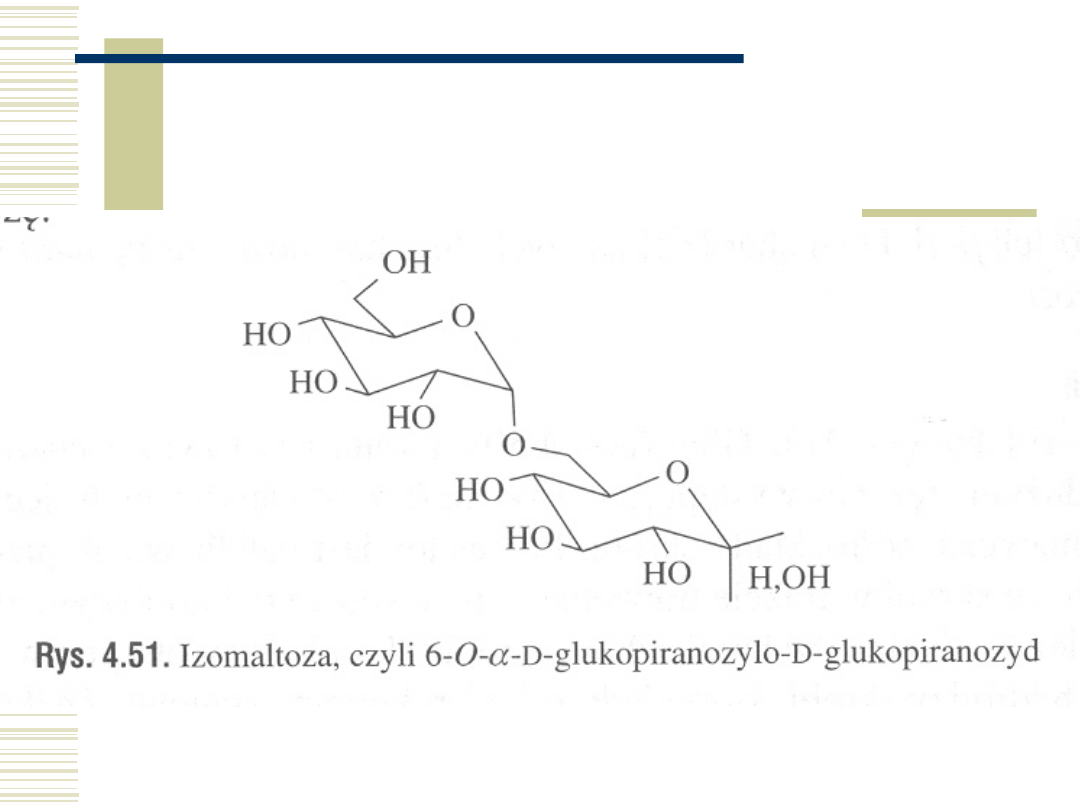
Izomaltoza
10.05.21
49
Trehaloza

10.05.21
50
Epimeryzacja cukrów
10.05.21
51
Kwasowe syropy
skrobiowe

10.05.21
52
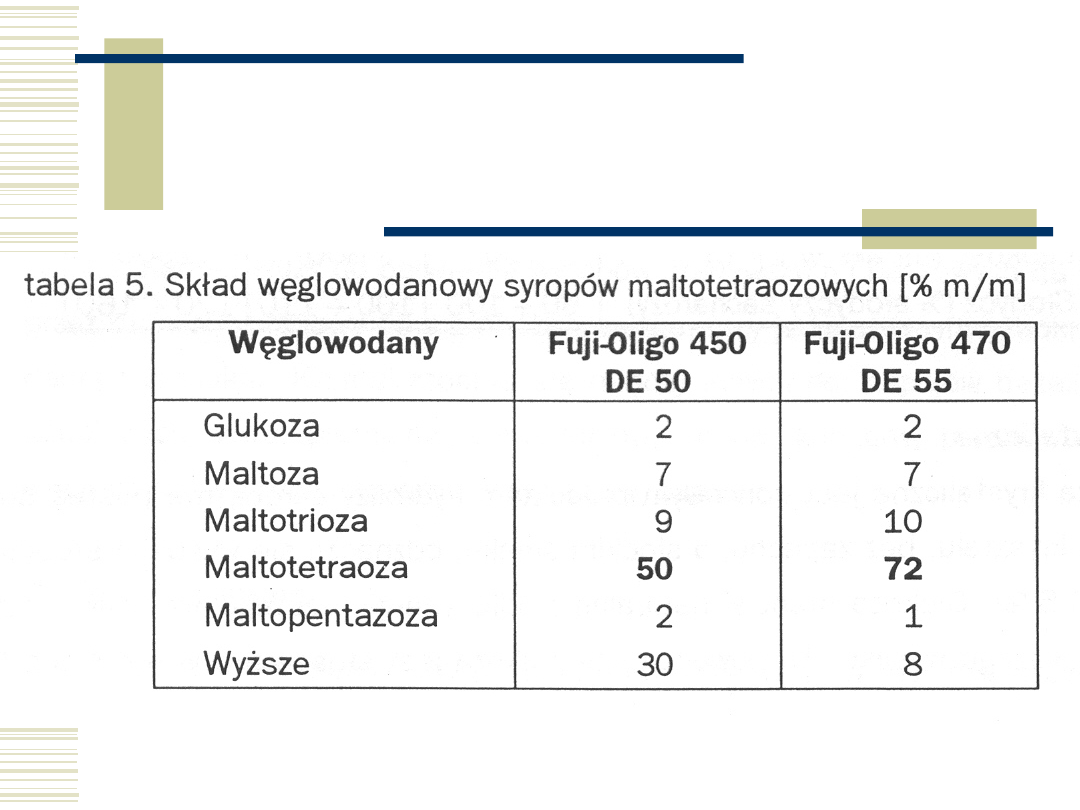
Enzymatyczne syropy
skrobiowe
Glukozowy
DE = 70 - 99,4
zaw. glukozy 55-97%
Maltozowy
DE = 35 - 45
zaw. maltozy 35-45%
Wysokomaltozowy
DE = 35 - 50
zaw. maltozy 45-60%
Ekstra
wysokomaltozowy
DE = 45 - 60
zaw. maltozy 70-85%
Maltotetraozowy I
generacji
DE = 50
zaw. maltotetraozy 50%
Maltotetraozowy II
generacji
DE = 55
zaw. maltotetraozy 72%
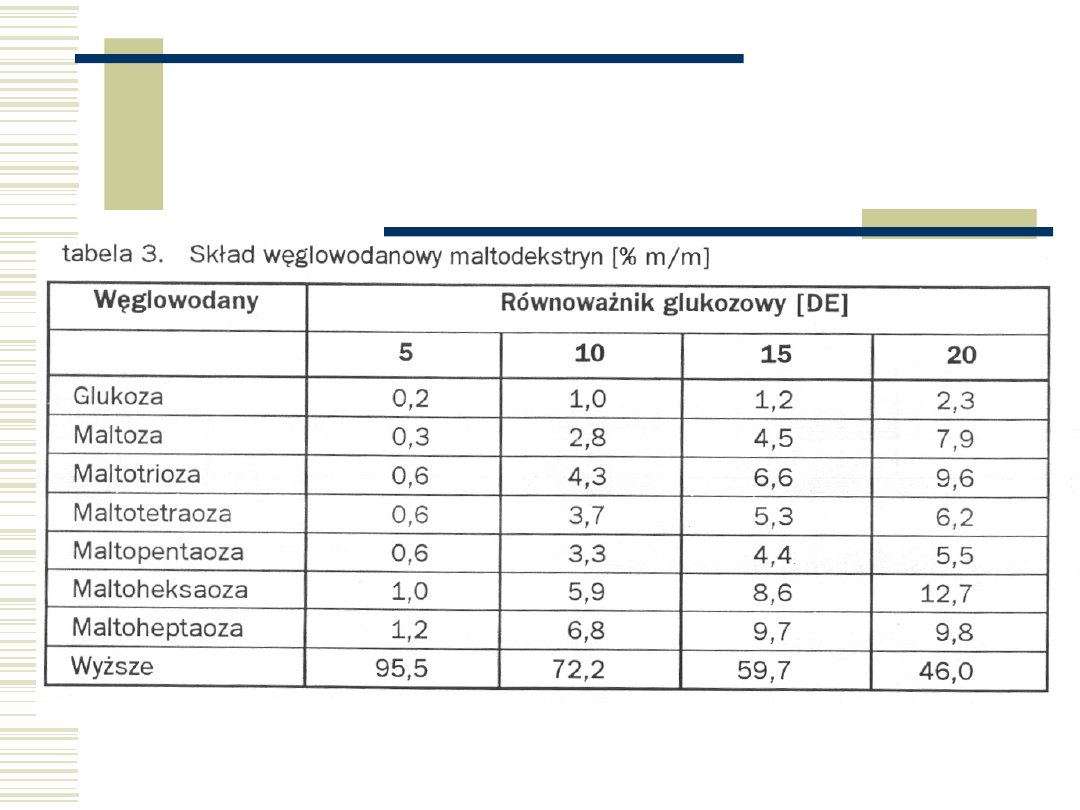
Fruktozowy I generacji
DE = 95
zaw. fruktozy 42%
Fruktozowy II generacji
DE = 95
zaw. fruktozy 55%
Fruktozowy III
generacji
DE = 95
zaw. fruktozy 90%
10.05.21
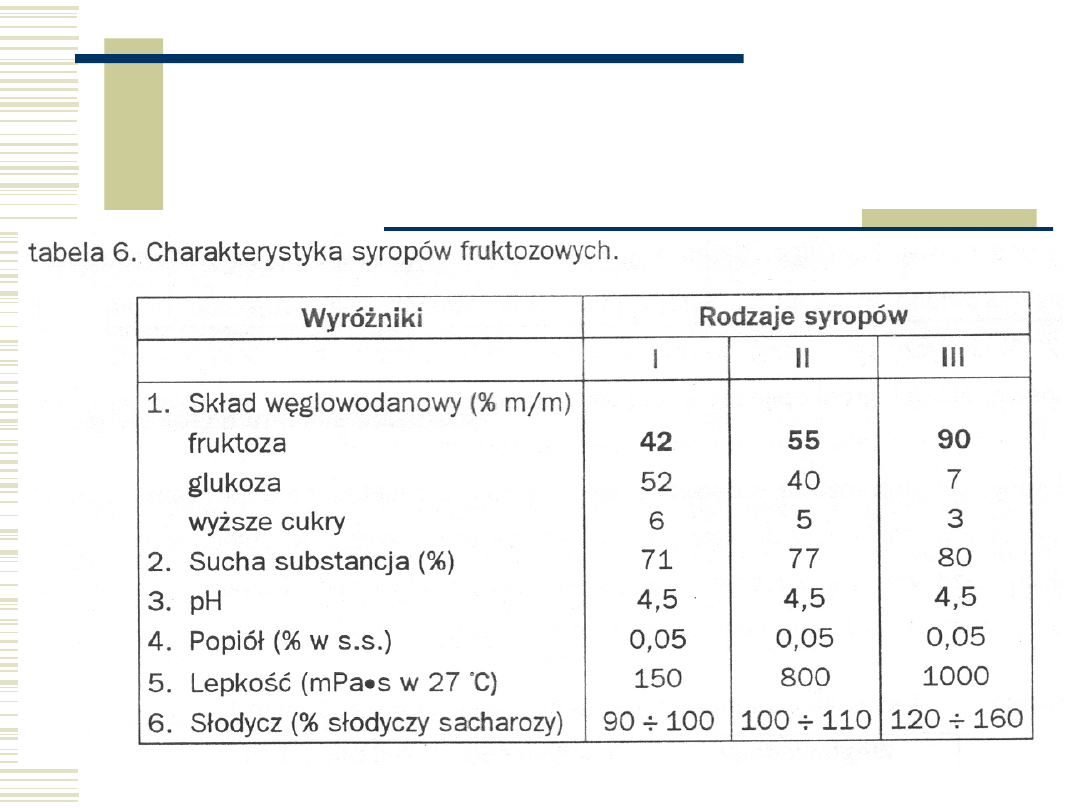
53
Enzymatyczne syropy
maltotetraozowe
10.05.21
54
Enzymatyczne syropy
fruktozowe
10.05.21
55
Maltodekstryny

10.05.21
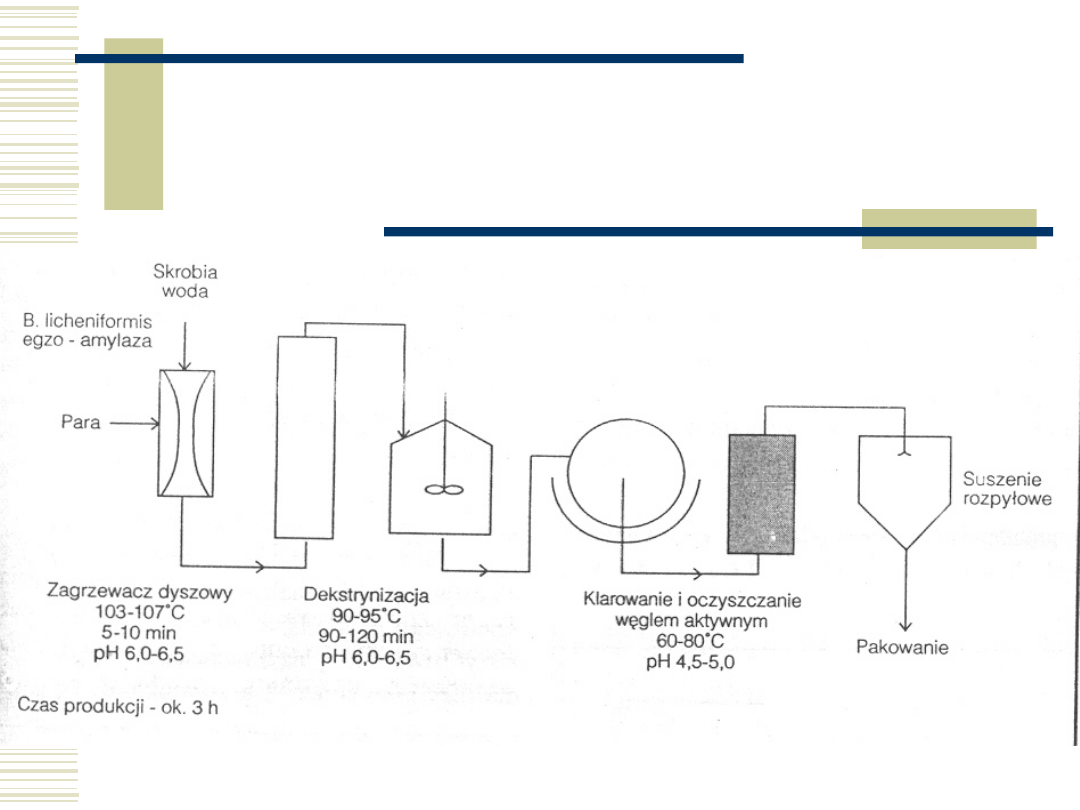
56
Funkcjonalność
hydrolizatów skrobiowych
10.05.21
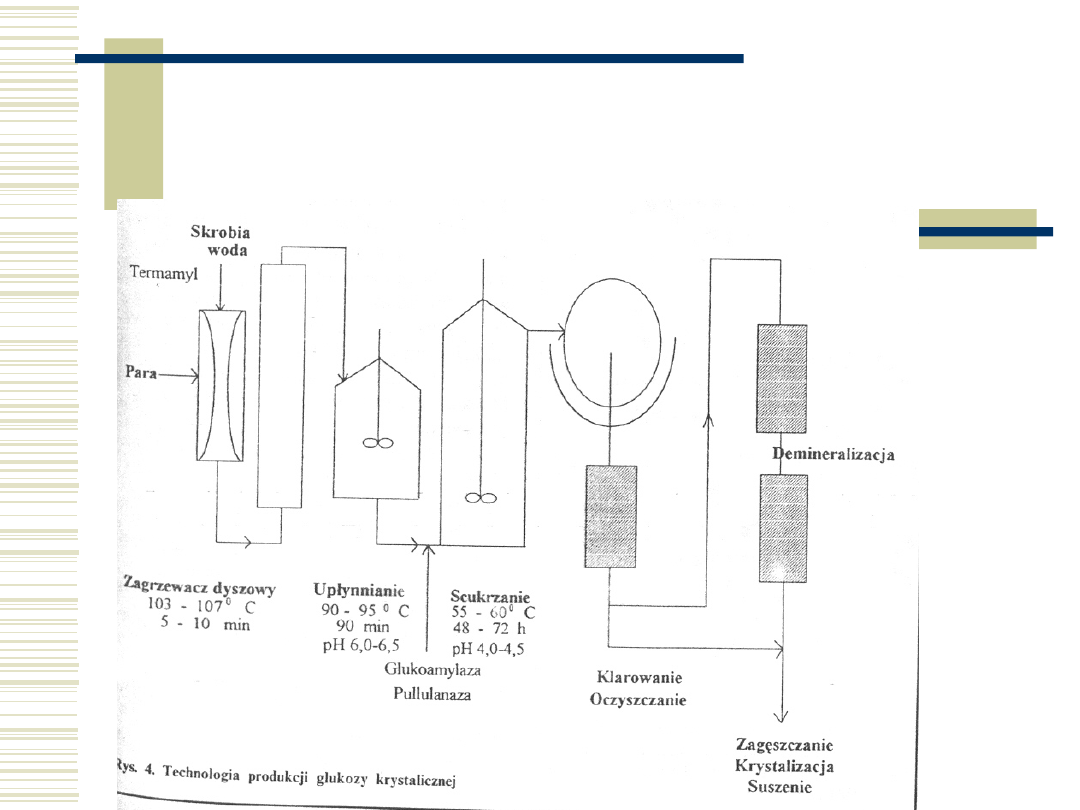
57
Schemat technologiczny
produkcji maltodekstryn
10.05.21
58
Schemat technologiczny
produkcji glukozy
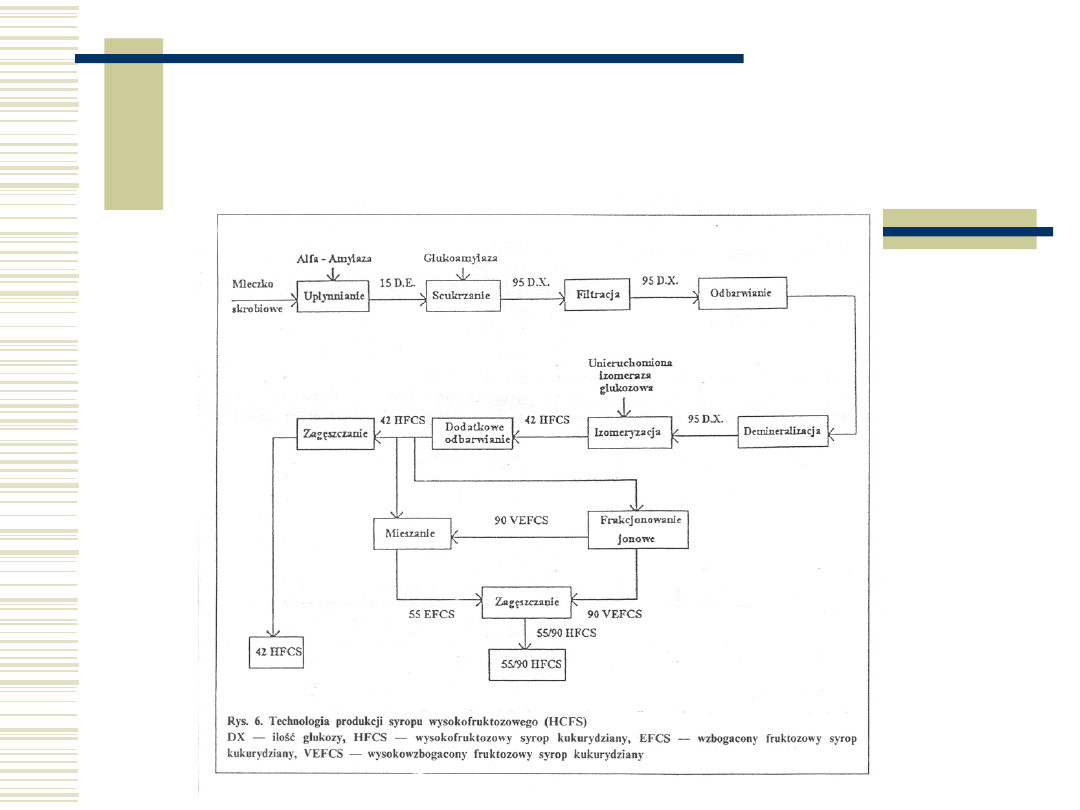
10.05.21
59
Schemat technologiczny
produkcji syropu
fruktozowego

10.05.21
60
Schemat technologiczny
produkcji cyklodekstryn
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
Wyszukiwarka
Podobne podstrony:
hydroliza enzymatyczna
(), Biochemia L, sprawozdanie Hydroliza enzymatyczna białka (ćw H)(1)
Hydroliza enzymatyczna OTŻ
Otrzymywanie i?danie właściwości fizykochemicznych hydrolizatów skrobi 16
Hydroliza lipidów mleka za pomocą lipazy trzustkowej, Biotechnologia Enzymatyczna
hydroliza skrobii, przyda sie do szkoły, biotechnologia
instrukcja kinetyka enzymatyczna - inwertaza, [1] Hydroliza sacharozy
cwiczenie 2 hydrolazy czynniki wplywajace na szybkosc reakcji enzymatycznych 15 05 2014
HYDROLIZA SKROBI. 5fantastic.pl , Ćwiczenia(1)
Enzymatyczna hydroliza pektyn poprawione
Enzymatyczna hydroliza tłuszczów
Otrzymywanie i?danie właściwości fizykochemicznych hydrolizatów skrobi 16
więcej podobnych podstron