
-1-
ANALIZA POLIMERÓW
Kolokwium: Przed przystąpieniem do ćwiczenia studenci zdają kolokwium obejmujące
materiał z instrukcji oraz podstawowe informacje z dziedziny spektroskopii IR oraz
NMR. Studenci zostaną poproszeni o narysowanie wzorów chemicznych znanych im
polimerów. Następnie prowadzący poprosi o zaproponowanie metod rozróżnienia
dwóch wybranych polimerów na podstawie prostych testów oraz podania
spodziewanych różnic w widmach IR i NMR.
Wykonanie ćwiczenia Analiza Polimerów
1.
Dla próbek 1-5, na podstawie prostych testów określić:
- czy polimer zawiera struktury aromatyczne ?
- czy zawiera atomy chlorowców ?
- czy zawiera azot?
- na podstawie zachowania w cieczach o różnej gęstości (tonie/pływa) określić w
przybliżeniu gęstość badanych polimerów
- zaproponować grupę polimerów do której należy badana próbka.
Po uzyskaniu prawidłowej odpowiedzi, dostaną Państwo widma IR, które posłużą do
porównania z atlasem widm. Należy podać nazwę systematyczną polimeru, narysować
jego wzór chemiczny, podać nazwy handlowe oraz producentów. W sprawozdaniu
należy również załączyć krótką charakterystykę polimeru (metody otrzymywania,
zastosowania itp.).
2.
Próbka nr 6 jest kopolimerem.
Należy:
- wykonać proste testy (jak w punkcie 1) oraz zaproponować grupę polimerów do której
należy badana próbka.
- na podstawie widma IR podać nazwę, wzór chemiczny i nazwy handlowe kopolimeru,
- na podstawie widma
1
H NMR określić zawartość procentową poszczególnych
monomerów w polimerze,
- W sprawozdaniu należy również załączyć krótką charakterystykę kopolimeru (metody
otrzymywania, zastosowania itp.).

-2-
1. WSTĘP
Analiza polimerów różni się znacznie od typowej analizy związków organicznych.
Jest to spowodowane ich charaktery
stycznymi cechami fizycznymi takimi jak: duży ciężar
cząsteczkowy, polidyspersyjność, różny stopień krystaliczności, różny stopień rozgałęzień itp.
Często przedmiotem badań są próbki użytkowe, zawierające prócz polimeru:
wypełniacze, plastyfikatory, stabilizatory, pigmenty itp. dodatki. Utrudnia to analizę, gdyż w
tym przypadku trzeba najpierw z całej kompozycji wydzielić polimer.
Analiza składa się z trzech zasadniczych etapów:
1) przygotowanie próbki,
2) wydzielenie polimeru,
3)
analiza właściwa.
Przygotowanie próbki
Najbardziej korzystną do badań postacią polimeru jest proszek. Jeśli otrzymanie
proszku jest niemożliwe, należy próbkę jak najbardziej rozdrobnić w inny sposób, np. przez
pocięcie jej, lub zmielenie w młynku z dodatkiem suchego lodu. Należy zwrócić uwagę na to,
aby w czasie rozdrabniania nie nastąpiło rozgrzewanie się próbki. Może to bowiem
doprowadzić do różnych zmian chemicznych.
Wydzielenie polimeru
Aby analiza dała właściwe wyniki należy badać polimer w formie czystego
indywiduum chemicznego.
W tym celu trzeba go z całej kompozycji wydzielić. Zasadniczymi
składnikami użytkowych kompozycji poza polimerem są: plastyfikatory, stabilizatory,
pigmenty, środki smarujące, wypełniacze, środki powierzchniowo-czynne i nośniki.
Podstawową metodą wydzielania polimeru jest rozpuszczenie próbki w odpowiednim
rozpuszczalniku. Wypełniacze, stabilizatory i nośniki, które są substancjami nieorganicznymi,
na ogół nie rozpuszczają się i pozostają jako osad w roztworze polimeru. Po oddzieleniu
osadu polimer wytrąca się z roztworu nierozpuszczalnikiem, w którym pozostają inne
składniki organiczne kompozycji jak np. plastyfikatory. Plastyfikatory mogą być usunięte z
polimeru także metodą ekstrakcji odpowiednim nisko wrzącym rozpuszczalnikiem. Należy
przy tym zwrócić uwagę, aby rozpuszczalnik ten nie rozpuszczał polimeru nawet częściowo
ani nie był przez polimer absorbowany.
Dobór rozpuszczalników i nierozpuszczalników odbywa się metodą prób i błędów lub
na podstawie pewnych wiadomości o badanym materiale. Polimer może się czasem wytrącać
w formie emulsji. W takim przypadku, przed odsączeniem polimeru emulsję należy

-3-
skoagulować przez dodanie odpowiednich soli nieorganicznych, dializę lub oziębienie
roztworu. Po oddzieleniu wytrąconego polimeru przez odsączenie lub odwirowanie, należy go
kilkakrotnie przemyć wytrącalnikiem, a następnie dobrze wysuszyć w temperaturze
pokojowej, stosując zmniejszone ciśnienie.
Dobierać należy wytrącalniki możliwie bardzo lotne, aby je łatwo można było usunąć
bez podwyższenia temperatury. Wyższa temperatura może doprowadzać do nieodwracalnych
zmian takich jak sieciowanie czy degradacja.
Analiza właściwa
Do przeprowadzenia analizy polimeru są stosowane następujące metody:
1) analiza elementarna,
2)
badanie zachowania się polimeru w płomieniu,
3) piroliza,
4)
badanie rozpuszczalności,
5) próba Libermanna - Storcha - Morawskiego,
6) oznaczenie temperatury przemian,
7)
oznaczenie gęstości,
8) spektrofotometria absorpcyjna w podczerwieni.
2. ANALIZA ELEMENTARNA
Oprócz węgla, wodoru i tlenu w skład wielu polimerów wchodzą: azot, chlorowce,
siarka i krzem. Analiza elementarna ma na celu określenie z jakich pierwiastków składa się
badany polimer.
Próba Lassaingne'a - wykrywanie azotu, siarki i chlorowców
Około 0,5 g substancji praży się ostrożnie z kawałeczkiem sodu wielkości ziarnka
grochu w małej probówce. Gorącą probówkę zanurza się następnie w kilku cm
3
wody
destylowanej (zachować ostrożność). Rurka pęka a wydzielający się pod działaniem
nieprzereagowanego sodu wodór zapala się. Roztwór sączy się i dzieli na trzy części.
Jeżeli substancja przy mieszaniu lub ogrzewaniu z sodem wybucha, postępuje się w
sposób następujący: 0,1 g substancji rozpuszcza się w 1-2 cm
3
kwasu octowego i dodaje 0,1
g pyłu Zn. Ogrzewa się do łagodnego wrzenia aż cały cynk przejdzie do roztworu. Następnie
roztwór odparowuje się do sucha i pozostałość stapia z sodem.
Wykrywanie azotu
Do jednej części przesączu dodaje się kilka kryształów siarczanu żelazawego FeSO
4
,

-4-
gotuje kilka minut, dodaje następnie 1-2 krople roztworu chlorku żelazowego FeCl
3
i gotuje
ponownie. Odczyn roztworu musi być zasadowy. Jeśli po zakwaszeniu roztworu kwasem
solnym wytrąca się niebieski osad błękitu pruskiego to badana substancja zawiera azot. W
przypadku, gdy zawartość azotu jest bardzo mała, pojawia się jedynie niebiesko-zielone
zabarwienie, przy czym niekiedy dopiero po upływie kilku godzin wydzielają się niebieskie
kłaczki. W czasie wykrywania zachodzą następujące reakcje:
N
org
CN
-
CN
-
+ Fe
2+
[Fe(CN)
6
]
-4
Fe(CN)
6
-4
+ Fe
3+
Fe
4
[Fe(CN)
6
]
3
Można także po dodaniu FeSO
4
i zagotowaniu dodać kwasu azotowego, który utleni
nadmiar Fe
2+
na Fe
3+
. Końcowy efekt jest taki sam jak opisany poprzednio.
Wykrywanie siarki
1. Część otrzymanego przesączu rozcieńcza się niewielką ilością wody i zadaje się
świeżo przygotowanym 1%-owym wodnym roztworem nitroprusydku sodu
(Na
2
(NO)Fe(CN)
5
. Jeśli występuje zabarwienie fioletowe przechodzące najczęściej w
krwistoczerwone, to substancja zawiera siarkę.
2. Kilka cm
3
roztworu zakwasza s
ię kwasem octowym i dodaje kilka kropel roztworu
octanu ołowiawego Pb(CH
3
COO)
2
. W obecności siarki wytrąca się czarny osad siarczku
ołowiu PbS.
Wykrywanie chlorowców
Przesącz zakwasza się rozcieńczonym kwasem azotowym a następnie dodaje roztworu
azotanu srebra (AgNO
3
). Wydzielający się osad halogenku srebra świadczy o obecności
chlorowca w badanym polimerze.
Wykrywanie bromu w obecności innych chlorowców
Około 0,5 cm
3
roztworu zakwasza się kilkoma kroplami kwasu siarkowego i miesza z
3-5 cm
3
stężonego roztworu nadmanganianu potasu. Następnie zakrywa się naczynie bibułą
nasyconą fluoresceiną i ogrzewa roztwór do temperatury 50
0
C. Po 15 minutach umieszcza się
tę bibułę w parach amoniaku. W obecności bromu bibuła zabarwia się na kolor
różowoczerwony.
Wykrywanie fluoru
2 cm
3
roztworu zakwasza się kwasem octowym i zagotowuje. 1-2 krople roztworu
umieszcza się na papierku cyrkonowoalizarynowym. W obecności fluoru papierek odbarwia
się lub ma zabarwienie żółte.

-5-
Próba Beilsteina
Małą próbkę substancji nabiera się na drucik platynowy lub na kawałek zwiniętej
siatki miedzianej, na których umieszczono poprzednio niewielką ilość tlenku miedziowego
(CuO) i ogrzewa w nieświecącym płomieniu palnika Bunzena. Jeśli płomień zabarwia się na
zielono, to substancja zawi
era chlorowiec. Czyste zabarwienie zielone świadczy o obecności
jodu, bardziej niebieskozielone o obecności chloru lub bromu. Przed wykonaniem próby
tlenek miedziowy i siatkę miedzianą należy prażyć tak długo, aż w płomieniu nie będzie już
zupełnie występować zielone zabarwienie.
Próba Beilsteina nie zawsze jest pewna. Znane są związki zawierające równocześnie
siarkę i azot a nie zawierające chlorowca, które dają pozytywny wynik reakcji.
Próba z tlenkiem wapniowym
Małą próbkę substancji miesza się z około 5-krotną ilością wolnego od chlorowców
czystego tlenku wapniowego, mieszaninę umieszcza się w wąskiej probówce i praży w
płomieniu palnika Bunsena. Gorącą probówkę zanurza się w zimnej wodzie przy czym
probówka pęka. Po przesączeniu i zakwaszeniu roztworu kwasem azotowym do przesączu
dodaje się wodny roztwór azotanu srebra (AgNO
3
). W obecności chlorowca strąca się
chlorowcowa sól srebra.
Tabela IV-1.
Klasyfikacja polimerów w zależności od ich składu elementarnego (1)
Węgiel i wodór
Polimery
poliolefiny
polietylen
polipropylen
polibutadien
poliizopren
polistyren
Pierwiastki (węgiel,
wodór, tlen)
Polimery

-6-
żywice fenolowe
poliestry
polietery
inne
żywice fenolowo-formaldehydowe
żywice fenolowo-furfurylowe
żywice krezolowe i ksylenolowe
poliestry kwasu ftalowego (gliptale)
poliestry kwasu izo i tereftalowego
żywice poliestrowe nienasycone
żywice poliestrowe kwasu maleinowego
poliestry winylowe (polioctan winylu)
poliestry allilowe
poliestry kwasu akrylowego
poliestry kwasu metakrylowego (polimetakrylan metylu)
estry celulozy
poliwęglany
alifatyczne polietery: polioksyetylen
żywice epoksydowe
polietery winylowe
polietery allilowe
etery celulozy
polialkohol winylowy
poliwinyloacetale
Pierwiastki (oprócz
węgla, tlenu i wodoru)
Polimery
azot
chlor
fluor
brom
siarka
azot i siarka
azotan celulozy
poliakrylonitryl
polimetakrylonitryl
poliamidy
żywice aminowo-formaldehydowe
żywice mocznikowo-formaldehydowe
żywice melaminowo-formaldehydowe
poliuretany
kauczuk butadienowo-akrylonitrylowy
niewulkanizowany
poliwinylokarbazol
poliwinylopirolidon
chlorokauczuk naturalny i syntetyczny
niewulkanizowany
polichlorek winylu
polichlorek winylidenu
policzterofluoretylen-teflon
żywice epoksydowe z bromowanego dianu
kauczuk wulkanizowany
polisulfony
żywice kondensacyjne tiofenolowe
żywice tiomocznikowo-formaldehydowe

-7-
3.BADANIE W PŁOMIENIU
Około 0,2 g próbki umieszcza się na łopatce i wkłada do zewnętrznej części palnika
Bunsena. Notuje się kolor płomienia, łatwość palenia, samogaśnięcie, zapach, odczyn
ulatniających się gazów oraz pozostałość po całkowitym spaleniu. Próbkę należy ogrzewać
wolno. Jeśli płomień jest za duży, rozkład następuje zbyt szybko, aby zaobserwować
zachodzące zjawiska.
Polimery, które ro
zkładają się w czasie palenia z wydzieleniem węglowodorów
aromatycznych, palą się żółtym kopcącym płomieniem, te które rozkładają się na
węglowodory alifatyczne palą się z kopceniem niewielkim lub płomieniem niekopcącym. Ze
wzrostem zawartości tlenu płomień staje się coraz bardziej niebieski.
Kwaśny lub zasadowy charakter wydzielających się gazów może być określony za
pomocą zmoczonego papierka wskaźnikowego uniwersalnego umieszczonego w badanych
parach.
W celu określenia zapachu wydzielających się gazów próbkę po kilku sekundach
utrzymywania w płomieniu wyjmuje się z niego i określa charakter zapachu. Jeśli próbka po
wyciągnięciu z płomienia pali się, należy płomień zgasić i dopiero potem określić zapach.
Na zakończenie analizy w płomieniu należy próbkę spalić do końca w silnym płomieniu w
celu zbadania czy następuje spalenie całkowite czy pozostaje popiół. Ewentualne pozostałości
badać można metodami mikrochemicznymi lub mikroskopowymi.
3.1. Identyfikacja polimerów na podstawie zachowania się w płomieniu (1,2,3)
Polimer nie pali się
1. Brak innego zapachu -
, próbka zachowuje swój kształt, we wszystkich przypadkach czuje
się zapach formaldehydu.
żywica mocznikowo-formaldehydowa
2. Silny rybi zapach -
.
3. Zapach fenolu -
żywica melaminowo-formaldehydowa.
żywica fenolowo-formaldehydowa.
Polimer pali się w płomieniu,
1. Płomień ma zielone zabarwienie;
ale po wyjęciu z płomienia gaśnie.
a) zapach palonej gumy,
- zielona obwódka - hydrochlorokauczuk,
-8-
-
zielona obwódka otoczona żółtą -
b) zapach ostry lecz nie taki jak przy palonej gumie -
neopren,
c) zapach słodki, czarny popiół -
pochodne chlorku winylu,
2. Zapach spalonego mleka -
polichlorek winylidenu.
kazeina.
Polimer pali się po wyjęciu z płomienia.
1. Palenie bardzo gwałtowne z intensywnym płomieniem,
Obserwuje się płomień podczas pierwszych
sekund palenia.
a) zapach kamfory -
b) brak zapachu kamfory -
azotan celulozy plastyfikowany,
2. Płomień głównie niebieski z małym białym końcem,
azotan celulozy.
a)
bardzo słodki owocowy zapach -
b)
zapach przypomina palone włosy, lub róg, płomień jest prawie cały niebieski -
metakrylany,
c)
słaby słodki zapach -
poliamid,
d)
zapach zjełczałego masła,
poliwinyloformal,
-
płomień iskrzący -
- brak iskier -
octano-
maślan celulozy,
3. Płomień otoczony przez czerwoną obwódkę, iskrzący, zapach kwasu octowego -
poliwinylobutyral.
4. Płomień żółty, luminescencja,
poliwinyloacetal.
a)
zapach kwasu masłowego -
b) zapach
słodki, kwiatowy, płomień kopcący -
octanomaślan celulozy,
c)
słaby słodki zapach -
polistyren,
d) zapach palonego papieru -
poliwinyloformal,
5. Płomień z żółto-zieloną obwódką,
celuloza.
a)
Pali się bardzo trudno i iskrzy, zapach kwasu octowego. Stopiony palący się
materiał wkroplony do wody tworzy ciężkie brązowo-czarne pieniące się granulki
lub płatki -
b)
palenie zaczyna się od razu, występuje słaby słodki zapach, stopiony polimer
wkroplony do wody tworzy płaskie dyski, które są jasnoorzechowe, jeśli polimer
nie był zabarwiony -
octan celulozy,
etyloceluloza.
-9-
4. PIROLIZA
Pirolizę najlepiej prowadzić w zamkniętym naczyniu pod zmniejszonym ciśnieniem w
określonej temperaturze. Otrzymuje się wtedy najbardziej powtarzalne wyniki. Jeżeli
aparatura taka jest połączona ze spektrofotometrem w podczerwieni lub chromatografem
gazowym, można otrzymać informacje odnośnie budowy polimeru.
W najprostszych warunkach wydzielające się podczas pirolizy gazy wprowadza się do
naczynia z odpowiednimi odczynnikami i obserwuje wys
tępujące efekty, zestawione w tabeli
IV-2.
Tablica IV-2.
Klasyfikacja polimerów na podstawie wydzielających się gazów i par.
Wydzielające się gazy i pary
wykazują następujące reakcje
Substancje
osad lub zmętnienie z AgNO
3
reakcja kwaśna
osad lub zmętnienie z BaCl
3
obecność kwasu octowego
obecność innych organicznych
kwasów
reakcja alkaliczna
polichlorek winylu, polichlorek winylidenu
naturalny i syntetyczny chlorowany kauczuk
neopren
polisulfony
wulkanizowany naturalny lub syntetyczny kauczuk
polioctan winylu, octan celulozy
poliestry winylowe, estry celulozy,
politetrafluoroetylen, polichlorotrifluoroetylen
produkty kondensacji aldehydowej z mocznikiem,
melaminą ,poliamidy
Można także prowadzić pirolizę polimerów wobec kwasu siarkowego.
Tablica IV-3. Klasyfikacja polimerów na podstawie pirolizy.
Reakcja
Polimer
zapach kwasu octowego
ogrzewanie z 25% H
2
SO
4
zapach aldehydu butylowego
zapach aldehydu benzylowego
zapach formaliny
zapach kamfory
odporne
ogrzewanie z 80% H
2
SO
4
rozkład
polioctan winylu
octan celulozy
octanomaślan celulozy
butwar (poliwinylobutyral)
benzyloceluloza
żywice fenolowe, mocznikowe, poliwinyloformal
azotan celulozy plastyfikowany
polietylen, poliizobutylen, polichlorek winylu,
polichlorotrifluoroetylen
kauczuk naturalny, polichloropren, poliakrylonitryl,
poliestry, kauczuk silikonowy

-10-
5. BADANIE ROZPUSZCZALNOŚCI
Rozpuszczalność polimerów jest jedną z ich charakterystycznych cech. Polimery na
ogół rozpuszczają się bardzo wolno, a proces rozpuszczania przechodzi przez etap pęcznienia.
Rozpuszczalność jednego polimeru w określonym rozpuszczalniku może się zmieniać w
zależności od ciężaru cząsteczkowego rozgałęzień i stopnia krystaliczności. Wzrost ciężaru
cząsteczkowego i stopnia krystaliczności zmniejsza rozpuszczalność, natomiast rozgałęzienia
cząsteczek rozpuszczalność zwiększają. Polimery usieciowane mogą jedynie pęcznieć.
5.1. Schemat analizy jakościowej polimerów na podstawie ich rozpuszczalności w
rozpuszczalnikach organicznych
Rozpuszczalne w toluenie: etyloceluloza, benzyloceluloza, polistyren, polimetakrylan
metylu, kopolimery akrylanu metylu i chlorku winylu, żywice kumaronowe, materiały
bitumiczne, chlorowany kauczuk, plastyfikatory.
Próbkę polimeru ogrzewać pod chłodnicą zwrotną w toluenie
Oddestylować toluen przez powolne ogrzewanie na łaźni wodnej.
Nierozpuszczalne w metanolu
Zalać metanolem i ogrzewać pod chłodnicą zwrotną.
benzyloceluloza, polistyren, polikwas akrylowy,
polimetakrylan metylu, żywice kumaronowe,
materiały bitumiczne, chlorowany kauczuk,
kopolimery
Rozpuszczalne w metanolu
Zalać eterem etylowym
etyloceluloza, plastyfikatory
Doda
ć nadmiar eteru naftowego
benzyloceluloza,
kopolimery,
chlorokauczuk,
materiały bitumiczne
(częściowo).
Nierozpuszczalne w
eterze etylowym:
polistyren, żywice
kumaronowe,
kopolimery (częściowo),
materiały bitumiczne
(częściowo)
Rozpuszczalne w eterze
etylowym:
etyloceluloza.
Sprawdzić drogą
identyfikacji grup
etylowych oraz na
podstawie
rozpuszczalności
Osad:
Plastyfikatory. Po
oddestylowaniu
rozpuszczalnika
badać pozostałość
metodami
fizycznymi
Roztwór:
Zalać mrówczanem
metylu
Oddestylować eter etylowy a pozostałość
ekstrahować eterem naftowym

-11-
chlorokauczuk,
polichlorek winylu,
materiały bitumiczne
tworzą ciemną
pozostałość
Nierozpuszczalne w
mrówczanie metylu
benzyloceluloza
częściowo kopolimery
Rozpuszczalne w
mrówczanie metylu
polistyren,
Nierozpuszczalne w
eterze naftowym
częściowo
kopolimery
żywice kumaronowe
Rozpuszczalne w
eterze naftowym
Nierozpuszczalne w toluenie:
żywice fenolowe, kazeinowe, mocznikowe i inne aminowe,
alkidowe, celuloza, azotan celulozy, octan celulozy, polichlorek winylu
O
dpędzić toluen na łaźni wodnej a pozostałość zalać mrówczanem metylu i podgrzewać pod
chłodnicą zwrotną
żywice fenolowe, kazeinowe, mocznikowe,
alkidowe, celuloza, polichlorek winylu
Nierozpuszczalne w mrówczanie metylu:
Oznaczenie:
azotan i octan celulozy.
Rozpuszczalne w mrówczanie metylu:
Oddestylować rozpuszczalnik a pozostałość
zalać mrówczanem amylu: (t.w. 116
0
C)
żywice fenolowe: ogrzewać z NaOH -
występuje zapach fenolu i charakterystyczne
zabarwienie
żywice aminowe: mocznikowe,
tiomocznikowe: ogrz
ewać z NaOH,
występuje zapach amoniaku, pozytywny
wynik próby na siarkę - żywice
tiomocznikowe
żywice kazeinowe: destylacja z rozkładem
zapach palonych włosów, ogrzewanie z
NaOH - zapach amoniaku
żywice alkidowe: barwne reakcje na kwasy.
celuloza próba w p
łomieniu - zapach
palonego papieru.
polichlorek winylu: pozytywna reakcja na
chlor.
octan celulozy
Nierozpuszczalny w
mrówczanie amylu:
azotan celulozy
Rozpuszczalne w
mrówczanie amylu:

-12-
Tabela IV-4.
Klasyfikacja polimerów na podstawie rozpuszczalności
Polichlorek winylu
-
-
-
+
-
+
-
+
-
-
-
-
-
x
-
-
+
+
Polichlorek winylidenu
-
-
-
cz
-
-
(+)
-
-
-
-
-
Polioctan winylu
-
+
+
+
+
+
+
+
+
+
+
+
+
x
+
+
+
Polialkohol winylowy
+
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Poliwinylobutyral
-
cz
+
(+)
+
+
(+)
cz
+
+
-
+
Poliwinyloformal
-
cz
+
+
+
+
-
cz
cz
-
Etyloceluloza
-
cz
+
+
+
cz
+
+
+
+
+
Octan celulozy
-
+
+
+
-
-
+
-
+
-
-
+
+
-
-
-
+
-
Metyloceluloza
+
-
-
x
x
x
x
-
-
Benzyloceluloza
-
cz
+
+
-
+
+
-
+
+
-
Acetylomaślan celulozy
-
+
+
+
-
+
+
-
-
x
Ż.fenolowo-formald.
-
+
-
-
-
-
+
+
+
+
+
Ż.mocznikowo-formald.
-
-
-
-
-
(+)
-
+
-
-
-
-
-
Ż.melaminowo-formald.
-
-
-
-
(+)
-
+
-
-
-
-
-
Polimetakrylan metylu
-
+
+
+
+
+
+
+
+
cz
+
-
-
+
-
Polietylen
-
-
-
-
(+)
-
(+)
(+)
-
-
-
-
-
-
-
-
-
-
(+)
Poliamid
-
-
-
-
-
-
-
-
+
+
+
-
-
-
-
-
-
Polistyren
-
x
x
+
+
+
(+)
+
-
-
-
-
+
+
+
x
-
-
+
Poliuretany
-
-
-
-
-
-
-
+
+
-
-
-
-
Policzterofluoroetylen
-
-
-
-
-
-
-
-
-
-
-
-
-
Azotan celulozy
-
+
+
NaOH, octan amylu metyloetyloketon
+ - rozpuszczalny, - - nierozpuszczalny, (+) -
rozpuszczalny na gorąco, cz - rozpuszczalny częściowo, x - pęcznieje

-13-
6. REAKCJA LIEBERMANA-STORCHA MORAWSKIEGO
Wiele polimerów po potraktowaniu ich bezwodnikiem octowym i kwasem siarkowym
tworzy barwne pochodne. Próba Liebermana-Storcha-Morawskiego wykorzystu
je tę reakcję
do identyfikacji polimerów.
Przeprowadza się ją następująco:
badany polimer umieszcza się w płaskim naczyniu szklanym i zadaje kilkoma kroplami
bezwodnika octowego. Dodaje się następnie kroplę stężonego kwasu siarkowego i po upływie
1/2 godz
iny obserwuje kolor roztworu i żywicy. Dane odnośnie zachowania się
poszczególnych polimerów znajdują się w tabeli IV-5.
Tabela IV-5. Identyfikacja polimerów na podstawie reakcji Liebermana-Storcha-
Morawskiego
Polimer
Zabarwienie
octan celulozy
octanomaślan celulozy
azotan celulozy
benzyloceluloza
etyloceluloza
metyloceluloza
chlorowany kauczuk
chloropren
izobutylen
kauczuk wulkanizowany
żywica melaminowo-formaldehyd.
metakrylan metylu
żywica fenolowa
poliamidy
polistyren
czterofluoroetylen
żywica mocznikowo-formaldehyd.
octan winylu
poliwinylobutyral
polichlorek winylu
brak zabarwienia lub jasnobrązowe
brak zabarwienia
wydziela się NO
2
pomarańczowe do brązowego
pomarańczowe do brązowego
żółte do oliwkowego i czarnego
brak zabarwienia
czerwonobrązowe
brak zabarwienia
brak zabarwienia
brak zabarwienia
brak zabarwienia
bardzo różowe
brak zabarwienia
brak zabarwienia
brak zabarwienia
brak zabarwienia
zielone (wolno)
żółte do ciemnobrązowego
niebieskie (wolno)
-14-
Polimer
Zabarwienie
kopolimer chlorku i octanu winylu
polichlorek winylidenu
zielone do niebieskiego do brązowego
żółte (wolno)
Istnieje także szereg modyfikacji w przeprowadzaniu próby. Np. ok. 0,5 g polimeru
ogrzewa się w probówce z 2 cm
3
bezwodnika octowego. Po ochłodzeniu do roztworu dodaje
się 3 krople stężonego kwasu siarkowego i obserwuje zabarwienie roztworu oraz zmiany jakie
zachodzą (Tab. VI-6).
Tabela IV-6. Identyfikacja polimerów na podstawie modyfikowanej reakcji Liebermana-
Storcha-Morawskiego.
Rozpuszczalność w
bezwodniku octowym
Zabarwienie
na gorąco
po
oziębieniu po dodaniu
H
2
SO
4
po 10 min.
po dodatk.
ogrzew.
Żywica
fenolowo-
formaldehydowa
mocznikowo-
formaldehydowa
melaminowo-
formaldehydowa
poliamidowa
epoksydowa
Polimer
polichlorek
winylu
polioctan winylu
polieter winylowy
poliwinylobutyral
całkowita
roztwór mętny
całkowita
jw.
roztwór mętny
roztwór
przezroczysty
jw.
jw.
roztwór mętny
roztwór mętnieje
roztwór mętny
roztwór
przezroczysty
jw.
roztwór mętny
roztwór mętnieje
jw.
roztwór
przezroczysty
roztwór mętny
czerwono-
fioletowe
przechodzące w
różowe, a
następnie żółte
brak zabarwienia
brak zabarw.
jw.
żółte
przechodzące w
czerwono-
brunatne
brak zabarw.
jw.
.
niebieskie
przechodzące w
ziel.
czerwone
przechodzące w
brunatne
brunatne
brak zabarwienia
brak zabarw.
jw.
żółte
przechodz
ące w
czerwono-
brak zabarw.
jw.
brunatne
ciemnobrunatne
czerwono-
brunatne
żółtaw. pomar.
brak zabarwienia
roztwór
półprzeźroczysty
jasnożółte
przechodzące w
czerwone
-
brunatno-
żółte
przechodzące w
brunatne
brudno-
niebieskie
-
ciemnobrunatne
-15-
Rozpuszczalność w
bezwodniku octowym
Zabarwienie
na gorąco
po
oziębieniu po dodaniu
H
2
SO
4
po 10 min.
po dodatk.
ogrzew.
polietylen chloro-
sulfonowany
poliizobutylen
poliakrylan
polimetakrylan
metylu
polistyren
acetyloceluloza
etyloceluloza
benzyloceluloza
nie rozpuszcza
się
jw.
rozpuszcza się
jw.
roztwór
mętnieje
rozpuszcza się
jw.
jw.
-
-
roztwór mętnieje
jw.
roztwór mętny
roztwór
przezroczysty
roztwór mętny
roztwór
przezroczysty
-
-
-
-
brak zabarwienia
jw.
żółto brunatne
brak zabarwienia
-
-
-
-
brak zabarw.
jw.
ciemnobrunatne
brak zabarwienia
jasno-brunatne
-
-
-
żółto-brunatne
brak zabarwienia
ciemnobrunatne
brak zabarwienia
7. TEMPERATURY PRZEMIAN
7.1. Pomiar temperatury topnienia
Temperatura topnienia jest jedną z najważniejszych charakterystycznych cech
substancji małocząsteczkowych. W przypadku polimerów jej rola w identyfikacji jest
drugorzędna.
Wz
ględnie ostry punkt topnienia mają tylko polimery częściowo krystaliczne, takie
jak poliamidy, polietylen, polichlorek winylidenu, niektóre poliestry itp.
Polimery amorficzne zwykle miękną w szerokim zakresie temperatur. Niektóre z nich
rozkładają się przed osiągnięciem punktu topnienia. Czasem można temu zapobiec przez
przeprowadzenie pomiaru w atmosferze gazu obojętnego takiego jak azot czy dwutlenek
węgla.
Pomiar temperatury topnienia polimerów krystalicznych przeprowadza się zwykle na
dobrze sproszkow
anym materiale umieszczonym w kapilarze. Kapilarę ogrzewa się na łaźni
lub w metalowym bloku. Można też badać temperaturę topnienia metodą różnicowej analizy
termicznej lub w mikroskopie z ogrzewanym stolikiem. Zastosowanie spolaryzowanego
światła umożliwia w takim przypadku dokładną obserwację topnienia fazy krystalicznej.
-16-
Temperatury mięknienia polimerów amorficznych można oznaczyć przy pomocy
konsystometru Hoeplera (p. V-4.1).
Tabela IV-7.
Zakresy mięknienia najpopularniejszych polimerów. Wartości podkreślone
określają temperaturę topnienia (1).
Polimer
Temp. mięknienia (
o
C)
polioctan winylu
octan celulozy
polichlorek winylu
azotan celulozy
polimetakrylan metylu
octanomaślan celulozy
polimetakrylan etylu
polistyren ataktyczny
polistyren izotaktyczny
poliwinyloformal
benzyloceluloza
polichlorek winylidenu
polietylen (wysokociśnieniowy)
polietylen (niskociśnieniowy)
polimetakrylonitryl
etyloceluloza
politereftalan heksametylenowy
polipropylen izotaktyczny
poliformaldehyd
poliamid 11 (Rilsan)
poliakrylonitryl
polialkohol winylowy
poliamid 10.10
poliamid 6
poliamid 6.9
poliamid 6.10
poliamid 10.6
poliamid 6.6
44 - 86
46 - 110
60 - 95
60 - 90
60 - 115
60 - 121
65
88 - 100
90
230
93 - 139
93 -
100 -
200
116
110 - 115
135
115 - 158
160 -
160
176
184 -
175
190 - 230
186
200 (rozkł)
194 -
196 -
216
212 -
230
208 -
213
220
230
270
-17-
Polimer
Temp. mięknienia (
o
C)
poliw€glan (Makrolon)
polichlorotrifluoroetylen
politereftalan etylenowy
politetrafluoroetylen
222 -
210 -
230
225
249
330
8. BADANIE GĘSTOŚCI
Gęstość polimerów zależy od ich budowy chemicznej, oraz struktury krystalicznej.
Obecność atomów o dużej masie zwiększa gęstość. Jeśli np. atom wodoru zastąpiony zostanie
atomem chloru (np. w polichlorku winylu) gęstość wzrasta.
Stopień krystaliczności polimeru także wpływa na jego gęstość - ze wzrostem stopnia
krystaliczności rośnie gęstość polimerów.
Gęstość cieczy najłatwiej mierzyć metodą piknometryczną (lit. p.7. str. 132), gęstość
ciał stałych metodą kolumny gradientowej (p.V-4.2.).
Gęstość najpopularniejszych polimerów podaje tabela IV-8.
Tabela IV-8.
Gęstość niektórych polimerów (lit. poz. 8)
Polimer
Gęstość g/cm
3
w 25
o
C
polietylen
polipropylen izotaktyczny
polioctan winylu
polistyren amorficzny
polistyren krystaliczny
polichlorek winylu amorficzny
poliakrylonitryl
poliakrylonitryl
polimetakrylan metylu
poliizopren
polichloropren
politetrafluoroetylen amorf.
politetrafluoroetylen krystal.
celuloza
0,910-0,925
0,90-0,91
1,19
1,04-1,065
1,111
1,385
1,44
1,17-1,18
1,188
0,906-0,916
1,230
2,00
2,302
1,582-1-630

-18-
9. IDENTYFIKACJA POLIMERÓW ZA POMOCĄ SPEKTROSKOPII W
PODCZERWIENI
W procesie identyfikacji polimerów za pomocą spektrofotometrii absorpcyjnej w
podczerwieni wyróżnia się dwa aspekty:
1.
proste porównanie analizowanego widma z widmem znanego związku,
2.
identyfikacja grup funkcyjnych potrzebnych do ustalenia budowy związku.
W pierwszym przypadku potrzebne są katalogi widm, w drugim tablice korelacyjne.
Interpretację widm trzeba prowadzić z dużą ostrożnością, gdyż istnieje wiele
czynników wpływających na zmianę charakteru i położenia pasm absorpcji, jak np.
oddziaływanie wewnątrz- i międzycząsteczkowe, efekty przeszkód przestrzennych,
taktyczność, krystaliczność itp.
-19-
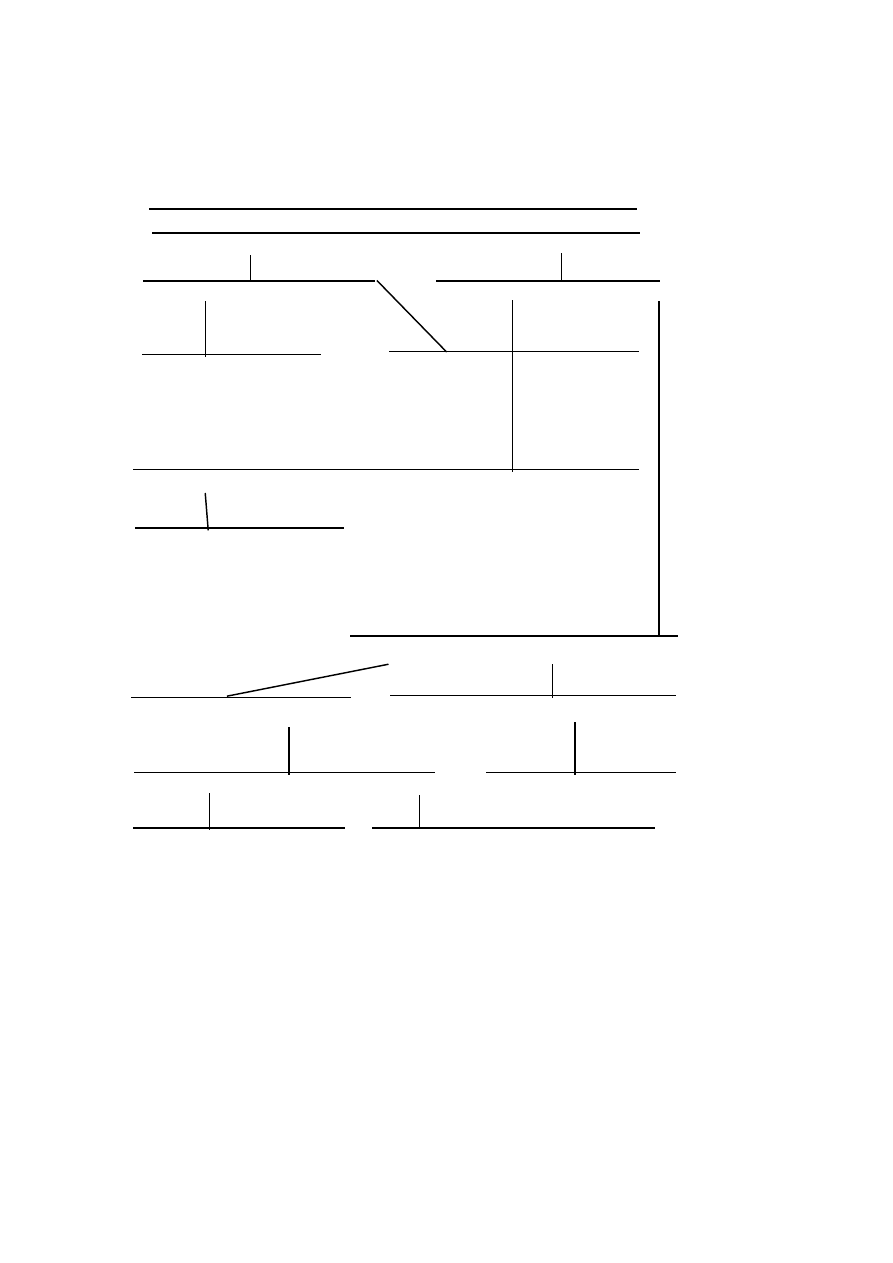
Schemat identyfikacji polimerów na podstawie widm w podczerwieni
Brak pasma C=O 1740 cm
-1
-1
, pasma związków aromatycznych
1605, 1590, 1490 cm
o
n
pasmo 3484-3333
pasmo 3333
s.pasmo 695 i 758
s.pasmo
1060-1100
s.pasmo 1670
s.pasmo
1430
o
n
o
n
żywice żywice
fenolowe epoksydowe
o
n
silikony
polistyren
kopolimer
styrenu z
butadienem
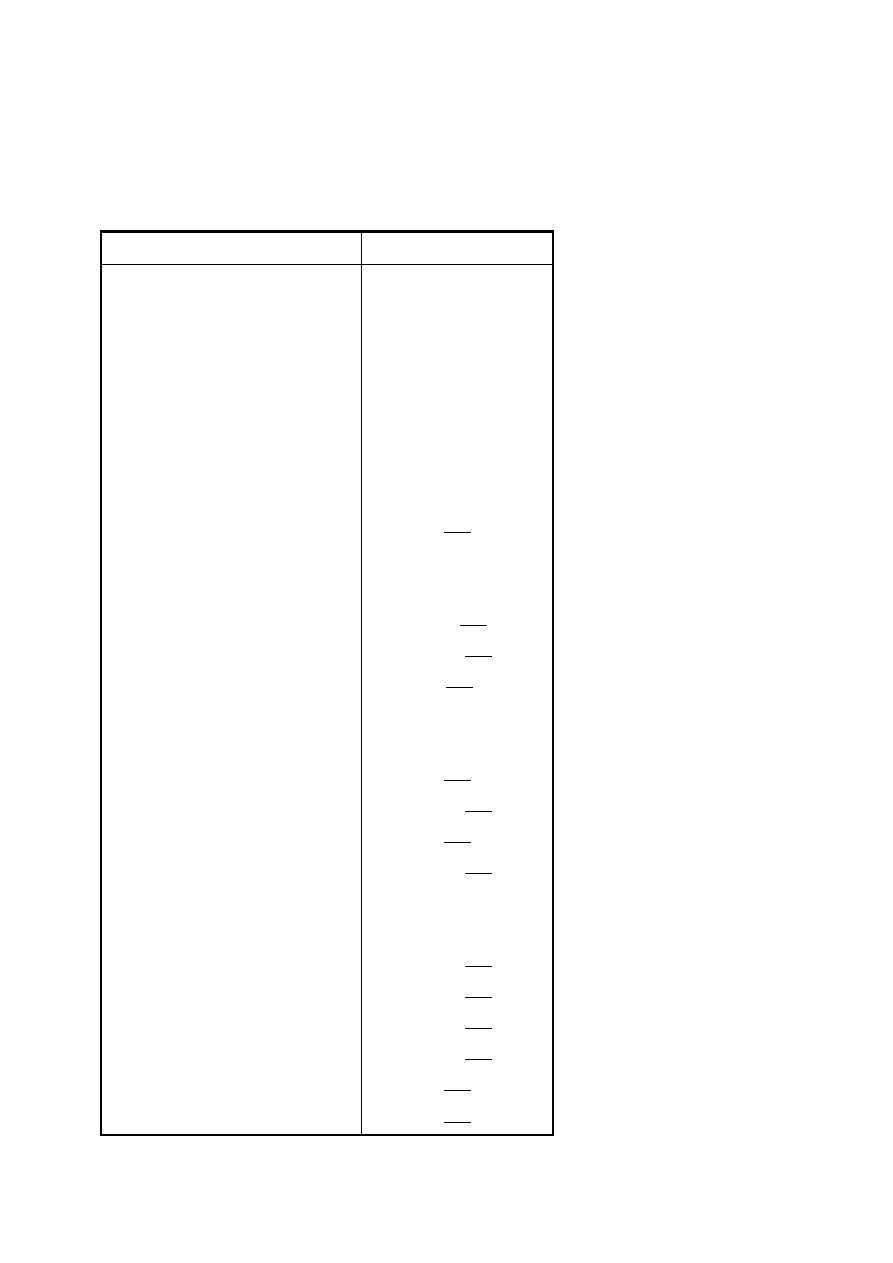
poliwinylobutyral
etylo- i metylo-
celuloza
żywice melaminowo-
formaldehyd.
alkohol poliwinylowy
żywice epoksydowe
s.pasmo 1540
nylon
żywice
aminowe
nitroceluloza
celofan
o
o
n
n
n
o
ostre pasmo 2220
ostre pasmo 1250
kopolimery
akrylonitrylu
s.pasmo 850
silikony
sz.s.pasmo 760 i 833
n
n
n
o
o
o
s.pasmo 950-925 pięć pasm 1250-1000
neopren polietylen
polibutadien
poliizobutylen
poliizopren
tiokol FA polichlorek winylu
n
n
n
o
o
n
o
o
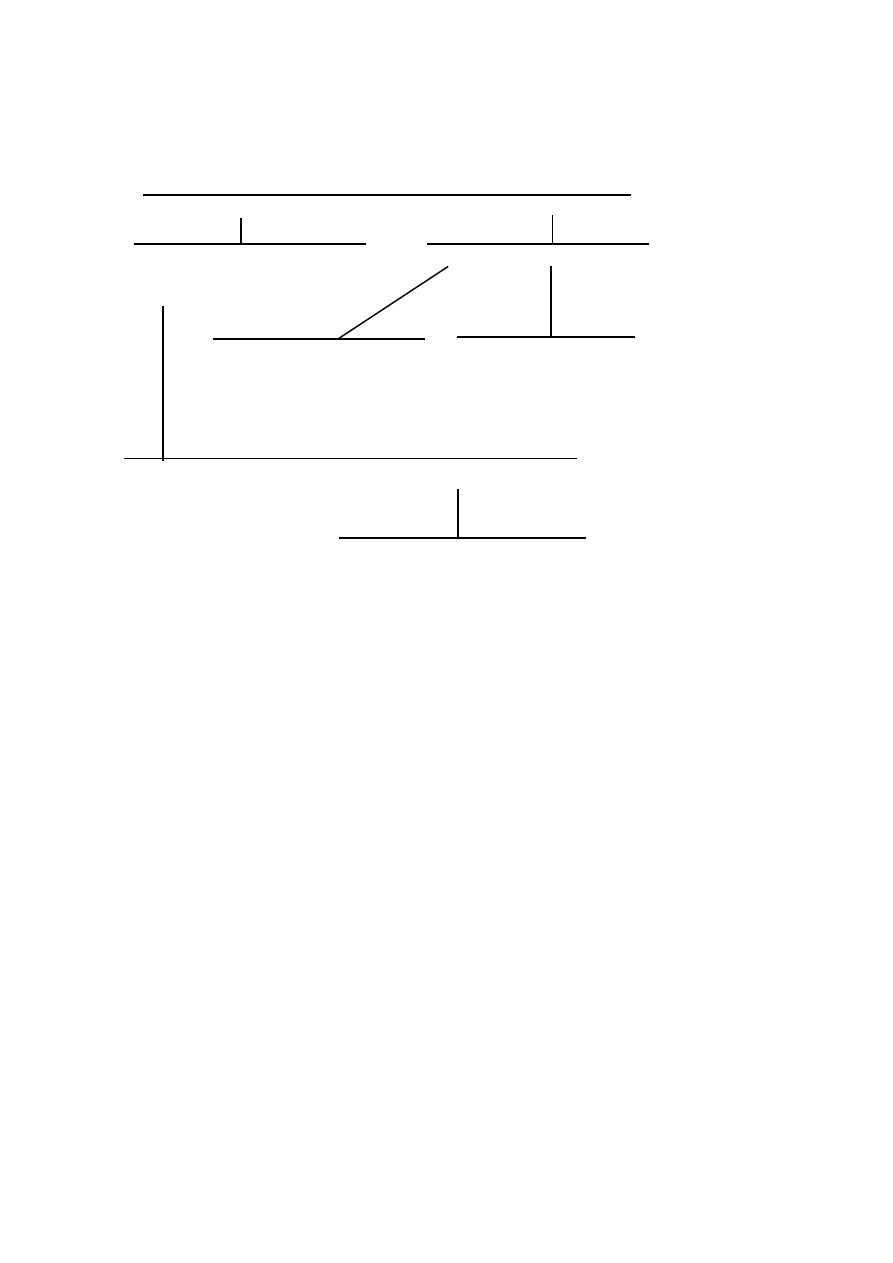
-20-
Wystepuje pasmo C=O 1740 cm
-1
-1
pasma związków aromatycznych
1605, 1590, 1490 cm
o
n
s.pasmo 830
ostre pasmo 1430
o
n
o
n
n
n
n
o
o
o
n
o
o - pasmo występuje,
n - pasmo nie występuje w widmie,
s - pasmo o dużej intensywnosci,
sz - pasmo szerokie.
modyfikowane
żywice
epoksydowe
ostre pasmo
1430
sz. pasmo 690
sz.pasmo 1050
kopolimer
polichlorku
winylu
polialkohol
winylowy
poliwinylo-
formal
estry
celulozy
akrylany
alifatyczne
poliestry
plastyfikowany
polichlorek winylu
s. pasmo 1330-1212
żywice
alkidowe
aromatyczne
poliestry
etery
celulozy
10. LITERATURA
1. Kline G.M.: "Analytical Chemistry of Polymers", III. Interscience Publ. N.York 1962.
2. Kalendarz Chemiczny II - 1, PWT, Warszawa 1955.
3.
Kastierina T.N., Kalina Ł.S.: "Chemiczna analiza tworzyw sztucznych" (tłum. z ros.),
WNT, Warszawa 1965.
4. Houvink R.: "Elastomery i plastomery" t.III, PWT, Warszawa 1953.
5.
Bałandina W.A., Gurwica D.D., Kleszczowa M.S., Nikitina W.A., Nikołajewa A.P.,
Nowikowa Je M.: "Analiza polimerizacjonnych płastmass", Izd. "Chmija", Leningrad
1967.
6. Praca zbiorowa: "Analiza polimerów syntetycznych", WNT, Warszawa 1971.
7.
Broniecki T., Iwasiewicz A., Kapko J., Płaczek W.: "Metody badań i ocena własności
tworzy sztucznych", WNT, Warszawa 1970.
8. Brandrug J., Immergut E.H.: "Polymer Handbook", J.Wiley a sons Inc., N.York 1975
Wyszukiwarka
Podobne podstrony:
Badania operacyjne wyklad 2 id Nieznany
Badania operacyjne, zadanie id Nieznany (2)
Badanie odbiornika radiowego id Nieznany (2)
Badanie odbiornikow RLC id 7741 Nieznany (2)
polimery teoria id 371571 Nieznany
Pomiary wielkosci elektrycznych Badanie bramek logicznych id 37
I Bakterie ogolnie id 208161 Nieznany
badania instalacji i lini id 76 Nieznany (2)
Badanie hartownosci stali id 77 Nieznany (2)
Badanie ukladu nerwowego id 781 Nieznany
Badanie halasu pojazdow id 7715 Nieznany (2)
Badanie stanow nieustalonych id Nieznany
Badania mieszanki betonowej id Nieznany (2)
Chemia polimerow II id 113148 Nieznany
Kulej M Badania Operacyjne w4m id 74430
Analiza koniunktury i badanie r prof Lubinski id 60714 (2)
Badanie wlasciwosci tworzyw id Nieznany (2)
badanie wskaznik tlenowy id 783 Nieznany (2)
więcej podobnych podstron