
1
Izabela Jasicka-Misiak
Piotr Młynarz
Paweł Kafarski
Identyfikacja grzybów halucynogennych ze wskazaniem
najpowszechniej stosowanych metod oznaczania substancji
halucynogennych z grzybów we krwi
Opole i Wrocław, 2006

2
1. WSTĘP
Nie wiadomo, kiedy człowiek po raz pierwszy sięgnął po środki odurzające. Zapewne
wtedy, gdy uświadomił sobie ograniczenia i kruchość swej egzystencji, poczuł ból i odkrył, że
niektóre rośliny potrafią go łagodzić.
Archeolodzy odnaleźli ślady makówek i nasiona konopi w grobach z epoki neolitu. W
trzecim tysiącleciu p.n.e., na Dalekim Wschodzie ludzie żuli już betel przygotowywany z
orzechów palmy arekowej (Areca catechu), a w Mezopotamii wytwarzali alkohol. W V wieku
p.n.e. Herodot pisał o Scytach odurzających się haszyszem. Ryty naskalne w grobowcu na
bretońskiej wysepce Gawinis sprzed 8.000 lat wywołują takie wrażenie, że wielu badaczy
podejrzewa ich twórców o działanie pod wpływem substancji halucynogennych.
Skomplikowane, powtarzające się wielokrotnie wzory geometryczne nie mają bowiem
żadnego odpowiednika w naturze [
R
UDGLEY
,
2000
].
Naukowcom nie udało znaleźć się żadnej cywilizacji pierwotnej, która obywałaby się
bez środków odurzających. Ludzie wszędzie znajdowali substancje zmieniające świadomość,
niezależnie od tego, gdzie przyszło im żyć, w amazońskiej dżungli, syberyjskiej tajdze, na
stepie czy pustyni. Botanicy opisali ponad 200 roślin o właściwościach halucynogennych, do
dziś odkryto w nich kilka tysięcy związków chemicznych. Największą grupę stanowią
alkaloidy, czyli zasady zawierające atom azotu. Łączy je zdolność wpływania na
funkcjonowanie układu nerwowego człowieka. Efekty mogą być różne - od uspokajania i
znieczulenia, przez pobudzanie, po wywoływanie halucynacji.
Alkaloidy w czystej postaci są toksyczne, przyjęte w dużych dawkach powodują
zatrucia, także śmiertelne. Dlatego od czasów prehistorycznych zażywanie zawierających je
preparatów starano się kontrolować. Po środki odurzające dawniej nie sięgano dla
przyjemności, lecz w ściśle określonych celach i czasie - dla nawiązania kontaktu z bogami i
duchami, wprowadzenia się w trans podczas rytualnych obrzędów, wzmocnienia sił i odwagi
przed wyruszeniem na łowy lub wojnę. Młodzież uzyskiwała prawo korzystania z używek
dopiero po inicjacji
Dawniej o tym, co dozwolone, decydowała religia i tradycja, dziś - przepisy prawa.
Środki dopuszczone do obrotu określa się zazwyczaj jako używki, zakazane - jako narkotyki.
Podstawą podziału jest ich szkodliwość, moc i właściwości uzależniające. W wypadku roślin
nieprzetworzonych nie jest to kryterium precyzyjne, o czym świadczy odmienne traktowanie
tytoniu i marihuany. Wątpliwości nie wzbudzają wyizolowane i zsyntetyzowane środki
psychotropowe. Przepisy regulujące dostęp do używek i narkotyków wydają się stałe, ale w
rzeczywistości ulegają zmianom. W XIX wieku w europejskich miastach działały palarnie
opium i kluby miłośników haszyszu. W XX wieku do dobrego tonu należało palenie tytoniu,
dziś napiętnowane. Freud uważał kokainę za cudowny lek, a zawierające ją napoje
reklamowano tak, jak dziś kawę czy herbatę. W Holandii można palić papierosy z marihuaną,

3
co w sąsiedniej Francji grozi już konsekwencjami prawnymi. Dla Indian z Andów zakaz żucia
liści koki jest równie absurdalny, jak dla Europejczyków alkoholowa prohibicja. Muzułmanie
zdelegalizowali obie te używki, ale nie mają nic przeciwko raczeniu się wywołującym
podobne efekty ghatem [
R
UDGLEY
,
2000
].
Od kilku lat obserwuje się stały wzrost liczby ujawnianych przestępstw ściganych na
podstawie ustawy o przeciwdziałaniu narkomanii, w tym przemytu i nielegalnego
wytwarzania narkotyków. Nagłaśniane przez media przykłady skutecznych działań
odpowiedzialnych służb i stosunkowo wysokie kary nakładane na producentów środków
odurzania czy kurierów narkotykowych, nie powstrzymują kolejnych sprawców. Na terenie
spokojnych dotąd województw (w tym województw dolnośląskie i opolskie) dynamicznie
wzrasta przestępczość narkotykowa, a proceder ten, z uwagi na ogromne zyski, podejmuje
niemal każda grupa przestępcza, dążąc następnie do stworzenia własnych źródeł zaopatrzenia
(kanału przemytu lub produkcji). Z danych statystycznych wynika, że na terenie całego kraju
w dalszym ciągu utrzymuje się wzrost podaży narkotyków i popytu na te środki, szczególnie
wśród młodych ludzi. Narkotyki dostępne są już praktycznie nie tylko w dużych miastach, ale
także w mniejszych miejscowościach, a co najgorsze również na terenie szkół. W ciągu
jedenastu lat prawie pięciokrotnie powiększyła się grupa uczniów, którzy próbowali
nielegalnych substancji odurzających. Po okresie stabilizacji, odnotowanej w latach 1994-
1996, dwa kolejne badania ujawniły skokowy wzrost liczby uczniów eksperymentujących z
narkotykami. Pochodne konopi indyjskich i ruteckich (marihuana i haszysz) to zdecydowanie
najbardziej powszechnie stosowany nielegalny narkotyk (w Polsce używa go stale 6,3%
młodzieży w ogóle, a w Czechach aż 22,1%). Następnym narkotykiem najczęściej
konsumowanym jest amfetamina i jej pochodne, w tym głównie Ecstasy (MDA, MDMA,
MDEA, PMA, PMMA). Zaznacza się spadek zainteresowania LSD, który rekompensowany
jest popytem na grzyby halucynogenne (np. łysiczka lancetowata) oraz inne halucynogeny
pochodzenia roślinnego. Choć rozpowszechnienie stosowania „magicznych grzybków” jest
stosunkowo niewielkie, są one najczęściej stosowanym środkiem halucynogennym w 12
Państwach Członkowskich UE (w Polsce ok. 20% oburzeń - według badań sieci „Znaczenie i
użytkowanie grzybów trujących w tym halucynogennych na terenie Polski i krajów
ościennych”).
Z ponad 5.000 odmian grzybów znanych przez człowieka około 80 posiada
właściwości psychoaktywne. Dolny Śląsk, a szczególnie rejon Karkonoszy, to jeden z
głównych regionów gdzie grzyby te są zbierane. Można dokonać też ich zakupu (wraz ze
szczegółowymi instrukcjami dotyczącymi hodowli) przez internet. Zjawisko narkotyzowania
się grzybami halucynogennymi ma w Polsce coraz szerszy zasięg. Istnieje zatem potrzeba
zdefiniowania tego typu grzybów ze wskazaniem najczęściej używanych, opracowanie
przewodnika dla potrzeb policji, identyfikacja głównych składników odpowiedzialnych za
efekty narkotyczne, opracowanie metod standardowego oznaczania poziomu tych substancji

4
w materiale biologicznym, w osoczu i moczu (w tym i metod immunologicznych - tzw.
testów paskowych).
Pod względem prawnym aktualnie obowiązująca ustawa z dnia 29 lipca 2005 r. „O
przeciwdziałaniu narkomanii” nie precyzuje dokładnie, które gatunki grzybów zaliczone są
do kategorii grzybów halucynogennych. Mówi ona jedynie, iż „grzyby halucynogenne, są to
grzyby zawierające substancje psychotropowe”. Taki stan prawny pozostawia wiele miejsca
do subiektywnej interpretacji zapisów tej ustawy. Przykładem takiej interpretacji może być
przypadek muchomora czerwonego, który posiada dobrze poznane właściwości
halucynogenne. Substancje czynne tego grzyba – kwas ibotenowy i muscymol, nie zostały
umieszczone w wykazie środków psychotropowych we wspomnianej ustawie.
Brak jest jednoznacznych informacji, które precyzują sposoby określania zawartości
substancji halucynogennych w grzybach oraz informacji, które gatunki należy bezsprzecznie
zaliczyć do kategorii halucynogennych.
2. GRZYBY HALUCYNOGENNE
Grzyby halucynogenne („magiczne grzyby”, „grzybki-halucynki”), to grupa grzybów,
które zawierają substancje psychoaktywne powodujące doznania narkotyczne. Grzyby te
należą do grupy trzeciego typu toksyczności określanego neurologicznym oraz ze względu na
działanie na człowieka sklasyfikowane są do szóstej grupy toksyczności (halucynogenne).
Zazwyczaj spożywane są one w celach narkotycznych bądź w wyniku pomyłki grzybiarza.
Obecnie znanych jest ok. 80 gatunków grzybów posiadających właściwości halucynogenne.
Grzyby halucynogenne należą głównie do rodzaju Psilocybe, natomiast sporadycznie do
rodzajów Gymnopilus i Panaeolus [
N
UGENT I
S
AVILLE
,
2004
]. Na świecie występuje około 140
gatunków łysiczek, z których około 80 zalicza się do halucynogennych. Grzyby te rosną
niemalże na wszystkich kontynentach, najwięcej jednak gatunków halucynogennych
zidentyfikowanych zostało w Meksyku [
G
UZMAN
,
1983
]. W Europie rośnie kilkanaście
gatunków Psilocybe, jednakże działanie halucynogenne wykazuje tylko kilka gatunków tych
grzybów. Najczęściej wymienia się: Psilocybe semilanceata (Fr.) Quel., Psilocybe bohemica,
Psilocybe montana, Psilocybe cyanescens Wakef. Łysiczki rosną na ziemi, nawozie,
odchodach roślinożerców, resztkach obumarłych roślin. Spotyka się je w trawie, najczęściej w
otwartym terenie, rzadziej rosną w lesie [
J
ANOSZKA
,
2005;
K
AFARSKI
,
2006
].

5
Łysiczka lancetowata (Psilocybe semilanceata) – gatunek grzyba należący do
pierścieniakowatych. Ze względu na wygląd i właściwości halucynogenne nazywany również
czapeczką wolności (Liberty Cap). Dość rzadko występujący w Polsce.
Królestwo: grzyby
Typ: grzyby podstawkowe
Klasa: podstawczaki
Podklasa: podstawczaki pieczarkopodobne
Rząd: pieczarkowce
Rodzina: pierścieniakowate
Rodzaj: łysiczka
Gatunek: Łysiczka lancetowata
Kapelusz higrofaniczny, 0,5-1,5 cm średnicy, zmienny w kształcie, stożkowaty lub
dzwonkowaty, ze szpiczastym guzkiem w środku, ale również bez guzka tylko z nieznacznym
uwypukleniem, gładki. W czasie wilgotnej pogody nieco lepki i brązowy, suchy jest
brudnoochrowy, żółtawy lub żółtawo-brązowy, czasami z odcieniem oliwkowozielonym.
U starszych owocników brzeg trochę pomarszczony. Blaszki dość rzadkie, szerokie,
przerośnięte, początkowo ochrowe, szybko stają się purpurowo-brązowe do prawie czarnych.
Trzon wysmukły, elastyczny, cylindryczny, do 10 cm długi i do 2 mm gruby (przeważnie
1 mm), zabarwiony kremowo, bladożółtawo lub żółtobrązowo, w podstawie może mieć
odcień niebieskawy, a czasami jest u dołu biało oprószony. Miąższ cienki, białawy, bez
wyraźnego smaku. Zapach nieznaczny, grzybowy, nieco stęchły. Wysyp zarodników
ciemnobrązowy z purpurowym odcieniem. Zarodniki elipsoidalne, grubościenne, gładkie,
z wyraźną porą rostkową; 13-15 x 6.5-7.5 µm, nieco spłaszczone. Występuje głównie na
terenach o dużej ilości opadów, w górach. Owocniki wyrastają od lata do jesieni, pojedynczo
lub w grupach po kilka, w trawie i mchach, w miejscach podmokłych, na ścieżkach.
Większość źródeł podaje, że występuje w miejscach bogatych w składniki odżywcze. Zawiera
psylocybinę
[
HTTP
://
WWW
.
GRZYBY
.
PL
].

6
Łysiczka czeska (Psilocybe bohemica) – podobnie jak łysiczka lancetowata
grzyb ten należy do pierścieniakowatych. Bardzo rzadko występujący w Polsce.
Królestwo: grzyby
Typ: grzyby podstawkowe
Klasa: podstawczaki
Podklasa: podstawczaki pieczarkopodobne
Rząd: pieczarkowce
Rodzina: pierścieniakowate
Rodzaj: łysiczka
Gatunek: Łysiczka czeska
Kapelusz higrofaniczny, wilgotny płowo do rdzawobrązowego, suchy jasnoochrowy,
z wiekiem i w miejscach uszkodzonych przebarwia się ciemno sino-zielonkawo; 20-50 mm
średnicy, początkowo tępostożkowaty, potem wypukły do rozpostartego; brzeg podgięty,
z wiekiem prosty lub odgięty, wilgotny słabo prążkowany; powierzchnia gładka, nie lepka;
skórka nieściągalna. Blaszki początkowo jasnobrązowe, z czasem przyjmują barwę kremową.
Wysyp zarodników brązowy z purpurowym odcieniem. Zarodniki elipsoidalne, nieco
spłaszczone, grubościenne, z wyraźną porą rostkową; 10-12.5 × 6-7.5 µm. Trzon wysmukły,
elastyczny, cylindryczny, do 12 cm długi i do 4 mm gruby. Zapach nieznaczny, grzybowy.
Owocniki wyrastają pojedynczo lub w grupach. Na silnie rozłożonym drewnie drzew
liściastych i iglastych, gałązkach, kompoście, resztkach roślinnych, w ogrodach, parkach, na
poboczach dróg, w miejscach żyznych, ruderalnych
[
HTTP
://
WWW
.
GRZYBY
.
PL
].
Łysiczka górska (Psilocybe montana) – jak większość łasiczek występuje dość
rzadko. Owocniki wyrastają przez cały rok, poza zimą, w grupach, rzadziej pojedynczo, na
ubogich terenach porośniętych mchem i trawą z mchami.
Królestwo: grzyby
Typ: grzyby podstawkowe
Klasa: podstawczaki
Podklasa: podstawczaki pieczarkopodobne
Rząd: pieczarkowce
Rodzina: pierścieniakowate
Rodzaj: łysiczka
Gatunek: Łysiczka czarnobrązowa

7
Kapelusz higrofaniczny, wilgotny ciemnobrązowy do ciemnoczerwonobrązowego, suchy
jasny beżowoochrowy do beżowego; 5-15(20) mm średnicy; półkulisty z wiekiem wypukły,
bez garbka lub nieznacznym garbkiem. Brzeg kapelusza ostry, gdy wilgotny to prążkowany,
mogą być widoczne białe włókienka osłonki. Blaszki początkowo szare, szybko brązowe z
purpurowym odcieniem. Trzon barwy kapelusza, u szczytu nieco jaśniejszy; 15-25(50) x 0.5-
1(2) mm, równogruby, powierzchnia oprószona na szczycie, poza tym włókienkowata.
Cechy wyróżniające, to nie lepki kapelusz, dojrzałe blaszki posiadają purpurowy odcień
[
HTTP
://
WWW
.
GRZYBY
.
PL
].
Muchomor czerwony (Amanita muscaria), to rozpowszechniony w Polsce grzyb
kapeluszowy z rodziny drobnołuszczakowatych. Jest to grzyb o słabych właściwościach
trujących. Ze względu na swój charakterystyczny wygląd, do zatruć nim dochodzi dość
rzadko. Najczęściej, są to zatrucia w przypadku nieodpowiedniego spreparowania grzyba w
celach odurzających. Wedle statystyk śmiertelność przy zatruciu tym grzybem waha się w
granicach 2-5%. Najbardziej trujące są świeże osobniki ze względu na zwiększoną zawartość
w swoim składzie kwasu ibotenowego.
Królestwo: grzyby
Typ: grzyby podstawkowe
Klasa: podstawczaki
Podklasa: podstawczaki pieczarkopodobne
Rząd: pieczarkowce
Rodzina: drobnołuszczakowate
Rodzaj: muchomor
Gatunek: Muchomor czerwony
Kapelusz grzyba jest żywo czerwony do żółtopomarańczowego, jego średnica wynosi
od 50 do 150 (200) mm; początkowo półkulisty, potem wypukły, w końcu rozpostarty.
Powierzchnia kapelusza pokryta jest dość regularnie rozmieszczonymi, białymi, luźno
przylegającymi łatkami będącymi resztkami osłony, łatki te mogą być spłukiwane przez
deszcze. Skórka błyszcząca, ściągalna, w czasie wilgotnej pogody lepka. Brzeg kapelusza
długo gładki, u starych okazów prążkowany. Blaszki białe do kremowych; dość gęste,
brzuchate, wolne. Trzon biały lub żółtawy; 60-150 (200) x 15-30 mm; cylindryczny;
podstawa bulwiasta, kulista od jajowatej, z pochwą zredukowaną do kilku pierścieni
kłaczkowato-wałeczkowatych brodawek, powyżej pokryta nielicznymi kosmkami. Pierścień

8
wyraźny, biały lub białożółtawy, zwieszony, nieprążkowany; brzeg pierścienia biały lub
żółtawo ząbkowany. Miąższ biały, pod skórką kapelusza żółty (żółtopomarańczowy);
niezmienny, kruchy. Smak grzyba jest łagodny oraz bez zapachu
[
HTTP
://
WWW
.
GRZYBY
.
PL
].
W
celach halucynogennych często wykorzystywany jest także dość pospolity w Polsce
muchomor plamisty (Amanita pantherina).
Królestwo: grzyby
Typ: grzyby podstawkowe
Klasa: podstawczaki
Podklasa: podstawczaki pieczarkopodobne
Rząd: pieczarkowce
Rodzina: drobnołuszczakowate
Rodzaj: muchomor
Gatunek: Muchomor plamisty
Oprócz wymienionych wyżej gatunków występujących w Polsce zawierających
substancje psychoaktywne, istnieje także wiele gatunków grzybów podejrzewanych o
zawartość w swym składzie substancji halucynogennych. Grzyby te są mniej poznane pod
względem zawartości substancji toksycznych i halucynogennych, a niektóre z nich rzadziej
występują w naszej strefie klimatycznej. Gatunki podejrzewane o zawartość substancji
halucynogennych to między innymi:
- Pierścieniaki: pierścieniak wieńczony (Stropharia coronilla),
- Czernidłaki: czernidłak narkotyczny (Corpinus narcoticus), czernidłak pospolity
(Corpinus atramentarius),
- Kołpaczki: kołpaczek motylkowaty (Panaeolus sphinctrinus), kołpaczek motylkowaty
(Panaeolus papilonaceus)
- Niektóre gatunki z rodzaju Inocybe (strzępiaki), Conocybe (stożkogłówka), Pluteus
(drobnołuszczak), Gymnopilus (łysak).
Do chwili obecnej przeprowadzono badania składu chemicznego niewielu spośród wyżej
wymienionych gatunków grzybów. Z dotychczas przeprowadzonych analiz wynika, że
w grzybie Inocybe aeruginascens obecna jest psylocybina w ilości 0,3% suchej masy oraz
baeocestyna w ilości 0,2% suchej masy. Dodatkowo odnotowano kilkanaście zatruć
spowodowanych tym grzybem. Kolejnym gatunkiem zbadanym pod kątem obecności
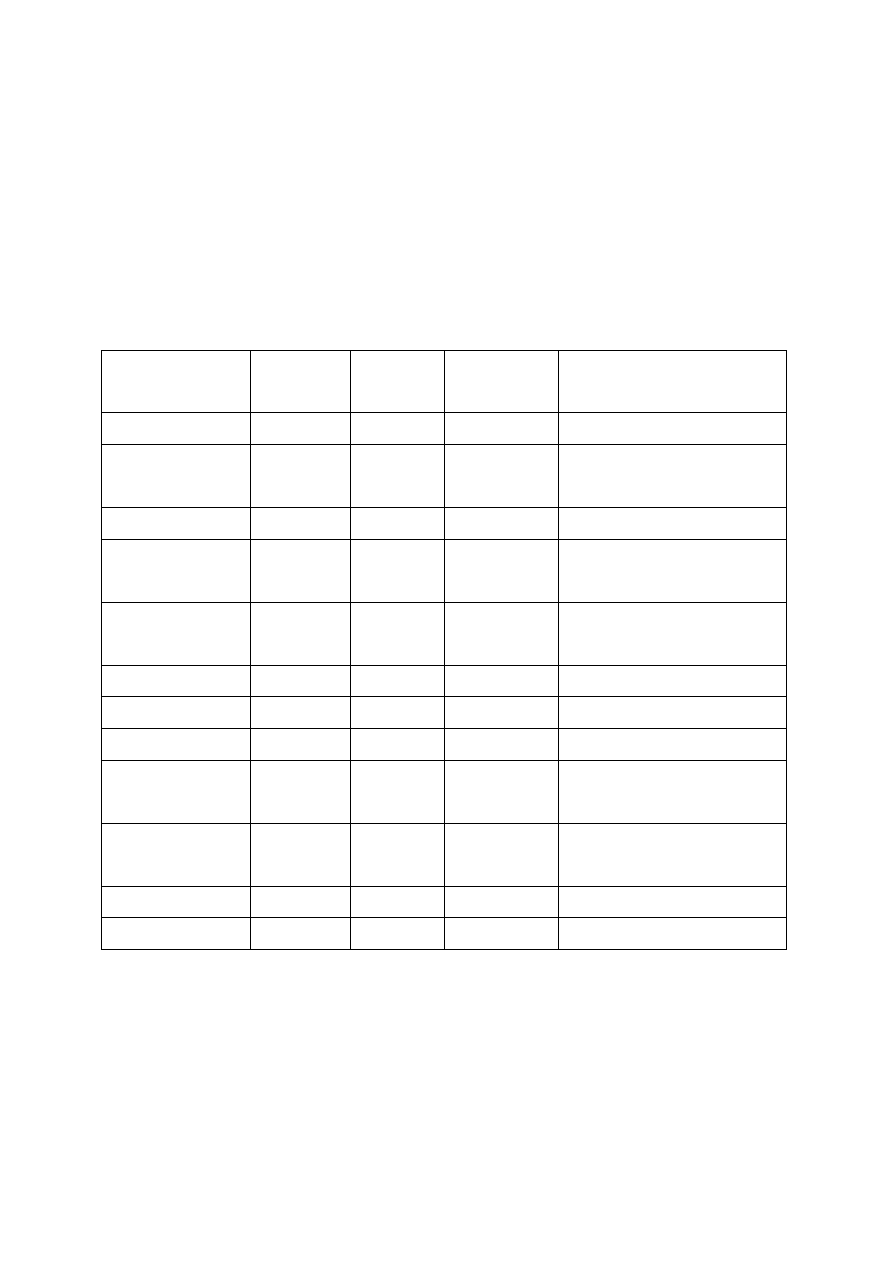
9
substancji halucynogennych był grzyb z rodziny łysaków - Gymnopilus purpuratus. Zarówno
psylocyna jak i baeocystyna znajdowały się w tym gatunku w ilości ok. 0,3% [
G
ARTZ
,
1992
].
Jak wynika z literatury, zawartość procentowa substancji halucynogennych w grzybach jest
zmienna i zależy od gatunku, stadium rozwojowego, warunków klimatycznych oraz
dostępności rozpuszczalnego azotu i fosforu w glebie (Tabela 1).
Tabela 1.
Przykładowe gatunki grzybów halucynogennych oraz zawartość psylocyny,
psylocybiny oraz baeocystyny w przeliczeniu na suchą masę grzyba.
Gatunek
%
Psylocybiny
%
Psylocyny
%
Baeocystyny
Źródło
P. azurenscens
1,78
0,38
0,35
[
S
TAMETS I
G
ARTZ
,
1995
]
P. bohemica
1,34
0,11
0,02
[
G
ARTZ I
M
UELLER
,
1990
];
[
G
ARTZ
,
1994
]
P. semilanceata
0,98
0,02
0,36
[
G
ARTZ
,
1994
]
P. baeocystis
0,85
0,59
0,1
[
R
EPKE
,
1977;
B
EUG I
B
IGWOOD
,
1982
]
P. cyanescens
0,85
0,36
0,03
[
S
TIJVE I
K
UYPER
,
1985;
R
EPKE I
IN
.,
1977
]
P. tampanensis
0,68
0,32
---
[
G
ARTZ
,
1994
]
P. cubensis
0,63
0,60
0,25
[
G
ARTZ
,
1994
]
P. weilii
0,61
0,27
0,05
---
P. hoogshagenii
0,60
0,10
---
[
H
EIM I
H
OFMANN
,1958;
HTTP
://
WWW
.
EROWID
.
ORG
]
P. stuntzii
0,36
0,12
0,02
[
B
EUG I
B
IGWOOD
,
1982;
R
EPKE
,
1977
]
P. cyanofibrillosa 0,21
0,04
---
[
S
TAMETS I
G
ARTZ
,
1995
]
P. liniformans
0,16
---
0,005
[
S
TIJVE I
K
UYPER
,
1985
]
Wydawać by się mogło, iż z racji sezonowego występowania grzybów, dostęp do
świeżego materiału ogranicza się wyłącznie do późnego lata i jesieni. Istnieje jednak
możliwość prowadzenia hodowli grzybów posiadających właściwości halucynogenne w
warunkach domowych. Nielegalne sklepy internetowe oferują sprzedaż zarodników takich
grzybów, zarówno gatunków występujących w naszej strefie klimatycznej, jak i gatunków

10
spoza naszej strefy (na przykład Psilocybe cubensis). Zarodniki, a także fragmenty
owocników stanowią materiał wyjściowy do prowadzenia hodowli w warunkach domowych.
Wraz z materiałem do hodowli grzybiarze żądni mocnych wrażeń otrzymują dokładne
wskazówki dotyczące warunków hodowli, których dotrzymanie gwarantuje wyhodowanie
owocników w ciągu czterech do ośmiu miesięcy [
J
ANOSZKA I IN
.,
2005
]. Poniżej pokazano
zdjęcia z instrukcji dla hodowców takich grzybów – łysiczki kubańskiej, których zarodniki
oferuje w internecie firma PF (1202 E. Pike #783, Seattle Wa. 98122, USA), oraz ofertę z
witryny „Buy magic mushrooms”. Warto zaznaczyć, że znalezienie tych ofert zajęło autorom
raportu 5 minut.
Psilocybe Colombian #1
This one has a nice history in Colombia. Picked from the cowfields of the
little village Villa de Leiva. Found to be very potent, giving a beautiful
journey. From the same grower as the Normal Mexican. Fresh Colombian
Magic Mushrooms available in 750g packs.
Not recommended for use under 18. If pregnant, nursing or taking a
prescription drug, consult your health care professional. Do not exceed
recommended dose. Consumption may impair ability to drive or operate
heavy equipment. Not recommended for consumption with alcoholic
beverages.
Opisano również metodę, w której wykorzystanie zarodników prowadzi do otrzymania
dikariotycznej grzybni. Grzybnię tę można wykorzystać do dalszego jej namnażania lub do
porcjowania i sprzedawania jako gotowego do spożycia materiału [
J
ANOSZKA I IN
.,
2005
].
Takie produkty, ze względu na swą bezpostaciową formę, są niemożliwe do identyfikacji za
pomocą tradycyjnych metod makro- i mikroskopowych [
A
DAMCZYK
,
2006
].
Dostęp do grzybków halucynogennych jest zatrważająco łatwy, nie dziwi zatem ich
rosnąca wciąż popularność. Należy jednak wziąć pod uwagę fakt, iż w naszej strefie
klimatycznej oprócz osławionej przez zbieraczy łasiczki lancetowatej, na łąkach rośnie
kilkadziesiąt podobnych gatunków grzybów, praktycznie nierozróżnialnych dla laików.

11
Gatunki te stanowią poważne zagrożenie życia dla amatorów odurzania, którzy przez
niewiedzę konsumują silnie trujące grzyby, jak na przykład stożogłówki (Conocybe), czy
hełmówki (Galerina).
3. MORFOLOGICZNA IDENTYFIKACJI GRZYBÓW
Oznaczanie grzybów do celów konsumpcyjnych jest zadaniem stosunkowo łatwym.
Dla oznaczenia gatunku grzyba konieczne jest sprawdzenie cech, które odróżniają ten gatunek
od innych podobnych. Są to tak zwane cechy diagnostyczne. Jedną z takich cech jest barwa
zarodników, dzięki której można nieuzbrojonym okiem określić gatunek grzyba. Wysyp
zarodników otrzymuje się układając dojrzały kapelusz hymenoforem do dołu na kartce
białego papieru. Po kilku godzinach należy usunąć kapelusz, na kartce pozostają wówczas
zarodniki o kolorze właściwym dla danego gatunku. Barwa wysypu zarodników jest cechą
bardzo pomocną przy oznaczaniu grzybów, pozwala ona na szybkie przyporządkowanie
znaleziska do rodziny w danej grupie grzybów. Warto podkreślić, że w przypadku grzybów
blaszkowych zrobienie wysypu zarodników jest łatwe i szybkie i jest bardzo pomocne.
W praktyce grzybiarza, umiejętność robienia wysypu zarodników jest także bardzo przydatna.
Określenie barwy wysypu zarodników umożliwia na przykład pewne odróżnienie pieczarek
(czekoladowobrązowy wysyp) od muchomorów (biały wysyp), opieniek (biały wysyp) od
"fałszywych opieniek" (brązowy wysyp), itd. Wysyp zarodników bywa także potocznie
nazywany "odciskiem kapelusza". W przypadku grzybów Psilocybe wysyp zarodników jest
purpurowo-brązowy. Często można zauważyć, iż kapelusze sąsiadujących ze sobą łysiczek są
oprószone smugami ciemnego pyłu.
Inną cechą, która ułatwia identyfikację gatunków grzybów Psilocybe jest niebieskie
zabarwienie trzonka u nasady kapelusza. Po ścięciu lub uszkodzeniu trzonka barwa ta zmienia
się na czerwoną w ciągu 30-60 min. Zjawisko to, nie jest cechą charakterystyczną gatunków
grzybów zawierających psylocybinę, ale może świadczyć o tym, iż grzyb nie należy do
gatunku trującego [
S
CHWARZ I
S
MITH
,
1988
]
Wysypu zarodników można dokonać dysponując świeżymi owocnikami, jednakże
najczęściej do identyfikacji i analizy otrzymywane są grzyby w postaci zasuszonej. Ze
względu na trudności z makroskopowym określeniem gatunku grzyba w celu jego
identyfikacji stosuje się często metody mikroskopowe.

12
Psilocybe semilanceata
Psilocybe cubensis
(Łysiczka lancetowta)
(Łysiczka kubańska)
Amanita muscaria (Muchomor czerwony)
Aby przywrócić turgor tkanek często stosuje się roztwór 2,5% wodorotlenku potasu.
Po potraktowaniu wodorotlenkiem tkanki grzyba powracają w pewnym stopniu do swojego
pierwotnego stanu i możliwa staje się identyfikacja gatunku przy pomocy mikroskopu
tradycyjnego bądź elektronowego.
W przypadku analizy z użyciem mikroskopu tradycyjnego bierze się pod uwagę
kształt oraz cechy charakterystyczne zarodników, cystyd oraz basyd umiejscowionych na
grzybni. Dodatkowo, analiza za pomocą mikroskopu elektronowego może ułatwić
identyfikację grubszych i bezbarwnych tkanek. W przypadku zastosowania skaningowego
mikroskopu elektronowego (SEM) otrzymuje się także zdjęcia trójwymiarowe [
T
SUJIKAWA
,
I
IN
.,
2003
].

13
4. EFEKTY SPOŻYWANIA GRZYBÓW
„Magiczne grzybki”, jak wynika z wielu doniesień [
M
USSHOFF I IN
.
2000;
P
ASSIE I IN
.,
2002
], konsumowane są zazwyczaj w postaci surowej, taka forma wywołuje, bowiem,
najsilniejsze doznania już po 20-40 minut od spożycia. Opisywane są również przykłady
spożywania grzybków zmieszanych w napojach lub potrawach. Zbiory grzybków
przechowywane są najczęściej w postaci suszonej bądź mrożonej, często są trzymane w
miodzie, co w znacznym stopniu pozwala zachować ich wysoką aktywność [
B
OGUSZ I IN
.,
1998; M
USSHOFF I IN
.,
2000
].
Doniesienia dotyczące formy oraz ilości spożywanych grzybków są bardzo
zróżnicowane. Jednakże za ilość pozwalającą odczuć działanie przyjmuje się 20-30 sztuk
świeżych lub 30-40 suszonych grzybków. Badania kliniczne pozwoliły na oszacowanie, iż
konsumpcja 15-20 mg grzybków wpływała na różnorodne zachowanie psychiczne niektórych
pacjentów. Notowano między innymi zaburzenia toku myślenia, zaburzenia emocjonalne oraz
zaburzenia spostrzegania rzeczywistości [
V
OLLENWEIDER I IN
.,
1997
]. W literaturze naukowej
oraz w doniesieniach internatów spotyka się opisy różnorodnych doznań po spożyciu
grzybków. Spośród wielu efektów najczęściej jednak opisywane są:
- halucynacje, zmiany percepcyjne i zmiany sposobu postrzegania świata definiowane
jako fałszywe spostrzeżenia zmysłowe, patologiczne postrzeganie przedmiotów, które
nie znajdują się w polu widzenia jednostki lub w ogóle nie istnieją; halucynacjom
towarzyszy silne przekonanie o realności odbieranych bodźców,
- uczucie błogostanu czyli przyjemne odprężenie, wrażenie „odpływania”, przyjemne
barwne wizje, ogólne pozytywne spostrzeganie stanu rzeczy, uczucie opuszczenia
ciała, brak koordynacji ruchowej [
K
ELLER I IN
.,
1999
];
- stany psychotyczne w tym paranoidalne urojenia oraz obsesje, nagłe i gwałtowne
zmiany osobowości oraz toku postępowania, może wystąpić tzw. „bad trip”
[
J
ANOSZKA I IN
.,
2005
]
- nadmierne pobudzenie psychosomatyczne, huśtawka nastrojów,
- różnorakiego rodzaju zaburzenia ze strony układu pokarmowego w tym wymioty,
biegunki oraz bóle brzucha.
Badania dotyczące konsumpcji Psilocybe dowodzą, że nie istnieje możliwość fizycznego
uzależnienia od tych grzybów, pomimo zwiększającej się tolerancji przy ich długotrwałym
zażywaniu. Ich częste spożywanie stwarza możliwość uzależnienia psychicznego. Element
oszołomienia, związany z ich spożywaniem, nie jest obojętny dla młodego organizmu.
14
Grzyby te powodują pobudzenie psychoruchowe, halucynacje, uczucie niepokoju. Przy
niewłaściwym stosowaniu może dojść nawet do ostrej psychozy. Człowiek w takim stanie
traci świadomość i może być bardzo niebezpieczny dla siebie i innych. Osoby często
zażywające
substancje
halucynogenne
wykazują
podwyższony
poziom
agresji
[https://hyperreal.info/].
5. SUBSTANCJE AKTYWNE WYSTĘPUJĄCE W GRZYBACH
Głównymi substancjami o właściwościach halucynogennych występującymi
w grzybach są psylocybina (4-fosfonyloksy-N,N-dimetylotryptamina) i towarzyszący jej
drugi alkaloid psylocyna (4-hydroksy-N,N-dimetylotryptamina). Oprócz tych związków, w
grzybach stwierdzono również obecność baeocystyny (4-fosforyloksy-N-metylotryptaminy)
będącej pochodną psylocybiny, a różniąca się od niej jedynie brakiem podstawnika
metylowego
przy
azocie
w
łańcuchu
bocznym,
oraz
norbaeocestyny
(4-
fosforyloksytryptaminy) występującej zazwyczaj w ilościach śladowych.
Psylocyna
Psylocybina
Baeocystyna
Norbaeocystyna
O
N
H
N
H
CH
3
P
OH
O
H
O
O
N
H
N
H
H
P
OH
O
H
O
OH
N
H
N
CH
3
CH
3
O
N
H
N
CH
3
CH
3
P
OH
O
H
O
15
Psylocybina jest jednym z nielicznych związków naturalnych, które zawierają w swej
strukturze atom fosforu. Substancja ta dobrze wchłania się poprzez tkanki jamy ustnej i ulega
w
organizmie
defosforylacji.
W
wyniku
tego
procesu
degradacji
powstaje
najprawdopodobniej jej metabolit – psylocyna, która jest odpowiedzialna za ogół właściwości
halucynogennych grzybów. Przyjęcie inhibitorów monoaminooksygenazy przed zażyciem
psylocybiny groźnie wzmacnia jej działanie. Farmakologicznie działanie psylocybiny jest
charakterystyczne dla substancji halucynogennych i przypomina efekty wywoływane przez
LSD, jednakże około 100 razy słabsze. Przyjęta doustnie, działa około 5-6 godzin. Pierwsze
efekty jej działania zauważalne są po około 15-40 minutach od jej zażycia. Psylocybina
pojawia się we krwi w oznaczalnych stężeniach w 20 - 40 minut po podaniu doustnym 0,2
mg/kg masy ciała [K
AFARSKI
,
2006].
Z przeprowadzonych badań wynika, że ilość psylocybiny niezbędna do wywołania
silnych halucynacji to około 10-18 mg [
H
ASLER I IN
.,
2002
]. Jest to jednak ilość szacunkowa,
gdyż na efekty działania psylocybiny składa się wiele czynników, jak na przykład
indywidualne cechy związane z metabolizmem osoby zażywającej oraz pokarm przyjęty
przed spożyciem grzybów.
Zarówno psylocybina, jak i psylocyna zostały sklasyfikowane jako substancje o
dużym potencjale nadużywania. Substancje te znajdują się w wykazie środków odurzających
w grupie I-P stanowiącym załącznik do ustawy „O przeciwdziałaniu narkomanii”.
O
N
O
H
NH
2
O
OH
O
N
O
H
NH
2
Kwas ibotenowy
Muscymol
Oprócz wyżej wymienionych psylocyny i psylocybiny w wielu grzybach
o właściwościach halucynogennych występują także kwas ibotenowy oraz muscymol (5-
(aminometylo)-3-izoksazolol), pochodne izoksazoli [
H
ALLEN I IN
.,
2002
]. Związki te występują
w znacznych ilościach w muchomorach (Amanita muscaria, Amanita phalloides, Amanita
pantherina), i to właśnie one odpowiedzialne są za ich właściwości odurzające. W 100 g
suchej masy grzyba Amanita muscaria zawartych jest 180 mg wymienionych substancji, z
których jedynie 25 mg, to kwas ibotenowy. W organizmie kwas ten metabolizowany jest
właśnie do muscymolu, który wykazuje mniejszą toksyczność i wydalany jest z moczem w

16
postaci niezmienionej. Dawka niezbędna do wywołania doznań narkotycznych to 30-60 mg
dla kwasu ibotenowego oraz 10-15 mg dla muscymolu [
H
ALPERN
,
2004
]. Aktualny pogląd
głosi, że kwas ibotenowy nie przekracza bariery krew-mózg w formie zmienionej i jest
częściowo metabolizowany do muscymolu i muskazonu, a częściowo wydalany w
niezmienionej formie. Z badań prowadzonych nad zwierzętami przy użyciu kwasu
ibotenowego wynika, że jest potężną neurotoksyną (po wstrzyknięciu domózgowym). Jest
strukturalnie podobny do glutaminy i aktywuje receptory NMDA, ale to prawdopodobnie nie
włącza się to w ogół działania psychoaktywnego Amanita muscaria. Ma on działanie 5-8 razy
słabsze niż muscymol (efektywna dawka to 50-100 mg). Muscymol odpowiada za większą
część działania psychoaktywnego muchomorów. Główne działanie tego związku polega na
blokowaniu receptora GABA-A. Związek ten używany jest w badaniach nad GABA jako jego
najskuteczniejszy broker [
L
I I
O
BERLIES
,
2005
]. Dowiedziono, że muscymol działa na kilka
obszarów mózgu - korę mózgową, hipokamp i móżdżek. Związek ten wpływa także na
poziom neuroprzekaźników: zwiększa ilość serotoniny i acetylocholiny w mózgu, a obniża
ilość noradrenaliny. Działanie muscymolu znacznie różni się od działania pochodnych
fenyloetyloaminy i indolu, co jest widoczne na wykresach badań EEG. Nie są to jednak
naukowo potwierdzone badania, gdyż muscymol nie jest metabolizowany przez organizm
ludzki. Oznacza to, z czysto teoretycznego punktu widzenia, że nie ma on prawa oddziaływać
w jakikolwiek sposób na ciało i umysł. Muscymol wydalany jest z organizmu w
niezmienionej formie. Dawkowanie doustne substancji waha się w granicach 10-15 mg. W
ustawie o przeciwdziałaniu narkomanii kwas ibotenowy oraz muscymol nie znajdują się w
wykazie środków psychotropowych.
Kolejnym związkiem, który występuje w muchomorach w niewielkich ilościach jest
muskazon. Wykazuje on psychoaktywość i bardzo możliwe, że odpowiada za część ogólnego
działania muchomorów czerwonych. W niewielkich ilościach (0,002% - 0,003% suchej masy
grzyba), w Amanita muscaria występuję muskaryna. Alkaloid ten, charakterystyczny dla
innych gatunków grzybów (min.: strzępiaka ceglastego Inocybe patouillardii) oddziaływuje
na poziom acetylocholiny w mózgu i działa na receptory muskarynowe. Zawartość
muskaryny w muchomorach jest dosyć niska, jednak może być ona odpowiedzialna za
cholinergiczne działanie muchomorów. Choć dowiedziono naukowo aktywność muskaryny,
to jej wchłanianie przez ścianę jelita jest bardzo powolne i prawie nie przedostaje się ona
przez barierę krew-mózg (możliwe jest to w zasadzie tylko przy równoczesnym podaniu
lecytyny). Ponadto efekt działania muskaryny znacznie różni się od działania Amanita

17
muscaria. Zatem muskaryna nie ma większego wpływu na charakter odurzenia muchomorem
czerwonym.
6. BADANIA FARMAKOKINETYCZNE
Rosnąca liczba publikacji naukowych wskazuje na coraz to większe zainteresowanie
zarówno środowisk medycznych jak i chemicznych tematem oddziaływania psylocybiny na
organizm ludzki.
Badania przeprowadzane na wolontariuszach oraz zwierzętach laboratoryjnych, przy
użyciu
14
C-znakowanej psylocybiny wykazały, iż metabolitami tej substancji są 4-hydroksy-
N,N-dimetylotryptamina, aldehyd 4-hydroksy-indolo-3-octowy, kwas 4-hydroksy-indolo-3-
octowy oraz 4-hydroksytryptofanol. Produkty te powstają w procesie deaminacji oraz
oksydacji psylocybiny [
H
ASLER I IN
.,
1997;
H
ASLER I IN
.,
2002
]. Dodatkowo postulowane jest
tworzenie się w szlaku metabolizmu psylocybiny, psylocyno-O-glukuronidu (typowego
produktu detoksykacji) na zasadzie analogii tworzenia się 5-hydroksytryptamin-O-
glukuronidu w szlaku metabolizmu serotoniny. Jednakże, przeprowadzone do tej pory
badania nie pozwalają na jednoznaczną identyfikację tego metabolitu [
P
ASSIE I IN
.,
2002
].
Psylocyna pojawia się w surowicy po około 30 minutach. W tym czasie, w wątrobie
zachodzi główny szlak przemiany metabolicznej tej substancji. Psylocybina ulega gwałtownej
defosforylacji, przy pomocy fosfatazy alkalicznej, do psylocyny, która jest główną substancją
odpowiedzialną za właściwości halucynogenne grzybków. Ponadto stwierdzono również, że
czas półtrwania psylocybiny oraz długość jej działania jest zmienna i zależy od sposobu jej
podania. I tak, dożylne podanie psylocyny skraca czas do 74,1 ± 19,1 min. w porównaniu do
czasu półtrwania psylocyny podanej doustnie – 163 ± 64 min. Z kolei czas działania tej
substancji po dożylnej aplikacji skraca się nawet do 15-30 minut [
H
ASLER I IN
.,
1997
].
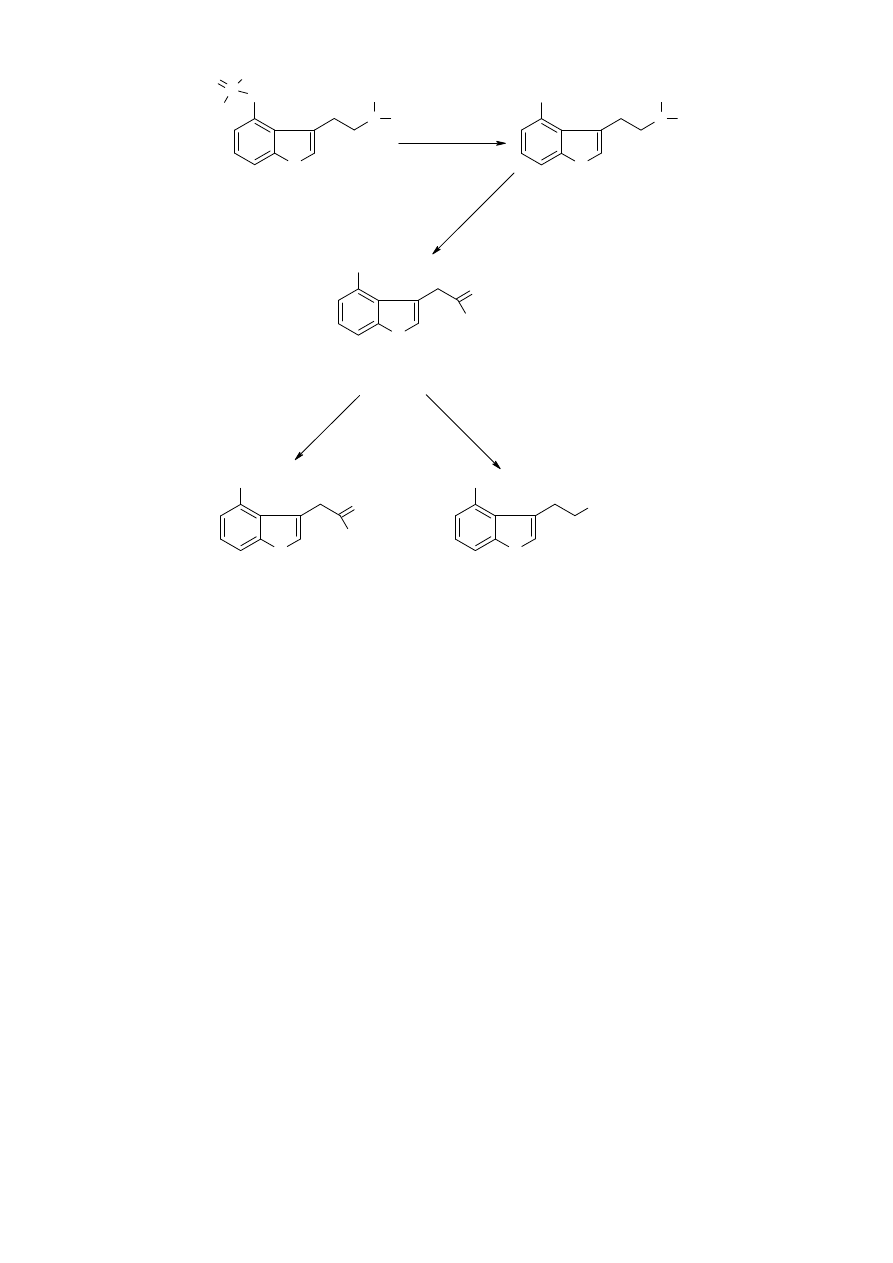
18
Postulowany szlak metabolizmu psylocybiny w organizmie ludzkim [H
ASLER I IN
.,
1997,
H
ASLER I IN
.,
2002].
Budowa zarówno psylocybiny, jak i psylocyny wykazuje podobieństwo strukturalne
do neuroprzekaźnika – serotoniny. Psylocyna jest substancją mniej hydrofilową niż jej
prekursor, w związku z czym łatwiej przenika barierę krew-mózg. Psylocyna wykazuje
właściwości antagonistyczne względem receptorów serotoniny oraz mimetyczne względem
samej serotoniny. Dowiedziono, iż za działanie halucynogenne, zarówno związków będących
analogami strukturalnymi fenyloetyloaminy (amfetamina, meskalina) jak i indoloaminy
(psylocyna) odpowiedzialne jest ich powinowactwo do receptorów serotoninowych typu 5-
HT
2
,
a w szczególności 5-HT
2A
i 5HT
2C
[
A
GHAJANIAN I
M
AREK
,
1999
]. Dzięki tym
właściwościom psylocybina zwiększa poziom serotoniny w mózgu oraz powoduje
pobudzenie czynności sensoromotorycznych i percepcyjnych. Dlatego też charakterystyczne
objawy zażywania grzybków halucynogennych, to niepokój oraz różnego rodzaju
halucynacje.
O
P
OH
O
H
O
N
H
N
CH
3
CH
3
OH
N
H
N
CH
3
CH
3
OH
N
H
O
H
OH
N
H
O
OH
OH
N
H
OH
Psylocybina
Psylocyna
4-hydroksyindoloacetaldehyd
4-hydroksyindoloetanol
kwas 4-hydroksyindolo-3-octowy

19
OH
N
H
N
CH
3
CH
3
N
H
NH
2
O
H
Psylocyna
Serotonina
7.
MOŻLIWOŚCI
IDENTYFIKACJI
I
OZNACZANIA
SUBSTANCJI
HALUCYNOGENNYCH
Z racji potencjalnego zagrożenia związanego ze zbieractwem, hodowlą, dystrybucją i
zażywaniem grzybków halucynogennych i realizacji założeń Ustawy o zapobieganiu
narkomanii, istnieje zwiększone zapotrzebowanie w zakresie określenia poziomu środków
psychoaktywnych w płynach ustrojowych. Metody analizy jakościowej i ilościowej,
przeznaczone do rutynowych oznaczeń wykorzystywanych przez właściwe instytucje,
powinny być wystarczająco szybkie i wiarygodne. Zatem w tej części opracowania omówione
zostaną aktualnie używane metody izolacji, oraz analizy jakościowej i ilościowej substancji
psychoaktywnych występujących w grzybach polskich.
Izolacja psylocyny i psylocybiny z materiału biologicznego
Proces izolacji psylocybiny i psylocyny z materiału grzybowego jest prosty i dość
szybki. Najczęściej izolacji tych alkaloidów dokonuje się na drodze ekstrakcji do
rozpuszczalnika. Standardowo stosowane rozpuszczalniki to chloroform, metanol bądź woda
[
K
YSILKA I
W
URST
1990,
W
URST I IN
.,
1992
]
. Izolacji substancji halucynogennych, jednym z
wybranych rozpuszczalników, wykonuje się używając ultrasonifikatora celem zniszczenia
komórek grzyba, a tym samym zwiększenia stopnia ekstrakcji substancji halucynogennych z
grzyba. Po oddzieleniu supernatantu od zawiesiny odparowuje się rozpuszczalnik, najlepiej w
środowisku niereaktywnego gazu. Tak otrzymany ekstrakt poddaje się dalszym badaniom
[
M
USSHOFF I IN
.,
2000
].
Inną metodą izolacji halucynogennych alkaloidów jest ekstrakcja materiału
grzybowego rozcieńczonym wodnym roztworem kwasu octowego. W kolejnym etapie
wyodrębniania otrzymany ekstrakt zakwasza się do pH=4 lodowatym kwasem octowym.
Rozwór pozostawia się do odstania na okres jednej godziny, a następnie podgrzewa

20
do temperatury 70º C. Po tym czasie ekstrakt chłodzi się, filtruje, otrzymany filtrat
doprowadza się do pH=8 przy użyciu stężonego wodorotlenku amonu. W ten sposób
otrzymany roztwór poddaje się ekstrakcji eterem dietylowym. Otrzymany ekstrakt eterowy
suszy się nad siarczanem sodu, filtruje i odparowuje w środowisku niereaktywnym [
C
ASALE
,
1985
].
W obu przypadkach otrzymuje się ekstrakty o wystarczającej czystości do
przeprowadzenia dalszych badań. Wynikiem ekstrakcji metanolem jest mieszanina psylocyny
oraz psylocybiny. Z kolei poprzez ekstrakcję, kolejno wodnym roztworem kwasu octowego i
eterem dietylowym otrzymuje się ekstrakt zawierający niemal wyłącznie psylocynę. W
zastosowanych warunkach, obecna w roztworze psylocybina ulega defosforylacji [
C
ASALE
,
1985
].
Najprostszą i najczęściej wykorzystywaną techniką rozdziału i identyfikacji
pochodnych indolowych zawartych w grzybach jest chromatografia cienkowarstwowa (TLC)
[
B
EUG I
B
IGWOOD
,
1981
;
G
ARTZ
,
1987;
G
ROSS
,
2002;
S
EMERDZIEVA I IN
.,
1986;
W
URST I IN
.,
1992
]
.
Rozdziału przy użyciu chromatografii cienkowarstwowej dokonuje się na płytkach pokrytych
krzemionką. Najlepsze efekty rozdziału otrzymano przy użyciu eluentów: n-butanol, kwas
octowy, woda (12:3:5 v/v/v), 1,5% rozwór amoniaku w metanolu, n-butanol, kwas octowy,
woda (2:1:1 v/v/v) oraz amoniak, woda, n-propanol (12:188:500 v/v/v). Stosując pierwszy z
opisanych eluentów otrzymano najlepszy rozdział i nie obserwowano rozmycia plamek na
płytce [
B
EUG I
B
IGWOOD
,
1981
]. W celu wizualizacji rozdzielonych substancji standardowo
używa się odczynnika Ehrliha służącego do wykrywania amin. Ponadto psylocyna jak i
psylocybina są dobrze widoczne na płytce w niskim paśmie promieniowania UV.
Metody immunochemiczne
Najbardziej przydatnymi metodami analizy jakościowej i ilościowej substancji o
właściwościach narkotycznych, są te, które nie wymagają dodatkowych technik izolacji z
materiału biologicznego (krew, mocz). Tego typu metody oparte są przede wszystkim o
badania immunochemiczne. Możliwość wytwarzania przeciwciał dowolnych leków w
organizmie żywym spowodowała istotny postęp w badaniach ilości i jakości środków
psychoaktywnych. Standardowy proces otrzymywania trwałych połączeń chemicznych
badana substancja-białko, opiera się na wykorzystaniu reaktywnych grup, które z tą
substancją tworzą czynny związek immunologiczny - wysokocząsteczkowy hapten
(immunogenic conjugate). Stworzenie tego typu haptenu może stymulować wytworzenie
wysoce specyficznych przeciwciał monoklonalnych, które mogą być wykorzystane w analizie

21
jakościowej oraz ilościowej wybranych substancji psychoaktywnych. W literaturze istnieje
niewiele informacji dotyczących zastosowania tej metody do identyfikacji substancji
halucynogennych. Jedyna informacja dotyczy prób syntezy koniugatów białkowych
psylocyny [
A
LBERS I IN
.,
2002
].
Metody analizy instrumentalnej
Do najbardziej przydatnych i efektywnych metod zarówno ilościowej, jak i
jakościowej analizy substancji psychoaktywnych należy obecnie wysokosprawna
chromatografia cieczowa (HPLC). Zastosowanie tej metody do celów identyfikacyjnych
wzrosło szczególnie po wprowadzeniu techniki detekcji typu diode-array. Ten typ detekcji
pozwala uzyskać obok sygnału piku danego związku na chromatografie jego widmo UV
(200-350 nm) w układzie trójwymiarowym, potwierdzające jego jednorodność. Ta
właściwość detektora diode-array znacznie podnosi możliwości identyfikacji związków
[
B
OGUSZ I
W
U
,
1991;
F
ERARA I IN
.,
1992;
L
OGAN I IN
.,
1990
].
Wykorzystanie HPLC z możliwością użycia innych detektorów: UV [
K
YSILKA I IN
.,
1985;
T
SUJIKAWA I IN
.,
2003
], fluorescencyjnym [
S
AITO I IN
.
2004;
S
AITO I IN
.,
2005
],
chemiluminescencyjnym [
A
NASTOS I IN
.,
2005;
A
NASTOS I IN
.,
2006
], elektrochemicznym
[
C
HRISTIANSEN I
R
ASMUSSEN
,
1983
], woltametrycznym [
K
YSILKA I IN
.,
1985
] i masowym
[
B
OGUSZ I IN
.,
1998;
S
AITO I IN
.
2004
], pozwala na uzyskanie wysokiego stopnia odzysku
substancji halucynogennych, wysoką selektywność pomiaru oraz niewielki nakład czasu
niezbędny do wykonania pomiarów. Metoda ta została z powodzeniem użyta do badania
obecności i stężenia psylocyny w próbkach krwi [
L
INDENBLATT I IN
.,
1998
], poziomu
psylocyny i psylocybiny w suszu grzybowym [
T
HOMPSON
,
1980
], oraz poziomu kwasu
ibotenowego w sporach i kapeluszach muchomora czerwonego [
STROEMER
I IN
.,
2004
].
Kolejną metodą identyfikacji oraz analizy ilościowej związków o aktywności
halucynogennej jest metoda chromatografii gazowej i spektrofotometrii masowej (GC-MS) z
równoczesną możliwością korzystania z biblioteki widm masowych np. systemu HP 5997 OC
MS/MD Chemistation. Wśród możliwych technik analitycznych w tym układzie,
zastosowanie znalazła techniki SIR (selected ion recording) oraz SIM (selected ion
monitoring) stosowane dla niższych stężeń związków halucynogennych [
S
TICHT I
K
ÄFERSTEIN
,
2000
]. Techniki te pozwalają na monitorowanie zmian intensywności wybranych
specyficznych fragmentów cząsteczki tworzących widmo masowe. Dane uzyskane dla
materiału badawczego, mogą znaleźć potwierdzenie w komputerowym układzie
porównawczym z odpowiednim wzorcem wybranym z banku widm. Metoda GC-MS

22
znajduje również zastosowanie w analizie ilościowej. Rutynowo, z uwagi na oznaczalność,
stosuje się technikę SIM z równoczesnym użyciem wzorca wewnętrznego, którym jest
pochodna deuterowana oznaczanego związku. Metoda ta została z powodzeniem zastosowana
do identyfikacji psylocyny, zarówno w materiale grzybowym, jak również w próbkach krwi i
moczu [
K
ELLER I IN
.,
1999;
S
TICHT I
K
ÄFERSTEIN
,
2000,
S
ARWAR I
M
C
D
ONALD
,
2003;
K
IKURA
-
H
ANAJIRI
,
2005
].
W rutynowych badaniach toksykologicznych zastosowanie znajdują również
programy systematycznej analizy ksenobiotyków, wśród których wymienić można system
Remedi HS (Bio-Rad). Program Remedi HS oparty jest na zasadach wysokosprawnej
chromatografii cieczowej (HPLC) i detekcji UV. System ten, który umożliwia szybką analizę
około 500 leków i ich metabolitów w układzie wielopunktowego pomiaru UV
(multiwavelenght ultrafiolet detection), znalazł również zastosowanie analizie substancji
psychotropowych zawartych w grzybach halucynogennych. Metodą tą zidentyfikowano
psylocynę w moczu [
S
TICHT I
K
ÄFERSTEIN
,
2000
].
Najnowszym rozwiązaniem analitycznym jest zastosowanie chromatografii cieczowej
sprzężonej ze spektrometrią masową (LC-MS). Osiągane progi detekcji dla oznaczeń wielu
związków w tym układzie są niższe aniżeli uzyskane w systemie GC-MS i najczęściej
występują w zakresie od 10 ng/ml. Z zastosowaniem techniki chromatografii cieczowej
sprzężonej ze spektrometrią mas z jonizacją przez rozpylanie w polu elektrycznym (LC/MS-
ESI), opracowano szybką identyfikację wielu substancji o właściwościach narkotycznych,
takich jak amfetamina, LSD oraz psylocybina. Czas analizy każdego ze związków jest był
dłuższy niż 5 minut, a zastosowanie łagodnej metody jonizacji ESI miało duże znaczenia dla
analizy, substancji termolabilnych [
P
IHLAINEN I IN
.,
2003
]. Z kolei stosując technikę
chromatografii cieczowej sprzężonej ze spektrometrią mas z chemiczną jonizacją pod
ciśnieniem atmosferycznym (LC/MS-APCI) wykryto i oznaczono psylocynę w
zredukowanych do niewielkich objętości próbkach krwi [
L
ECHOWICZ
,
2004
].
Metodą służącą najczęściej do rozdziału związków o niewielkich masach
cząsteczkowych jest strefowa elektroforeza kapilarna (CZE). Znalazła ona również
zastosowanie w identyfikacji i określeniu zawartości substancji o właściwościach
halucynogennych w grzybach. Pomiary psylocybiny zostały przeprowadzone w systemie
P/ACE 5000 i pozwoliły na dokładne określenie zawartości psylocybiny oraz baeocestyny w
próbkach grzybów. [
P
EDERSEN
-B
JERGAARD I IN
.,
1997
].

23
Inne metody
W ostatnich kilkudziesięciu latach nastąpił znaczny rozwój technik analitycznych
opartych o zastosowanie metod biologii molekularnej. Metody te są coraz powszechniej
wykorzystywane w wielu dziedzinach nauki, w tym również do identyfikacji grzybów
halucynogennych. Umożliwiają one identyfikację poszczególnych gatunków grzybów
halucynogennych [
K
IMBERLY I
S
AVILLE
,
2004;
NUGENT I SAVILLE
,
2004; L
I I
O
BERLIES
,
2005
]
bez konieczności mikroskopowej analizy zarodników, czy też makroskopowego rozpoznania
materiału w postaci zasuszonej.
Jedną z takich metod jest PCR, która zrewolucjonizowała współczesną biologię
molekularną umożliwiając wyprodukowanie milionów kopii fragmentów DNA w zaledwie
kilka godzin. Metoda ta jest doskonałym narzędziem do wykrywania ekstremalnie niskiego
stężenia szukanego metabolitu z wysoką specyficznością. Niezwykła wybiórczość i
wydajność amplifikacji metody PCR jest uzupełnieniem procedur analitycznych, które
omówiono powyżej. Połączenie tych metod umożliwia badanie pojedynczego genu lub
krótkiego segmentu w jego obrębie, nawet jeśli cały dostępny do analiz DNA pochodzi z
zaledwie jednej komórki. Metodę PCR wykorzystuje się obecnie powszechnie do
wykrywania infekcji wirusowych, również obecności wirusa HIV-1 we krwi pacjentów
chorych na AIDS (lub podejrzewanych o chorobę); do badania samoczynnie powstających
nowotworów ludzkich, aby określić ewentualne zmiany w sekwencji genów kontrolujących
wzrost i podział komórek, oraz przed przeszczepami, do określania typu genów, od których
zależy układ zgodności tkankowej. PCR okazuje się również potężnym narzędziem do
jednoznacznej
identyfikacji
grzybów
z
rodzaju
Psilocybe
[
A
DAMCZYK
,
2006
].
Przeprowadzenie testów przy użyciu tej metody może zostać wykorzystane do odróżniania
bezpostaciowych grzybni, ujawniania łysiczki w mieszaninach suszu różnych gatunków
grzybów.
8.
MOŻLIWOŚCI
IDENTYFIKACJI
I
OZNACZANIA
SUBSTANCJI
HALUCYNOGENNYCH W LABORATORIACH DOLNEGO ŚLĄSKA
Badania strukturalne substancji halucynogennych za pomocą metody NMR:
Zakład Chemii Bioorganicznej
Kierownik: Prof. Paweł Kafarski
Tel.: +713203458

24
Politechnika Wrocławska
Wybrzeże Wysińskiego 27
50-370 Wrocław
Rozdział
i
identyfikacja
chemicznych
substancji
halucynogennych
metodą
wysokosprawnej chromatografii cieczowej HPLC:
Zakład Chemii Bioorganicznej
Kierownik: Prof. Paweł Kafarski
Politechnika Wrocławska
Wybrzeże Wysińskiego 27
50-370 Wrocław
Rozdział
i
identyfikacja
chemicznych
substancji
halucynogennych
metodą
chromatografii gazowej, HPLC i elektroforezy kapilarnej:
Zakład Chemii Ekologicznej
Kierownik: dr hab. Piotr Wieczorek
tel.: +774545841 w. 2545; 2550
Uniwersytet Opolski
ul Oleska 48
45-052 Opole
Badania materiału biologicznego za pomocą PCR:
Zakład Technik Molekularnych
Kierownik: Dr hab. Tadeusz Dobosz
Tel.: +717841588
Akademia Medyczna we Wrocławiu
ul. M. Curie-Skłodowskiej 52
50-368 Wrocław
Opracowanie metody immunologicznej oznaczania substancji halucynogennych:
Zakład Immunologii Chorób Zakaźnych
Kierownik: Prof. dr hab. Andrzej Gamian
Tel.: +71 370 99 86
Polska Akademia Nauk
Instytut Immunologii i Terapii Doświadczalnej
ul. Rudolfa Weigla 12
53-114 Wrocław
9. LITERATURA
Adamczyk A., Identyfikacja grzybów gatunku Psilocybe semilanceata przy pomocy techniki
PCR, Praca magisterska, Wydział Chemiczny, Politechnika Wrocławska, Wrocław,
2006.
Aghajanian G. K., Marek G. J., 1999, Serotonin and hallucinogens,

25
Neuropsychopharmacology, 21, 16-23.
Albers Ch., Lehr M., Beike J. Köhler H., Brinkmann B., 2002, Synthesis of a psilocyn hapten
and a protein-hapten conjugate, J. Pharm. Pharmacol. 54, 1265-
1267.
Anastos N., Barnett N. W., Lewis S. W., Gathergood N., Scammells P. J.,. Sims D. N, 2005,
Determination of psilocin and psilocybin using flow injection analysis with acidic
potassium permanganate and tris(2,2
/
-bipyridyl) ruthenium(II) chemiluminescence
detection respectively, Talanta, 67, 354-359.
Anastos N., Lewis S. W., Barnett N. W., SimsD. N., 2006, The determination of psilocin and
psilocybin in hallucinogenic mushrooms by HPLC utilizing a dual reagent acidic
potassium permanganate and tris(2,20-bipyridyl)ruthenium(II) chemiluminescence
detection system, J. Forensic Sci. 51, 45-51.
Beug M., Bigwood J., 1981, Quantitative analysis of psilocybin and psilocin in Psilocybe
baeocystis by High-Performance Liquid Chromatography and Thin-Layer
Chromatography, J. Chromatogr., 207, 379-385.
Bogusz M., Wu M., 1991, Standarized HPLC-DAD systems based on retention for systematic
toxicological screening, J. Anal. Toxicol. 15, 188-195.
Bogusz M. J., Maier R. D., Schafer A. T., Erkens M., 1998, Honey with Psilocybe
mushrooms: a revival of a very old preparation on the drug market, Int. J. Legal. Med.,
111, 147–50.
Casale J. F., 1985, An aqueous-organic extraction method for the isolation and identification
of Psilocin from hallucinogenic mushrooms, J. Forensic Sci., 30, 247-250.
Christiansen A., Rasmussen K.., 1983, Screening of hallucinogenic mushrooms with high
performance liquid chromatography and multiple detection, J. Chromatogr. 270, 293–
299.
Ferara S. D., Tedeschi L., Frison G., Castanga F., 1992, Solid phase extraction and HPLC-UV
confirmation of drug of abuse in urine, J. Anal. Toxicol. 16, 217-221.
Gartz J., 1987,
Gartz J., 1992, New aspect of the occurrence, chemistry and cultivation of European
hallucinogenic mushrooms, Storia e Scienze Naturali, 8.
Gartz J., 1994, Extraction and analysis of indole derivatives from fungal biomass, J. Basic.
Microbiol. 34, 17–22.
Gartz J., Mueller G. K., 1990, Analysis and cultivation of fruit bodies and mycelia of
Psilocybe bohemica, Biochem. Physiol. Pflanzen, 184, 337-341.

26
Gross S., 2002, Psychotropic drugs in developmental mushrooms: a case study review. J.
Forensic Sci. 47, 1298–1302.
Guzman, G., The genus Psilocybe, 1983 , Beih. Nova Hedwigia 74. J. Cramer, Vaduz.
Hallen H. E., Adams G.C., Eicer A., 2002, Amatoxins and phallotoxins in indigenous and
introduced South African Amanita species, South African J. Botany
68, 322-
326.
Halpern J. H., 2004, Hallucinogens and dissociative agents naturally growing in United
States, Pharmacol. Ther., 102, 131-138.
Hasler F., Bourquin D., Brenneisen R., Bar T., Vollenweider F. X., 1997, Determination of
psilocin and 4-hydroxyindole-3-acetic acid in plasma by HPLC-ECD and
pharmacokinetic profiles of oral and intravenous psilocybin in man, Pharm.
Acta Helv., 72, 175-184.
Hasler F., Bourquin D., Brenneisen R., Vollenweider F. X., 2002, Renal excretion profiles of
psilocin following oral administration of psilocybin: a controlled study in man,
J. Pharm. Biomed. Anal., 30, 331-339.
Heim R., Hofmann A., 1958, Isolement de la Psilocybine à partir du Stropharia cubensis Earle
et d'autres espèces de champignons hallucinogènes mexicains appartenant au genre
Psilocybe, Compt. rend. Acad. sc., 247, 557-561.
http://www.erowid.org/references
http://www.grzyby.pl
https://hyperreal.info/
Janoszka J., Rymkiewicz A., Dobosz T., 2005, Halucynogenne grzyby – Łysiczki
(Psilocybe). Część I. Charakterystyka, skutki zażycia, rozpoznawanie, Arch. Med. Sąd.
Krym. 55, 215-219.
Kafarski P., 2006, Rodzaje i zawartość związków halucynogennych w źródłach biologicznych
z terenu Polski oraz możliwości ich identyfikacji we krwi, Referat na seminarium
naukowym „ Biotechnologia w Strategii Rozwoju Województwa Dolnośląskiego”,
Wrocław.
Keller T., Schneider A., Regenscheit P., Dirnhofer R., Riicker T., Jaspers J., Kisser W., 1999,
Analysis of psilocybin and psilocin in Psilocybe subcubensis GUZMAN by ion
mobility spectrometry and gas chromatography-mass spectrometry, Forensic Sci.
Int., 99, 93-105.
Kikura-Hanajiri R., Hayashi M., Saisho K., Goda Y., 2005, Simultaneus determination of
nineteen hallucinogenic tryptamines/β-calbolines and phenethylamines using gas

27
chromatography-mass spectrometry and liquid chromatography-electrospray
ionization-mass spectrometry, J. Chromatogr. B 825, 29-37.
Kimberly G. N., Saville B. J., 2004, Forensic analysis of hallucinogenic fungi: a DNA-Based
approach, Forensic Sci. Int., 140, 147-157.
Kysilka R., Wurst M., Pacakova V., Stulik K., Haskovec L., 1985, High-performance liquid
chromatographic determination of hallucinogenic indoleamines with simultaneous UV
photometric and voltametric detection, J. Chromatogr. 320, 414–20.
Kysilka R., Wurst M., 1989, High performance liquid chromatographic determination
of some psychotropic indole derivatives, J Chromatogr. 464, 434–437.
Kysilka R., Wurst M., 1990, A novel extraction procedure for psilocybin and psilocin
determination in mushroom samples, Planta Med., 56, 327-328.
Lechowicz W., Metodyka identyfikacji i oznaczania wybranych substancji halucynogennych
dla potrzeb opiniowania sądowego, Materiały konferencyjne, Sympozjum Ślesin 2004.
Li Ch., Oberlies N. H., 2005, The most widely recognized mushroom: Chemistry of the genus
Amanita, Life Sci., 78, 532-538.
Lindenblatt H., Kramer E., Holzmann-Erens P., Gouzoulis-Mayfrank E., Kovar K.A., 1998,
Quantitation of psilocin in human plasma by high-performance liquid chromatography
and electrochemical detection: comparison of liquid—liquid extraction with automated
on-line solid-phase extraction, J. Chromatogr. B, 709, 255-263.
Logan K. G., Stafford D. T., Tebbett J. R., Moore C. M., 1990, Rapid screening for 100 basic
drugs and metabolites in urine using cation exchango solid phase extraction and high-
performance liquid chromatography with diode array detection, J. Anal. Toxicol., 14,
154-160.
Musshoff F., Madea B., Beike J., Hallucinogenic mushrooms on the German market —
simple instructions for examination and identification, 2000, Forensic Sci. Int., 113,
389-395.
Nugent K. G., Saville B. J., 2004, Forensic analysis of hallucinogenic fungi: A DNA-based
approach, Forensic Sci. Int. 140,147-153.
Passie T., Seifert J., Schneider U., Emrich H. M., 2002, The pharmacology of psilocybin,
Addiction Biology, 7, 357–364
Pedersen-Bjergaard S., Sannes E., Rasmussen K. E, Tonnesen F., 1997, Determination of
psilocybin in Psilocybe semilanceata by capillary zone electrophoresis, J.
Chromatogr. B, 694, 375-381.
Pihlainen K., Sippola E., Kostiainena R., 2003, Rapid identification and quantitation of

28
compounds with forensic interest using fast liquid chromatography-ion trap mass
spectrometry and library searching, J. Chromatogr. A, 994, 93-102.
Repke D. B., Leslie D. T., Mandell D. M., Kish N.G., 1977, GLC-mass spectral analysis of
psilocin and psilocybin, J. Pharm. Sci. 66, 743–744.
Rudgley R., Alchemia kultury. Od opium do kawy, PIW, 2000.
Saito K., Toyo’oka T., Fukushima T., Kato M., Shirota O., Goda Y., 2004, Determination of
psilocin in magic mushrooms and rat plasma by liquid chromatography with
fluorimetry and electrospray ionization mass spectrometry, Anal. Chim. Acta. 527,
149–156.
Saito K., Toyo’oka T., Kato M., Fukushima T., Shirota O., Goda Y., 2005, Determination of
psilocybin in hallucinogenic mushrooms by reversed-phase liquid chromatography
with fluorescence detection, Talanta 66, 562–568.
Sarwar M., McDonald J. L., 2003, A rapid extraction and GC/MS methodology for the
identification of psilocin in mushroom/chocolate concoctions, Microgram J. 1,
177–183.
Schneider S., Donnelly M., Mushroom Toxicity, w: Auerbach PS, edytor:, Wilderness
Medicine 3
rd
ed, St. Louis, Mosty, 1995.
Schwartz R. H., Smith D. E., 1988, Hallucinogenic mushrooms, Clin. Pediatr. 27, 70-73.
Semerdzieva M., Wurst M., Koza T., Gartz J., 1986, Psilocybin in Fruchtkoerpern von
Inocybe aeruginascens. Planta Med., 47, 83-85.
Shirota O., Hakamata W., Goda Y., 2003, Concise large-scale synthesis of psilocin and
psilocibin, principal hallucinogenic constituents of „Magic Mushroom”, J.
Nat. Prod. , 66, 885-887.
Stamets P., Gartz J., 1995, A new caerulescent Psilocybe from the Pacific Coast of
Northwestern America Integration, Bereich Biotechnologie 6, 21-28.
Sticht G., Kaferstein H., 2000, Detection of psilocin in body fluids, Forensic Sci. Int., 113,
403-407.
Stijve T., Kuyper T., 1985, Occurence of psylocybin in various higher fungi from several
European countries, Planta Med., 385-387.
Stroemer F. C., Janak, K., Koller G. E. B. 2004, Ibotenic acod in Amanita muscaria spores
and caps, Mycologist, 18, 114-117.
Thompson B. M., 1980, Analysis of psilocybin and psilocin in mushroom extracts by
reversed-phase high performance liquid chromatography, J. Forensic. Sci, 25, 779-
785.

29
Tsujikawa K., Kanamori T., Iwata Y., Ohmae Y., Sugita R., Inoue H., Kishi T., 2003,
Morphological and chemical analysis of magic mushrooms in Japan, Forensic Sci.
Int., 138, 85-90.
Vollenweider F. X., Leenders K. L., Scharfetter C., Maguire P., Stadelamnn O., Angst J.,
1997, Positron emission tomography and fluorodeoxyglucose studies of metabolic
hyperfrontality and psychopathology in the psilocybin model of psychosis,
Neuropsychopharmacology, 16, 357-372.
Wurst M., Kysilka R., Koza T., 1992, Analysis and isolation of indole alkaloids of fungi by
high-performance liquid chromatography, J. Chromatogr. 593, 201–208.
Wyszukiwarka
Podobne podstrony:
Metody hodowli i identyfikacji grzybów drożdżopodobnych i dimorficznych
Metody hodowli i identyfikacji grzybów drożdżopodobnych i dimorficznych
Metody hodowli i identyfikacji grzybów drożdżopodobnych i dimorficznych
Ryzyko przyjmowania grzybów halucynogennych
Metoda wyodrębniania psylocyny z grzybów halucynogennych
leki psychostymulujące i halucynogenne
identyfikacja analiza i ocena zagrozen
6 Identyfikacja antropologiczna
Charakterystyka niektórych wirusów i grzybów
Morfologia grzybow
jak zdekodowac informacje zawarte w numerze identyfikacyjnym nadwozia lub ramy pojazdu
Identyfikacja majka
Identyfikacja modelu matematycznego elementu
1 Identyfikacja obiektow sterow Nieznany (2)
ZIARENKOWCE I GRONKOWCE IDENTYFIKACJA
Identyfikacja Chrystusa we wszystkich wiekach 640409
więcej podobnych podstron