
WYKŁAD 1, 05.10.12 r.
BIOTECHNOLOGIE Z OCHRONY ROŚLIN W OCHRONIE ŚRODOWISKA
Wielodyscyplinarne problemy ochrony roślin powinny, za punkt odniesienia, przyjmować ochronę
środowiska rolniczego, czyste środowisko rolnicze jest bowiem podstawą produkcji czystej żywności
mającej być dla ludzi źródłem nie tylko pokarmu, ale również zdrowia.
a) Zasady IPM (Integrowana Ochrona Roślin) i znaczenie dla ochrony środowiska
b) Ochrona gleby i wód przed zanieczyszczeniem pestycydami i metalami ciężkimi
Zasadniczy rozwój nowoczesnej ochrony roślin datuje się od połowy ubiegłego stulecia, kiedy to
nastąpił gwałtowny rozwój nauk przyrodniczych.
Opracowywano i wdrażano najróżniejsze metody oraz wykorzystywano różne środki. U podstaw
powodzenia leżało jednak zawsze poznanie biologii i ekologii szkodników oraz czynników
chorobotwórczych.
To dopiero pozwalało na opracowanie metody lub zespołu metod przeciwdziałających ich szkodliwej
działalności.
DDT
W walce ze szkodnikami ludzkość wykorzystywała różne sposoby.
Jednym z pierwszych była prymitywna metoda mechanicznego, czyli po prostu ręcznego,
niszczenia szkodników (np. w starożytności).
Bardzo wcześnie zaczęto również wykorzystywać proste metody biologiczne.
Wyróżniamy 6 głównych metod, które w miarę rozwoju coraz powszechniej używano w
poszczególnych uprawach, są to:
Zwalczanie mechaniczne, fizyczne, biologiczne, agrotechniczne …
W miarę rozwoju naszej wiedzy zmieniły się techniki i materiały ich realizacji.
W przeciągu stulecia zmieniał się także ranking ich ważności.
Pierwsze 3 dekady XX wieku to duże zainteresowanie metodami biologicznymi.
Ich skuteczność była jednak z ekonomicznego punktu widzenia zbyt mała.
Zabiegi chemiczne stały się prawie tak automatyczną czynnością w uprawie roślin jak oranie, sianie
czy sadzenie, a terminy ich wykonywania wyznaczano zwykle na podstawie faz fenologicznych.
Zgubne skutki takiego postępowania nie kazały jednak długo na siebie czekać. Zaliczamy do nich:
rozwój ras odpornych, wyniszczenie organizmów pożytecznych, zanieczyszczenia środowiska.
Kolejnym etapem w praktyce ochrony roślin było tzw. zwalczanie nadzorowane.
Definicja koncepcji integracji przyjęta przez Międzynarodową Organizację Biologicznego i
Integrowanego Zwalczania Szkodliwych Zwierząt i Roślin brzmi:
„ Jest to zwalczanie szkodników i chorób przy użyciu wszystkich metod zgodnie z wymaganiami
ekonomicznymi, ekologicznymi i toksykologicznymi, dających pierwszeństwo naturalnym czynnikom
ograniczającym i ekonomicznym programom zagrożenia.”
Precyzyjne rolnictwo – system
Metody i techniki wykorzystywane w ochronie integrowanej (agrotechniczne, mechaniczne, fizyczne,
biologiczne, chemiczne, genetyczne, prawne) muszą odpowiadać standardom nowoczesnego
rolnictwa.
Jednak ranga ich ważności zmienia się zarówno ze względu na rodzaj rośliny uprawnej, jak i gatunek
lub zespół gatunków zwalczanych agrofagów.
Integrowany system ochrony roślin jest realizowany nie tylko w uprawach roślin polowych, ale także
szklarniowych.
W przypadku roślin polowych, największy postęp odnotowano w produkcji sadowniczej, a zwłaszcza
w uprawie jabłoni.
Podstawą integrowanych metod produkcji jest integrowanie różnych sposobów zwalczania
agrofagów.
Znaczne możliwości w dalszym rozwoju integrowanych metod ochrony roślin. Możliwości te, to
zarówno pozyskiwanie przy pomocy
inżynierii genetycznej roślin odpornych
na czynniki
chorobotwórcze i szkodniki, jak i
genetyczne modyfikacje pożytecznych stawonogów
, w celu
efektywnego wykorzystania ich wraz z chemicznymi środkami ochrony roślin.
Rozwój nowych koncepcji ochrony roślin wymusił również daleko idące zmiany w asortymencie
używanych środków ochrony roślin.
Ze względu na pozostałości pestycydów w środowisku, a także w organizmach zwierząt wycofano
najbardziej niebezpieczne, np. związki arsenowe, nitrowane i chlorowane węglowodory.
Pocieszające jest, że duże i liczące się koncerny chemiczne prowadzą intensywne badania nad syntezą
nowych, bezpieczniejszych związków, w tym pochodzenia naturalnego. Jedną z takich grup są
syntetyczne pyretroidy
.
Jednak ze względu na wady:
toksyczne działanie
Znacznie bezpieczniejszą grupę związków nowej generacji stanowią
inhibitory syntezy chityny
,
zakłócające proces przeobrażenia stadiów larwalnych owadów.
W ostatnich latach pojawiły się
związki z grupy tzw. MAC’s
. Są to związki uniemożliwiające
prawidłowe zmiany wahań.

Substancje pochodzenia roślinnego, ale o innych właściwościach niż pyretroidy, np. azadirachtyna
wykazująca działanie w stosunku do gąsienic wielu gatunków motyli, uznanych za szkodniki roślin
uprawnych lub magazynów.
Metody ochrony roślin w programie IPM!!!
Zgubne skutki takiego postępowania nie kazały jednak długo na siebie czekać. Zaliczamy do nich:
rozwój ras odpornych,
wyniszczenie organizmów pożytecznych,
zanieczyszczenie środowiska.

WYKŁAD 2, 12.10.12 r.
PRZEDMIOT BIOTECHNOLOGII I DEFINICJE PODSTAWOWYCH POJĘĆ
BIOTECHNOLOGIA jest interdyscyplinarną dziedziną nauki, obejmującą różne kierunki technicznego
wykorzystania materiałów i procesów biologicznych.
Obejmuje ona procesy biosyntezy i biotransformacji przebiegające przy udziale drobnoustrojów,
kultur komórkowych – roślinnych i zwierzęcych – in vitro oraz enzymów, a także izolację tak
otrzymanych bioproduktów.
NAUKOWE PODSTAWY ORAZ ZAKRES ZASTOSOWAŃ BIOTECHNOLOGII
BIOTECHNOLOGIA
-> genetyka, biochemia, chemia, biologia molekularna, inżynieria, informatyka, matematyka, fizyka,
ekonomia, analityka, biologia komórki, mikrobiologia, ekologia, rolnictwo, ochrona zdrowia, ochrona
środowiska, przemysł chemiczny, przemysł spożywczy, nośniki energii, surowce, inne zastosowania.
BIOTECHNOLOGIE TRADYCYJNE, przebiegające z użyciem naturalnych enzymów lub drobnoustrojów
i komórek organizmów wyższych nie zawierających obcego materiału genetycznego.
BIOTECHNOLOGIE NOWOCZESNE, w których stosowane są szczepy drobnoustrojów lub linie
komórkowe, skonstruowane metodami inżynierii genetycznej, względnie enzymy modyfikowane
technikami inżynierii białka.
TECHNOLOGIA MIKROBIOLOGICZNA – procesy uwarunkowane działalnością drobnoustrojów,
wyróżniają się ogromnymi możliwościami w zakresie praktycznego wykorzystania zdolności
poszczególnych mikroorganizmów do wywołania różnorodnych przemian chemicznych.
Jest to dział biotechnologii obejmujący procesy mikrobiologicznej biosyntezy i biotransformacji, który
powstał na gruncie technologii fermentacji i mikrobiologii przemysłowej.
FERMENTACJA
– termin pochodzi od łacińskich słów: fervere, fermentatio, co oznacza burzenie się.
Pierwotnie używano go do określenia wizualnych efektów towarzyszących procesom zachodzącym w
sokach, zacierach zbożowych na skutek wydzielania się pęcherzyków CO
2
podczas przemiany cukrów.
Według Pasteura fermentacja to „życie bez tlenu”.
W mikrobiologii technicznej i praktyce przemysłowej termin „fermentacja” określa różne procesy
mikrobiologiczne, w których związki organiczne podlegają przemianom chemicznym w wyniku
aktywności metabolicznej drobnoustrojów.
Pojęciem fermentacji zostały objęte zarówno procesy beztlenowe, np. fermentacja etanolowa czy
mleczanowa, jak i tlenowe, np. fermentacja cytrynianowa czy octowa, procesy biosyntezy (np.
fermentacja penicylinowa), jak również biotransformacji (np. przekształcenia związków
steroidowych).
Technologia fermentacji jest synonimem technologii mikrobiologicznej.

TECHNOLOGIA ENZYMÓW – enzymy znalazły zastosowanie w przemyśle spożywczym, chemicznym,
farmaceutycznym i włókienniczym, w lecznictwie, analityce i gospodarstwie domowym.
Zostały opracowane techniki unieruchamiania (immobilizacji) biokatalizatorów, co nadaje im większą
stabilność, pozwala na wielokrotne użycie oraz opracowanie enzymowych procesów ciągłych.
Opracowano także metody immobilizacji całych komórek oraz procesy technologiczne z ich użyciem.
Dzięki temupowstał nowy dział biotechnologii – technologia biokatalizatorów unieruchomionych.
INŻYNIERIA BIOPROCESOWA – wcześniej używano terminów „inżynieria biochemiczna”, „inżynieria
fermentacji”, „inżynieria mikrobiologiczna”.
Jest to element biotechnologii, który warunkuje wykorzystanie osiągnięć biologów i chemików przez
przeniesienie „technologii laboratoryjnej” do warunków fabrycznych.
Rozwój inżynierii bioprocesowej pozwolił na praktyczna wykorzystanie nowych koncepcji w biologii –
technika hodowli in vitro.
INŻYNIERIA GENETYCZNA (technologia genowa) – określa nowoczesne metody biologii molekularnej
i genetyki, które umożliwiają manipulacje genetyczne poza komórką, czyli rekombinowanie DNA in
vitro (np. konstruowanie nowych genotypów, które nie występują w naturze).
Praktyczne wykorzystanie inżynierii genetycznej to biotechnologia środków leczniczych (hormony,
białka odpornościowe, szczepionki nowych generacji). Możliwa jest biosynteza metabolitów, których
otrzymywanie przy użyciu drobnoustrojów było dotychczas niemożliwe.
Duże usługi oddaje inżynieria genetyczna w badaniach molekularnych w zakresie immunologii i
onkologii.
INŻYNIERIA CYTOGENETYCZNA – inżynieria genetyczna na poziomie komórkowym.
Praktyczne wykorzystanie w biotechnologii to np. fuzja protoplastów, jako metoda doskonalenia
właściwości biosyntetycznych szczepów i linii komórkowych, metody fuzji komórek zwierzęcych (np.
fuzja nowotworowych komórek szpiczaka – technologia wytwarzania przeciwciał monoklonalnych).
INŻYNIERIA BIAŁKA – metody chemiczne lub biologiczne dążące do otrzymania enzymów w postaci
zmodyfikowanej, półsyntetycznej lub zmutowanej w stosunku do enzymów naturalnych.
Modyfikacja enzymów w celu zmiany ich charakterystyki funkcjonalnej, np. specyficzności
substratowej, stabilności, optymalnych warunków działania, wymaga rozwoju badań nad zależnością
pomiędzy ich strukturą a funkcją.
Pomocna staje się komputerowa analiza struktury chemicznej enzymu i substratu, która umożliwia
zaprojektowanie optymalnej budowy chemicznej enzymu.
Dzięki inżynierii białka możliwe jest wzbogacanie białek drobnoustrojowych i roślinnych w
aminokwasy egzogenne, które występują w zbyt małych ilościach.

WYKŁAD 3, 19.10.12 r.
OKRESY ROZWOJU BIOTECHNOLOGII
1. OKRES PRZEDPASTEUROWSKI
(od zarania ludzkości do połowy XIX w.) – era spontanicznych
procesów fermentacyjnych wykorzystywanych do otrzymywanie ważnych produktów
żywnościowych: chleba, wina, piwa, produktów mlecznych, przetworów roślinnych.
2. OKRES PRZEJŚCIOWY
(druga połowa XIX w. oraz pierwsze czterdziestolecie XX w.).
Poznawanie w sposób naukowy biologicznej i chemicznej natury bioprocesów –
zapoczątkowane przez L. Pasteura – zaowocowało rozwojem nowych koncepcji, nowych
biotechnologii, nowych bioproduktów, a postęp techniczny umożliwił tworzenie podstaw
biotechnologii wielkoprzemysłowej.
Etap ten można określić jako erę mikrobiologicznych początków współczesnej biotechnologii i
opracowania produkcji kwasu mlekowego i cytrynowego, acetonu i butanolu, technologii
otrzymywania drożdży.
W tym okresie zapoczątkowano stosowanie czystych kultur drobnoustrojów oraz prowadzenie
bioprocesów w warunkach aseptycznych.
3. ERA NOWOCZESNEJ BIOTECHNOLOGII
rozpoczęła się pod koniec II wojny światowej od
opracowanie przemysłowej produkcji penicyliny metodą tlenowej hodowli wgłębnej
prowadzonej w warunkach aseptycznych w bioreaktorach o pojemności kilkudziesięciu m
2
.
a. PODOKRES 1
(do roku 1970). Dzięki integracji dyscyplin biologicznych, chemicznych i
inżynieryjnych opracowano nowe technologie, m.in. biosyntezy antybiotyków,
aminokwasów, enzymów i biotransformacji steroidów oraz wprowadzono pierwsze
technologie, w których zastosowano katalizatory immobilizowane.
b. PODOKRES 2
(od roku 1970) – praktyczne wykorzystanie genetyki i biologii molekularnej w
biotechnologii. Pod koniec 1969 r. narodziła się koncepcja manipulacji genami poza komórką.
Nastąpił rozwój metod rekombinacji DNA in vitro i in vivo.
Opracowano szereg nowych biotechnologii, m.in. mikrobiologiczną produkcję insuliny,
hormonów wzrostu, interferonów, białek odpornościowych oraz technologię wytwarzania
przeciwciał monoklonalnych.
ZAKRES ZASTOSOWAŃ WSPÓŁCZESNEJ BIOTECHNOLOGII
I.
Produkcja żywności
Przemysł spożywczy
1) Tradycyjne procesy fermentacyjne – produkcja pieczywa, fermentowanych produktów
mlecznych i roślinnych, drożdży, napojów alkoholowych;
2) Nowe technologie mikrobiologiczne wytwarzania białka jednokomórkowców (SCP),
aminokwasów, witamin, nukleotydów, kwasów organicznych, polisacharydów;

3) Zastosowanie enzymów do wytwarzania wyrobów mleczarskich, owocowo-warzywnych,
napojów fermentowanych, przetworów skrobiowych;
4) Utrwalanie żywności: oksydaza glukozowa (antyutleniacz), nizyna;
Rolnictwo (produkcja roślinna i zwierzęca)
1) Produkcja pasz: preparaty białkowe, witaminowe, aminokwasowe, antybiotyczne,
stymulatory wzrostu, kiszonki roślinne;
2) Nowoczesne techniki hodowli tkanek i komórek in vitro oraz metody inżynierii genetycznej;
3) Ochrona roślin: antybiotyki, bioinsektycydy, biopestycydy;
4) Lecznictwo zwierząt: antybiotyki, szczepionki.
II.
Ochrona zdrowia
1) Namnażanie drobnoustrojów oraz hodowla komórek zwierzęcych in vitro w celu wytworzenia
szczepionek i przeciwciał;
2) Mikrobiologiczna biosynteza naturalnych metabolitów drobnoustrojowych: antybiotyków,
aminokwasów, kwasów organicznych, witamin, enzymów, inhibitorów enzymów, dekstranu,
alkaloidów;
3) Mikrobiologiczna biosynteza hormonów peptydowych, antygenów oraz innych produktów
przy użyciu szczepów konstruowanych metodami inżynierii genetycznej, zawierających obcą
informacje genetyczną;
4) Zastosowanie procesów biotransformacji mikrobiologicznej i enzymatycznej w produkcji
leków steroidowych, aminokwasów, antybiotyków, witaminy C, glukonianu wapnia,
efedryny;
5) Wytwarzanie przeciwciał monoklonalnych, m.in. do celów diagnostycznych (testy
immunologiczne).
III.
Przemysł chemiczny i inne przemysły
1) Wytwarzanie surowców:
Alkohole: etanol, butanol, izopropanol, glikol etylenowy, glikol propylenowy, glicerol;
Kwasy: octowy, cytrynowy, adypinowy, itakonowy, akrylowy;
Polimery: dekstran, ksantan, pululan, kwas Poli-β-hydroksymasłowy
2) Nośniki energii – paliwa: etanol, metan, potencjalnie wodór;
3) Biotechnologiczna obróbka surowców naturalnych: roszenie roślin włókienniczych, hydroliza
skrobi w trakcie wytwarzania tkanin, odwłaszanie i wytrawianie skór, fermentacja tytoniu;
4) Biohydrometalurgia: ługowanie rud, biozatężanie, odzyskiwanie metali;
5) Bioelektronika: bioczipy.

IV.
Ochrona środowiska
1) Oczyszczanie ścieków: złoża zraszane, filtry biologiczne, osad czynny;
2) Bioutylizacja odpadów: namnażanie biomasy, procesy biosyntezy mikrobiologicznej,
produkcja biogazu.
V.
Analiza
1) Zastosowanie enzymów rozpuszczalnych, np. oksydazy glukozowej (łącznie z katalazą lub
peroksydazą) lub dehydrogenazy glukozo-6-fosforanowej (w połączeniu z heksokinazą);
2) Czujniki enzymowe i komórkowe: oksydaza glukozowa + elektroda tlenowa, ureaza +
elektroda PH;
3) Analiza genomów: analiza restrykcyjna, sekwencjonowanie, sondy molekularne.
Główne atuty biotechnologii:
1) Przetwarzanie surowców odnawialnych i bioproduktów,
2) Duża różnorodność bioprocesów i bioproduktów,
3) Selektywne otrzymywanie enancjomerów biologicznie czynnych,
4) Łagodne warunki przebiegu bioprocesów,
5) Mała ich energochłonność,
6) Duży stopień bezpieczeństwa bioprocesów,
7) Mniej groźne niż w technologiach chemicznych oraz łatwiejsze do zneutralizowania
zanieczyszczenia środowiska.
Najważniejsze zadania biotechnologii:
1) Opracowywanie produkcji nowych leków i preparatów do ochrony zdrowia ludzi i zwierząt,
2) Rozwiązywanie problemów żywieniowych,
3) Udział w kompleksowym rozwiązywaniu problemów ochrony środowiska,
4) Upowszechnianie procesów biokatalizy w przemyśle chemicznym oraz w przetwórstwie
surowców naturalnych,
5) Udział w rozwiązywaniu problemów energetycznych.
Głównymi surowcami
w procesach biotechnologicznych są węglowodany – skrobia i sacharoza oraz
produkty uboczne przetwórstwa rolno-spożywczego, np. melasa. Skrobia i sacharoza, najłatwiej przez
drobnoustroje przyswajane węglowodany, stanowią jednak zaledwie ok. 1% biomasy roślinnej. W
przyszłości będzie prawdopodobnie można wykorzystywać celulozę (40% biomasy roślinnej), ligniny i
hemicelulozę.
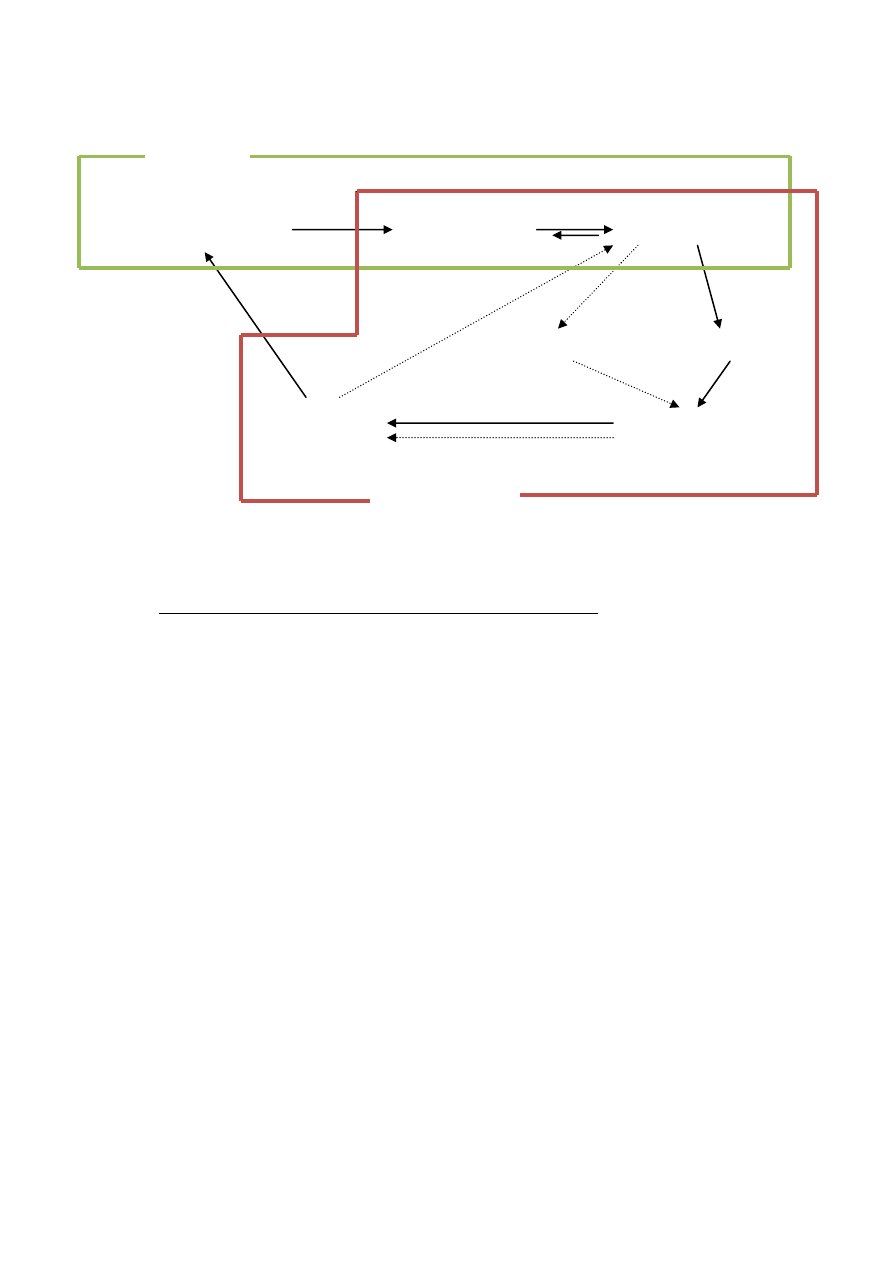
PROCES BIOTECHNOLOGICZNY
obszar nauki
badania podstawowe
wiedza (publikacje)
badania aplikacyjne
usprawnienia
nowe technologie
nowe problemy
wdrożenia (produkcja)
obszar technologii
Relacje pomiędzy nauką i technologią:
Strzałkami ciągłymi zaznaczono dużą, a przerywanymi mała przydatność biotechnologiczną.
Program opracowywania procesu biotechnologicznego obejmuje:
1) Fazę wstępną, czyli analizę zapotrzebowania społecznego na określone produkty oraz
analizę możliwości biotechnologicznego ich pozyskiwania;
2) Fazę badawczą, mającą na celu opracowanie technologii, kończącą się rachunkiem
ekonomicznym i podjęciem decyzji inwestycyjnych;
3) Fazę wdrożenia, czyli projektowanie oraz budowę linii technologicznej i uruchomienie
produkcji.
ETAPY OPRACOWYWANIA PROCESU BIOSYNTEZY:
1) Pozyskiwanie odpowiednich drobnoustrojów (skrining) –
poszukiwanie właściwych drobnoustrojów prowadzących określony bioproces lub
wytwarzających określony bioprodukt. Pierwszym źródłem drobnoustrojów jest ich naturalne
środowisko: gleba, części roślin, woda, otoczenie określonych zakładów przemysłowych.
2) Wstępne ustalenie warunków ich hodowli
na etapie skriningu określone są wstępne warunki hodowli drobnoustrojów przez dobór podłoży,
temperatury, natlenienia. Nadania te są nastepnie kontynuowane w celu stworzenia warunków
zapewniających wyselekcjonowanym szczepom maksymalną ekspresję fenotypową określonej cechy,
np. produkcji enzymu.

Należy dokonać również wyboru sposobu prowadzenia bioprocesu: hodowla powierzchniowa lub
wgłębna, okresowa lub ciągła, w zawiesinie lub na nośniku, z użyciem całych komórek lub
izolowanych enzymów. Na tym etapie rozpoczyna się zazwyczaj opracowywanie warunków
wyodrębnienia i oczyszczanie bioproduktów.
3) Doskonalenie cech produkcyjnych szczepów
Podstawową metodą jest mutagenizacja. Wynikiem ulepszenia szczepów jest produkcja
określonej metabolitów tri l. przewyższającej
4) Optymalizacja bioprocesu
Każdy wysokowydajny szczep ma określony potencjał metaboliczny w zakresie biosyntezy,
biodegradacji lub biotransformacji, uwarunkowany genotypowo. Jednakże maksymalne
wykorzystanie tego potencjału wymaga doboru optymalnych warunków prowadzenia bioprocesu. Są
one ustalone w etapie projektowania technologii laboratoryjnej.
Na etapie optymalizacji procesu w laboratorium ustalany jest skład podłoża, warunki jego
mieszania i napowietrzenia oraz szereg dalszych parametrów procesowych. Ważnym zagadnieniem
jest też ustalenie kinetyki bioprocesu. Coraz częściej etap optymalizacji i następujące po nim etapy
opracowywane są przy użyciu techniki komputerowej.
5) Powiększenie jego skali
Przejście od warunków laboratoryjnych technologii przemysłowej bioprocesu stanowi z
inżynieryjnego punktu widzenia etap najtrudniejszy.
Powiększenie skali procesu od objętości kilku lub kilkunastu litrów hodowli do kilkudziesięciu lub
kilkuset metrów sześciennych wymaga stosowania instalacji pilotażowych i stopniowego zwiększenia
pojemności bioreaktorów.
6) Uruchomienie produkcji
Stwarza wiele problemów natury technicznej, jak i biologicznej. Znaczne trudności może sprawić
dotrzymywanie optymalnych parametrów procesu, np. natlenienie środowiska, odprowadzenie
wydzielającego się ciepła, zmienność morfologiczno-fizjologiczna szczepu produkcyjnego,
utrzymywanie czystości mikrobiologicznej procesu.
Przez cały czas trwania produkcji prowadzi się nadal ulepszanie szczepów, optymalizację i
ekonomizację podłoża oraz usprawnianie sposobu prowadzenia procesu.

Trzy warunki powodzenia w zakresie opracowywania i usprawniania biotechnologii:
1) Stały wzrost udziału nauki w rozwiązywaniu problemów technologicznych oraz zastosowanie
nowoczesnych metod badawczych i analitycznych;
2) Postęp w zakresie budowy aparatury i urządzeń biotechnologicznych;
3) Właściwa organizacja badań, polegająca na wyborze problemów, powoływaniu zespołów
składających się ze specjalistów różnych dyscyplin naukowych oraz koordynacji ich
współpracy podczas rozwiązywania problemów technologicznych.

WYKŁAD 4, 26.10.12 r.
BEZPIECZEŃSTWO W BIOTECHNOLOGII
Zagadnienia bezpieczeństwa w biotechnologii są przedmiotem dyskusji w wielu krajach oraz
na forum Światowej Organizacji Zdrowia, w Europejskiej Wspólnocie Gospodarczej oraz w
Europejskiej Federacji Biotechnologicznej.
Problemy:
Analiza patogeniczności drobnoustrojów opornych na antybiotyki w wyniku ich
powszechnego stosowania,
Zagrożenie, które wynika z otrzymania i stosowania organizmów konstruowanych metodami
inżynierii genetycznej,
Możliwości ich przenikania do otoczenia.
Wśród drobnoustrojów stosowanych w biotechnologii przeważają
gatunki całkowicie bezpieczne
.
W biotechnologii stosowane są jednak również
drobnoustroje chorobotwórcze
(konieczne w
produkcji wielu szczepionek bakteryjnych i wirusowych).
Istnieją ścisłe przepisy pracy z drobnoustrojami procesowymi i tworzone są bardzo precyzyjne
mechanizmy kontroli warunków technicznych bezpiecznego namnażania drobnoustrojów
patogennych.
W porównaniu z biotechnologią znacznie większe zagrożenie stwarzają tradycyjne metody
rolnicze w produkcji żywności i pasz, gdzie w warunkach dynamicznej kontroli możliwe jest, i w
istocie często występuje, skażenie surowca, materiału w fazie produkcji lub produktu w fazie
przechowywania drobnoustrojami chorobotwórczymi i wytwarzanymi przez nie toksynami.
Biotechnologia traktowana kompleksowo, rozwijana racjonalnie i w sposób kontrolowany, należy
obecnie do technologii bezpiecznych. Winna ponadto przyczynić się do zmniejszenia zagrożeń, jakie
dla człowieka i środowiska stwarzają inne technologie, zwłaszcza chemiczne.
Odrębnym zagadnieniem, budzącym duży niepokój, jest potencjalne niebezpieczeństwo
związane z rozwojem inżynierii genetycznej i biotechnologii z użyciem organizmów modyfikowanych
genetycznie.
WSPÓŁCZESNA BIOTECHNOLOGIA
Metody rekombinacji DNA in vitro zastosowano do genetycznych modyfikacji organizmów
wykorzystywanych w celach biotechnologicznych.
Technologie służące do wytwarzania użytecznych żywych organizmów i (lub) ich części
definiowane są jako biotechnologiczne.
Dzięki nowym metodom genetycznym powstały nowe możliwości świadomych modyfikacji
genotypów i tworzenia nowych kombinacji genów.

I.
Zakres stosowania technik rekombinacji DNA in vitro
Biotechnologicznymi celami osiąganymi w badaniach metodami rekombinacji in vitro mogą być:
Klonowanie i ekspresja genów kodujących określone białka,
Optymalizacja poziomu ekspresji określonego genu kodującego żądane białko,
Zamierzone modyfikacje sekwencji nukleotydowych kodujących dane białko, badania
stanowią przedmiot zainteresowań inżynierii białkowej,
Utworzenie wyższych organizmów transgenicznych, nosicieli heterologicznych genów
we wszystkich komórkach, również rozrodczych,
Somatyczna terapia genowa dojrzałych osobników,
Diagnostyka genowa, związana z oznaczaniem sekwencji nukleotydów pojedynczych
genów, dużych fragmentów i pełnych genomów.
Organizmy modyfikowane metodami rekombinacji DNA in vitro znalazły zastosowanie w praktyce
medycznej i rolniczej, w licznych technologiach przemysłów: farmaceutycznego, chemicznego,
przetwórczego, wydobywczego, w różnego typu analityce i wreszcie w ochronie środowiska
naturalnego.
Rekombinacja DNA in vitro jest jedną z licznych metod realizacji celów biotechnologicznych.
Jej optymalne wykorzystanie zależy od osiągnięć wielu gałęzi nauki, takich jak mikrobiologia,
biochemia, biologia komórki, chemia, informatyka, fizyka, a także ekonomia.
II.
Czynniki warunkujące sukces projektu biotechnologicznego
Projekt programu biotechnologicznego powinien wynikać z podstawowej wiedzy o
mechanizmach ekspresji genów:
Znajomości struktury genomu dawcy i biorcy DNA (geny podzielone u Eukaryota, układy
operonów u Prokaryota, częstotliwość używania kodonów itp.),
Znajomości sekwencji DNA regulujących transkrypcję i translację,
Znajomości potranslacyjnych modyfikacji pierwotnego produktu translacji (skracanie,
specyficzna glikozylacja, fosforylacja, acylacja itp.).
Należy zmierzać do jak najlepszego dostosowania konstrukcji klonowanych heterologicznych
sekwencji DNA do cech genetycznych biorcy. Jest to warunek konieczny, ale niewystarczający do
osiągnięcia pomyślnego wyniku końcowego.

Decydują o nim:
Stabilność strukturalna zrekombinowanego DNA,
Stabilność segregacyjna wektora,
Warunki hodowli,
Stabilność odpowiedniego mRNA,
Poziom ekspresji klonowanego genu,
Czułość metody wykrywania poszukiwanego produktu (białka) i formy jego gromadzenia
przez komórkę biorcę.
Wydajność końcowa produkcji zależy od składu pożywki hodowlanej (obecność czynników
selekcyjnych), pH, temperatury, sposobu hodowli (np. unieruchomienie komórek).
Uzyskiwane białko może być denaturowane (ciałka inkluzyjne w E. coli) albo ulegać nie
zaplanowanej proteolizie.
Wydajność ekspresji i trwałość końcowego produktu białkowego można zwiększyć klonując
odpowiedni gen w wektorze sekrecyjnym lub dokonując fuzji klonowanego genu z fragmentem genu
biorcy (wynikiem ekspresji jest fuzyjne białko).
III.
Rozwój firm biotechnologicznych
Rozwój współczesnej biotechnologii, zapoczątkowany w Stanach Zjednoczonych, rozpoczął się od
tworzenia małych firm biotechnologicznych.
Zakładali je zazwyczaj pracownicy uniwersytetów, którzy wcześniej już nauczyli się stosować w
doświadczeniach metody rekombinacji DNA in vitro.
Firmy rozpoczynały działalność od rozeznania potrzeb rynkowych. Po podjęciu decyzji o profilu
produkcji organizowano laboratorium.
Wyniki pracy są w firmach biotechnologicznych tajne (do momentu uzyskania patentu), a firmie
przede wszystkim zależy na szybkim tempie osiągnięcia końcowego produktu handlowego.
W miarę rozwoju biotechnologii małe firmy były wchłanianie przez wielkie koncerny, bądź też
podpisywały z nimi umowy o przekazaniu technologii gotowej do wdrożenia.
W roku 1991 w Stanach Zjednoczonych działały 742 firmy biotechnologiczne:
Firmy prywatne (59%),
Spółki akcyjne (19,5%),
Pododdziały dużych korporacji (18,5%).
Na czele listy spółek akcyjnych znajdowały się: Amgen, Centocor, Chiron i Genentech. Wydawały
na badania 3,6 mld $ rocznie, ich dochód wynosił 12 mld $.
Najszybciej rosła liczba oddziałów dużych koncernów przemysłowych.
Nowoczesną biotechnologią farmaceutyczną, wytwarzaniem leków i medycznych zestawów
diagnostycznych zajmowało się w roku 1991 w Stanach Zjednoczonych 363 firm.

Przemysł farmaceutyczny należy do bardzo dochodowych, chociaż uzyskanie nowego leku trwa
długo (ok. 12-15 lat) i jest kosztowne (ok. 250 mln $).
Każdy produkt musi być przebadany pod kątem bezpieczeństwa, wymaga badań przedklinicznych
na komórkach i zwierzętach oraz trzech faz badań klinicznych.
Budżet federalny na rozwój biotechnologii w roku 1993 w Stanach Zjednoczonych przewidywał
3 125 mln $ na dziedziny szeroko pojętej ochrony zdrowia i 900 mln $ na pozostałe.
W dalszej kolejności na liście biotechnologicznych przedsiębiorstw w Stanach Zjednoczonych w
roku 1991znalazły się firmy pracujące na rzecz rolnictwa (127),odczynników i wyposażenia (88),
wreszcie ochrony środowiska (29).
Wśród najbardziej dochodowych produktów królowały:
Ludzka insulina wytwarzana przez mikroorganizmy (Humulina, 450 mln $),
Tkankowy aktywator plazminogenu (t-PA, lek trombolityczny stosowany przy zatorach naczyń
krwionośnych)
Erytropoetyna (hormon białkowy wytwarzany w nerkach, pierwotny regulator erytropoezy u
ssaków, stymulujący podziały i różnicowanie komórek erytroidalnych, 200-300 mln $).

WYKŁAD 5, 09.11.12 r.
BIOTECHNOLOGIA A ROZWÓJ BIOLOGICZNYCH METOD OCHRONY ROŚLIN
Biologiczne metody ochrony roślin sa jedną z wielu dziedzin, o których postępie dawniej
decydował rozwój biotechnologii tradycyjnej, a obecnie decyduje rozwój biologii molekularnej i
inżynierii genetycznej. Postęp w tych dziedzinach jest ogromny, dzięki czemu
niedawneprzewidywania w ochronie roślin stały się rzeczywistością.
Rośliny transgeniczne, zawierające geny owadobójczej bakterii Bacillus thuringiensis, są
dynamicznie wprowadzane do praktyki ochrony roślin (1,6 mln ha w 1996, 11,0 mln ha w
1997, 27,8 mln ha w 1998 r. i 39,9 mln ha w 1999 r.).
XXI wiek to era biotechnologii.
Żyjemy w Wieku Pestycydów, który zaczął się w 1946 r. wprowadzeniem DDT.
Możemy w nim wyróżnić trzy ery:
optymizmu (1946-1962),
zwątpienia (1962-1976)
oraz obecną erę integracji metod (1976-)
Integrowanie metod w dużej mierze opiera się na chemicznym zwalczaniu, a to stwarza ogromne
zapotrzebowanie na badania i wdrożenia z zakresu biologicznych metod ochrony roślin.
Tym oczekiwaniom metoda biologiczne będzie mogła sprostać, gdy oprócz rozwijania
klasycznych metod introdukcji, w szerokim zakresie będzie korzystać z metod biologii molekularnej i
inżynierii genetycznej, które otwierają nowe perspektywy.
INTRODUKCJA – KLASYCZNA METODA BIOLOGICZNEGO ZWALCZANIA
Niedawno obchodzono setną rocznicę pierwszej udanej introdukcji biedronki Rodolia cardinalis z
Autralii do USA celem biologicznego zwalczania czerwca Iceiya purchasi w sadach cytrusowych.
Wiadomo, że wiele problemów w ochronie roślin wynika z zamierzonego lub przypadkowego
przewozu gatunków roślin lub zwierząt z ich ojczystych kontynentów na nowe tereny, na
których stają się agrofagami (patogenami, szkodnikami, chwastami).
Wiele gatunków roślin i zwierząt, obecnie uznawanych za organizmy szkodliwe, w
rzeczywistości sprowadzono na kontynent Ameryki Północnej w celach użytkowych.
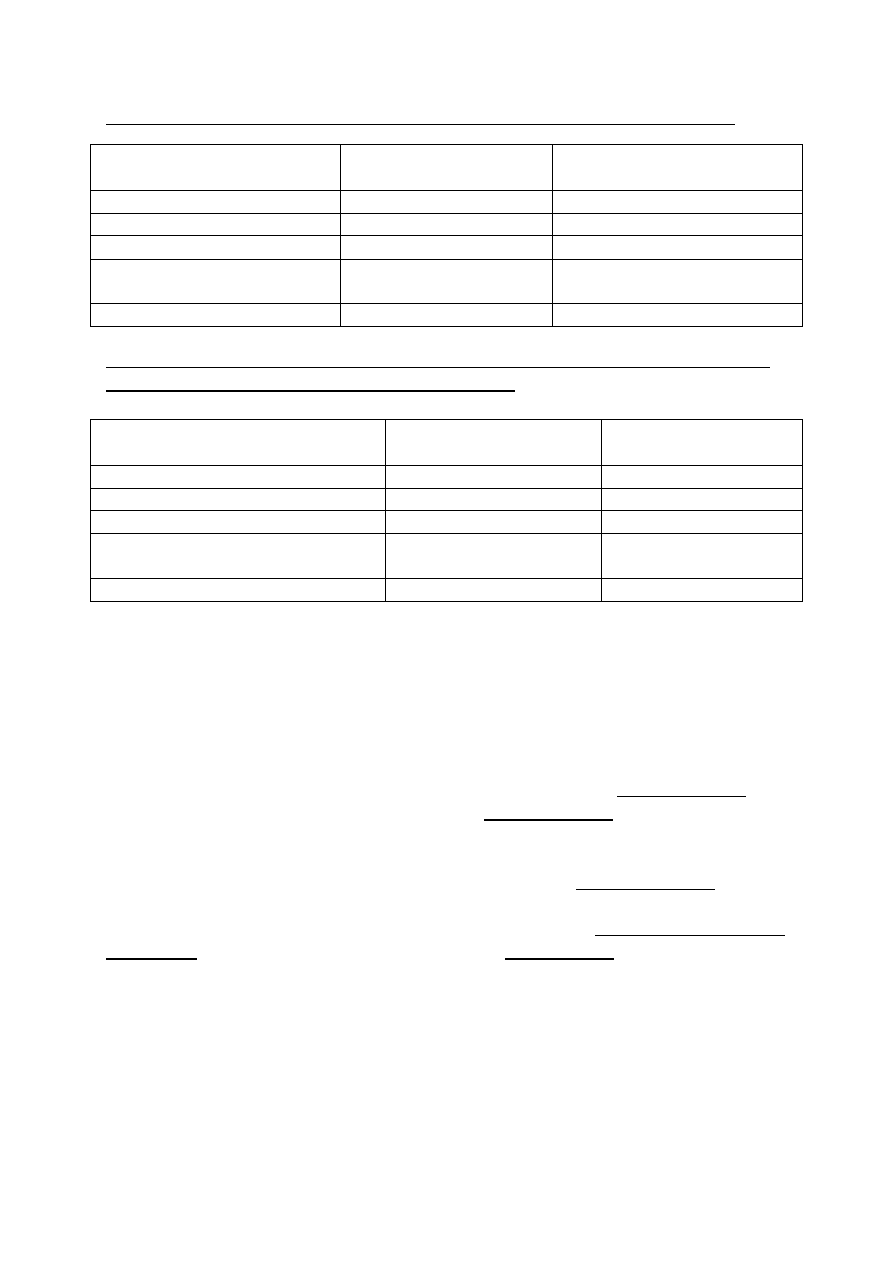
Gatunki roślin oraz zwierząt sprowadzonych do USA, które stały się organizmami szkodliwymi:
Cel sprowadzenia
Liczba gatunków
sprowadzonych
Liczba gatunków, które stały się
szkodliwe
Rośliny rolnicze i ozdobne
5800
125
Domowe ssaki i ptaki
20
10
Sportowe ssaki i ptaki
20
9
Kręgowce celem biologicznego
zwalczania
6
6
Ryby (sportowe i akwaryjne)
2000
5
Ilościowa charakterystyka akcji biologicznego zwalczania agrofagów i chwastów metodą introdukcji
drapieżnych, pasożytniczych oraz fitofagicznych stawonogów
Akcje
Przeciw szkodnikom
Przeciw chwastom
Liczba introdukcji
4769
5461
Liczba udanych kolonizacji
1445
1888
Liczba zwalczanych obiektów
543
658
Liczba udanych programów
421
494
Liczba krajów lub wysp
196
9
Z analizy Międzynarodowego Instytutu Biologicznego Zwalczania (IIBC) w Silwood Park
(Wielka Brytania), wynika więc, że spośród ogólnej liczby 5461 dokonanych introdukcji około 30%
było udanych, a 9% dało bardzo dobre wyniki zwalczania agrofagów.
Przez dziesięciolecia praktykowano biologiczne zwalczanie egzotycznych agrofagów
wyłącznie drogą introdukcji ich wrogów naturalnych znanych w ojczyźnie szkodnika.
W warunkach Polski udanym przykładem introdukcji jest zwalczanie bawełnicy korówki
(Eriosoma lanigerum) za pomocą pasożytniczego owada ośca korówkowego (Aphelinus mali)
pochodzącego z Ameryki.
Natomiast nieudanym przykładem jest biologiczne zwalczanie stonki ziemniaczanej
(Leptinotarsa decemlineata), gdyż narodowe i międzynarodowe programy introdukcji z Ameryki do
Europy, w tym także do Polski, wrogów naturalnych stonki: pluskwiaków Perillus bioculattus i Podisus
maculiventris (Heteroptera, Pentatomidae) oraz błonkówki Edovum puttleri (Hymenoptera:
Eulophidae), zakończyły się niepowodzeniem.
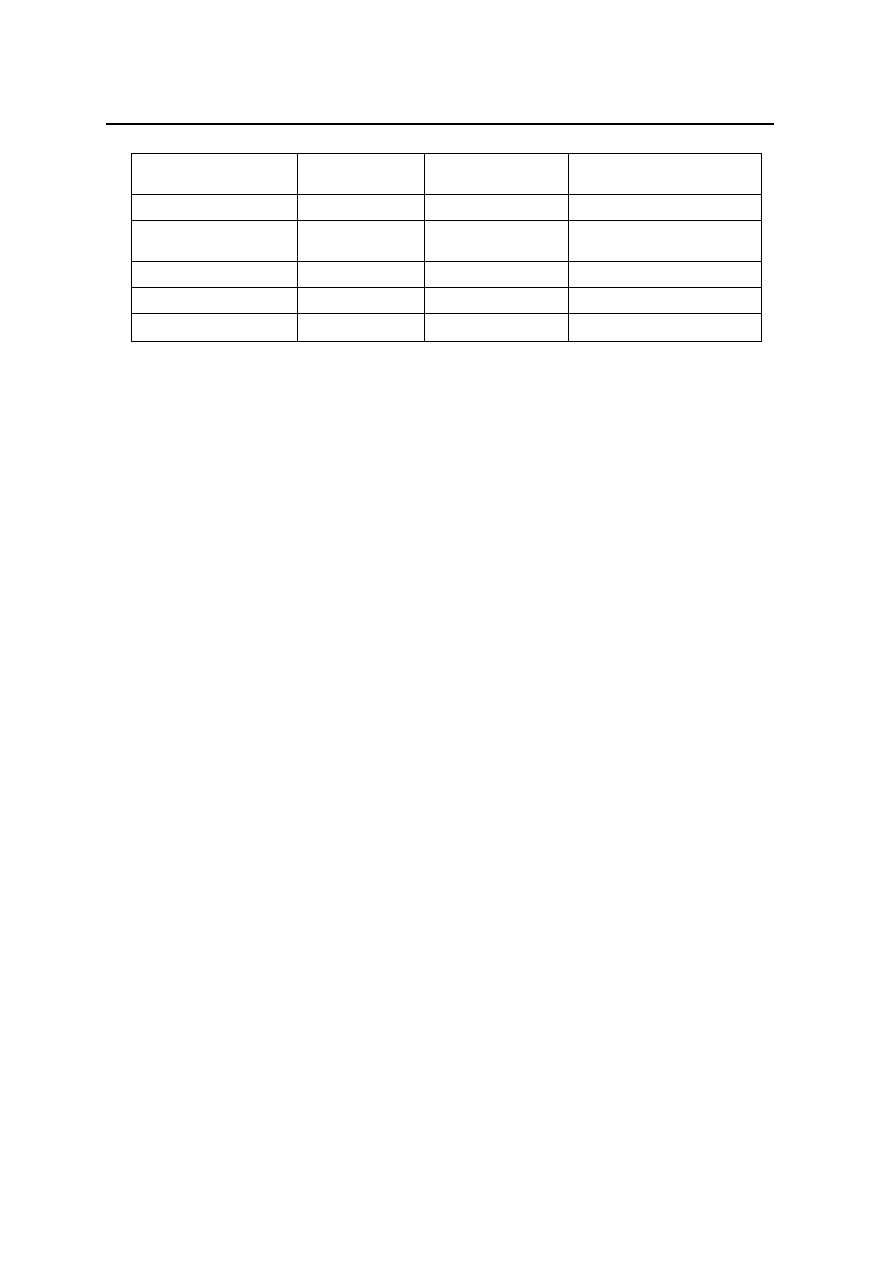
Ekonomiczna opłacalność niektórych aktualnie prowadzonych programów biologicznego zwalczania
Zwalczany agrofag
Kraj programu
Nakłady [mld
USD]
Korzyści roczne [mln
USD]
Antonina graminis
USA
0,2
194,0
Phenacoccus
manihoti
Afryka (23
kraje)
14,8
96,0
Chondrilla juncea
Australia
3,1
13,9
Tetranychus urticea
Australia
0,9
0,9
Sirex noctilio
Australia
1,4
0,8
Znamy jednak przypadki ujemnych następstw introdukcji, które miały na celu biologiczne
zwalczanie (owadów i kręgowców), zarówno dla bioróżnorodności środowiskowej, jak i działalności
rolniczej.
Fakty te sprawiły, że Organizacja Rolnictwa i Wyżywienia (FAO) w Rzymie opracowała „Kodeks o
postępowaniu podczas importu i uwalniania czynników biologicznego zwalczania”, który obowiązuje
kraje członkowskie.
BIOTECHNOLOGIA W NOWOCZESNEJ OCHRONIE ROŚLIN
Techniki biotechnologiczne są wszechstronnie przydatne do ochrony roślin.
Przy ich pomocy można w dosyć krótkim czasie:
Uzyskiwać odmiany roślin uprawnych odpornych na szkodniki, choroby i na herbicydy.
Uzyskiwać mikroorganizmy, które rozkładają pozostałości chemicznych pestycydów w glebie.
Doskonalić biopreparaty dla biologicznej ochrony roślin.
W krajach wysoce rozwiniętych gospodarczo postęp w tej dziedzinie jest widoczny zwłaszcza
poprzez rynek produktów biotechnologicznych, który jest oceniany na około 700 milionów dolarów
rocznie.
Największy udział w tym rynku mają:
Biopestycydy do zwalczania chorób i szkodników roślin;
Rośliny transgeniczne odporne na choroby i szkodniki oraz na herbicydy;
Preparaty diagnostyczne do wczesnego i szybkiego wykrywania infekcji wirusowych lub
bakteryjnych i identyfikacji fito patogennych mikroorganizmów;
Rośliny nazywane umownie „rośliny-fabryki”, gdyż są one używane do produkcji
specyficznych produktów białkowych o przeznaczeniu farmakologicznym;
Wprowadzenie osiągnięć biotechnologii do ochrony roślin wcale nie musi stać w sprzeczności z
rozwojem chemicznych metod ochrony roślin. Te dwa kierunki rozwijają się równolegle i niezależnie
od siebie.

Można nawet założyć, że wprowadzenie do szerokiej uprawy roślin transgenicznych może
pociągnąć za sobą wzrost zużycia środków chemicznych.
Na przykład rolnik, który ma wysokowartościowe plantacje nasienne roślin technologicznie
ulepszonych, będzie je intensywniej chronił środkami chemicznymi w ciągu całego sezonu niż inne
rośliny tradycyjne.
Z drugiej zaś strony w odniesieniu do trangenicznie modyfikowanych warzyw może istotnie wzrastać
zapotrzebowanie na biopreparaty lub inne metoy biologiczne, aby unikać pozostałości chemicznych
pestycydów i wzbogacać listę tzw. produktów zdrowej żywności.
PERSPEKTYWY ZASTOSOWAŃ BIOTECHNOLOGII W OCHRONIE ROŚLIN
Jak szybki jest postęp we wdrażaniu biotechnologii w ochronie roślin świadczy nie tylko
rozwijający się rynek biotechnologiczny, ale także spełnianie się prognoz w tym zakresie
przedstawione w 1986 roku na Sesji Naukowej IOR (Lipa 1986).
Przewidywania zastosowania biotechnologii w rolnictwie i ochronie roślin do roku 2005 (Prognozy
zaprezentowane w 1986 roku na Brytyjskiej Konferencji Ochrony Roślin w Brighton):
1990 – Rośliny o zwiększonej odporności na stres;
1990 – Zwalczanie szkodników i chorób biopreparatami;
1990 – Biologiczne zwalczanie chwastów;
1995 – Poprawa przyswajania azotu;
2000 – Rośliny ulepszone genetycznie;
2000 – Wzrost skuteczności nawożenia na drodze mikrobiologicznej;
2005 – Odporność roślin na choroby i szkodniki;
W większości kierunków prognozy zostały osiągnięte przed terminem szczególnie dotyczy to
postępu w zakresie biopreparatów owadobójczych.
Wyszukiwarka
Podobne podstrony:
Biotechnologia w ochronie srodo Nieznany (2)
Biotechnologia wyklady id 89045 (2)
Biotechnologia Wyklady id 89130 Nieznany (2)
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
Badania operacyjne wyklad 2 id Nieznany
historia gospodarcza wyklady id Nieznany
Metodologia nauk spolecznych wyklad id 294758
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
Ochrona Środowiska wykład Nr 1 z dnia 27 streszczenie, ochrona środowiska(1)
Ekonomika ochrony srodowiska wyklad 18.04.05, administracja, II ROK, III Semestr, rok II, sem IV, Ek
Piekarska,metody biotechnologiczne w ochronie środowiska, Biotechnologia
Ochrona środowiska wyklad
Biotechnologia Rozrodu Zwierzat Indeks id 89115 (2)
więcej podobnych podstron