1
W1
Biotechnologia- jedna z kluczowych nauk XIX wieku.
Biotechnologia jest nauką interdyscyplinarną skupiającą:
-
chemia
-
biologia
-
biofizyka
-
matematyka
-
inżynieria chemiczna
-
inżynieria środowiskowa
Biotechnologia: wykorzystanie możliwości organizmów żywych oraz pochodzących z nich
biokatalizatorów do produkcji i ulepszania dóbr konsumpcyjnych.
Inspiracją dla rozwoju biotechnologii jest podpatrywanie przyrody i wykorzystywanie jej
mechanizmów metabolicznych oraz regulacyjnych w celu polepszenia życia człowieka.
Podział biotechnologii:
-
klasyczna
-
nowoczesna
BIOTECHNOLOGIA KLASYCZNA
Ø Procesy fermentacyjne:
-
produkcja piwa
-
produkcja wina
-
produkcja octu
-
produkcja fermentowanych napojów mlecznych
-
wytwarzanie chleba z użyciem zakwasu
Ø Metabolity pierwszorzędowe: są to niewielkie cząsteczki chemiczne, które mogą być
produktami końcowymi podstawowych procesów metabolicznych lub ich produktami
pośrednimi
Ważne przemysłowo metabolity pierwszorzędowe:
-
alkohole: alkohol etylowy
-
alkohole wielowodorotlenowe: glicerol
-
aminokwasy: Lys, Thr, Phe, Trp
-
kwasy organiczne: kwas octowy, kwas propionowy
-
cukry: fruktoza
-
polisacharydy: ksantan, gellan
-
witaminy: B
2
, B
12
Ø Biokonwersja (biotransformacja): aktywność mikroorganizmów w zakresie enzymatycznych
przekształceń różnych związków chemicznych, które nie wykazują zazwyczaj żadnej funkcji
metabolicznej i z dużą wydajnością gromadzone są pozakomórkowo.
W1
-
procesy biotransformacji nie dostarczają energii
-
nie dostarczają prekursorów do syntez komórkowych
-
przebiegają z udziałem niewielkiej ilości enzymów
-
są stereospecyficzne
-
np. biokonwersja steroli
Ø Metabolity wtórne: wszystkie procesy przemiany materii o nieznanej lub drugorzędowej
funkcji biologicznej określane są mianem metabolitów wtórnych a przemiany których są
wynikiem metabolizmem wtórnym; charakteryzują się wielokierunkową aktywnością
biologiczną
2
Produkcja metabolitów wtórnych jest silnie uzależniona od warunków środowiskowych (skład
podłoża, sposób hodowli).
Faza intensywnego wzrostu mikroorganizmów TROFOFAZA. Metabolity wtórne produkowane są
w IDIOFAZIE.
Grupa ważnych idiolitów:
-
antybiotyki
-
czynniki nieantybiotyczne (leki)
-
toksyny
-
biopestycydy
-
czynniki stymulujące wzrost roślin i zwierząt
Ø Antybiotyki: małocząsteczkowe substancje naturalne, najczęściej pochodzenia
drobnoustrojowego lub ich półsyntetyczne modyfikacje albo syntetyczne analogi
Replikacja DNA:
-
aktynomycyna,
-
ryfamycyna
Translacje:
-
chloramfenikol
-
tetracykliny
-
streptomycyny
Transport przez błony:
-
polimyksyny
-
jonofory
-
nystatyna
Synteza składników ściany komórkowej:
-
penicylina
-
cykloseryna
-
bacytracyna
Procesy energetyczne:
-
antymycyna
-
oligomycyna
W1
Przyczyny poszukiwania antybiotyków:
-
oporność drobnoustrojów
-
poprawa właściwości farmakologicznych
-
działanie toksyczne
Ø Leki o działaniu nieantybiotycznym:
POLIETERY (używane jako promotory wzrostu u przeżuwaczy):
-
Monensin
-
Lasalocid
-
Salonomycyna
AVERMYKTYNY (makrocykliczne laktony produkowane przez Streptomyces avermitilis)
wykazują aktywność p/pasożytniczą
STATYNY (pochodzenia grzybowego, czynniki obniżające poziom cholesterolu u ludzi i
zwierząt):
-
Lovastatyna
-
Parastatyna
-
Kwas klawulanowy (inhibitor penicylaz)
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
3
AKARBOZA (Actinomycetes) : inhibitor jelitowej glukozydazy, hiperglikemia i synteza
trójglicerydów w wątrobie i jelicie u pacjentów z cukrzycą, otyłością i hiperlipidemią IV
Ø Ukierunkowana biosynteza: manipulacje warunkami hodowli mikroorganizmów pozwalają na
pewną kontrolę ich metabolizmu
Stosuje się odpowiednie czynniki:
-
prekursory: biosynteza penicyliny G w podłożu z fenylooctanem
-
induktory: Met w syntezie cefalosporyn
-
mutagenezę: szczepy o wysokiej wydajności i wybiórczości produkcji
BIOTECHNOLOGIA NOWOCZESNA
Ø Technologie rekombinacji DNA
Technologia pozwalająca na manipulowanie materiałem genetycznym na najniższym poziomie
strukturalnym genu w sposób całkowicie kontrolowany przez eksperymentatora (swoiste
techniki).
Najczęściej wykorzystywane szczepy:
-
Escherichia coli
-
Bacillus subtilis
-
Sacharomyces cerevisiae
-
Aspergillus niger
W1
Otrzymujemy:
-
szczepionki
-
hormony
-
enzymy
-
przeciwciała
-
czynniki wzrostu
Ø Biosynteza kombinatoryjna
Technologie rekombinacji DNA używane są aby wprowadzić geny odpowiedzialne za syntezę
odpowiednich związków do materiału genetycznego mikroorganizmów, które wcześniej nie były
zdolne do produkcji tych związków; dalsze postępowanie jest analogiczne do biosyntezy
ukierunkowanej.
Ø Biopestycydy jako alternatywa dla klasycznych pestycydów
-
posiadają wąski i specyficzny zakres działania
-
działają powoli
-
powstrzymują a nie eliminują populacje chwastów
-
krótki czas półtrwania
-
bezpieczniejsze dla środowiska
-
brak problemu zalegania
Istnieją dwa typy biopestycydów:
1. „biochemiczne”: struktura i funkcja podobna do naturalnie występujących związków
chemicznych; nietoksyczne (analogi owadzich feromonów- kontrola owadzich populacji)
2. „mikrobiologiczne”: związki wytwarzane przez naturalnie występujące lub zmodyfikowane
genetycznie bakterie, grzyby i inne.
Ø Bioinsektycydy
-
Agrobacterium tumefaciens
4
-
Bacillus thuringiensis
ANALIZA ILOŚCIOWA MIKROORGANIZMÓW
1. Metody mikroskopowe:
•
liczenie drobnoustrojów przy użyciu komór (Thoma, Burkera)
•
liczenie drobnoustrojów w preparacie przeżyciowym
•
metoda Breeda
•
metoda DEFT
2. Metody hodowlane (tylko żywe komórki):
•
metoda rozcieńczeń
W1
•
metoda płytkowa Kocha
•
modyfikacje metody płytkowej Kocha:
o
metoda filtrów membranowych
o
metoda posiewów spiralnych
o
metody kropelkowe
o
metoda mikrohodowli Frosta
o
„plate loap”
o
„roll tube”
o
gotowe zestawy z podłożami nani9esionymi na plastikowe paski
3. Metody wagowe (mokra lub sucha biomasa).
4. Metody optyczne (turbidymetria, nefelometria).
5. Metody biochemiczne:
A. pomiar zawartości pirogronianiu (340 nm) : kwas pirogronowy
→ kwas mlekowy
- enzym: dehydrogenaza mleczanowa
- NADH
+
+ H
+
→
NAD
+
- reakcja redukcji
- zasada: obniżenie ilości zredukowanego NAD-u jest proporcjonalna do ilości
mikroorganizmów
B. bioluminescencja w wykrywaniu ATP:
metodę można stosować do badania stanu higienicznego zakładu, linii produkcyjnych czy pomiaru
ilości drobnoustrojów w środowisku
I ETAP: ekstrakcja ATP (związki zwiększające przepuszczalność błon komórkowych).
II ETAP: dodatek substratu (lucyferyny) i enzymu (lucyferazy).
Enzym w obecności ATP katalizuje reakcję oksydatywnej dekarboksylacji lucyferyny
lucyferyna
→ AMP, CO
2
, fotony światła, utleniona lucyferyna
- enzym: lucyferaza
- dodatkowo: jony Mg
2+
- zasada: światło które jest wydzielane jest równoważne stężeniu ATP; ilość emitowanego
światła jest proporcjonalna do ilości żywych komórek
C. oznaczanie poziomu ergosterolu
pomiar ilości grzybów w produktach żywnościowych
D. testy reduktazowe
6. Metody biofizyczne:
•
System Bioscrean: uniwersalny robot mikrobiologiczny (rozcieńczenia, nanoszenia,
mieszanie, kinetyczny pomiar zmętnienia hodowli); określanie zanieczyszczeń
mikrobiologicznych drożdży piwowarskich, skrobi, mleka.
•
metoda impedymetryczna: impedancja jest opornością przepływu prądu przez
przewodzącą pożywkę; rozwój mikroorganizmów prowadzi do obniżenia impedancji
podłoża podczas gdy siła jonowa i przewodnictwo zwiększają się; określanie
zanieczyszczeń mikrobiologicznych surowego i mrożonego mięsa, mleka, soków,
kosmetyków, itp.
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
5
•
cytometria przepływowa: metoda wykorzystywana do kontroli prawidłowości
przebiegu procesu biotechnologicznego opartego na hodowli mikroorganizmów
W1
PRZECHOWYWANIE MIKROORGANIZMÓW
Podstawowym źródłem szczepów są kolekcje drobnoustrojów.
1. ATCC- drożdże, bakterie, pleśnie;
2. NRRL- drożdże, bakterie, glony, grzyby strzępkowe
3. CBS- drożdże, porosty, grzyby strzępkowe; możliwość zdeponowania materiału genetycznego
drobnoustrojów
4. DSMZ- drożdże, pleśnie, plazmidy, wirusy
5. NCTC- bakteria
6. NCIMB- bakterie dla przemysłu i medycyny
7. CCM- bakterie, grzyby strzępkowe
8. CCY- drożdże i promieniowce
Kolekcje światowe są zrzeszone w Światowej Federacji Kultur z siedziba w Japonii.
Polskie kolekcje należące do WFCC:
1. PCM- Polska Kolekcja Mikroorganizmów (Wrocław)
2. DMVB- Państwowa Kolekcja Szczepów Oddziału Weterynarii (Puławy)
3. LOCK- Ośrodek Czystych Kultur Drobnoustrojów Przemysłowych (Łódź)
4. IAFB- Kolekcja Mikroorganizmów Przemysłowych (Warszawa)
5. LCC- Laboratorium Kolekcji Kultur (Olsztyn)
6. IBA- Warszawa
7. KOS- Gdynia
8. CPPPPI- Kolekcja Patogenów Roślin (Poznań)
Rosja : 1979 rok; ochrona patentowa na szczepy
Polska: proces technologiczny może podlegać opatentowaniu ale szczep nie może.
METODY PRZECHOWYWANIA SZCZEPÓW
-
okresowe przesiewy mikroorganizmów na pożywki stałe lub płynne i przechowywanie w
40
°
C
-
skosy agarowe zalane warstwą jałowej parafiny
-
opracowana indywidualnie metoda przechowywania (suszenie, liofilizowanie, mrożenie)
Kolekcje o charakterze przemysłowym zajmują się ponadto przygotowaniem i dostarczaniem czystych
kultur do zakładów przemysłowych.
PRODUKCJA SZCZEPIONEK PRZEMYSŁOWYCH
1. Namnożenie szczepów składanych w optymalnych środowiskach hodowlanych
2. Uzyskanie dużej liczby komórek w stanie pełnej aktywności biochemicznej
3. Standaryzacja składu gatunkowego (zestawienie właściwych proporcji gatunkowych)
4. Zabezpieczenie żywotności komórek i ich właściwości biochemicznych przez odpowiednie
utrwalanie szczepionki
W1
Przemysł winiarski, browarniczy, gorzelniczy- drożdże na skosach agarowych, w pożywkach
płynnych, zagęszczane hodowle, suszone, granulowane preparaty w ochronnej polewie.
Przemysł piekarski- kultury liofilizowane lub mrożone.
Szczepionki grzybów są przygotowywane jako:
6
-
hodowle na skosach agarowych
-
hodowle na słupach przygotowanych ze świeżych skrawków roślin
-
wodna zawiesina zarodników
-
liofilizaty zarodników lub grzybni wegetatywnej
POZYSKIWANIE I DOSKONALENIE MIKROORGANIZMÓW:
Procesy biotechnologiczne prowadzone z udziałem drobnoustrojów izolowane ze środowiska
przebiegają najczęściej z wydajnością niewystarczającą opracowania ekonomicznie procesów
biotechnologicznych.
Znaczącą poprawą ich wydajności można uzyskać poprzez zmiany mataboliczno-fizjologiczne
powstałe w wyniku modyfikacji genotypu drobnoustrojów.
MUTACJE:
Warunki naturalne: mutanty spontaniczne.
Mutacje indukowane: czynniki mutagenne.
Mutacje punktowe: odwracalne, nieodwracalne (przesunięcie ramki odczytu).
Mutacje to główna droga pozyskiwania szczepów dla przemysłu.
Produkcja penicyliny: Penicylium chrysogenum (1945)
Szczepy przemysłowe, które charakteryzuje wybiórczość produkcji:
-
produkcja L-lizyny Corynebacterium glutamicum :
a. mutacja genu kodującego dehydrogenazę homoserynową (nie wytwarzają Thr)
b. zmiana charakteru kinazy asparaginowej (nie reaguje na duże stężenia L-Lys)
Hybrydyzacja:
a. hybrydyzacja naturalna: przekazanie informacji genetycznej dawcy do komórki biorcy w
wyniku fizycznego kontaktu obu komórek i polega na wymianie odcinków DNA między
chromosomami lub genoforami
b. fuzja protoplastów: do otrzymywania protoplastów stosuje się:
-
bakterie G(+)- lizozym
-
bakteria G(-)- lizozym, EDTA, warunki jonowe
-
grzyby- sok żołądkowy ślimaka Helix pomatia lub enzymy lityczne pochodzenia
drobnoustrojowego (Cytophaga, Arthrobacter, Trichoderma)
W1
Zbliżenie protoplastów, inicjacja fuzji (PEG)- rekombinacja wewnątrz i międzygatunkowa;
rekombinacja więcej niż dwóch genotypów.
Technologie rekombinacji DNA:
Technologia rekombinacji DNA polega na przenoszeniu genów z jednego organizmu do drugiego
i otrzymywaniu tzw. klonów komórek, które są zdolne do syntezy nowego białka.
Narzędzia pozwalające na wycinanie i łączenie fragmentów DNA, syntezę DNA, itp.:
-
enzymy endonukleazy restrykcyjne: rozpoznają specyficzne zazwyczaj palindronowe
sekwencje w dwuniciowym DNA i hydrolizują wiązanie fofsodiestrowe w obu niciach w
miejscu rozpoznania sekwencji lub w niewielkiej odległości od tego miejsca;
-
metylazy: towarzysza restryktazom; system chroniący komórki przed inwazją obcego DNA;
-
egzonukleazy: nukleaza S
1
(endoegzonukleaza) hydroliza jednoniciowego DNA lub RNA;
-
alkaliczna fosfataza
-
polimerazy DNA: synteza DNA
a. polimeraza I DNA- holoenzym
-
odwrotna transkryptaza
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
7
-
ligaza- łączy polinukleotydy ufosforylowane w pozycji 5’ do polinukleotydów posiadających
wolną grupę 3’-OH
-
rybonukleazy- enzymy z trzustki cielęcej
-
enzymy lityczne- lizozym, celulazy, chitynazy
Do klonowania genów i ich wprowadzania do komórek gospodarzy służą wektory.
Proces klonowania genów składa się z kilku etapów:
1. izolacja lub synteza genu (cięcia losowe DNA, synteza cDNA)
2. łączenie genu z wektorem
3. wprowadzenie rekombinowanego DNA do komórki gospodarza
4. selekcja klonów komórek zawierających zrekombinowany DNA
5. produkcyjne wykorzystanie otrzymanych klonów komórek
WYKORZYSTANIE REKOMBINOWANYCH SZCZEPÓW W BIOTECHNOLOGI:
-
hormon wzrostu- somatotropina
o
wytwarzana przez przysadkę mózgową
o
191 aa
o
niedobór- karłowatość przysadkowa
o
usunięcie sekwencji sygnałowej HGH cDNA, wprowadzenie kodonu start, miejsce
wiązania rybosomów, promotora lac- sztuczny gen
o
Escherichia coli- 2 mg/dm
3
-
insulina:
o
pochodzenia zwierzęcego mniej efektywna niż ludzka
o
aktywna insulina- 2 polipeptydy połączone mostkami siarczkowymi
o
chemiczna synteza genów odpowiedzialnych za produkcję polipeptydów,
wklonowanie do plazmidu- aktywny promotor, transkrypcja, translacja- białko
fuzyjne (zawiera fragment jednego z łańcuchów polipeptydowych)
-
czynniki krzepliwości krwi
o
czynniki VII, VIII, IX- krzepliwość krwi
o
hemofilia- brak jednego z czynników
o
produkcja z Escherichia coli
-
immunoszczepionki:
o
białka otoczkowe wirusów, białka powierzchniowe bakterii o właściwościach
antygenowych
o
wirusowe zapalenie wątroby typu B, wścieklizna, grypa
o
Lactococcus lactis z plazmidem ekspresyjnym (jadalna szczepionka p/tężcowa)
-
inne:
o
klonowana podpuszczka
o
enzymy hydrolityczne, pochodzenia mikrobiologicznego środki piorące
W2
BIOKATALIZA
Biokatalizator- podstawowe narzędzie procesu biotechnologicznego.
Najobszerniejsza klasa naturalnych substancji katalitycznych to enzymy.
CECHY ENZYMÓW:
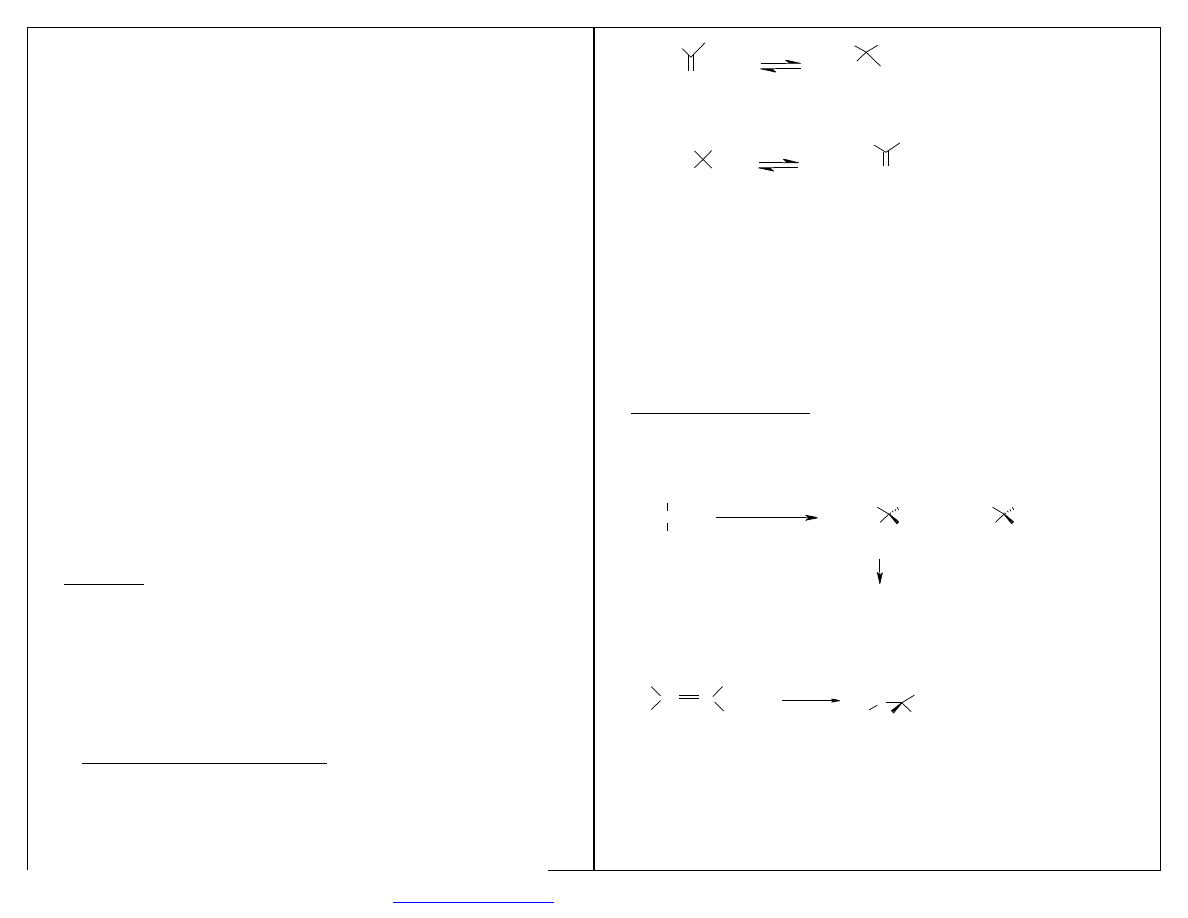
1. Selektywność enzymów:
o
selektywność substratowa
o
stereoselektywność
o
regioselektywność
o
chemiselektywność
S E L E K T Y W N O Ś Ć S U B S T R A T O W A
Zdolność do tolerancji dużej grupy substratów (ale enzym katalizuje tylko określony typ reakcji).
8
O
R
COOH
L- KETOKWAS
R
COOH
N
H
2
H
L-AMINOKWAS
HO
2
H
2
CC
COOH
H
N
H
2
COOH
O
HO
2
CH
2
C
KWAS L-Asp
KWAS SZCZAWIOOCTOWY
grupy aminowej z donora na akceptor
przeniesienie
Substraty transaminazy:
-
2-ketoglutaran
-
β
-fluorofenylopirogronian
-
4-tiometylo-2-ketomaślan
-
fenylopirogronian
-
indylopirogronian
-
3-imidazolopirogronian
Im bardziej skomplikowany enzym tym mniej substratów toleruje.
S T E R E O S E L E K T Y W N O Ś Ć (enancjoselektywność, diastereoselektywność)
Zdolność do odróżniania pojedynczych enencjomerów lub diastereoizomerów.
W2
A. Produkcja herbicydów pochodnych kwasu fenoksypropionowego:
CH
3
CHCl
COOH
kwas R,S-
2
-chloropropionowy
R-dehydrogenaza
C
H
3
Cl
H
HOOC
kwas S,
2
- chloropropionowy
pochodne kwasu
R-fenoksypropionowego
C
H
3
OH
H
HOOC
kwas S-mlekowy
Substratem R-dehydrogenazy jest izomer R.
B. Produkcja aspartamu:
C
C
H
O
2
C
CO
2
H
+ NH
aspartaza
C
H
2
CO
2
H
N
O
2
C
kwas fumarowy L-Asp
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
9
C
H
2
CO
2
H
N
O
2
C
L-Asp
+
H
N
H
2
CO
2
CH
3
termolizyna
H
CO
2
CH
3
HN
O
N
H
2
HOOC
aspartam
40.00 ton L-Asp / rok
Biosynteza aspartamu- enzym w postaci enzymatycznej lub całej komórki, zawsze immobilizowany; 1
kg enzymu
→
10.000 kg produktu (3$/1 kg).
R E G I O S E L E K T Y W N O Ś Ć
Zdolność odróżniania grup funkcyjnych znajdujących się w różnych regionach tej samej cząsteczki.
W2
Hydroksylacja steroli:
O
O
Aspergillus niger
O
O
O
H
progestreon 1,1-alfa-hydroksyprogesteron
C H E M I S E L E K T Y W N O Ś Ć
Zdolność do rozróżniania określonych grup funkcyjnych spośród grup o podobnej lub wyższej
reaktywność.
Hydroliza nitryli:
CN
H
3
COOC
COOH
H
3
COOC
nitrylaza
2. Enzymy pracują w łagodnych warunkach- minimalizacja niepożądanych reakcji ubocznych
(dekompozycja, racemizacja, izomeryzacja).
Produkcja akrylamidu:
10
-
proces chemiczny
-
temp: 80-180
°
C
-
produkt uboczny (kwas akrylowy)
-
katalizator miedziowy (toksyczność)
C
C
CN
hydrataza nitrylowa
akrylonitryl
C
C
O
NH
2
akrylamid
3. Kataliza enzymatyczna jest „przyjazna środowisku”.
4. Przyspieszanie reakcji chemicznej o wartość 10
-9
-10
-10
W2
ZARZUTY WOBEC ENZYMÓW:
1. Działają tylko w środowisku wodnym (kłamstwo- biokataliza w układach dwufazowych i
niewodnych).
2. Cena enzymów.
3. Stabilność enzymów:
BIOKATALIZATOR
OKRES PÓŁTRWANIA
Aspartaza
6 m. – 2 l.
Fumaraza
180 dni
Deaminaza Arg
140 dni
Transaminaza
90 dni
Amidaza penicylazy
>
6 m.
Proteaza
>
60 dni
Izomeraza glukozy
>
60 dni
4. Wydajność reakcji katalizowanych przez enzymy:
-
reakcje wysokowydajne:
o
produkcja L-Asp przez immobilizowaną aspartazę
o
produkcja L-Phe przez amidazę lub transaminazę
o
produkcja L-tert-Leu przez dehydrogenazę leucynową w reaktorze membranowym
o
produkcja kwasu 2-chloropropionowego z użyciem lipaz
5. Regeneracja kofaktorów:
-
metoda regeneracji NAD
+
:
o
dodatkowa reakcja chemiczna
O
CO
2
OH
CO
2
dehydrogenaza
fenylopirogronianu
fenylopirogronian
NADH 2000 cykli NAD+
S- fenylomleczan
HOCCH
3
dehydrogenaza
alkoholowa
CH
3
CH
3
OH
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
11
W2
o
reaktor membranowy (zwiększenie masy kofaktora), np. otrzymywanie
L-tert-Leu:
(CH
3
)
2
C
CO
2
O
+ NH
dehydrogenaza Leu
(CH
3
)
2
C
N
H
2
H
CO
2
PEG-NADH 6000 cykli PEG-NAD+
CO
2
dehydrogenaza
mrowczanowa
HCOO-
o
zastosowanie całych komórek:
§ źródło węgla napędzające komórkę
§ alkohole wykorzystywane do produkcji leków benzodiazepinowych
§ 2 kg glukozy / kg produktu
O
O
CH
3
O
Z. rouxii, glukoza
O
O
CH
3
H
OH
izomer S
o
stereoselektywna redukcja 2-podstawionych-
β
-ketoestrów
R1
O
O
OEt
R
2
Cl
R1
O
O
OEt
R2
H
R. arrbizzus
ATTC 1145
OEt
O
OH
H
R2
H
NH
2
NH
2
R1
OH
H
NH
2
NH
2
R2
O
H
NH
2
R2
H
OH
H
R1
12
W2
6. Enzymy nie katalizują przemysłowo atrakcyjnych reakcji:
a. kwasy tłuszczowe
b. syropy fruktozowe
c. aspartam
d. akrylamid
e. 6-APA
f. aminokwasy
g. cyklodekstryny
h. S-2-chloropropionian
Forma katalizatora
ZALETY
WADY
prosta aparatura,
tolerancja na wysokie
stężenia substratów i
produktów
niezbędny system
regeneracji kofaktora
reakcja w roztworach
wodnych
wysoka aktywność
produkty uboczne,
substraty
nierozpuszczalne w
wodzie, ekstarkcja
reakcja w
rozpuszczalnikach
organicznych
łatwa procedura,
substraty
rozpuszczalne w
rozpuszczalnikach
organicznych, łatwe
odzyskanie enzymu
niska aktywność
ENZYMY
immobilizowane
łatwe odzyskanie
enzymu
utrata aktywności
podczas procesu
immobilizacji
brak systemów
regeneracji kofaktora
sprzęt, obróbka dużych
objętości, niższa
tolerancja na reagenty-
niższa produktywność,
niska tolerancja na
rozpuszczalniki
organiczne, reakcje
uboczne
kultury rosnące
aktywność
duża biomasa,
produkty uboczne
kultury spoczynkowe
łatwa obróbka, mniej
produktów ubocznych
niska aktywność
KOMÓRKI
immobilizowane
wielokrotność użycia
niska aktywność
W2
WYKORZYSTANIE ENZYMÓW W PRZEMYŚLE
1. Optycznie czynne:
a. D-p-hydroksymetyloglicyna (prekursor semisyntetycznych penicylin i cefalosporyn)
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
13
CHO
COOH
+
NH
2
CO
NH
2
+
OH
amidoalkilacja
N
H
CO
NH
CO
O
H
racemizacja spontaniczna
N
H
CO
NH
CO
H
O
H
D-hydantoinaza
O
H
H
NHCOSH
2
HOOC
D-karboamylaza
O
H
H
HOOC
NH
2
2. Produkcja akrylamidu.
akrylonitryl
woda
usuniecie CO
2
hydratacja
oddzielenie katalizatora
nierozpuszczalny akrylonitryl
odzyskanie katalizatora
zageszczenie
usuniecie Cu
(dekoloryzacja)
W2
proces mikrobiologiczny:
14
woda
hydratacja
oddzielenie katalizatora
dekoloryzacja
produkt
hodowla i immobilizacja mikroorganizmow
CH
2
CH
2
CH
hydrataza nitrylu
woda
CH
2
CH
2
CHNH
2
amidaza
woda
CH
2
CH
2
COOH
akrylonitryl
- Rhodococcus rhodochrous (również produkcja nikotynamidylu z 3-cyjanopirydyny)
-
H-NHaza 520 kDa- mocznik jako induktor, substraty alifatyczne
-
L-NHaza 130 kDa- cykloheksanokarboksyamid, substraty aromatyczne
-
Krotonamid- obie formy
3. Produkcja kwasu D-pantotenowego.
O
O
H
OH
O
O
OH
H
O
O
OH
O
D-P
L
L-PL
DL-PL
L-specyficzna
hydroliza
D-specyficzna
hydroliza
O
COOH
OH
H
O
COOH
H
OH
L-PA D-PA
PL- lakton pentyloway
PA- kwas pantoteinowy
DL-PD- hydroliza enzymatyczna
→
ekstrakcja
→
D-PA
→
obróbka
→
D-PL
↓
L-PL
→
obróbka
→
DL-PL
-
suszona mycelia Fusarium oxysporum
-
70% roztwór form L i D PL w pH 7 przez 20 h izomer D jest całkowicie hydrolizowany
W2
4. Produkcja hydroksyproliny.
-
trans-4-hydroksy-Pro
-
hydriksylacja Pro (8 izomerów)
-
hydroksylaza z Dactylosporangium sp. (RHI-trans-4-hydroksy-1-Pro)
-
hydrolaza z Streptomyces sp. (TH2-cis-3-hydroksy-1-Pro)
-
dioksygenazy, askorbinian
SPOSOBY ZASTOSOWANIA ENZYMÓW W R. CHEMICZNYCH
1. Typowe reakcje w roztworach wodnych.
2. Enzymy immobilizowane.
3. Reakcje w układach dwufazowych.
4. Reakcje w rozpuszczalnikach organicznych.
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
15
ENZYMY W ROZPUSZCZALNIKACH ORGANICZNYCH
Zastosowanie układów niewodnych:
-
umożliwia rozpuszczanie hydrofobowych substratów
-
przesuwa równowagę reakcji w stronę reakcji syntezy a nie hydrolizy (synteza estrów,
peptydów, laktonów)
-
daje możliwość uniknięcia niepożądanych reakcji ubocznych zachodzących w obecności
wody
-
daje możliwość uniknięcia procesu immobilizacji (łatwy odzyski nierozpuszczalnych w
rozpuszczalnikach organicznych enzymów
-
w przypadku, gdy immobilizacja jest niezbędna wystarczy immobilizacja na porowatych
powierzchniach
-
łatwy odzysk produktu
-
wzrost termostabilności enzymów
-
obniżone ryzyko zakażenia mikrobiologicznego
Badania zastosowania enzymów w roztworach organicznych rozwijały się w kilku etapach:
-
woda / rozpuszczalnik organiczny mieszający się z wodą
-
układy dwufazowe
-
środowisko niewodne
Woda jest niezbędna enzymom do przyjęcia odpowiedniej konformacji.
Enzym musi być otoczony molekularną cząsteczka wodą.
PROBLEM pH
Enzymy liofilizowane bądź wytrącone z roztworów o pH optymalnym- dla ich aktywności „pamięć
pH” (najlepiej liofilizować ze środowiska o pH optymalnym, bo to pH enzym „zapamięta”).
W rozpuszczalnikach organicznych nie da się zmierzyć pH- enzym będzie w takim stanie w jakim był
liofilizowany (grupy jednogenne enzymu odpowiedzą na to w jakim są środowisku).
W2
P R Z Y G O T O W A N I E B I O K A T A L I Z A T O R A
-
modyfikacja kowalencyjna, np. przyłączenie PEG
-
modyfikacja niekowalencyjna:
o
„the ion pairing” (parowanie jonów)- niezbędne niskie stężenie surfaktantu
o
liofilizacja z roztworów wodnych w obecności:
§ soli nieorganicznych (KCl), np. subtylizyna Carlsberga była liofilizowana w
obecności KCl, uzyskano enzym, którego aktywność w heksanie była 4000
razy wyższa
§ związków organicznych (etery koronowe, cyklodekstryny)
§ substratów- zmiany w specyficzności substratowej („molecular imprinting”-
analog stanu przejściowego jest zmieniony tak, że uzyskuje aktywność
kataliyczną)
W P Ł Y W R O Z P U S Z C Z A L N I K A N A P R O C E S B I O K A T A L I Z Y
-
bezpośredni wpływ na enzym- obniżenie aktywności katalitycznej lub stabilności
-
oddziaływanie na reagenty
-
oddziaływanie na warstwę molekularną otaczającą enzym
J A K W Y B R A Ć R O Z P U S Z C Z A L N I K?
1. Kompatybilność rozpuszczalnika z planowaną reakcją:
-
np. modyfikacja cukrów- cukry rozpuszczają się w hydrofilowych, mieszalnych z wodą
rozpuszczalnikach; zastosowanie rozpuszczalnika niepolarnego jest niekorzystne ponieważ nie
dojdzie do kotaktu pomiedzy substratem a enzymem
16
-
np. oksydaza polifenolowa- w heksanie podane produkty (chinony) dążą do pozostania blisko
enzymu (utrata aktywności, reakcje uboczne); zamiast heksanu stosue się chloroform.
2. Rozpuszczalnik musi być obojętny dla reakcji:
-
reakcja transestryfikacji- zastosowanie rozpuszczalnika o charakterze cukru lub alkoholu-
estry rozpuszczalnikowe
Miarą hydrofobowości rozpuszczalnika jest log P (P- współczynnik podziału pomiędzy etanol a
wodę).
log P wysoki- rozpuszczalniki niepolarne (proszki enzymatyczne)
log P niski- rozpuszczalniki polarne
R E A K C J E E N Z Y M A T Y C Z N E Z A C H O D Z Ą C E W
R O Z P U S Z C Z A L N I K A C H O R G A N I C Z N Y C H:
a. utlenianie steroidów- sterole charakteryzują się niską rozpuszczalnością w H
2
O;
Nocardia rodocrous; 3-
β
-hydroksy-
δ
5
-steroid
→
3-keto-
δ
4
-steroid, np.: utlenianie
cholesterolu do cholestenonu (heksan:benzen 1:1)
b. reakcja epoksydacji i hydroksylacji
W2
c. reakcja katalizowanaprzez dehydrogenazę alkoholową, np. HLADH (wątroba
końska); optycznie czynne alkohole, ketony; enzym immobilizowany na szklanych
kulkach, eter izopropylowy, racemiczny alkohol lub keton, regeneracja kofaktora-
aldehyd izomasłowy
d. polimeryzacja fenoli
e. depolimeryzacja lignin
f. synteza estrów- lipazy jako proszki enzymatyczne lub całe komórki, estryfikacja
kwasów tłuszczowych;
i. wysuszone mycelia Rhizopus arrhizus w mieszaninie oktanolu + kwasu
olejowego + sita molekularne (wiążą wodę ze środowiska)
ii. reakcja interestryfikacji (wymiana grup acylowych) ważna komercyjnie;
produkcja masła kakaowego, niskotopliwe margaryny (topią się już w 30
°
C)
iii. lipaza z Rhizopus nivens- przekształcanie POP (pochodna glicerolu) przy
udziale stearynianu w mieszaninę związków, które są skałdnikami masła
kakowego; modyfikacja triglicerydów wykorzystywana do otrzymywania
niskotopliwych margaryn
g. synteza peptydów- udział wody 50% lub układ niewodny; hydrofobowe pochodne
aminokwasów
i. chymotrypsyna immobilizowana na Sepharose
ii. ester N-acetylo-L-Phe-o-metylowy + amid Ala (Gly) w butanodiolu (10%
wody)
iii. chymotrypsyna immobilizowana na chitynie katalizuje syntezę
HOOC-Tyr-Gly-NH
2
95% acetonitrylu
h. rozdział mieszanin recemicznych- lipaza ze szczepu Candida cylindracea
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
17
OH
(+) mentol
lipaza
C. cylindracea
OCO(CH
2
)
10
CH
+
CH
3
(CH
2
)
10
COOH
(-)
W przemyśle rozdział mieszaniny racemicznej kwasów 2-halogenokarboksylowych (2-
chloro i 2-bromopropionian) przy pomocy butanolu, w heksanie.
Rozdział racemicznych alkoholi przy pomocy świńskiej lipazy trzustkowej, otrzymuje się
2-oktanol, 2-dodekanol, transestryfikacja z trichloroetylomaślanem (izomer R reaguje
dając czysty R-ester, izomer S wydzielony)
W2
PERSPEKTYWY BIOKATLIZY
1. Dostosowanie biokatalitycznej cząsteczki do procesu:
-
poszukiwanie nowych biokatalizatorów pochodzących z ekstremofili
-
wprowadzanie zmian w molekularnej strukturze biokatalizatora (modyfikacje chemiczne,
mutacje punktowe, ukierunkowana molekularna ewolucja in vivo)
-
odpowiednia postać biokatalizatora
-
inżynieria warunków fizycznych procesu
-
inżynieria środowiska reakcji (środowisko niewodne, dwufazowe, ciecz nadkrytyczna)
2. Katalityczne biocząsteczki:
-
rybozymy (RNA-zymy)- niektóre domeny natywnych cząsteczek RNA o właściwościach
katalitycznych, opisane na poczatku lat 90
-
deoksyrybozymy (DNA-zymy)- katalityczne DNA znalezione w kombinatoryjnych
bibliotekach fragmentów jednoniciowych syntezowanych chemicznie i wyselekcjonowanych
za pomocą metody Selex
-
abzymy- p/ciała katalityczne; immunizacja zwierząt doświadczalnych przy pomocy analogu
stanu przejściowego jakiegoś substartu (p/ciała katalityczne); droga produkcja, około 100
różnych reakcji (hydroliza, kondensacja, inne)
W3
ABZYMY (dodatkowo seminarium)
Są to katalityczne przeciwciała występujące w naturze.
-
mleko kobiet karmiących- abzymy o aktywności kinazy białkowej, rybonukleazy,
deoksyrybonukleazy,
α
-amylazy.
-
mikrozymy
-
masy molowe niższe niż 10 kDa
-
najmniejszy opisany enzym to mikroesteraza z Bacillus stearothermophilus
(problemy z procedurą izolacji i oczyszczania)
18
-
mikroesteraza z Candida lipolytica (5,7 kDa)
-
mikroproteaza z termofilnego szczepu Actinomyces sp.
-
mikrozym z archeabakterii Sulfolubus sulfataricus
-
metaloproteinaza z Grant Kurthia spirofornie (alkalofilna, termostabilna)
-
mikroesterazy z termofilnych grzybów (1530-5257 kDa)
Mikrozymy są alternatywą dla rybozymów i abzymów.
Jaka jest różnica między ekstermofilami a ekstremozymami? (EGZAMIN)
EKSTREMOZYMY
Enzymy pochodzące z mikroorganizmów ekstremofilnych.
Termofile : T
opt
>
45
°
C
-
hipertermofile : T
opt
>
85
°
C
-
psychrofile : T
min
<
0
°
C
-
acidofile : pH
<
2
-
alkalofile : pH
>
10
-
barofile : p
>
1 atm
-
halofile : NaCl 4-5 M
-
metalofile : odpowiednie metale ciężkie
-
mikroaerofile : O
2
<
21%
-
enetektofile : mikroorganizmy żyjące w eutektycznej warstwie lodu (lód typu 4)
Badania zaawansowane prowadzone są na termozymach.
Komercyjny sukces: fag polimerazy z Thermus agnaticus (Pyrococcus furiosus):
termofilne amylazy, ksylanazy, proteazy (produkcja glukozy i fruktozy ze skrobi, bielenie mas
papierniczych, browarnictwo, detergenty piorące).
Etap wdrażania:
-
pullulanaza z Thermococcus aggregans
-
hydrataza nitrylowa z Bacillus pallidens
W3
-
termoacydofilna esteraza z Bacillus acidocaldavirus
-
termostabilne lipazy z Bacillus thermocatemulants
Badane psychrofile:
-
lipaza z Candida autarctica
-
antarktyczna mletylizyna z TA41 (muteina 3G7-3 cykle ukierunkowanej ewolucji
in vitro, wymiana 7 aminokwasów, 500-krotny wzrost termostabilności w 60
°
C, przesunięcie
T
top
)- detergenty piorące
-
psychrofilne oksydorektuazy- biosensory, bioremedacja skażonych ropopochodnymi
związkami środowisk
-
lipazy i esterazy w środowiskach niewodnych (gęstość cząsteczki)
-
glikozydaza - w niskotemperaturowych roztworach hydrolizy (hydroliza laktozy w mleku i
ściekach o dużej zawartości serwatki
Enzymy eutektofili- badanie metagenomu („środowiskowe DNA”).
Ukierunkowana ewolucja enzymów in vitro
-
opiera się na wykreowaniu dużej liczby wariantów wyjściowego białka katalitycznego i
znalezienie wśród nich docelowego ulepszonego enzymu;
-
stworzenie biblioteki wariantów genu enzymów (10
8
– 10
12
wariantów) i sprawdzenie czy
każdy wariant ulega ekspresji;
a. Tworzenie biblioteki genów:
-
metody nierekombinacyjne
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
19
o
Ep-PCR (error-prone PCR)
o
mutacje chemiczne wyjściowego DNA
o
techniki inżynierii białkowej (ukierunkowane punktowe mutacje, mutacje poprzez
nasycenie punktowe)
o
pasaże genów przez mutatorowe szczepy Escherichia coli
-
metody rekombinacyjne
o
„tasowanie genów” (DNA shuffling)
o
STEP (Stagered Extention Process)
o
RACHITT (Random Chimera Genesis On Transient Template)
b. Wiązanie genotypu z fenotypem:
-
ekspozycja na fagu (białko fuzyjne z białkiem płaszcza wirusa)
-
ekspozycja na powierzchni komórki drożdżowej (2002 r.)
-
ekspozycja na rybosomie (rybosom – m-RNA – białko = kompleks)
-
ekspozycja na m-RNA
-
kompertmentacja in vitro (jeden gen w kropelce wody; inertny)
c. Sortowanie biblioteki wariantów zmutowanego genu fizycznie związanego z enzymem jako
produktem jego ekspresji
-
selekcja (ważna)
-
skrining wysokorpzepustowy
o
QUEST (obecny polimeryczne aktywator transkrypcji)
o
FAS (pomiar fluorescencji klonów zawierających różne warianty genów enzymu)
d. Dotychczasowe osiągnięcia DE:
-
zmieniona peroksydaza cytochromowu C
W3
-
Escherichia coli
β
- galaktozydaza
→
β
- glukozydaza
-
lipaza Staphylococcus aureus
→
fosfolipaza
-
dehydrogenaza 3-izopropylojabłczan (zwiększenie aktywności)
-
fragment DNA (biblioteka genów hipertemofilnego Pyrococcus furiosus)
o
aktywność
β
-laktamazy
-
inżynierowanie szlakami metabolicznymi (biosynteza karotenoidów)
-
modyfikacje DE (3-indolo-glicerol)
o
izomeraza fosforybozylo antranilanu
Nowe postacie preparatów enzymów
-
biokatalityczny plastik złoża do bioreaktorów
-
enzymy zamykane w hybrydowych kompozytach organiczno- nieorganicznych
-
biokatalizator zamykany w sieci polimeru wraz z cząsteczkami magnetytu (złoża do reaktorów
fluidalnych)
-
sieciowanie kryształów enzymów (CLESs)
-
usieciowane agregaty białek enzymatycznych (CLEAs)
Inżynierowanie środowiskiem reakcji
-
ciecze jonowe- sole występujące w temperaturze otoczenia w stanie ciekłym (ciekłe w
temperaturze T
>
300
°
C, rozpuszczają się w nich różne związki, organiczne i nieorganiczne
polimery; wysoka polarność, znikome ciśnienie par, doskonała kwasowość Lewisa Bronsteda,
recykling) stosowane w laboratorium w procesach transestryfikacji, alkoholizy, amonolizy,
rozdziale racematów P-chiralnych hydroksymetanofosfonatów, syntezie aspartamu (przy
udziale termolizyny)
-
rozpuszczalniki nadfluoranowe
Biokataliza i biosynteza kombinatoryjna
-
biokataliza kombinatoryjna jest techniką stosowaną w celu stworzenia bibliotek produktów
naturalnych lub syntetycznych
o
lipaza z Candida antarctica (biblioteka 24 estrów; 4 alkohole + 6 estrów)
-
biosynteza kombinatoryjna to przetwarzanie lub inżynierowanie naturalnymi szlakami
metabolicznymi aby otrzymać analogi produktów naturalnych
20
o
nowe makrolidy- manipulacje na poziomie syntezy poliketydylowej
o
karotenoidy
ANTYBIOTYKI
1928 r. – początek ery antybiotyków
1942 r. – definicje antybiotyków S.A.Waksman „... antybiotyki są to substancje chemiczne
wytwarzane przez mikroorganizmy i mające w dużych rozcieńczeniach zdolność zabijania lub
hamowania wzrostu innych drobnoustrojów...”
W3
DEFINICJA WSPÓŁCZESNA
Makrocząsteczkowe substancje naturalne, najczęściej pochodzenia drobnoustrojowego lub ich
półsyntetyczne modyfikacje albo syntetyczne analogi, które w małym stężeniu działają wybiórczo
na struktury i procesy biologiczne hamujące wzrost lub rozmnażanie komórek.
PODZIAŁ ZE WZGLĘDU NA BUDOWĘ CHEMICZNĄ
-
pochodne aminokwasów, np.:
o
β
-laktamy
o
antybiotyki polipeptydowe
o
antybiotyki glikopeptydowe
o
antybiotyki lipopeptydowe
-
pochodne cukrów, np.:
o
aminoglikozydy
o
glikolipidy
-
antybiotyki makrocykliczne
-
chinony i ich pochodne, np.:
o
antracykliny
-
inne (pochodne cykloalkanów, nukleozydy, polietery aromatyczne, fosfoniany, steroidy)
PODZIAŁ ZE WZGLĘDU NA WŁAŚCIWOŚCI BAKTERIOBÓJCZE I
BAKTERIOSTATYCZNE
Antybiotyki
β-laktamowe – penicyliny
TYP PENICYLINY
ŁAŃCUCH BOCZNY
PREKURSOR
benzylowa (penicylina G)
CH
2
CO
kwas fenylooctowy
hydroksybenzylowa (X)
CH
2
O
H
CO
kwas hydroksyfenylooctowy
pentylowa (F)
CO
kwas 3-heksynowy
fenoksymetylowa (V)
O
CH
2
CO
kwas fenoksyoctowy
n-heptylowa (K)
CO
kwas karpylowy
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
21
Penicylina G - pierwszy naturalny antybiotyk
β
-laktamowy o bardzo dobrej aktywności wobec
ziarenkowców, Gram (+), wywiera działanie bakteriobójcze; nie jest stabilna w roztworach
wodnych, więc nie może być podawana doustnie.
W3
Penicylina V- podobne spectrum aktywności- nieaktywna w stosunku do gronkowców; podawana
doustnie.
AKTYWNOŚĆ:
Penicyliny degradowane są przez
β
-laktamazy.
Inhibitory
β
-laktamaz: kwas klawulanowy, sublaktam, tiazolaktam.
JAK DZIAŁA PENICYLINA?
Blokuje ostatni etap biosyntezy bakteryjnej ściany komórkowej (tworzenie poprzecznych wiązań
pomiędzy różnymi łańcuchami peptydoglikanu). Jej bezpośrednim celem jest transpeptydaza
glikopeptydowa (mimikra molekularna).
PROCES PRODUKCJI PENICYLIN:
1. Liofilizowane spory szczepu produkcyjnego.
2. Hodowle na skosach agarowych.
3. Kultury wegetatywne w kolbach stożkowych.
4. Namnażanie biomasy.
5. Właściwy proces syntezy (dozowanie odpowiednich składników i prekursorów,
izolacja, oczyszczanie).
PROCES BIOSYNTEZY PENICYLIN (II fazy):
I.
trofofaza- namnażanie grzybni (30-40 h), szybka asymilacja składników
podłoża, temperatura 27-24
°
C;
II.
idiofaza- właściwa faza produkcji
WYODRĘBNIANIE PRODUKTU I OCZYSZCZANIE:
A. oddzielenie grzybni od płynu pohodowlanego, filtracja;
B. ekstrakcja rozpuszczalnikami w układzie ciecz-ciecz;
C. chromatografia kolumnowa (węgiel aktywny);
D. krystalizacja, suszenie i inne czynności prowadzące do otrzymania
farmaceutyku
Penicyliny semisyntetyczne
Penicyliny półsyntetyczne zostały wprowadzone do lecznictwa pod koniec lat 50. Niektóre z nich
mają wąski zakres działania, np.:
-
p/gronkowcowe (Oksacylina, Kloksacylina, Metycylina, Nafcylina)
-
szeroki zakres (Ampicylina, Amoksycylina, Piperacylina)
Najbardziej znanym antybiotykiem tej grupy jest Ampicylina, która jako pierwsza była
wprowadzona do lecznictwa. Następcą Ampicyliny jest Amoksycylin, która wykazuje znacznie
lepszą aktywność i korzystniejsze właściwości farmakokinetyczne.
W3
W ostatnich latach pojawiły się skuteczne preparaty, łączące penicylinę półsyntetyczną z
inhibitorem
β
-laktamaz.
Penicylina G
1667 mg
-1
Penicylina V
1595 mg
-1
22
Połączenie to rozszerza zakres działania penicylin na bakterie wytwarzające
β
-laktamazy.
Przykładem takich połączonych leków jest amoksycylina z kwasem klawulanowym, ampicylina z
sublaktamem czy piperocylina z tazolaktamem.
N
S
O
CH
3
CH
3
COOH
N
C
R
H
O
acylaza, H
2
O
N
S
O
CH
3
CH
3
COOH
2
HN
6APA
metody chemiczne
S
CH
3
CH
3
COOH
O
N
N
RCO
RCO
diacylopenicylina
penicylina G (V)
Jak się otrzymuje semisyntetyczne penicyliny? (E)
NOWE ANTYBIOTYKI
β-LAKTAMOWE
Thienamycyna- Streptomyces cattleya szerokie spektrum działania (Gram +, Gram -); odporny na
działanie
β
-laktamaz.
COOH
O
N
SCH
2
CH
2
NH
2
H
H
O
H
3
HC
Kwas klawulanowy- Strepotmyces sp.; inhibitor
β
-laktamaz.
Epithienamycyny (kwas oliwanowy) Streptomyces olivaceus; aktywne wobec Gram (-);
inhibitory
β
-laktamaz.
W3
Nocardicyny- Nocardia sp.; monocykliczne
β
-laktamy, np.:
-
nocardicyna A (aktywna przeciwko Gram - , nietoksyczna, stabilna w roztworach wodnych,
odporna na
β
-laktamazy)
Cefalosporyny
Wzory strukturalne penicylin, Thienamycyny (E).
Antybiotyki aminoglikozydowe
Aminocukier + aminocyklitol
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
23
Produkty naturalne : Streptomycyna, Neomycyna, Kanamycyna, Gentamycyna
Produkty semisyntetyczne: Dibekacyna, Amikacyna
PODZIAŁ ANTYBIOTYKÓW AMINOGLIKOZYDOWYCH
-
aminocyklitol jest pochodną streptaminy- streptomycyna
-
aminocyklitol jest pochodną
Bardzo silne antybiotyki. Szerokie spektrum działania- działanie bakteriobójcze. Aktywne przeciw
Escherichia coli, Klebsiella sp, Proteus sp, Enterobacter enterococcus, Pseudomonas aeruginosa,
Staphylococcus aureus. Nieaktywne wobec Streptococcus sp., bakterii beztlenowych, grzybów,
wirusów i pierwotniaków. Odporność na te antybiotyki powstaje powoli wśród bakterii
MECHANIZM DZIAŁANIA
Działają na poziomie biosyntezy białka – rybosom 70S.
Streptomycyna- podjednostka 30S, wiązanie terminalnego RNA z rybosomami (inicjacja biosyntezy
białka), błędna odczytanie m-RNA .
Gentamycyna, Neomycyna, Kanamycyna- dezorganizacja miejsca dekodowania, blokada splicingu
autokatalitycznego grupy I intronów.
TOKSYCZNOŚĆ: narządy słuchu, nerki.
Oporność na antybiotyki aminoglikozydowe może być spowodowana:
-
zmianami w przepuszczalności błony komórkowej
-
mutacjami 30S
-
enzymami modyfikującymi antybiotyki
W4
STREPTOMYCYNY
Rodzina antybiotyków:
-
Streptomycyna
-
Mannozylostreptomycyna
-
Dihydrostreptomycyna
-
Mannozylodihydrostreptomycyna
-
N-demetylostreptomycyna
-
Hydroksystreptomycyna
PROCES WYTWARZANIA STREPTOMYCYNY:
1967 r. –Singh et all opis procesu laboratoryjnego
-
Streptomyces griseus DTH
2
– liofilizowane spory zmieszane z ziemią zostają umieszczone na
płytkach Petriego lub butelkach Rouxa z agarem sojowym, inkubacja 2-3 tyg, w temp. 27
°
C
-
inokulum
o
I etap: kultury wegetatywne; 0,5-2 l kolby Erlenmayera, sojowe podłoże A
o
II etap: fermentator 5 l, sojowe podłoże B
-
proces właściwy- fermentator produkcyjny, podłoże B, pH 7-6,5-7,5, mieszanie,
napowietrzanie (trofofaza, idiofaza)
-
oczyszczanie:
o
zawiesina pohodowlana
o
filtracja lub odwirowanie – przesącz (50 m
3
, 5,5 g/cm)
o
+ 50 m
3
H
2
O
o
chromatografia jonowymienna
o
wymywanie związku EDTA, woda nasycona CO
2
, 2,5 M H
2
SO
4
o
wodny roztwór siarczanu streptomycyny (2700 l, 90 g/cm)
o
dekoloryzacja na węglu aktywnym
o
zagęszczanie pod próżnią
24
o
suszenie
o
275 kg siarczanu streptomycyny 98% czystości
POSZUKIWANIE NOWYCH AMINOGLIKOZYDÓW
-
skrining + inżynieria genetyczna
-
mutageneza
-
modyfikacje chemiczne lub enzymatyczne
-
synteza chemiczna
CEFALOSPORYNY
Antybiotyki
β
-laktamowe produkowane przez Cephalosporium (grzyb). Mechanizm działania
analogiczny do penicylin (hamuje syntezę białka...). Poszczególne generacje cefalosporyn różnią
się przenikalnością do OUN i odpornością w stosunku do
β
-laktamaz.
Proces wytwarzania FBC (Feed Batch Culture). W lecznictwie stosuje się ponad 50 cefalosporyn.
W4
N
S
COOH
O
CH
2
OCOCH
3
N
S
COOH
O
N
H
2
CH
2
OCOCH
3
H
2
NCHCOOH(CH
2
)
3
CCOHN
cefalosporyna
ACA
CEFAMYCYNY
N
S
O
COOH
CH
2
OCOCH
3
H
2
NCHCOOH(CH
2
)
3
COHN
OMe
Cefamycyna C- Nocardia lactamdurans, Streptomyces clavuligerus; trwałe
Gram (-)- oporne na
β
-laktamazy
Cefoksytyna- zmodyfikowana cefamycyna (grupa tienacetylowa).
LINKOZAMIDY
Linkomycyna- Streptomyces lincolnensis, metylotioaminocukier + aminokwas, Gram (+)
(Staphylococcus sp., Diplococcus sp. ) oraz beztlenowce; dobra przenikalność do tkanek i kości;
działanie- hamowanie biosyntezy białka 50S.
ANTYBIOTYKI PEPTYDOWE
Blastycydyna S- Pyricularia oryzae, Streptomyces sp., rolnictwo
Bleomycyna, Bestatyna – terapia p/nowotworowa
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
25
-
Bleomycyna- hamowanie syntezy białek kwasów nukleinowych
-
Bestatyna- hamuje aminopeptydazy
ZWIĄZKI P/NOWOTWOROWE
Rośliny, mikroorganizmy, ssacze kultury tkankowe. Trudności przy procesie produkcji:
toksyczność, wydzielanie, oczyszczanie; detoksyfikacja ścieków.
W4
1. Poszukiwanie i izolacja odpowiednich produktów- izolacja produktu.
2. Preskrining – linie P388 mysiej leukemii.
3. Testy in vitro sposób podania leku.
4. I faza badań klinicznych.
5. II faza badań klinicznych.
6. III i IV faza badań klinicznych.
Bezpieczeństwo przy produkcji leków cytotoksycznych- bariery biologiczne, filtry HEPA,
czujniki, blokady, detoksyfikacja ścieków.
ANTRACYKLINY
Należą do najszerzej używanych związków p/nowotworowych.
Budowa: chromofor antrachinowy podstawiony jednym lub więcej cukrem.
Dannorubicyna (Daunomycyna)- Streptomyces coeruleorubidus
Doksorubicyna (Adriamycyna)- mutant; Streptomyces peucetius; szerokie spektrum działania
PROCES PRODUKCJI DAUNOMYCYNY
Streptomyces peucetius, glikozyd, 60-70
µ
g/ml daunomycyny, 5-15
µ
g/ml adriamycyny.
METODA I:
Skosy agarowe (10 dni, 26-27
°
C), kultury w kolbach (2 dni, mieszanie, napowietrzanie), 800 l
fermentator (28
°
C, 67 h).
METODA II:
Kultury w 4 l kolbach (zamrożone mycelia, 28
°
C, 2,5 dnia), 100 l fermentator (30
°
C, 24h), 1000 l
fermentator (12 dni), 10000 l fermentator (7-10 dni).
PROCES PRODUKCJI ADRIAMYCYNY
Agarowe skosy (26-27
°
C, 10 dni), homogenizacja zaszczepu i zawieszenie w wodzie, kultury w
kolbach (48 h), wytrząsanie (28
°
C), 800 l fermentator (27
°
C, 67-145
°
C).
ANTYBIOTYKI NUKLEOZYDOWE
Najsilniejsze czynniki cytotoksyczne, hamują biosyntezę kwasów nukleinowych i białek, wykazują
aktywność antybiotyczną, antywirusową, immunosupresyjną.
Produkcja: Streptomyces sp., Nocardia sp.
Enzymy cytotoksyczne:
L-asparaginaza- hamuje asparaginozależną biosyntezę białka i ewentualnie kwasów nukleinowych;
limfocytowa leukemia u dzieci.
W4
CO JESZCZE BIOTECHNOLOGIA DAJE MEDYCYNIE?
26
PRZECIWCIAŁA MONOKLONALNE
-
diagnostyka, terapia chorób zakaźnych
-
badanie właściwości antygenowych białek
-
charakterystyka wirusów
-
transplantacja organów
KONIUGATY PRZECIWCIAŁO-LEK
-
indukowane wirusem komórki nowotworowe (limfoma myszy)
-
produkcja przeciwciał kozich (infekcja co 5 dni)
-
surowica- wysalanie 33% siarczanem amonu
-
frakcje immunoglobulin- odwirowanie, rozpuszczenie w buforze
-
trawienie pepsyną, 0,1 M octan sodu, pH 4,5, 16 h, 37
°
C
-
fragmenty (Fab)
2
-
lek w postaci utlenionej, kowalencyjne wiązanie typu zasady Schiffa
-
redukcja i stabilizacja wiązania p/ciało-lek (HBr)
-
gotowy koniugat (2-10 moli leku / 1 mol p/ciała)
SIDEROFORY
Makroelementy – fosfor, wapń, magnez, potas, sód, żelazo.
Fe
3+
- warunki tlenowe Fe
2+
- warunki
beztlenowe
Rola żelaza w organizmach żywych (mikroorganizmy)
Skład komórki
niedobór żelaza powoduje zahamowanie wzrostu, zmniejszenie
syntezy kwasów nukleinowych, hamowanie sporulacji, zmiany
morfologii komórki
Metabolizm
procesy wymagające żelaza: CKT, transport elektronów, fosforylacja
oksydacyjna, wiązanie azotu, biosynteza aminokwasów
aromatycznych, fotosynteza
Produkty metabolizmu
biosynteza porfiryn, toksyn, witamin, antybiotyków, pigmentów,
kwasów nukleinowych (regulowane żelazem)
Białka i enzymy wymagające
żelaza
peroksydazy, dysmutazy nadtlenkowe, nitrogenazy, hydrogenazy
syntaza glutaminy, cytochromy, ferrodoksyna, flawoproteiny
Mikroorganizmy wykształciły specjalne mechanizmy umożliwiające pobieranie żelaza ze środowiska.
zewnątrz błona komórkowa wewnątrz
enterobaktyna
←
enterobaktyna (synteza de novo)
↓
Fe
3+
↓
Fe
2+
ferri-enterobaktyna
→
produkty hydrolizy
rozpuszczanie
transport
asymilacja
W4
CECHY SIDEROFORÓW
-
substancje niskocząsteczkowe (względna masa cząsteczkowa mniejsza 1500)
-
rozpuszczalne w wodzie
-
wiążą żelazo z wysoką swoistością i powinowactwem (stała stabilność 10
30
)
-
związki fenolowe lub hydroksomaty
enterobaktyna- bakteria jelitowe
ferichromy- grzyby
ferrioksoamina- promieniowce
egzochelina- bakteria śluzowe
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
27
Drobnoustroje wytwarzają siderofory zazwyczaj wtedy, gdy nikła dostępność żelaza ogranicza ich
wzrost. Siderofory mogą posiadać aktywność antybiotyczną: sideromycyna, albomycyna, ferrimycyna.
Produkcja przemysłowa sideroforów jest trudna. Siderofor produkowany na skalę przemysłową:
deksterioksamina (Desferal) produkowany przez Streptomyces pilosus.
WYKORZYSTANIE SIDEROFORÓW
-
zatrucia żelazem- terapia chelatowa (cechy dobrego chelatora: łatwość produkcji,
efektywność, specyficzność, toksyczność, dostęp do puli);
-
hemochromatoza
-
usuwanie toksycznych metali z organizmu
-
zastosowanie pozamedyczne: rolnictwo (Pseudomonas putida- pseudobaktyna; Rhizobium)
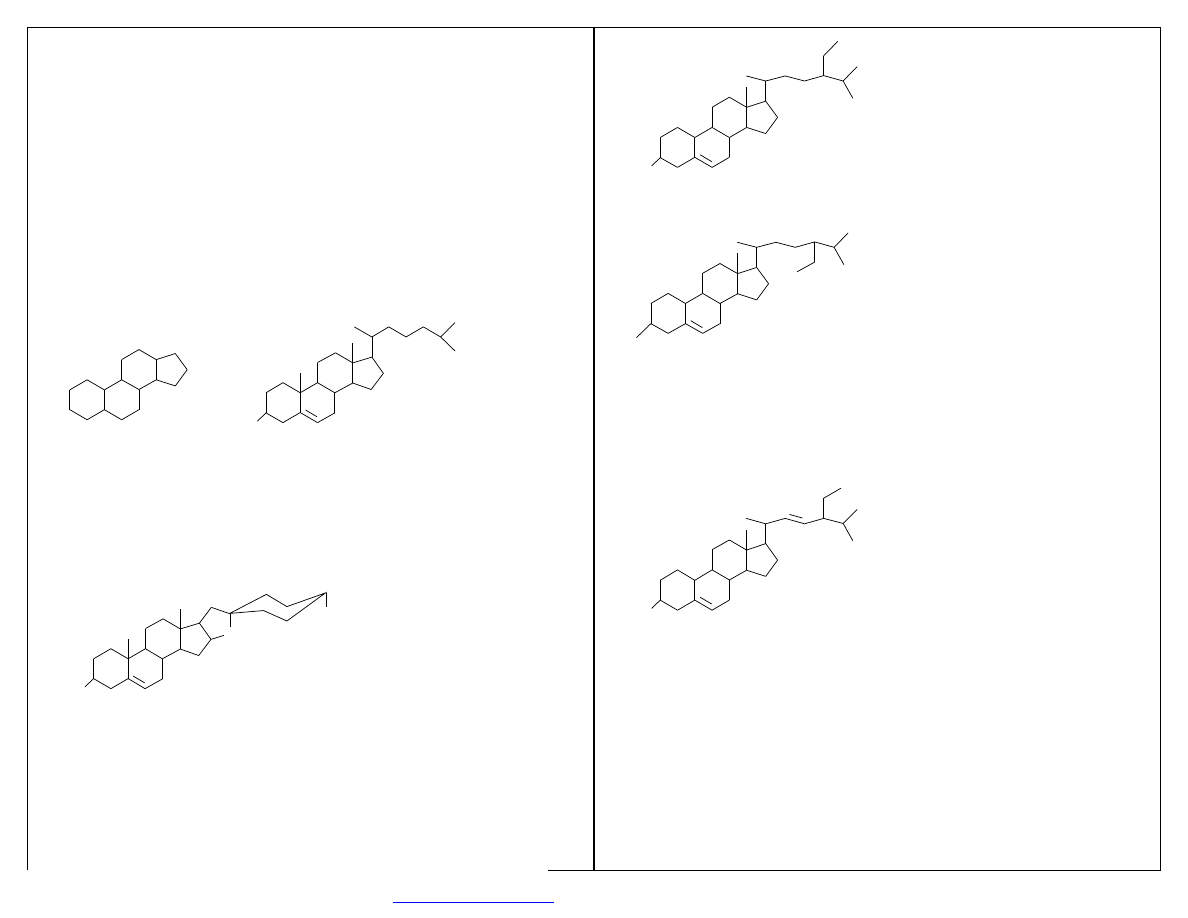
FERMENTACJA STEROLI
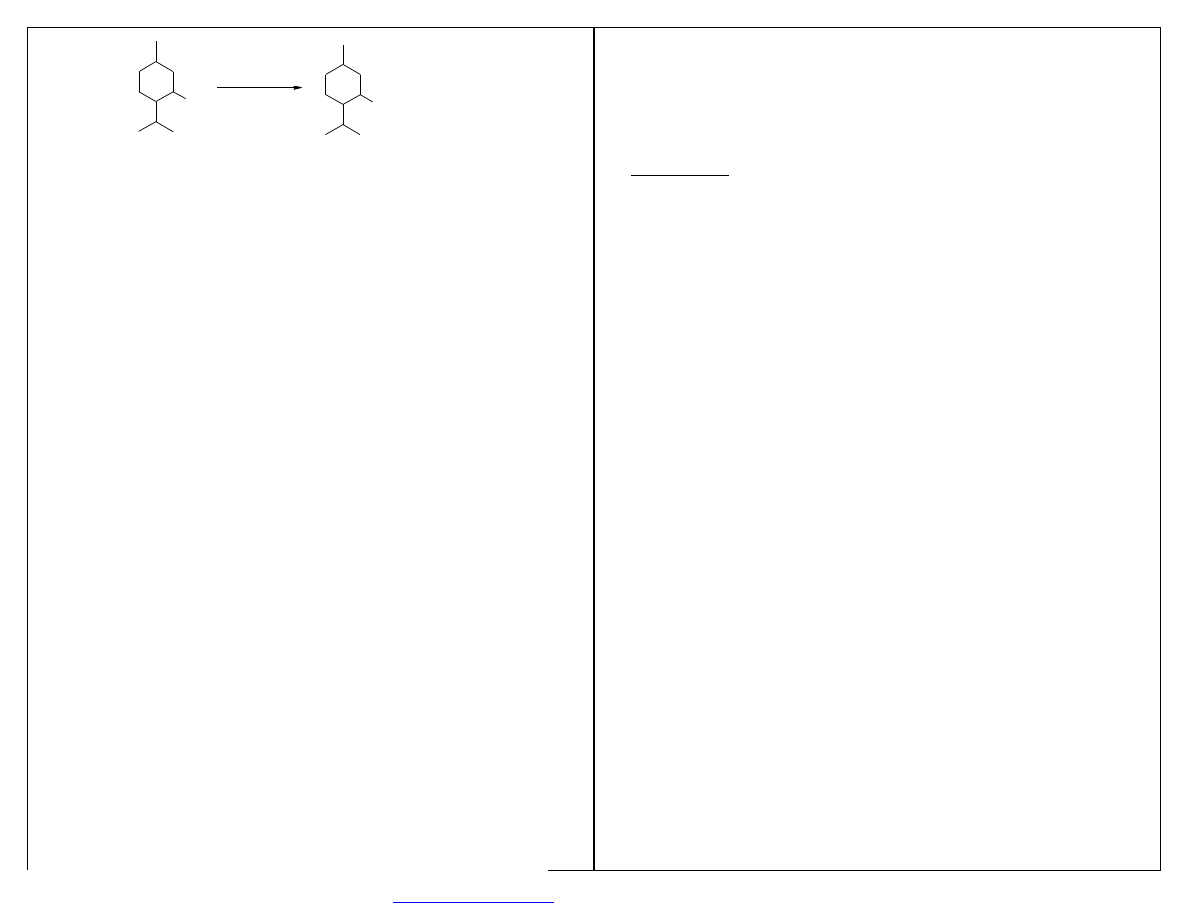
Steran- 4-pierścieniowy system cyklopentanoperhydrofenantrenu.
Hormony sterydowe – ważna funkcja metaboliczna.
Przemysł – leki.
STERAN
O
H
CHOLESTEROL
wypchnięte przez analogi półsyntetyczne
W4
Analogi półsyntetyczne:
-
diosgenina (Discorea mexicana, Discorea composita)
-
stygmasterol
-
β
- i
γ
- sitosterole (nasiona soi, bawełny i trzciny cukrowej)
O
H
O
O
CH
3
DIOSGENINA
28
O
H
SITOSTEROL
SITOSTEROL
HO
W4
O
H
STYGMASTEROL
MIKROBIOLOGICZNA KONWERSJA STEROLI OBEJMUJE:
-
dehydrogenację
-
epoksydację
-
estryfikację
-
izomeryzacje
-
hydrolizę acetali
-
hydrolizę estrów
-
hydrolizę epoksydów
-
hydroksylację
-
utlenianie alkoholi i ketonów
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
29
-
redukcja ketonów i podwójnych wiązań
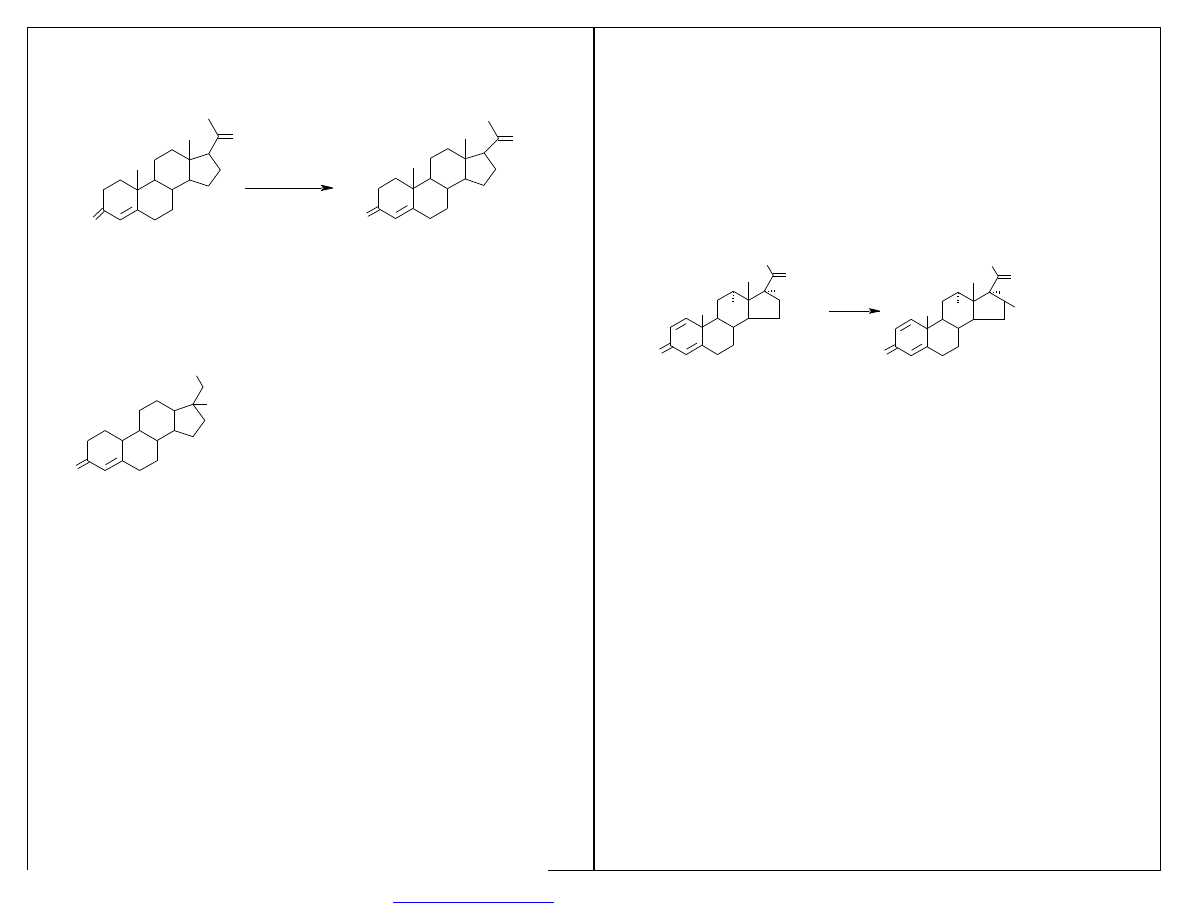
REAKCJE O ZNACZENIU PRZEMYSŁOWYM
1. Hydroksylowanie w pozycji 11
α
i 11
β
, np. hydroksylowanie progesteronu w pozycji 11
α
O
O
PROGESTERON
O
O
HYDROKSYPROGESTERON
produkty uboczne: 6-
α
-, 11-
β
-dihydroksyprogesteron
Rhizopus arrhizus, Rhizopus nigricans, Aspergillus ochraceus
W4
O
OH
O
H
ZWIAZEK S
Currularia lunata, Cunninghamella blakestleeana
MECHANIZM REAKCJI HYDROKSYLOWANIA- polega na wprowadzeniu jednego atomu tlenu
cząsteczkowego do substratu przy udziale specyficznych oksygenaz i redukcji drugiego do H
2
O.
steroid steroid OH
enzym-FeO
2+
enzym - Fe
2+
NADP
+
NADPH + H
+
H
2
O O
2
2. Dehydrogenacja w pozycji
∆
1
Arthrobacter simplex, Bacillus sphaericus, Nocardia restricus, Septomyxa affinis, Fusarium solani
30
W4
3. hydroksylowanie w pozycji 16-
α
.
O
OH
O
H
O
F
OH
fluorohydrokortyzon
O
OH
O
H
O
F
OH
OH
hydroksy- -fluoro- -metylohydrokortyzon
Streptomyces argenteolus
4. Modyfikacje łańcuchów bocznych.
Nocardia sp., Streptomyces sp., Arthrobacter sp., Mycobacterium sp.
Grupa ketonowa (C-17) oraz grupa karboksylowa (C-20).
PROCES FERMENTACJI STEROIDÓW
Produkty o znaczeniu komercyjnym:
-
kortyzon
-
hydrokortyzon
-
testosteron
-
testolakton
-
flokortolon
-
preolnizon
-
preolnizolon
BIOTECHNOLOGIA SZTUCZNYCH KOMÓREK
Błony komórki sztucznej:
-
półprzepuszczalna
-
grubość 0,002
µ
m – 1,8 nm
-
uzyskuje się w procesie emulsyfikacji a następnie polimeryzacji międzyfazowej (silastik,
octan celulozy, nylon polietyloaminowy, materiały biodegradowalne).
Zamykanie systemów enzymatycznych wymagających systemu regeneracji kofaktora:
-
heksokinaza i kinaza pirogronianowa (regeneracja ATP)
o
glukoza
→
glukozo-6P
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
31
o
fosfoenolopirogronian
→
pirogronian
-
dehydrogenaza alkoholowa i dehydrogenaza jabłczanowa (NAD
+
→
NADH)
-
ureaza, dehydrogenaza glutaminianowa, dehydrogenaza glukozo-6P (mocznik
→
amoniak
→
α
-ketoglutaran)
W4
Sztuczne komórki zawierające komórki biologiczne i inny materiał biologiczny:
-
sztuczne organy
o
powierzchnia wymiany 33 ml śr 0,1 mm
→
2 m
2
o
przepuszczalność 0,002
µ
m
→
20
µ
m
-
detoksyfikatory krwi
-
sztuczna wątroba
-
sztuczna nerka
-
substytuty krwi
NOWE TRENDY BIOTECHNOLOGII DLA MEDYCYNY
-
1990 r.- Humane Genome Project USA
-
Functional Genomics, FunctIonal Proteomics
-
technologia rekombinacji DNA
-
inżynieria białka – wykorzystanie organizmów transgenicznych
-
systemy ekspresji:
o
prokariotyczny system ekspresji Escherichia coli
o
eukariotyczny system ekspresji (Sacharomyces cerevisiae, Pichia pastoris)
o
systemy ekspresji oparte na hodowlach komórek ssaków (chomik, małpa)
o
hodowle owadzie (system bakulowirusa, Drosphilla melanogaster)
o
ekspresja heterologicznych białek w gruczołach mlecznych ssaków (myszy, króliki,
owce, kozy, krowy)
o
systemy roślinne
-
szczepionki (rekombinowane szczepionki antygenowe, hybrydowe szczepionki wirusowe i
bakteryjne, antyidiotopowe, hybrydowe, białkowe, antygenowe syntetyczne peptydy)
-
terapia genowa
-
strategia antysensu i rybozymowa
-
metody diagnostyczne
W5
BIOTECHNOLOGIA DLA MEDYCYNY – POLSKA
Poznań, Łódź- techniki chemicznej syntezy genów i ich analogów
-
zespół prof. W. Markiewicza (JChB PAN Poznań)- nowe biblioteki kombinatoryjne
-
zespół A. Legockiego (JChB PAN Poznań)- ekspresja immunogennego białka
powierzchniowego HBV w transgenicznych roślinach jadalnych
-
zespół B. Szewczyk (UG-AMG Gdańsk)- system bakulowirusa do ekspresji heterologicznych
białek (antygenów białkowych wirusów grypy oraz opryszczki)
-
AM Łódź- Escherichia coli (czynniki nekrozy nowotworów)
BROWARNICTWO
Egipcjanie praktykowali warzenie piwa już 6000 lat temu. Narody wschodu potrafiły otrzymywać
napoje fermentowane z ryżu.
1643 r.- król Karol I opodatkował produkcję piwa
XIX w.- Niemcy; produkcja i eksport
XIX w.- L. Pasteur; badania mające na celu udoskonalenie francuskich technologii produkcji piwa
(1889 r. francuski kongres browarników)
1883 r.- E. Hansen; czyste szczepy drożdży
32
SŁÓD
-
otrzymywany z jęczmienia browarnego (odpowiednie odmiany)
-
produkcja słodu (wytworzenie i uaktywnienie enzymów ziarna koniecznych do rozkładu
skrobi i białek) obejmuje:
o
moczenie ziarna jęczmienia
o
kiełkowanie
o
suszenie
-
podział słodów:
o
jasne (pilzneńskie)
o
ciemne (monachijskie)
CHMIEL
-
przyprawa
-
rozdzielnopłciowa bylina (Humulus lupus)
-
kwiatostany żeńskie: gorzkie żywice (goryczka); olejki chmielowe (składniki aromatyczne)
-
stosowano suszone szyszki chmielowe (chmiel naturalny siarkowany w balotach)
-
stosuje się preparaty chmielowe: proszki, granulaty, ekstrakty
-
rodzaje chmielu:
o
-
14-21% żywice chmielowe: walory smakowe poprawiające stabilność piany, właściwości
bakteriobójcze
-
200 g/l piwa (słodu 100 razy więcej)
W5
WODA
-
zużycie wody w browarze: 3,7-10,9 hl/hl wyprodukowanego piwa
-
woda- zacieranie
-
alkaliczność resztkowa- różnice pomiędzy właściwościami alkalizującymi anionów (HCO
3
_
),
a właściwościami zakwaszającymi kationów (Ca
2+
, Mg
2+
)
-
piwa pilzneńskie- AR
<
5
°
n
-
jony wpływające ujemnie na proces produkcji: Fe
2+
, Fe
3+
, Mn
2+
, NO
3
-
, SiO
3
-
, SO
4
2-
-
systemy uzdatniania wody: (Ca
2+
)
DODATKI NIESŁODOWANE
-
źródło węglowodanów: 15-20% dodatek do słodu
-
kukurydza, śruta, płatki, skrobia, syrop kukurydziany, ryż, jęczmień, sorgo, pszenica, cukier
-
preparaty enzymatyczne, stabilizujące, filtrujące
DROŻDŻE
-
mikroorganizmy odgrywają pierwszoplanową rolę w produkcji piwa
-
Polska- wyłącznie drożdże; Niemcy, Belgia- bakteria (mlekowe):
o
drożdże- wytwarzanie alkoholu, substancji chromatycznych, obniżenie pH brzeczki
o
bakterie- obniżenie kwasowości brzeczki
-
drożdże dolnej fermentacji
-
drożdże górnej fermentacji- Sacharomyces cerevisiae
-
dzikie drożdże – Sacharomyces pastorianus, Torulopsis (stęchły smak i zapach)
ETAPY PRODUKCJI PIWA
1. Przygotowanie słodu:
a. usunięcie kiełków
b. 5-6 tyg. odleżenia
2. Mielenie słodu
a. przygotowanie słodu do procesu zacierania
b. celem mielenia jest ułatwienie rozpuszczenia składników ekstraktywnych słodu w
wodzie i pobudzenie działania enzymów; stworzenie materiału do budowy warstwy
filtracyjnej brzeczki w kadzi fermentacyjnej
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
33
c. najmniejsze rozdrobnienie łuski, największe rozdrobnienie bielma
3. Zacieranie
a. ma na celu wyprodukowanie brzeczki (surowiec i podłoże dla mikrobów)
b. I faza – przechodzą do roztworu substancje rozpuszczalne słodu powstałe na skutek
enzymatycznych przemian bielma w czasie kiełkowania
c. II faza – hydroliza skrobi w temp. 35-75
°
C (maltoza i dekstryny graniczne); hydroliza
białek w temp. 48-55
°
C; 50
°
C przerwa białkowa
d. typowy skład węglowodanów w typowej brzeczce: 44% maltoza, 31% dekstryny,
11% maltotrioza, 9% glukoza, 3% sacharoza, 2% fruktoza
4. Filtracja brzeczki
W5
5. Gotowanie brzeczki z chmielem
a. smak i aromat
b. ma na celu:
i. sterylizacja brzeczki
ii. wytrącanie osadów
iii. usuwanie niepożądanych składników
iv. ustalenie barwy
v. zakwaszenie i zagęszczenie brzeczki
vi. inaktywacja enzymów
c. dawkę chmielu ustala się na podstawie aktualnej zawartości „izo-związków” w
chmielu oraz wymaganej zawartości w piwie
d. związki goryczkowe- „kwasy”, gotowanie formy „izo” (odpowiedni czas dodawania
odpowiedniego rodzaju chmielu)
6. Usuwanie osadów gorących.
7. Chłodzenie i natlenianie brzeczki.
8. Usuwanie osadów zimnych.
9. Zadawanie drożdżami:
a. czysta kultura lub drożdże z wcześniejszych szarży
b. pielęgnacja drożdży: dekarboksylacja, przemywanie, przesiewanie, napowietrzanie,
homogenizacja, przechowywanie
c. przygotowanie do zaszczepu, napowietrzanie i mieszanie w celu ujednolicenia
10. Fermentacja:
a. konwersja cukrów brzeczki do etanolu i CO
2
b. węglowodany zużywane w odpowiedniej kolejności
c. związki azotowe- aminokwasy, peptydy niskocząsteczkowe, zasady azotowe,
purynowe i pirymidynowe
d. aminokwasy- wyższe alkohole alifatyczne i aromatyczne (Wal- diacetyl)
e. jony
f. temperatura
g. fermentacja dolna (8-10 dni)
h. fermentacja górna (2-3 dni)
i. fermentacja główna (burzliwa):
i. zaszczepienie
ii. faza krążków niskich
iii. faza krążków wysokich
iv. faza opadania krążków
11. Dojrzewanie piwa (leżakowanie):
a. dojrzewanie piwa (fermentacja wtórna)
b. zachodzi: nasycenie piwa CO
2
, sklarowanie piwa, uzyskanie odpowiedniego stopnia
odfermentowania, wytworzenie właściwego bukietu smakowo-zapachowego
c. parametry kontrolowane- temperatura, zawartość ekstraktu, zawartość CO
2
, zmiana
pH, zawartość diacetylu, ilość osadów drożdżowych
12. Filtracja, karbonizacja, rozlew piwa.
Piwa angielskie:
ALE- owocowy smak
Lager- dolna fermentacja, złocista barwa
34
W5
Porter- mocne, ciemne piwo
Piwa niemieckie:
Altbier- miedziana barwa, ze słodu jęczmiennego
Bock- fermentacja dolna, mocne, sezonowe
Eisbock- moc wzrasta dzięki procesowi mrożenia
Weissbier- piwo pszennicze
Piwa belgijskie:
Guezue
Saison
Piwa holenderskie:
Kruidenbier- piwo z przyprawami
Piwa hiszpańskie:
Oscura- ciemne piwo
Produkcja piwa- etapy (E)
PRODUKCJA DROŻDŻY PIEKARSKICH
-
czołowe miejsce wśród przemysłów fermentacyjnych
-
piekarnictwo, dodatek żywieniowy (witaminy B, aminokwasy)
-
drożdże prasowane, suszone, suszone instant
-
drożdże fermentacji górnej Sacharomyces cerevisiae
-
cechy drożdży piekarskich:
o
wysoka, właściwa szybkość wzrostu
o
wysoka aktywność w procesie glikolizy
o
zdolność adaptacji do szybko zmieniających się substratów w pożywce hodowlanej
o
wysoka aktywność inwertazy
α
-glukozydazy,
β
-fruktofuranozydazy
o
zdolność do wzrostu i syntezy enzymów i koenzymów zarówno w procesie tlenowym
jak i beztlenowym
o
produkt- dobra trwałość w czasie przechowywania
-
przemysłowa produkcja drożdży piekarskich- prowadzenie kilkuetapowej hodowli tlenowej ze
zwiększeniem objętości pożywki hodowlanej
-
brzeczka hodowlana- melasa, związki będące źródłem azotu i fosforu, witaminy (biotyna,
kwas pantotenowy, inozytol, tiapirodoksyna, niacyna)
-
III etapy produkcji:
o
stadium czystych kultur
o
generacja I
o
generacja handlowa
PRODUKCJA SCP (Single Cell Protein)
-
wykorzystywanie do produkcji białka
-
biomasa mikroorganizmów źródłem białka
W5
-
wykorzystywana przede wszystkim jako pasza dla zwierząt
-
SCP
-
korzyści z zastosowania:
o
bardzo szybki wzrost mikroorganizmów
o
możliwość modyfikacji genetycznej
o
odpady jako składnik pokarmowy
1. wytwarzanie SCP z węglowodanów:
-
węglowodory aromatyczne Pseudomonas sp., Anthrobacter sp., Nocardia sp.,
Candida sp., Torulopsis sp., Aspergillus sp., Penicillium sp.
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
35
-
n-oktadekan, n-heksadekan
-
produkcyjna hodowla odbywa się w warunkach silnego napowietrzenia pożywki w
zemulgowanych środowiskach
-
metan jako substrat dla mikroorganizmów
2. SCP z alkoholi
a. etanol i metanol
b. SCP z metanolu- firma U.V.Hoechst (Niemcy), Mitshubishi (Japonia), Methylophilus
methylotrophus, ICI (Anglia), Pseudomonas sp.
c. SCP z etanolu- Skonaft (Czechy), Amoco Foods (USA)- drożdże
3. SCP ze ścieków i odpadów przemysłowych:
-
wywary gorzelnicze, melasa, serwatka, poślady zbóż, korzenie, słoma, łuski, osady czynne
biologicznych oczyszczalni ścieków
-
Szwecja- produkcja SCP z odpadów przemysłu krochmalniczego, mieszanka dwóch szczepów
Endgmycopsis fibuligria, Candida utilis
-
Finlandia- produkcja z SCP z ługów posiarczanowych zbiałczonych przez Peacilomyces sp.
-
Anglia- Rank Haris McDougall wykorzystanie przemysłu rolno-spożywczego
-
odpady lignino- celulozowe Clostridium thermocellum
-
Szwecja- rozkład lignin Sporotriculum pulvenilentum
W6
MLEKO = płynna wydzielina gruczołów mlecznych ssaków
Skład chemiczny zależy od:
•
rasy krów
•
okresu laktacji
•
sposobu odżywiania
•
pory roku, itp.
SKŁADNIKI
średnia zawartość %
woda
87,7
tłuszcz
3,4
kazeina
2,5
inne białka
0,7
laktoza
4,8
kwas cytrynowy, witaminy A, B
1
, B
2
, B
6
, B
12
,biotyna, inozytol, cholina,
kwasy: pantotenowy, foliowy, nikotynowy
0,2
popiół
0,7
Bakterie fermentacji mlekowej przetwarzają laktozę i kazeinę.
LAKTOZA- cukier, może być w warunkach beztlenowych fermentowana z wydzieleniem głównie
kwasu mlekowego, który w odpowiednim stężeniu ścina białka mleka powodując powstanie skrzepu.
Niektóre szczepy bakterii są zdolne do hydrolizy białka mleka.
PRODUKTY FERMENTACJI MLEKOWEJ:
-
diacetyl
-
aldehyd octowy
-
alkohol etylowy
-
kwas propionowy
-
kwas mrówkowy
-
lotne kwasy tłuszczowe
-
alkohole
-
aceton
-
estry
FERMENTACJA INDUKOWANA – STARTERY
Funkcja bakterii fermentacji mlekowej:
36
-
nadanie produktom specyficznych cech organoleptycznych (smak, aromat, konsystencja)
-
zwiększenie ich wartości odżywczych
-
zwiększenie przyswajalności składników mineralnych
-
stabilizacja biologiczna produktów (antagonistyczne właściwości bakterii mlekowych)
W6
Główne metabolity antagonistyczne:
-
kwasy organiczne- mlekowy, octowy, 2-pirolodono-5-karboksylowy
-
bakteriocyny- aktywne, głównie w stosunku do bakterii Gram (+)
-
enzymy- układ peroksydazy, lizozym
-
niskocząsteczkowe produkty przemiany materii: renteryna, diacetyl, aldehyd octowy, kwasy
tłuszczowe
-
inne: H
2
O
2
PRODUKCJA SERÓW
SERY produkty nabiałowe bogate w białko i tłuszcz, otrzymane na drodze koagulacji kazeiny,
odpowiedniej obróbki skrzepu oraz przemian biochemicznych zwanych dojrzewaniem
PODZIAŁ SERÓW PODPUSZCZKOWYCH:
-
twarde i półtwarde
o
typ szwajcarski (Ementaler, Grujer)
o
typ włoski (Orana, Parmezan)
o
typ holenderski (Edamski, Gouda)
o
typ szwajcarsko-holenderski
o
typ angielski (Chedar)
o
typ z masy parzonej (Oscypek)
-
miękkie
o
z porostem pleśniowym (Camembert, Brie)
o
z przerostem pleśniowym (Roquefort)
o
maziowe (Limburski)
o
pomazankowe (Bryndza)
PRZYGOTOWANIE MLEKA DO WYROBU SERÓW:
-
standaryzacja- białka/tłuszcze (P/F stały)
-
filtracja- 30
°
C, filtr bawełniany
-
klarownie- 32-38
°
C
-
usuwanie bakterii- 99% bakterii, 95% spor
-
subpasteryzacja- 63-65
°
C, schłodzenie
-
ultrafiltracja- sery miękkie
-
homogenizacja- rozbicie drobin tłuszczu
-
pasteryzacja- całkowite zabicie drobnoustrojów i inaktywacja enzymów 63
°
C, 30 min. lub
72
°
C, 16 s.
DODATKI DO MLEKA:
-
CaCl
2
-
azotany
-
barwniki
-
H
2
O
2
-
lipazy
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
37
W6
PRODUKCJA SERÓW PODPUSZCZKOWYCH:
-
przygotowanie mleka do przerobu
-
przygotowanie i dodatek zakwasu lub preparatu bakterii fermentacji mlekowej
-
przygotowanie i zaprawienie mleka podpuszczką lub innym preparatem koagulacyjnym
-
obróbka skrzepu i gęstwy
-
formowanie serów
-
ociekanie i prasownie
-
solenie
-
dojrzewanie i pielęgnacja serów
SERY TWARDE
Mleko (30-32
°
C) + CaCl
2
+ saletra potasowa + zakwas
Zadaniem zakwasu dodawanego do mleka w ilości 0,3-2% jest prawidłowe ukierunkowanie procesów
fermentacji podczas obróbki gęstwy serowej na wannie i w czasie dojrzewania oraz zahamowanie
rozwoju drobnoustrojów niepożądanych.
Jednocześnie bakterie zakwasu posiadają enzymy proteolityczne biorące udział w degradacji białka i
tłuszczu w czasie dojrzewania.
ZAKWAS TERMOFILNY- bakterie termofilne Lactobacillus salivaris, Lactobacillus velveticus,
Lactobacillus bulgaricus, bakterie propionowe.
ZAKWAS MEZOFILNY- Streptococcus lactis, Streptococcus diacetilacti,
Streptococcus cremoris, Lactobacillus casei.
FERMENTACJA LAKTOZY
Po uzyskaniu skrzepu o odpowiedniej zwięzłości następuje jego krojenie i rozdrobnienie do postaci
ziarna w celu usunięcia serwatki.
Ziarno w serwatce (gęstwa) miesza się i podgrzewa do 38
°
C (Gouda) lub 54-58
°
C (Ementaler).
Formowanie, solenie.
Dojrzewanie- 15
°
C, wilgotność względna powietrza 80-85%, proces w całej masie. Produkty
powstające w czasie dojrzewania i decydujące o cechach organoleptycznych sera:
-
produkty przemiany laktozy- kwas mlekowy, propionowy, octowy i inne, lotne kwasy,
aldehyd octowy, diacetal
-
produkty degradacji białek- peptydy, polipeptydy, aminokwasy oraz związki powstające w
wyniku deaminacji, dekarboksylacji aminokwasów
-
produkty przemiany tłuszczów- aldehydy i estry
-
produkty biosyntezy powstające w wyniku procesów życiowych mikroorganizmów
W6
SERY MIĘKKIE:
Pasteryzowane mleko o znormalizowanej zawartości tłuszczu zaszczepia się dużą dawką zakwasu
mezofilnego (paciorkowce). Czas krzepnięcia jest dłuższy- 1-2 h , nagromadzenie bakterii w szczepie.
Uzyskany skrzep kroi się na duże ziarna, gęstwę osusza się i bez dogrzewania dolewa się do form. Po
soleniu sery umieszcza się w dojrzewalni.
Otrzymana masa serowa posiada więcej laktozy, która ulega przemianie a tym samym jest bardziej
kwaśna.
Pielęgnacja- pierwsze rozwijają się drożdże, grzyby i bakterie Brevibacterium lineus.
38
Camembert, Brie:
-
Penicillium camembert
-
Penicillium candidum
-
Penicillium caseicolum
-
Brevibacterium lineus
Roquert:
-
Penicillium roquefort
BIOTECHNOLOGICZNE PRZETWARZANIE SERWATKI
-
produkcja napojów fermentowanych (Streptococcus sp., Lactobacillus sp.)
-
browarnictwo- zamiast wody do przygotowywania zacieru
-
koncentraty biologicznie ukwaszonej serwatki- utrwalenie odpowiednich drożdży piekarskich
-
SCP
-
kwas mlekowy, kwas propionowy
-
podłoże z serwatką do hodowli pieczarek
1. Zsiadłe mleko:
-
wysoka pasteryzacja mleka
-
dodatek zakwasu
-
bakterie kwaszące i aromatyzujące: Streptococcus lactis, Streptococcus cremoris
-
inkubacja 30-35
°
C, 7-12 h
2. Mleko acidofilne:
-
Lactobacillus acidofilus
-
mleko wysoce pasteryzowane lub sterylizowane
-
zakwas monokulturowy
-
inkubacja 38-40
°
C, 7-12 h
3. Jogurt:
-
mleko pełne lub odtłuszczone,
-
zgęszczone,
-
zakwas 1:1 lub 1:2 (Lactobacillus bulgaricus, Lactobacillus thermophilus);
-
metoda zbiornikowa lub termostatowa;
-
wzbogacenia: Lactobacillus acidophilus, Bifidobacterium bifidum
W6
4. Biogurt:
-
zakwas 1:3 (Lactobacillus acidophilus, Streptococcus lactis)
5. Kefir:
-
napój musujący
-
grzybki kefirowe (Streptococcus lactis, Streptococcus cremoris, Streptococcus diacetilactis,
Lactobacillus desidious, Brevibacterium brevis, Lactobacillus casei, Lactobacillus
cellobiosis), drożdże (Candida kefyr, Candida pseudotropicalis, Kluyveromyces lactis,
Saccharomyces florentimus, Saccharomyces globasus, Saccharomyces delbrueckii,
Saccharomyces unisporus)
6. Maślanka:
-
ukwaszenie maślanki (proces ubocznego procesu produkcji masła)
-
zakwas Streptococcus Streptococcus cremois lub lactis, S. Diacetalis lub leuconostoc
-
22
o
C, 18 godzin
7. Kwaśna śmietana- zakwas śmietankowy
-
22
o
C, 18 godzin
-
S. cremosis lub lactis, S.leuconostoc
8. Kumys
-
Lactobacillus bulgaricus, Candida kefyr (bakteria + grzyb)
-
28
o
C, 2 godziny
9. Szampan serwatkowy
-
niskoprocentowy napój alkoholowy
10. Masło:
-
najszlachetniejszy tłuszcz jadalny
-
15-16% woda, 83-84% tłuszcze, śmietanka
-
dojrzałość fizyczna
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
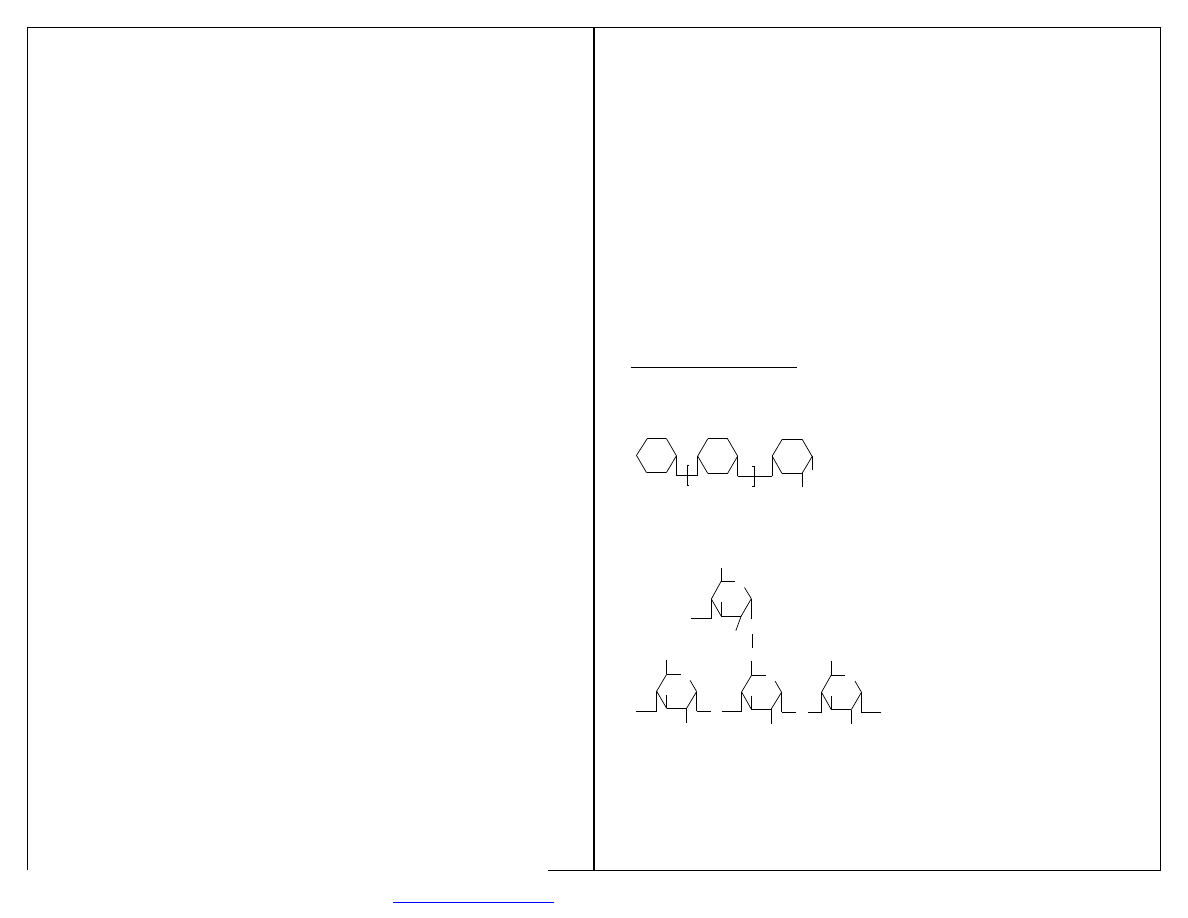
39
-
dojrzałość biologiczna – pH 5,5-5,9
-
zakwas Streptococcus lactis, Streptococcus cremoris, Streptococcus diacetilactis, Leuconostoc
cremoris, Lactobacillus lactis
Lactobacillus
→
warunki beztlenowe i powstaje CH
3
COOH zamiast mleczanu
Leuconostoc dextranium
→
kwas cytrynowy
→
kwas pirogronowy
→
acetoina (zapach maślany)
→
diacetyl + CO
2
L. bulgaricus, S. thermophilus
→
acetaldehyd (główny składnik smakowy jogurtu)
ZAKWASY STOSOWANE W MLECZNICTWIE:
Zakwas- hodowla czystych kultur bakterii fermentacji mlekowej stosowana do wyrobu sera, twarogu,
masła i napojów mlecznych.
Zadaniem zakwasu jest prawidłowe ukierunkowanie procesów fermentacyjnych podczas obróbki
produktu.
Cechy zakwasu:
-
odpowiedni skład mikrobiologiczny
-
wysoka aktywność
-
czystość mikrobiologiczna
W6
Rodzaje zakwasów:
-
zakwasy pojedynczych szczepów
-
zakwasy wieloszczepowe
-
zakwasy mieszane kombinowane
Kryteria doboru i selekcji nowych szczepów, które wprowadza się do serowarstwa:
mieszanina szczepów
↓
przesiewanie
↓
aktywność syntazy kwasu mlekowego
↓
odporność na bakteriofagi
↓
identyfikacja plazmidów DNA
↓
badanie zgodności steroidów
↓
test na wytwarzanie substancji smakowo-zapachowych
↓
próbny wyrób sera
↓
ocena i klasyfikacja szczepu
RODZAJE SZCZEPIONEK STOSOWANYCH W PRZEMYŚLE SPOŻYWCZYM
-
ciekłe
-
suszone
-
zamrożone
OCENA SANITARNA WARUNKÓW PRODUKCJI
40
HACCP (Hazard Analysis Critical Central Point) system krytycznych punktów kontroli ustalanych na
podstawie przeprowadzonej analizy zagrożeń. Prawidłowy stan mikrobiologiczny produktu zostaje
osiągnięty poprzez zapobieganie zagrożeniom w całym łańcuchu zagrożeń.
Krytyczny punkt kontrolny- surowiec, miejsce, postępowanie, procedura, operacja jednostkowa, punkt
w którym należy działanie kontrolne lub zapobiegawcze w celu wyeliminowania lub
zminimalizowania zagrożeń wpływających na jakość końcowego produktu.
Produkowanie zgodnie z praktyką higieniczną- całkowite wykluczenie możliwości wzajemnego
krzyżowania się lub cofania dróg surowca, półproduktu i gotowego wyrobu we wszystkich etapach
produkcji.
W6
Właściwe opracowanie dróg i szlaków transportu wewnętrznego w celu wyeliminowania ich ruchu
przez obszary, które mogą być źródłem zanieczyszczeń wtórnych (zasada „first in- first out”).
Higiena personelu.
Metody badań:
-
metody klasyczne- tamponowa, wypłukiwania, bezpośrednia, odciskowa (dają efekt po
upływie czasu)
-
metody nowoczesne- modyfikacja metody płytkowej, bioluminescencji (najszybsza metoda)
W7
PROCES KONWERSJI SKROBII
Skrobia- roślinna substancja zapasowa występująca w dwóch formach: amylazy i amylopektyny.
Amylaza- nie ma rozgałęzień, cząsteczki glukozy połączone wiązaniami
α
-1,4-glikozydowym.
n
OH
OH
Amylopektyna- rozgałęzienia, na jedno wiązanie
α
-1,6-glikozydowe przypada 30 wiązań
α
-1,4-
glikozydowych.
O
O
OH
CH
2
OH
OH
O
O
O
OH
OH
CHOH
CH
2
OH
OH
OH
O
O
OH
O
H
CH
2
OH
Konwersji podlega tylko skrobia kukurydziana.
HFCS (High Fructose Corn Syrup)- mieszanina dekstrozy i fruktozy, 42%, 55%, 90% środek
słodzący.
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
41
PROCES PRODUKCJI:
1. Przygotowanie dekstrozy ze skrobii (
α-amylaza).
2. Przygotowanie do sacharyfikacji- zmiana pH i temperatury.
3. Sacharyfikacja (glukoamylaza).
4. I rafinacja- oczyszczanie hydrolizatu na węglu aktywnym:
a. jony Mg
2+
aktywują izomerazę glukozy
b. inhibitory kompetencyjne do jonów Ca
2+
(ochrona)
5. Izomeryzacja- immobilizowana izomeraza glukozy.
6. II rafinacja- odparowanie:
a. węgiel aktywny
b. chromatografia jonowymienna
7. gotowy produkt- 42% HFCS (komercyjnie otrzymuje się)
W7
Wytłumaczyć proces konwersji skrobi, na czym polega? (E)
PREPARATY ENZYMATYCZNE STOSOWANE W PRZEMYŚLE.
Dzięki zastosowaniu preparatów enzymatycznych uzyskuje się:
-
oszczędność surowca, np. zastąpienie słodu jęczmiennego słodem pleśniowym
-
zwiększenie wydajności procesu technologicznego, np. zastosowanie pektynaz do klarowania
soków
-
skrócenie cyklu produkcyjnego, np. zastosowanie enzymów proteolitycznych w przemyśle
mięsnym
-
poprawienie jakości wyrobu, np. lepsza jakość soków odwłasianych enzymatycznie
-
zwiększenie trwałości produktu, np. stabilizacja piwa za pomocą oksydazy glukozowej
-
możliwość sterowania reakcją enzymatyczną
1896 r.- TAKADIASTAZA (enzymy hydrolityczne); surowy preparat enzymatyczny otrzymywany z
hodowli Aspergillus oryzae prowadzonych na otrębach pszennych.
OGÓLNY DIAGRAM PRODUKCJI PRZEMYSŁOWEJ ENZYMÓW
mikroorganizmy tkanki roślinne i zwierzęce
↓
↓
produkcja biomasy
mielenie i homogenizacja
↓
↓
fermentacja fermentacja
wgłębna powierzchniowa
wodna
ekstrakcja i filtracja
roztwór
enzymu
suszenie
↓
↓
zagęszczanie rozdrabnianie
dodatek stabilizatora lub precypitacja surowy preparat
konserwantów
enzymatyczny
↓
↓
roztwór enzymu filtracja
↓
suszenie
↓
rozdrabnianie
↓
42
proszek enzymatyczny
W7
Większość enzymów używanych w przemyśle to enzymy egzogenne.
ENZYMY PROTEOLITYCZNE
Stanowią 60% komercyjnie używanych enzymów.
HYDROLAZY PPEPTYDOWE
-
pochodzenie roślinne, zwierzęce i mikrobiologiczne
-
enzymy indukcyjne
-
enzymy egzogenne, endogenne
PROTEINAZY SERYNOWE
Trypsynopodobne, alkaliczne,
α
-lityczne, proteinazy, Myxobacterium sp.
Proteinazy trypsynopodobne- trypsyna (pankreatyna- przemysł spozywczy, garbarstwo i przemysł
farmaceutyczny), chemotrypsyna, enzymy Streptomyces sp.
Proteinazy alkaliczne- bakteria, drożdże i pleśnie, tkanki ssacze, znaczenie komercyjne: subtylizyna
(alkaliczne enzymy detergentów), enzym Aspergillus oryzae (preparaty termostabilnych proteinaz
alkalicznych), enzym Streptomyces vimosus (przemysłowa produkcja oksytetracykliny).
Proteinazy tiolowe-
Proteinazy kwaśne (karboksylowe):
-
reninopodobne- podpuszczka cielęca i bakteryjna
-
peptydopodobne- wieprzpowa i wołowa pepsyna proteinazy z Aspergillus
Podpuszczka i proteinazy podobne- „gorzkie peptydy”, enzymy zwierzęce, rybne (ryby morskie),
niskie optimum temperatury, mikrobiologiczne (Aspergillus sp., Rhizopus sp.)
Metaloproteinazy- naturalne, alkaliczne:
-
naturalne:
o
bakteryjne: Bacillus subtilis (browarnictwo); Bacillus stearothermophilus- termolizyna
(aspartam)
o
grzybowe: Aspergillus oryzae (piekarnictwo, przemysł spożywczy, modyfikacje białek,
przemysł farmaceutyczny)
-
alkaliczne: Pseudomonas aeruginosa, Serratia sp. (dtergenty)
PRZEMYSŁOWE ZASTOSOWANIE PROTEAZ POCHODZENIA
MIKROBIOLOGICZNEGO:
-
hydroliza białek- zmiana właściwości białka i produktu, którego ma być składnikiem kontrola
gorzkiego smaku hydrolizatów białkowych [„gorzkie peptydy”- maskowanie (polifosforany,
żelatyna), usuwanie (filtracja, wytrącanie kwasem), zapobieganie (enzymem)]
W7
-
hydrolizaty sojowe- doskonałe właściwości białek soi, sosy i przetwory sojowe, suplementowanie
białkami napojów, dietetycznej żywności
-
hydroliza żelatyny- zniesienie efektu żelu, niski poziom Trp, środki dietetyczne, przemysł
kosmetyczny; typowy proces 30% roztwór żelatyny + mieszanina alkalicznych i neutralnych
proteaz,
>
4 h, pasteryzacja 90
°
C
-
hydroliza kazeiny i białek serwatki
-
hydroliza białek mięsa
-
białka rybie
-
kruszenie mięsa- enzymy roślinne (papaina, ficyna)
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
43
-
detergenty- enzymy o dużej stabilności, aktywności w roztworze detergentu;
-
mleczarstwo- serowarstwo (podpuszczka zwierzęca 65%, renina + pepsyna 50:50)
-
browarnictwo- mielenie słodu (zwiększenie wydajności, poziom aminokwasów, klarowanie-
papaina)
-
piekarnictwo- poprawa jakości mąki
-
garbarstwo- proteazy alkaliczne, etap moczenia skóry, oczyszczanie, odwłasianie
-
produkcja podłoży mikrobiologicznych
-
przemysł farmaceutyczny- mieszanki poprawiające trawienie, urokinaza, zaburzenia krzepnięcia
krwi, kolagenaza, likwidacja zmian skórnych
INNE ENZYMY HYDROLITYCZNE
PEKTYNAZY- Aspergillus niger, Rhisopus (pektyny-kwasne polimery cukorwe)
-
esteraza pektynowa- pomidor, Fusarium oxysporum, Clostridium multifermentans
-
egzopoligalaktouranaza- brzeczka pofermentacyjna (produkcja kwasu cytrynowego przez
Aspergillus niger)
LIAZY
CELULAZY- Aspergillus niger, Penicillium sp.:
-
enzymy odporne, stabilne w niskim pH
-
substrat to celebioza
-
zastosowanie:
o
przemysłowy alkohol etylowy z celulozy
o
obróbka nasion (browarnictwo, przetwórstwo)
o
wydzielenie wielocukrów glonów morskich
β-GLUKANAZY:
-
hydroliza glukanu jęczmienia
-
hydroliza poliglukanu wytworzonego przez grzyb etylujący winogrona
HEMICELULAZY I KSYLANAZY- pleśnie, hydroliza arabanu, galaktanu, mannanu, ksylanu
(tkanki roślinne) wraz z pektynazami i celulazami.
LAKTAZA- konwersja laktozy do glukozy i galaktozy, di- i trisacharydy sa produktami ubocznymi,
enzymy roślinne (jabłka, brzoskwinie, morele), zwierzęta, mikroorganizmy, enzymy bakteryjne i
drożdżowe (wewnątrzkomórkowe), grzybowe (zewnątrzkomórkowe);
W7
znaczenie komercyjne Kuyveromyces lactis, Kuyveromyces fragilis, Aspergillus oryzae, Bacillus sp.
ŻRÓDŁO PRODUKT
UWAGI
pasza dla zwierząt
zwiększenie wydajności, , wartości odżywczej,
zapobieganie krystalizacji laktozy w koncentratach
serwatkowych
serwatka
bezlaktozowy syrop serwatkowy
piekarnictwo, lody
mleko
mleko bezlaktozowe
składnik diety ludzi z niską tolerancja laktozy,
słodki smak, zapobieganie krystalizacji laktozy w
koncentratach laktozowych
44
MLEKO
UHT
MLEKO UHT
pasteryzacja
laktoza drozdzowa
hydroliza fermentowa
pakowanie sterylne
hydrolizat
hydroliza
bezlaktozowe mleko UHT
UHT
pasteryzowane mleko bezlaktozowe
odparowanie
mleczny koncentrat bezlaktozowy
W7
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
45
SERWATKA
pasteryzacja
zmiana pH
laktoza grzybowa
hydroliza
bla
bla
hydroliza
pasteryzacja
odparowanie
bezlaktozowy syrop serwatkowy
UHT- Ultra High Temperature
LIPAZY- Candida sp., Aspergillus sp., Rhizopus sp., Mucor sp., lipazy trzustkowe, przemysł
farmaceutyczny, produkcja zapachów, przyspieszenie dojrzewania serów twardych, hydroliza olejów
w produkcji mydła.
PROCES PRZEMYSŁOWY:
-
kadzie przedmateczne z podłożem A (białko sojowe);
-
kadzie mateczne z podłożem B (namok kukurydziany, skrobia kukurydziana, ekstrakt drożdżowy,
silikan);
-
fermentator produkcyjny (podłoże B + dekstroza), 4-28 h, zasilany odpowiednio przygotowanym
sterylizowanym namokiem kukurydzianym;
-
immobilizacja;
-
oddzielenie biomasy od płynu pohodowlanego;
-
suszenie;
W7
IMMOBILIZACJA IG
MIKROORGANIZM
METODA IMMOBILIZACJI
Actinoplanes missouriensis
całe komórki, żelatyna, glutaraldehyd, enzym,
alumina
Streptomyces rubiginosus
enzym, żelatyna
46
Flavobacterium arborescens = całe komórki, glutaraldehyd
Bacillus coagulans = lizat komórkowy, glutaraldehyd
Sweetzyme® = Bacillus coagulans
Maxazyme® = Actinoplanes missouriensis
Ketozym® = Actinoplanes missouriensis
Tako–Sweet® = Streptomyces olivaceus
Optisweet22® = Streptomyces rubinosus
ENZYMY PRZEMYSŁOWE – PODSUMOWANIE
ENZYMY GLIKOLITYCZNE
α
- amylazy
Bacillus subtilis
Aspergillus niger
tekstylia, syropy glukozowe,
detergenty, fermentacja
etanolowa, karma dla zwierząt
browarnictwo, piekarnictwo
β
-amylazy
Bacillus browarnictwo, syropy
maltozowe
celulazy
płyny do mycia naczyń, pasze
dla zwierząt, bioenergia,
tekstylia
β
-glukanazy
piwowarstwo
dekstranazy
przemysł spożywczy
2-galaktozydaza
przemysł spożywczy
glukoamylaza
cukrownictwo
hemicelulazy
Aspergillus niger
Rhizopus
syropy glukozowe i dekstranowe
pentozanazy
ksylonazy
inwertaza
laktaza
Klebsiella lactis
Aspergillusoryzae
Bacillus subtilis
mleczarstwo
naringinaza
usuwanie goryczy ze skórek
cytrusowych
pektynaza
produkcja soków
pullulanaza
Klebsiella aerogenes
Bacillus subtilis
drożdże piekarskie,
p/podziałowy
W7
PROTEAZY
proteinazy kwaśne
Aspergillus niger
Aspergillus oryzae
piekarnictwo
proteazy alkaliczne
Bacillus subtilis
detergenty, garbarstwo
pepsyna
żołądki wieprzowe, wołowe
produkcja serów
subtytlizyna
Bacillus subtilis
OKSYDOREDUKTAZY
•
dehydrogenaza alkoholowa
•
katalaza
LIAZY
•
histydaza
TRANSFERAZA
•
glikozylotransferaza
•
cyklodekstrynaza
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
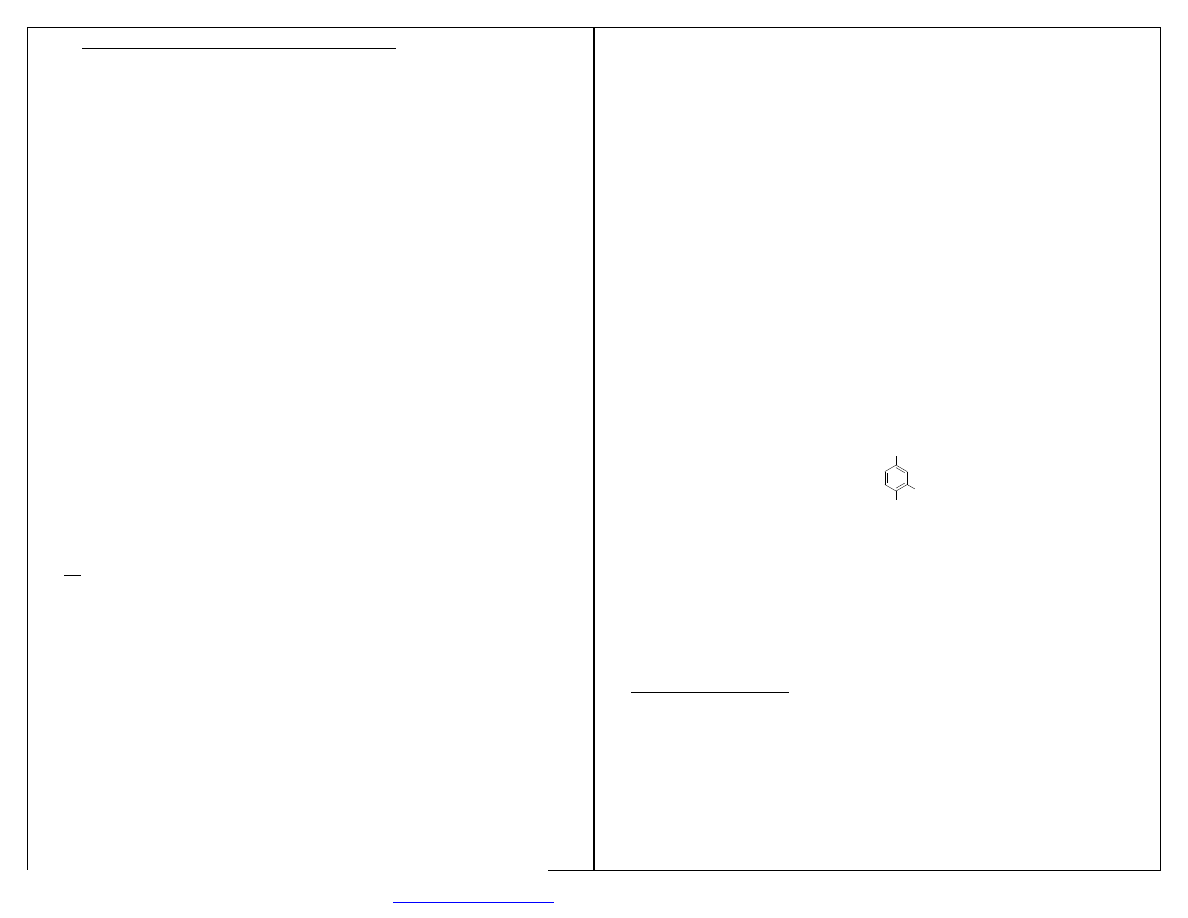
47
MIKROBIOLOGICZNE ŚRODKI SMAKOWE I ZAPACHOWE
Związki aromatyczne i smakowe - kompleksowe mieszaniny
Komercyjny sukces:
•
wysoka wydajność
•
tanie substraty
•
ograniczenie syntezy chemicznej
1. METYLOKETONY
•
aromat sera
•
Penicillium roqueforti – formy spoczynkowe, nie wegetatywne, konwersja kwasów
tłuszczowych (C14)
→
metyloketon (C1)
•
produkcja przemysłowa – koszt
•
toksyczność związków
•
lotność – techniki fermentacyjne + konwersja enzymatyczna
•
fermentacja grzybowa
→
kwasy tłuszczowe
→
β
-oksydacja
→
odzysk poprzez
ekstrakcję lub destylację
2. DIACETYL
•
roztwór wodny
•
charakterystyczny, ostry masłowy zapach
•
przemysł spożywczy i perfumeryjny
•
występuje w mieszaninie z acetoiną
•
Streptococcus lactis, Leuconostoc
W7
3. LAKTONY
•
cykliczne estry specyficzne hydroksykwasów
•
zapachy: śmietankowy, owocowy, brzoskwiniowy, orzechowy, kokosowy, miodowy
4. KWAS MASŁOWY:
•
uzupełnianie zapachu maślanego w serowarstwie
•
estry- pentylowy (zapach bananowy), izobutylowy (zapach gruszkowy)
•
proces fermentacji zależy od pH i podłoża
W8
3. LAKTONY
4. KWAS MASŁOWY:
- niskie stężenie uzupełnia zapach maślany w serowarstwie,
- naturalne 2% masła,
- obligatoryjne anaeroby Clostridium, Eubacterium, Fusarium, wrażliwe na pH, w fermentorze pH
≈
5
(CaCO
3
),
- toksyczny dla produktu:
a) maślan pentylowy = zapach owoców brzoskwini, ananasa, moreli;
b) maślan izobutylowy = gruszka, ananas, brzoskwinia
5. KWAS IZOWALERIANOWY: najsilniejszy zapach, zapach brudnych stóp
•
izowalerian etylu = zapach jabłkowy (cukierki, gumy do żucia)
•
izowalerian izopentylowy = zapach jabłek, malinowy (przemysł spożywczy)
•
izowalerian izobutylu = zapach jabłkowo-malinowy (przemysł perfumeryjny)
6. TERPENY i produkty ich transformacji:
48
-
olejki eteryczne,
-
różnorodność zapachów: owocowe, różane, geranium pachnący, trawiasty,
migdałowy, grzybowy, kamforowy
7. JONONY:
-
produkty enzymatycznej hydrolizy karotenoidów
-
zapach tabaki
8. GEOSMIN: algi, baterie, grzyby, perfumy, olejki eteryczne.
Mikroorganizmy mogą syntezować kompleksowe mieszaniny związków, które uzupełniają się:
•
zapachy nabiałowe – zapachy serowe (chipsy, sosy, wypieki), jogurtowe, śmietankowe
•
zapachy chlebowe: zapach białego chleba – składniki, produkty fermentacji drożdżowej i
bakteryjnej, degradacji, produkty reakcji termicznej, 2 kierunki :
o
zapachy prefermentacyjne (mieszanina drożdży, wody, cukru, soli, odtłuszczonego
mleka, pożywki drożdżowej; 6h fermentacji bezpośrednio do ciasta lub podczas
wyrabiania)
o
preparaty enzymatyczne: amylazy, proteazy mikrobiologiczne
•
zapachy grzybowe: 1-octan-3-ol, kwas glutaminowy, 5’-guanylan; poszukiwanie zapachów
grzybowych nie koncentruje się na poszukiwaniu producentów; hodowla wgłębna, suszenie
•
zapachy i smaki z tkanek roślinnych: wanilia i mięta pieprzowa, koszt i dostępność;
metoda pozyskiwania: bezpośrednia ekstrakcja z materiału, podłoża, biotransformacja, synteza
enzymatyczna,
wszystkie techniki z fermentacji mikrobiologicznej używa się w produkcji związków
smakowych i zapachowych z roślin: selekcja komórek nadprodukujących prekursory,
manipulacje położenia, hormony.
W8
AROMATY IDENTYCZNE Z NATURALNYMI
COH
OH
OMe
WANILINA = 4-hydroksy-3-metoksybenzaldehyd (aromat identyczny z naturalnym)
•
odpowiedzialna za zapach wanilii;
•
w materiale roślinnym znajduje się 2% suchej masy wanilii; izolowana w postaci
proszku o słodkim smaku i intensywnym zapachu;
•
zastosowanie: przemysł spożywczy, cukiernictwo, produkcja napojów, perfumy,
kosmetyki;
•
produkcja: 6000ton/rok;
•
synteza chemiczna: gwajakol i ligniny, tanio 12$/kg związku (ludziom nie podoba się
ten związek – jest syntetykiem, więc rozpoczęto poszukiwania metod do produkcji
tych związków, tzn. identycznych z naturalnymi: biotransformacje, synteza de novo
przez specjalne szczepy).
Aromaty identyczne z naturalnymi: związki produkowane przy udziale mikroorganizmów.
1. PRODUKCJA WANILINY PRZEZ BIOTRANSFORMACJĘ:
- biotransformacja lignin: utlenianie „white rot fungi”; peroksydaza ligninowa z grzybów z rodzaju
hub
- biotransformacja kwasu ferulowego:
WANILINA
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
49
OH
OMe
COOH
pochodna kwasu cynamonowego, enzymatyczne uwalnianie z lignin: esteraza ferulowa i hydrolaza
estrów cynamonowych
•
dekarboksylacja: grzyby i drożdże
•
redukcja: Burkolderia cepacia, Lactobacillus plantarum, Saccharomyces cervisiae
•
deacetylacja niezależna od CoA: Pseudomonas, Bacillus subtilis, Escherichia coli
•
deacetylacja zależna od CoA: P. putida, Rhodotorula rubra
- biotransformacja kwasu wanilinowego: Pseudomonas fluorescens, 95% wydajności;
OH
OMe
COOH
- biotransformacja eugenolu i izoeugenolu: składniki olejków eterycznych z drzewa
goździkowego: Corynobacterium, Pseudomonas;
W8
- biotransformacje Phe;
2. Produkcja waniliny de novo (toksyczna dla organizmów, które ją produkują i nie jest
możliwa jej konwersja) mutant Escherichia coli; nadprodukcja aminokwasów
aromatycznych (Trp); konwersja glukozy w kwas wanilinowy, odzyskiwany i redukowany
enzymatycznie do waniliny (dehydrogenaza alkoholu arylowego z
Nocardia crassa)
BIOTECHNOLOGICZNA PRODUKCJA AMINOKWASÓW
PRODUKCJA AMINOKWASÓW JEST MOŻLIWA:
•
na drodze syntezy chemicznej (D,L – Met)
•
na drodze syntezy enzymatycznej (L-Asp, L-Trp)
•
w procesie jedno- lub wielostopniowej biosyntezy
•
zastosowanie aminokwasów: przemysł spożywczy, paszowy, medycyna, przemysł
farmaceutyczny, chemiczny
aminokwasy
produkcja [t/rok]
mat. produkcji
zastosowanie
glutaminian sodu (sól
jednosodowa)
370 000
biosynteza
poprawia smak
potraw
L-Lys
70 000
biosynteza
wzbogacenie pasz
białkowych
(podawana krowom
w dawkach
10mg/dziennie
zwiększa ilość białka
w mleku o 10%,
ekonomicznie
opłacalne)
L-Asp, L-Phe
7 000
synteza
enzymatyczna,
biosynteza
aspartam (produkt
spożywczy jako
słodzik)
L-Cys
7 000
biosynteza
antyoksydant,
dodatek do chleba
D,L-Met
70 000
synteza chemiczna
wzbogacenie pasz
białkowych
(podawana krowom
w dawkach
10mg/dziennie
KWAS WANILINOWY
KWAS FERULOWY
50
zwiększa ilość białka
w mleku o 10%,
ekonomicznie
opłacalne)
DO MIKROBIOLOGICZNEJ PRODUKCJI AMINOKWASÓW WYKORZYSTUJE SIĘ:
•
Corynobacterium glutamicum
•
Bravibacterium flavum
W8
-
G(+), katalazododatnie,
-
morfologicznie zmienne: tlenowce lub względne beztlenowce w warunkach
tlenowych: substrat
→
CO
2
+ H
2
O;w warunkach beztlenowych: fermentacja mlekowa
-
mezofile
-
niskie wymagania pokarmowe (źródło N – nieorganiczne, C – mono-, disacharydy,
kwasy tłuszczowe, alkany),
-
brak aktywności proteolitycznej (bardzo niskie)
-
naturalne auksotrofy w stosunku do biotyny bądź tiaminy,
Wspólne cechy tych bakterii: w sprzyjających warunkach produkują i wydzielają poza komórkę kwas
glutaminowy (duże ilości); bardzo prosty materiał pierwotny: manipulacje dają zmodyfikowane
ścieżki metaboliczne, tak aby była możliwość nadprodukcji materiału pierwotnego.
1.
KWAS GLUTAMINOWY
Kiedyś
→
synteza metodą kwaśnej, ciśnieniowej hydrolizy bogatych w ten aa białek
pszenicy
Obecnie
→
jednostopniowa fermentacja
glukoza
PEP
szczawiooctan pirogronian
Corynebacterium glutamicum
cytrynian
dehydrogenaza glutaminianowa (duza aktywnosc)
dehydrogenaza alkoholowa (mala aktywnosc)
cis-akonitan
dodatek detergentu, penicyliny
(zmodyfikowana blona komorkowa-latwosc przenikania aa)
izocytrynian
ketoglutaran
glutaminian
dehydrogenaza glutaminianowa
dehydrogenaza 2-oksoglutaranu
Skład pożywki hodowlanej:
•
5
µ
g/l biotyna (stężenie nie może być większe, hamuje wzrost)
•
melasa buraczana (uboga w biotynę
•
(NH
4
)
2
SO
4
•
kreda (środek zobojętniający)
efektywna hodowla: napowietrzana, 30
0
C, 40 – 72 h
→
wydajność 50%
tzw. bakterie kwasu
glutaminowego
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
51
W8
Bakterie wykorzystujące inny cukier niż glukoza, np. Corynebacterium sp. R7. Wykorzystują
heksadekan i penicylinę lub Tween 80 ( wydajność 75 g/l), małe stężenie tiaminy.
2.
KWAS ASPARAGINOWY
Kiedyś
→
produkowany z soku asparagusa
Teraz
→
metody fermentacyjne, enzymatyczne
Zastosowanie:
•
medycyna: sól K, Mg (leczenie znużenia, chorób serca, wątroby, skurczów nóg u
diabetyków), sól Fe (anemia)
•
kosmetyka: związki powierzchniowo czynne L-Asp + B
6
(kremy rewitalizujące)
•
przemysł spożywczy (soki pomarańczowe, aspartam)
Metoda fermentacyjna:
•
glukoza: Brevibacterium flavum
•
kwas fumarowy: Bacillus, mutanty F. fluorescens, E. coli
Metoda enzymatyczna: wykorzystanie liaz do produkcji (L-Asp całkowicie nie rozpuszczalny w
wodzie, łatwy do wydzielenia)
CH – COOH
kwas fumarowy
CH – COOH
aspartaza
↑↓
amoniak
CH – COONH
4
CH
2
– COOH
CH – COONH
4
CH
2
(NH
2
)COO
-
fumaran amonu
L-Asp
(zw. nierozpuszczalny w wodzie)
Stosuje się do tego celu specjalne kolumny wypełnione immobilizowanymi komórkami
Escherichia coli, jako nośnika używa się roztworu fumaranu amonu.
kolumna z immobilizowanymi komórkami E. coli
odciek
kryształy L-Asp
W8
BIOTECHNOLOGIA PRODUKCJI KWASÓW ORGANICZNYCH
1. KWAS CYTRYNOWY
- otrzymywany na drodze biologicznej
Zastosowanie:
•
przemysł spożywczy (80%):
metody mało wydajne; trudne do
kontroli
CH
2
– COONH
4
+
CH
2
(NH
2
)COOH
sól amonowa L-Asp
roztwór 1,2 M fumaranu amonu + 1mM Mg
2+
pH 8,5
37
0
C
powolny przepływ
zmiana pH 2,8, 60% H
2
SO
4
ochłodzenie do 15
0
C
odwirowanie
przemycie wodą
OH
HOOC
COOH
COOH
52
o
składnik konserw – obniża pH
o
inaktywacja oksydaz (oksydazy odpowiedzialne za ciemnienie owoców)
o
kompleksuje Me powodujące jełczenie tłuszczów
•
przemysł metalurgiczny: czyszczenie powierzchni metali przed spawaniem
•
przemysł farmaceutyczny:
o
dodatek do tabletek musujących
o
cytrynian sodu wykorzystywany jest jako preparat zapobiegający krzepnięciu krwi w
stacjach krwiodawstwa
•
przemysł chemiczny:
o
detergenty (wyparł biodegradowalne fosforany)
o
plastyfikatory, stosowane w mleczarniach do usuwania „kamienia mlecznego”;
Producenci:
•
Aspergillus niger
•
Aspergillus wenti
•
Candida sp.
Otrzymywanie kwasu cytrynowego (300.000 t/rok)
a) metoda powierzchniowa: dwie fazy w systemie jednostopniowym
1 faza – rozwój grzybni (72h)
2 faza – koniec rozwoju grzybni, właściwa produkcja kwasu cytrynowego
Surowiec: melasa buraczana (pozostałość po produkcji cukru) rozcieńczona do 16% zawartości
sacharozy + sole mineralne (KH
2
PO
4
, ZnSO
4
x7H
2
O, K
4
Fe(CN)
6
)
•
rozlanie sterylnej pożywki na system tac
•
zaszczepienie zawiesiną konidiów w węglu aktywnym
•
wzrost grzybni (dojrzała grzybnia 2-3cm)
•
produkcja kwasu cytrynowego (za produkcję odpowiedzialna jest część grzybni stykającej się
z powierzchnią pożywki)
•
wydzielenie produktu (metoda cytrynianowa i bezcytrynianowa)
•
wydajność 70%, proces trwa ok. 200h
•
istnieje zagrożenie zarażeniem mikrobiologicznym
b) metoda wgłębna:
•
opiera się na wykorzystaniu bioreaktorów (50 –100m
3
)
•
warunkiem wydajności procesu jest surowiec o dużej masie i wyższej klasie czystości (cukier
handlowy, soki cukrownicze, mączki cukrowe, hydrolizaty skrobiowe)
•
zaszczepienie: konidia lub grzybnia indukcyjna
W8
•
warunki: zamknięty reaktor, dozowanie po wysterylizowaniu, niskie pH 2,5 – 3
( nie sprzyja zakażeniom)
•
czas 120 –168 h, temperatura 30 –32
0
C
•
pożywka mineralna (sole)
→
wydajność 80%
•
normy spożywczego kw. cytrynowego muszą być spełnione (cukier handlowy, soki
cukrownicze, mączki cukrowe, hydrolizat skrobiowy)
•
problemy bioinżynieryjne:
o
wzrost w stałej objętości,
o
zmiana środowiska zewnętrznego,
o
zmiana gęstości,
o
specjalne bioreaktory;
•
problem z melasą buraczaną (mało wydajna)
2. KWAS MLEKOWY = kwas 2-hydroksypropionowy
COOH
HO – C – H
CH
3
związek optycznie
czynny (L,D, racemat)
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
53
•
zależy od tego czemu ma służyć kwas mlekowy, ceny i dostępności surowca
•
surowce: melasa buraczana, trzcinowa, serwatka, ługi posiarczynowe
•
przedsiębiorstwo „Akwawit”: sacharoza + kiełki lub ekstrakt drożdżowy; Lactobacillus
delbrueckii; temp. 50 –55
0
C, 2-8 dni, neutralizacja Ca(OH)
2
→
95%
•
pleśnie: Rhizopus oryzae; mogą wykorzystywać te same szlaki metaboliczne co bakterie
mlekowe, te które są zdolne do wytwarzania pojedynczych enancjomerów
•
hodowla wgłębna
Zastosowanie:
•
zakwaszanie i konserwacja przetworów i konserwantów owocowo-warzywnych
•
produkcja napojów chłodzących
•
przemysł garbarski, farbiarski, chemicznych
•
przemysł kosmetyczny, farmaceutyczny
3. KWAS GLUKONOWY = kwas pentahydroksykapronowy
O
H
OH
OH
OH
OH
COOH
•
otrzymywany metodami chemicznymi lub biologicznymi
•
oksydaza glukozowa: Aspergillus niger, Gluconobacter sp., Pseudomonas sp.
•
źródłem węgla jest glukoza
W8
Zastosowanie:
•
przemysł spożywczy: zakwaszacze produktów, sztuczny miód, kiełbasy, sery, napoje
gazowane, proszek do pieczenia
•
glukonian wapnia: związek łatwo przyswajalny przez zwierzęta
•
rozpuszczalnik skrzepów krwi
•
dodatek do antybiotyków: stabilność, rozpuszczalność, poziom we krwi
•
przemysł tekstylny: wybielanie i nabłyszczanie tkanin
•
przemysł metalurgiczny: jak kwas cytrynowy
•
glukonian sodu: automatyczne mycie butelek
•
glukonian potasu: ochrona instalacji przemysłowych
•
produkcja 50 000 ton/rok
α
-D-glukoza
β
-D-glukoza
D-glukozo-
δ
-lakton
D-glukozo-
γ
-laktan
kwas glukonowy
Aspergillus niger:
•
proces wgłębny
•
pożywka: 30% roztwór glukozy, P i N
•
pH 5,5 – 5,6
w roztworze wodnym ustala się
między nimi równowaga
oksydaza glukozowa: zawsze towarzyszą jej katalazy,
odszczepia 1C, dwa H, tworzy się lakton
54
•
ważny jest poziom napowietrzenia
•
proces trwa 60 – 70 h
•
wydajność 90%
Kwas glukonowy otrzymuje się jako roztwór 50% i wykorzystuje się go w przemyśle. Po zakończeniu
procesu kwas jest neutralizowany; otrzymaną sól neutralizuje się i oczyszcza.
5. KWAS OCTOWY
Surowiec: etanol, alkohole, wino, sfermentowany sok jabłkowy.
Metody otrzymywania:
a) powierzchniowa (orleańska)
– Acetobacter aceti
– temperatura 25 - 28
0
C
– najstarsza metoda
– samorzutna fermentacja wina w beczkach
– objętość 1/3 beczki zaszczepiona bakteriami
W8
– czterokrotnie odciąganie części zawartości
– otrzymujemy ocet winny
b) metoda ociekowa (wiązana): dwie odmiany
-
metoda stojakowa (przestarzała): mała wydajność 60 –80 % , trudna kontrola
-
metoda generatorowa: unieruchamianie bakterii octowej na nośniku np. pumeks,
kolby kukurydzy, wióry bukowe, koks;
-
zacier = brzeczka: dzieli się ją na 3 partie:
i. 50% zacieru w kolumnie: stężenia alkoholu ok. 4%
ii. 25% : stężenie alkoholu ok.. 3%
iii. 25%: stężenie alkoholu poniżej 3%
-
proces prowadzi się do momentu aż stężenie alkoholu wyniesie ok. 0,03%
-
14% EtOH (maksymalne stężenie alkoholu)
-
pożywka hodowlana 1 – 3% CH
3
COOH
-
stymulowany wzrost bakterii octowych (ekstrakt sodowy, drożdżowy, glukoza, sole
mineralne – N,P)
-
metoda fermentacyjna (metoda wgłębna):
i. fermentatory wyposażone w wężownice (utrzymują stałą temperaturę 30
0
C) i
system napowietrzający;
ii. proces jest szybki, okresowy, wysoce efektywny
iii. jedyna wada: produkt zanieczyszczony komórkami bakterii
iv. zacier: 10 –14% EtOH, 1- 3% kwas octowy, stymulatory wzrostu bakterii
octowych (glukoza, ekstrakt drożdżowy, sole mineralne)
v. materiał biologiczny – ocet spożywczy
vi. materiał chemiczny – kwas octowy dla celów technicznych
OCET BALSAMICZNY:
-
winogrona umieszczane są w beczce z drzewa kasztanowego o pojemności 100 l
-
po ich tłoczeniu otrzymuje się 70 l. świeżego moszczu., stężonych cukrów 16 –18%
-
zachodzi tu fermentacja alkoholowa i octowa
-
gotowanie na wolnym ogniu pod gołym niebem; 30 l koncentratu o stężeniu cukrów
30 –36%
-
chłodzenie w okresie zimowym, dekantacja w gąsiorkach
W9
POLISACHARYDY PRODUKOWANE PRZEZ MIKROORGANIZMY
Typy mikrobiologicznych polisacharydów:
•
egzopolisacharydy:
o
wydzielane na zewnątrz komórki
o
gumy
o
nierozpuszczalne w wodzie i nieszkodliwe dla człowieka
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
55
o
przemysł spożywczy i farmaceutyczny
o
jako koagulanty, emulsyfikatory
o
opłacalne pod względem ekonomicznym
•
wewnątrzkomórkowe
o
stanowią materiał zapasowy
o
komponenty ściany komórkowej
o
egzopolisacharydy (niektóre wydzielane w postaci kapsułek)
Producenci polisacharydów:
o
bakterie Gram +
o
bakterie Gram –
o
glony
o
grzyby
mikroorganizm
substrat
Polisacharyd
Azotobacter vinelandii sacharoza
polisacharyd
Zymononas mobilis
sacharoza
alginian
Sclerotium rolfsii
glukoza
skleroglukan
Aureobasidium campestris
sacharoza
pullan
Pseudomonas elodea
węglowodory
gellan
Xanthomonas campestris
laktoza
ksantan
Pod względem budowy polisacharydy dzielimy na:
•
homopolisacharydy: pullulan, dekstran
•
heteropolisacharydy: ksantan
•
proste
•
rozgałęzione
Pod względem niesionego ładunku:
•
kationowe
•
obojętne
•
neutralne
1. KSANTAN
•
produkowany przez Xanthomonas campestris
•
dodatek do żywności
•
naturalne pochodzenie mikrobiologiczne
•
otrzymywany na drodze fermentacji surowców węgla
W9
•
hydrokoloid zbudowany z glukozy, mannozy, i kwasu glukuronowego (3:2:2)
•
tworzy pseudoplastyczne roztwory
•
roztwory ksantanu oparte na: kwaśnym środowisku, działaniu enzymów i zmianach
temperatury
•
chemiczna i fizyczna stabilność = zagęszczanie produktów silnie kwaśnych, zasadowych
•
ksantan + mączka chleba świętojańskiego = żel elastyczny, termoodwracalny
Zastosowanie:
•
zagęszczacz i substancja żelująca: mleczne napoje fermentowane i niefermentowane,
musztarda, majonez, kisiel, galaretka, marmolada, sery, dżemy, sery topione, twarogi
•
emulgator i substancja żelująca: mieszaniny masła i tłuszczów roślinnych, napoje z
cząsteczkami owoców
2. DEKSTRAN
•
nośniki do wypełnień kolumny
56
•
homopolimer z cząsteczkami
α
-
∆
-glukozy połączonymi w pozycjach 1,6-
α
-1,6-glukan: płyny
infuzyjne (polimery 30 – 70kDa)
•
Leuconostoc mesenteroides: zdolny do przeprowadzania fermentacji, wykorzystuje sacharozę,
w podłożu musi zawierać mało aminokwasów
•
dekstrenosacharoza: transglukozydaza; hydroliza cząsteczki glukozy na dekstran
•
produkcja materiałów chromatograficznych, żeli dekstranowych, Sephadex
3. ALGINIAN
•
produkowany głównie przez glony morskie
•
źródło Azotobacter vinelandii
•
polisacharyd liniowy zbudowany z kwasu
∆
-mannozopiranosylurowego (
β
-1,4) i kwasu
glukoronowego (
α
-1,4)
•
nośnik do immobilizacji enzymów
4. PULLULAN
•
biały proszek bez smaku i zapachu, dobrze rozpuszczalny w wodzie, nie rozpuszcza się w
metanolu i acetonie
•
liniowy egzopolisacharyd
•
podstawowa jednostka tri- lub tetrasacharyd
•
Zastosowanie:
•
osłonki produktów spożywczych
•
substytut skrobi – żywność niskokaloryczna
•
modyfikacja chemiczna –produkcja torebek, pudełek (częściowa estryfikacja: folie
nierozpuszczalne w wodzie)
•
dodatek plastycyzerów (poprawia plastyczność)
•
kosmetyki, laminaty, włókna podobne do jedwabiu
W9
Proces produkcji polisacharydów pochodzenia mikrobiologicznego
- kontrola na poziomie środowiska hodowlanego
•
pożywka:
o
Xanthomonas campestris = ksantan
o
Azotobacter vinelandii = alginian
•
temp, pH, stężenie O
2
, rozp.CO
2
- kontrola na poziomie sprzętowo –technologicznym
Problemy inżynieryjne: wydzielanie i oczyszczanie produktu.
TŁUSZCZE I OLEJE POCHODZENIA MIKROBIOLOGICZNEGO
Rośliny oleiste = soja, orzeszki ziemne, bawełna, rzepak, słonecznik, oliwki, itp.
Przemysł
spożywczy
margaryny, tłuszcze do
pieczenia, majonezy, olej
sałatkowy, lody,
cukiernictwo
olej sojowy, z orzeszków
ziemnych, rzepakowy,
oliwa z oliwek
Przemysł
kosmetyczny
kosmetyki, leki
olej kokosowy, palmowy,
rycynowy
Przemysł
chemiczny
detergenty, surfaktanty,
mydła woski, wybielacze,
plastiki
olej palmowy, kokosowy
olej palmowy, sojowy
olej sojowy
Przemysł
metalurgiczny
olej palmowy
ograniczenie źródła węgla
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
57
Mikroorganizmy olageageniczne:
•
20 –25% biomasy w postaci lipidów
•
drożdże, pleśnie i inne mikroorganizmy eukariotyczne zawierają enzym liazę ATP cytrynianu
•
mikroorganizmy zawierające ten enzym zdolne są do przeprowadzania reakcji:
cytrynian + ATP +CoA
→
acetyloCoA + szczawiooctan + ADP +Pi
•
biosynteza tłuszczów – styren
Mikroorganizmy produkują lipazy, gdy pożywka zawiera odpowiednie stężenia źródeł N i C (C:N –
50:1).
Hodowla okresowa = wzrost biomasy do momentu wyczerpania źródła azotu (pozostające źródło C
→
produkcja lipidów)
Hodowla ciągła = ograniczenie dostępności do źródła N
PRODUCENCI LIPIDÓW
1. Bakterie:
- mycobakterie – Nocardia
- Arthrobacter – 80% biomasy w postaci lipidów (triacyloglicerole)
W9
•
poli-
β
-hydroksymaślan
o
produkowany w warunkach ograniczonego dostępu do źródła azotu;
o
synteza zależna od O
2
o
nierozpuszczalny w chloroformie, dlatego jest klasyfikowany jako lipid
o
polimer zapasowy
o
biodegradowalny plastik; producent : Alcaligenes enthropus (70 – 80% masy w
postaci polimeru)
•
woski: Acinetobacter; proste estry kwasów tłuszczowych i alkoholi tłuszczowych, pożywka z
bursztynianem jako źródłem węgla lub octanem (10-25% lipidów) oraz alkohole tłuszczowe –
wysoka wydajność
2. Glony:
§ oleje-do 70% Chlorella perenoiclosa
§ przejściowe produkty olejów napędowych
W10
2,3-BUTANODIOL
1906r. – odkrycie 2,3-butanodiolu w płynie pohodowlanym Klebsiella pneumoniae
II w. św. – przemysł zbrojeniowy
obecnie – paliwo płynne, prekursory pianek, atramenty, farby drukarskie, plastyfikatory, materiał
wybuchowy
•
producenci:
o
Klebsiella pneumoniae
o
Klebsiella oxytoc
o
Enterobacter aerogenes
o
Serratia marcescens
o
Bacillus subtilis
o
Bacillus polymyxa
•
substraty:
o
Klebsiella oxytoca = melasy, enzymatycznie hydrolizowane zaciery zbożowe,
zhydrolizowana skrobia, pszenica, hydrolizaty drewna, odpady posiarczynowe
o
Bacillus polymyxa = skrobia kukurydziana, pszeniczne zaciery (enzymy
amylolityczne)
•
warunki fermentacji: pH 5-6,5, temp. 37
o
C, O
2
, stężenie substratów 5-10%
•
biochemia procesu:
58
glukoza
pentan
frutozo-6-fosforan + aldehyd-3-fosfoglicerynowy
2-pirogronian
acetoina
diacetyl
2,3-butanodiol
•
produkty otrzymywane z 2,3-butandiolu
o
2-buten
o
1,3-butadien
o
estry butanodiolu
o
eter tetrametylowy
o
MEK
GLICEROL
•
zastosowanie: przemysł spożywczy, kosmetyczny, farmaceutyczny, chemiczny, materiał
wybuchowy (pochodne estrowe)
•
dodatek siarczku sodu
→
drożdże zamiast etanolu wytworzą glicerol
W10
ENZYMATYCZNA SYNTEZA TLENKÓW ALKENÓW
O
2
propylen, Cl
-
, H
2
O
2
chlorek hydroksypropylenu
H
-
Cl
-
tlenek propylenu
ALKOHOL ETYLOWY = ETANOL
•
CH
3
CH
2
OH
•
przemysł spożywczy, odczynnik chemiczny, rozpuszczalnik, paliwo
•
proces fermentacji cukrów z wytworzeniem alkoholu jest szeroko rozpowszechniony w
przyrodzie
•
produkcja przemysłowa: gorzelnicze odmiany drożdży: Saccharomyces cerevisiae, w USA:
Saccharomyces cerevisiae+ Candida+ Kluyveromyces
•
cechy drożdży gorzelniczych:
o
wysoka aktywność fermentacyjna
o
wydajność produkcji biomasy
o
wysoka stabilność cech morfologicznych i fizjologicznych
o
odporność na temperaturę >30
o
C
glikoliza
CO
2
oksydaza
2-pyranosowa
chloroperoksydaza
epoksydaza
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
59
o
odporność na duże stężenia etanolu w pożywce
o
zdolność do fermentowania brzeczek o podwyższonej zawartości cukrów (nawet ok.
50%)
•
fermentacja alkoholowa: piwowarska, winiarska, gorzelnicza
•
surowce do produkcji alkoholu etylowego
o
surowce skrobiowe – kukurydza, żyto, ziemniaki, jęczmień, owies, sorgo, ryż
o
surowce zawierające mulinę – łopian, buraki
o
surowce zawierające cukry proste i oligocukry – melasa, sacharoza, serwatka, buraki
paszowe, owoce, soki owocowe
o
surowce zawierające celulozę – drewno i jego odpady, torf, ługi posiarczynowe,
trawa, słoma
•
surowce zawierające skrobię: oczyszczanie, obróbka termiczna, obróbka enzymatyczna
•
przygotowanie słodu gorzelnianego:
α
-amylaza,
β
-amylaza,
α
-glukozydaza, glukozydaza
amylopektynowa, oligo-1,6-glikozydaza
•
warunki procesu:
o
14 – 16 dni, temperatura 8 – 10
o
C, półmrok
o
rozdrobnienie i ługowanie enzymów wodą = mleczko słodowe
W10
o
zacieranie = przemiana skleikowanej skrobi na cukry w temp. 55
o
C
o
α
-amylaza: pH op. 5-6, temp. op. 70
o
C
β
-amylaza: pH op. 4-5, temp. op. 40 –50
o
C
•
preparaty enzymatyczne scukrzające skrobię:
o
termamyl – Bacillus lichenifornis
o
SAN – Aspergillus niger
o
Fungamyl – Aspergillus oryzae
o
BAN – Bacillus subtilis
•
przygotowanie drożdży gorzelnianych
o
namnożenie przez ok. 20h na przecieku drożdżowym
o
dobre rezultaty – immobilizacja
§ mniejsza zależność od zmian kwasowości i temperatury
§ mniejsze ryzyko zakażenia
§ mniejsze koszty inwestycyjne i energochłonność
§ szybkość i wydajność produkcji
•
fermentacja:
o
I = zafermentowanie 18 –20h, powolny wzrost
II = fermentacja główna 20 –22h, temp. max 30
o
C
III = defermentowanie 20 – 30h, temp. 25 –26
o
C
o
zacier dojrzały zawiera 8 –12% alkoholu
o
produkty uboczne: kwas octowy, bursztynowy, aldehyd octowy, estry, wyższe
alkohole (fuzle)
o
teoretyczna wydajność:
C
6
H
12
O
6
→
2C
2
H
5
OH + 2CO
2
100g glukozy
→
51,5g EtOH
o
wydajność praktyczna:
45 – 48g metanolu / 87 – 94% w stosunku do wydajności teoretycznej
o
proces fermentacji surowców zawierających cukry proste lub dwucukry nie wymaga
stosowania słodu scukrzających preparatów enzymatycznych
•
poszczególne surowce:
o
melasa: rozcieńczenie, sterylizacja, proces okresowy, ciągły i półciągły
o
serwatka: Kluyveromyces; 42 l serwatki (4,4% laktozy) = 100% EtOH
o
surowiec zawierający celulozę: hydroliza
•
destylacja
napój destylowany
surowiec
Wódka
ziemniaki, zboże
Scotch Whisky
jęczmień
Irish Whisky
jęczmień, pszenica, owies, ryż
Canadian Whisky
ryż
Gin (1650r)
ziarna zbóż, owoce jałowca
Aquavit
ziemniaki, ziarna zbóż, kminek
70% skrobi:
•
80% maltoza
•
20% dekstryny, glukoza
60
Tequilla
sok kaktusa Agare Aequilana
Kirchwasser
sok wiśniowy
Brandy
owoce
Cognac
białe winogrona
Rum
trzcina cukrowa
W11
METALWORKING FLUIDS
W procesie obróbki metali stosowane są różne substancje ciekłe, które spełniają trzy podstawowe
funkcje:
1. chłodzenie
2. smarowanie
3. odprowadzanie drobin i opiłków
Ciecze niewodne oraz na bazie wody.
Drobnoustroje zasiedlające ciecze na bazie wody:
•
szczepy Pseudomonas = duże zdolności adaptacyjne do niekorzystnych warunków życia,
wykorzystują składniki organiczne, tak więc:
o
utleniają alkany do kwasów tłuszczowych
o
przeprowadzają
β
-oksydację kwasów tłuszczowych
o
przeprowadzają deaminację aminy
o
hydrolizują sulfoniany ropy naftowej
o
degradują inhibitory korozji
co powoduje zmiany w charakterze substancji (dekoloryzacja, zmiana pH) i przygotowania
środowiska życia dla anaerobów
•
szczepy anaerobów Desulfovibrio = nigdy nie pojawiają się, gdy zasiedlą środowisko bardzo
trudno się ich pozbyć; smród H
2
S
•
grzyby wszędobylskie Cephalosporium, Fusarium, Aspergillus, Penicillium, Cladosporium,
Candida:
o
zdolne do przetwarzania w obecności dużych populacji Pseudomonas
Detekcje (wykrywanie) mikroorganizmów w cieczach związanych z obróbką metali:
•
redukcja błękitu metylowego = populacje Pseudomonas
•
oznaczanie poziomu ATP
•
stężenie O
2
uwalnianego z H
2
O
2
przez katalazę komórkową
•
radiospirometria, konduktometria, kalorymetria – nie są wykorzystywane
Choroby ludzi:
•
1978r. – 250 pracowników zakładów Forda „Ford – Pontiac Fever”
•
związane z obecnością biocydów
Problemy ze stosowaniem biocydów.
Nie ma środka uniwersalnego i zawsze skutecznego.
Przykładowe biocydy: Dowcide, Bioban, Tris Nitro, Vancide TH.
W11
SCO = Single Cell Oil
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
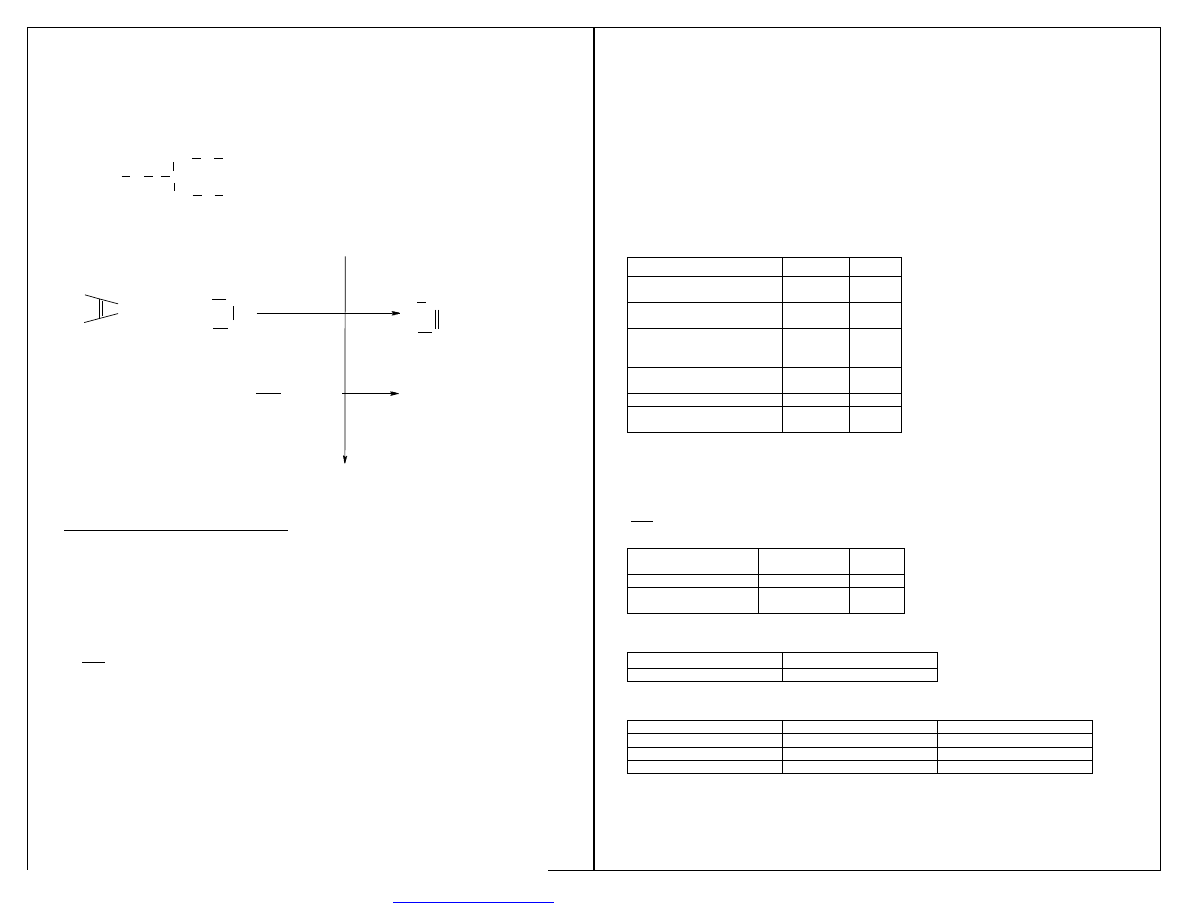
61
•
Do SCO nie zalicza się wosków,
•
zalicza się te, które mają strukturę triacylogliceroli
•
główni producenci: glony, grzyby (pleśnie, drożdże)
•
idealny substrat powinien zawierać taki sam stosunek reszt (2 nasycone : 1 nienasycone
łańcuchy)
Olej z drożdży jako odpowiednik masła kakaowego
H
33
C
17
OC
O
CH
CH
2
O
CH
2
O
CO
CO
C
17
H
35
C
18
H
37
CBE = substytut masła kakaowego (16:0, 18:0,18:1)
O
2
R
R1
CH
2
R1
CH
2
CH
2
R
R1
CH
R
CH
NADPH
NADP+
desaturaza
inhibitor
2 H
2
O
Mutagenaza = Candida curvata
→
nieaktywna desaturaza
POLINIENASYCONE KWASY TŁUSZCZOWE
•
prekursory prostaglandyn, leukotrienów, tromboksanów
•
EPA i DHA polecane przy profilaktyce chorób serca
•
kwasy
γ
-linolenowe (GLA) – egzema
o
kwas
γ
-linolenowy (GLA) – Mucorcircinelloides
o
kwas dihomo-
γ
-linolenowy – Mucorcircinelloides
o
kwas arachidonowy (ARA) – Mucorcircinelloides
o
EPA – powstaje w wyniku działania
∆
17 desaturazie działąjącej na ARA
20% zawartości lipidów u grzybów Mortierella i Pythium, glon Porphyridium cruentum 40% lipidów
W11
•
DHA = grzyby morskie (Tchranstochytrium aureum) – 50% lipidów komórkowych, brak EPA
•
bakterie produkują PUFAs – Altermonas, Shewanella, Flexibacter, Vibrio = produkcja
przemysłowa EPA możliwa dla Shewanella putrifaciens (15 – 18 g biomasy, 12 –18 h, 10 –15
% biomasy to lipidy w tym 25 –40 % EPA)
PERSPEKTYWY W AGROBIOTECHNOLOGII
Nowa agrobiotechnologia bazuje na inżynierii genetycznej, biologii molekularnej i mikrobiologii
stosowanej.
XX w. - biotechnologia mikroorganizmów
MASŁO KAKAOWE
62
XXI w. - biotechnologia roślin i zwierząt
Cel wprowadzenia:
•
zwiększenie wydajności plonów
•
aby rolnictwo było przyjazne dla środowiska
TECHNOLOGIE GENOWE
Strategia doskonalenia rolnictwa zawsze koncentruje się na:
•
dobór odpowiednich upraw
•
zarządzanie ziemią i wodą
•
walce ze szkodnikami i ochronie upraw
Wprowadzanie do środowiska organizmów transgenicznych musi mieć wpływ na te czynniki.
ROŚLINY TRANSGENICZNE
produkt
status
Producent
rośliny odporne na stres (susze,
zasolenie)
próby
polowe
zboża zdolne do wiązania N
2
z
genami roślin strączkowych
wczesne
badania
rośliny z tolerancją na pestycydy w handlu
Monsanto
Calgene
Dupont
owoce i warzywa odporne na
wirusy
próby polne
Asgrow
jadalne szczepionki
badania
pomidory z opóźnionym
dojrzewaniem
w handlu
Calgene
W11
ZWIERZĘTA TRANSGENICZNE
produkt
zwierzę lub jego
produkt
status
p/ciała monoklonalne
mleko krów
hormon wzrostu
tilapie (ryba)
próby
polowe
MIKROORGANIZMY TRANSGENICZNE
produkt
status
chymozyna
Zaakceptowane przez FDA
MIKROORGANIZMY W ROLNICTWIE (BIONAWOZY)
Rhizobie wiązanie N
2
rośliny strączkowe
Cyanobacterie wiązanie N
2
ryż
mikoryza
P,N,S
drzewa szpilkowe
kompost
żyzność gleby
rośliny
CZYNNIKI BIOKONTROLI
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
63
-
biopestycydy
-
bioinsektycydy
-
bioherbicydy
-
inne: diagnostyka, bioremediacja
Biotechnologiczne doskonalenie roślin a środowisko:
2001r. – 52 mln hektarów upraw roślin transgenicznych (39 mln hektarów w Ameryce Płn)
Biotechnologia roślin rozwija się w dwóch kierunkach:
1. technik umożliwiających selekcję genetyczną rekombinantów przyśpieszających uzyskanie
nowych odmian roślin
techniki markerów molekularnych– łatwy i szybki sposób oceny segregującej populacji przez
co skraca się czas selekcji określonego genotypu
mapowanie molekularne- służy do identyfikacji miejsca, w którym znajdują się określone
geny co może być wykorzystane w doborze komponentów do krzyżowania
techniki kultur in vitro, techniki mikrorozmnażania, otrzymywanie podwojonych haploidów,
technika fuzji protoplastów i uzyskiwania mieszańców somatycznych
2. modyfikacji genetycznej
W11
MOŻLIWOŚCI MODYFIKACJI GENETYCZNEJ W PRZYKŁADZIE GENÓW
WARUNKUJĄCYCH ODPORNOŚĆ
Geny roślinne kodujące:
•
inhibitory enzymów trawiennych owadów
•
toksyczne substancje (lektyny, chitynazy, alkaloidy)
•
białka
•
białka antywirusowe
•
naturalne geny gospodarza kodujące odporność na patogeny
Geny patogenu lub mikroorganizmu niepatogenicznego:
•
geny białek wirusa
W celu zapewnienia długotrwałego i silnego efektu ochronnego produktu trans genezy powinny
cechować się szerokim spektrum działania, np. gen B
s
2 z papryki- produkty rozpoznają białka
awirulencji bakterii Xanthomonas campestris , X. Oryzae gen X
a
21 z ryżu- produkty rozpoznają
białka awirulencji bakterii Xanthomonas campestris , X. oryzae
Korzystny efekt można też uzyskać poprzez optymalizację
KIERUNKI ROZWOJU TECHNIK TRANSFORMACJI
•
metody transformacji za pomocą Agrobacterium jako system bardziej precyzyjny niż
transformacje bezpośrednie
•
transformacje chloroplastów jako metoda znacznie zwiększająca ilość produktu i
umożliwiająca poziome rozprzestrzenienie się transgenów
•
transformacja in plane
•
precyzyjne transformacje do wybranego miejsca w genomie
•
użycie nowych markerów selekcyjnych do selekcji pozytywnej
•
rozwój metod eliminacji genów selekcyjnych
64
ROŚLINY TRANSGENICZNE JAKO PRODUCENCI WAŻNYCH DLA CZŁOWIEKA
PRODUKTÓW
•
oleje roślinne
•
węglowodany
•
białka – szczepionki, przeciwciała, biofarmaceutyki (somatotropina), białka przemysłowe
•
tytoń i ziemniaki
•
przeciwciała – większa aktywność biologiczna niż przeciwciała monoklonalne
o
przeciwciała IgA z tytoniu przeciwko mikroorganizmom powodującym gnicie zębów
u ludzi
•
biofarmaceutyki – hormony
o
somatotropina = w chloroplastach tytoniu
W11
ROŚLINNE SZCZEPIONKI BAKTERYJNE
Nawóz bakteryjny (szczepionka bakteryjna)- preparat składający się z gleby, substancji odżywczej
oraz szczepu drobnoustroju, który może:
•
wzbogacać glebę w określony składnik pokarmowy (szczepionki wzbogacające w związki
azotu
•
mobilizować procesy przekształcania związków chemicznych niedostępnych dla roślin w
związki dostępne (szczepionki immobilizujące)
SZCZEPIONKI WZBOGACAJĄCE
•
Nitragina – Rhizobium
•
Azotobakteryna (nie tylko do roślin motylkowych) – Azotobacter (występuje tam gdzie dużo
związków organicznych)
SZCZEPIONKI IMMOBILIZUJĄCE
•
Fosfobakteryna – Bacillus megaterium (zdolność mineralizacji wiązań fosforowych)
•
szczepionki oparte o siderofory
•
szczepionki oparte o mikoryzę (współdziałanie roślin wyższych z grzybami)- w leśnictwie
o
zewnętrzna – obrasta korzenie, nie wnika do wnętrza
o
wewnętrzna – przebija skórę, przerasta strzępkami
BIOINSEKTYCYDY
mikroorganizm
cel
sposób otrzymywania
Bacillus
thuringensis
larwy Leptidopteran
larwy Dipteran
fermentacja
w handlu
Bacillus popilae
żuki japońskie
w handlu
Bacillus sphaericus
larwy komarów
fermentacja
Beauveria bassiana
różne
fermentacja
Hirutella thompson
roztocza cytrusów
fermentacja
w handlu
Verticillum lecani
mszyce w szklarniach
fermentacja
w handlu
W12
OCHRONA ŚRODOWISKA
Biotechnologia w ochronie środowiska
Tworzenie zintegrowanych systemów ochrony środowiska:
•
wydobywanie surowca
•
transport surowca do punktu przerobu
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
65
•
przetwarzanie surowca
•
eksploatacja urządzeń procesu technologicznego
•
zagospodarowanie surowców ubocznych, odpadów, ścieków
LCA - cykl życia produktów
Strategie odpadów:
•
unikanie ich powstawania lub zmniejszenie ich ilości i szkodliwości
•
materiałowe i energetyczne wykorzystanie odpadów
Metody czyszczenia ścieków:
•
mechaniczne
•
fizykochemiczne
•
biologiczne
Złoże biologiczne - mikroorganizmy zamieszkujące błonę biologiczną, przez którą przesączają się
ścieki
Bioremediacje - użycie biologicznych układów w celu redukcji wielkości zanieczyszczenia
środowiska lub transformacji różnego rodzaju zanieczyszczeń w formy mniej szkodliwe
•
bioremediacje podstawowe = naturalna mikroflora skażonego terenu jest wykorzystywana
do obniżenia substancji toksycznych w środowisku do bezpiecznego poziomu w określonych
i akceptowalnych ramach czasowych ( z naszej strony żadnych działań tylko monitoring)
•
biostymulacja = np. natlenianie i wprowadzanie pożywek, wzbogacanie w azot i fosfor;
zależy od pH, zasolenia i wilgotności
•
bioaugmentacja = (wprowadzenie obcej mikroflory gdy bioremediacja podstawowa i
biostymulacja zawodzą) = wzbogacanie zanieczyszczonego terenu w specjalnie
wyselekcjonowane mikroorganizmy o dużej zdolności biodegradacji zanieczyszczeń
Przeprowadzanie bioremediacji:
•
in situ = na miejscu
•
ex situ
Rodzaj i miejsce
skażenia
Koszt metody
konwencjonalnej
Koszt bioremediacji
Różnica
grunt skażony
węglowodanami
pochodzenia
petrochemicznego
wydobycie gruntu i
oczyszczenie ex situ
3 mln $
biowentylowanie
0,2 mln$
2,8 mln $
W12
Zalety:
•
procesy ekonomiczne
•
możliwość prowadzenia procesu in situ
•
grunt nadaje się do użytku bezpośrednio po przeprowadzeniu procesu oczyszczania
•
nie wymaga stosowania kosztownej i skomplikowanej aparatury
Ograniczenia:
•
rodzaje skażenia
•
warunki panujące w mieście
•
skażenie czasowe
Technologie te znajdują szczególne zastosowanie przy remediacji gruntów i wód gruntowych
skażonych:
•
produktami ropopochodnymi, benzenem, toluenem, paliwami, benzyną
•
produktami organicznymi: pestycydami, rozpuszczalnikami, środkami do impregnacji drewna
•
metalami ciężkimi
FITOREMEDIACJE - technologia oczyszczania środowiska, która wykorzystuje naturalne
zdolności roślin do pobierania i gromadzenia substancji zanieczyszczających lub do ich biodegradacji
66
np. zanieczyszczenie metalami ciężkimi:
Cu:
mniszek > skrzyp> trawy > sałata > kukurydza
Cd:
tobołek > szpinak > sałata > wierzba > słoma, jęczmień > trawy
Typy fitoremediacji:
•
fitoakumulacje (fitoekstarkcje) - wnikanie do wnętrza roślin; nie ulegają one degradacji
o
wierzba
o
gryka
o
luceryna
•
ryzofiltracje - rozwój roślin w środowisku wodnym
•
fitodegradacja - system korzeniowy, enzymy roślinne degradują toksyny
•
biodegradacja ryzosferyczna - roślina wydziela do środowiska związki degradujące toksyny
•
fitostabilizacje - wydzielanie związków do podłoża, unieruchamianie toksyn
•
fitoutlenianie =-transpiracja toksyn przez liście
•
kontrola hydrauliczna drzew
Zalety:
•
niski koszt nakładów inwestycyjnych
•
minimalne zakłócenie istniejących warunków środowiska
•
powszechna aprobata opinii publicznej
Ograniczenia:
•
wolne tempo oczyszczania
•
ograniczenie działania do płytkich warstw gleby
•
odpowiednio duże powierzchnie
W12
•
powolny wzrost i specyficzne wymagania oraz różna tolerancja na inne zanieczyszczenia
gleby
•
nie pomocne w wielu przypadkach
•
toksyczność i biologiczne własności produktów biodegradacji
•
przenikanie do żywności
•
niska efektywność w przypadku zanieczyszczeń, silnie zaobserwowanych na następnych
glebach
BIOGEOCHEMIA - zajmuje się rolą organizmów żywych w procesach obiegu pierwiastków w
przyrodzie, ich przemieszczaniem, akumulacją, tworzeniem i rozkładem minerałów oraz skał
Metody wymywania pierwiastków:
1. techniki laboratoryjne – perkolator - technika hodowli wstrząsanej; metoda zamkniętej kolby
ekologicznej; wymywanie pod ciśnieniem
2. metody in situ - hałdy niskoprocentowych rud „hole to hole”, „hole to mine”
Czynniki warunkujące efektywność wymywania pierwiastków:
•
dostępność tanich źródeł wody
•
odpowiedni skład rudy
•
dobór odpowiedniego szczepu
•
odczynniki chemiczne
M I K R O B I O L O G I C Z N E R E A K C J E G E O C H E M I C Z N E
O Z N A C Z E N I U P R A K T Y C Z N Y M
1. BIOGEOCHEMIA Cu:
•
wymywanie Cu związane jest z reakcjami utleniania związków towarzyszących czyli
związków siarki i żelaza: H
2
SO
4
, FeSO
4
, Fe
2
(SO
4
)
3
•
Thiobacillus thiooxidans, Thiobacillus ferroxidans
•
piryt:
FeS
2
+ 7O
2
+ H
2
O
→
2FeSO4 + H
2
SO
4
•
chalkopiryt: Fe S
2
+ 7,5O
2
+ H
2
O
→
Fe
2
(SO
4
)
3
+ H
2
SO
4
•
chalkozyn: Cu
2
S + 2Fe
2
(SO
4
)
3
→
2CuSO
4
+ 4FeSO
4
+ S
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
67
CuSO
4
+ Fe
2+
→
FeSO
4
+ Cu
2+
Piryt towarzyszy
związkom miedzi
Cu
2
S
Chalkozyn
S
2-
+
CuFeS
2
Chalkopiryt S
2-
, Fe
2+
-
CuS
kowelin
S
2-
+
2. BIOGEOCHEMIA Zn:
Skład chemiczny
Nazwa minerału
ZnS
Sfaleryt
ZnO
Cynkit
ZnCO
3
Smitsonit
Zn
2
(SiO
4
)
Wilemit
Zn
4
(OH)
2
(SiO
7
) x H
2
O
Kupryt
•
Thiobacillus ferrooxidans:
ZnS + 2Fe
2
(SO
4
)
3
+ O
2
→
ZnSO
4
+ 4FeSO
4
+ 2H
2
SO
4
H
2
SO
4
= ułatwia wymywanie, zakwasza środowisko, stwarza warunki dla wzrostu
Thiobacillus ferroxidans
3. BIOGEOCHEMIA URANU:
Podatność na
wymywanie
mikrobiologiczne
UO
2
Uraninit
+
Guninit
+
Bekerelit
+
Kofinit
-
238
U +
235
U +
234
U - naturalny uran
W13
AKUMULACJA METALI PRZEZ MIKROORGANIZMY
1. Usuwanie metali ciężkich ze środowiska przez mikroorganizmy wynika z:
•
powierzchni wiązania metali przez reaktywne polimery i makrocząsteczki osłon
komórkowych
•
wewnątrzkomórkowe wiązanie metali
Oporność mikroorganizmów na metale ciężkie wynika z obecności systemów komórkowych
umożliwiających:
•
wydalanie metali na zewnątrz komórki
•
akumulację wewnątrz komórki
•
mechanizmy enzymatyczne prowadzące do powstawania form mniej toksycznych
BIOSORPCJA - usuwanie metali ze środowiska
2. Mechanizmy usuwania metali ciężkich:
•
powierzchniowe wiązanie metalu:
o
procesy wymiany jonowej = ważna rola grupy COOH, fosforanowa (występują jako
składniki błon komórkowych)
o
tworzenie trwałych kompleksów = grupy COOH, OH, NH
3
(powinowactwo do
elektrododatnich metali)
68
o
rola białka (Cd: chityna; Cu, Co: mannan)
o
różnice w efektywności usuwania metali u bakterii Gram (+) i Gram (–) (różna
budowa ściany komórkowej); Gram (+) 10x efektywniej wiążą metale, ponieważ mają
wielowarstwową ścianę co umożliwia wiązanie jonowe z metalem)
o
ważne jest jakie mikroorganizm posiada otoczki, warstwy śluzowe (ułatwiają
wiązanie metalu)
•
zmiana pH środowiska:
o
zmiana odczynu powoduje przesunięcie równowagi chemicznej pomiędzy formami
metali w roztworze, a pośrednio ma wpływ na powinowactwo adsorpcyjne metalu do
otoczek i ścian komórkowych
o
grzyby- obniżają pH środowiska
o
bakterie- podwyższają pH środowiska
o
w środowisku alkalicznym tworzą się trudnorozpuszczalne związki
o
w środowisku kwaśnym tworzą się łatworozpuszczalne związki
o
Alcaligenes denitrificans = usuwanie Cd związane jest ze zdolnością do silnej
alkalizacji środowiska (prowadzą proces denitryfikacji).
3. Pozakomórkowe wydzielanie przez mikroorganizmy substancji nieorganicznych i organicznych:
•
kwasy organiczne, białka przyłączają Cd i powstałe kompleksy są deponowane w obrębie
osłon komórkowych
•
mikroorganizmy redukujące siarczany do H
2
S wytrącają metale w postaci nierozpuszczalnych
siarczków
•
Citobacter sp. – Cd (pożywka z fosfoglicerolu, kwaśna fosfataza
→
−
2
4
HPO
, nierozpuszczalne
MeHPO
4
W13
4. Biotransformacje polegające na przemianie enzymatyczne j metalu (f. rozpuszczalne
→
f. mniej
rozpuszczalne):
•
reakcje utleniania i redukcji
•
reakcje metylacji i demetylacji
As – utleniany przy pomocy oksydaz do As (V)- mniej rozpuszczalny i łatwiej strącany przez
fosforany czy FeCl
3
Cr(VI) – redukcja do Cr(III) Enterobacter elocae
Hg – Aeromonas hydrophila (proces dwuetapowy)
5. Akumulacja metali:
•
metalotioneiny (duża ilość grup tiolowych) = politiolowe polipeptydy
zawierające duże ilości (30%) Cys – Zn, Cu, Ag, Sn, Mg, Cd
•
fitochelatony = glony, rośliny wyższe
•
drożdże = niskocząsteczkowe polifosforany (kumulacja metalu w postaci granulek)
ETAPY W PRZEMYSŁOWYCH PROCESACH USUWANIA METALI CIĘŻKICH ZE
ŚRODOWISKA
•
biosorpcja: w tym procesie można wykorzystywać:
o
mikroorganizmy stanowiące produkt uboczny w przemyśle farmaceutycznym czy
fermentacyjnym lub procesach oczyszczania ścieków
o
mikroorganizmy hodowane i namnażane na specjalnych podłożach i wykazujące
zdolności do efektywnego wiązania metali
o
biopreparaty: AMT – BIOCLAM
•
desorpcja i regeneracja biomasy
Unieruchamianie biomasy:
•
pasywne:
o
agregacja (biomasa mało odporna na uszkodzenia)
o
zasiedlenie nośników
o
zastosowanie związków chemicznych, np. aldehyd glukonowy
•
aktywne:
o
specjalne nośniki modyfikowane chemicznie (silnego związanie biomasy z
nośnikiem)
białka indukcyjne = pojawiają się
gdy komórka ma kontakt z
metalem
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version

69
o
biomasa musi być zregenerowana, a metal odzyskany np. metodą elektrolizy
MEOR = Microbiologically Ennanced Oil Recovery (wydobycie ropy naftowej przy użyciu
mikroorganizmów)
•
złoża odpowiednie dla MEOR: pH 4-8
temp. <75
o
C
zasolenie < 10%
obecność fazy wodnej (decydująca)
•
w złożach panują warunki beztlenowe, jest na dużych głębokościach, panuje wysokie
ciśnienie, pH wody jest ekstremalne, bardzo wysokie zasolenie(warunki ekstremalne nawet
dla mikroorganizmów)
•
istnieją mikroorganizmy wykorzystujące węglowodory jako źródło węgla, ale tylko w
warunkach tlenowych (w złożu warunki beztlenowe), dlatego wraz z mikroorganizmami do
złoża wprowadza się substancje odżywcze
W13
•
w metodzie tej nie używa się bakterii wytwarzających polimery, bakterii fermentacyjnych,
kłaczkujących w celu uniknięcia zatkania por (miejsce iniekcji musi być czyste)
•
problem dyspersji- mikroorganizmy wprowadzane jako zawiesina wodna, bakteria nie może
być większa niż por w skale (ważny rodzaj skały)
•
w złożu znajdują się mikroorganizmy, więc może dojść do interakcji z bakteriami przez nas
wprowadzonymi
•
charakter ropy zmienia się pod wpływem obecności mikroorganizmów (rozwój, wzrost), np.
utlenianie olejów do kwasów tłuszczowych – tworzą się detergenty
•
wzrost biomasy wypycha ropę na zewnątrz
Printed with FinePrint - purchase at www.software-partners.co.uk
PDF created with pdfFactory Pro trial version
Wyszukiwarka
Podobne podstrony:
Biotechnologia Wyklady id 89130 Nieznany (2)
Biotechnologia w ochronie srodo wyklad 1 5 id 89126
Biotechnologia Wyklady lejczak id 89046
Biotechnologia w ochronie srodo wyklad 1 5 id 89126
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
Badania operacyjne wyklad 2 id Nieznany
historia gospodarcza wyklady id Nieznany
Metodologia nauk spolecznych wyklad id 294758
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
biotechnologia wykład
Finanse miedzynarodowe B Pus wszystkie wyklady id 171643
edema biotech materialy id 1501 Nieznany
Geologia inzynierska Egzamin Wyklady id 189201
6 11 2013 EGIPT W OKRESIE STA wyklad id 43515 (2)
ZP wyklad1 id 592604 Nieznany
Administracja publiczna wyklady id 51845
więcej podobnych podstron