
1
Laboratorium
Podstawowe procesy jednostkowe
w technologii chemicznej
Studia niestacjonarne
Ćwiczenie
Alkilowanie toluenu chlorkiem tert-butylu

2
PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO:
ALKILOWANIE TOLUENU CHLORKIEM tert-BUTYLU
1. WPROWADZENIE
Istnieją cztery podstawowe rodzaje reakcji chemicznych organicznych:
1) reakcje addycji – zachodzą wtedy, gdy dwa substraty łączą się ze sobą dając jeden
produkt
A + B
C
2) reakcje eliminacji – zachodzą, gdy jeden substrat rozczepia się dając dwa produkty
A
B + C
3) reakcje substytucji (podstawienia) – zachodzą, gdy dwa substraty wymieniają ze
sobą fragmenty swoich cząsteczek i dają nowe produkty
A
B + C
D
A
C + B
C
4) reakcje przegrupowania – zachodzą, gdy jeden substrat ulega reorganizacji wiązań i
atomów, dając produkt izomeryczny
A
B
W przypadku wszystkich reakcji chemicznych następuje rozrywanie jednych wiązań i
tworzenie innych. Pełny opis sposobu, w jaki zachodzą reakcje nosi nazwę mechanizmu
reakcji. Istnieją dwa podstawowe sposoby rozrywania/tworzenia dwuelektronowych wiązań
atomowych (mechanizmy reakcji).
a. Mechanizm rodnikowy – gdy wiązanie ulega rozerwaniu/tworzeniu w sposób
symetryczny (hemolityczny/homogeniczny) tzn. taki gdzie jeden elektron pozostaje w
każdej części produktu (rozrywanie) lub gdy każdy substrat wnosi do nowego
wiązania po jednym elektronie (tworzenie),
rodnikowe (homolityczne) rozerwanie wiązania przebiega następująco:
A
B
A
+
B (w każdym fragmencie pozostaje jeden elektron)
rodnikowe (homogeniczne) tworzenie wiązania przebiega następująco:
A
+
B
A
B (każdy fragment dostarcza jeden elektron)
Rodnik jest to indywiduum molekularne, które zawiera nieparzystą liczbę elektronów
walencyjnych i dlatego ma pojedynczy, niesparowany elektron na jednym ze swoich
orbitali
b. Mechanizm polarny – gdy wiązanie ulega rozerwaniu/tworzeniu w sposób
niesymetryczny (heterolityczny/heterogeniczny), tzn. taki gdzie elektrony wiążące
pozostają z jedną częścią produktu, pozostawiając drugą część z orbitalem
niezapełnionym (rozrywanie) lub gdy do nowego wiązania elektrony wiążące wnosi
tylko jeden z substratów (tworzenie)
polarne (heterolityczne) rozerwanie wiązania przebiega następująco:
A
B
A
+
+
B
-
(w jednym fragmencie znajdują się dwa elektrony)
3
polarne (heterogeniczne) tworzenie wiązania przebiega następująco:
A
+
+
B
-
A
B (jeden fragment dostarcza dwa elektrony)
W wyniku takiej reakcji powstaje indywiduum molekularne, które ma parzystą liczbę
elektronów walencyjnych i dlatego na swoich orbitalach ma jedynie pary elektronów
Reakcje polarne są najczęściej występującym typem reakcji w chemii organicznej.
W odniesieniu do obiektów biorących udział w reakcji polarnej wprowadzono pojęcia
nukleofil i elektrofil.
Nukleofil jest indywiduum molekularnym, które „lubi jądro” (czyli ładunek dodatni. W
strukturze nukleofila znajduje się atom bogaty w elektrony, który może tworzyć wiązanie w
wyniku dostarczenia pary elektronowej do atomu ubogiego w elektrony. Nukleofile są często
naładowane ujemnie.
Elektrofil to indywiduum molekularnym, które „lubi elektrony” elektrofil zawiera w
swojej strukturze atom ubogi w elektrony i może tworzyć wiązanie w wyniku przyjęcia
(akceptacji) pary elektronów pochodzącej od nukleofila. Elektrofile często są naładowane
dodatnio.
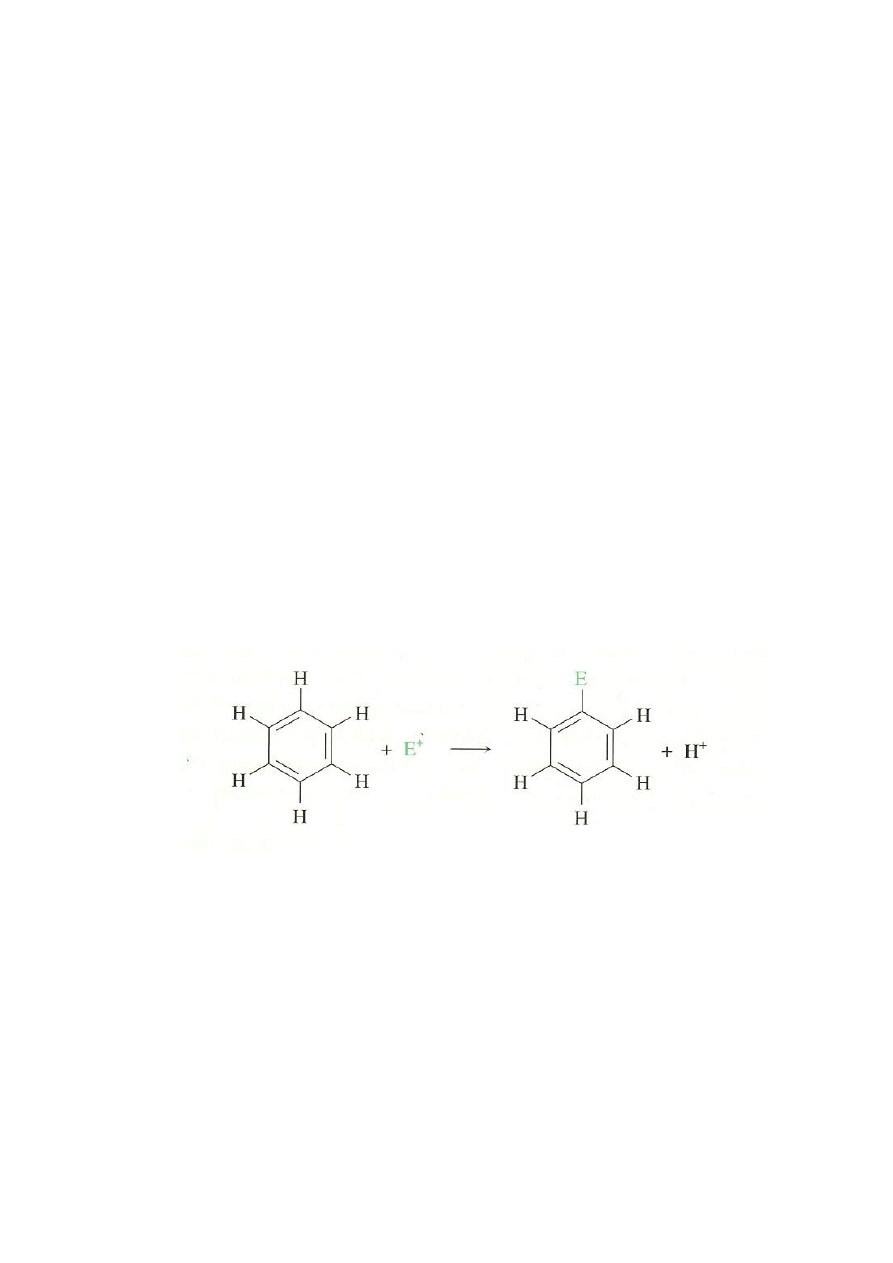
2. REAKCJA AROMATYCZNEJ SUBSTYTUCJI ELEKTROFILOWEJ
Reakcja aromatycznej substytucji elektrofilowej jest najważniejszą reakcją
związków aromatycznych. W reakcji tej elektrofil (E
+
) reaguje z pierścieniem aromatycznym
i podstawia jeden z atomów wodoru (rys.1).
Rys.1. Schemat reakcji aromatycznej substytucji elektrofilowej (wg 1).
Pierścień benzenowy, ze swoimi sześcioma elektronami
w cyklicznym układzie
sprzężonym, charakteryzuje się znaczną gęstością elektronową. Ponadto elektrony
benzenu
są sferycznie dostępne dla czynników atakujących za względu na swoje położenie poniżej i
powyżej płaszczyzny pierścienia. Z tego powodu benzen jest donorem elektronów
(nukleofilem) w większości swoich reakcji. Czynnikami atakującymi są elektrofile. Reakcje
substytucji elektrofilowej są reakcjami charakterystycznymi dla wszystkich pierścieni
aromatycznych. Zdolność związku do ulegania tej reakcji jest testem na jego aromatyczność.
W wyniku reakcji substytucji elektrofilowej do pierścienia aromatycznego można
wprowadzić różne podstawniki. Przykłady reakcji aromatycznej substytucji elektrofilowej
przedstawia rys.2.
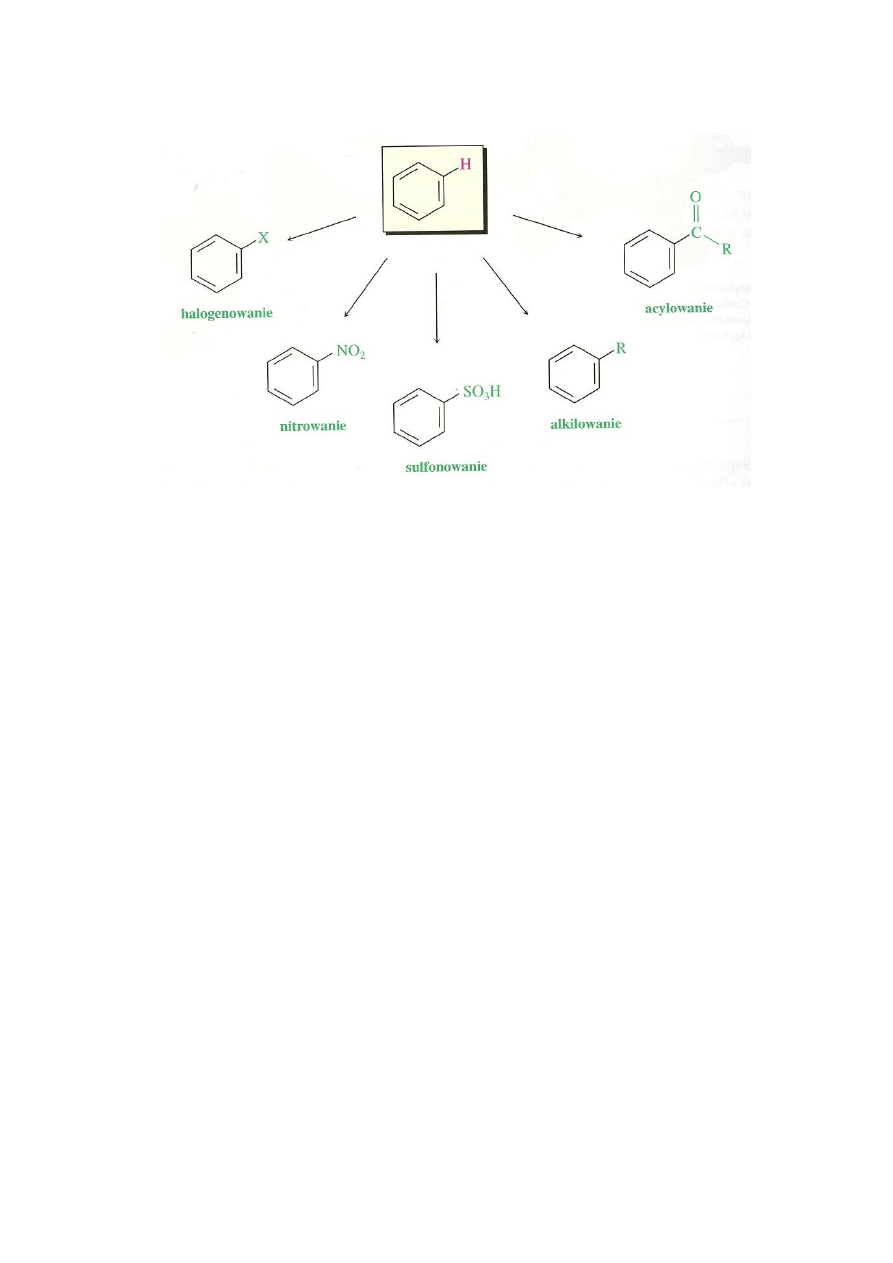
4
Rys.2. Przykłady reakcji aromatycznej substytucji elektrofilowej (wg 1).
Gdy reakcję substytucji elektroforowej przeprowadza się na podstawionym już
pierścieniu aromatycznym (np. toluenie) to grupa przyłączona do pierścienia (podstawnik)
wywiera wpływ na reaktywność pierścienia i orientację (kierunek) reakcji substytucji.
Grupa, która zwiększa reaktywność pierścienia w porównaniu z pierścieniem benzenu
nazywana jest grupą aktywującą. Wspólną cechą wszystkich grup aktywujących jest to, że
dostarczają one elektronów do pierścienia. Grupa, która zmniejsza reaktywność pierścienia w
porównaniu z pierścieniem benzenu nazywana jest grupą dezaktywującą. Wspólną cechą
wszystkich grup dezaktywujących jest to, że wyciągają one elektrony z pierścienia.
Charakter podstawnika już obecnego w pierścieniu benzenowym określa położenie
drugiego podstawnika (orientację reakcji) – trzy możliwe produkty dwupodstawione (orto,
meta, para), zazwyczaj nie tworzą się w równych ilościach. Niektóre grupy kierują następny
podstawnik przede wszystkim w położenia orto i para, natomiast inne w położenie meta.
Podstawniki można podzielić na trzy grupy: aktywujące kierujące w położenia orto i
para, dezaktywujące kierujące w położenia orto i para oraz dezaktywujące kierujące w
położenie meta. Nie są znane żadne grupy aktywujące kierujące w położenie meta. Wpływ
różnych grup (podstawników) na orientację (kierunek) reakcji aromatycznej substytucji
elektrofilowej przedstawia tablica 1.

5
Tablica 1. Efekt podstawnikowy w reakcji aromatycznej substytucji elektrofilowej (wg 2).
Reakcje elektrofilowej substytucji w pierścieniu aromatycznym, z punktu widzenia
przydatności do syntezy, nie mają odpowiadającej im klasy reakcji organicznych. Reakcje te
są wykorzystywane we wstępnym etapie złożonych syntez prowadzących do otrzymania
niemal wszystkich związków aromatycznych; umożliwiają one bezpośrednie wprowadzenie
określonych podstawników, które mogą być następnie wymienione (przez zastąpienie lub
przekształcenie) na inne podstawniki, a nawet na dodatkowe pierścienie aromatyczne.
Wychodząc jedynie z kilku prostych odczynników można otrzymać wiele tysięcy
podstawionych związków aromatycznych.
3. REAKCJA ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO
Alkilowanie, czyli przyłączanie grupy alkilowej do pierścienia benzenowego, jest jedną
z najbardziej użytecznych reakcji aromatycznej substytucji elektrofilowej. Charles Friedel
i James Crafts dowiedli, że pierścień benzenowy można alkilować w reakcji z chlorkiem
alkilu w obecności chlorku glinu jako katalizatora.
W reakcji alkilowania metodą Friedela-Craftsa elektrofilem jest karbokation R
+
.
Chlorek glinu/żelaza katalizuje reakcję, ułatwiając jonizację halogenku alkilu. Reakcję
kończy odszczepienie protonu. Mechanizm reakcji alkilowania metodą Friedela-Craftsa
przedstawia rys.3.

6
Rys.3. Mechanizm reakcji alkilowania metodą Friedela-Craftsa (wg.1).
Alkilowanie Friedela-Craftsa jest szeroko stosowane do syntezy alkilobenzenów,
metoda ta ma jednak następujące ograniczenia:
w reakcji tej można stosować jedynie halogenki alkilowe, natomiast halogenki
arylowe i winylowe nie reagują wcale ponieważ utworzenie karbokationów arylowych
i winylowych wymaga zbyt dużo energii, by mogło nastąpić w warunkach reakcji
Friedela-Craftsa
alkilowanie nie następuje w pierścieniach aromatycznych, które są podstawione
grupami silnie wyciągającymi elektrony (tab.1)
często trudno jest zatrzymać reakcję po zajściu pojedynczego podstawienia, ponieważ
gdy przy pierścieniu znajduje się pierwsza grupa alkilowa drugie podstawienie jest
ułatwione, dlatego często następuje polialkilowanie np. (wg.1):
reakcja benzenu z równoważną ilością 2-chloro-2-metylopropanu (chlorek tert-butylu)
daje jako produkt główny p-di-tert-butylobenzen i małą ilość tert-butylobenzenu oraz
nieprzereagowanego substratu. Wysokie wydajności produktu monoalkilowego
otrzymuje się jedynie wtedy, gdy użyje się dużego nadmiaru benzenu
7
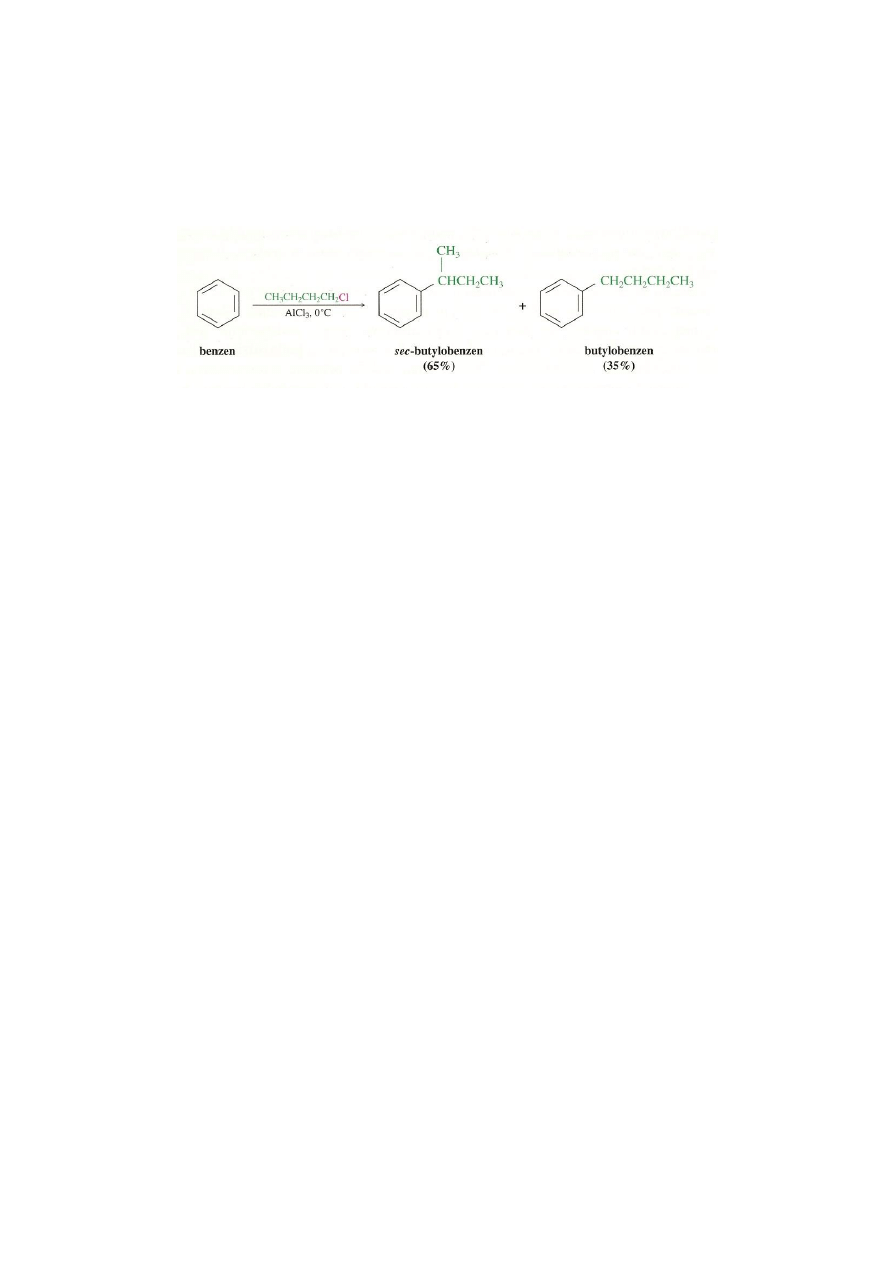
czasami w trakcie reakcji dochodzi do przegrupowania szkieletowego, szczególnie
wtedy gdy stosowane są pierwszorzędowe halogenki alkilu, zależy to również od
katalizatora, temperatury reakcji i rozpuszczalnika, w jakim reakcja jest prowadzona
np. (wg.1):
traktowanie benzenu 1-chlorobutanem w temp. 0
o
C, z zastosowaniem AlCl
3
jako
katalizatora, daje produkt z podstawnikiem przegrupowanym (sec-butylowym)
i nieprzegrupowanym (n-butylowym) w przybliżonym stosunku 2:1.
LITERATURA
[1] J. McMurry, Chemia organiczna, Wydawnictwo Naukowe PWN, Warszawa 2000.
[2] R.T. Morrison, R.N. Boyd, Chemia organiczna, Państwowe Wydawnictwo
Naukowe, Warszawa 1985.

8
PRZEBIEG ĆWICZENIA
Cel ćwiczenie
Celem ćwiczenia jest przeprowadzenie procesu alkilowania toluenu 2-chloro-2-
metylopropanem (chlorkiem tert-butylu), którego produktem jest (tert-butylo)toluen.
Odczynniki
1. Toluen
2. Chlorek tert-butylu (2-chloro-2-metylopropan)
3. Chlorek żelaza (III) bezw.
4. Chlorek wapnia bezw.
Aparatura
1. Kolba stożkowa
2. Kolba okrągłodenna
3. Chłodnica zwrotna
4. Mieszadło magnetyczne
5. Rozdzielacz
6. Cylinder miarowy
7. Chłodnica Liebiga
Wykonanie ćwiczenia
Reakcję wykonywać pod wyciągiem!!!
W kolbie stożkowej o poj. 250 ml zaopatrzonej w chłodnicę zwrotną i mieszadło
magnetyczne umieścić toluen (24,00 g; 27,
6 ml
) i chlorek tert-butylu (24,00 g;
28,2 ml). Mieszać przez 10 mimut w temp. pokojowej, a następnie dodać bezw.
chlorek żelaza III (0,3 g) i kontynuować mieszanie przez 45 min.
Produkt przenieść do rozdzielacza zawierającego wodę (100 ml), mieszać ruchem
wirowym nie zamykając rozdzielacza korkiem, a następnie oddzielić warstwę
organiczną, którą wytrząsa się z wodą (3x40 ml) i suszy bezw. chlorkiem wapnia.
Po usunięciu środka suszącego produkt destylować (chłodnica Liebiga) zbierając
frakcję o temp. wrzenia 190-195
o
C
Oznaczyć współczynnik załamania światła otrzymanego związku.
CH
3
CH
3
CH
3
+ CH
3
C
Cl
H
3
C
C
CH
3
+ HCl
CH
3
CH
3
toluen chlorek tert-bytylu (tert-butylo)toluen kwas solny
kat. FeCl
3

9
Wyszukiwarka
Podobne podstrony:
walendziewski, PODSTAWOWE PROCESY JEDNOSTKOWE W TECHNOLOGII CHEMICZNEJ L, fotogegradacja organicznyc
Procesy jednostkowe - egzamin 0, Technologia chemiczna PWR, SEMESTR V, Podstawowe procesy jednostkow
procesy 5lk, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chemicznego i aparatura,
18 Prowadzenie procesów jednostkowych w technologii
Podstawowe procesy jednostkowe, Dermatologia
Estry metylowe podstawionych kwasów benzoesowych, technologia chemiczna, chemia organiczna 2003,2004
18 Prowadzenie procesów jednostkowych w technologii
18 Prowadzenie procesów jednostkowych w technologii
wyplyw cieczy ze zbiornika, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chemiczne
wilk & steller, technologia chemiczna surowce i procesy przemysłu organicznego,podstawowe surowce n
Podstawy technologii chemicznej nowoczesne procesy utleniania
Podstawowe jednostki, Inżynieria chemiczna i procesowa
ELEKTROFILTR, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chemicznego i aparatura
Procesy obliczenia do 10 pomiaru1, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu ch
pomiar natezenia przeplywu gazu, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chem
wyplyw cieczy ze zbiornika poprwione moje, Technologia chemiczna, 5 semestr, Podstawowe procesy prze
Wyplyw cieczy ze zbiornika poprwione do końca, Technologia chemiczna, 5 semestr, Podstawowe procesy
więcej podobnych podstron