
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
FLUOROWCOZWIĄZKI
3 godz.
Halogenki alkilowe
- fluorowcozwiązki, w których atom fluorowca jest związany z
atomem węgla o hybrydyzacji sp
3
.
1.
Klasyfikacja ze względu na budowę fragmentu alkilowego
Pierwszorzędowe (1°), np. 1-chlorobutan
Drugorzędowe (2°), np. 2-bromobutan
Trzeciorzędowe (3°), np. 2-jodo2-metylopropan
Allilowe: 1° (np. chlorek allilu), 2° (np. 3-chlorobut-1-en), 3° (np. 3-chloro-3-
metylopent-1-en)
Benzylowe: 1° (np. chlorek benzylu), 2° (np. 1-bromo-1-fenyloetan), 3° (np. 3-
benzylo-3-fluoropropan)
2.
Nomenklatura
3.
Metody otrzymywania
3.1.
Elektrofilowa addycja halogenowodoru (HX) lub halogenu (X
2
) do alkenów
(zgodnie z regułą Markownikowa) na przykładzie addycji:
HCl do 1-metylocykloheksenu
Br
2
do cykloheksenu
HI do heks-1-enu
3.2.
Rodnikowa addycja bromowodoru do alkenów w obecności nadtlenków
(niezgodnie z regułą Markownikowa) na przykładzie addycji:
HBr do bromku allilu w obecności nadtlenku benzoilu
HBr do 2-bromopropenu w obecności nadtlenku benzoilu
3.3.
Reakcje alkoholi z halogenowodorami (HX); X = Cl, Br, I
Reaktywność alkoholi: 3° > 2° > 1°
Reaktywność HX: HI > HBr > HCl
3.3.a.
Otrzymywanie bromków z alkoholi o różnej rzędowości na przykładzie reakcji
butan-1-olu z HBr(stęż.)
3.3.b.
Otrzymywanie chlorków z:
Alkoholu 1°, na przykładzie reakcji butan-1-olu z mieszaniną
HCl(stęż.)/ZnCl
2
(bezwodny)
Alkoholu 2°, na przykładzie reakcji cykloheksanolu z mieszaniną
HCl(stęż.)/CaCl
2
(bezwodny)
Alkoholu 3°, na przykładzie reakcji alkoholu t-butylowego z HCl(stęż.)
3.3.c.
Otrzymywanie jodków na przykładzie reakcji alkoholu izobutylowego lub sec-
butylowego z HI(stęż.)
3.4.
Reakcje alkoholi z chlorowcowymi pochodnymi siarki i fosforu
3.4.a.
Reakcje alkoholi 1° z chlorkiem tionylu (SOCl
2
) na przykładzie reakcji propan-1-
olu
3.4.b.
Reakcje alkoholi 1° i 2° z halogenkami fosforu: PX
3
(X = Cl, Br, I) lub PX
5
(X =
Cl, Br), na przykładzie reakcji:
Alkoholu propylowego z PBr
3
Cykloheksanolu z I
2
/P(czerwony)
Cykloheksylometanolu z PCl
5
3.5.
Reakcje wymiany halogenu: Cl (lub Br) na I oraz Cl (lub Br) na F na przykładzie
reakcji:
3.5.a.
Chlorku allilu z NaI/aceton
3.5.b.
1-Bromo-3-metylobutanu z NaI/aceton
3.5.c.
Bromku heksylu z KF
1
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
4.
Reakcja substytucji nukleofilowej (schemat ogólny)
Nu – nukleofil; cząsteczka obojętna lub ujemnie naładowana, posiadająca
wolne elektrony, dzięki którym tworzy wiązanie z atomem węgla obdarzonym
całkowitym lub cząstkowym ładunkiem dodatnim; nukleofile często wykazują
również właściwości zasadowe, tj. mają zdolność do odrywania protonów.
4.1.
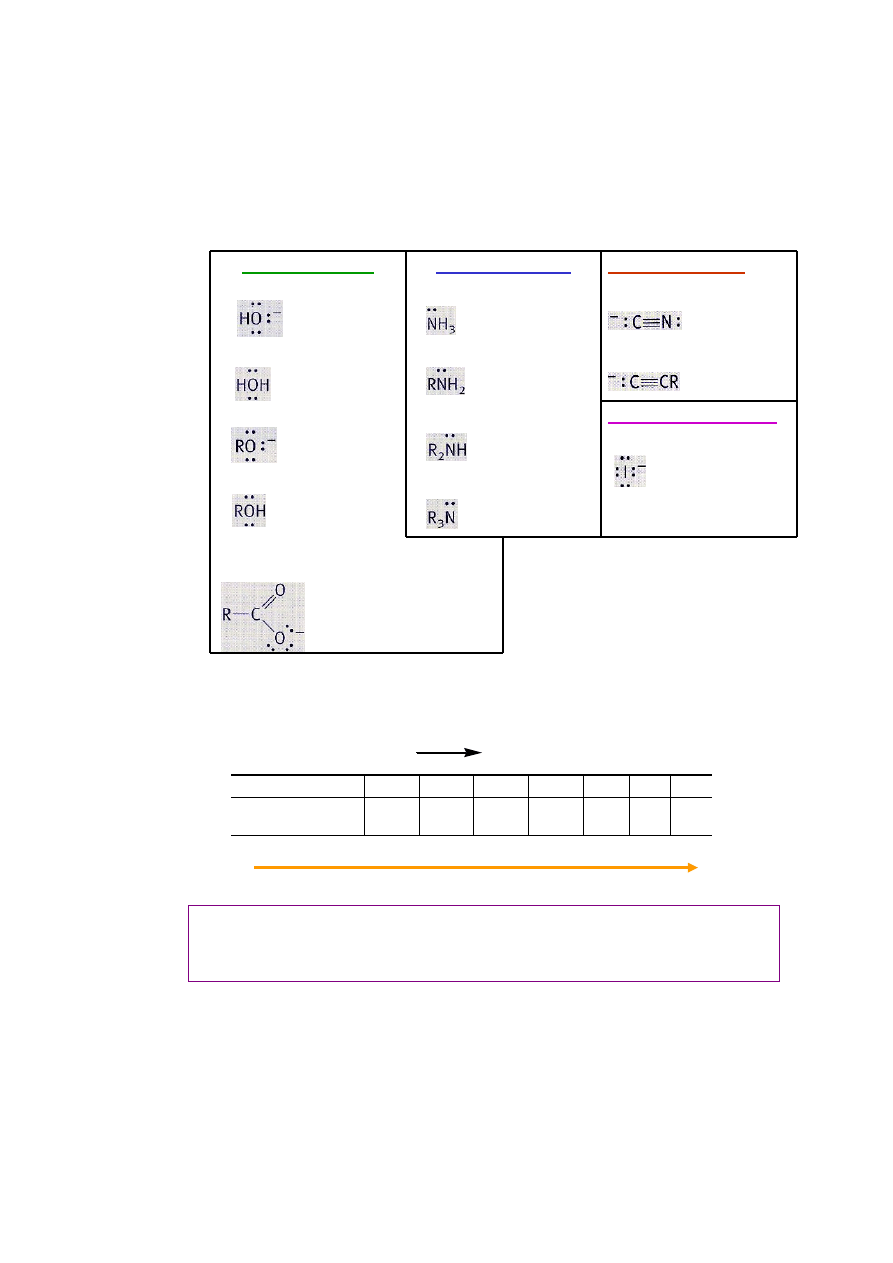
Nukleofile – klasyfikacja
Nie można podać Nie można podać uniwersalnego szeregu reaktywności
nukleofili; można tylko porównywać względne szybkości reakcji tego samego
halogenku alkilowego w różnymi nukleofilami w tych samych warunkach:
4.1.a.
Prawidłowości zaobserwowane eksperymentalnie:
2
Nukleofile węglowe
Nukleofile azotowe
Nukleofile tlenowe
R
1
-O-C(O)R
estry
sole kwasów
karboks.
jodki
alkilowe
4
°
sole
amoniowe
aminy 3
°
alkohole
Nukleofile halogenkowe
jodki
R
1
-I
R
1
-NHR
2
aminy 3
°
aminy 2
°
R
1
-O-R
etery
R
1
-O-R
etery
alkoholany
R
1
-C
≡
CR
alkiny
acetylenki
R
1
-NHR
aminy 2
°
aminy 1
°
woda
R
1
-CN
nitryle
cyjanki
R
1
-NH
2
aminy 1
°
amoniak
R
1
-OH
alkohole
R
1
-OH
alkohole
wodorotlenki
Nukleofile węglowe
Nukleofile azotowe
Nukleofile tlenowe
R
1
-O-C(O)R
estry
sole kwasów
karboks.
jodki
alkilowe
4
°
sole
amoniowe
aminy 3
°
alkohole
Nukleofile halogenkowe
jodki
R
1
-I
R
1
-NHR
2
aminy 3
°
aminy 2
°
R
1
-O-R
etery
R
1
-O-R
etery
alkoholany
R
1
-C
≡
CR
alkiny
acetylenki
R
1
-NHR
aminy 2
°
aminy 1
°
woda
R
1
-CN
nitryle
cyjanki
R
1
-NH
2
aminy 1
°
amoniak
R
1
-OH
alkohole
R
1
-OH
alkohole
wodorotlenki
3
1
R
N
R
⊕
−
CH
3
Br + Nu CH
3
−
Nu + Br
−
1
700
16000
25000
100000
125000
125000
Względna szybkość
reakcji
H
2
O
NH
3
OH
−
CH
3
O
−
I
−
CN
−
HS
−
Nu
1
700
16000
25000
100000
125000
125000
Względna szybkość
reakcji
H
2
O
NH
3
OH
−
CH
3
O
−
I
−
CN
−
HS
−
Nu
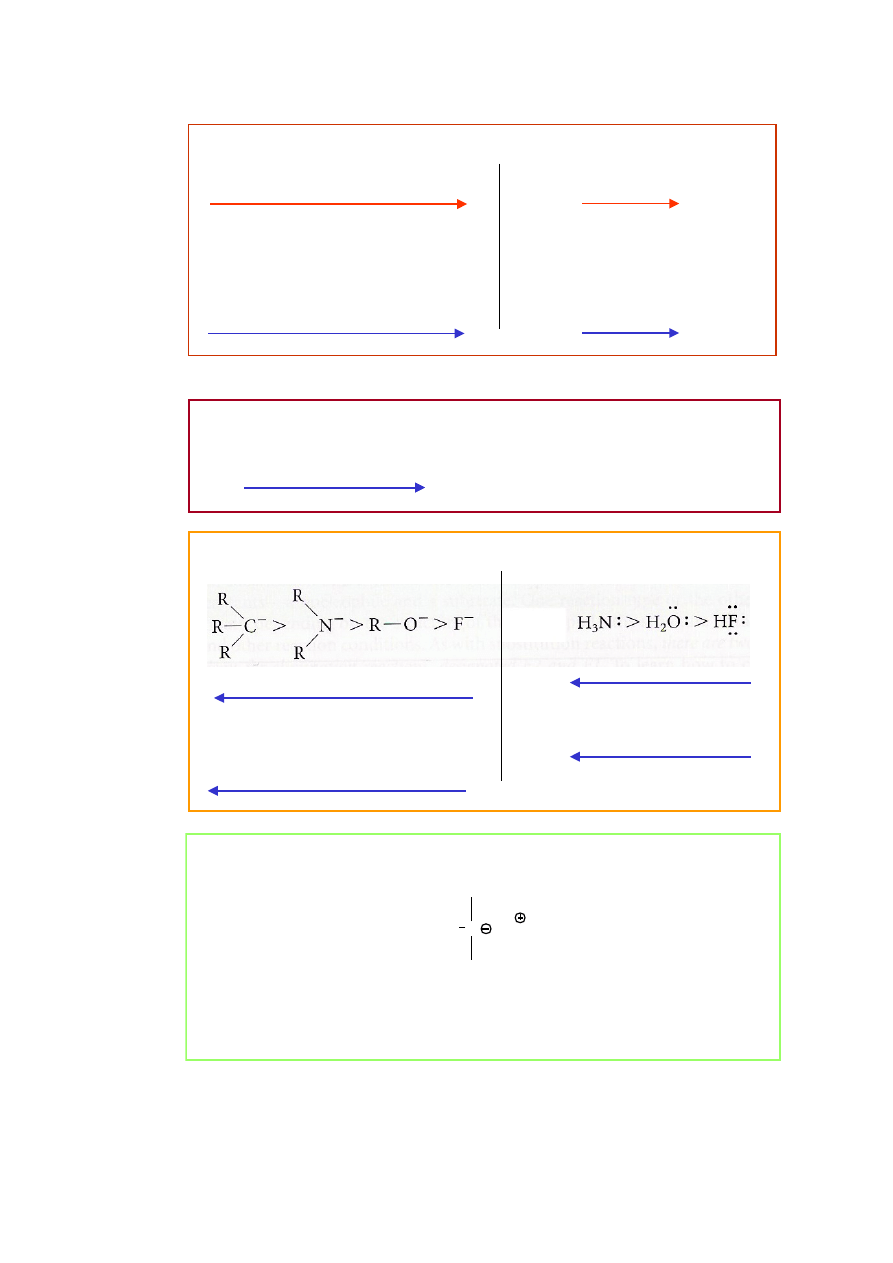
spadek szybkości reakcji
* Aniony są bardziej nukleofilowe niż ich sprzężone kwasy.
OH
−
> HOH
RO
−
> ROH
H
2
N
−
> NH
3
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
nukleofile
3
* Nukleofilowość nukleofili tego samego pierwiastka jest zgodna z jego
zasadowością.
H
3
O
+
> CH
3
CO
2
H > H
2
O > CH
3
OH
spadek mocy sprzężonego kwasu
H
4
N
+
> H
3
N
spadek mocy sprzężonego kwasu
wzrost mocy zasady
wzrost mocy nuklofila
H
2
O < CH
3
CO
2
−
< OH
−
< CH
3
O
−
ponieważ:
wzrost mocy zasady
wzrost mocy nuklofila
H
3
N < H
2
N
−
ponieważ:
*
W grupie układu okresowego nukleofilowość nukleofili rośnie od góry do
dołu.
*
W okresie układu okresowego nukleofilowość nukleofili jest zgodna z ich
zasadowością.
wzrost mocy nukleofila
wzrost mocy nukleofila
F
−
<
Cl
−
<
Br
−
<
I
−
(w rozpuszczalnikach protonowych,
tj. posiadających grupy OH)
wzrost mocy nukleofila
F
−
<
Cl
−
<
Br
−
<
I
−
(w rozpuszczalnikach protonowych,
tj. posiadających grupy OH)
wzrost mocy nukleofila
F
−
<
Cl
−
<
Br
−
<
I
−
(w rozpuszczalnikach protonowych,
tj. posiadających grupy OH)
wzrost mocy zasady
wzrost mocy nuklofila
R
3
C-H < R
2
N-H < RO-H < HF
spadek mocy sprzężonego kwasu
ponieważ:
spadek mocy kwasu
ponieważ:
*
Dodatek substancji solwatujących kationy zwiększa szybkość ataku nukleofila.
Szybkość ataku w benzenie
bez dodatku CH
3
O-CH
2
CH
2
-OCH
3
<
z dodatkiem CH
3
O-CH
2
CH
2
-OCH
3
C
C O
2
Et
H
9
C
4
C O
2
Et
N a

Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
.
5.
Reakcja eliminacji (schemat ogólny)
Reakcja eliminacji zawsze towarzyszy reakcji substytucji nukleofilowej; dzięki
zastosowaniu odpowiednich warunków reakcji, można spowodować, że
przeważa tylko jedna z tych reakcji.
6.
Przykłady reakcji halogenków alkilowych z różnymi nukleofilami – zależność
przebiegu reakcji od budowy organicznego fragmentu halogenku alkilowego,
rodzaju nukleofila, użytego rozpuszczalnika, temperatury reakcji i innych
warunków na przykładzie reakcji:
6.1.
Halogenku 1° (1-bromobutanu) lub 3° (2-bromo-2-metylopropanu) z nukleofilem
obdarzonym ładunkiem (CN
−
).
6.2.
Halogenku 3° (2-bromo-2-metylopropanu) z nukleofilem obdarzonym ładunkiem
(OH
−
)
lub z nukleofilem pozbawionym ładunku (H
2
O).
7.
Mechanizmy reakcji substytucji nukleofilowej
7.1.
Mechanizm i cechy charakterystyczne reakcji substytucji nukleofilowej
dwucząsteczkowej (symbol S
N
2) - proces jednoetapowy; w kluczowym etapie
reakcji bierze udział cząsteczka nukleofila i halogenku alkilowego
7.1.a.
Cechy charakterystyczne reakcji S
N
2:
Szybkość reakcji zależy od stężenia obu reagentów: nukleofila oraz halogenku
alkilowego; np. dwukrotne zwiększenie stężenia wodorotlenku lub bromku
etylu spowoduje dwukrotny wzrost szybkości reakcji.
Reakcja przebiega z inwersją (odwróceniem) konfiguracji, na przykładzie
reakcji (R)-2-bromobutanu z wodorotlenkiem.
Reakcja przebiega szybciej, gdy grupa alkilowa w substracie jest metylowa lub
pierwszorzędowa (1°) i wolniej, gdy jest trzeciorzędowa (3°); halogenki
drugorzędowe (2°) reagują z pośrednią szybkością.
Szereg reaktywności halogenków:
Rozpuszczalniki protonowe (posiadające grupy OH) utrudniają przebieg
reakcji.
Rozpuszczalniki
aprotonowe
(dimetylosulfotlenek,
DMSO;
dimetyloformamid, DMF; acetonitryl, CH
3
CN) sprzyjają reakcji S
N
2 –
rozpuszczają wiele soli, których aniony są nukleofilami.
7.2.
Mechanizm substytucji nukleofilowej jednocząsteczkowej (symbol S
N
1) - proces
dwuetapowy; w kluczowym etapie reakcji następuje samorzutna jonizacja
halogenku alkilowego
4
−
I >
−
Br >
−
Cl >
−
F
wzrost szybkości reakcji
*
Nukleofile często wykazują właściwości zasadowe, tj. mają zdolność do drywania
protonów
Zasadowość:
(CH
3
)
3
C
−
>
CH
3
CH
2
O
−
Nukleofilowość:
(CH
3
)
3
C
−
<
CH
3
CH
2
O
−
*
Wyjątki od reguły: mocniejsza, ale większa przestrzennie zasada jest słabszym
nukleofilem niż zasada słabsza, ale mniejsza przestrzennie.

Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
7.2.a.
Cechy charakterystyczne reakcji S
N
1:
Szybkość reakcji zależy od szybkości jonizacji halogenku alkilowego, a nie
zależy od stężenia nukleofila, ponieważ nie bierze on udziału w tym etapie
reakcji..
Jeśli atom halogenu w halogenku alkilowym jest przyłączony do
asymetrycznego atomu węgla, to produkt reakcji powstaje w postaci
mieszaniny racemicznej, tj. równomolowej mieszaniny dwóch enancjomerów
(na przykładzie reakcji (R)-3-bromo-3-metyloheksanu z wodą).
Reakcja przebiega szybciej w przypadku halogenków trzeciorzędowych (3°) i
wolniej w przypadku halogenków pierwszorzędowych (1°); wiąże się to z
trwałością powstających karbokationów - im szybciej powstaje dany
karbokation, tym szybciej zachodzi reakcja: 3°, 2° allilowe; 3°, 2° benzylowe;
3° alifatyczne > 2° alifatyczne > 1° alifatyczne > CH
3
+
.
Rozpuszczalnikami odpowiednimi do prowadzenia reakcji są rozpuszczalniki
protonowe (zawierające grupy OH): woda, alkohole, kwasy karboksylowe;
jeżeli rozpuszczalnik jednocześnie pełni rolę nukleofila, to mówimy o reakcji
solwolizy (od ang. solvent = rozpuszczalnik).
8.
Mechanizmy reakcji eliminacji
8.1.
Mechanizm eliminacji dwucząsteczkowej (symbol E2) - reakcja jednoetapowa;
szybkość powstawania alkenu zależy od stężenia halogenku alkilowego i od
stężenia zasady
Atom wodoru ulegający eliminacji i atom halogenu muszą znajdować się w
konformacji antyperiplanarnej
Produkty zgodne z regułą Zajcewa powstają w przewadze, na przykładzie
eliminacji 2-bromobutanu
8.2.
Mechanizm eliminacji jednocząsteczkowej (symbol E1) na przykładzie hydrolizy
2-chloro-2-metylopropanu
9.
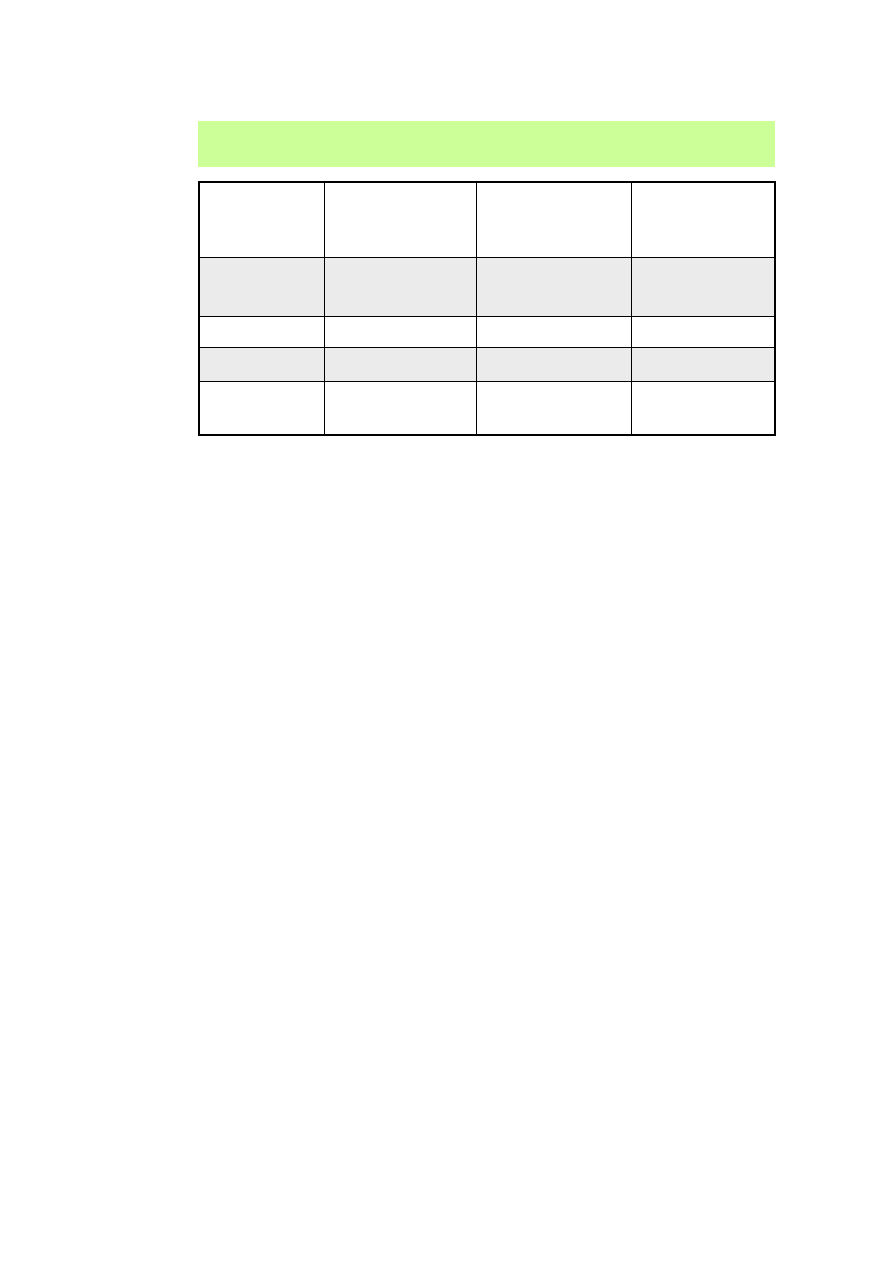
Współzawodnictwo między reakcją substytucji a reakcją eliminacji –
Halogenki 1° - z większością nukleofili reagują wg mechanizmu S
N
2, ale w
przypadku silnych i dużych objętościowo zasad przeważa eliminacja E2; na
przykładzie reakcji 1-bromobutanu z etanolanem sodu lub t-butanolanem sodu.
Halogenki 2° mogą reagować wg wszystkich mechanizmów substytucji
nukleofilowej (S
N
2 i S
N
1) i eliminacji (E2 i E1); na przykładzie reakcji 2-
bromopropanu z tioetanolanem sodu, etanolem lub etanolanem sodu.
Halogenki 3° mogą ulegać podstawieniu tylko słabymi nukleofilami wg
mechanizmu S
N
1; towarzyszy temu eliminacja E1; w reakcji z silnymi
nukleofilami ulegają eliminacji E2; na przykładzie reakcji bromku t-butylu z
metanolem lub worotlenkiem.
5
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
Halogenki winylowe
- fluorowcozwiązki, w których atom fluorowca jest związany z
alifatycznym atomem węgla o hybrydyzacji sp
2
(przykłady:
chlorek winylu, 2-bromopropen, 1-jodocyklopentan).
1.
Metody otrzymywania
1.1.
Elektrofilowa addycja halogenowodoru (HX) do alkinów (zgodnie z regułą
Markownikowa), na przykładzie addycji HBr do heks-1-ynu.
1.2.
Rodnikowa addycja HBr do alkinów (w obecności nadtlenków; niezgodnie z regułą
Markownikowa), na przykładzie addycji HBr do heks-1-ynu.
2.
Reaktywność - nie ulegają reakcji substytucji nukleofilowej w żadnych
warunkach; silne zasady mogą eliminować z nich halogenowodór - wykorzystuje
się tę reakcję do syntezy alkinów; na przykładzie otrzymywania but-1-ynu z 1,2-
dibromobutanu.
Halogenki arylowe
– fluorowcozwiązki, w których atom fluorowca jest związany z
aromatycznym atomem węgla o hybrydyzacji sp
2
(Przykłady: p-
chlorotuluen, o-jodonitrobenzen, m-fluorofenol, bromobenzen).
1.
Reaktywność:
1.1.
Podstawienie fluorowca w halogenkach posiadających podstawniki silnie
elektronoakceptorowe (np. NO
2
) w pozycjach orto i/lub para
•
Zwiększenie ilości grup NO
2
sprawia, że reakcja zachodzi w coraz
łagodniejszych warunkach; porównanie reaktywności p-chloronitrobenzenu,
2,4-dinitrochlorobenzenu i 2,4,6-trinitrochlorobenzenu.
1.2.
Podstawienie fluorowca w halogenkach nie posiadających podstawników
elektronoakceptorowych- reakcja przebiega tylko w ostrych warunkach (wysoka
temperatura, wysokie ciśnienie) lub z udziałem bardzo silnych zasad i dlatego
może być stosowana tylko w przemyśle; na przykładzie otrzymywania p-krezolu i
m-krezolu z p-chlorotoluenu.
6
Współzawodnictwo między reakcją substytucji a reakcją eliminacji -
podsumowanie
S
N
1/E1
(1
° ,
2° i 3
°
)
E2 (3
°
)
S
N
2 (1
°
i 2
°
)
Allilowy
Benzylowy
S
N
1/E1
E2
E2
Alifatyczny 3
°
S
N
1/E1
E2
S
N
2/E2
Alifatyczny 2
°
nie reagują
S
N
2 (KOH)
E2 (tert-BuOK)
S
N
2/E2
Alifatyczny 1
°
Słaby
Nu
, słaba
B
np. H
2
O, alkohol
Silna zasada (
B
)
np. KOH w etanolu,
tert-BuOK
Silny
Nu
np. NaOH w H
2
O
CN
−
, N
3
−
Halogenek
S
N
1/E1
(1
° ,
2° i 3
°
)
E2 (3
°
)
S
N
2 (1
°
i 2
°
)
Allilowy
Benzylowy
S
N
1/E1
E2
E2
Alifatyczny 3
°
S
N
1/E1
E2
S
N
2/E2
Alifatyczny 2
°
nie reagują
S
N
2 (KOH)
E2 (tert-BuOK)
S
N
2/E2
Alifatyczny 1
°
Słaby
Nu
, słaba
B
np. H
2
O, alkohol
Silna zasada (
B
)
np. KOH w etanolu,
tert-BuOK
Silny
Nu
np. NaOH w H
2
O
CN
−
, N
3
−
Halogenek
Document Outline
- Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
- FLUOROWCOZWIĄZKI 3 godz.
Wyszukiwarka
Podobne podstrony:
dyd k2c r id 144871 Nieznany
DYD 2012 id 144884 Nieznany
dyd inz1d id 144848 Nieznany
dyd k3c r id 144875 Nieznany
dyd k2c r id 144871 Nieznany
dyd inz e05 id 144824 Nieznany
dyd inz e02 id 144818 Nieznany
dyd inz e08 id 144830 Nieznany
dyd inz e03 id 144820 Nieznany
dyd szcz tematy id 144878 Nieznany
dyd inz e05 id 144824 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
więcej podobnych podstron