ROZWI¥ZANIA ZADAÑ I SCHEMAT OCENIANIA
Numer
zadania
Przewidywana odpowiedŸ
Punktacja
za
czynnoϾ
suma-
rycznie
1
A
Typ hybrydyzacji atomu azotu — sp
3
1 p.
5 p.
B
Liczba wi¹zañ chemicznych — 3
1 p.
C
Liczba i rodzaj orbitali molekularnych — 4 orbitale molekularne typu
s
1 p.
D
K¹t pomiêdzy wi¹zaniami H
ÔNÔH — oko³o 107°
1 p.
E
Kszta³t przestrzenny cz¹steczki — piramidalny
1 p.
2
Obliczenia:
2 p.
4 p.
N
2
H
2
NH
3
c
r
, mol/dm
3
0,5
2,5
3
c
mol
, mol/dm
3
0,5 + 1,5 = 2
2,5 + 4,5 = 7
0
Stê¿enie pocz¹tkowe azotu wynosi 2 mol/dm
3
.
1 p.
Stê¿enie pocz¹tkowe wodoru wynosi 7 mol/dm
3
.
1 p.
3
A
NH
4
NO
3
+ H
2
O
Ü HNO
3
+ NH
3
+ H
2
O
NH
4
+
+ H
2
O
Ü NH
3
+ H
3
O
+
2 · 1 p.
6 p.
B
CH
3
COONH
4
+ H
2
O
Ü CH
3
COOH + NH
3
+ H
2
O
CH
3
COO
–
+ NH
4
+
+ H
2
O
Ü CH
3
COOH + NH
3
+H
2
O
2 · 1 p.
C
KNO
2
+ H
2
O
Ü KOH + HNO
2
NO
2
–
+ H
2
O
Ü OH
–
+ HNO
2
2 · 1 p.
4
A
Równanie reakcji:
2 HNO
3
+ Ca(OH)
2
Û Ca(NO
3
)
2
+ 2 H
2
O
1 p.
4 p.
B
Obliczenia:
Obliczenie liczby moli Ca(OH)
2
zawartych w 50 cm
3
0,3-molowego roztworu
(n
Ca(OH)
2
= 0,015 mola Ca(OH)
2
)
1 p.
Obliczenie liczby moli HNO
3
, jaka jest potrzebna do zobojêtnienia 0,015 mola
Ca(OH)
2
(n
HNO
3
= 0,03 mola HNO
3
)
1 p.
Obliczenie objêtoœci 0,5-molowego roztworu HNO
3
, w której znajduje siê 0,03
mola HNO
3
(V = 60 cm
3
)
1 p.
5
A
Probówka I:
3 Cu + 8 HNO
3
Û 3 Cu(NO
3
)
2
+ 2 NO
+ 4 H
2
O
2 p.
7 p.
Probówka II:
3 Pb + 8 HNO
3
Û 3 Pb(NO
3
)
2
+ 2 NO
+ 4 H
2
O
1 p.
Probówka III:
Al + HNO
3
Û reakcja nie zachodzi
1 p.
Probówka IV:
Ag + 2 HNO
3
Û AgNO
3
+ NO
2
+ H
2
O
1 p.
B
Bezbarwny gaz wydziela siê w probówkach I i II.
2 · 0,5 p.
Brunatny gaz wydziela siê w probówce IV.
1 p.
www.wsip.com.pl
1

Numer
zadania
Przewidywana odpowiedŸ
Punktacja
za
czynnoϾ
suma-
rycznie
6
A
Równania reakcji:
1 p.
4p.
1 p.
1 p.
B
W parownicy pozosta³ tlenek miedzi(II) CuO.
1 p.
7
A
Równania reakcji:
1.
1 p.
14 p.
2. SO
3
+ H
2
O
Û H
2
SO
4
1 p.
3. H
2
SO
4
+ Ca(OH)
2
Û CaSO
4
+ 2 H
2
O
1 p.
4. Cu + 2 H
2
SO
4
Û CuSO
4
+ SO
2
+ 2 H
2
O
1 p.
5. SO
2
+ NaOH
Û NaHSO
3
1 p.
6. NaHSO
3
+ NaOH
Û Na
2
SO
3
+ H
2
O
1 p.
7. Na
2
SO
3
+ H
2
SO
4
Û Na
2
SO
4
+ SO
2
+ H
2
O
1 p.
8. SO
3
+ 2 NaOH
Û Na
2
SO
4
+ H
2
O
1 p.
9. H
2
S + Cu(NO
3
)
2
Û CuS¯ + 2 HNO
3
1 p.
10. CuS + O
2
Û Cu + SO
2
1 p.
11. 2 H
2
S + 3 O
2
Û 2 SO
2
+ 2 H
2
O
1 p.
B
Reakcje utleniania–redukcji: 1, 4, 10, 11
4 · 0,5 p.
8
A
Równanie reakcji
H
2
S + Pb(NO
3
)
2
Û PbS¯ + 2 HNO
3
1 p.
4 p.
B
Obliczenia:
Obliczenie liczby moli Pb(NO
3
)
2
, jaka znajduje siê w 100 cm
3
0,1-molowego
roztworu tej soli (n
Pb(NO )
3 2
= 0,01 mola Pb(NO
3
)
2
)
1 p.
Obliczenie liczby moli H
2
S, jaka jest potrzebna do ca³kowitego str¹cenia jonów
o³owiu(II) w postaci PbS z roztworu (n
H S
2
= 0,01 mola H
2
S)
1 p.
Obliczenie objêtoœci H
2
S, jak¹ zajmuje 0,01 mola H
2
S (V = 0,224 dm
3
)
1 p.
9
A
K
2
Cr
2
O
7
+ 3 H
2
S + 4 H
2
SO
4
Û K
2
SO
4
+ Cr
2
(SO
4
)
3
+ 3 S + 7 H
2
O
(je¿eli wspó³czynniki stechiometryczne równania nie s¹ prawid³owe, a wzory
wszystkich reagentów zosta³y napisane prawid³owo)
(je¿eli wspó³czynniki stechiometryczne równania nie s¹ prawid³owe i co naj-
mniej 1 wzór reagenta zosta³ napisany b³êdnie)
2 p.
(1 p.)
(0 p.)
2 · 1 p.
6 p.
B
(NH
4
)
2
CO
3
+ H
2
SO
4
Û (NH
4
)
2
SO
4
+ CO
2
+ H
2
O
CO
3
2–
+ 2 H
+
Û CO
2
+ H
2
O
2 · 1 p.
2
T
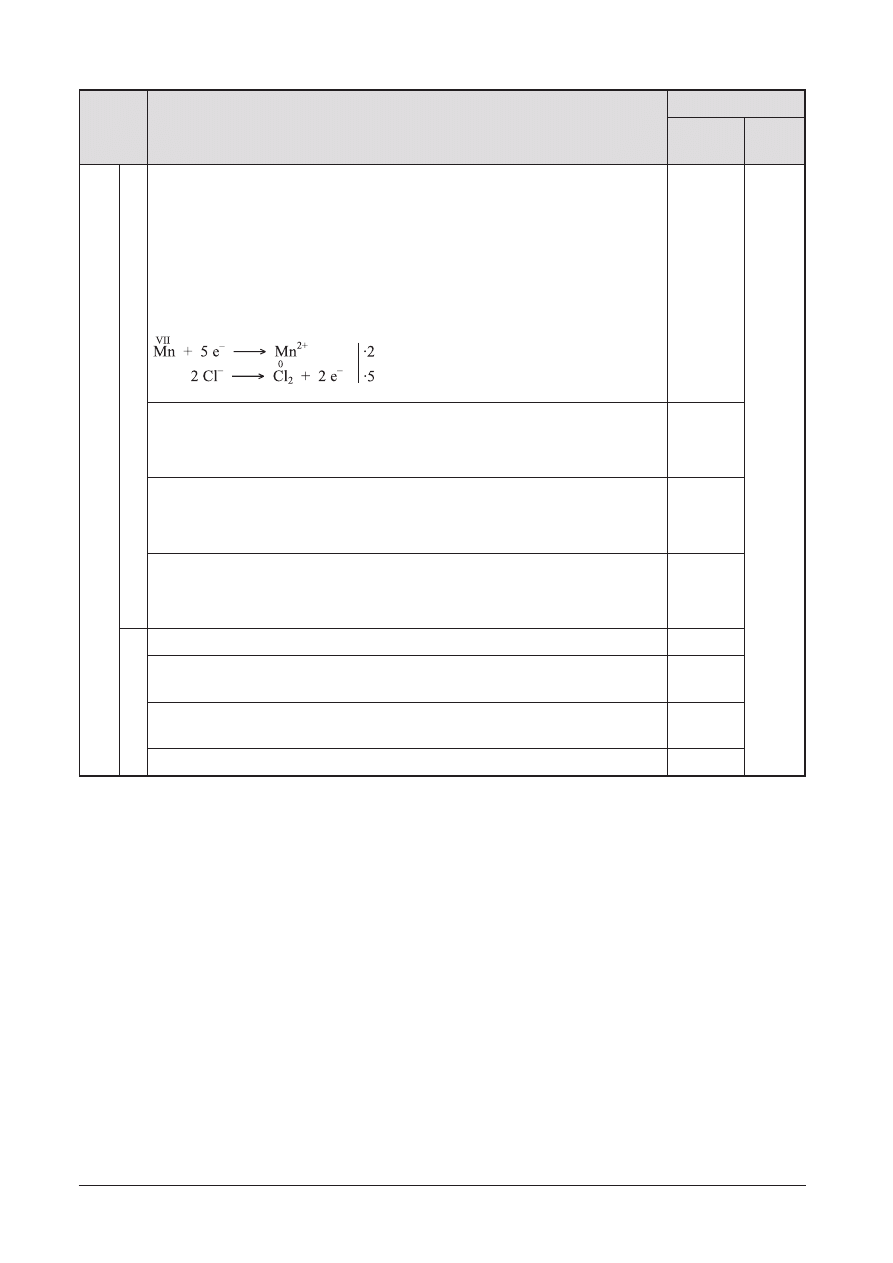
Numer
zadania
Przewidywana odpowiedŸ
Punktacja
za
czynnoϾ
suma-
rycznie
10
A
Równania reakcji:
Probówka I:
2 KMnO
4
+ 16 HCl
Û 2 KCl + 2 MnCl
2
+ 5 Cl
2
+ 8 H
2
O
(je¿eli wspó³czynniki stechiometryczne równania nie s¹ prawid³owe, a wzory
wszystkich reagentów zosta³y napisane prawid³owo)
(je¿eli wspó³czynniki stechiometryczne równania nie s¹ prawid³owe i co naj-
mniej 1 wzór reagenta zosta³ napisany b³êdnie)
2 p.
(1 p.)
(0 p.)
2 · 1 p.
14 p.
Probówka II:
K
2
CO
3
+ 2 HNO
3
Û 2 KNO
3
+ CO
2
+ H
2
O
CO
3
2–
+ 2 H
+
Û CO
2
+ H
2
O
2 · 1 p.
Probówka III:
Zn + H
2
SO
4
Û ZnSO
4
+ H
2
Zn + 2 H
+
Û Zn
2+
+ H
2
2 · 1 p.
Probówka IV:
K
2
S + 2 HCl
Û 2 KCl + H
2
S
S
2–
+ 2 H
+
Û H
2
S
2 · 1 p.
B
Bezbarwny, bezwonny, niepalny gaz wydziela siê w probówce II.
1 p.
Bezbarwny, bezwonny, palny gaz, tworz¹cy mieszaninê piorunuj¹c¹ z tlenem
wydziela siê w probówce III.
1 p.
Bezbarwny gaz o nieprzyjemnym zapachu zepsutych jaj wydziela siê w probów-
ce IV.
1 p.
¯ó³tozielony gaz wydziela siê w probówce I.
1 p.
www.wsip.com.pl
3
Wyszukiwarka
Podobne podstrony:
arkusz 3 03
arkusz 4 03
arkusz 8 03
arkusz 9 03
arkusz 7 03
arkusz 1 03
arkusz 2 03
arkusz 6 03
312[01] 03 122 Arkusz egzaminacyjny
arkusz kalkulacny technilogia V sem, do uczenia, materialy do nauczania, rok2009 2010, 03.01.10
03, PP, arkusz
312[01] 03 122 Arkusz egzaminac Nieznany (2)
514[03] 01 121 Arkusz egzaminacyjny
KVIab14.03-TWORZYMY ARKUSZ KALKULACYJNY, Konspekty dydaktyka
Tworzenie wykresów w arkuszu kalkulacyjnym EXCEL, do uczenia, materialy do nauczania, rok2010-2011,
KVIa09.03- ARKUSZ KALKULACYJNY CD., Konspekty dydaktyka
ARKUSZ SAMOOCENY NAUCZYCIELA, 03. DLA NAUCZYCIELI
więcej podobnych podstron