ROZWI¥ZANIA ZADAÑ I SCHEMAT OCENIANIA
Numer
zadania
Przewidywana odpowiedŸ
Punktacja
za
czynnoϾ
suma-
rycznie
1
Wzór
sumaryczny
H
2
S
SO
2
SO
3
2–
H
2
SO
4
HSO
4
–
Na
2
S
2
O
3
7 · 1 p.
7 p.
Stopieñ
utlenienia
–II
IV
IV
VI
VI
–II i VI
2
Wzór
sumaryczny
NH
4
+
NO
2
Ca(NO
3
)
2
NO
3
–
KNO
2
NH
4
NO
3
7 · 1 p.
7 p.
Stopieñ
utlenienia
–III
IV
V
V
III
–III i V
3
Utleniaczem jest kwas azotowy(V), a reduktorem — siarczek miedzi(I).
Za wskazanie utleniacza i reduktora.
2 · 1 p.
2 p.
Za wskazanie tylko utleniacza lub reduktora.
1 p.
4
W reakcji A siarka pe³ni rolê utleniacza.
1 p.
4 p.
W reakcji B siarka pe³ni rolê reduktora.
1 p.
W reakcji C siarka pe³ni rolê reduktora.
1 p.
W reakcji D siarka pe³ni rolê utleniacza.
1 p.
5
A Jony Na
+
i Mg
2+
mog¹ pe³niæ tylko rolê utleniacza.
2 · 1 p.
8 p.
B
Atomy sodu i magnezu oraz jony Br
–
oraz S
2–
mog¹ pe³niæ tylko rolê reduktora.
4 · 1 p.
C
Atomy bromu i siarki mog¹ pe³niæ rolê zarówno utleniacza, jak i reduktora.
2 · 1 p.
6
Zwi¹zki, które mog¹ pe³niæ tylko rolê utleniacza:
K
2
Cr
2
O
7
, KNO
3
, KMnO
4
, KClO
4
.
4 · 1 p.
4 p.
7
A
3 Cu + 8 HNO
3
Û 3 Cu(NO
3
)
2
+ 2 NO
+ 4 H
2
O
2 p.
12 p.
2 · 1 p.
Utleniacz: kwas azotowy(V)
Reduktor: miedŸ
2 · 1 p.
B
K
2
Cr
2
O
7
+ 3 SnCl
2
+ 14 HCl
Û 2 CrCl
3
+ 3 SnCl
4
+ 2 KCl + 7 H
2
O
2 p.
2 · 1 p.
Utleniacz: dichromian(VI) potasu
Reduktor: chlorek cyny(II)
2 · 1 p.
www.wsip.com.pl
1

Numer
zadania
Przewidywana odpowiedŸ
Punktacja
za
czynnoϾ
suma-
rycznie
8
A
2 KMnO
4
+ 5 H
2
O
2
+ 6 HCl
Û 2 MnCl
2
+ 2 KCl + 5 O
2
+ 8 H
2
O
2 p.
10 p.
2 · 1 p.
Nadtlenek wodoru pe³ni w tej reakcji rolê reduktora.
1 p.
B
2 Cr(NO
3
)
3
+ 3 H
2
O
2
+ 10 KOH
Û 2 K
2
CrO
4
+ 6 KNO
3
+ 8 H
2
O
2 p.
2 · 1 p.
Nadtlenek wodoru pe³ni w tej reakcji rolê utleniacza.
1 p.
9
2 KMnO
4
+ 5 SnSO
4
+ 8 H
2
SO
4
Û 2 MnSO
4
+ K
2
SO
4
+ 5 Sn(SO
4
)
2
+ 8 H
2
O
2 p.
6 p.
2 MnO
4
–
+ 5 Sn
2+
+ 16 H
+
Û 2 Mn
2+
+ 5 Sn
4+
+ 8 H
2
O
2 p.
2 · 1 p.
10
A
2 KNO
2
+ 2 KI + 2 H
2
SO
4
Û I
2
+ 2 NO + 2 K
2
SO
4
+ 2 H
2
O
2 p.
6 p.
2 · 1 p.
B
Azotan(III) potasu pe³ni w tej reakcji rolê utleniacza, a jodek potasu — rolê redu-
ktora
2 · 1 p.
11
A
Równanie reakcji utleniania-redukcji, w której kation Fe
3+
jest utleniaczem:
2 Fe
3+
+ Sn
2+
Û 2 Fe
2+
+ Sn
4+
lub
Fe
3+
+ Cr
2+
Û Fe
2+
+ Cr
3+
2 p.
6 p.
Wskazanie kationu Fe
3+
jako utleniacza.
1 p.
B
Równanie reakcji utleniania-redukcji, w której kation Fe
2+
jest reduktorem:
2 Fe
2+
+ Pb
4+
Û 2 Fe
3+
+ Pb
2+
2 p.
Wskazanie kationu Fe
2+
jako reduktora.
1 p.
12
A
2 · 1 p.
6 p.
B
2 · 1 p.
C
2 · 1 p.
2
Numer
zadania
Przewidywana odpowiedŸ
Punktacja
za
czynnoϾ
suma-
rycznie
13
A
2 · 1 p.
4 p.
B
Obliczenia:
Na katodzie wydzieli siê 14 g niklu.
2 p.
14
Obliczenia:
Zastosowanie prawa Faradaya (skorzystanie z wzoru)
1 p.
4 p.
Obliczenie czasu, po którym wydzieli siê 0,1 mola ¿elaza
(z rozk³adu 0,1 mola FeCl
3
) — 5789 s
1 p.
Obliczenie czasu, po którym wydziel¹ siê 0,2 mola miedzi
(z rozk³adu 0,2 mola CuCl
2
) — 7719 s
1 p.
Ca³kowity czas przeprowadzania elektrolizy — 225,13 minut.
1 p.
15
A
2 · 1 p.
8 p.
B
Obliczenia:
Obliczenie liczby moli atomów miedzi wydzielonych na elektrodzie (1 mol Cu).
2 p.
Obliczenie objêtoœci wody, która uleg³a rozk³adowi podczas elektrolizy (18 cm
3
).
2 p.
Obliczenie objêtoœci roztworu (V = 1,982 dm
3
).
1 p.
Obliczenie stê¿enia molowego Cu
2+
w roztworze (c
mol
= 0,505 mol/dm
3
).
1 p.
16
Równania elektrodowe:
2 · 1 p.
4 p.
Podczas elektrolizy na katodzie wydzieli siê 1,2 g cynku.
2 p.
17
A
Równania reakcji elektrodowych:
2 · 1 p.
5 p.
B
Obliczenia:
Obliczenie objêtoœci chloru wydzielonego na elektrodzie, bez uwzglêdnienia
jego rozpuszczalnoœci w wodzie (15 dm
3
).
2 p.
Obliczenie objêtoœci chloru wydzielonego na elektrodzie, z uwzglêdnieniem
jego rozpuszczalnoœci w wodzie (13,2 dm
3
).
1 p.
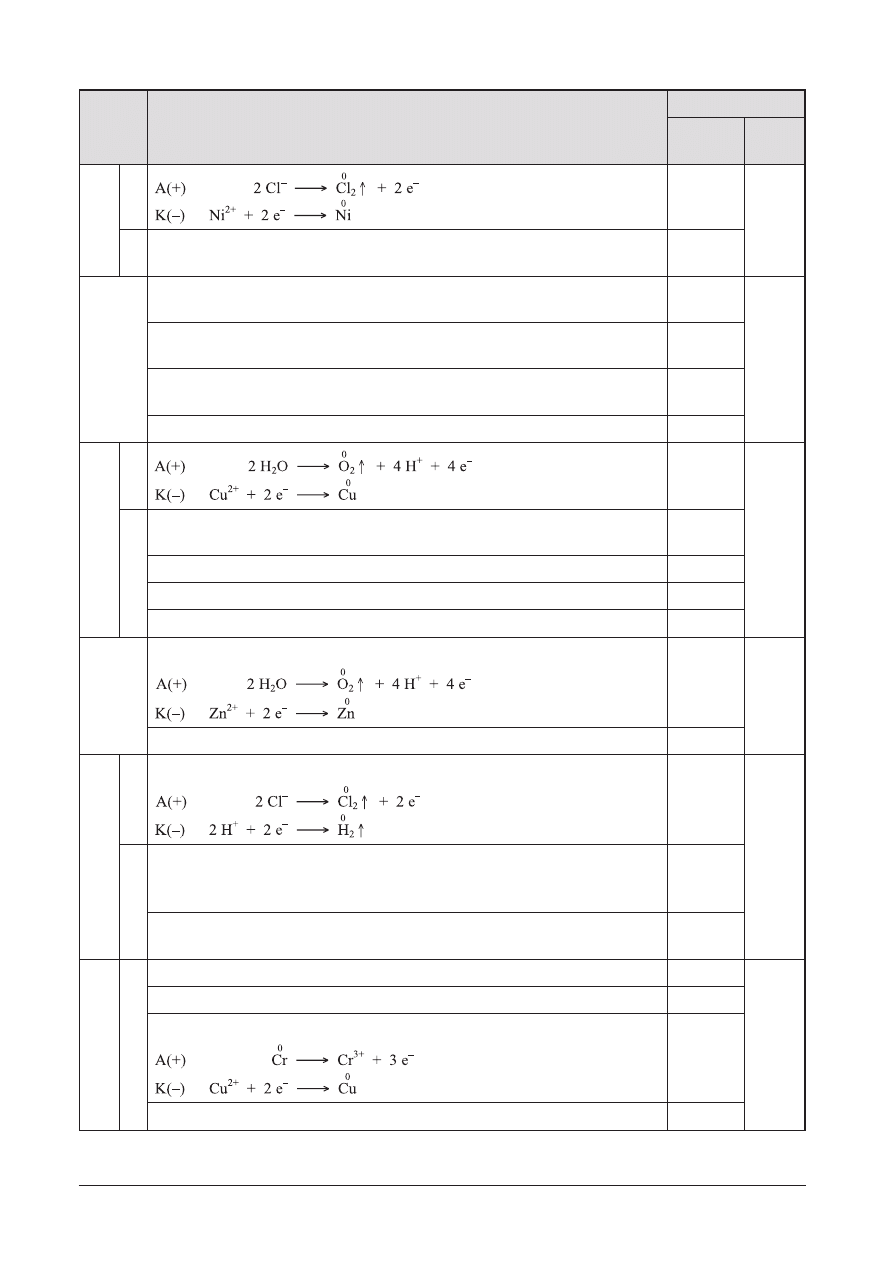
18
Ogniwo
I
A. Schemat ogniwa: Cr | Cr
3+
|| Cu
2+
| Cu
1 p.
12 p.
B. Anod¹ jest elektroda chromowa, a katod¹ — elektroda miedziana.
2 · 1 p.
C. Reakcje elektrodowe:
2 · 1 p.
D. Obliczenie standardowej SEM ogniwa: SEM = 1,08 V
1 p.
www.wsip.com.pl
3

Numer
zadania
Przewidywana odpowiedŸ
Punktacja
za
czynnoϾ
suma-
rycznie
18
Ogniwo
II
A. Schemat ogniwa: Co | Co
2+
|| Pb
2+
| Pb
1 p.
B. Anod¹ jest elektroda kobaltowa, a katod¹ — elektroda o³owiana
2 · 1 p.
C. Reakcje elektrodowe:
2 · 1 p.
D. Obliczenie standardowej SEM ogniwa: SEM = 0,14 V
1 p.
20
Schemat ogniwa ¿elazowo-niklowego: Fe | Fe
2+
|| Ni
2+
| Ni
1 p.
8 p.
Reakcje elektrodowe:
2 · 1 p.
Obliczenie SEM tego ogniwa, gdy [Fe
2+
] = [Ni
2+
] = 0,1 mol/dm
3
(w T = 298 K):
SEM = 0,21 V
1 p.
Obliczenie SEM tego ogniwa, gdy [Fe
2+
] = 1 mol/dm
3
,
a [Ni
2+
] = 0,01 mol/dm
3
(w T = 298 K): SEM = 0,15 V
4 p.
19
Równanie procesu zachodz¹cego w trakcie elektrolizy:
1 p.
5 p.
Obliczenie przyrostu masy p³ytki wskutek wydzielenia siê 2 moli atomów srebra
(
Dm = 157 g).
2 p.
Obliczenie masy wydzielonego srebra (m
Ag
= 34,4 g).
2 p.
4
0
0
Wyszukiwarka
Podobne podstrony:
arkusz 3 03
arkusz 4 03
arkusz 8 03
arkusz 9 03
arkusz 7 03
arkusz 1 03
arkusz 5 03
arkusz 6 03
312[01] 03 122 Arkusz egzaminacyjny
arkusz kalkulacny technilogia V sem, do uczenia, materialy do nauczania, rok2009 2010, 03.01.10
03, PP, arkusz
312[01] 03 122 Arkusz egzaminac Nieznany (2)
514[03] 01 121 Arkusz egzaminacyjny
KVIab14.03-TWORZYMY ARKUSZ KALKULACYJNY, Konspekty dydaktyka
Tworzenie wykresów w arkuszu kalkulacyjnym EXCEL, do uczenia, materialy do nauczania, rok2010-2011,
KVIa09.03- ARKUSZ KALKULACYJNY CD., Konspekty dydaktyka
ARKUSZ SAMOOCENY NAUCZYCIELA, 03. DLA NAUCZYCIELI
więcej podobnych podstron