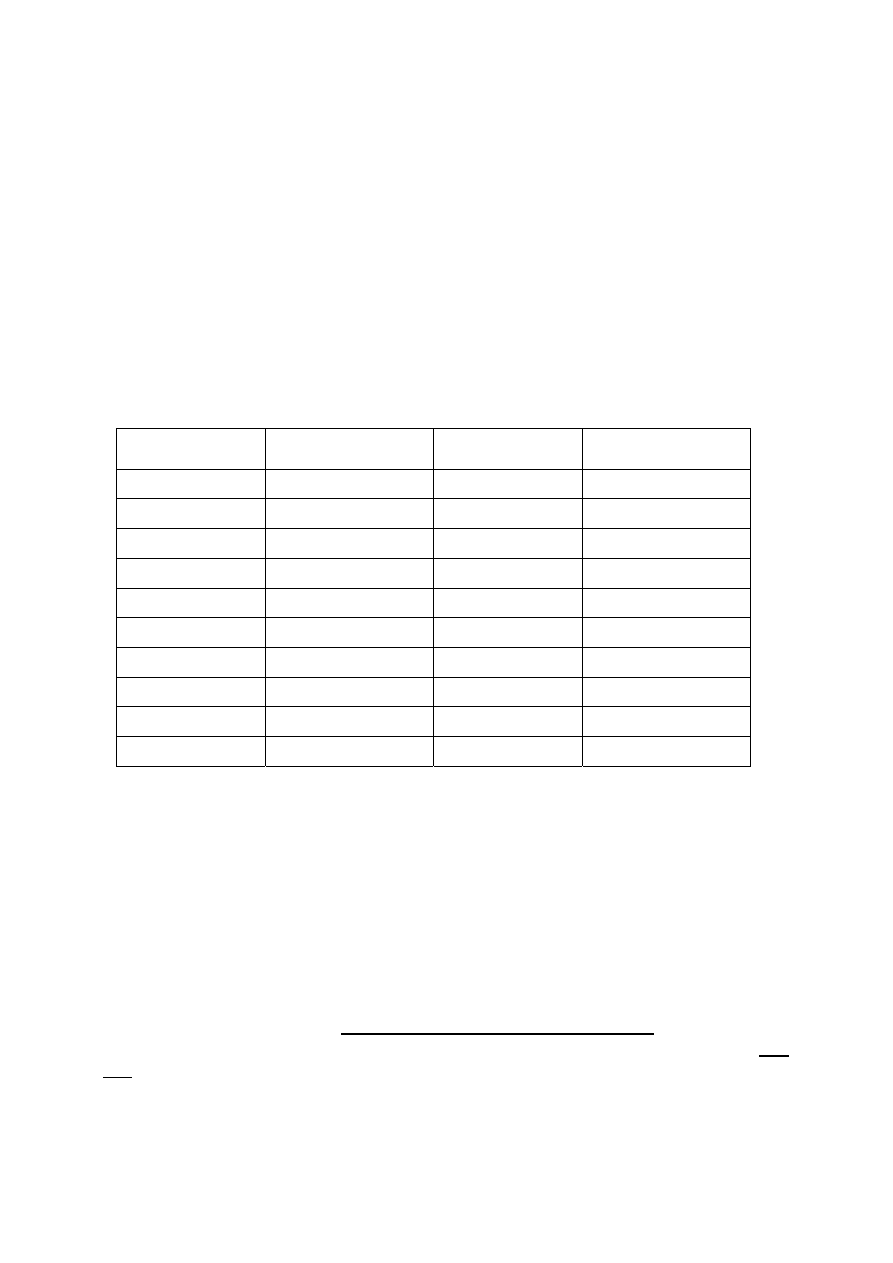
1
Rozdział 2. ANALIZA ILOŚCIOWA
2.1 Przygotowanie mianowanego roztworu HCl
Do cylindra o pojemności 100 cm
3
nalać ostrożnie stężony roztwór HCl. Następnie do roztworu
włożyć suchy areometr wykalibrowany w zakresie 1,100-1,200 g/cm
3
, zwracając uwagę, aby
przyrząd unosił się swobodnie w roztworze kwasu. Odczytać gęstość roztworu na skali
areometru. Z poniższej tabeli określić procentowość roztworu chlorowodoru.
Gęstość i stężenie procentowe (%) roztworów kwasu solnego (chlorowodoru) w
temperaturze 20
o
C
Gęstość (g/cm
3
)
Stężenie procentowe
% (g/100g)
Gęstość (g/cm
3
)
Stężenie procentowe
% (g/100g)
1,0980 20 1,1492 30
1,1032 21 1,1542 31
1,1083 22 1,1593 32
1,1135 23 1,1642 33
1,1187 24 1,1691 34
1,1239 25 1,1740 35
1,1290 26 1,1789 36
1,1344 27 1,1837 37
1,1397 28 1,1885 38
1,1445 29
Obliczyć objętość stężonego roztworu HCl potrzebną do przygotowania 100 cm
3
o stężeniu 0,1
mol/dm
3
.
Przykład obliczeń. (W przykładzie tym pominięto różnicę wynikającą z temperatury pomiaru i
temperatury, dla której podane są wartości w tabeli oraz temp., w której został wykalibrowany
areometr).
Oznaczona gęstość wynosi 1,15 g/cm
3
a odpowiadające jej stężenie HCl (odczytane z
tabeli) to ~30%. W 1 cm
3
tego roztworu znajduje się 1,15 * 30g/100g, czyli 0,345 gramów
chlorowodoru. Dzieląc tę wartość przez masę molową HCl otrzymujemy ilość moli zawartą w 1
cm
3
stężonego roztworu: 0,345/36,46 = 0,00946 mol/cm
3
.
Jeżeli mamy przygotować 100 cm
3
roztworu o stężeniu 0,1 mol/dm
3
, należy odmierzyć
taką ilość roztworu stężonego, by zawierała 0,01 mola chlorowodoru, czyli 0,01/0,00946 = 1,05
cm
3
roztworu o gęstości 1,15 g/cm
3
.
2
Do kolbki miarowej o pojemności 100 cm
3
odmierzyć obliczoną objętość roztworu kwasu,
uzupełnić wodą destylowaną do kreski i dokładnie wymieszać zawartość kolbki. Za pomocą
pipety odmierzyć 10 cm
3
roztworu do kolbki stożkowej (kolby Erlenmayera), dodać 2 krople
roztworu oranżu metylowego. Odczytać oraz zapisać początkową objętość roztworu NaOH w
biurecie, następnie dodawać kroplami mianowany roztwór (o wcześniej określonym stężeniu),
ciągle mieszając zawartość kolby. W chwili, gdy miareczkowany roztwór uzyska pomarańczową
barwę przejściową przy pH ~4 zakończyć miareczkowanie i odczytać objętość roztworu w
biurecie. Powtórzyć miareczkowanie z następną porcją kwasu.
Wykonać również dwa miareczkowanie wobec fenoloftaleiny do momentu, gdy roztwór zabarwi
się na kolor lekko różowy.
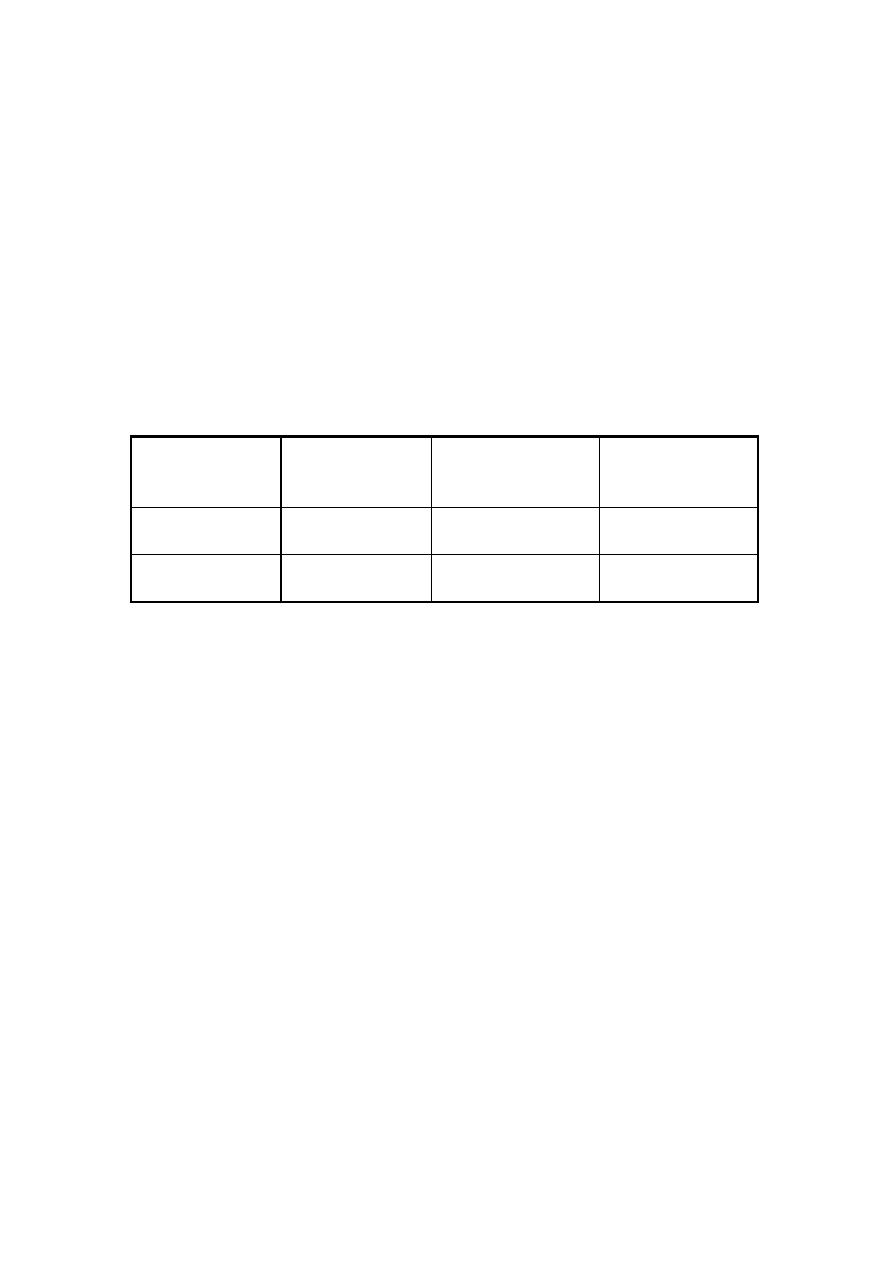
Właściwości wskaźników alkacymetrycznych
Wskaźnik
Zabarwienie w
roztworze bardziej
kwaśnym
„Barwa przejściowa”
Zabarwienie w
roztworze bardziej
zasadowym
Oranż metylenowy
czerwona
pomarańczowa
pH = 4
żółta
Fenoloftaleina bezbarwna słabo różowa
pH = 9,4
malinowa
Obliczenie stężenia miareczkowanego kwasu.
Przy złożeniu, że stężenie roztworu NaOH użytego do miareczkowania wynosi 0,1025
mol/dm
3
, miareczkowano próbki o objętości 10 cm
3
i otrzymano wyniki miareczkowań: 9,8, 9,9
cm
3
wobec oranżu metylowego oraz 10,1 i 10,1 cm
3
wobec fenoloftaleiny.
Rzeczywiste stężenie przygotowanego roztworu oblicza się korzystając z zależności:
C
1
· V
1
= C
2
· V
2
Gdzie: C
1
= obliczane stężenie roztworu HCl
V
1
= znana objętość miareczkowanego roztworu HCl (10 cm
3
)
C
2
= znane stężenie NaOH (z dokładnością do czwartego miejsca po przecinku)
V
2
= średnia objętość NaOH z trzech kolejnych miareczkowań o różnicy między
wynikiem najwyższym i najniższym nie większej niż 0,2 cm
3
.
Średnia objętość roztworu NaOH użytego do miareczkowania wynosi 9,97 cm
3
co
odpowiada 0,1025
·
9,97 = 1,0219 mmoli NaOH znajdujących się w 10 cm
3
mianowanego
roztworu NaOH, co oznacza, że 10 cm
3
przygotowanego roztworu HCl zawiera taką samą ilość
milimoli kwasu, a więc stężenie molowe HCl wynosi 1,0219 mmola /10 cm
3
= 0,1022
mmol/cm
3
= 0,1022 mol/dm
3
.
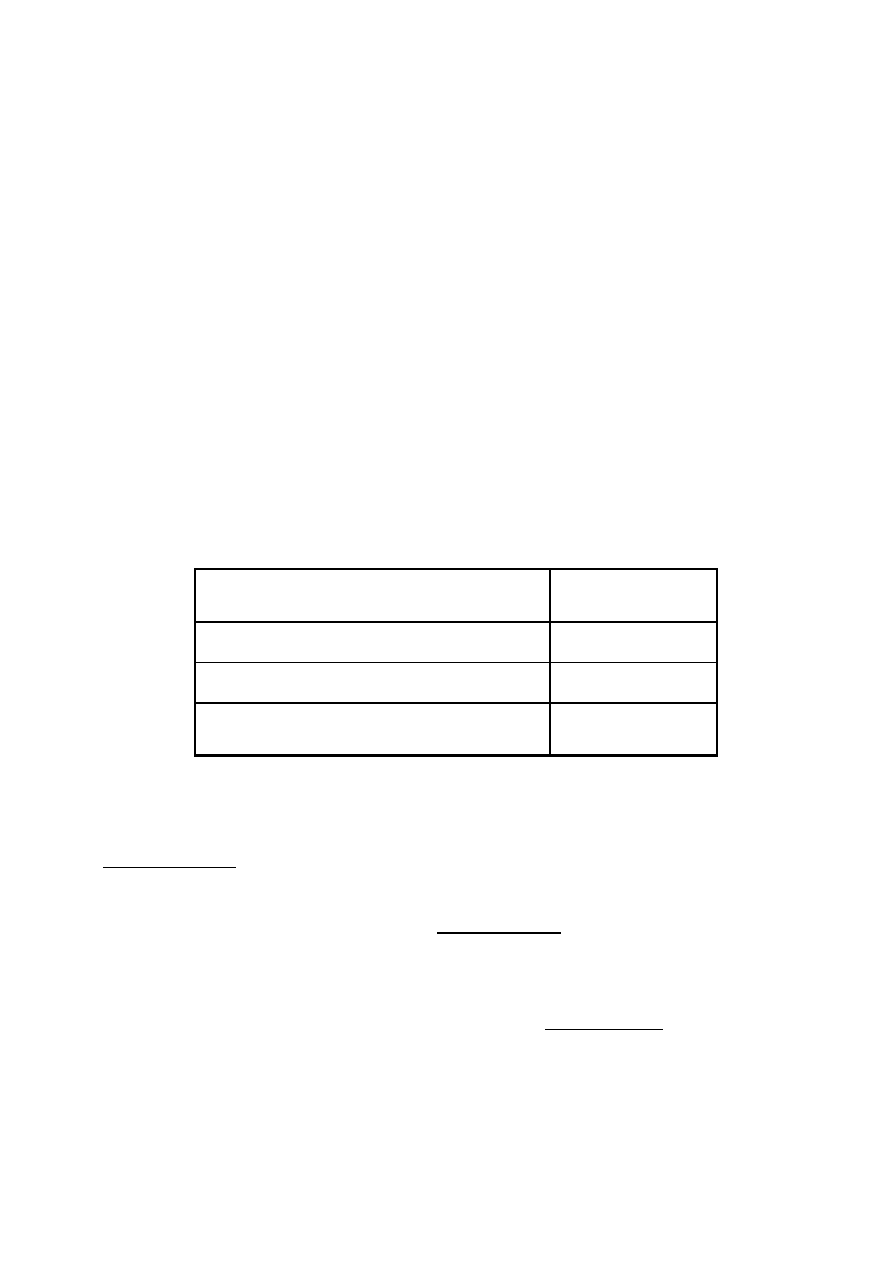
3
2.2 Oznaczanie kwasu octowego
Otrzymaną w kolbce miarowej próbkę roztworu kwasu octowego uzupełnić wodą destylowaną
do objętości 100 cm
3
, dokładnie wymieszać a następnie odmierzyć pipetą 10 cm
3
roztworu kwasu
octowego i przenieść go do kolby stożkowej (Erlenmayera). Dodać 2-3 krople roztworu
fenoloftaleiny, a następnie miareczkować mianowanym roztworem NaOH do uzyskania
różowego zabarwienia w całej objętości próby. Powtórzyć miareczkowanie trzykrotnie.
Obliczyć molowe stężenie kwasu octowego korzystając z zależności:
C
1
·
V
1
= C
2
·
V
2
Gdzie: C
1
= obliczane stężenie kwasu octowego CH
3
COOH
V
1
= znana objętość miareczkowanego roztworu CH
3
COOH
C
2
= znane stężenie NaOH (z dokładnością do czwartego miejsca po przecinku
V
2
= średnia objętość NaOH z trzech kolejnych miareczkowań o różnicy między
wynikiem najwyższym i najniższym nie większej niż 0,2 cm
3
.
Wyniki podać w tabeli
Oznaczanie kwasu octowego
Numer stanowiska
Średnia objętość z trzech miareczkowań
V =
Stężenie molowe
C =
Masa kwasu octowego zawarta w 100 cm
3
(wyrażona w mg)
mg/100 cm
3
=
Masa molowa CH
3
COOH = 60
Przykład obliczeń. Średnia objętość z trzech miareczkowań wynosi 5,1 cm
3
. Mnożąc tę objętość
przez stężenie mianowanego roztworu NaOH obliczymy liczbę mmoli NaOH znajdujących się 10
cm
3
miareczkowanego roztworu. 5,1
·
0,1042 mol/dm
3
= 0,5314 mmoli. Stężenie tego kwasu
wynosi 0,5314 mmol/10 = 0,0531 mmol/cm
3
= 0,05314 mol/dm
3
.
W celu obliczenia ilości mg kwasu octowego znajdującego się w 100 cm
3
wykonujemy
następujące działanie:
0,5314 mmol
·
10
·
60 mg = 318,8 mg/100 cm
3
,
po zaokrągleniu do całkowitych wartości = 319 mg/100 cm
3
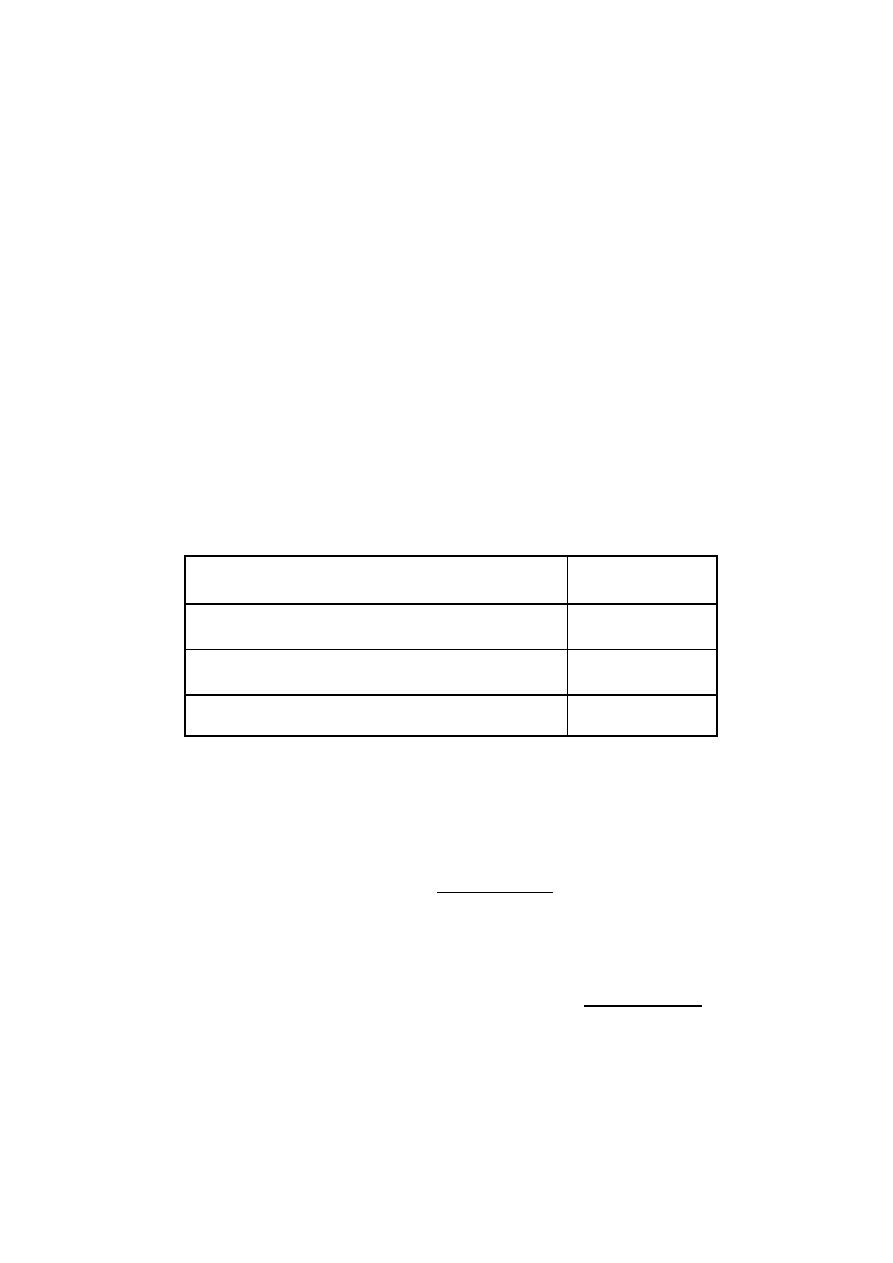
4
2.3. Oznaczanie NaOH
Otrzymaną próbkę roztworu NaOH uzupełnić wodą destylowaną do objętości 100 cm
3
w kolbce
miarowej, dokładnie wymieszać, a następnie odmierzyć pipetą 10 cm
3
roztworu NaOH i
przenieść go do kolby stożkowej (Erlenmayera). Dodać 2-3 krople roztworu oranżu metylowego,
a następnie miareczkować NaOH mianowanym roztworem HCl do uzyskania
charakterystycznego zabarwienia przejściowego w całej objętości próby. Powtórzyć
miareczkowanie trzykrotnie.
Korzystając z poniższej zależności obliczyć molowe stężenie NaOH:
C
1
·
V
1
= C
2
·
V
2
gdzie: C
1
= obliczane stężenie NaOH
V
1
= objętość miareczkowanego roztworu NaOH
C
2
= znane stężenie HCl (z dokładnością do czwartego miejsca po przecinku)
V
2
= średnia objętość HCl z trzech kolejnych miareczkowań o różnicy między
wynikiem najwyższym i najniższym nie większej niż 0,2 cm
3
.
Wyniki podać w tabeli
Oznaczanie NaOH
Numer
stanowiska
Średnia objętość z trzech miareczkowań
V =
Stężenie molowe
C =
Masa NaOH zawarta w 100 cm
3
(wyrażona w mg)
mg/100 cm
3
=
Masa molowa NaOH = 40
Przykład obliczeń. Średnia objętość z trzech miareczkowań wynosi 7,1 cm
3
. Mnożąc tę objętość
przez stężenie mianowanego roztworu HCl obliczymy liczbę mmoli NaOH znajdujących się 10
cm
3
miareczkowanego roztworu. 7,1
·
0,1083 mol/dm
3
= 0,7689 mmoli. Stężenie tej zasady
wynosi 0,7689 mmol/10 = 0,0769 mmol/cm
3
= 0,0769 mol/dm
3
W celu obliczenia ilości mg zasady sodowej znajdującej się w 100 cm
3
wykonujemy
następujące działanie:
0,7689 mmol
·
10
·
40 mg = 307,5 mg/100 cm
3
,
po zaokrągleniu do całkowitych wartości = 307 mg/100 cm
3
5
2.4. Oznaczanie węglanu sodowego obok wodorotlenku sodowego metodą R.B. Wardera
Roztwór zawierający mieszaninę wodorotlenku sodu (NaOH) i węglanu sodu (Na
2
CO
3
)
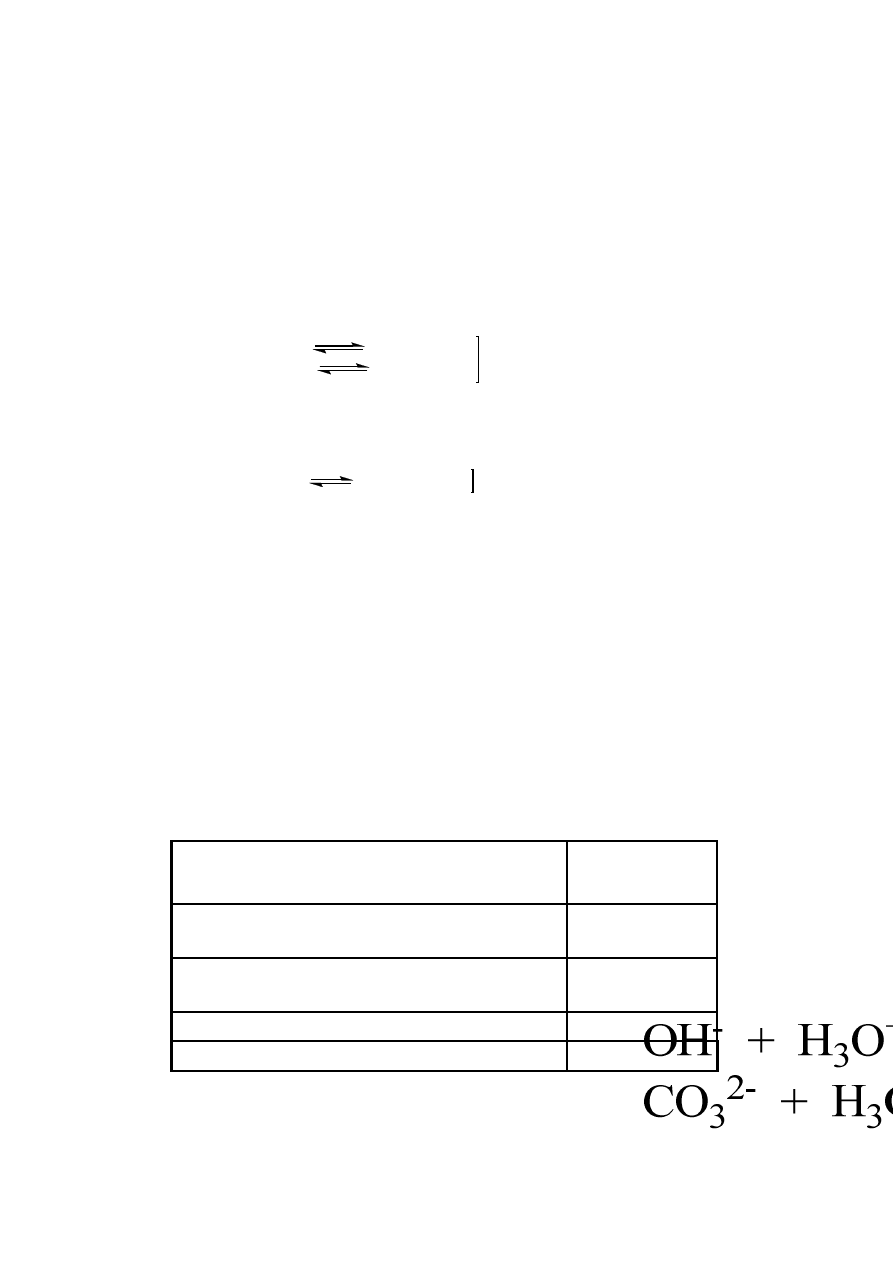
miareczkuje się mianowanym kwasem solnym w obecności fenoloftaleiny. W miarę dodawania
kwasu następuje zobojętnienie jonów OH
-
, pochodzących z dysocjacji NaOH oraz jonów CO
3
2-
przekształcających się w HCO
3
-
. Moment zniknięcia barwy fenoloftaleiny, odpowiada stanowi, w
którym zobojętnione zostały jony wodorotlenowe pochodzące z NaOH, a jony CO
3
2-
zostały
przekształcone w HCO
3
-
.
Do odbarwionego roztworu dodaje się roztwór oranżu metylowego i miareczkuje kwasem
solnym aż do zmiany barwy z żółtej na przejściową – jasno pomarańczową. Przebiega wtedy
zobojętnienie HCO
3
-
zgodnie z reakcją:
Wykonanie oznaczenia: Otrzymaną próbkę roztworu uzupełnić wodą destylowaną do objętości
100 cm
3
w kolbce miarowej, dokładnie wymieszać, a następnie odmierzyć pipetą 10 cm
3
roztworu i przenieść go do kolby stożkowej (Erlenmayera). Dodać 3-4 krople roztworu
fenoloftaleiny i miareczkować mianowanym roztworem HCl do zaniku zabarwienia (uwaga-
podczas miareczkowania ciągle mieszać kolbę). Odczytać objętość zużytego kwasu ( X cm
3
).
Dodać 2-3 kropli oranżu metylowego i dalej miareczkować do momentu osiągnięcia barwy
przejściowej – jasno pomarańczowej. Odczytać objętość roztworu kwasu zużytego na
miareczkowanie od momentu odbarwienia fenoloftaleiny do osiągnięcia zmiany barwy oranżu
metylowego (Y cm
3
). Powtórzyć miareczkowanie trzykrotnie.
Zawartość NaOH w oznaczanym zadaniu jest równoważna (X-Y)cm
3
mianowanego
roztworu kwasu solnego, a ilość Na
2
CO
3
odpowiednio Ycm
3
.
Obliczyć masę NaOH wg wzoru: (X-Y)cm
3
·
C
HCl
·
10
·
40 mg (m.mol. NaOH = 40)
Obliczyć masę Na
2
CO
3
wg wzoru: Ycm
3
·
C
HCl
·
10
·
106 mg
(m.mol Na
2
CO
3
= 106)
Wyniki podać w tabeli
Oznaczanie NaOH + Na
2
CO
3
Numer
stanowiska
Średnia objętość z trzech miareczkowań
wobec fenoloftaleiny
X =
Średnia objętość z trzech miareczkowań
wobec oranżu metylowego
Y =
Masa NaOH zawarta w 100 cm
3
(wyrażona w mg)
mg/100 cm
3
=
Masa Na
2
CO
3
zawarta w 100 cm
3
(wyrażona w mg)
mg/100 cm
3
=

6
2.5. Oznaczanie chlorków metodą Mohra
Obojętny roztwór chlorku sodu miareczkuje się mianowanym roztworem AgNO
3
w obecności
jonów CrO
4
2-
jako wskaźnika. Jony Ag
+
reagują z chlorkiem powodując wytrącanie się białego
osadu chlorku srebra Ag
+
+ Cl
-
→ AgCl↓. Gdy jony Cl
-
zostaną wytrącone z roztworu, wtedy
zaczyna się wytrącać czerwono-brunatny osad Ag
2
CrO
4
oznaczający koniec miareczkowania.
Kolejność wytrącania się osadu chlorku srebra i chromianu srebra jest spowodowana różnicą w
rozpuszczalności tych soli (stężenie jonów srebra w nasyconym roztworze AgCl wynosi 1,26
·
10
-5
mol/dm
3
natomiast w nasyconym roztworze Ag
2
CrO
4
2
·
10
-4
mol/dm
3
). Zatem stężenie
jonów srebra jest ~16 razy wyższe w nasyconym roztworze chromianu niż chlorku srebra.
Różnica ta pozwala na zastosowanie roztworu chromianu jako wskaźnika przy ilościowym
oznaczaniu chlorków.
Wykonanie oznaczenia: Otrzymaną próbkę roztworu NaCl uzupełnić wodą destylowaną
do objętości 100 cm
3
w kolbce miarowej, dokładnie wymieszać a następnie odmierzyć pipetą 10
cm
3
roztworu i przenieść go do kolby stożkowej (Erlenmayera). Dodać 2 krople roztworu
chromianu potasowego K
2
CrO
4
i miareczkować mianowanym roztworem AgNO
3
. Pojawienie się
czerwono-brunatnego zabarwienia w całej objętości zadania świadczy o powstaniu osadu
Ag
2
CrO
4
i oznacza koniec miareczkowania. Powtórzyć miareczkowanie trzykrotnie.
Przykład obliczeń. Średnia objętość z trzech miareczkowań wynosi 5,5 cm
3
. Mnożąc tę objętość
przez stężenie mianowanego roztworu AgNO
3
obliczymy liczbę mmoli NaCl znajdujących się w
10 cm
3
miareczkowanego roztworu. 5,5 cm
3
·
0,1034 mol/dm
3
= 0,5687 mmoli AgCl. Stężenie
NaCl wynosi 0,5687 mmol/10 = 0,0569 mmol/cm
3
= 0,0569 mol/dm
3
W celu obliczenia ilości mg chlorku sodu znajdującego się w 100 cm
3
wykonujemy następujące
działanie:
0,5687 mmol
*
10
*
58,45 = 343,1 mg/100 cm
3
, czyli 343 mg/100 cm
3
.
Wyniki podać w tabeli
Oznaczanie NaCl metodą Mohra
Numer stanowiska
Średnia objętość z trzech miareczkowań
V =
Stężenie molowe
C =
Masa NaCl zawarta w 100 cm
3
mg/100 cm
3
=

7
2.6. Oznaczanie szczawianu amonu metodą manganometryczną
Reakcja szczawianu z nadmanganianem w środowisku kwaśnym opisana jest równaniem:
Jon MnO
4
–
ulega redukcji do jonu Mn
2+
, przy czym następuje zmniejszenie stopnia utlenienia
manganu z +7 do +2. Odpowiednia liczba elektronów w tej reakcji dostarczana jest przez jon
C
,2O42-, który
utleniając się zwiększa stopień utlenienia atomów węgla z +3 do +4.
Wykonanie oznaczenia. Roztwór (NH
4
)
2
C
2
O
4
w kolbie miarowej o pojemności 100 cm
3
uzupełnić wodą destylowaną do kreski i dobrze wymieszać. Pobrać pipetą 10 cm
3
roztworu z
kolby miarowej i przenieść do kolby Erlenmayera, następnie dodać cylinderkiem ok. 10 cm
3
2-
molowego roztworu H
2
SO
4
, podgrzać roztwór prawie do wrzenia i miareczkować mianowanym
roztworem KMnO
4
. Miareczkowanie prowadzić do chwili, w której pierwsza kropla roztworu
KMnO
4
zabarwi roztwór w kolbie Erlenmayera na kolor lekko różowy. Miareczkowanie
powtórzyć trzykrotnie i obliczyć średnią objętość zużytego w trzech miareczkowaniach roztworu
KMnO
4
.
Przykład obliczenia. Na zmiareczkowanie 10 cm
3
roztworu (NH
4
)
2
C
2
O
4
zużyto średnio 9,8 cm
3
roztworu KMnO
4
o stężeniu 0,0152 mol/dm
3
, tj. 9,8 · 0,0152 = 0,148 milimola jonów MnO
4
–
.
Z reakcji utlenienia C
2
O
4
2–
przez jony MnO
4
–
wynika, że 2 mole MnO
4
–
utleniają w
środowisku kwaśnym 5 moli C
2
O
4
2–
, 0,148 milimola KMnO
4
utlenia 0,37 milimola (NH
4
)
2
C
2
O
4
(0,148 · 5/2 = 0,37). Stężenie roztworu (NH
4
)
2
C
2
O
4
wyniesie, więc 0,37/10 = 0,037 mmol/cm
3
, co
jest równoważne stężeniu molowemu 0,037. Zawartość (NH
4
)
2
C
2
O
4
w 10 cm
3
wynosi 0,37 · 124
= 45,88 mg (masa molowa (NH
4
)
2
C
2
O
4
=124), natomiast w 100 cm
3
(objętość kolbki miarowej)
45,88 · 10 = 458,8 mg.
Wyniki podać w tabeli
Oznaczanie (NH
4
)
2
C
2
O
4
Numer
stanowiska
Średnia objętość z trzech miareczkowań
V =
Stężenie molowe (NH
4
)
2
C
2
O
4
C =
Masa (NH
4
)
2
C
2
O
4
w 100 cm
3
mg/100 cm
3
=
C
2
O
4
2-
- 2e 2CO
2
MnO
4
-
+ 8H
+
+ 5e Mn
2+
+ 4H
2
O
x5
x2
2MnO
4
-
+ 5C
2
O
4
2-
+ 16H
+
10CO
2
+ 2Mn
2+
+ 8H
2
O

8
2.8. Oznaczanie dichromianu(VI) potasu metodą jodometryczną
Oznaczanie dichromianu(VI) potasu, który jest utleniaczem, odbywa się w dwóch etapach. W
pierwszym etapie dichromianu(VI) potasu zostaje zmieszany z nadmiarem jodku potasu i
kwasem siarkowym. Dochodzi wówczas do utlenienia jonów jodkowych do wolnego jodu
zgodnie z poniższym równaniem:
Równanie 1
W drugim etapie oznacza się ilościowo jod miareczkując jego roztwór mianowanym roztworem
Na
2
S
2
O
3
.
Równanie 2
Jod zmniejszając stopień utlenienia redukuje się do jonu I
-
, zaś anion S
2
O
3
2-
, w którym
jeden z atomów siarki utleniając się podwyższa stopień utlenienia z -2 do -1, przechodzi w jon
S
4
O
6
2–
(czterotionian). Wskaźnikiem stosowanym w jodometrii jest roztwór skrobi (jest to w
istocie roztwór rozpuszczalnej frakcji skrobi tj. amylozy). W obecności I
2
roztwór skrobi
zabarwia się na kolor intensywnie niebieski, w skutek tworzenia kompleksów I
2
z amylozą.
Redukcja I
2
do jonów I
-
dokonująca się podczas miareczkowania tiosiarczanem powoduje
odbarwienie roztworu. Pozwala to uchwycić moment zakończenia miareczkowania.
Liczba milimoli zużytego tiosiarczanu umożliwia obliczenie stężenia K
2
Cr
2
O
7
w badanym
roztworze. Przy obliczaniu należy uwzględnić, że reakcje w obu etapach zachodzą w różnych
stosunkach stechiometrycznych i liczba milimoli zużytego Na
2
S
2
O
3
jest sześć razy większa od
liczby milimoli K
2
Cr
2
O
7
znajdującego się w miareczkowanym roztworze.
Wykonanie oznaczenia. Otrzymaną do oznaczenia próbkę w kolbce miarowej o pojemności 100
cm
3
uzupełnić wodą destylowaną do kreski i dokładnie wymieszać. Przenieść pipetą 10 cm
3
roztworu z kolbki miarowej do kolby Erlenmayera, dodać cylinderkiem ok. 10 cm
3
2% roztworu
KI i 5 cm
3
2-molowego roztworu H
2
SO
4
, następnie dodać ok. 1 cm
3
(1 pipetka) roztworu skrobi i
dokładnie mieszając miareczkować roztworem Na
2
S
2
O
3
o znanym stężeniu do zmiany
zabarwienia z granatowego na zielonkawe. Miareczkowanie należy powtórzyć 3-krotnie,
wyznaczając średnią objętość zużytego w 3 oznaczeniach roztworu Na
2
S
2
O
3
.
Przykład obliczenia. Na redukcję I
2
do I
–
zużyto średnio 10,6 cm
3
0,1618 molowego roztworu
Na
2
S
2
O
3
, co oznacza zużycie 10,6 · 0,1618 = 1,71 milimola jonów S
2
O
3
2–
. Z równania nr 2

9
wynika, że ta ilość S
2
O
3
2–
redukuje 1,71/2 = 0,855 milimola I
2
. Oznaczany w próbie I
2
powstał w
wyniku utlenienia I
–
do I
przez jony Cr
2
O
7
2–
zgodnie z reakcją nr 1, pozwala to stwierdzić, że
0,855 milimola I
2
powstało w wyniku redukcji 0,855/3 = 0,285 milimola jonów Cr
2
O
7
2–
do Cr
3+
i
oznacza, że tyle samo milimoli K
2
Cr
2
O
7
znajdowało się w 10 cm
3
oznaczanej próby. Stężenie
molowe roztworu K
2
Cr
2
O
7
wynosi, więc 0,285/10 = 0,0285, natomiast zawartość w 10 cm
3
zadania równa jest 0,285 milimola · 294 mg = 83,8 mg (masa molowa K
2
Cr
2
O
7
= 294), a w 100
cm
3
10 razy więcej, czyli 838 mg.
Podsumowując, obliczenia stężenia i masy K
2
Cr
2
O
7
wykonujemy wg wzorów:
C
dichromianu
= V
tiosiarczanu
· C
tiosiarczanu
/ 60
masa dichromianu / 100 cm
3
= V
tiosiarczanu
· C
tiosiarczanu
· 10 / 6 · 294 mg
Wyniki podać w tabeli
Oznaczanie K
2
Cr
2
O
7
Numer
stanowiska
Średnia objętość z trzech miareczkowań
V =
Stężenie molowe K
2
Cr
2
O
7
C =
Masa K
2
Cr
2
O
7
w 100 cm
3
mg/100 cm
3
=
Wyszukiwarka
Podobne podstrony:
Analiza ilo¶ciowa
analiza złożonych aktów ruchowych w sytuacjach patologicznych
Prezentacja 2 analiza akcji zadania dla studentow
Wypadkoznawstwo analiza wypadków
Zarz[1] finan przeds 11 analiza wskaz
Analiza czynnikowa II
4 ANALIZA WSKAŹNIKOWA Rachunkowość
analiza finansowa ppt
Analiza rys w twarzy
Analiza rynku konsumentów
Analiza
więcej podobnych podstron