1
1
dr Ewa Więckowska-Bryłka
Katedra Chemii WNoŻ
p. 2036
Wykład 1. Wielkości podstawowe i
pochodne stosowane w chemii
fizycznej
Szkoła Główna Gospodarstwa Wiejskiego
Wydział Nauk o Żywności
CHEMIA FIZYCZNA
Konsultacje:
• Środa godz. 10-11
• Pon 11-12
• Wtorek (sala 2065)
2
Kryteria zaliczenia przedmiotu: chemia fizyczna
dla studentów I roku kierunku Technologia żywności i żywienie
człowieka WNoŻ – studia stacjonarne
Program studiów dla studentów kierunku: technologia żywności i
żywienie człowieka Wydziału Nauk o Żywności przewiduje w II
semestrze studiów dla przedmiotu Chemia Fizyczna 15 godzin wykładów
(7 tyg. x 2 godz. + 1 tydz. x 1 godz.) i 15 godzin ćwiczeń
laboratoryjnych (5 tyg. x 3 godz.).
Ćwiczenia z chemii fizycznej są prowadzone na przemiennie grupami co
drugi tydzień (czyli przez 10 tygodni w semestrze) i rozpoczynają się:
24 marca – gr. 9, 1, 5 – sala 2010 , gr. 10, 2, 6 – sala 2065
31 marca – gr. 7, 3, 11 – sala 2010, gr. 8, 4, 12 – sala 2065
zgodnie z godzinami podanymi w tygodniowym planie zajęć.
Studenci wykonują ćwiczenia w zespołach 2– lub 3– osobowych (w
każdej grupie 6 zespołów) według ustalonego harmonogramu (dla każdego
zespołu zaplanowano 5 ćwiczeń)
3
Założenia i cele przedmiotu:
opanowanie przez studenta podstawowych pojęć i praw z zakresu
chemii fizycznej,
poznanie wybranych zjawisk fizykochemicznych,
zaznajomienie się z prostymi metodami badawczymi,
nabycie umiejętności samodzielnego wykonywania pomiarów i
interpretacji ich wyników.
Zgodnie z REGULAMINEM
STUDIÓW, od 1 października 2012 r. w
SGGW
obowiązuje system punktowy odpowiadający standardowi
ECTS (Europejski System Transferu i
Akumulacji
Punktów).
Przedmiotowi Chemia Fizyczna przypisano 3 pkt ECTS. Uzyskanie 3
pkt ECTS odzwierciedla
osiągnięcie przez studenta założonych dla
tego przedmiotu
efektów kształcenia, potwierdzone jego zaliczeniem.
4
Efekty kształcenia uwzględnione w sylabusie przedmiotu
Chemia fizyczna to:
student zna podstawowe prawa rządzące procesami fizycznymi i reakcjami
chemicznymi
zna metody opisu przemian fizykochemicznych i chemicznych
zna podstawowe metody i techniki instrumentalnej analizy fizykochemicznej i
chemicznej
wykorzystuje poznane zjawiska i równania do opisu oraz oceny właściwości
substancji
opanował umiejętność samodzielnego uczenia się
posiada umiejętność wykonania pomiarów, ich interpretacji i oceny
wiarygodności
zna
podstawowe
metody
opracowywania
i
interpretacji
danych
eksperymentalnych
posiada umiejętność pracy samodzielnej i zespołowej i jest odpowiedzialny za
odpowiednie warunki i bezpieczeństwo własne i innych.
2
5
Do weryfikacji efektów kształcenia służy:
1.
ocena z 5 sprawozdań pisemnych z wykonanych ćwiczeń laboratoryjnych,
ocenianych w skali 0-3 pkt;
2.
ocena z 5 kolokwiów pisemnych składających się z 2 pytań związanych z
wykonywanym w danym dniu ćwiczeniem przeprowadzanych podczas
ćwiczeń laboratoryjnych, ocenianych w skali 0-5 pkt;
3.
ocena z pisemnego kolokwium składającego się z 7 pytań z materiału
wykładowego, ocenianych w skali 0-5 pkt. Kolokwium to odbędzie się po
zakończeniu wykładów – 13 maja 2015 r. (środa) godz. 15-17 (aula III i IV)
Dla każdego z tych trzech elementów określona jest maksymalna liczba punktów
do uzyskania, tj.
1. 15 pkt., 2. 50 pkt., 3. 35 pkt. Razem 100 pkt.
6
Przedmiot zalicza student, który z każdego elementu uzyskał co
najmniej 50% punktów, tzn. odpowiednio: 1. 7,5 pkt., 2. 25 pkt.,
3. 17,5 pkt.
Warunkiem zaliczenia przedmiotu i uzyskania 3 pkt. ECTS jest zaliczenie
wszystkich w/w elementów weryfikacji efektów kształcenia.
Ocena końcowa z przedmiotu zależy od sumy wszystkich punktów:
50,5-60 pkt. – ocena 3,0; 60,5-70 pkt. – ocena 3,5;
70,5-80 pkt. – ocena 4,0; 80,5-90 pkt. – ocena 4,5;
90,5-100 pkt. – ocena 5,0.
Zgodnie z § 20 pkt. 3. REGULAMINU STUDIÓW:
W przypadku uzyskania w trakcie trwania semestru, w wyniku
przeprowadzenia określonych form weryfikacji efektów kształcenia
określonych w opisie modułu, ocen negatywnych studentowi
przysługuje jeden termin poprawkowy. Termin ten wyznaczany jest
przez osobę odpowiedzialną za moduł i może zostać ustalony w
terminie sesji zaliczeniowej.
7
Studenci, którzy nie uzyskają 50% możliwej liczby punktów z
kolokwiów ćwiczeniowych, piszą kolokwium z całości materiału
związanego z wykonanymi ćwiczeniami po zakończeniu pracowni
9 czerwca 2015 r.
Studenci, którzy nie uzyskają 50% możliwej liczby punktów z
kolokwium wykładowego, piszą kolokwium poprawkowe z
całości materiału wykładowego w dniu 10 czerwca (środa) godz.
15-17 (aula III).
Ćwiczenia laboratoryjne są obowiązkowe i wszystkie
przewidziane w programie dla danego zespołu ćwiczeniowego
muszą być wykonane praktycznie.
8
Zgodnie z § 10 pkt. 2, 4 i 5 REGULAMINU STUDIÓW:
2. Obecność studenta na zajęciach innych niż wykłady jest obowiązkowa.
Student nie może mieć więcej niż 20% nieobecności na tych zajęciach -
bez względu na przyczyny.
4. Prowadzący zajęcia decyduje o sposobie i terminie wyrównania
zaległości powstałych wskutek nieobecności studenta na zajęciach.
5. Student, który nie uczestniczył w zajęciach i nie wyrównał zaległości w
sposób opisany w ust. 4, nie może uzyskać zaliczenia modułu.
Studenci przystępują do ćwiczeń przygotowani teoretycznie –
kolokwium piszą przed rozpoczęciem ćwiczeń laboratoryjnych.
Wyniki pomiarów i ich opracowanie studenci przedstawiają w formie
(jednego na zespół) pisemnego sprawozdania formatu A4 (cel
ćwiczenia, krótki wstęp teoretyczny, wykonanie ćwiczenia, wyniki
pomiarów i ich opracowanie). Wszystkie sprawozdania muszą być
poprawnie opracowane i oddane !
Podręcznik: Eksperymentalna chemia fizyczna, praca zbiorowa, Wyd.
SGGW, Warszawa 2007, wyd. III zmienione
3
9
Wykaz ćwiczeń laboratoryjnych z chemii fizycznej
(numery ćwiczeń podano wg podręcznika "Eksperymentalna chemia fizyczna", praca
zbiorowa, Wyd. SGGW, Warszawa 2007, wyd. III zmienione).
1 – 1. Wyznaczanie ciepła rozpuszczania, sala 2010
2 – 1. Wyznaczanie gęstości pary i masy molowej metodą Meyera, sala 2065
2 – 2a. Pomiar współczynnika lepkości cieczy za pomocą wiskozymetru Ostwalda, sala 2065
2 – 3. Wyznaczanie zawartości alkoholu etylowego w badanym roztworze, sala 2010
3 – 1. Wyznaczanie współczynnika podziału kwasu octowego w układzie dwóch nie mieszających się
cieczy, sala 2010
4 – 1. Adsorpcja kwasu octowego na węglu aktywowanym, sala 2010
6 – 1. Wyznaczanie stałej szybkości reakcji inwersji sacharozy metodą polarymetryczną, sala 2010
7 – 1. Miareczkowanie konduktometryczne, sala 2065
7 – 2. Wyznaczanie klasycznej stałej dysocjacji z pomiarów przewodnictwa, sala 2065
8 – 1. Miareczkowanie potencjometryczne kwasu zasadą, sala 2065
9 – 1. Oznaczanie grubości osadzonej powłoki miedzianej i wydajności prądowej elektrolizy, sala 2065
10 – 1. Kolorymetryczne oznaczanie stężenia jonów żelaza (III), sala 2010
Sala 2010
Sala 2065
10
Harmonogram ćwiczeń laboratoryjnych z chemii fizycznej
Zespoły 2-lub 3-osobowe (6 zespołów w każdej z sal; w momencie rozpoczęcia
pracowni - w sali 2010 zespoły oznaczone literami A-F, w sali 2065 – G-L)
kolor zielony – w sali
2065
Kolor żółty – ćwiczenia wykonywane w
sali 2010
Zespół
Nr tygodnia
A B
C
D
E
F
G
H
I
J
K
L
I
10–1 1–1 2–3
3–1
4–1
6–1
2–1 2–2a 7–2
7–1
8–1
9–1
II
4–1
3–1
6–1
1–1 10–1 2–3
9–1
8–1 2–2a 2–1
7–2
7–1
III
2–1 2–2a 7–2
7–1
8–1
9–1 10–1 1–1
2–3
3–1
4–1
6–1
IV
9–1
8–1 2–2a 2–1
7–2
7–1
4–1
3–1
6–1
1–1 10–1 2–3
V
7–1
7–2
8–1
9–1
2–1 2–2a 6–1 10–1 1–1
2–3
3–1
4–1
11
Zespół Imiona i nazwiska osób w
zespole
Nr ćwiczenia wykonywanego
w dniu 24 03 15 godz. 8 -11
G
2–1
H
2–2a
I
7–2
J
7–1
K
8–1
L
9 - 1
Nr grupy: 10
SALA 2065
12
Rozkład zajęć z chemii fizycznej (we wtorki) dla studentów I roku kierunku
Technologia żywności i żywienie człowieka WNoŻ (studia dzienne) od 24
marca (31 marca) 2015 r. do 14 kwietnia (21 kwietnia) 2015 r. - pierwsze
dwa tygodnie wg harmonogramu
Sala 2010
Sala 2065
Godz.
Nr grupy Prowadzący
Nr
grupy
Prowadzący
8 – 11
9 (7)
dr B. Parczewska–Plesnar
10 (8)
dr E. Więckowska–Bryłka
11 – 14
1 (3)
dr B. Parczewska–Plesnar
2 (4)
dr E. Więckowska–Bryłka
14 – 17
5 (11)
dr B. Parczewska–Plesnar
6 (12)
dr E. Więckowska–Bryłka
4
13
1. Do każdego ćwiczenia obowiązuje materiał teoretyczny całego
rozdziału o takim numerze jak pierwsza liczba w symbolu
wykonywanego ćwiczenia i Pytania i zadania zamieszczone w
podręczniku po danym ćwiczeniu. Wyjątki dotyczą ćwiczeń z
rozdziału 2, gdzie obowiązuje materiał teoretyczny z poszczególnych
części rozdziału, zgodnie z wymienionymi w ćwiczeniu wymaganiami
kolokwialnymi.
2. W przypadku ćwiczenia 1–1 obowiązują również zadania z prawa
Hessa zamieszczone po teorii rozdziału 1 (np. zad. 48-54 ze str. 48-
50), a przed ćw. 1–1.
Wymagania kolokwialne związane z pytaniami z ćwiczeń:
Wzór nagłówka do sprawozdania:
Nr i tytuł ćwiczenia:
Imię i nazwisko osoby prowadzącej ćwiczenia:
Data wykonania ćwiczenia Godz. Nr grupy
studenckiej
Zespół
Nazwiska osób
wykonujących ćw.
Pkt za spr
Uwagi
prowadzącego:
14
TEMATYKA WYKŁADÓW:
I.
Wielkości podstawowe i pochodne stosowane w chemii
fizycznej
Omówienie sposobu realizacji przedmiotu i kryteriów zaliczenia. Definicje,
jednostki wg układu SI. Przeliczanie jednostek z zastosowaniem jednostek
pod- i wielokrotnych dla wielkości podstawowych i ich pochodnych.
II. Termodynamika. Termochemia.
Układ, otoczenie, faza, stan, parametry stanu, funkcje stanu, zasady
termodynamiki. Procesy odwracalne i nieodwracalne. Kryteria samorzutności
procesów. Równania Kirchhoffa. Prawo Hessa. Statyka chemiczna (prawo
działania mas, reguła przekory, izoterma i izobara van't Hoffa). Wyznaczanie
ciepła rozpuszczania.
III.
Płyny.
Sposób opracowania wyników pomiarów, sporządzanie wykresów i ich
interpretacja na przykładzie wielkości mierzonych i wyznaczanych podczas
ćwiczeń laboratoryjnych.
Gazy: gaz doskonały, równania gazu doskonałego, ciepło molowe, gaz
rzeczywisty, równanie van der Waalsa. Prawa: Daltona i Grahama.
Wyznaczanie masy molowej metodą Meyera.
Ciecze: właściwości cieczy, gęstość, lepkość, metody pomiaru lepkości cieczy,
napięcie powierzchniowe i metody jego wyznaczania. Współczynnik
załamania światła i refraktometria.
15
IV.
Układy jedno i wieloskładnikowe – wielofazowe.
Przemiany i równowagi fazowe. Reguła faz Gibbsa. Roztwory. Prawo Henry'ego.
Napoje gazowane. Choroba kesonowa. Dyfuzja, osmoza. Rola ciśnienia
osmotycznego w procesach biologicznych i w życiu człowieka. Konserwacja
żywności. Prawo Raoulta. Ebulio i kriometria. Destylacja i rektyfikacja. Prawo
podziału Nernsta i ekstrakcja.
V.
Zjawiska powierzchniowe. Adsorpcja i kataliza
Klasyfikacja procesów adsorpcji. Izotermy adsorpcji. Wykorzystanie procesów
adsorpcji: metody chromatograficzne, jonity. Kataliza i reakcje enzymatyczne.
Adsorpcja z roztworu i środki powierzchniowo czynne.
VI.
Koloidy
Układy dyspersyjne. Koloidy, ich klasyfikacja i właściwości. Metody
otrzymywania i oczyszczania koloidów. Dializa. Właściwości optyczne koloidów
– nefelometria i turbidymetria. Punkt izoelektryczny. Elektroforeza. Koagulacja,
denaturacja, peptyzacja. Żele, piany, emulsje (homogenizacja).
16
VII. Metody analizy instrumentalnej
Klasyfikacja metod analizy instrumentalnej. Metody spektroskopowe –
klasyfikacja ze względu na sposób oddziaływania promieniowania
elektromagnetycznego z materią i wykorzystywany w badaniach zakres
promieniowania.
Zasada
działania spektrofotometru. Spektroskopia
elektronowa i barwa związków kompleksowych. Prawo Lamberta - Beera i
jego zastosowanie w kolorymetrycznej metodzie oznaczenia stężenia
kompleksu jonów żelaza (III) z kwasem salicylowym. Spektroskopia UV i IR
w analizie produktów pochodzenia naturalnego.
VIII. Metody analizy instrumentalnej
– cd.
Elektrochemiczne metody analizy instrumentalnej. Potencjometria – pomiar
pH i miareczkowanie potencjometryczne. Konduktometria i miareczkowanie
konduktometryczne. Elektroliza i kulometria (metoda miareczkowania
kulometrycznego). Wykorzystanie metod elektrochemicznych w analizie
produktów pochodzenia naturalnego.
5
17
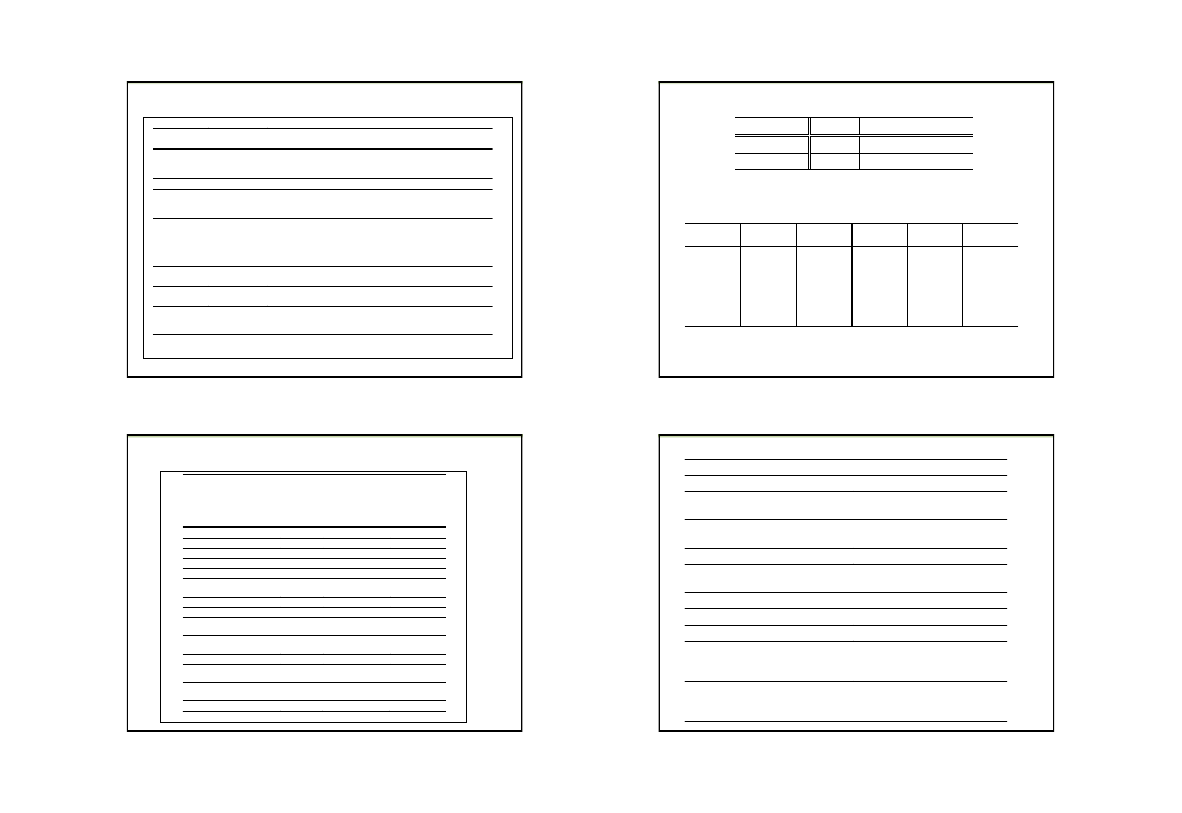
TABELA 1. Jednostki podstawowe układu SI
Wielkość
Nazwa i symbol
jednostki
Definicja
Długość
metr [m]
Metr jest to długość równa 1 650 763,73 długości fali w
promieniowania odpowiadającego przejściu między poziomami 2p
10
a
5d
5
atomu
86
Kr (kryptonu 86)
Masa
kilogram [kg]
Wzorzec
Czas
sekunda [s]
Sekunda jest to czas równy 992 631 770 okresów promieniowania
odpowiadającego przejściu między dwoma nadsubtelnymi poziomami
stanu podstawowego atomu
133
Cs (cezu 133)
Prąd
elektryczny
(natężenie
prądu
elektrycznego)
amper [A]
Amper jest to taki prąd stały, który płynąc przez dwa równolegle
przewody prostoliniowe o nieskończonej długości i znikomo małym
kołowym przekroju poprzecznym, umieszczone w próżni w odległości
jednego metra jeden od drugiego, wywoła między tymi przewodami siłę
2 · 10
–7
niutona na każdy metr długości.
Temperatura
kelwin [K]
Kelwin jest to 1/273,16 temperatury termodynamicznej punktu
potrójnego wody.
Liczność
materii
mol [mol]
Mol jest to ilość substancji składająca się z tylu elementów materii, ile
jest atomów w 0,012 kg węgla
12
C.
Światłość
kandela [cd]
Kandela jest to światłość jaką ma w kierunku prostopadłym pole
substancji doskonale czarnej o powierzchni 1/600 000 m
2
w
temperaturze krzepnięcia platyny pod ciśnieniem 101 325 Pa.
18
TABELA 2. Jednostki pochodne
układu SI
Wielkość
Nazwa i
symbol
jednostki
Relacja między
podstawowymi
jednostkami
układu SI
Relacje
między
innymi
jednostkami
pochodnymi
układu SI
Masa molowa
[M]
kg/mol
Stężenie molowe
[c]
mol/m
3
Objętość molowa
[V]
m
3
/mol
Molalność
[m]
mol/kg
Siła
niuton [N] kg ·m/s
2
Ciśnienie
paskal
[Pa]
kg/(m
·
s
2
)
N/m
2
Energia, praca, ciepło
dżul [J]
kg
· m
2
/s
2
N
·
m
Moc, strumień energii
wat [W]
kg
·
m
2
/s
3
J/s
Ładunek elektryczny
kulomb
[C]
A
· s
Potencjał i napięcie
elektryczne
wolt [V]
kg
·m
2
/(A
· s
3
)
W/A
Opór elektryczny
om [
Ω]
kg
·
m
2
/(A
2
·s
3
)
V/A
Przewodność
elektryczna
simens
[S]
A
2
·
s
3
/(kg
· m
2
)
A/V
Napięcie
powierzchniowe
kg/s
2
N/m
Lepkość dynamiczna
kg/(m
·
s)
Pa
·
s
19
TABELA 3. Przeliczanie jednostek energii
Jednostka
J
kaloria
Dżul [J]
1
2,39 ·10
–1
Kaloria [cal] 4,19
1
TABELA 4.
Dziesiętne wielokrotności i
podwielokrotności jednostek miar
Przedrostek Oznaczenie
Mnożnik
Przedrostek Oznaczenie
Mnożnik
mega
kilo
hekto
deka
M
k
h
da
10
6
10
3
10
2
10
1
decy
centy
mili
mikro
nano
piko
d
c
m
μ
n
p
10
–1
10
–2
10
–3
10
–6
10
–9
10
–12
20
TABELA 5.
Stałe fizykochemiczne
Liczba Avogadra
N
A
= 6,0220943 ·10
23
mol
–1
Stała Boltzmanna
k = 1,35805 [J/K ]
Uniwersalna stała gazowa
R = 8,31433 ± 0,00044
[J/(K·mol)]
Prędkość światła w próżni
c = 2,99792 ·10
8
[m/s] ≈ 3 ·10
8
[m/s]
Stała Plancka
h = 6,6256 ·10
–34
[J·s]
Stała Faradaya
F = 96486 ± 0,31 [C/mol] ≈ 96
500 [C/mol]
Ładunek elektronu
e = 1,6021733 · 10
–19
[C]
Stała dielektryczna próżni
= 8,85418782 ·10
–12
[C
2
/(J·
m)]
Przyspieszenie ziemskie
g = 9,806 [m/s
2
]
Objętość molowa gazu
doskonałego w war. normalnych
(101 325 Pa, 273,15 K)
22,41383 ·10
–3
[m
3
/mol] (22,4
dm
3
/mol)
Objętość molowa gazu
doskonałego w war. standardowych
(101 325 Pa, 298 K)
24,4· 10
–3
[m
3
/mol] (24,4
dm
3
/mol)
6
21
Przykład 1. Wyraź 15 dm w: a) metrach, b)
centymetrach i c) milimetrach.
Wykorzystujemy współczynniki przeliczeniowe (w). W związku z
tym, że
b) 1 dm = 10
–1
m, 1 cm = 10
–2
m , 1 dm = 10 cm
w = 10
1
cm/dm ,
15 dm = 15 dm · 10
1
cm/ dm = 150 cm
Rozwiązanie:
a) 1 dm = 10
–1
m, współczynnik przeliczeniowy w = 10
–1
m/dm,
stąd: 15 dm·10
–1
m/dm = 1,5 m
c) 1 dm = 10
–1
m, 1 mm = 10
–3
m,
w = 10
2
mm/dm
15 dm = 15 dm · 10
2
mm/dm = 1500 mm
22
Przykład
2.
Długość
promieniowania
absorbowanego przez
roztwór wynosi 300 nm.
Wyraź ją w: a) m, b) pm.
Przedrostek nano (n) wiąże się z mnożnikiem jednostki miary
wynoszącym 10
–9
m.
W związku z tym:
b) 3·10
–7
m · 10
12
pm/m = 3 ·10
5
pm.
a) 300 nm ·10
–9
m/nm = 3·10
–7
m,
Rozwiązanie:
23
Przykład 3. Wyraź objętość: a) 30 dm
3
w m
3
, b)
1500 cm
3
w m
3
i dm
3
, c) 2000 mm
3
w cm
3
i dm
3
.
Rozwiązanie:
c) 1 mm
3
= 10
–3
cm
3
,
2000 mm
3
·10
–3
cm
3
/mm
3
= 2 cm
3
1 mm
3
= (10
–2
dm)
3
= 10
–6
dm
3
,
2000 mm
3
·10
–6
dm
3
/mm
3
= 2·10
–3
dm
3
a) 1 dm
3
= 10
–3
m
3
30 dm
3
·10
–3
m
3
/dm
3
= 3,0·10
–2
m
3
b) 1 cm
3
= 10
–6
m
3
1500 cm
3
·10
–6
m
3
/cm
3
= 1,5·10
–3
m
3
1 cm
3
= (10
–1
dm)
3
= 10
–3
dm
3
1500 cm
3
·10
–3
dm
3
/cm
3
= 1,5 dm
3
24
Przykład 4. Objętość molowa gazu doskonałego w
warunkach normalnych (pod
ciśnieniem 101 325 Pa i
w temperaturze 273,15 K) wynosi 0,02241 m
3
/mol. Ile
wynosi w dm
3
/mol?
1 m
3
= (10 dm)
3
= 10
3
dm
3
0,02241 m
3
/mol·10
3
dm
3
/m
3
= 22,41 dm
3
/mol
Rozwiązanie:
7
25
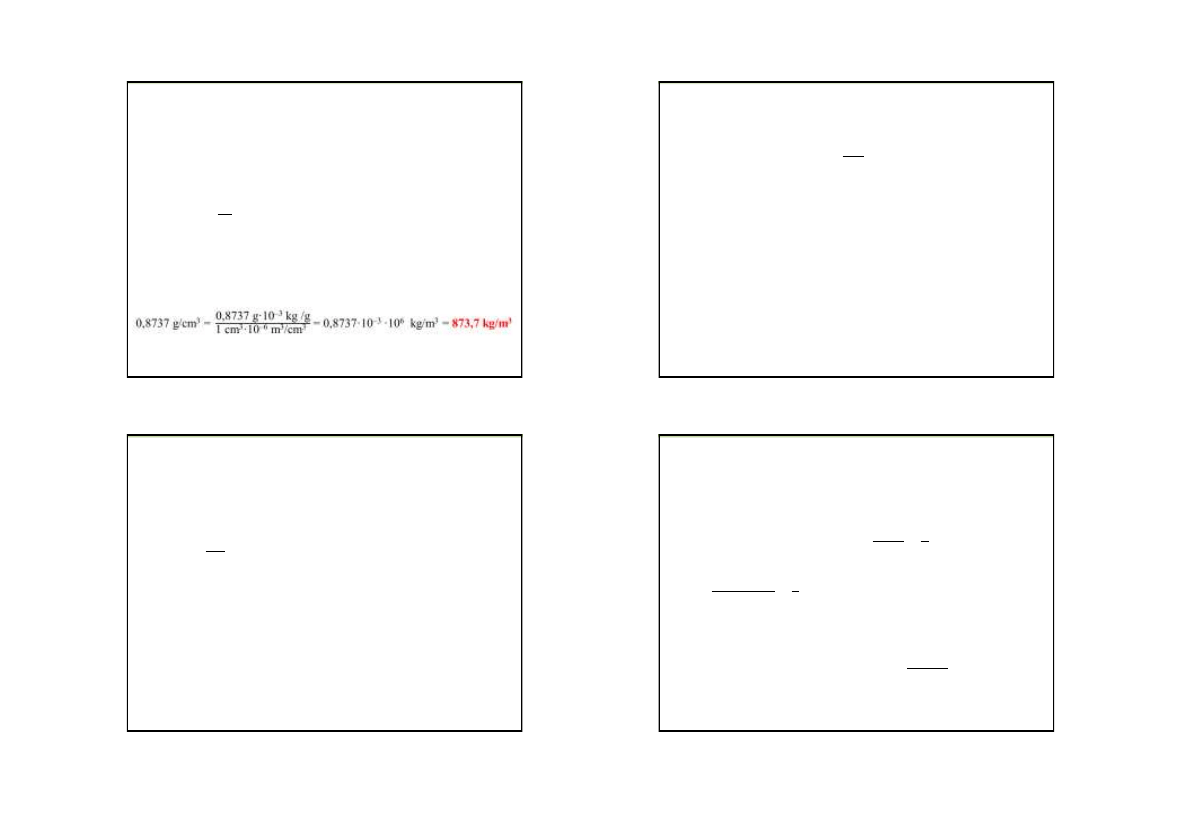
Przykład 5. Oblicz gęstość benzenu w kg/m
3
,
jeżeli 200
cm
3
tego rozpuszczalnika
waży 174,74 g.
Rozwiązanie:
d
benzenu
= 174,74 g / 200 cm
3
= 0,8737 g/cm
3
1g = 10
–3
kg, 1 cm
3
= 10
–6
m
3
V
m
d
Korzystamy ze wzoru na gęstość:
26
Przykład 6. W 100 cm
3
alkoholu etylowego o
gęstości d = 0,7851 g/cm
3
rozpuszczono 1,54 g
jodu. Oblicz c
p
roztworu.
Rozwiązanie:
Obliczamy masę alkoholu etylowego m
r
:
m
r
= d · V = 100 cm
3
· 0,7851 g/cm
3
= 78,51 g
Masa roztworu m
R
= 1,54 +78,41 = 80,05 g
c
p
= (1,54 g : 80,05 g)·100 % = 1,9 %
100%
R
m
s
m
p
c
r
s
R
m
m
m
m
s
– masa substancji, m
r
- masa rozpuszczalnika, m
R
- masa roztworu
27
Przykład 7. Wyraź w molach/m
3
następujące stężenia
roztworów: a) 0,05 mol/dm
3
, b) 5 mmoli/cm
3
.
Rozwiązanie:
b) 1 mmol = 10
–3
mola
1 cm
3
= 10
–6
m
3
(5 mmoli·10
–3
mola/mmol): (1 cm
3
·10
–6
m
3
/cm
3
)
= 5·10
–3
·10
6
mol/m
3
= 5·10
3
mol/m
3
R
s
m
V
n
c
a) 1 dm
3
= 10
–3
m
3
0,05 mol/dm
3
= 0,05 mol : (1dm
3
·10
–3
m
3
/dm
3
) =
0,05·10
3
mol/m
3
= 50 moli/m
3
28
Przykład 8. Na zmiareczkowanie 20 cm
3
roztworu NaOH
zużyto 25 cm
3
0,2 molowego roztworu H
2
SO
4
. Oblicz miano
roztworu NaOH. Masa molowa NaOH wynosi 40 g/mol.
otrzymujemy:
T = (0,5 mol/dm
3
·40 g/mol ) : 1000 cm
3
/ dm
3
= 0,02 g/cm
3
1
2
4
2
SO
H
NaOH
n
n
1
2
4
2
SO
H
m
NaOH
m
)
v
c
(
)
v
c
(
1000
s
m
M
c
T
Rozwiązanie:
2 NaOH + H
2
SO
4
Na
2
SO
4
+ 2H
2
O
W związku z tym, że n = C
m
· v
Obliczamy c
m
NaOH wstawiając dane do przekształconego wzoru:
c
m
NaOH = (2·0,2·0,025) : 0,020 = 0,5 mol/dm
3
Stosując wzór na miano roztworu
Z równania reakcji:
wynika, że stosunek liczby moli
8
29
Siłę definiuje się jako iloczyn masy i przyspieszenia.
Jednostką siły jest niuton N.
1 niuton jest to
siła, która masie 1 kg nadaje
przyspieszenie 1 m/s
2
:
1 N = 1
kg·1 m/s
2
= 1
kg·m/s
2
Ciśnienie definiuje się jako iloraz siły działającej
prostopadle i
równomiernie na daną powierzchnię przez
pole tej powierzchni. Jednostka
ciśnienia – paskal należy
do jednostek pochodnych
układu SI. Liczbowo 1 paskal
równy jest sile jednego niutona działającej prostopadle na
płaską powierzchnię 1 m
2
.
1 Pa = 1 N/m
2
= 1 kg/(m·s
2
)
30
1 kilopaskal = 1kPa = 1000 Pa = 10
3
Pa,
1 megapaskal = 1 MPa = 10
6
Pa.
•
atmosfera fizyczna, atm
– 1 atm równa jest ciśnieniu słupa
rtęci o wysokości 76 cm, gęstości 13,5951 g/cm
3
(w
temperaturze
273
K)
pod
działaniem normalnego
przyspieszenia ziemskiego,
•
milimetr
słupa rtęci, mm
Hg
, tor Tr
– 1 mm
Hg
= 1Tr = 1/760
atm, 1 atm = 760 mm
Hg
.
Ciśnieniu 101 325 Pa odpowiada 760 mm
Hg
czyli 1 atm.
Jednostkami
ciśnienia nie należącymi do układu SI, a dość
często stosowanymi są:
Jednostką wielokrotną jest
1 hektopaskal = 1 hPa = 10
2
Pa
.
Jednostkami wielokrotnymi paskala
najczęściej stosowanymi są:
31
Przykład 9. Ciśnienie atmosferyczne w warunkach
standardowych wynosi 101 325 Pa.
Wyraź tę wartość
w hPa.
Rozwiązanie:
1 hPa = 10
2
Pa 1 Pa = 10
–2
hPa
101325 Pa · 10
–2
hPa/Pa = 1013,25 hPa
Przykład 10. Wyraź ciśnienie 10 atmosfer w MPa.
1 MPa = 10
6
Pa, 1 Pa = 10
–6
MPa
10 atm = 10 atm·101 325 Pa/atm = 1 013 250 Pa
1 013 250 Pa·10
–6
MPa/Pa = 1,013250 MPa
Rozwiązanie:
32
1 watogodzina = 1
W·h = 3600 W·s = 3600 J.
Jednostką pracy, energii oraz ilości ciepła jest
dżul (J). 1 dżul jest pracą wykonaną przez siłę
równą 1 niutonowi na drodze 1 metra w kierunku
działania siły:
1 dżul = 1 J = 1 N·1 m = 1 N·m = 1 Pa·m
3
=
1 watosekunda = 1 W·s = 1 kg·m
2
/s
2
Jednostkami wielokrotnymi są:
1 kilodżul = 1kJ = 10
3
J
oraz nie należąca do układu SI jednostka:
9
33
Temperatura jest
wielkością skalarną określoną w
każdym punkcie ciała lub układu, której średnia wartość
jest
miarą energii wewnętrznej całego ciała lub układu.
• W przypadku skali Celsjusza – skali stustopniowej jako
ciecz
termometryczną zastosowano rtęć, której
rozszerzalność zmienia się wraz z temperaturą.
Obecnie w powszechnym
użyciu są trzy skale
temperatury: Celsjusza, Fahrenheita
(głównie poza
Europą – USA, Kanada) i Kelvina.
Jednostka temperatury
wiąże się ściśle ze sposobem
ustalenia
skali
temperatury
w
odniesieniu
do
temperatury odpowiednich
wzorców.
Jako punkty skrajne w tej skali
przyjęto temperaturę
krzepnięcia i wrzenia czystej wody (0
o
C i 100
o
C
odpowiednio).
Stopień Celsjusza 1
o
C stanowi
jedną setną
wymienionego
przedziału temperatury.
34
W wyniku ekstrapolacji
objętości lub ciśnienia gazu
doskonałego do wartości zerowej, otrzymano punkt
zerowy skali
bezwzględnej, tzw. zero bezwzględne
(absolutne),
powiązane z temperaturą w skali Celsjusza
zależnością:
• Skala bezwzględna temperatury, zwana skalą
Kelvina, oparta
została na rozważaniach nad
rozszerzalnością gazu doskonałego.
T (K) = t (
o
C) + 273,15
35
•
Ze
skalą
Kelvina
związana
jest
bezpośrednio
termodynamiczna skala temperatur oparta na temperaturze
tzw. punktu
potrójnego czystej wody (punktu współistnienia
obok siebie w stanie
równowagi: wody ciekłej, jej pary
nasyconej i lodu; parametry tego punktu: temperatura T =
273,16 K, czemu odpowiada 0,01
o
C i
ciśnienie p = 610,5 Pa).
Jednostką podstawową temperatury w układzie SI jest kelwin
K, definiowany jako jednostka temperatury termodynamicznej:
Wartość stopnia w skali Celsjusza i w skali Kelvina jest jednakowa:
1
o
C = 1 K, a temperatura zera
bezwzględnego (absolutnego) jest
przesunięta w stosunku do zera w skali Celsjusza o 273,15
o
C,
czyli 0 K odpowiada
–273,15
o
C lub 0
o
C odpowiada 273,15 K.
1 K = 1/273,16
części temperatury termodynamicznej
punktu
potrójnego wody.
36
Przykład 11. Wyraź temperaturę: a) 20 K, b) 25 K, c)
200 K w skali Celsjusza.
T (K) = t (
o
C) + 273,15
W naszym zadaniu: T = –183 + 273,15 = 90,15 K
Przykład 12. Temperatura wrzenia tlenu pod
ciśnieniem standardowym wynosi –183
o
C. Ile
wynosi w skali
bezwzględnej?
Rozwiązanie:
Korzystamy ze wzoru:
T (K) = t (
o
C) + 273,15
a) 20 K odpowiada t = 20 – 273,15 = –253,15
o
C
b) 25 K odpowiada t = 25 – 273,15 = –248,15
o
C
c) 200 K odpowiada t = 200 – 273,15 = –73,15
o
C
Rozwiązanie:
10
37
Do jednostek podstawowych
układu SI należy jednostka
natężenia prądu elektrycznego – amper (A).
Jednostkami podwielokrotnymi
są:
1 mA = 10
–3
A,
1
µA = 10
–6
A.
t
Q
I
s
C
A
Q = I
.
t
Jednostką pochodną jest kulomb C – jednostka
ładunku elektrycznego.
Jednostką wielokrotną jest amperogodzina A · h :
1 A · h = 3600 A·s = 3600 C.
1 kulomb jest to
ładunek elektryczny przepływający
przez
powierzchnię w czasie 1 sekundy, gdy natężenie
prądu płynącego przez tę powierzchnię wynosi 1 A:
1 kulomb = 1 C = 1 A·s (amperosekunda).
38
Z definicji stałej Faradaya wynika, że 1 molowi elektronów odpowiada
ładunek 96 486 C. Z kolei liczba Avogadra, czyli liczba cząstek w
jednym molu wynosi 6,022·10
23
. Oznaczając ładunek pojedynczego
elektronu jako q
e
obliczamy dalej:
Przykład 14. Elektrolizę prowadzono prądem o natężeniu
0,1 A w
ciągu 0,5 godziny. Oblicz jaki ładunek płynął w
ciągu 1 sekundy.
Przykład 13. Oblicz ile wynosi ładunek elektryczny
1 elektronu.
Rozwiązanie:
Q = I
.
t =0,1 A·0,5 h·3600 s/h = 180 C
Rozwiązanie:
q
e
= 96 486 C/mol : (6,022·10
23
) elektronów /mol =
1,6022·10
–19
C/ elektron.
39
Jednostką
potencjału
elektrycznego,
napięcia
elektrycznego U i
siły elektromotorycznej
E
SEM
jest
wolt V.
Jednostką oporu elektrycznego jest om:
1 om = 1 = 1V/1A = 1 kg
· m
2
/(s
3
· A
2
)
Jednostkami podwielokrotnymi są:
1 milisimens = 1 mS = 10
–3
S,
1 mikrosimens = 1 µS = 10
–6
S.
Odwrotnością
oporu
elektrycznego
R
jest
przewodnictwo
elektryczne
(
przewodność
elektryczna).
Jednostką tej wielkości jest simens S:
Wymiarem wolta jest:
1 wolt = 1 V = 1 W/1A = 1 kg·m
2
/(s
3
·A).
Jednostką podwielokrotną jest miliwolt: 1 mV = 10
–3
V.
1 simens = 1 S = 1/
= 1 s
3
· A
2
/( kg·m
2
).
40
b) 1 µS = 10
–6
S
150 µS · 10
–6
S/µS = 1,5·10
–4
S
R = 1 / (1,5 · 10
–4
S) = 0,66·10
4
= 6,6·10
3
R = 6,6 · 10
3
·10
–3
k
= 6,6 k
.
Przykład 15. Zmierzone przewodnictwo roztworu
wynosiło: a) 10 mS, b) 150 µS. Wyraź te wartości w
jednostce SI i oblicz
opór tego roztworu w omach i
kiloomach.
Rozwiązanie:
a) 1 mS = 10
–3
S
10 mS·10
–3
S/mS = 10
–2
S
W związku z tym, że R = 1/
, obliczamy
R = 1/10
–2
S = 10
2
i dalej R = 10
2
·10
–3
k
= 10
–1
k

11
41
• Lepkość dynamiczna – definiuje się ją jako siły tarcia
występujące w cieczach podczas przesuwania się
jednych warstw cieczy
względem drugich.
Jednostką
lepkości
dynamicznej
jest
Pa
.
s
(paskalosekunda).
Jest liczbowo
równa sile przypadającej na jednostkę
powierzchni, potrzebnej do utrzymania jednostkowej
różnicy prędkości między warstwami cieczy odległymi od
siebie o
jednostkę długości.
Wyszukiwarka
Podobne podstrony:
Materiały do wykładu 4 (27 10 2011)
Materiały budowlane wykład3 2010 (2)
MATERIALY DO WYKLADU CZ IV id Nieznany
Wyklad z bankowosci operacje bierne i czynne, Podręczniki i materiały dydaktyczne, wykłądy, finanse
Raki gruczołowe, Studia - materiały, Patofizjologia, Wykłady
07. Układ oddechowy, Studia - materiały, Histologia, Wykłady - histologia
Materialy budowlane wyklady2h
Materiały Budowlane wykład
Rozkład materiału z inf kl III
MATERIALY DO WYKLADU CZ VIII i Nieznany
MATERIALY DO WYKLADU CZ V id 2 Nieznany
Materiały do wykładu z Rachunkowości
Materiały budowlane wykład1 2010 (2)
MATERIALY IV WYKLAD
Materiały do wykładu 4 (28 10 2011)
Materialy budowlane wyklad
Materiały budowlane - Kruszywa 1, Budownictwo S1, Semestr II, Materiały budowlane, Wykłady
Rak krtani, Studia - materiały, Patofizjologia, Wykłady
więcej podobnych podstron