1
ĆWICZENIE 6
Alkohole, fenole, aldehydy, ketony, cukry
I. Badanie właściwości chemicznych alkoholi
1.
Próba z siarczanem(VI) rtęci(II) na alkohole III-rzędowe wg Deniges`a
Reakcję tą dają tylko alkohole III-rzędowe, z których po dehydratacji powstają węglowodory
nienasycone. Powstałe alkeny reagują z HgSO
4
tworząc osady o barwach od żółtej do czerwonej.
Alkohole II-rzędowe dają w tych warunkach tylko zmętnienie, a I-rzędowe jedynie opalescencję,
gdyż szybkość powstawania z nich alkenów jest minimalna.
Wykonanie:
Do około 1 ml odczynnika Deniges`a (roztwór siarczanu(VI) rtęci(II) - w rozcieńczonym kwasie
siarkowym(VI)) dodać 0,5 ml roztworu alkoholu III-rzędowego i ogrzewać próbę we wrzącej łaźni
wodnej, aż do pojawienia się osadu o barwie żółtej. W czasie dalszego ogrzewania barwa żółta
znika.
2
. Próba estryfikacji
Ester metylowy kwasu salicylowego otrzymuje się przez ogrzewanie alkoholu metylowego z
kwasem salicylowym w obecności stężonego kwasu siarkowego(VI) jako katalizatora, a zarazem
środka wiążącego powstającą w reakcji wodę.
OH
C
O
HO
CH
3
H
+
OH
C
O
O CH
3
H
2
O
OH
+
+
kwas salicylowy
salicylan metylu
Wykonanie:
Do
około 1 ml metanolu dodać szczyptę kwasu salicylowego i około 1 ml stężonego kwasu
siarkowego(VI). Po wymieszaniu próbę ogrzewać we wrzącej łaźni wodnej. Po kilku minutach
ogrzewania pojawia się charakterystyczna, żywiczna woń estru metylowego kwasu salicylowego.
3
. Próba jodoformowa Liebena
Spośród alkoholi I-rzędowych reakcji jodowania w opisanych warunkach ulega jedynie alkohol
etylowy. Reakcję tę dają natomiast metyloketony (aceton). Sumaryczny zapis reakcji jest
następujący:
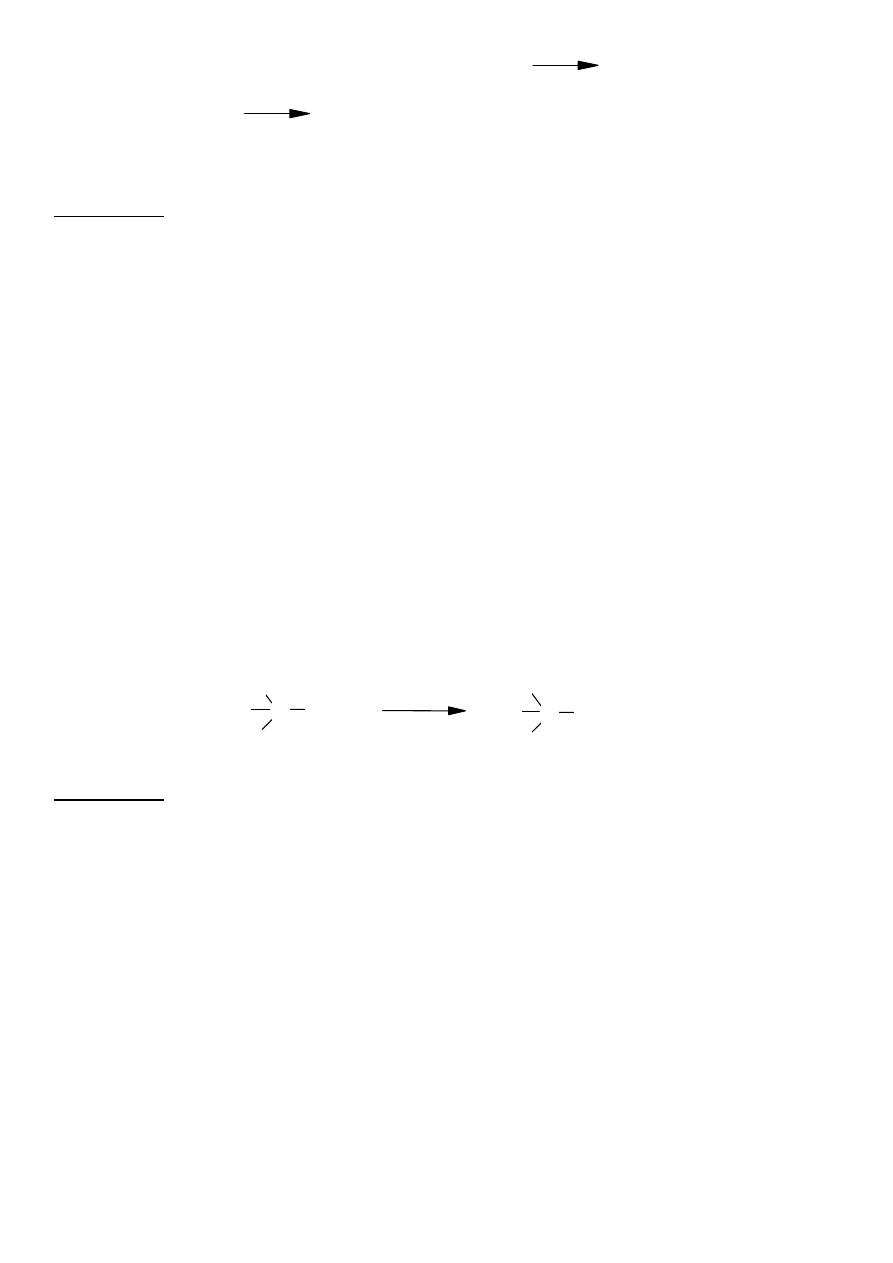
2
CH
3
CH
2
OH
I
2
NaOH
HCOONa
NaI
O
H
2
CHI
3
+
+ 6
+
+
+ 5
jodoform
5
4
Wykonanie:
Do
około 0,5 ml roztworu etanolu dodać 1ml roztworu jodu w jodku potasu (płyn Lugola − I
2
w
KI). Następnie powoli kroplami dodawać 5% wodny roztwór NaOH, aż do zmiany brunatnej barwy
jodu na żółtą. Po wymieszaniu i lekkim ogrzaniu próby w łaźni wodnej, pojawia się
charakterystyczny zapach, a następnie żółte kryształki jodoformu - CHI
3
.
4
. Próba Lucasa
Alkohole I, II i III-rzędowe zachowują się różnie w reakcji z odczynnikiem Lucasa (roztwór
bezwodnego chlorku cynku w stężonym kwasie solnym).
Alkohole I-rzędowe, niższe od heksylowych (C
6
), nie reagują z tym odczynnikiem, dając
roztwór klarowny, co najwyżej lekko ściemniały.
W obecności alkoholi II-rzędowych następuje zmętnienie roztworu, a po 1-1,5 godz.
rozdzielenie się warstw.
W obecności alkoholi III-rzędowych roztwór mętnieje i szybko wytwarzają się dwie warstwy.
ZnCl
2
2
(R)H
C
OH
R
R
+HCl
(R)H
C
R
R
Cl + H O
Wykonanie: (wykonać pod dygestorium, w zespołach 2-osobowych)
Do 3 suchych probówek z korkiem szlifowym, zawierających po 0,5 ml kolejno: alkohol
I-rzędowy, alkohol II-rzędowy i alkohoI III-rzędowy dodać po 5 ml odczynnika Lucasa (bezwodny
ZnCl
2
w stężonym HCl). Probówki zakorkować, wstrząsnąć przez chwilę, po czym odstawić
i zaobserwować po jakim czasie utworzy się zmętnienie i rozdzielenie warstw, wyciągnąć wnioski.
II. Właściwości chemiczne fenoli
Reakcja z chlorkiem żelaza(III)
Chlorek żelaza(III) daje z fenolami i ich pochodnymi, posiadającymi wolną grupę
hydroksylową związki o zabarwieniu fioletowym, fioletowo-niebieskim, niebieskim, zielonym,
rzadziej czerwonym. Przebieg reakcji zależy od budowy fenolu i obecności w jego cząsteczce w
pozycji orto grupy kompleksotwórczej (aldehydowa, ketonowa, karboksylowa, hydroksylowa lub
sulfonowa). Fenole, które nie mają takiej grupy kompleksotwórczej w pozycji orto, reagują z FeCl
3
3
tylko w środowisku wodnym, z utworzeniem soli żelazowych o nietrwałym zabarwieniu. Fenole
mające w pozycji orto grupę kompleksotwórczą dają z FeCl
3
typowe związki chelatowe o trwałym
zabarwieniu.
Wykonanie:
Do około 3 ml wodnego roztworu fenolu dodać 1 kroplę roztworu FeCl
3.
Powstaje fioletowe
zabarwienie, które znika po zakwaszeniu 1M H
2
SO
4
.
III. Ketony, aldehydy, cukry
1
. Próba Legala na metyloketony
Metyloketony reagują z nitroprusydkiem sodu dając barwne produkty. Przebieg reakcji nie
jest znany.
Wykonanie:
Mały kryształek nitroprusydku sodu rozpuścić w około 2 ml wodnego roztworu acetonu i
dodać kilka kropli 2M roztworu NaOH. Roztwór staje się brunatno-czerwony, lecz po pewnym
czasie (ok. 10 min.) barwa jaśnieje. Po zakwaszeniu 2M CH
3
COOH, barwa roztworu ponownie
staje się intensywnie czerwona.
2.
Próba z fuksyną na aldehydy – reakcja Schiffa
Fuksyna jest czerwonym barwnikiem, który pod wpływem ditlenku siarki przechodzi w
bezbarwny kwas bis-N-aminosulfinowy, tzw. odczynnik Schiffa. Związek ten reaguje z dwiema
cząsteczkami aldehydu dając nietrwały produkt przyłączenia, który traci kwas siarkowy(IV) i
powstaje fioletowo-purpurowy barwnik chinoidowy zgodnie z reakcją:
2
SO
3
H
NHSO
2
H
2
H N
C
+ 2R
C
O
H
2
SO
3
H
NH S
O
O
C
OH
H
R
2
_
H
2
SO
3
H N
C
HN
C
NH S
O
O
C
OH
H
R
2

4
Podobnie
reagują 2-deoksycukry (np. 2-deoksyryboza), natomiast inne cukry
posiadające grupę hydroksylową przy węglu sąsiadującym z grupą aldehydową lub ketonową nie
przywracają barwy odbarwionej fuksynie.
Wykonanie:
Do dwóch probówek odmierzyć po około 2 ml roztworu aldehydu mrówkowego
(formaldehydu) i roztworu glukozy, dodać 3-4 krople odczynnika Schiffa i lekko wymieszać. Po
upływie kilku minut roztwór aldehydu mrówkowego zabarwia się na kolor purpurowo-fioletowy,
natomiast roztwór glukozy pozostaje bezbarwny.
3.
Próby redukcyjne na aldehydy i cukry
Aldehydy, w odróżnieniu od ketonów, łatwo utleniają się do kwasów, działają zatem
redukująco. Utlenianie jest możliwe, gdy w mieszaninie reakcyjnej znajdują się akceptory
elektronów. Najczęściej stosowanymi do utleniana grupy aldehydowej akceptorami elektronów są
jony metali ciężkich: Cu
2+
(próby: Fehlinga, Trommera, Hainesa, Benedicta), Bi
3+
(próba
Nylandera) i Ag
+
(próba Tollensa).
Monosacharydy (aldozy i
α-hydroksyketozy) wykazują również zdolność redukowania
powyższych jonów w środowisku alkalicznym, same zaś utleniają się do odpowiednich kwasów.
Aldozy ulegają tej reakcji ze względu na obecność grupy –CHO, natomiast ketozy w środowisku
alkalicznym ulegają izomeryzacji do odpowiedniej aldozy. W roztworach wodnych cukry występują
w stanie równowagi form pierścieniowej z łańcuchową , odpowiedzialną za właściwości redukcyjne
cukru, ale występującą w znikomej ilości i w stałym stosunku do formy pierścieniowej. W
warunkach prób redukcyjnych, podczas zużywania formy łańcuchowej, cząsteczki pierścieniowe
kolejno przechodzą w cząsteczki łańcuchowe. W efekcie tych przemian zwiększa się również ilość
produktów zredukowanych (Cu
2+
— Cu
1+
, Ag
+
— Ag
o
itp.). Właściwości redukcyjne wykazują
także disacharydy, które posiadają wolną, niezablokowaną grupę –OH przy węglu glikozydowym
(półacetalowym).
Utleniane mogą być albo grupa aldehydowa, albo I-rzędowa grupa alkoholowa albo obie
grupy, w zależności od warunków utlenienia. Łagodne utlenianie prowadzi do utlenienia grupy
aldehydowej, w wyniku czego powstają kwasy R-onowe, w wyniku energicznego utleniania
powstają kwasy dikarboksylowe R-cukrowe, a jeśli utlenieniu ulegnie tylko grupa alkoholowa I-
rzędowa powstają kwasy R-uronowe. W tym ostatnim przypadku utlenianie winno odbywać się
tylko po zablokowaniu grupy aldehydowej, co ma miejsce podczas przemian biochemicznych w
żywych organizmach.

5
[O]
[O]
glukoza
kwas glukonowy
kwas glukocukrowy
kwas glukarowy
[O]
C
C
C
OH
OH
H
H
H
H
OH
OH
O
C
grupy
aldehydowej
kwas glukuronowy
/
z blokada
C
C
O
C
C
C
OH
OH
H
H
H
H
OH
C
C
OH
C
O
H
2
OH
C
C
C
OH
OH
H
H
H
H
OH
C
C
C
O
H
2
OH
C
C
C
OH
OH
H
H
H
H
OH
OH
O
C
C
OH
C
O
H
H
HO
HO
HO
HO
energiczne
utlenianie
lagodne
utlenianie
3a) Próba Fehlinga
W próbie Fehlinga po zmieszaniu odczynników Fehling I (CuSO
4
×5H
2
O w rozcieńczonym
H
2
SO
4
) i Fehling II (roztwór winianu sodowo-potasowego i NaOH) powstaje zasadowy roztwór
kompleksu miedzi z winianem, co zapobiega wytrącaniu się osadu Cu(OH)
2
i maskowaniu
końcowego
produktu
reakcji - czerwonego osadu Cu
2
O.
Dodany aldehyd ulega utlenieniu oddając elektrony, których akceptorem jest
dwuwartościowa miedź. Kompleks miedzi z winianem po ogrzaniu rozpada się i powstaje
czerwony osad tlenku miedzi(I).
C
2
H
4
O
2
(COO)
2
NaK
CuSO
4
NaOH
-
Na
2
SO
4
2
+
2
+
2
+ 6H
2
O
4
H
C
2
H
4
O
2
(COO)
2
O
C
Cu
2+
H
2
O
2
x
x
+
R
3
OH
C
2
H
4
O
2
(COO)
2
NaK
O
C
H
2
O
Cu
2
O
R
+
ogrzanie
2
+
+
2

6
Wykonanie:
Zmieszać po 1 ml roztworów Fehling I i II, ogrzać do wrzenia aby sprawdzić czy nie wystąpi
redukcja własna odczynnika. Następnie dodać kilka kropli roztworu (aldehydu mrówkowego,
glukozy, sacharozy) i ponownie ogrzać. Pojawia się osad o barwie pomarańczowej lub czerwonej,
zależnie od stanu rozproszenia powstającego tlenku miedzi(I). Sacharoza tej próby nie daje.
3b) Próba Trommera z glukozą
Próbę redukcyjną Cu
2+
→ Cu
1+
można wykonać także bez stosowania winianu sodowo-
potasowego, jako związku solubilizującego Cu(OH)
2
, gdyż sam cukier posiada kilka grup
hydroksylowych, które mogą w podobny sposób solubilizować wodorotlenek miedzi. W próbie
Trommera ważne jest dodanie tylko nieznacznej ilości roztworu CuSO
4,
aby nie przekroczyć
molekularnego stosunku cukier : Cu(OH)
2
(1:1) i wtedy otrzymuje się efekt próby identyczny, jak w
próbie Fehlinga. Jeśli jednak roztwór CuSO
4
zostanie dodany w nadmiarze, to po ogrzaniu
otrzymuje się czarny osad CuO, który maskuje powstający równolegle czerwony osad Cu
2
O
.
Wykonanie:
Do 1 ml roztworu glukozy dodać około 1 ml 2 M roztworu NaOH, po czym dodawać
kroplami roztwór CuSO
4
dopóty, dopóki strącający się Cu(OH)
2
jeszcze się rozpuszcza przy
wstrząsaniu płynu. Podgrzać w płomieniu palnika górną część płynu do wrzenia. Powstaje żółto-
pomarańczowy lub czerwony osad tlenku miedzi(I). Gdyby dodano zbyt dużo CuSO
4
i wytrącający
się osad Cu(OH)
2
nie rozpuszczał się, należy przed ogrzaniem próby osad odsączyć.
3c) Próba Tollensa (próba lustra srebrowego)
— 1 próba na salę
Odczynnik Tollensa stanowi roztwór wodorotlenku diaminasrebra, który przygotowuje się
bezpośrednio przed użyciem w czystej, dokładnie odtłuszczonej probówce.
Wykonanie:
Do dokładnie odtłuszczonej probówki odmierzyć 1 ml 0,1 M roztworu AgNO
3
i wkraplać
ostrożnie 2 M roztwór amoniaku NH
3
·H
2
O. Najpierw powstaje zmętnienie i osad AgOH, który po
dodaniu dalszych kropli roztworu amoniaku rozpuszcza się wskutek powstania związku
kompleksowego [Ag(NH
3
)
2
]OH. Do przyrządzonego w ten sposób odczynnika dodać 8 kropli
badanego roztworu (1% roztwór glukozy lub laktozy), zmieszać i ogrzewać na wrzącej łaźni
wodnej lub w płomieniu palnika. Po pewnym czasie na ściankach probówki wydziela się
metaliczne srebro w postaci lustra.
glukoza
H
2
O
Ag(NH
3
)
2
OH
Ag
kwas glukonowy
NH
3
+
+
+
2
4
+
2
2
7
3d) Próba Barfoeda z glukozą i laktozą
Próba służy do odróżnienia cukrów prostych od dwucukrów redukujących. Dwucukry
redukujące dają dodatni wynik reakcji dopiero po dłuższym ogrzaniu, a więc dopiero po hydrolizie
do cukrów prostych. Próba jest stosowana w diagnostyce cukromoczu dla odróżnienia redukcji
pochodzącej od glukozy lub od laktozy.
Wykonanie:
Do dwóch probówek odmierzyć po 0,5 ml odczynnika Barfoeda (roztwór octanu miedzi(II)
i kwasu octowego), po czym do pierwszej dodać 1 ml roztworu glukozy, do drugiej laktozy,
zmieszać i ogrzewać we wrzącej łaźni wodnej około 3 minut. Osad tlenku miedzi(I) pojawia się
tylko w probówce zawierającej glukozę. Po dalszym ogrzewaniu (ok. 0,5 godziny) osad tlenku
miedzi(I) pojawia się również w probówce zawierającej laktozę.
4.
Próby grupowe na cukry
Stężone kwasy, takie jak kwas solny, siarkowy(VI), a nawet octowy odwadniają cząsteczki
monosacharydów, w wyniku czego powstają aldehydowe pochodne furanu, z pentoz powstaje
furfural, a z heksoz hydroksymetylenofurfural
O
C
C
HOCH
2
O
H
H
H
H
O
furfural
H
O
hydroksymetylenofurfural
H
H
Związki te, kondensując z fenolami, dają barwne pochodne triarylometanowe (w próbach
Molischa, tymolowej) lub ksantenowe (w próbach Biala, Seliwanowa). Reakcje barwne dają nie
tylko monosacharydy, ale również oligo- i polisacharydy, które pod wpływem kwasu ulegają
hydrolizie do cukrów prostych.
Próby Molischa i tymolowa są próbami grupowymi na cukry. Wynik ujemny wyklucza
obecność węglowodanów w środowisku, natomiast wynik dodatni nie jest jeszcze dowodem
wystarczającym dla stwierdzenia ich obecności. Reakcje barwne z fenolami dają również inne
substancje (aldehydy, aceton, kwasy: mlekowy, cytrynowy, mrówkowy i inne).
4a) Próba Molischa
Wykonanie:
Do około 1 ml roztworu cukru dodać 2 krople alkoholowego roztworu α-naftolu, dobrze
wymieszać i podwarstwić 1 ml stężonego H
2
SO
4.
Po kilku minutach,
na granicy warstw, powstaje
czerwono-fioletowy pierścień. Czasami poniżej pierścienia pojawia się krążek zielony, który
pochodzi od zanieczyszczeń α-naftolu.

8
4b) Próba Seliwanowa na ketozy
W środowisku stężonego HCl ketoheksozy ulegają odwodnieniu o wiele łatwiej niż
aldoheksozy. Powstały hydroksymetylenofurfural tworzy z rezorcyną (1,3-dihydroksybenzen)
kompleks o barwie czerwonej. Próbę uważa się za dodatnią jedynie wtedy, gdy zabarwienie
występuje przed upływem 1 minuty. Przy dłuższym ogrzewaniu, odczyn ten wypada również
dodatnio z sacharozą i inuliną, które ulegają hydrolizie do fruktozy.
Wykonanie:
Do około 1 ml odczynnika Seliwanowa (0,5% roztwór rezorcyny w kwasie solnym
rozcieńczonym wodą w stosunku 1:2) dodać 4-5 kropli roztworu fruktozy, zmieszać i ogrzewać we
wrzącej łaźni wodnej ok. 1 minuty, po czym oziębić. W obecności ketoz próba barwi się na
jasnoczerwono, zaś przy dużych ich stężeniach powstaje osad.
4c) Próba Biala na pentozy
Zasada próby oparta jest również na zachowaniu się cukru wobec stężonych kwasów, po
czym furfural kondensuje z orcyną w obecności FeCl
3
.
Wykonanie:
Do około 1 ml odczynnika Biala (roztwór orcyny w stężonym kwasie solnym z dodatkiem
FeCl
3
) dodać 2 krople roztworu pentozy (ksylozy) i ogrzać we wrzącej łaźni wodnej. Po
kilkudziesięciu sekundach roztwór zabarwia się na zielono. Heksozy w powyższych warunkach
tworzą połączenia o barwie żółtej.
4d) Próba z jodem na skrobię
Wykonanie:
Do około 1 ml kleiku skrobiowego dodać 1 kroplę roztworu jodu w jodku potasu. Powstaje
niebieskie zabarwienie znikające po krótkim ogrzaniu w płomieniu palnika i powracające po jej
oziębieniu.
5.
Inwersja sacharozy
Skręcalność właściwa sacharozy = + 66,5, glukozy = + 52,5, fruktozy = – 92,5 .
W roztworze sacharozy po hydrolizie zmienia się kąt skręcenia płaszczyzny światła
spolaryzowanego z (+) na (–). Proces ten nazywamy inwersją sacharozy, a roztwór cukrem
inwertowanym. Zmiana kierunku skręcalności po hydrolizie sacharozy wynika z wypadkowej
skręcalności produktów, z których fruktoza (lewuloza) ma większą skręcalność w lewo niż glukoza
w prawo.

9
Wykonanie:
Do 15 ml 10% roztworu sacharozy dodać 15 ml 2 M HCl, zmieszać, napełnić rurkę
polarymetryczną i natychmiast odczytać skręcalność roztworu w polarymetrze. Po 1 godzinie
odczyt skręcalności powtórzyć i zaobserwować zmianę kąta skręcenia płaszczyzny światła
spolaryzowanego.
W celu zbadania właściwości redukujących roztworu sacharozy przed i po hydrolizie,
można wykonać próbę redukcyjną na cukry (np. Fehlinga).
Wyszukiwarka
Podobne podstrony:
2 9 10 Alkohole i Fenole Aldehydy i Ketony
Chemia alkohole, fenole, aldehydy, ketony
2 9 10 Alkohole i Fenole Aldehydy i Ketony
instrukcja aldehydy ketony cukry
26. Aldehydy ketony i cukry, chemia(2)
Alkohole, aldehydy, ketony, kwasy, estry i mydła zadania
Powstórka z chemii alkohole, aldehydy, ketony
Węglowodory, ketony, alkohole, aldehydy, ketony, estry, kwasy
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
Aldehydy i ketony
Alkohole i fenole 3 id 58102 Nieznany
instrukcja węglowodory, alkohole i fenole
test alkohole i fenole chem, chemia gimnazjum
Aldehydy, ketony, kwasy, ALDEHYDY
Aldehydy, ketony i kwasy - test 2, 1p
więcej podobnych podstron