
Chemia kliniczna
Dla studentów IV roku Analityki Medycznej
2011/2012
Strona 1 z 6
Białka osocza
Rola białek
utrzymanie objętości krwi krążącej i równowagi wodnej
organizmu (albuminy)
funkcje transportowe (albuminy, haptoglobina,
transferyna, transkobalamina, transkortyna, białko
wiążące tyroksynę – TBG)
enzymy, ich inhibitory oraz aktywatory
białka systemu odpornościowego (immunoglobuliny)
zapewnienie hemostazy (białka układu krzepnięcia)
Stężenie białka całkowitego
W osoczu wyższe niż w surowicy
W moczu?
W płynie mózgowo-rdzeniowym?
W płynach z jam ciała?
Stężenie zależy od równowagi pomiędzy wytwarzaniem a
degradacją/wydzielaniem
Hiperproteinemia
Hipergammaglobulinemie
Monoklonalne
Poliklonalne
Odwodnienie
Błąd przedlaboratoryjny (staza!)
Hipoproteinemia
Najczęściej hipoalbuminemia
Zahamowanie syntezy lub zwiększona utrata białek
Rozcieńczenie składników krwi wodą, zmiana dystrybucji
wody – naczynia krwionośne/przestrzeń pozakomórkowa
Efekt ortostatyczny
Przewodnienie
Błąd pobrania (z domieszką płynów infuzyjnych)
Dysproteinemie odczynowe
Zapalenie ostre (reakcja ostrej fazy)
Wzrost dodatnich białek ostrej fazy:
białko C-reaktywne
fibrynogen
haptoglobina
białko A-amyloidu (SAA)
α
1
-antychymotrypsyna
α
1
-kwaśna glikoproteina
ceruloplazmina
składniki dopełniacza C2, C3 i C4
Spadek ujemnych białek ostrej fazy:
albumina
prealbumina
transferyna

Chemia kliniczna
Dla studentów IV roku Analityki Medycznej
2011/2012
Strona 2 z 6
Dysproteinemie odczynowe
Przewlekłe zapalenia
Zwiększenie stężenia α
2
-globulin (umiarkowane)
i γ-globulin (znaczne)
Zmniejsza się stężenie albumin
Choroby wątroby (marskość)
Zwiększa się stężenie γ-globulin
Zmniejsza się stężenie albumin, α
1
- i α
2
-globulin,
prealbumin i protrombiny
Zaburzenia równowagi białkowej
Utrata białka z ustroju
przez nerki (zespoły nerczycowe – selektywna utrata białka)
We krwi następuje zwiększenie stężenia α
2
- i β-globulin, α
2
-
makroglobuliny, β-lipoprotein. Zmniejsza się stężenie białka
całkowitego, albumin.
W moczu rośnie stężenie białka (fizjologicznie 40–80 mg/dobę),
są to głównie białka o małej masie cząsteczkowej (to zależy od
rodzaju białkomoczu).
przez przewód pokarmowy (utrata białka jest nieselektywna)
Znaczne zmniejszenie stężenia białka całkowitego, niewielkie
przesunięcia we frakcjach na korzyść α
1
- i α
2
-globulin.
przez skórę (oparzenia, rozległe sączące zapalenia), do płynów
wysiękowych i przesiękowych oraz z krwotokami – wszystkie
białka.
Zaburzenia równowagi białkowej
Niedożywienie
niedostateczny dowóz białka w pokarmach
zaburzenia wchłaniania i trawienia białka
wzmożony katabolizm (gorączka, sepsa, nowotwór)
zmniejszenie stężenia albumin, prealbumin, białka wiążącego
retinol (RBP – retinol binding protein)
Zaburzenia syntezy białka
Zaburzenia uwarunkowane genetycznie (rzadko wpływ
na stężenie białka całkowitego)
analbuminemia, bisalbuminemia
niedobór α
1
-antytrypsyny
niedobór globuliny wiążącej tyroksynę
ahaptoglobinemia
aceruloplazminemia
niedobór składników dopełniacza
afibrynogenemia
niedobór antytrombiny III
agammaglobulinemia (dotycząca wszystkich klas Ig albo
selektywny niedobór IgG, IgA lub IgM)
Zaburzenia syntezy białka
Gammapatie monoklonalne (może dochodzić do
wzrostu białka całkowitego)
Szpiczak mnogi
Makroglobulinemia Waldenströma
Choroba łańcuchów lekkich
Gammapatie poliklonalne
Przewlekle stany zapalne
Choroby wątroby
Choroby autoimmunizacyjne, np. choroby reumatoidalne, toczeń
układowy, sklerodermia, sarkoidoza
Albuminy
α
1-antytrypsyna, α1-kwaśna glikoproteina (AAG – orozomukoid),
α
-lipoptoteiny (HDL)
białko wiążące tyroksynę (TBG), α1-antychymotrypsyna,
α
1-antytrypsyna
Haptoglobina, ceruloplazmina, α2-makroglobulina
β
-lipoproteiny (Apo B = LDL), transferyna, hemopeksyna, białka układu
dopełniacza,
fibrynogen (osocze)
CRP
Immunoglobuliny IgG, IgA, IgM
Chemia kliniczna
Dla studentów IV roku Analityki Medycznej
2011/2012
Strona 3 z 6
Frakcja
Białko
Funkcja
Albuminy
Albumina
Utrzymuje ciśnienie onkotyczne, białko transportowe
α1-globuliny α
1
-antytrypsyna
α
1
-antychymotrypsyna
α
1
-kwaśna glikoproteina
TBG (thyroxine binding globulin)
α-lipoptoteiny
Inhibitor proteinaz, BOF
Inhibitor chymotrypsyny, BOF
BOF (orozomukoid)
białko wiążące tyroksynę
frakcja lipoprotein (HDL)
α2-globuliny Haptoglobina
α
2
-makroglobulina
Ceruloplazmina
Antytrombina III
Transport wolnej Hb, BOF
Inhibitor proteinaz, diagnostyka uszkodzenia cewek
nerkowych
Transport miedzi, BOF
Inhibitor trombiny
β-globuliny
Transferyna
Hemopeksyna
β
1
-mikroglobulina
β-lipoproteiny
Białka układu dopełniacza
(C1S, C4, C5 )
Properdyna
Transport żelaza, ujemne BOF
Transport wolnego hemu
Białko immunosupresyjne, diagnostyka białkomoczu
Frakcja lipoprotein (LDL)
Reakcje odpornościowe
Tworzy z jonami Mg i składnikiem C3 dopełniacza
układ (procesy odporności - wirusy, bakterie)
γ-globuliny
Immunoglobuliny
CRP (między β i γ)
Lizozym
Fibrynogen
(osocze, między β i γ)
Przeciwciała różnych klas
BOF, rola eliminacyjna
Działanie bakteriobójcze
Białko układu krzepnięcia, BOF (białko ostrej fazy)
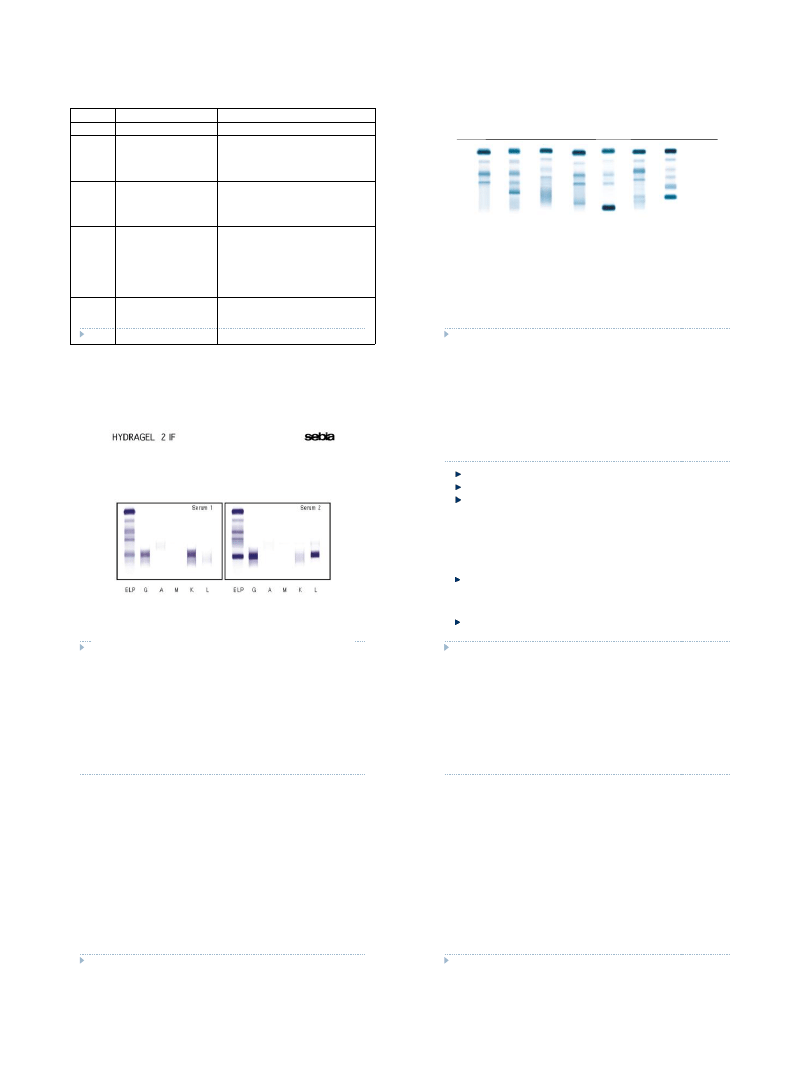
Przypadek 1- hipogammaglobulinemia
Przypadek 2- osocze – obecny fibrynogen
Przypadek 3- hipergammaglobulinemia
Przypadek 4- nikłe białko monoklonalne
Przypadek 5- białko monoklonalne
Przypadek 6- rozrost poliklonalny
Przypadek 7- białko biklonalne
1
2
3
4
5
6
7
Białko średniej wielkości – 66 kDa,
Syntetyzowana w wątrobie, okres półtrwania 14 dni
Rola Albumin:
•
Regulacja ciśnienia onkotycznego
•
Transport:
Kwasów tłuszczowych
Bilirubiny
Leków
Hormonów sterydowych i hormonów tarczycy
Ca, Mg
Zaburzenia genetyczne:
•
Bisalbuminemia
•
Analbuminemia (niskie ciśnienie tętnicze, obrzęki)
Metody pomiaru:
1. Interakcja z barwnikami np. zieleń bromokrezolowa
2. Immunonefelometrycznie – mocz (mikroalbuminuria)
Albumina
Białko C- reaktywne (CRP)
Czynnik ostrej fazy – receptor polisacharydu C błony komórkowej pneumokoków
CRP:
Wiąże składniki obce dla organizmu człowieka – składniki bakterii, grzybów, pasożytów
Aktywuje makrofagi (fagocytoza)
Aktywuje układ dopełniacza – klasyczna droga
Wzrost:
Pojawia się we krwi w 12-24 godz. od zaistnienia stanu zapalnego/choroby
Maksymalne stężenie osiąga w 48 godz.
Normalizacja następuje po 10 dniach
Stany zapalne: do 1000-krotny wzrost stężenia w 1-2 dobie
Znaczący wzrost: zawał mięśnia sercowego, odrzut przeszczepów, białaczka
Umiarkowany wzrost: ciąża i przewlekłe stany zapalne (liszaj rumieniowaty, kolagenozy,
wrzodziejące zapalenie jelita grubego)
Nie zawsze występuje korelacja CRP – OB!
Metody oznaczania : immunonefolometria (metoda standardowa i ultraczuła – inne
zastosowanie oznaczeń)
Znaczenie testu CRP:
Rozpoznawanie i monitorowanie przebiegu ostrych zapaleń
W chorobach infekcyjnych różnicowanie zakażeń wirusowych od
bakteryjnych wzrost > 150 mg/l dowodzi zakażenia bakteryjnego).
Powikłania pooperacyjne (zakażenia, martwice tkanek)
Posocznica noworodków
Wczesne wykrywanie infekcji bakteryjnych
Kontrola skuteczności antybiotykoterapii i leczenia przeciwzapalnego
Różnicowanie etiologii wrzodów żołądka od choroby Crohna
Ocena skuteczności leczenia chorób reumatoidalnych
Nowotwory złośliwe, zawał mięśnia sercowego, białaczki, odrzucanie
przeszczepu
Czynnik ryzyka miażdżycy: oznaczanie CRP metodą ultraczułą:
1 – 5 mg/l

Chemia kliniczna
Dla studentów IV roku Analityki Medycznej
2011/2012
Strona 4 z 6
AAT – α1-antytrypsyna
Inhibitor proteaz – odpowiada za 90% ogólnej aktywności
antyproteolitycznej krwi
Ok. 51 kDa
Hamuje:
trypsynę (ostre zapalenie trzustki)
trombinę (aktywacja procesu krzepnięcia)
plazminę (aktywacja fibrynolizy)
elastazę (degradacja tkanki łącznej)
ATT hamuje wytwarzanie wolnych rodników
Występuje w kilku wariantach genetycznych o różnej
aktywności inhibitorowej:
MM (100%)
SS (50%)
ZZ (15%)
Pi (0%)
Występowanie wariantów ZZ i Pi prowadzi do ciężkich zaburzeń
funkcji wątroby)
Niedobór aktywności inhibitorowej/brak AAT:
Dzieci: żółtaczka noworodków (powiększona wątroba
gromadząca AAT, zagrażająca marskość wątroby)
Dorośli: rozwój rozedmy płuc, rozstrzeni oskrzeli z
powodu braku hamowania elastazy wydzielanej przez
makrofagi płucne
Metody oznaczania:
stężenie AAT – immunonefelometria
warianty AAT – ogniskowanie izoelektryczne
Haptoglobina (Hp)
Alfa-2-kwaśny glikoproteid (białko ostrej fazy)
Rola:
Wiązanie i transport hemoglobiny pozakrwinkowej (zapobiega utracie Fe
przez nerki)
Powstający kompleks : Hgb-Hp wiązany jest przez RES – wątroba
Masywna hemoliza wewnątrznaczyniowa powoduje całkowite
wysycenie Hp – zespół hemolityczno-mocznicowy (HUS)
Masywna hemoliza wewnątrznaczyniowa może powodować
przejściową ahaptoglobinemię
W ostrych stanach zapalnych:
Hp wzrasta 4x – 6x,
Maksymalny poziom osiąga 2-4 dnia choroby
Metody oznaczania: immunonefelometria (aktywność
pseudoperoksydazy)
Fibrynogen
Białko układu krzepnięcia, białko ostrej fazy
Zmiany stężenia:
Obniżenie: choroby wątroby
Wzrost poziomu w nerczycy (do 10g/l)
Mierny wzrost w procesie miażdżycowym (koreluje z poziomem
LDL-CH)
Monitorowanie poziomu fibrynogenu w:
leczeniu trombolitycznym streptokinazą
powikłaniach zagrażających wykrzepianiem wewnątrznaczyniowym
(DIC)
Metoda oznaczania: immunonefelometria grawimetrycznie -
fibryna
Ferrytyna
Białko 480 kDa magazynujące żelazo
Tkankowa: wiąże do 2500 atomów Fe
Występuje jako rozproszona w cytoplazmie lub jako agregaty w makrofagach,
syderoblastach
Krążąca we krwi: 15 - 300 μg/l
Powstaje z puli komórek parenchymalnych ulegających apoptozie lub
nekrozie (30%) oraz w wyniku sekrecji przez komórki RES (70%)
Zmiany stężenia:
spadek poziomu ferrytyny = miernik niedoboru żelaza
wzrost poziomu ferrytyny
Infekcje
Reakcje cytolizy (ostre wirusowe zapalenie wątroby),
Stany zapalne
Przeładowanie żelazem (w tym hemochromatoza)
stany nowotworowe
AIDS
Oznaczanie: immunochemiluminescencja (ultraczuła metoda
immunochemiczna)
Ceruloplazmina
135 kDa
Magazynuje 6 -7 atomów miedzi
Białko ostrej fazy:
podwyższony poziom w stanach zapalnych i nowotworowych
Posiada aktywność enzymatyczną oksydazy [Fe(II) → Fe(III)]
Krążąca we krwi: 18 - 45 mg/dl
Syntetyzowana w wątrobie
Wiązanie miedzi zapobiega toksycznemu oddziaływaniu jonów Cu na
organizm.
Choroba Wilsona polega na wzroście stężenia Cu (dializowalnej - > 5%)
natomiast spadkowi stężenia CER we krwi.
Choroba Wilsona przejawia się obrzękiem i uszkodzeniem wątroby (dzieci)
– w starszym wieku dominują objawy neurologiczne
Oznaczanie: immunonefolometria

Chemia kliniczna
Dla studentów IV roku Analityki Medycznej
2011/2012
Strona 5 z 6
Immunoglobuliny – niedobory
Nabyte:
Nowotwory układu chłonnego
Splenektomia (utrata śledziony)
Jelitowe zespoły utraty białka
Cytostatyki
Wrodzone – rzadkie
Hipergammaglobinopatie – poliklonalne
IgM: stany zapalne – ostre
Ostre wirusowe zapalenie wątroby
Marskość wątroby
Pasożyty wątroby
IgG: stany zapalne – przewlekłe
Marskość wątroby
Autoimmunizacja (GPP, toczeń rumieniowaty, dermatozy,
sarkoidoza)
IgA: stany zapalne – przewlekłe
Autoimmunizacja
Choroby dróg oddechowych
Hipergammaglobinopatie - monoklonalne
jeden klon plazmocytu (limfocyt B)
55% IgG
25% IgA
Choroba łańcuchów lekkich (białko Bence-Jonesa w moczu)
łańcuchy lekkie (amyloidoza) - wydzielane w moczu, powodują
uszkodzenia nerek, nerczyca, nerka szpiczakowa, zmiany kostne
Choroba łańcuchów ciężkich
IgM – makroglobulinemia Waldenströma
krioglobuliny, przebieg choroby łagodniejszy
Inne oznaczane białka specyficzne:
Transferyna
Prokalcytonina
Orozomukoid (α1-kwaśna glikoproteina)
Białko wiążące retinol
Prealbumina
α2-makroglobulina
Składniki dopełniacza C3 i C4
Cystatyna C
Mioglobina
SAA
β2-mikroglobulina
Fizjologia nefronu
Jeden milion
nefronów filtruje
180 litrów
osocza
w ciągu
jednego dnia
produkując w
przybliżeniu 1,5
litra moczu.
Wydzielanie
kanalikowe
(
białko Tamma-
Horsfalla)
Mocz końcowy zawiera 1/3
albumin i 2/3 globulin
Reabsorpcja
kanalikowa
albumina
transferryna
immunoglobuliny
mikroproteiny
Filtracja
kłębuszkowa
albumina
transferryna
immunoglobuliny
mikroproteiny
mikroproteiny
Białkomocz
Prawidłowo <150 mg/doba, Alb <30 mg/doba
przednerkowy:
białko Bence-Jonesa
Hb (anemia hemolityczna)
mioglobina (urazy mięśni)
kłębuszkowy: wydalanie 2–6 g białka/dobę
nieznaczny (selektywny) – wydalanie Alb, Tf
ciężki (białkomocz nieselektywny)
białkomocz fizjologiczny (np. powysiłkowy)
Kanalikowy: zaburzenia resorpcji białek w nerce – wydalane są
bardzo małe białka:
β-2-mikroglobulina 11 kDa (B-2-MG)
lizozym 14,5 kDa

Chemia kliniczna
Dla studentów IV roku Analityki Medycznej
2011/2012
Strona 6 z 6
Białkomocz
białko
prawidłowo
kłębuszkowy kanalikowy
mieszany
Albumina
mg/dobę
< 30
> 30
± 30
> 30
B-2-MG
mg/dobę
< 0,25
< 0,25
> 0,25
> 0,25
–
+
ROZDZIAŁ GŁÓWNYCH BIAŁEK MOCZU
NA
HYDRAGEL 5 PROTEINURIE
Markery
uszkodzenia
kanalika
(MW < 67 kDa)
Markery
uszkodzenia
kłębuszka
(MW > 67 kDa)
Albumina (MW : 67 kDa)
a
1-mikroglobulina (MW : 33 kDa)
Wolne lekkie łańcuchy (MW
25 kDa)
Transferyna (MW : 80 kDa)
Cystatyna (MW : 11 kDda)
b
2-mikroglobulina (MW :12 kDa)
Lizozym (MW : 15 kDa)
RBP (MW : 21 kDa)
Dimer wolnych lekkich łańcuchów
(MW
50 kDa)
Ig G (MW : 160 kDa)
Ig A (MW : 165 kDa)
Haptoglobiny
Punkt nałożenia próbki
a
2-makroglobulina (MW :900 kDa)
Wyszukiwarka
Podobne podstrony:
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
ZP wyklad1 id 592604 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
or wyklad 1 id 339025 Nieznany
II Wyklad id 210139 Nieznany
cwiczenia wyklad 1 id 124781 Nieznany
BP SSEP wyklad6 id 92513 Nieznany (2)
MiBM semestr 3 wyklad 2 id 2985 Nieznany
algebra 2006 wyklad id 57189 Nieznany (2)
olczyk wyklad 9 id 335029 Nieznany
Kinezyterapia Wyklad 2 id 23528 Nieznany
AMB ME 2011 wyklad01 id 58945 Nieznany (2)
AWP wyklad 6 id 74557 Nieznany
PRAWO SPORTOWE Wyklady(1) id 38 Nieznany
AGH Wyklad 4 id 52883 Nieznany (2)
więcej podobnych podstron