
Ćwiczenie nr 4.
Wybrane elementy układów dyspersyjnych. Wyrażanie stężeń
roztworów. Obliczanie stężeń i przygotowywanie roztworów
kwasów zasad i soli.
Układami dyspersyjnymi nazywamy układy złożone z co najmniej dwóch
substancji. Jedna z nich stanowi ośrodek rozpraszający, czyli jest środowiskiem,
w którym znajduje się substancja rozproszona. W zależności od stanu skupienia
środowiska i substancji rozproszonej może istnieć dziewięć rodzajów układów
dyspersyjnych:
1) gaz w gazie,
2) ciecz w gazie,
3) ciało stałe w gazie,
4) gaz w cieczy,
5) ciecz w cieczy,
6) ciało stałe w cieczy,
7) gaz w ciele stałym,
8) ciecz w ciele stałym,
9) ciało stałe w ciele stałym (roztwór stały).
Biorąc pod uwagę stopień rozdrobnienia możemy rozróżnić następujące
układy dyspersyjne:
1. Zawiesiny — układy nietrwałe zawierające cząstki rozproszone o bardzo
dużych rozmiarach, widoczne gołym okiem lub przez mikroskop, osadzające
się na dnie zbiornika, gdy mają większą gęstość od ośrodka dyspersyjnego, lub
.wypływające (unoszące się) do góry, gdy mają mniejszą gęstość. Za zawiesiny
uważamy zwykle układy z cząstkami o rozmiarach większych niż 100 nm.
2. Roztwory właściwe — układy o rozdrobnieniu cząsteczkowym (moleku-
larnym), bardzo trwałe i nie rozdzielające się w czasie długotrwałego stania.
Cząstki rozproszone są pojedynczymi cząsteczkami lub mają rozmiary rzędu
pojedynczych cząsteczek.
3. Roztwory koloidalne (roztwory niewłaściwe), w których cząstki rozdrob-
nione mają rozmiary mniejsze niż cząstki zawiesin, a większe niż cząstki roz-
proszone w roztworach właściwych. Drobne cząstki substancji rozproszonej
roztworu koloidalnego można zobaczyć za pomocą ultramikroskopu, a naj-
drobniejsze są widoczne przez mikroskop elektronowy. .
ROZTWORY WŁAŚCIWE
Roztwory właściwe są to jednorodne układy doskonale zmieszanych z sobą
cząsteczek ośrodka rozpraszającego i cząsteczek substancji rozproszonej. W roz-
tworach właściwych zachodzi dokładne wzajemne przenikanie się rozpuszczal-
nika i ciała rozpuszczonego, przy czym za rozpuszczalnik przyjmujemy sub-
stancję, która zachowuje swój pierwotny stan skupienia. Na przykład sól NaCl
rozpuszcza się w wodzie, wodór rozpuszcza się w metalach. W przypadku gdy
obie substancje znajdują się w tym samym stanie skupienia (np. ciecz rozpuszcza
się w cieczy), za rozpuszczalnik przyjmujemy składnik występujący w większej
ilości.
Procesy dyfuzji cząsteczek w cieczach zachodzą wolniej niż w gazach, lecz
dzięki nim w całej objętości cieczy istnieje jednakowe stężenie ciała rozpuszczo-
nego. Na ogół najlepiej rozpuszczają się nawzajem substancje chemicznie po-
dobne. Substancje niepolarne, takie jak benzen, rozpuszczają dobrze inne sub-
stancje niepolarne (np. naftalen). Natomiast substancje polarne rozpuszczają
inne substancje polarne. Związki jonowe nie rozpuszczają się na ogół w substan-
cjach niepolarnych (np. NaCl z benzenem- nie tworzy roztworu), natomiast
łatwo rozpuszczają się w substancjach polarnych (np. NaCl rozpuszcza się w
wodzie). Na jony kryształu jonowego umieszczonego w rozpuszczalniku po-
larnym działają dipolowe cząsteczki rozpuszczalnika, które powodują zmniej-
szenie sił przyciągania między jonami w sieci krystalicznej. Podczas rozpusz-
czania zachodzą często efekty cieplne powodujące oziębienie lub ogrzanie ukła-
du. Na przykład, ciepło rozpuszczania Li
2
C0
8
w wodzie jest dodatnie, a dla
AgNO
3
jest ujemne. Ciepło rozpuszczania ciał stałych w cieczy zależy od
względnej wartości dwóch energii — energii potrzebnej do rozerwania sieci kry-
stalicznej (energii sieci krystalicznej) i energii wydzielanej podczas solwatacji
cząsteczek.
Jeżeli energia solwatacji jest większa od energii sieci krystalicznej, to proces
rozpuszczania jest egzotermiczny a jeśli mniejsza, to endotermiczny. Dla NaCl
energia sieci jest w przybliżeniu równa energii hydratacji, a więc ciepło rozpu-
szczania NaCl (różnica tych dwóch wartości) jest w tym przypadku zbliżone
do zera.
Czasem roztwór dwóch cieczy ma objętość mniejszą niż suma objętości
składników (np. roztwór alkoholu C
2
H
5
OH w wodzie),. Efekty cieplne rozpu-
szczania oraz zmiany objętości świadczą, że nie można rozpatrywać roztworów
wyłącznie jako mieszanin mechanicznych — są one układami utworzonymi z
cząsteczek rozpuszczalnika i substancji rozpuszczonej oraz często z nietrwałych
produktów ich oddziaływania.
W miarę rozpuszczania substancji stałej w ciekłym rozpuszczalniku stężenie
roztworu wzrasta do pewnej wartości granicznej. Roztworem nasyconym nazy-
wamy roztwór zawierający największą ilość substancji stałej, jaką określona
objętość danego rozpuszczalnika jest zdolna rozpuścić w danych warunkach
temperatury. Miarą rozpuszczalności danej substancji w rozpuszczalniku jest
stężenie roztworu nasyconego. Stopień nasycenia zależy od natury ciał tworzą-
cych roztwór, w wysokim stopniu od temperatury, a w mniejszym stopniu od
ciśnienia. Na ogół rozpuszczalność ciał stałych wzrasta wraz z temperaturą. Za-
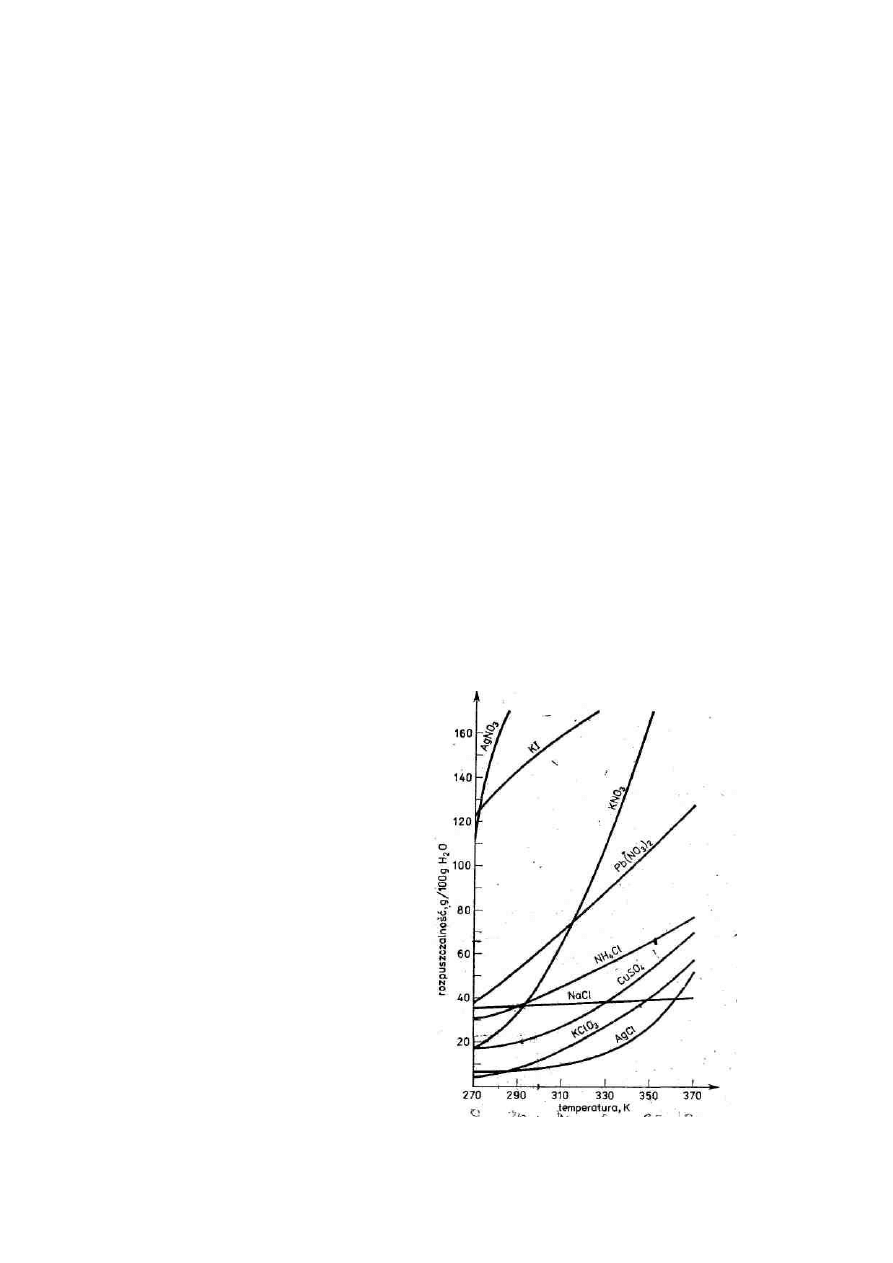
leżność rozpuszczalności od temperatury wyrażamy graficznie za pomocą
krzywych rozpuszczalności (rys. 1).
Rozpuszczalność różnych substancji
w tym samym rozpuszczalniku zmienia
się w bardzo szerokich granicach. Ist-
nieje podobieństwo przebiegu krzy-
wych rozpuszczalności i krzywych
prężności pary wynikające z analogii
parowania do rozpuszczania. Rozpusz-
czanie można traktować jako „parowa-
nie wśród rozpuszczalnika", a parowa-
nie jako „rozpuszczanie w próżni". Roz-
puszczalność w wodzie nielicznych sub-
stancji stałych, np. Ca(OH)
2
, maleje
wraz ze wzrostem temperatury (rys. 2).
W przypadku ciał stałych, które
rozpuszczając się w wodzie pochłaniają
ciepło (proces endotermiczny), podwyż-
szenie temperatury powoduje zwięk-
szenie rozpuszczalności.
Rys.1. Krzywe rozpuszczalności niektórych soli
w wodzie
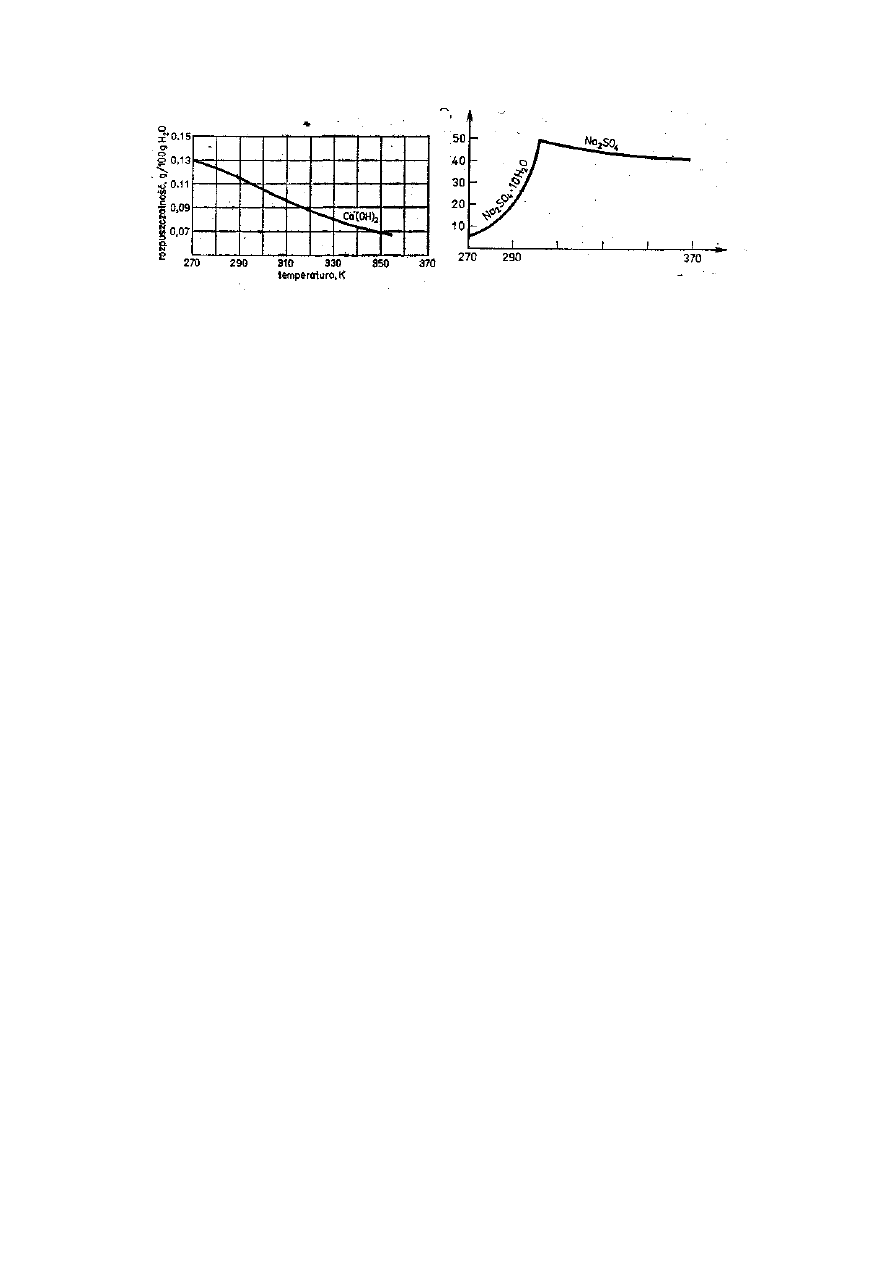
Rys.2. Krzywa rozpuszczalności wodorotlenku wap-
niowego Ca (OH)
2
w wodzie
Rys.3. Krzywe rozpuszczalności soli glauber-
skiej Na
2
SO
4
·
lO H
2
O i bezwodnego siar-
czanu sodowego Na
2
SO
4
w wodzie
Gdy proces rozpuszczania się jest egzotermiczny, wówczas wzrost temperatury
powoduje zmniejszenie się rozpuszczalności (zgodnie z regułą przekory).
Szczególny przypadek obrazuje krzywa rozpuszczalności siarczanu sodowego
(soli glauberskiej). Rozpuszczalność tej soli wzrasta do pewnej temperatury, a
następnie maleje (rys. 3). Tłumaczymy to faktem, że w temp. 305,55 K krysta-
liczny hydrat Na
2
SO
4·
10 H
2
O rozkłada się i przechodzi w sól bezwodną Na
2
S0
4
.
W tym przypadku mamy zobrazowaną na wykresie rozpuszczalność nie jednej,
lecz dwóch różnych substancji.
Niektóre substancje dość łatwo tworzą roztwory przesycone, w których za-
wartość substancji rozpuszczonej jest większa niż to wynika z rozpuszczalności
danej substancji w określonych warunkach. Roztwór przesycony otrzymujemy
najczęściej przez ostrożne oziębianie roztworu uprzednio nasyconego w wyż-
szej temperaturze. Wprowadzenie do roztworu przesyconego zarodka w postaci
małego kryształu substancji rozpuszczonej lub częste pocieranie bagietką we-
wnętrznej ścianki naczynia z roztworem powoduje szybką krystalizację ciała
rozpuszczonego.
ROZPUSZCZALNOŚĆ CIECZY W CIECZACH
Rozpatrując wzajemną rozpuszczalność cieczy możemy rozróżnić trzy za
sadnicze różne typy układów:
Typ I — ciecze rozpuszczają się wzajemnie we wszystkich możliwych sto-
sunkach (np. alkohol etylowy i woda).
Typ II — ciecze są praktycznie wzajemnie nierozpuszczalne (np. woda i
benzen)*
Typ III — ciecze rozpuszczają się w sobie w stopniu ograniczonym, zależnym
od temperatury. Na przykład w układzie utworzonym z wody i eteru tworzą się
dwie warstwy cieczy: górna eterowa, zawierająca pewien procent wody w eterze,
oraz dolna wodna, zawierająca niewielką ilość eteru w wodzie.
Zmianę rozpuszczalności cieczy w zależności od temperatury w układach
typu III (roztwory o ograniczonej rozpuszczalności) dogodnie jest wyrażać gra-
ficznie w postaci krzywych odmieszania (rys. 4-6).
Na rysunku 4 przedstawiono układ fenol-woda. Na osi odciętych wyrażono
procentowy skład układu: lewemu końcowi odcinka odpowiada 100% fenolu i
0 % wody, prawemu zaś 100 % zawartości wody. Na osi rzędnych odłożono
temperaturę. Układ określony przez punkt A (40% fenolu, 60% wody; temp.
353 K) jest fizycznie jednorodny (jednofazowy), to znaczy w tej temperaturze
ciecze wzajemnie doskonale się mieszają. Jeśli-temperaturę obniżymy po niżej
punktu B leżącego na krzywej odmieszania, np. do punktu C (323 K), to z cie-
czy fizycznie jednorodnej powstają dwie ciecze (warstwy), przy czym jedna z
nich ma skład określony przez punkt D, a druga przez punkt E, czyli przez koń-
ce odcinka BE przechodzącego poziomo przez punkt P określający temperaturę
układu. W niższej temperaturze następuje jeszcze większe odmieszanie, ponie-
310 330 350
temperatura, K
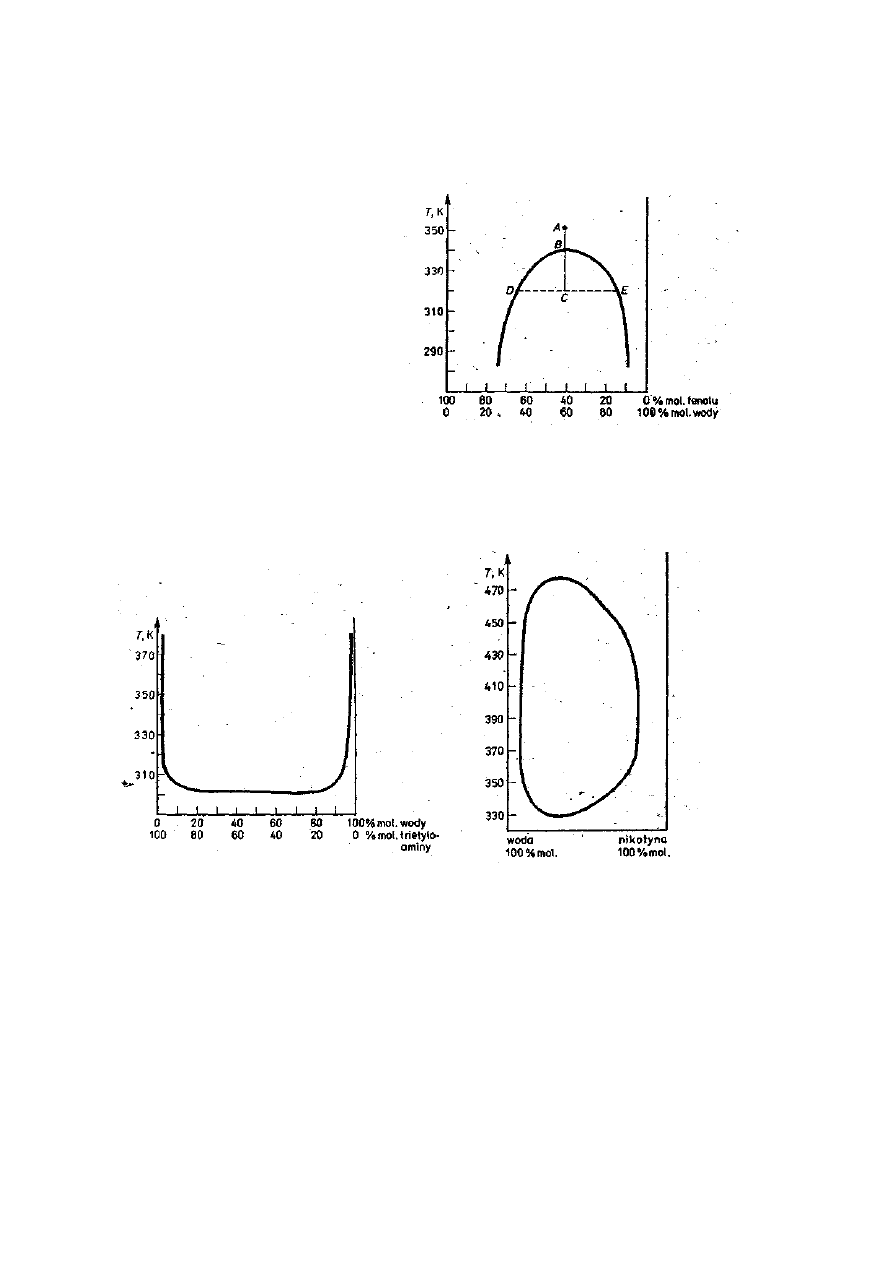
waż warstwa fenolowa zawiera coraz mniej wody, a warstwa wodna coraz
mniej fenolu. Temperatura, powyżej której zachodzi całkowite zmieszanie
warstw (punkt B), nosi nazwę górnej temperatury krytycznej mieszania (lub
rozpuszczalności).
Rys. 4. Krzywa wzajemnej rozpusz-
czalności fenolu i wody.
Na rysunku 5 przedstawiono
układ, woda-trietyloamina. Dla układu tego istnieje dolna temperatura krytycz-
na mieszania, poniżej której układ przedstawia jedną ciecz fizycznie jednorodną.
Powyżej tej temperatury następuje odmieszanie roztworu, czyli z jednej warstwy
cieczy powstają dwie warstwy — roztwór wodny trietyloaminy i roztwór triety-
loaminy zawierający niewielką ilość wody.
Rys. 5. Krzywa wzajemnej rozpuszczalności
wody i trietyloaminy
Rys. 6. Zamknięta krzywa rozpuszczalności
dla układu woda-nikotyna
Na rysunku 6 przedstawiono układ woda-nikotyna, dla którego stwierdzono dwie
temperatury krytyczne mieszania: górną (483 K) i dolną (333 K). Poniżej 333 K i po-
wyżej 483 K obie ciecze mieszają się z sobą w dowolnych stosunkach. W temperatu-
rach pośrednich układ przedstawia sobą dwie warstwy (ograniczona rozpuszczal-
ność).
ROZPUSZCZALNOŚĆ GAZÓW W CIECZACH
I W CIAŁACH STAŁYCH
Rozpuszczalność różnych gazów w tym samym ciekłym rozpuszczalniku jest
różna. Na przykład woda w zwykłych warunkach (w temperaturze pokojowej) roz-
puszcza 400 objętości chlorowodoru, a tylko 0,02 objętości wodoru.
Ze wzrostem temperatury rozpuszczalność gazu w cieczy maleje (prawo Behra).
Zależność ta jest jednak słuszna tylko dla niskich temperatur. W temperaturach wyso-
kich zbliżonych do temperatury krytycznej rozpuszczalnika wzrost temperatury po-
woduje zwiększenie rozpuszczalności gazu. W temperaturze krytycznej rozpuszczal-
nika wzajemna rozpuszczalność składników roztworu jest nieograniczona, gdyż po-
wyżej temperatury krytycznej istnieje tylko faza gazowa. Znany jest przypadek, gdy
ze wzrostem temperatury w obszarze niskich temperatur rozpuszczalność gazu wzra-
sta; przypadek ten dotyczy roztworu wodoru w ciekłym amoniaku.
Na ogół gazy, z wyjątkiem amoniaku i fluorowodorów, rozpuszczają się lepiej w
cieczach organicznych niż w wodzie.
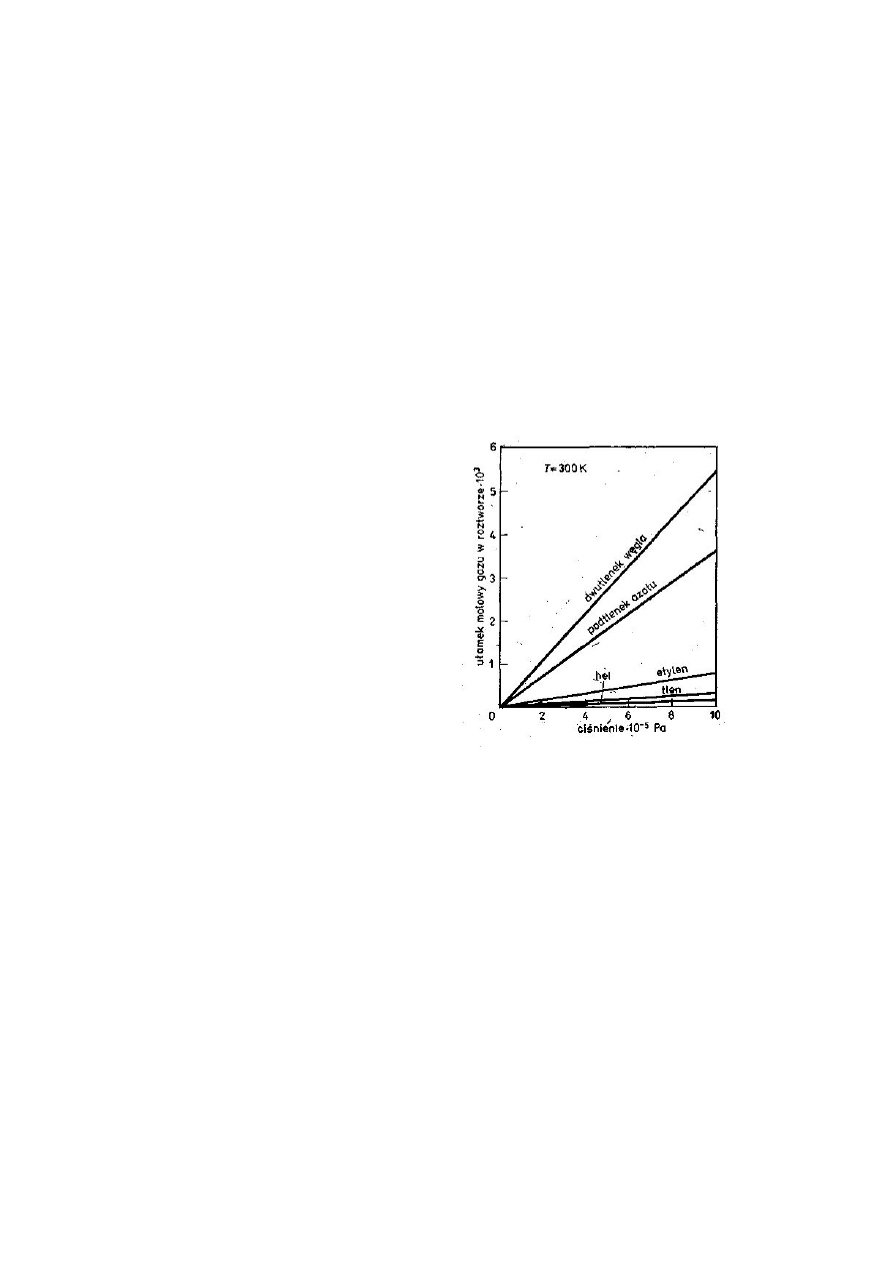
Rys.7. Wykres przedstawiający zależność wyrażo-
ną prawem Henry'ego
Zależność rozpuszczalności gazów w cieczy od ciśnienia wyraża prawo Henry'ego :
masa gazu rozpuszczonego w danej objętości cieczy jest w stałej temperaturze
wprost proporcjonalna do ciśnienia gazu nad cieczą, czyli
m = k p
gdzie m — masa gazu rozpuszczonego, k — współczynnik proporcjonalności dla danej
cieczy, p — ciśnienie.
Na przykład jeśli ciśnienie zewnętrzne wzrośnie dwukrotnie, masa gazu rozpusz-
czonego w jednym decymetrze sześciennym wody wzrośnie również dwukrotnie
(rys.7). Ponieważ dwukrotny wzrost ciśnienia zmniejsza dwukrotnie objętość danej
masy gazu nad cieczą (prawo Boyle'a i Mariotte'a), prawo Henry'ego można zatem
sformułować następująco: objętość gazu ulegającego pochłanianiu przez daną ilość
cieczy nie zależy od ciśnienia.
Gazy rozpuszczają się również w ciałach stałych przenikając w ich sieć krysta-
liczną. Szczególnie wodór ma dużą zdolność rozpuszczania się w kryształach niektó-
rych metali (palladu, platyny, niklu i żelaza), ponieważ jego atomy są małe i łatwo
wchodzą w luki przestrzenne sieci krystalicznej.

WYRAŻANIE STĘŻEŃ ROZTWORÓW
Większość odczynników chemicznych stosuje się w laboratorium analitycznym
w postaci roztworów. Można je podzielić na roztwory o dokładnie ustalonym stężeniu,
np. roztwory mianowane w analizie miareczkowej, oraz roztwory pomocnicze, których
stosowanie wymaga tylko znajomości ich przybliżonego stężenia.
W Polsce obowiązuje Międzynarodowy Układ Jednostek Miar(Systeme International),
zwany skrótowo SI (Rozporządzenie Rady Ministrów z dnia 17 października 1975 r.).
Stężeniem substancji w roztworze jest jej ilość (liczność) zawarta w określonej ob-
jętości roztworu lub rozpuszczalnika. Spotyka się też wyrażanie stężenia w odnie-
sieniu do jednostki masy (1 kg) roztworu lub rozpuszczalnika.
Zgodnie z Układem SI podstawową jednostką ilości (liczności materii) jest mol.
Zgodnie z przyjętą definicją: „mol jest to ilość substancji, która zawiera tyle
cząstek elementarnych, ile ich jest w 0,012 kg węgla-12".
Poprzednio pojęcie „mol" odnosiło się tylko do atomów i cząsteczek i było rów-
noznaczne ze stosowanym wówczas pojęciem gramoatomu lub gramocząsteczki. Te
ostatnie pojęcia przestają być stosowane od wprowadzenia Układu SI, a rozszerzone
pojęcie „mol" wymaga określenia, czego on dotyczy, np.: mol cząsteczek AgN0
3
,
mol jonów S0
4
2-
, mol jednych trzecich cząsteczki H
3
P0
4
, mol jednych piątych
cząsteczki KMn0
4
, mol elektronów.
Jednostką objętości w Układzie SI jest metr sześcienny (m
3
) oraz odpowiednie
jednostki mniejsze, dm
3
i cm
3
. Dopuszczone do stosowania, jako równocenne jed-
nostki objętości, są litr (1) i mililitr (ml)* Należy tu przypomnieć, że w 1964 r. XII
Konferencja Generalna Miar i Wag zmieniła dawną definicję litra w tym sensie,
że od tego czasu 1 dm
3
= 1 l.. W literaturze chemii analitycznej jako jednostki
objętości stosuje się powszechnie litr (1) i mililitr (ml).
Z dwu podstawowych jednostek: ilości substancji (mol) i objętości (litr) tworzy
się podstawową jednostkę stężenia roztworu, wyrażającą się stężeniem jednego
mola cząstek w jednym litrze roztworu. Opisuje się ją skrótem „mol/1" lub
„mol·l
-1
"; oznacza się ją również przymiotnikiem „molowy", np. roztwór jedno-
molowy. Zgodnie ze światową literaturą analityczną pozostawiono również w sto-
sowanie dużej litery „M" na oznaczenie roztworu o stężeniu molowym, np. roztwór
0,5 M **. Odpowiednio do tych ustaleń jednomolowy roztwór kwasu azotowego za-
wiera 63,01 g HN0
3
w 1 litrze roztworu, półmolowy roztwór kwasu siarkowego —
49,04 g H
2
S0
4
w 1 litrze roztworu, a 0,1 M roztwór azotanu srebra — 16,987 g
AgN0
3
w 1 litrze roztworu. Wymienione przykłady można również zapisać w po-
staci: c(HN0
3
) = 1 mol/1, c(H
2
S0
4
) = 0,5 mol·l
-1
i c(AgN0
3
) = 0,1 mol/1. Stężenie
molowe roztworu odpowiada zatem dotychczas stosowanemu pojęciu i wymaga
tylko zaznaczenia, jakich cząstek dotyczy mol.
Poprzednio stosowano również wyrażanie stężeń roztworów, głównie w ana-
lizie alkacymetrycznej i redoksometrycznej, za pomocą pojęcia „normalność". Okre-
ślenie „roztwór normalny", oznaczany symbolem „N", było związane ze stosowa-
nymi wówczas pojęciami gramorównoważnika, który w reakcjach kwas-zasada od-
powiadał liczbie gramów kwasu oddającego lub zasady przyłączającej 1 gramojon
protonów, w reakcjach utlenienia-redukcji zaś odpowiadał części gramocząsteczki
reagującej substancji, odniesionej do wymiany jednego elektronu.
* W literaturze USA oznacza się litr dużą literą L (i odpowiednio mL). '
** M należy traktować jako skrót wyrażenia „mol/l lub słowa „molowy".

Układ SI nie dopuszcza stosowania normalności i roztworów normalnych.
Pojęcia te zastępuje się obecnie pojęciami molowości i roztworów molowych.
Mol w tym przypadku odpowiada równoważnikowi chemicznemu, to jest takiej
części mola cząsteczek, atomów lub jonów, która w danej reakcji chemicznej jest
równoważna jednemu molowi protonów lub jednemu molowi elektronów.
Dawne określenie „roztwór 0,2 N NaOH" zastępuje się obecnie określe-
niem: „wodorotlenek sodowy, roztwór o c(NaOH) = 0,2 mol/l”. Dawny
zapis „1 N roztwór kwasu siarkowego" zastępuje się obecnie zapisem:
„kwas siarkowy o c(1/2H
2
S0
4
) = 1 mol/1" lub „kwas siarkowy o c(H
2
S0
4
)
= 0,5 mol/1". Zamiast „0,1 N roztwór KMn0
4
" stosuje się: „nadmanga-
nian potasowy, roztwór o c(1/5KMn0
4
) = 0,1 mol/1" lub „nadmanganian
potasowy, roztwór o c(1/5KMn0
4
) = 0,02 mol/l". Zamiast „0,1 N roztwór
jodu" stosuje się obecnie: „ jod, roztwór o c(1/2J
2
) = 0,1 mol/l" lub „jod,
roztwór o c(J
2
) = 0,05 mol/l".
Procent objętościowy
wyraża liczbę części objętościowych substancji
zawartych w 100 częściach objętościowych roztworu, odnosi się zatem tylko
do roztworów substancji ciekłych. Na przykład określenie 20 %-owy (obj.)
wodny roztwór etanolu oznacza, że 20 ml etanolu rozcieńczono wodą do ob-
jętości 100 ml. Procent objętościowy bywa często oznaczany symbolem
%(v/v).
Procent masowy (wagowy)
wyraża liczbę części masowych substancji
zawartych w 100 częściach masowych roztworu. Na przykład określenie 20
%-owy (m/m) wodny roztwór chlorku sodowego oznacza, że w 100 g roztwo-
ru zawarte jest 20 g NaCl. W przypadkach, kiedy symbol % nie jest specjal-
nie oznaczony, rozumie się go jako masowy.
Procent masowo-objętościowy
wyraża liczbę części masowych substancji
zawartych w 100 częściach objętościowych roztworu. Jest to najczęstszy spo-
sób wyrażania stężenia procentowego substancji stałych. W tym przypadku
określenie 20 %-owy (m/v) roztwór wodny chlorku sodowego oznacza,
że 20 g NaCl znajduje się w 100 ml roztworu. Często wyraża się stężenia
roztworów w jednostkach masy na jednostkę objętości, np. w g/l, g/ml,
mg/l, mg/ml, μg/ml.
W analizie śladowej przyjęte jest określanie stężenia w częściach na mi-
lion, w skrócie ppm (parts per million), odpowiadające 1 μg/ml lub 1 μg/g, a
także niekiedy w częściach na miliard, w skrócie ppb (parts per billion,
amer. billion = miliard).
Dość często stosuje się roztwory nasycone, tj. zawierające największą w
danej temperaturze ilość substancji rozpuszczonej. Roztwory takie powinny
zawierać zawsze nadmiar substancji rozpuszczonej w postaci osadu na dnie
naczynia, który gwarantuje, że stan nasycenia został osiągnięty.
OBLICZANIE STĘŻEŃ ROZTWORÓW
PRZYKŁADY OBLICZANIA STĘŻEŃ ROZTWORÓW
Przykład 1.
Przygotować 250 g 22% roztworu Na
2
CO
3
.
Na podstawie definicji stężenia procentowego obliczamy ile gramów substancji
znajduje się w 250 g roztworu:
100 g roztworu - 22 g Na
2
CO
3
.
250 g roztworu - x g Na
2
CO
3
.
Aby obliczyć masę wody należy od masy roztworu odjąć masę substancji roz-
puszczonej:
2 5 0 g - 5 5 g = 195 g H
2
0
ponieważ gęstość wody d
H20
= 1 g /cm
3
, objętość wody będzie wynosiła 195 cm
3
.
Rozwiązanie. W celu przygotowania 22% roztworu Na
2
CO
3
należy odważyć
55 g Na
2
CO
3
i rozpuścić go w 195 cm
3
wody.
Przykład 2.
Przygotować 500 g 2 % roztworu HCl z handlowego kwasu solnego o stężeniu
35,6 % i gęstości d = 1.18 g /cm
3
Korzystając z definicji stężenia procentowego wyznaczamy masę substancji
(czystego kwasu) znajdującą się w 500 g 2 % roztworu HCl
w 100 g roztworu - 2 g HCl
w 500 g roztworu - x g HCl
Ponieważ roztwór przygotowujemy z kwasu handlowego, którego stężenie wy-
nosi 35,6 % należy obliczyć w ilu gramach handlowego kwasu znajduje się 10 g
czystego HCl
w 100 g 35,6 % kwasu handlowego - 35,6 g czystego HCl
w x g 35,6 % kwasu handlowego - 10,0 g czystego HCl
Obliczamy masę wody:
500,0 – 28,1 = 471,9 g wody.
250·22
x =
100
= 55 g Na
2
CO
3
.
500·2
x =
100
= 10 g HCl.
100,0·10,0
x =
35,6
= 28,1 g HCl 35,6 %
Do przygotowania tego roztworu, należy więc odważyć 28,1 g 35,6 % roztworu
handlowego kwasu solnego i wlać go do 471,9 cm
3
wody (gęstość wody wynosi
bowiem 1 g/cm
3
). Ze względu na trudności w odważaniu stężonego roztworu
kwasu i znacznie łatwiejsze jego odmierzanie, możemy skorzystać ze wzoru na
gęstość i przeliczyć jego masę na objętość
m
28,1
-
v = — = —— = 23,8 cm
3
d
1,18
Rozwiązanie. Aby przygotować 500 g 2 % roztworu HCl z handlowego kwasu
solnego o stężeniu 35,6 % należy odmierzyć 23,8 cm
3
tego kwasu
i dodać go do 471,9 cm
3
wody.
Przykład 3.
Przygotować 200 cm
3
0,1 m roztworu MgSO
4
Obliczanie masy molowej: 1 mol MgSO
4
= 24,3 + 32,1 + 4·16,0 = 72,4 g
Zgodnie z definicją stężenia molowego układamy proporcję:
1000 cm
3
1m roztworu – 72,4 g MgSO
4
200 cm
3
0,1 m roztworu - x g MgSO
4
200 · 0,1 · 72,4
x = ----------------------------- = 1,45 g MgSO
4
1000 · 1
Rozwiązanie. Aby przygotować powyższy roztwór należy odważyć 1,45 g
MgSO
4,
rozpuścić związek w małej ilości wody i przenieść ilo-
ściowo do kolby miarowej o pojemności 200 cm
3
.
Uzupełnić wo-
dą destylowaną do kreski i dokładnie wymieszać.
Przykład 4.
Przygotować 250 cm
3
2 m roztworu H
2
SO
4
, z kwasu handlowego, którego stę-
żenie wynosi 95,6 %, a gęstość d = 1.84 g /cm
3
1 mol H
2
SO
4
= 2·1,0 + 32,1 + 4 · 16,0 = 98,1 g
Korzystając z definicji stężenia molowego otrzymujemy:
1000 cm
3
1 m roztworu - 98,1 g H
2
SO
4
250 cm
3
2 m roztworu - x g H
2
SO
4

Następnie obliczamy masę handlowego kwasu siarkowego o stężeniu 95,6 %
i gęstości d = 1,84 g/cm
3
, która zawiera 49,1 g czystego H
2
SO
4
:
100 g 95,6% roztworu - 95,6 g czystego H
2
SO
4
x g 95,6% roztworu – 49,1 g czystego H
2
SO
4
Objętość tego kwasu wynosi:
Rozwiązanie. Aby przygotować 2 m roztwór kwasu siarkowego z odczynnika
handlowego należy odmierzyć 27,9 cm
3
stężonego handlowego
H
2
SO
4
, przenieść do kolby miarowej o objętości 250 cm
3
, uzu-
pełnić wodą destylowaną do kreski i dokładnie wymieszać.
250·2·98,1
x =
1000·1
= 49,1 g H
2
SO
4
100·49,1
x =
95,6
= 51,4 g handlowego H
2
SO
4
m
51,4
v =
d
=
1,84
= 27,9 cm
3
handlowego H
2
SO
4

Wykonanie ćwiczenia
Część praktyczna ćwiczenia polega na przygotowaniu roztworów, których objęto-
ści i stężenia zostaną podane przez prowadzącego zajęcia. Należy pamiętać aby
przygotowując roztwory stosować następujące zasady i sposoby postępowania:
1. Naważkę substancji stałej potrzebnej do przygotowania roztworów o wy-
znaczonych przez prowadzącego stężeniach, należy odważać na automa-
tycznej wadze technicznej „Sartorius”, a stężone roztwory kwasów należy
odmierzać cylinderkiem miarowym lub pipetą wielomiarową. Należy
pamiętać aby przy napełnianiu pipety posługiwać się gruszką gumową.
2. Roztwory o stężeniach procentowych należy przygotowywać w zlewkach
o pojemnościach dostosowanych do końcowej objętości otrzymywanego
roztworu. Odmierzoną objętość lub naważkę substancji należy ostrożnie
wprowadzić do wody redestylowanej, mieszając przez kilka minut za
pomocą bagietki lub mieszadła magnetycznego, aby zapewnić wyrówna-
nie stężeń w całej objętości roztworu.
3. Roztwory o stężeniach molowych należy przygotowywać w kolbach
miarowych o pojemnościach odpowiadających końcowym objętościom
przygotowywanych roztworów. Jeżeli przygotowywany jest roztwór
z naważki substancji stałej, naważkę należy najpierw rozpuścić w nie-
wielkiej ilości wody redestylowanej, przenieść ilościowo do kolby mia-
rowej a następnie dopełnić kolbę do kreski. Zawartość kolby należy do-
kładnie wymieszać poprzez kilkunastokrotne odwracanie kolby dnem do
góry. Jeżeli przygotowywany jest roztwór przez rozcieńczanie roztworu
o wyższym stężeniu roztwór ten należy odmierzać przy użyciu pipety
wielomiarowej.
4. Masy atomowe pierwiastków potrzebne do obliczeń stężeń molowych
należy odczytać z tablicy układu okresowego znajdującej się na ostatniej
stronie instrukcji.
5. Szczególną uwagę należy zachować przy odważaniu i rozpuszczaniu
wodorotlenków, które występują w postaci stałej (pastylki lub kuleczki).
Należy pamiętać, że alkalia te są substancjami silnie żrącymi i powodu-
jącymi oparzenia chemiczne oraz trudno gojące się rany. W żadnym wy-
padku nie wolno dotykać i podnosić rozsypanych alkaliów rękoma.
6. Należy zachować szczególną ostrożność w trakcie rozcieńczania stężo-
nych roztworów kwasów. Ze względu na egzotermiczny charakter re-
akcji rozcieńczania stężonych roztworów kwasów, ich żrące właściwo-
ści, oraz niebezpieczeństwo wystąpienia groźnych oparzeń chemicz-
nych, stężone kwasy należy zawsze rozcieńczać wprowadzając kwas
do wody. Nigdy odwrotnie!. Kwasy należy wprowadzać do wody bar-
dzo ostrożnie, wlewając je do naczynia po jego ściankach lub po ba-
gietce. Rozcieńczanie stężonych roztworów kwasów należy prowa-
dzić pod wyciągiem!
7. Przygotowane roztwory kwasów zasad i soli należy przedstawić labo-
rantce do kontroli. Laborantka po kontroli roztworów, potwierdza po-
prawne wykonanie ćwiczenia podpisem w zeszycie ćwiczeń a potem na
sprawozdaniu z ćwiczeń.
Wyszukiwarka
Podobne podstrony:
cwiczenie nr 04 poprawione id 1 Nieznany
Cwiczenia nr 2 RPiS id 124688 Nieznany
Cwiczenie nr 15 id 125710 Nieznany
Cwiczenia nr 6 RPiS id 124693 Nieznany
cwiczenie nr 2 instrukcja id 12 Nieznany
Cwiczenie nr 10 id 125701 Nieznany
Cwiczenia nr 4 RPiS id 124689 Nieznany
cwiczenie nr 3 instrukcja id 12 Nieznany
Cwiczenia nr 5 RPiS id 124692 Nieznany
E 08 - Uklady przelaczajace, Ćwiczenie nr: 8 Podstawowe układy przełączające
Cwiczenie nr 60 id 99947 Nieznany
Cwiczenia nr 1 RPiS id 124683 Nieznany
Ćwiczenie nr 04
Cwiczenia nr 9 (z 14) id 98690 Nieznany
cwiczenie nr 26 id 101103 Nieznany
ĆWICZENIE NR 04 - Skład granulomeryczny gruntu, Mechanika Gruntów
mzt 71 Cwiczenie nr 71 id 78283 Nieznany
więcej podobnych podstron