CIŚNIENIE OSMOTYCZNE
1.
Zjawisko osmozy
występuje gdy czysty rozpuszczalnik i roztwór
składnika w tym rozpuszczalniku zostaną rozdzielone przegrodą
nie przepuszczającą cząsteczek substancji rozpuszczonej, lecz nie
stanowią przeszkody dla cząsteczek rozpuszczalnika ( w tym
układzie panuje stała, po obu stronach przegrody jednakowa
temperatura). Można stwierdzić, że zjawisko osmozy polega na
powolnym przepływie rozpuszczalnika do roztworu.
Przepływ ten można powstrzymać, działając na roztwór odpowiednio
dużym ciśnieniem zewnętrznym p
2
, większym niż ciśnienie p
1
panujące w tej części układu , w której znajduje się czysty
rozpuszczalnik. Przy wyższym ciśnieniu działającym na roztwór
nastąpi nawet odwrócenie kierunku przepływu. Wartość różnicy
(p
2
- p
1
), jaka jest potrzebna, by w układzie został osiągnięty stan
równowagi procesu osmozy, nosi nazwę ciśnienia osmotycznego
roztworu ( Π ).
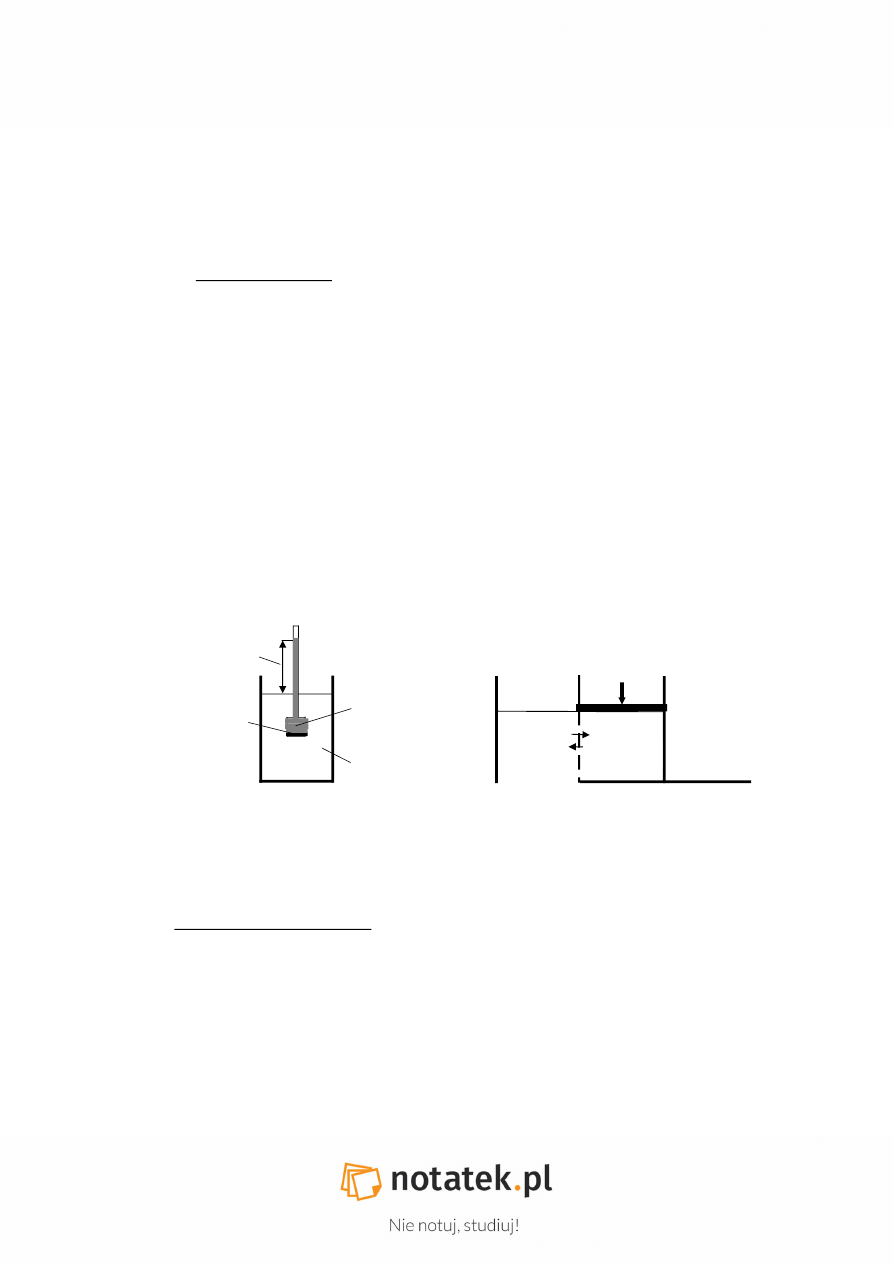
rys.1. uproszczony schemat osmometru
rys.2. odwrócenie kierunku osmozy pod
działaniem zewnętrznego ciśnienia p
2
Warunek równowagi: μ
H2O
L
= μ
H2O
r-rze (P)
(1)←μ
r
o
(p
1
,T) = μ
r
x
(p
2
,T)+ gRTlnx
r
→(2)
Proces samorzutny osmozy zachodzi, gdy potencjał chemiczny
rozpuszczalnika w roztworze (2) jest mniejszy od potencjału
chemicznego czystego rozpuszczalnika (1) w warunkach stałej
temperatury i ciśnienia.
roztwór
rozpuszczalnik
przegroda
półprzepusz-
czalna
wysokość
proporcjonalna do
ciśnienia
osmotycznego
p
2
p
1
rozpuszczalnik
roztwór
μ
r
=μ
r
o
μ
r
= μ
r
x
+gRTlnx
r

2. Ciśnienie osmotyczne ( Π ) równe jest ciśnieniu jakie należy
wywrzeć na roztwór (wewnętrzny), aby powstrzymać przepływ
rozpuszczalnika, a co za tym idzie by nie doszło do procesu osmozy.
Ciśnienie jest wyrażane w [ mm słupa roztworu ]. Na paskale
przeliczamy je wg wzoru
Π = delta h * g * ρ
roztw.
gdzie: g – przyspieszenie ziemskie;
delta h – wysokość słupa wyrażona w metrach;
ρ
roztw.
– gęstość roztworu wyrażona w kg/m
3
Dla roztworu doskonałego (zgodnie z prawem Raoulta) ciśnienie
osmotyczne wynosi :
Π = (-RT)/V * lnx
1
= (-RT)/V * ln(1-x
2
)
gdzie: V – objętość molowa rozpuszczalnika;
x
1
,x
2
– ułamki molowe rozpuszczalnika i substancji rozpuszczonej
Gdy x
2
jest bardzo małe (roztwory rozcieńczone) zamiast
ln(1-x
2
) = x
2
i otrzymujemy:
Π = RT/V * x
2
W warunkach stałej temperatury Π jest proporcjonalne do stężenia
(wzór van’t Hoffa) :
Π = cRT
pamiętając, że c = n/V = m/(MV) = c
w
/M, wzór można przekształcić
do często używanej postaci :
Π = c
w
RT/M
gdzie: c
w
– stężenie masowe;
M – masa molowa substancji rozpuszczonej.

Z równania wynika, że iloraz Π / c
w
powinien być niezależny od
stężenia. W roztworach rzeczywistych taka sytuacja nie jest
spotykana, natomiast jest powszechna w roztworach dyspersyjnych.
Iloraz ten jest zazwyczaj rosnąca funkcją stężenia. Do opisu ciśnienia
osmotycznego stosuje się wówczas równanie wirialne:
gdzie : B2,B3,... – drugi , trzeci , ... współczynnik wiriału.
Pomiary ciśnienia osmotycznego stanowią metodę wyznaczania mas molowych
cząstek.
3.Współczynnik izotoniczny ( i ) jest miarą odchyleń ciśnienia
osmotycznego roztworów elektrolitów od ciśnienia osmotycznego
roztworów doskonałych.
i = Σn / n
0
Związek A
n
B
m
dysocjuje wg schematu: A
x
B
y
= xA
+
+ yB
-
n
0
(1-α) xn
0
α yn
0
α
Σn =
n
0
(1-α) + n
0
α(x+y) x+y = ν
i =
n
0
(1-α) + n
0
αν
/ n
0
i =
1 – α + αν
i = 1 + α (ν – 1) → końcowa postać, na obliczenie współczynnika
izotonicznego.
Wykres wykorzystywany przy wyznaczaniu masy molowej
metodą osmotyczną. Wartość masy molowej oblicza się z
punktu przecięcia prostej z osią rzędnych
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1
0
2
4
6
8
10
c [ g/l]
h
/c
[
(
cm
*l
)/
g
Wyszukiwarka
Podobne podstrony:
CHEMIA I Podstawowe pojecia id Nieznany
chemia nieorganiczna zadania id Nieznany
chemia fizyczna lab id 112228 Nieznany
Chemia kliniczna kontrola id 11 Nieznany
chemia okiem niechemika id 1126 Nieznany
chemia kliniczna cw 1 2011 id Nieznany
chemia fizyczna egzamin id 1122 Nieznany
chemia maj 2005 id 112453 Nieznany
Cisnienie osmotyczne, Farmacja, Chemia Fizyczna, zadania
chemia przykladowe zad id 11281 Nieznany
Chemia Organiczna Cz1 id 112665 Nieznany
chemia tematy 1kolos id 112928 Nieznany
Chemia polimerow II id 113148 Nieznany
Chemia wyklady 2007 2008(1) id Nieznany
Chemia zadania 13 id 113043 Nieznany
więcej podobnych podstron