
2
1. Wstęp teoretyczny
Ścieki przemysłowe zawierają wiele substancji szkodliwych będących pozostałością procesów
produkcyjnych. Przed odprowadzeniem ścieków do sieci kanalizacyjnej lub do odbiornika, należy
dokonać neutralizacji szkodliwych składników. Celem neutralizacji ścieków przemysłowych jest
doprowadzenie ich odczynu do wartości wymaganych regulacjami prawnymi : wody powierzchniowe:
pH=6,5-9,0; sieć kanalizacyjna: pH=6,5-9,5. Wyjątkiem jest zakres pH=8,0-10,0 dla ścieków
zawierających cyjanki (Rozporządzenie Ministra Środowiska z dnia 29 listopada 2002r. w sprawie
warunków, jakie należy spełnić przy wprowadzaniu ścieków do wód lub do ziemi oraz w sprawie
substancji szczególnie szkodliwych dla środowiska wodnego). Neutralizacji wymagają zarówno ścieki
kwaśne (w celu podwyższenia ich odczynu do wartości powyżej 6,5 pH), jak i ścieki alkaliczne (w celu
obniżenia ich odczynu poniżej 9,0 pH). Do zobojętniania ścieków alkalicznych można używać
kwaśnych gazów spalinowych, powstających np. z paliw zasiarczonych i zawierających dwutlenek
węgla, tlenki siarki i azotu. Do neutralizacji ścieków kwaśnych używa się mleka wapiennego lub
gazów odpadowych zawierających amoniak. Neutralizację można prowadzić następującymi
metodami:
- mieszaniem ścieków kwaśnych z alkalicznymi,
- dodawaniem odpowiednich odczynników, takich jak wapień, dolomit, wapno lub wodorotlenek
sodowy.
- przepuszczaniem ścieków kwaśnych przez złoża sporządzone np. z kamienia wapiennego i
innych skał o podobnym odczynie (np. dolomitów)
- elektrodowe oczyszczanie zanieczyszczeń
Istnieje bardzo dużo grup ścieków przemysłowych, które wykazują charakter zdecydowanie
kwaśny lub zdecydowanie alkaliczny. Można tu wymienić ścieki z procesu trawienia metali,
szczególnie dotyczy to ścieków powstających w galwanizerniach. W Polsce istnieje ponad tysiąc
galwanizerni skupionych w przemyśle samochodowym, maszyn rolniczych, elektronicznym,
elektrochemicznym itp. Galwanizacją nazywamy nakładanie na stalowe produkty powłoki podczas
ciekłej kąpieli. Ścieki, które powstają podczas tych procesów produkcyjnych tzw. ścieki galwaniczne
zaliczane są do szczególnie niebezpiecznych i uciążliwych dla środowiska naturalnego ze względu na
dużą zawartość metali ciężkich. Ich ilość waha się w granicach od 10 - 1000 mg/dm3. Obecność tych
metali wpływa na zmianę pH wody, ilości rozpuszczonego w niej tlenu oraz jej właściwości
organoleptyczne, niestety wpływa także na proces samooczyszczania się wód.
Procesy galwanotechniczne prowadzone są w roztworach o odczynie kwaśnym lub alkalicznym.
Galwanizernia wyposażona jest zazwyczaj w kilka wanien galwanicznych, w których zanurzane są
metalowe przedmioty. W oczyszczaniu tych ścieków największe znaczenie mają metody, które
pozwalają na wielokrotne wykorzystanie tych kąpieli , oraz odzyskiwanie jonów metali ciężkich.
Przed odprowadzeniem ścieków do oczyszczania istotne jest ich rozdzielenie na grupę kwaśną i
grupę alkaliczną. Jeśli w grupie kwaśnej występują cyjanki, ze ścieku może się wydostać łatwo
parujący kwas cyjanowodorowy.

3
Neutralizacja zmienia pH środowiska. Ma to znaczenie głównie dlatego, że toksyczność cyjanków
metali ciężkich wzrasta wraz z podwyższaniem pH. Dzięki neutralizacji wody odprowadzane do
kanalizacji stają się znacznie bezpieczniejsze dla środowiska.
2. Cel ćwiczenia
Celem przeprowadzonego ćwiczenia była neutralizacja ścieków kwaśnych pochodzących z
procesu trawienia metali. Ćwiczenie laboratoryjne polegało na właściwym doborze dawki czynnika
neutralizującego ścieki – wodorotlenku sodu, tak aby ścieki uzyskały pH powalające na
odprowadzenie ich do kanalizacji. Ścieki nie powinny oddziaływać negatywnie na wody
powierzchniowe tj. nie mogą zakłócać procesów biologicznych, dla których wymagane jest pH=7, ani
na sieć kanalizacyjną, powodując jej korozję.
3. Opis przebiegu wykonywania badań
Dobranie odpowiedniej dawki czynnika alkalizującego 10% NaOH dla neutralizacji ścieków
kwaśnych, zaczynamy od ustalenia dawki teoretycznej 10% NaOH (roztwór właściwy). Ustala się
najpierw tzw. kwasowość mineralną (K
m
) czyli kwasowość wobec metylooranżu. Wyznacza się ją
poprzez miareczkowanie 100 ml próby ścieków wodorotlenkiem sodowym do momentu zmiany
zabarwienia z czerwonego na żółte (gdy osiągnie pH=4,5). Uzyskany wynik pozwala ustalić dawkę
teoretyczną.
Dawka teoretyczna: D
T
=X
NaOH
M
NaOH
Masa molowa NaOH = 22,98977 + 15,9994 + 1,0079 = 40g/mol;
D
T
=3,36
40 = 134 mg NaOH = 1,34 ml NaOH;
Gdzie: 3,36 - zmiareczkowana ilość 10% roztworu NaOH
1. 100g roztworu - 10g NaOH
2. 100ml - 10000 mg NaOH
3. 1ml - 100mg NaOH
Taka ilość NaOH pozwala na zobojętnienie kwasowości, ale do odczynu wynoszącego około 5,0
pH. Na skutek obecności związków buforowych nie uzyskuje się od razu odczynu w granicach pH = 6
8. Należy więc dalej prowadzić doświadczenie.
Następnie do czterech porcji ścieków o obj. podanej przez prowadzącego ćwiczenia (1000 cm
3
)
wprowadzono 10% roztwór NaOH w ilościach odpowiadających 100, 120, 155 i 170
dawki
obliczonej. Po dokładnym wymieszaniu i 15 - minutowym czasie reakcji w klarownych ściekach
ponownie oznacza się odczyn, kwasowość i zasadowość oraz żelazo ogólne.
Wyniki zestawione tabelarycznie wg podanego wzoru pozwolą na określenie optymalnej dawki
NaOH.
W przypadku badania ścieków surowych określono ich odczyn pH, przewodność, kwasowość
oraz żelazo ogólne. W pozostałych czterech próbach określono odczyn pH, pH po sedymentacji,
przewodność, kwasowość i zasadowość, żelazo ogólne oraz ilość wytrąconego osadu.
4
3.1 Początkowy odczyn pH i pH po sedymentacji
Wartość odczynu pH każdej z prób została oznaczona przy użyciu pH - metru. Odczytane wyniki
nie wymagały przeliczania. W celu sprawdzenia czy sedymentacja powoduje dalszą zmianę pH próbek
odstawiono próby po dodaniu odpowiedniej dawki NaOH na pewien czas, a następnie przefiltrowano
ścieki przez sączek w celu oddzielenia powstałego osadu. Dopiero dla tych prób zmierzone zostało
ponownie pH.
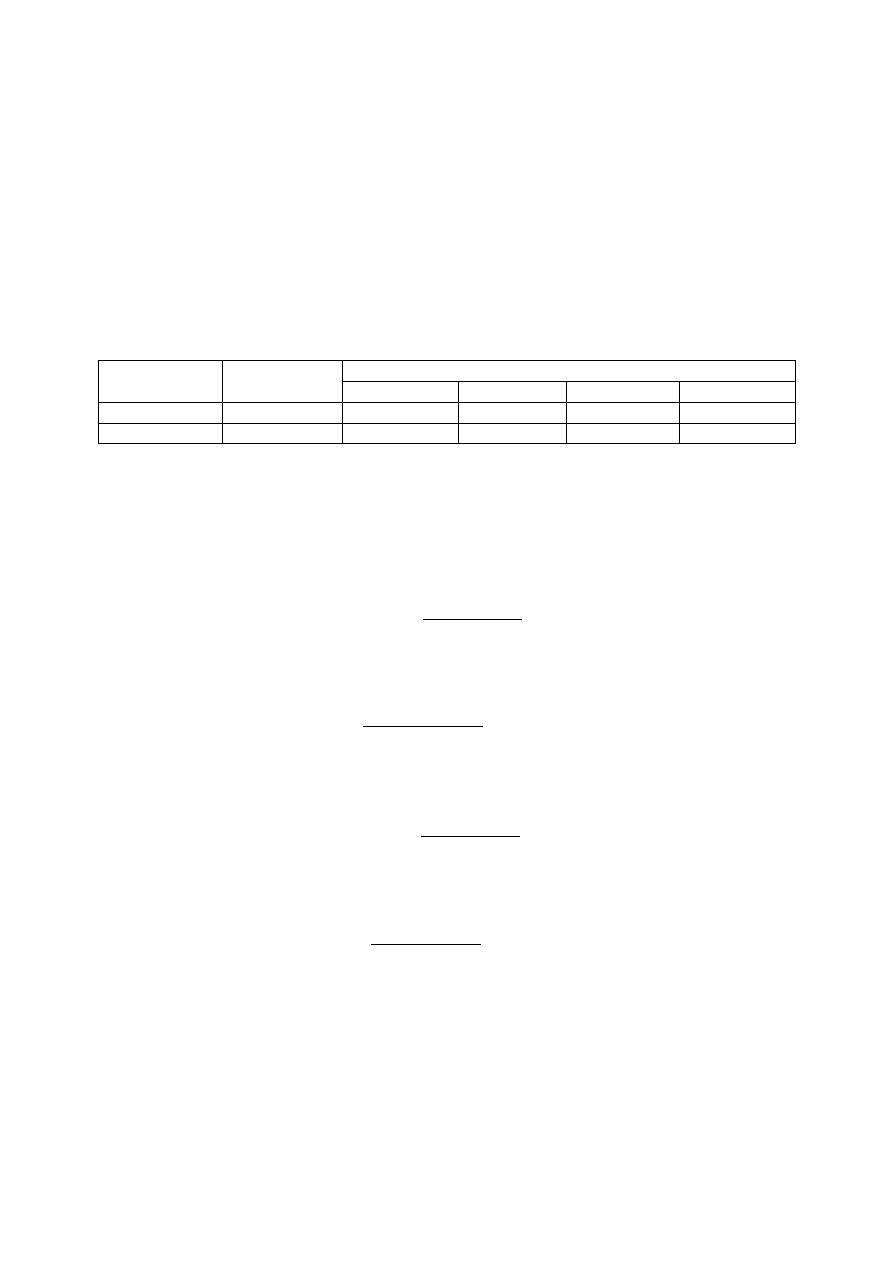
3.2 Przewodność
Przewodność każdej próby określono przy użyciu konduktometru. Odczytane wartości
wymagały przemnożenia przez stałą dla danego urządzenia równą 1,32.
Parametr
Ścieki surowe
Próby pod dodaniu dawki
100%
120%
155%
171%
odczyt
1503
793
856
958
1208
przewodność
1983
1047
1130
1265
1595
3.3 Kwasowość
Kwasowość jest to zdolność do zobojętniania dodawanych do wody silnych zasad.
Kwasowość mineralna (K
m
) czyli kwasowość wobec metyloranżu - wyznaczana jest poprzez
miareczkowanie 100 ml próby wody wodorotlenkiem sodowym do zmiany zabarwienia z czerwonego
na żółte (gdy osiągnie pH = 4,5).
Przykładowo:
⁄
Kwasowość ogólna (K
p
) czyli kwasowość wobec fenoloftaleiny – wyznaczana jest poprzez
miareczkowanie 100 ml próby wody wodorotlenkiem sodowym do zmiany zabarwienia z
bezbarwnego na różowy (gdy osiągnie pH = 8,3).
Przykładowo:
⁄

5
Występowanie kwasowości i zasadowości obrazuje następujący schemat:
3.4 Zasadowość
Zasadowość jest to zdolność do zobojętniania dodawanych do wody silnych kwasów
mineralnych.
Zasadowość „p” jest to zasadowość wobec fenoloftaleiny – wyznaczana jest poprzez
miareczkowanie próby kwasem solnym, aż do odbarwienia z koloru różowego jaki nadaje jej
fenoloftaleina. Odbarwienie następuje przy dojściu do pH = 8,3. Jeśli próba po dodaniu fenoloftaleiny
nie zabarwia się na różowo oznacza to, że pH jest niższe od 8,3 (zaobserwowaliśmy to przy dawkach
100%, 120%, 155%).
Przykładowo:
⁄
Zasadowość ogólna „m” jest to zasadowość wobec metylooranżu – wyznaczana jest poprzez
miareczkowanie próby kwasem solnym aż do zmiany zabarwienia z żółtego na pomarańczowy (gdy
osiągnie pH = 4,5). Ponieważ próba z dawką 171% wykazała zasadowość wobec fenoloftaleiny Z
p
=2,0
(po dodaniu fenoloftaleiny zabarwiła się na różowo, następnie po zmiareczkowaniu kwasem HCl
odbarwiła się), a tym samym uzyskała pH=8,3, dodanie do niej metylooranżu i dalsze miareczkowanie
HCl określiło zasadowość Z
o
wyliczaną z tego samego wzoru. Natomiast zasadowość ogólna Z
m
określona została poprzez zsumowanie Z
p
i Z
o
.
Przykładowo:
⁄
⁄ ⁄ ⁄
6
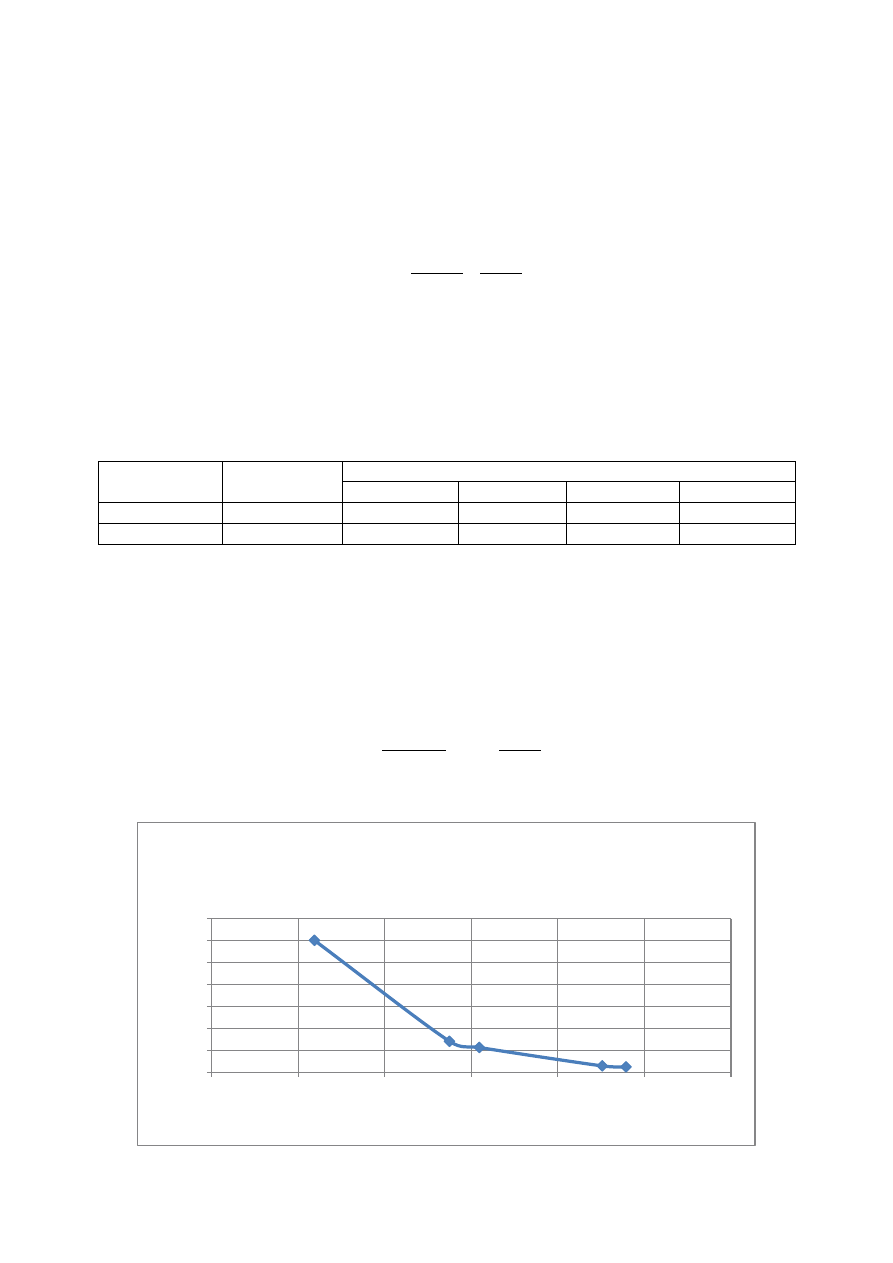
3.5 Żelazo ogólne
Oznaczenie żelaza w każdej próbie polegało na wyznaczeniu zawartości żelaza ogólnego
odczytanej ze skali wzorców „a” przy wcześniej ustalonej objętości próbki użytej do oznaczenia „V”.
Wyniki przedstawione w tabeli w rozdziale 4 są rezultatem obliczeń przy zastosowaniu poniższego
wzoru:
[
]
Gdzie:
a – zawartość żelaza ogólnego w badanej próbce odczytana ze skali wzorców
V – objętość próbki użytej do oznaczenia [ml]
Parametr
Ścieki surowe
100%
120%
155%
171%
a
0,3
0,35
0,28
0,35
0,29
V
[ml]
1
5
5
25
25
Początkowo objętość próbki użytej do oznaczenia przy analizie z dawkami 155% i 171% została
ustalona na poziomie 10 ml jednak ta ilość nie była wystarczająca do oznaczenia zawartości żelaza
ogólnego odczytanej ze skali wzorców. W związku z powyższym oznaczenie zostało powtórzone przy
objętościach próbek wynoszących 25 ml.
Przykładowe obliczenie zawartości żelaza ogólnego w próbie ścieków surowych:
[
]
Obliczenia zostały powtórzone analogicznie dla pozostałych prób.
30
7
5,6
1,4
1,16
0
5
10
15
20
25
30
35
0
2
4
6
8
10
12
Fe
[
m
g
Fe
/l
]
pH
Zależność zawartości żelaza ogólnego w
ściekach od ich pH
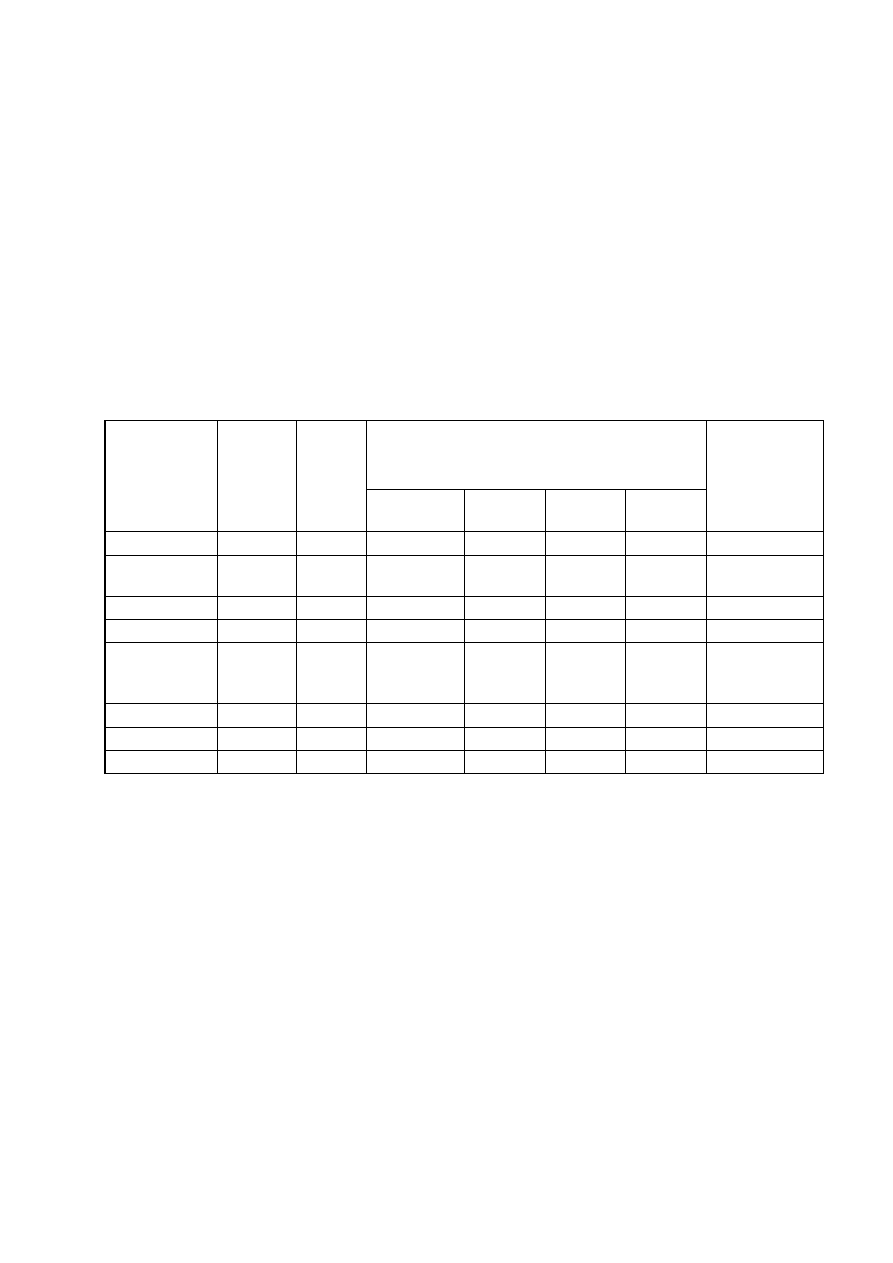
7
3.6 Osad
W wyniku dodania do ścieków galwanicznych wodorotlenku sodowego produktem końcowym
neutralizacji jest mieszanina wodorotlenków oraz tlenków takich metali jak, żelazo, chrom, cynk,
miedź, kadm, nikiel, i inne, w różnych stosunkach w zależności od prowadzonych procesów obróbki
powierzchniowej metali. Podczas sedymentacji w/w produkty wytrącają się w postaci osadu i ich
ilość rośnie wraz ze wzrostem dawki NaOH. Ilość osadu zmierzono po 60 min sedymentacji i wyniki
przedstawiono w tabeli.
4. Wyniki
Zestawienie wyników analizy fizykochemicznej ścieków przedstawiono poniżej w tabeli:
Parametr
Jednostka
Ścieki
surowe
Próby po dodaniu x% dawki teoretycznej NaOH
Wymagania dla
ścieków
przemysłowych
oczyszczonych*
100%
134,4mg/l
120%
160,0mg/l
155%
209,6mg/l
171%
230,4mg/l
Odczyn
pH
2,38
5,50
6,19
9,03
9,58
Odczyn po
sedymentacji
pH
-
5,65
6,53
8,20
9,40
6,5-9,0
Przewodność
µS/cm
1983,00
1047,00
1130,00
1264,56
1595,00
-
Kwasowość
mval/l
Km=3,36
Kp = 2,00
Kp = 1,70 Kp = 1,10
-
-
Zasadowość
mval/l
-
Z
m
= 0,5
Z
m
= 1,3
Z
m
= 2,8
Z
p
= 2,0
Z
o
= 3,0
Z
m
=5,0
-
Żelazo ogólne
mg Fe/l
30,00
7,00
5,60
1,40
1,16
-
% redukcji
%
-
76,70
81,30
95,30
96,13
-
Osad
ml/l
-
12
17
28
32
-
*
Zgodnie z Roz. Min. Środowiska z dnia 28 stycznia 2009 r. zmieniające rozporządzenie w sprawie warunków,
jakie należy spełnić przy wprowadzaniu ścieków do wód lub do ziemi, oraz w sprawie substancji szczególnie
szkodliwych dla środowiska wodnego
5. Wnioski
pH analizowanych przez nas ścieków surowych wynoszące 2,38 nie pozwalało odprowadzić ich ani
do kanalizacji, ani też do wód powierzchniowych czy do ziemi.
Cel ćwiczenia, czyli neutralizacja ścieków wodorotlenkiem sodu do pH z zakresu 6,5-9,0 został
osiągnięty dla prób z dawkami 120% i 155%. Ponieważ jednak uzyskane wartości pH są bliskie
skrajnym wartościom, a przy tym zawartość żelaza jest duża, to należałoby w dalszych badaniach
zbadać dawki pośrednie pomiędzy 120% a 155% w celu wyznaczenia bardziej optymalnej dawki
NaOH. Zawartość żelaza ogólnego w próbach dla wszystkich dawek waha się w granicach od 30
mgFe/l dla próbki ścieków surowych przy bardzo niskim pH=2,38 do 1,16 mgFe/l przy pH 9,58.

8
Oznacza to, że wraz z neutralizacją ścieków (zwiększaniu dawki teoretycznej NaOH) zawartość żelaza
ogólnego w ściekach spadała – zwiększał się procent redukcji. Z przeprowadzonych doświadczeń
wywnioskować można, że przy neutralizacji ścieków kwaśnych do wymaganego min pH=6,5,
zawartość żelaza ogólnego w ściekach zneutralizowanych wynosić będzie w granicach 4-5 mgFe/l.
Przewodność pozwala na określenie wskaźnika zawartości elektrolitów w roztworze. Wody
zawierająco mało jonów mają małą przewodność elektryczną. Jeśli woda ma przewodność
przekraczającą 500 µS/cm uważa się ją za wodę silnie zasoloną. Wszystkie próbki przebadane na
zajęciach zawierały dużą ilość substancji ulegających dysocjacji w wodzie. Ścieki surowe wykazywały
największe przewodnictwo, a dodanie 10% NaOH spowodowało jego spadek. Należy zauważyć, iż
wraz ze zwiększaniem dawki NaOH wartość przewodności rosła.
Występowanie kwasowości mineralnej jest niepożądane ze względu na silnie korozyjny charakter
takich ścieków. Zastosowanie wodorotlenku sodu pozwala na podwyższenie pH, a tym samym
wystąpienie zasadowości mineralnej. Największą zasadowość mineralną zaobserwowaliśmy w
przypadku próbki zawierającej 155% dawki teoretycznej NaOH, która wynosiła 2,8 mval/l.
Największą ilość osadu, a także największy procent jego redukcji otrzymaliśmy dla próbki ze 171%
dawki teoretycznej NaOH. Wartość obu parametrów rosła wraz ze zwiększaniem dawki NaOH.
Wyszukiwarka
Podobne podstrony:
Isolated neutral id 220567 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron