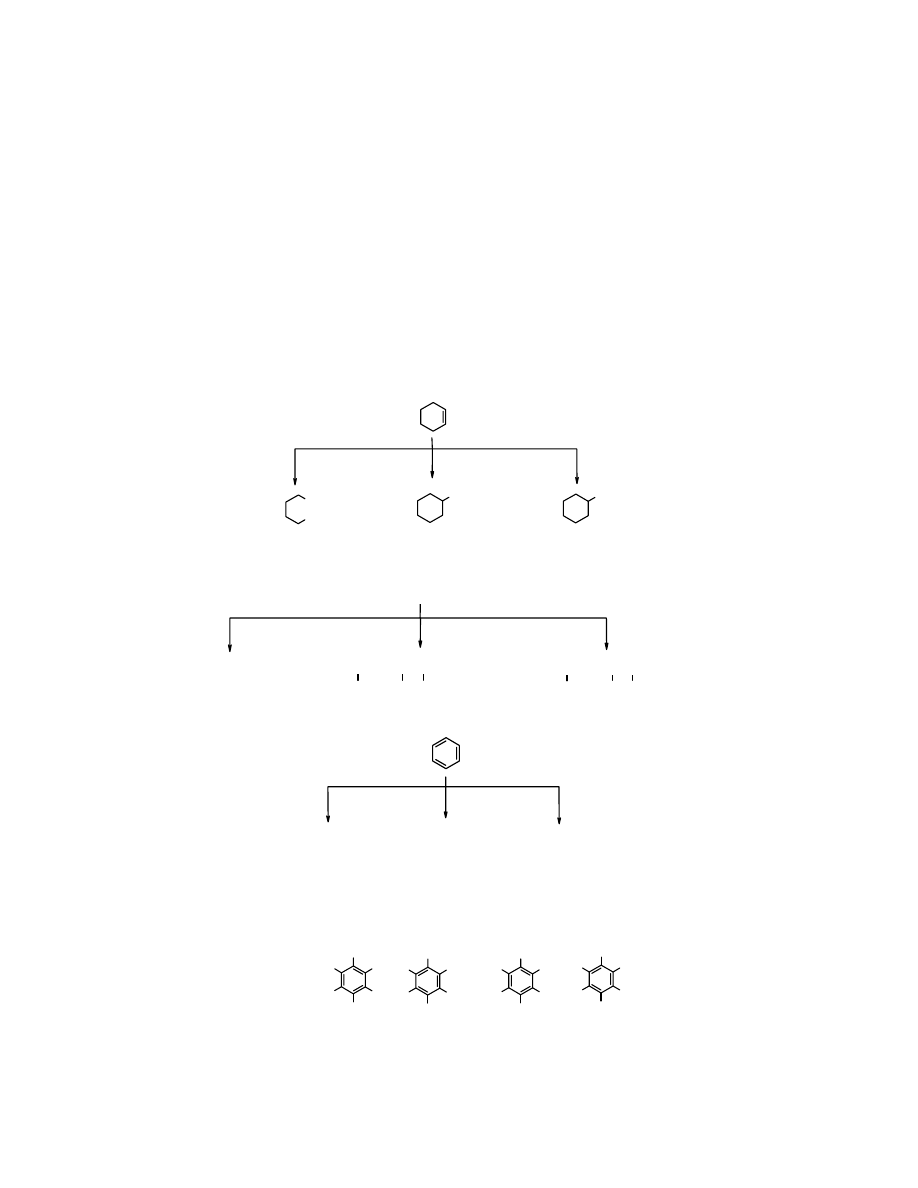
8. W Ę G L O W O D O R Y A R O M A T Y C Z N E - ARENY
Aleksander Kołodziejczyk grudzień 2007
BENZEN
Benzen
, nowy związek, odkryty w 1825 r. przez
Faraday’a
w oleistej pozostałości zbierającej się
na dnie zasilanych gazem z gazowni londyńskich lamp ulicznych, miał właściwości, które
wprawiły w zdumienie ówczesnych chemików.
Michał Faraday (1791-1867); ur. W Newington Butts, Surrey, Wielka Brytania, dyrektor laboratorium w Royal
Institution, prof. chemii w Royal Institution.
Cykloheksa-1,3,5-trien
, znany lepiej pod zwyczajową nazwą
benzen
, pomimo że zawiera trzy
podwójne wiązania C=C nie wykazuje właściwości chemicznych typowych dla alkenów (np.
cykloheksenu
), ani sprzężonych alifatycznych polienów, np.
heksa-1,3,5-trienu
. Przede
wszystkim
nie ulega
charakterystycznym dla alkenów
reakcjom addycji elektrofilowej
.
COOH
COOH
OH
Cl
KMnO
4
/HOH
H
+
/HOH
HCl/eter
cykloheksen
kwas
adypinowy
cykloheksanol
chlorocykloheksan
Podobnie reaguje
heksa-1,3,5-trien
:
OH
OHOH
Cl
Cl Cl
KMnO
4
/HOH
H
+
/HOH
HCl/eter
heksa-1,3,5-trien
CH
2
=CH-CH=CH-CH=CH
2
2 CO
2
+
2 (COOH)
2
CH
3
CHCH
2
CHCHCH
3
CH
3
CHCH
2
CHCHCH
3
kwas
szczawiowy
heksa-2,4,5-triol
2,4,5-trichloroheksan
Benzen
jest niepodatny na działanie tych reagentów:
KMnO
4
/HOH
H
+
/HOH
HCl/eter
benzen
brak reakcji
brak reakcji
brak reakcji
Geometria wiązań w cząsteczce
benzenu
jest inna niż w alkenach czy polienach sprzężonych.
W
benzenie
wszystkie wiązania C-C i C=C są jednakowej długości. Nie ma różnicy pomiędzy
1,2-dimetylobenzem
zapisanym wg poniżej podanych dwóch wzorów. To nie są izomery
konstytucyjne, tj. ten sam związek:
benzen
1,2-dimetylobenzen
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
CH
3
CH
3
H
H
H
H
CH
3
CH
3
długość wiązania C-C = C=C = 1,39 Å, kąty w pierścieniu = 120
o
1
Występowanie
Związki aromatyczne są rozpowszechnione w przyrodzie, wiele z nich pełni ważne funkcje
biochemiczne:
CH
2
CHCOOH
NH
2
CH
2
CHCOOH
OH
NH
2
CH
3
H
O
H
H
H
3
CNH
H
H
H
OH
O
H
O
N CH
3
O
H
O
H
OH
OH
CH
2
NHCH
3
H
O
H
fenyloalanina
aminokwas
tyrozyna
aminokwas
H
3
C
efedryna
alkaloid
adrenalina
neuroprzekaźnik
estradiol
żeński hormon płciowy
morfina
alkaloid, narkotyk
Źródła węglowodorów aromatycznych
Węglowodory aromatyczne występują w ropie naftowej, ale zwykle w małym stężeniu. Znane są
jednak gatunki ropy naftowej o podwyższonej zawartości arenów w stosunku do średniej. W
dużych ilościach znajdują się w smole pogazowej – produkcie
wysokotemperaturowej pirolizy
węgla kopalnego. Z wsadu węglowego powstaje 3-4% smoły pogazowej. Obok smoły pogazowej
w produktach
pirolizy
węgla znajduje się gaz (np. gaz koksowniczy) i koks. Gaz koksowniczy po
ochłodzeniu ulega częściowo skropleniu i ta ciekła frakcja nazywa się benzolem surowym.
Znajduje się w niej głównie
benzen
(>70%) i
toluen
(~15%). Smołę pogazową – bogate źródło
arenów – poddaje się destylacji i uzyskuje się frakcje różniące się lotnością. W zależności od ich
lotności w danej frakcji w przewadze znajduję się takie substancje, jak:
benzen
,
toluen
,
ksyleny
,
etylobenzen
, polialkilowane benzeny,
kumen
,
naftalen
,
inden
,
antracen
i wyższe areny oraz
pochodne węglowodorów aromatycznych, np. fenole, aminy aromatyczne,
pirydyna
i inne.
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
2
CH
3
toluen
o-ksylen
m-ksylen
p-ksylen
etylobenzen
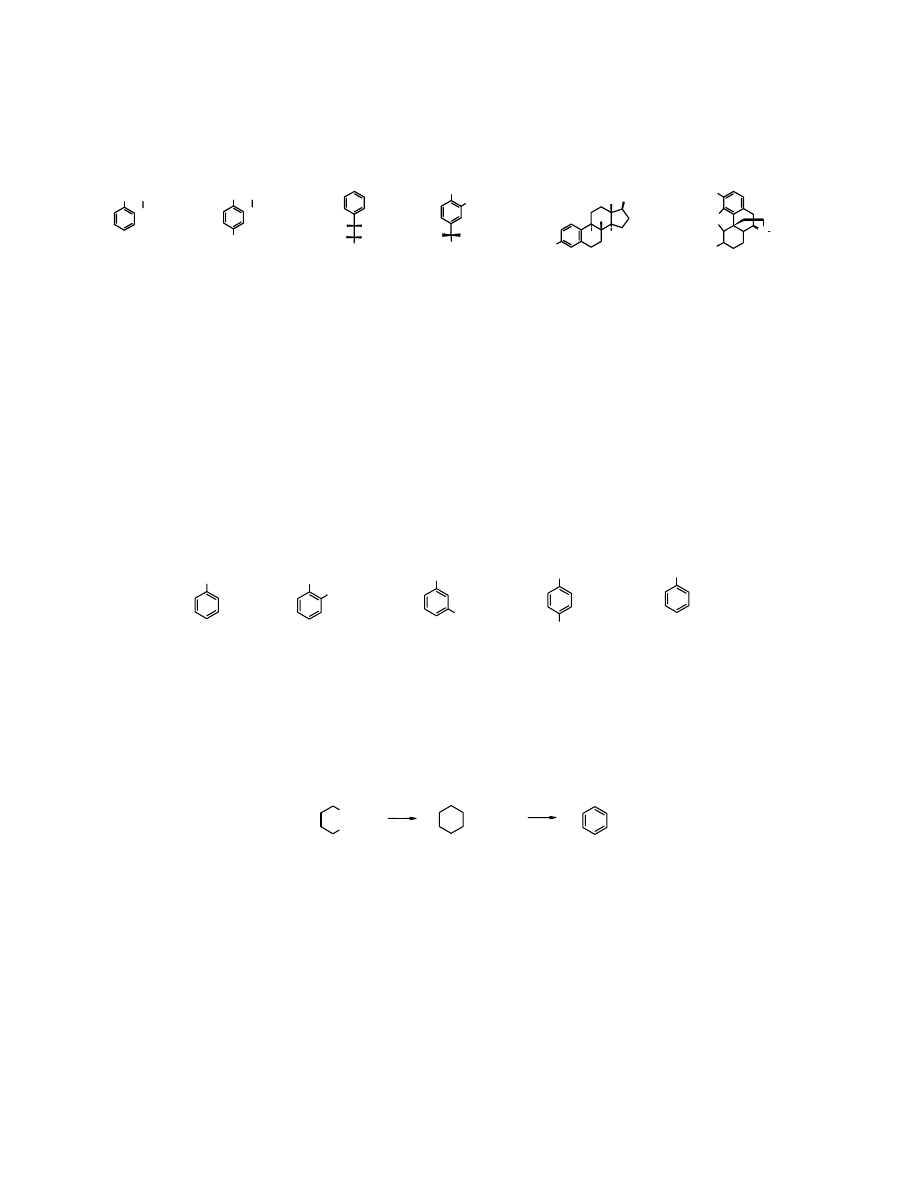
Areny powstają z węglowodorów alifatycznych (np. z frakcji ropy naftowej) w procesie
reformingu
, polegającym na ogrzewaniu ich w wysokiej temp. w obecności katalizatorów. Z
benzyny lekkiej (frakcji wrzącej w temp. 60-85
o
C) powstaje głównie
benzen
, z frakcji 60-105
o
C
w produktach
reformingu
przeważają
benzen
i
toluen
, a z destylatu 105-140
o
C otrzymuje się
przede wszystkim
ksyleny
i
etylobenzen
. Proces przekształcania alkanów w areny składa się z
etapów
cyklizacji
i
aromatyzacji
. Najcenniejszym surowcem do otrzymywania arenów są
frakcje zawierające dużo cykloalkanów.
CH
3
CH
3
∆
-H
2
Pt
500
o
C
n-heksan
cykloheksan
benzen
W przemyśle petrochemicznym areny wytwarza się też z gazu płynnego, czyli
propanu
i
butanów w procesie dehydrocyklooligomeryzacji, zwanej
procesem Cyclar
. Jest to
skomplikowany cykl reakcji obejmujących
odwodornienie
alkanów do alkenów, następnie ich
izomeryzację
,
oligomeryzację
,
cyklizację
i w końcu
aromatyzację
, czyli dalsze
odwodornienie
. W produktach przeważa
toluen
.
Aromatyzację
cykloalkenów można również przeprowadzić za pomocą utleniaczy takich, jak
siarka lub selen, a nawet tlen. W reakcjach układów cyklicznych z S lub Se następuje
eliminacja
odpowiednio H
2
S lub H
2
Se i utworzenie wiązań podwójnych. Im więcej podwójnych wiązań w
pierścieniu substratu, tym łatwiej dochodzi do
aromatyzacji
. Stosunkowo łatwo
aromatyzacji
ulegają produkty
addycji
Dielsa-Adlera, ponieważ są one cykloalkenami.
2
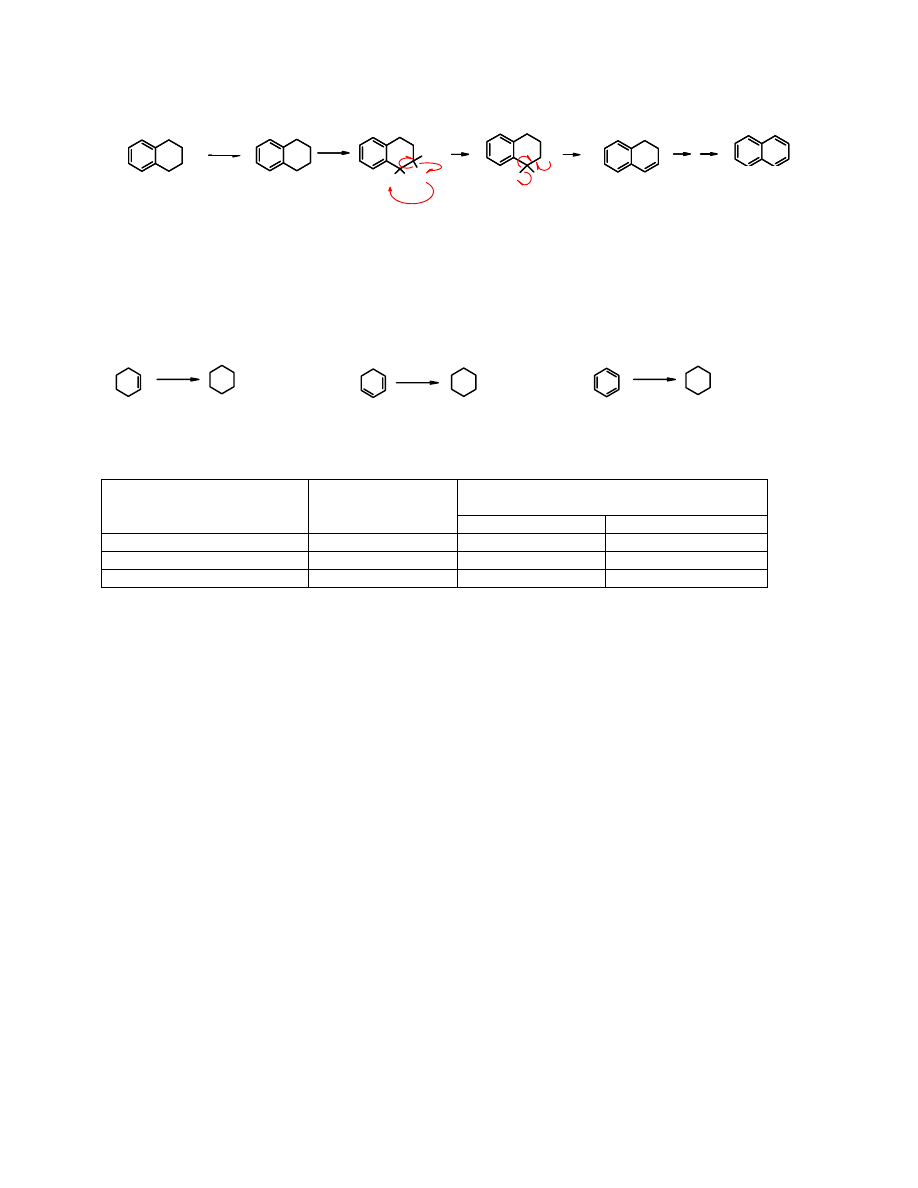
Mechanizm reakcji utleniającego odwodornienia:
S HH
H
S
H
H
S HH
H
S
H
H
250
o
C
- H
.
.
S
.
.
- HS
.
S - HS.
tetralina
250
o
C
- H.
.
S
.
.
S
naftalen
Do
odwodornienia
cykloalkanów dochodzi również w obecności katalizatorów
heterogenicznych (np. Pt). Jest to odwrócony kierunek
uwodornienia
.
Uwodornienie arenów
Uwodornienie katalityczne arenów jest możliwe, jednak
zachodzi znacznie trudniej niż
alkenów
i wydziela się mniej energii niż podczas uwodornienia 3 moli alkenu.
H
2
katalizator
2 H
2
katalizator
2 H
2
katalizator
cykloheksen cykloheksan
cykloheksa-1,3-dien cykloheksan
-28,6 kcal/mol
-55,4 kca/mol
-49,8 kcal/mol
benzen cykloheksan
Ciepło uwodornienia Tabela 8.1.
Ciepło uwodornienia
∆H
o
, kcal/mol
Substrat
Produkt
oczekiwane Oznaczone
cykloheksen cykloheksan
28,6 28,6
cykloheks-1,3-dien cykloheksan
57,2 55,4
benzen cykloheksan
85,8 49,8
Z porównania obliczonej (oczekiwanej) wartości ciepła uwodornienia
cykloheksa-1,3,5-trienu
(trzykrotnie więcej niż wynosi
∆H
o
uwodornienia cykloheksenu), a oznaczonej wartości wynika,
że energia potencjalna
benzenu
jest o 36 kcal/mol niższa niż hipotetycznego,
niearomatycznego
cykloheksa-1,3,5-trienu
.
Z powodu wyżej przedstawionych właściwości
benzenu
nie zalicza się go do alkenów
(polienów).
Tego typu układy nazwano związkami aromatycznymi, w skrócie arenami.
Charakterystycznymi właściwościami
benzenu
i innych związków aromatycznych są:
•
cykliczna budowa;
•
planarność i wysoka symetria cząsteczki, np. sześciobok foremny o bokach
(długościach wiązań) równych 1,39 Å i kątach 120
o
;
•
układ 3 sprzężonych podwójnych wiązań;
•
wysoka stabilność cząsteczki (niska energia potencjalna);
•
brak aktywności w reakcjach addycji eletrofilowej (typowej dla alkenów);
•
podatność na substytucję elektrofilową.
Te właściwości zostały uznane za cechy związków aromatycznych
.
Wymagania dotyczące struktury elektronowej i geometrii związków aromatycznych zawiera
reguła Hückela:
3
Do związków aromatycznych zalicza się płaskie związki pierścieniowe, które zawierają
elektrony
π w liczbie określonej wzorem 4n + 2, gdzie n jest liczbą naturalną = 0, 1, 2, 3,
4,.....
Innymi słowy związkami aromatycznymi są te płaskie związki pierścieniowe, w których znajduje
się 2, 6, 10, 14, 18 .... sprzężonych elektronów
π.
Erich Hückel (1896-1980), ur. w Stuttgardzie, doktorat u Debye’a w Getyndze, prof. fizyki w Stuttgardzie i
Marburgu.
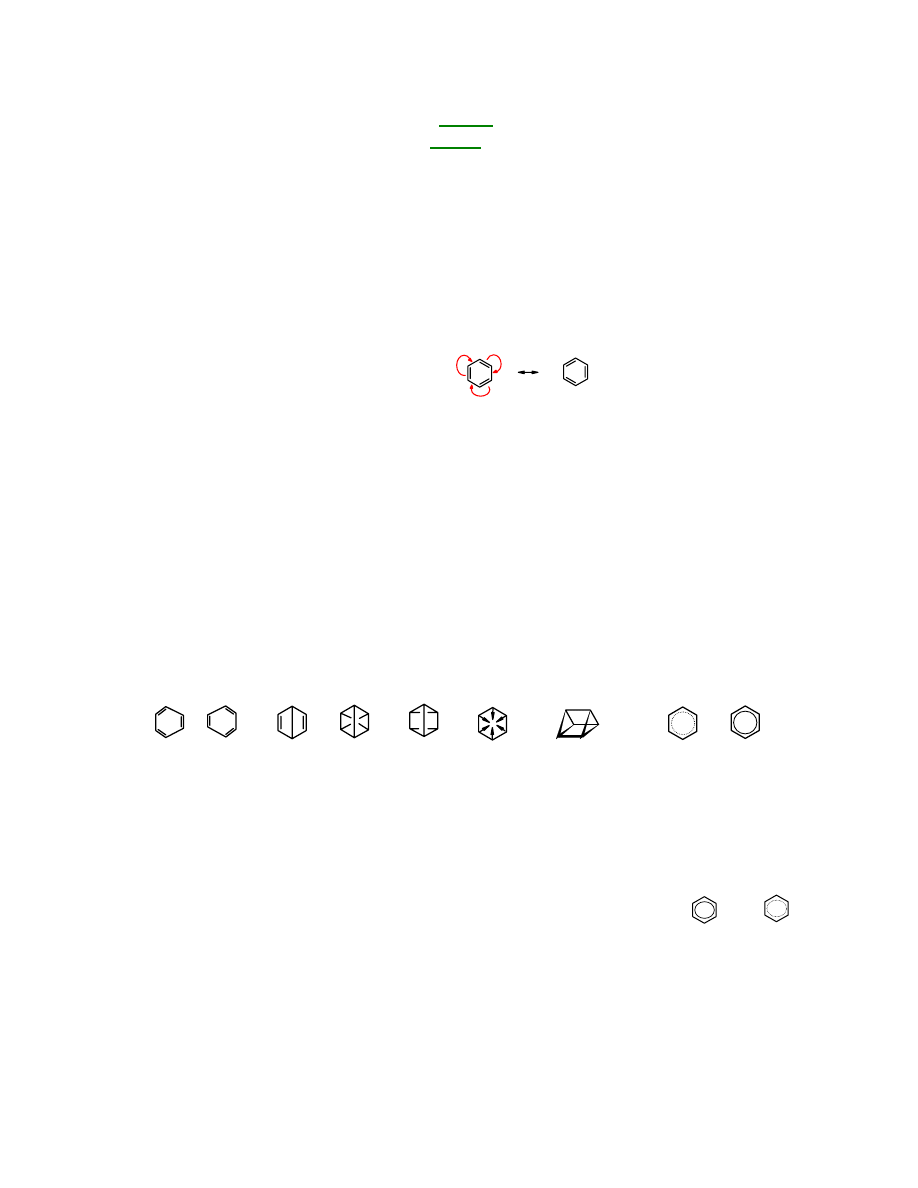
Cząsteczkę
benzenu
można przedstawić za pomocą dwóch wzorów różniących się położeniem
elektronów
π.
Przedstawiają one tę samą cząsteczkę
, są równocenne i tylko oba razem opisują
właściwości tej cząsteczki:
benzen
wzory mezomeryczne
Zjawisko polegające na tym, że tę samą cząsteczkę można opisać za pomocą dwóch lub więcej
wzorów, różniących się jedynie położeniem elektronów
π lub wolnych elektronów nazywa się
mezomerią
(
rezonansem
) i jest charakterystyczne dla związków aromatycznych (nie tylko).
Wzór
benzenu
jako
cykloheksylo-1,3,5-trienu
zaproponował w 1864 r. twórca teorii budowy
związków organicznych - A. Kekulé. Początkowo koncepcja Kekulégo nie została powszechnie
zaakceptowana, ponieważ wzór trienu nie tłumaczył
aromatycznych właściwości
benzenu
.
Pojawiły się różne inne propozycje, ale żadna z nich również nie wyjaśniała właściwości
aromatycznych takiego związku. Dużo czasu upłynęło zanim zaczęto rysować wzory
benzenu
w
postaci sześcioboku foremnego, z trzema podwójnymi wiązaniami rozmieszczonymi
symetrycznie (czyli prawie zgodnie z propozycją Kekulégo) i wprowadzono pojęcie
mezomerii
.
Poniżej przedstawione są różne sposoby rysowania wzoru
benzenu
zaproponowane przez
Kekulégo, Ladenburga, Dewara, Clausa, Baeyera i z kółeczkiem w środku, obrazującym
sprzężone elektrony
π.
Kekulégo
Dewara
Clausa
Baeyera
Ladenburga
z pierścieniem elektronów
π
Możliwość zapisania cząsteczki za pomocą dwóch lub więcej wzorów mezomerycznych
sugeruje niższą energię potencjalną danej cząsteczki. Niższą, niż można sądzić obserwując
pojedynczy wzór. Pojedynczy wzór
benzenu
sugeruje, że jest on dienem sprzężonym, dwa wzory
mezomeryczne świadczą o jego
aromatycznym charakterze
.
Czasami cząsteczkę
benzenu
przedstawia się za pomocą innych pojedynczych
wzorów, ale one też nie oddają aromatycznego charakteru związku:
Z reguły Hückela wynika, że związek aromatyczny nie musi mieć kształtu sześcioczłonowego
pierścienia. Istotnie znane są związki aromatyczne zbudowane z pierścieni o innych rozmiarach
niż homologi
benzenu
.
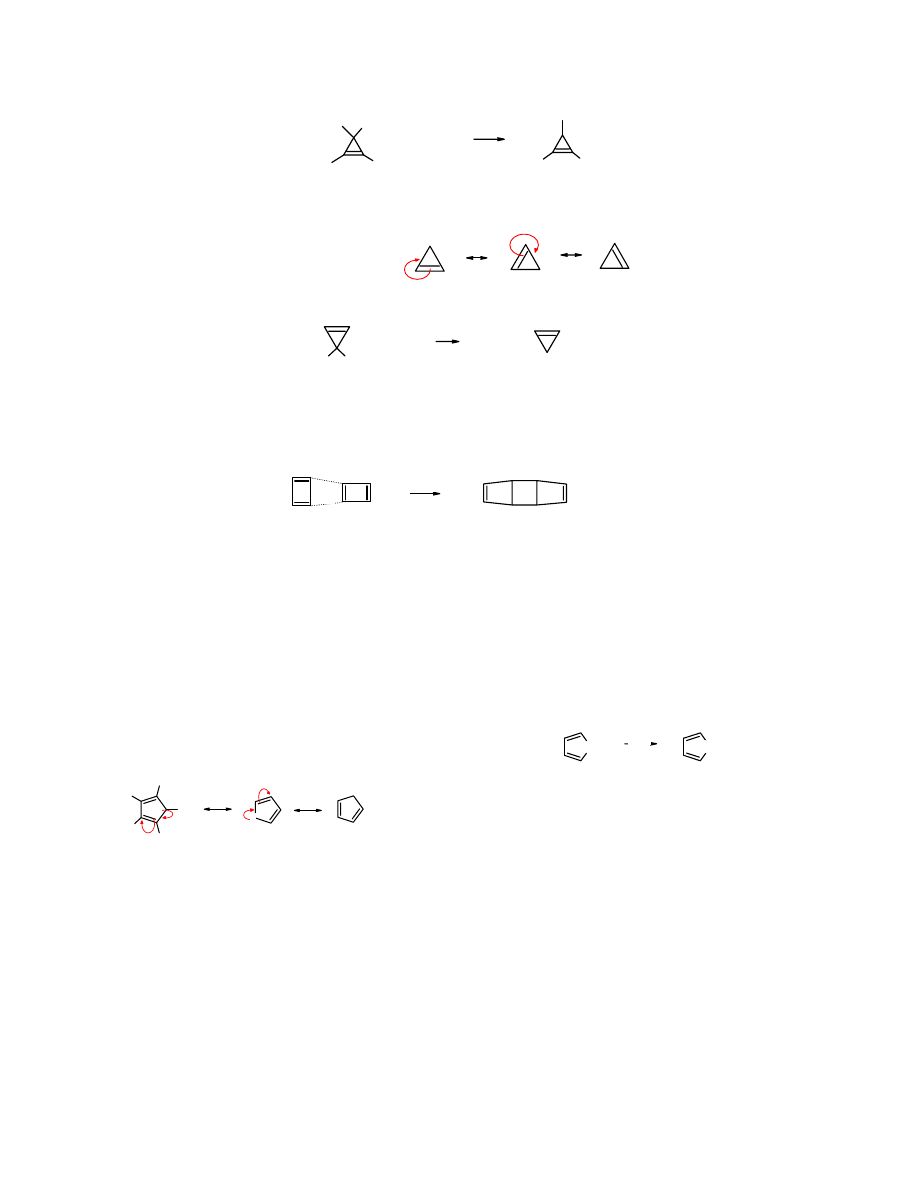
Może to być związek trójczłonowy, np. pochodna kationu cyklopropyliowego:
4
Cl
Cl
Cl
Cl
Cl
Cl
Cl
1,1,2,3 -tetrachlorocyklopropen
+ SbCl
5
+
- SbCl
6
-
kation
1,2,3 -trichlorocyklopropyliowy
(2e)
Kation cyklopropyliowy jest płaski i spełnia regułę Hückela odnośnie liczby elektronów
π w
pierścieniu. Można dla niego rozpisać wzory mezomeryczne:
+
+
+
wzory mezomeryczne
kation
cyklopropyliowy
Kation cyklopropyliowy powstaje z
3-chlorocyklopropanu
pod wpływem SbCl
5
:
H
Cl
+ SbCl
5
+
SbCl
6
-
.
1-chlorocyklopropen
heksachloroantymonian
cyklopropyliowy
Cyklobuta-1,3-dien
jest płaski, jednak ma 4 elektrony
π, a więc nie spełnia reguły Hückela.
Nie
ma właściwości aromatycznych
– jest bardzo reaktywny, nawet w temperaturze -78
o
C,
zachowuje się jak sprzężony dien, tzn. reaguje zgodnie z reakcją Dielsa-Adlera, tworząc
tricykliczny
oktadien
:
+
-78
o
C
reakcja Dielsa-Adlera
cyklo-1,3-butadien
tricyklo[2,0,2,0]okta-2,6-dien
Niektórzy autorzy
cyklobuta-1,3-dien
nazywają
związkiem antyaromatycznym
.
Cyklopenta-1,3-dien
jest prawie płaski, ale liczba sprzężonych elektronów w pierścieniu nie
spełnia reguły Hückela – są 4e, zamiast 2 lub 6. Wystarczy jednak
cyklopenta-1,3-dien
przekształcić w anion, a zyska on cechy aromatyczności. Z anionową parą elektronów osiąga
wymaganą liczba 6 sprzężonych elektronów (4
π + 2), których orbitale mogą się wzajemnie na
siebie nakładać. Z tego powodu allilowe atomy wodoru w
cyklopenta-1,3-dienie
są wyjątkowo
kwaśne – jak na atomy H związane z atomem węgla – stosunkowo łatwo można je oderwać.
Tego typu związki nazywane są
C-kwasami
, reagują ze związkami Grignarda jak kwasy.
CH
2
CH
-OH
:
- H+
-
cyklopenta-1,3-dien
po oderwaniu protonu staje się układem aromatycznym
H
H
H
H
H
:
:
..
Wzory mezomeryczne
anionu cyklopentadienowego
Kolejny węglowodór pod względem wielkości pierścienia –
benzen
, jak już zostało powiedziane
spełnia regułę Hückela.
Był on pierwszym poznanym związkiem aromatycznym; on i jego
homologi bez zastrzeżeń spełniają regułę Hückela.
5
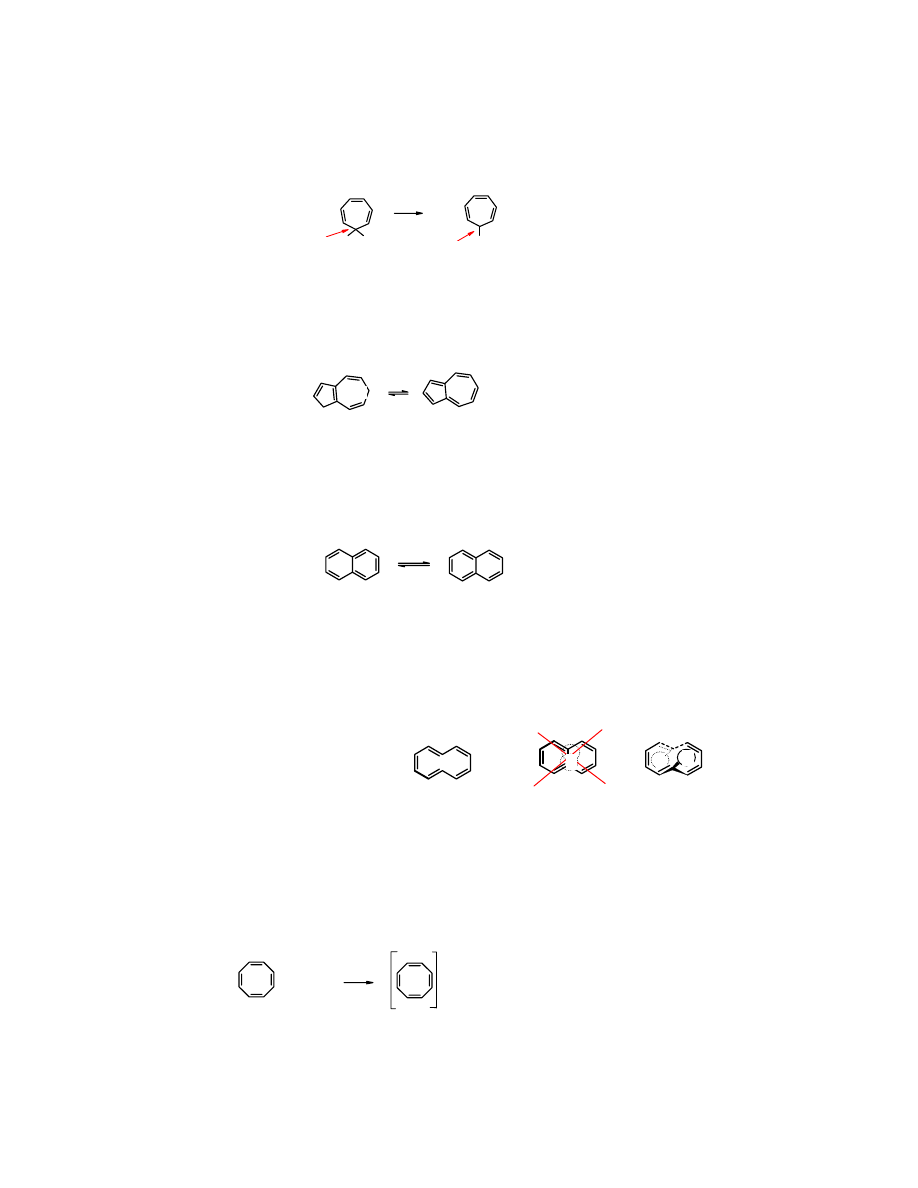
Cyklohepta-1,3,5-trien
ma, co prawda liczbę elektronów wymaganą przez regułę Hückela (6e),
ale jego pierścień nie jest płaski. Wystarczy jednak przekształcić go w kation, zwany
kationem
cykloheptatrienylowym
lub
tropyliowym
, żeby cząsteczka stała się płaska, a tym samym układ
zyskał właściwości aromatyczne. Karbokation ma hybrydyzację sp
2
, wobec czego jest płaski.
H
H
H
Br
2
- HBr
+
sp
2
sp
3
kation tropyliowy
Zadanie: Narysuj wzory mezomeryczne kationu cykloheptatrienylowgo
Azulen
zbudowany z dwóch pierścieni – cyklopentadienylowego i cykloheptatrienylowego – jest
węglowodorem aromatycznym, ponieważ w rzeczywistości skondensowane są pierścienie
anionu
cyklopentadienylowego i
kationu
cykloheptatrienylowego:
niebieski
moment dipolowy
µ = 1,0 D
-
+
azulen
↑
Rozdzielone ładunki
wpływają na wzrost wartości momentu dipolowego cząsteczki
azulenu
.
Bardziej znany izomer azulenu –
naftalen
– jest bezbarwny, a jego moment dipolowy jest równy
0, ponieważ oba skondensowane sześcioczłonowe pierścienie w
naftalenie
, podobnie jak w
benzenie
są aromatyczne z „natury” i cząsteczka nie ulega żadnym przemianom, żeby osiągnąć
aromatyczność.
bezbarwny
moment dipolowy
µ = 0
naftalen
Cyklodeka-1,3,5,7,9-pentaen
(zwany inaczej
10-anulem
), chociaż bardzo zbliżony budową do
naftalenu
, co widać, kiedy jest przedstawiony za pomocą wzoru, jak na rysunku,
nie jest
węglowodorem aromatycznym
, chociaż spełnia regułę Hückela (10e). Jednak wbrew pozorom
jego cząsteczka nie jest płaska, ponieważ atomy wodoru w położeniach 2 i 7 nie mają
wystarczająco dużo miejsca, żeby ułożyć się obok siebie; zajmują one położenie „nad” i „pod”
pierścieniem, przez co odchylają atomy C2 i C7, zaburzając planarność cząsteczki:
H
H
H
7
2
2
7
7
H
1 2 3
4
5
6
8
9
10
cyklodeka-1,3,5,7,9-pentaen
Wzajemne odpychanie się atomów wodoru przy C2 i C7 powoduje, że cząsteczka
cyklodeka-
1,3,5,7,9-pentaenu
nie jest płaska.
Zadanie: Określ geometrię wiązań podwójnych w cząsteczce
cyklodeka-1,3,5,7,9-pentaenu
Cząsteczka
cyklookta-1,3,5,7-tetraenu
, jest płaska (wszystkie atomy C mają hybrydyzację sp
2
),
ale związek staje się aromatycznym dopiero po zyskaniu dwóch elektronów.
+ 2 Na
2e
2 Na
2
-
+
aromatyczny
dianion cyklooktatetraenylowy
Cyklookta-1,3,5,7-tetraen
łatwo reaguje z metalami alkalicznymi w wyniku, czego powstaje
dianion cyklooktatetraenylowy
wykazujący właściwości aromatyczne. Obniżenie energii układu
6
poprzez przekształcenie się w związek aromatyczny jest przyczyną dużej kwasowości dwóch
atomów wodoru
cyklooktatetraenu
– kolejny przykład
C-kwasu
.
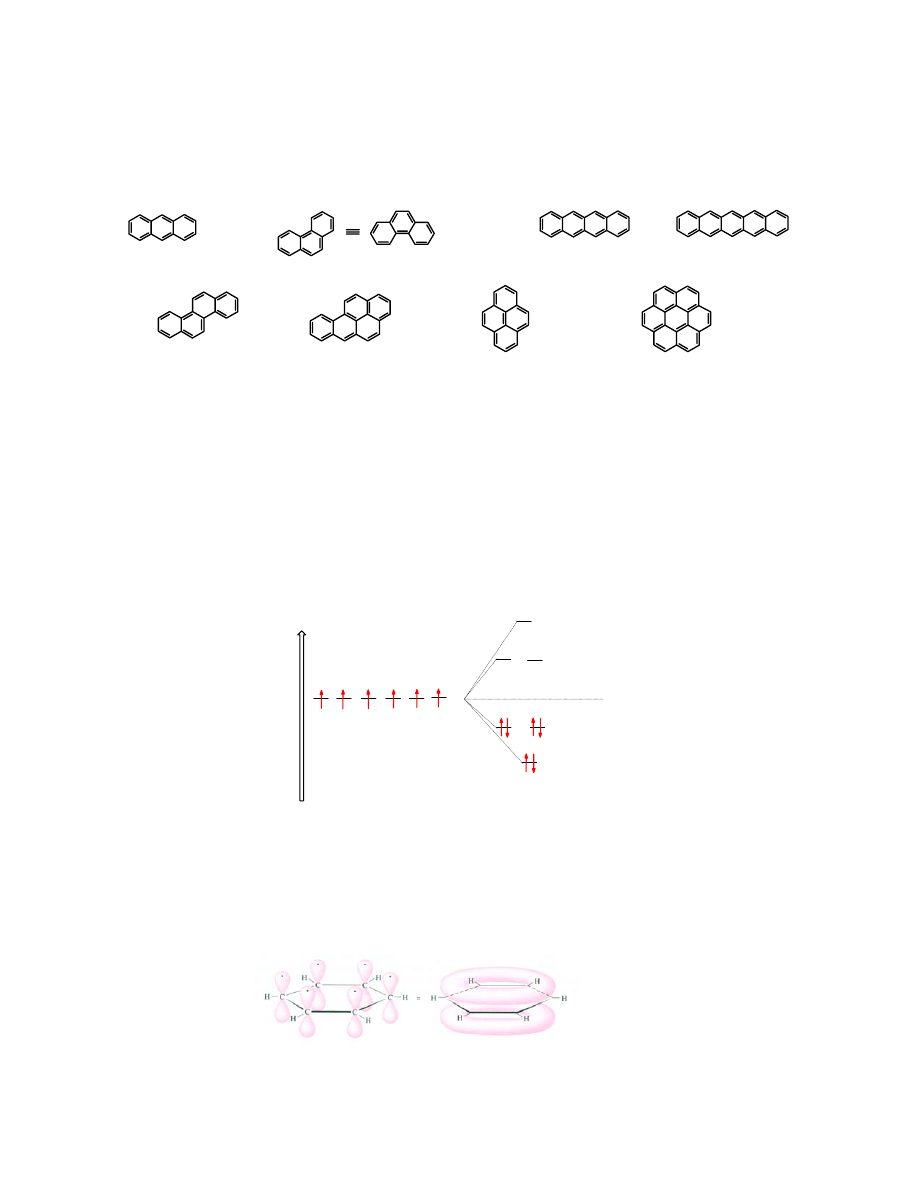
Znanych jest wiele węglowodorów aromatycznych, w których strukturach można wyróżnić
skondensowane pierścienie benzenowe:
antracen
fenantren
tetracen
pentacen
chryzen
benzo[a]piren
piren
koroner
Benzo[a]piren
należy do najsilniejszych, znanych związków rakotwórczych.
Znane są wyjątki od reguły Hückla. Należy do nich
piren
, który zawiera 16 elektronów
π (8
wiązań
C=C), czyli nie spełnia tej reguły. Jednak jego właściwości chemiczne i nawet fizyczne
wskazują na to, że należy on do rodziny węglowodorów aromatycznych.
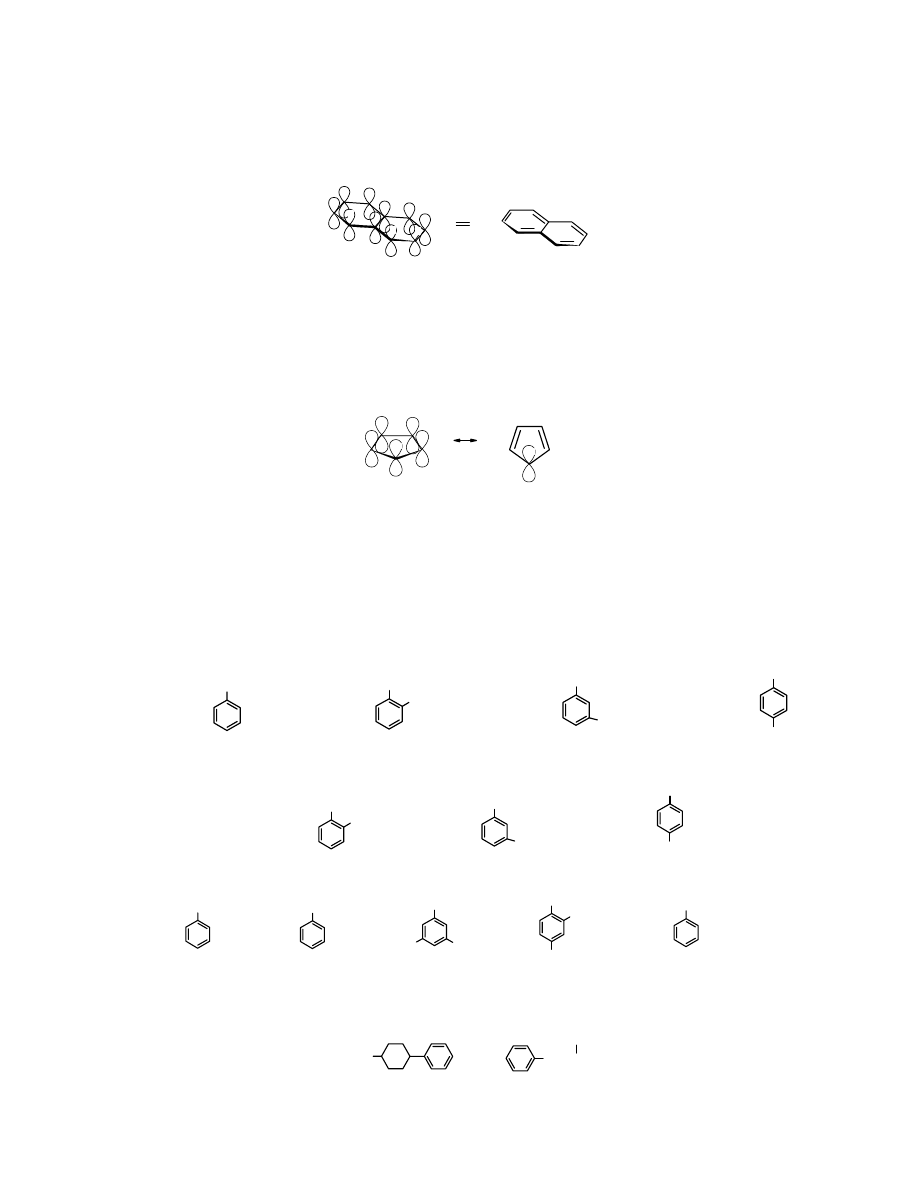
Struktura elektronowa benzenu
Wszystkie atomy węgla w cząsteczce benzenu mają hybrydyzację sp
2
. Trzy elektrony orbitali sp
2
atomów C
benzenu
tworzą wiązania
σ: jedno z atomem wodoru, dwa z sąsiednimi atomami
węgla. Sześć orbitali atomowych p, sześciu atomów węgla tworzących cząsteczkę
benzenu
nakłada się tworząc sześć orbitali cząsteczkowych: trzy wiążące i trzy antywiążące:
ψ
1
ψ
2
ψ
3
ψ
4
ψ
5
ψ
6
,
*
*
*
,
orbitale wiążące
orbitale antywiążące
energia
Rys.8.1 Sześć orbital atomowych p 6 atomów węgla w cząsteczce nakłada się i powstaje orbitali cząsteczkowych
ψ
Z doświadczenia wiadomo, że orbitale cząsteczkowe
benzenu
ψ
1
,
ψ
2
i
ψ
3
są równocenne, należy
więc przyjąć, że dochodzi do dalszego ich wzajemnego nałożenia i uśrednienia ich energii. W
takim przypadku mówimy o orbitalach zdegenerowanych (o tej samej energii). Orbital wiążący
powstały po nałożeniu się orbitali
ψ
1
,
ψ
2
i
ψ
3
ma kształt dwóch obwarzanek zajmujących pozycje
symetryczne nad i pod płaszczyzną pierścienia cząsteczki
benzenu
:
Rys.8.2 Zdelokalizowane orbitale
π
benzenu
,
wg J. McMurry, Chemia Organiczna, PWN, Warszawa 2000
7
Struktura elektronowa naftalenu
W
naftalenie
10 atomowych orbitali p nakłada się tworząc 5 cząsteczkowych orbitali wiążących i
5 antywiążących.
.
.
.
.
.
.
.
.
.
Dla zachowania przejrzystości detali ważnych dla omawianego problemu, w powyższych
wzorach nie uwzględniono 6 atomów H związanych po jednym z każdym atomem C.
Struktura elektronowa anionu cyklopentadienowego
W anionie cyklopentadienowym nakładają się na siebie cztery orbitale atomowe p zawierające
po 1 elektronie i jeden orbital p anionowego atomu węgla zawierający 2 elektrony:
..
.
.
.
.
..
Należy pamiętać jeszcze o atomach wodoru przy każdym z atomów C.
Nazewnictwo pochodnych benzenu
Nazwy pochodnych
benzenu
tworzy się poprzez dodanie w przedrostku nazwy podstawnika,
poprzedzonej lokantem, jeżeli z pierścieniem związanych jest więcej niż jeden podstawnik. Wiele
popularnych pochodnych
benzenu
ma nazwy zwyczajowe. Często wzajemne położenie dwóch
(nie więcej) podstawników w pierścieniu określa się za pomocą pisanych kursywą przedrostków
orto- (1,2), meta- (1,3) i para 1,4).
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
toluen
orto-ksylen
meta-ksylen
para-ksylen
(metylobenzen)
(1,2-dimetylobenzen)
(1,3-dimetylobenzen)
(1,4-dimetylobenzen)
Zamiast pełnych nazw przedrostków stosuje się również skróty o-, m- i p-:
CH
3
Cl
CH
3
Cl
CH
3
Cl
o-chlorotoluen
m-chlorotoluen
p-chlorotoluen
Często używane nazwy zwyczajowe:
OH
NH
2
CH(CH
3
)
2
CH
3
CH
3
C
H
3
CH
3
CH
3
CH
3
fenol
anilina
mezytylen
pseudokumen
kumen
Reszta
benzenu
po usunięciu atomu wodoru nosi nazwę fenylu. Fenyl jako przedrostek służy do
tworzenia nazw w sposobie podstawnikowym.
C
H
3
CH
2
-CH-CH
3
OH
1-fenylopropan-2-ol
1-fenylo-4-metylocykloheksan
8

9
Właściwości fizyczne:
Benzen
,
toluen
i niektóre inne alkilobenzeny są cieczami o aromatycznym zapachu, stąd
pochodzi nazwa tej grupy związków.
Benzen
wrze w temperaturze 80
o
C, a
toluen
111
o
C.
Benzen
ze względu na swoją symetryczna budowę, a więc łatwość do tworzenia struktur
uporządkowanych ma stosunkowo wysoką tt., wynoszącą 5,5
o
C, podczas gdy tt.
toluenu
jest
znacznie niższa – -95
o
C.
Naftalen
jest ciałem stałym, tt. = 80
o
C. Węglowodory aromatyczne są
trudno rozpuszczalne w wodzie.
Benzen
należy do jednych z najbardziej niebezpiecznych popularnych związków organicznych, z
uwagi na swoje właściwości toksyczne, kancerogenne i teratogenne.
Właściwości chemiczne węglowodorów aromatycznych zostaną omówione później.
Document Outline
Wyszukiwarka
Podobne podstrony:
ARENY 2
ARENY 2
Weglowodory aromatyczne Areny
Areny, CHEMIA, organiczna
Nazwa?ltic Areny
Powtórzenie węglowodory nienasycone i areny
8. Areny, organa
areny 3
8. Areny', chemia, 0, httpwww.pg.gda.plchemKatedryOrganaindex.phpoption=com content&view=category&id
Areny globalizacji, UEK Stosunki Międzynarodowe stacjonarne, V semestr, Polityczne aspekty globaliza
Areny, studia
11 Areny
chemia, ARENY, ARENY- są to cząsteczki spełniające następujące warunki:
Areny
ARENY
ARENY 2
ARENY
[Beata Świerkocka & Jacek Świerkocki] Węglowodory aromatyczne areny
więcej podobnych podstron