
Biochemia
Dżej Dżeja
1
J. J. Jernajczyk
Poznań 2014

SPIS TREŚCI:
1. AMINOKWASY:
4
- BIOSYNTEZA AMINOKWASÓW ENDOGENNYCH................................................... 4
- PRZEMIANY SZKIELETÓW WĘGLOWYCH AMINOKWASÓW
6
- PRZEMIANA AMINOKWASÓW W INNE PRODUKTY O FUNKCJACH
BIOLOGICZNYCH............................................................................................................... 12
2. ZWIĄZKI AZOTOWE:
16
- PURYNY................................................................................................................................16
- PIRYMIDYNY
18
- BILANS AZOTOWY I CYKL MOCZNIKOWY..............................................................20
3. WĘGLOWODANY:
24
- GLIKOLIZA.........................................................................................................................24
- CYKL KWASU CYTRYNOWEGO
26
- GLIKOGENOGENEZA......................................................................................................29
- GLIKOGENOLIZA
29
- GLUKONEOGENEZA...................................................................................................... 30
- SZLAK PENTOZOFOSFORANOWY
33
- SZLAK KWASU URONOWEGO...................................................................................... 34
- FRUKTOZA
35
- GALAKTOZA...................................................................................................................... 36
- AMINOCUKRY
36
4. LIPIDY:............................................................................................................................... 38
- BIOSYNTEZA KWASÓW TŁUSZCZOWYCH
38
- β-OKSYDACJA KWASÓW TŁUSZCZOWYCH............................................................ 39
- KETOGENEZA
40
- BIOSYNTEZA TRIACYLOGLICEROLI I POCHODNYCH LIPIDÓW.....................41
2

- TRAWIENIE LIPIDÓW
45
- CHOLESTEROL................................................................................................................. 46
- LIPOPROTEINY
48
- POCHODNE CHOLESTEROLU...................................................................................... 50
5. ŁAŃCUCH ODDECHOWY
56
6. ENZYMY............................................................................................................................. 61
7. WITAMINY I KOENZYMY
66
8. HORMONY PRZYSADKI................................................................................................ 72
3

1. AMINOKWASY
Aminokwasy egzogenne:
- Izoleucyna (Ile) [I]
- Leucyna (Leu) [L]
- Lizyna (Lys) [K]
- Metionina (Met) [M]
- Fenyloalanina (Phe) [F]
- Treonina (Thr) [T]
- Tryptofan (Trp) [W]
- Walina (Val) [V]
- Histydyna (His) [H]
- Arginina (Arg) [R] jest syntetyzowana przez ludzki organizm, ale w trakcie rozwoju szybkość tej
syntezy jest niewystarczająca do pokrycia zapotrzebowania organizmu dziecka
Aminokwasy endogenne:
- Alanina (Ala) [A]
- Asparagina (Asn) [N]
- Asparaginian (Asp) [D]
- Cysteina (Cys) [C]
- Glutaminian (Glu) [E]
- Glutamina (Gln) [Q]
- Glicyna (Gly) [G]
- Prolina (Pro) [P]
- Seryna (Ser) [S]
- Tyrozyna (Tyr) [Y]
- Hydroksyprolina i hydroksylizyna powstają podczas syntezy kolagenu w wyniku zmian
potranslacyjnych.
BIOSYNTEZA AMINOKWASÓW ENDOGENNYCH:
1. Glutaminian.
α-ketoglutaran + NH
4
+
+ NADH + H
+
-> glutaminian + H
2
O + NAD
+
enzym: dehydrogenaza glutaminianowa
- dehydrogenaza glutaminianowa może wykorzystywać także NADP
2. Glutamina.
glutaminian + NH
4
+
+ ATP -> glutamina + ADP + Pi
enzym: syntetaza glutaminowa
3. Alanina.
pirogronian + glutaminian <-> alanina + α-ketoglutaran
lub
4

pirogronian + asparaginian <-> alanina + szczawiooctan
enzym: aminotransferaza alaninowa
4. Asparaginian.
alanina + szczawiooctan <-> pirogronian + asparaginian
enzym: aminotransferaza alaninowa
5. Asparagina.
asparaginian + glutamina + ATP -> asparagina + glutaminian + AMP + PPi
enzym: syntetaza asparaginowa
6. Seryna.
3-fosfo-D-glicerynian + NAD
+
-> fosfohydroksypirogronian + NADH + H
+
fosfohydroksypirogronian + α-aminokwas -> fosfo-L-seryna + α-ketokwas
fosfo-L-seryna + H
2
O -> L-seryna + Pi
Seryna może także powstawać z glicyny:
glicyna + metylenotetrahydrofolian -> seryna + tetrahydrofolian
enzym: hydroksymetylotransferaza serynowa
7. Glicyna.
Z choliny:
cholina -> aldehyd betainy -> betaina -> dimetyloglicyna -> sarkozyna -> glicyna
Z CO2:
CO
2
+ NH
4
+
+ metylenotetrahydrofolian + NADH + H
+
-> glicyna + tetrahydrofolian + NAD
+
Z glioksalanu:
glioksalan + glutaminian -> glicyna + α-ketoglutaran
lub
glioksalan + alanina -> glicyna + szczawiooctan
enzym: aminotransferaza glicynowa
8. Prolina.
glutaminian + NADH + H
+
-> glutamylo-γ-semialdehyd + H
2
O + NAD
+
glutamylo-γ-semialdehyd + NADH + H
+
-> prolina + H
2
O + NAD
+
9. Cysteina.
metionina + ATP + H
2
O -> S-adenozylometionina + PPi + Pi
enzym: adenozylotransferaza L-metioninowa
S-adenozylometionina + akceptor grupy metylowej -> S-adenozylohomocysteina + CH
3
-akceptor
S-adenozylohomocysteina + H
2
O -> homocysteina + adenozyna
L-homocysteina + L-seryna -> cystationina + H
2
O
enzym: β-syntaza cystationinowa
5

cystationina + H
2
O -> L-cysteina + L-homoseryna
10. Tyrozyna.
fenyloalanina + O
2
+ tetrahydrobiopteryna -> tyrozyna + H
2
O + dihydrobiopteryna
enzym: hydroksylaza fenyloalaninowa
dihydrobiopteryna + NADPH + H
+
-> tetrahydrobiopteryna + NADP
+
11. Hydroksyprolina i hydroksylizyna to prolina i lizyna poddane reakcji hydroksylacji dopiero po
wbudowaniu do peptydu. Hydroksylacja ta odbywa się kosztem przemiany α-ketoglutaranu w
bursztynian. Enzymami są odpowiednio: hydroksylaza prolilowa i hydroksylaza lizylowa,
wymagające do działania witaminy C. Brak witaminy C uniemożliwia syntezę kolagenu i
powoduje szkorbut.
Selenocysteina:
- jest 21. aminokwasem białkowym
- znajduje się w miejscach aktywnych oksydoreduktaz i uczestniczy w ich aktywności
katalitycznej
- ma swoje specyficzne tRNA (w przeciwieństwie do hydroksyproliny i hydroksylizyny)
- powstawanie:
SeO
4
2-
+ ATP -> selenofosforan + AMP + Pi
enzym: syntetaza selenofosforanu
selenofosforan + seryna -> selenocysteina + Pi
Ta reakcja zachodzi już po połączeniu seryny z tRNA.
PRZEMIANY SZKIELETÓW WĘGLOWYCH AMINOKWASÓW:
- aminokwasy ketogenne: leucyna, izoleucyna, lizyna, fenyloalanina, tryptofan, tyrozyna –
przekształcają się do acetylo-CoA:
1. Fenyloalanina.
fenyloalanina + tetrahydrobiopteryna + O
2
-> tyrozyna + dihydrobiopteryna + H
2
O
enzym: hydroksylaza fenyloalaninowa
2. Tyrozyna.
tyrozyna + α-ketoglutaran <-> parahydroksyfenylopirogronian + glutaminian
enzym: aminotransferaza tyrozynowa
koenzym: fosforan pirydoksalu (witamina B
6
)
p-hydroksyfenylopirogronian + [O] -> homogentyzynian + CO
2
enzym: dioksygenaza parahydroksyfenylopirogronianowa
6

koenzymy: witamina C, Cu
2+
homogentyzynian + [O] -> mealeiloaccetooctan
enzym: oksydaza homogentyzynianowa
maleiloacetooctan <-> fumaryloacetooctan
fumaryloacetooctan + H
2
O -> fumaran + acetooctan
enzym: fumaryloacetoacetaza
acetooctan + CoA-SH -> acetylo-CoA + octan
3. Lizyna.
lizyna -> sacharopina -> δ-semialdehyd-L-α-aminoadypinowy
enzym (do obu reakcji): syntaza semialdehydu aminoadypinowego
δ-semialdehyd-L-α-aminoadypinowy -> L-α-aminoadypinian -> α-ketoadypinian -> glutarylo-CoA
Zachodzi tu reakcja transaminacji, w wyniku której powstaje glutaminian, który może
przekształcać się w α-ketoglutaran i wchodzić do cyklu Krebsa (dlatego lizyna jest też
glukogenna).
glutarylo-CoA + NAD
+
-> krotonylo-CoA + NADH + H
+
+ CO
2
Krotonylo-CoA jest rozkładany do acetylo-CoA i CO
2
w procesie β-oksydacji kwasów
tłuszczowych.
4. Tryptofan.
tryptofan + O
2
-> N-formylokinurenina
enzym: oksygenaza tryptofanowa
inhibitor: pochodne kwasu nikotynowego (np. NADPH)
aktywator: Fe
2+
, tryptofan, kortykosteroidy
N-formylokinurenina + H
2
O -> kinurenina + mrówczan
enzym: formylaza kinureninowa
kinurenina -> 3-hydroksykinurenina
3-hydroksykinurenina -> 3-hydroksyantranian
enzym: kinureninaza
koenzym: fosforan pirydoksalu (witamina B
6
)
- w wypadku niedoboru witaminy B
6
3-hydroksykinurenina przekształca się w ksanturenian
3-hydroksyantranian -> -> α-ketoadypinian -> -> krotonylo-CoA (rozkładane do acetylo-CoA i CO
2
w procesie β-oksydacji)
- aminokwasy glukogenne: alanina, arginina, asparagina, asparaginian, cysteina, glutamina,
glutaminian, glicyna, histydyna, hydroksyprolina, metionina, prolina, seryna, treonina, walina -
przekształcają się do związków biorących udział w cyklu kwasu cytrynowego:
7

* do pirogronianu:
1. Alanina.
alanina + α-ketoglutaran <-> pirogronian + glutaminian
enzym: aminotransferaza glutaminianowa
2. Treonina.
treonina -> aldehyd octowy + glicyna
enzym: aldolaza treoninowa
3. Glicyna.
glicyna + metylenotetrahydrofolian <-> seryna + tetrahydrofolian
enzym: hydroksymetylotransferaza serynowa
4. Seryna.
seryna -> pirogronian + NH
4
+
enzym: dehydrataza serynowa
5. Cysteina.
cystyna + NADH + H
+
<-> cysteina + NAD
+
enzym: reduktaza cystynowa
Cysteina ma 2 drogi przemian do pirogronianu:
A.cysteina -> cysteinosulfonian -> sulfinylopirogronian -> pirogronian
B. cysteina -> 3-merkaptopirogronian (tiolopirogronian) -> pirogronian + 3-merkaptomleczan
6. 4-hydroksyprolina.
* do α-ketoglutaranu:
1. Arginina.
arginina + H
2
O -> mocznik + ornityna
enzym: arginaza
ornityna + α-ketoglutaran -> γ-semialdehyd-L-glutaminowy + glutaminian
enzym: δ-aminotransferaza ornitynowa
2. Prolina.
prolina + NAD
+
+ H
2
O -> γ-semialdehyd-L-glutaminowy + NADH + H
+
enzym: dehydrogenaza prolinowa
γ-semialdehyd-L-glutaminowy + NAD
+
-> glutaminian + NADH + H
+
enzym: dehydrogenaza γ-semialdehydo-L-glutaminowa
3. Histydyna.
histydyna -> urokanian + NH
4
+
enzym: amoniakoliaza histydynowa (histydaza)
urokanian -> 4-imidazolono-5-propionian -> N-formiminoglutaminian (Figlu)
8

Figlu + tetrahydrofolian -> glutaminian + N
5
-formiminotetrahydrofolian
enzym: formiminotransferaza glutaminianowa
4. Glutamina.
glutamina + H
2
O -> glutaminian + NH
4
+
enzym: glutaminaza
5. Glutaminian.
glutaminian + pirogronian -> α-ketoglutaran + alanina
enzym: aminotransferaza alaninowa
* do bursztynylo-CoA:
1. Izoleucyna (patrz niżej).
2. Walina (patrz niżej).
3. Metionina.
metionina + ATP + H
2
O -> S-adenozylometionina + PPi + Pi
enzym: adenozylotransferaza L-metioninowa
S-adenozylometionina + akceptor grupy metylowej -> S-adenozylohomocysteina + CH
3
-akceptor
S-adenozylohomocysteina + H
2
O -> homocysteina + adenozyna
L-homocysteina + L-seryna -> cystationina + H
2
O
enzym: β-syntaza cystationinowa
cystationina + H
2
O -> L-cysteina + L-homoseryna
Cysteina przekształca się w pirogronian (patrz wyżej).
L- homoseryna -> α-ketoizomaślan -> propionylo-CoA -> metylomalonylo-CoA -> bursztynylo-
CoA
* fumaran powstaje w reakcjach katabolizmu fenyloalaniny i tyrozyny (patrz wyżej)
* do szczawiooctanu:
1. Asparagina.
asparagina + H
2
O -> asparaginian + NH
4
+
enzym: asparaginaza
2. Asparaginian.
asparaginian + pirogronian -> szczawiooctan + alanina
enzym: aminotransferaza alaninowa
* katabolizm szkieletów węglowych aminokwasów o rozgałęzionych łańcuchach (leucyny,
izoleucyny i waliny)
9

Pierwsze 3 reakcje przebiegają w ten sam sposób i przy użyciu tych samych enzymów:
I. Transaminacja.
enzym: odpowiednia aminotransferaza
II. Dekarboksylacja oksydacyjna.
enzym: dehydrogenaza α-ketokwasów o rozgałęzionych łańcuchach (aktywna, gdy jest
defosforylowana)
III. Dehydrogenacja.
W wyniku tych 3 procesów powstają odpowiednio:
leucyna -> β-metylokrotonylo-CoA
izoleucyna -> tyglilo-CoA
walina -> metakrylilo-CoA
Dalszy katabolizm:
A. Leucyny.
β-metylokrotonylo-CoA -> -> acetooctan + acetylo-CoA
W jednym z etapów koenzymem jest biotyna.
Leucyna jest tylko ketogenna!!
B. Izoleucyny.
tyglilo-CoA -> -> acetylo-CoA + propionylo-CoA
propionylo-CoA -> metylomalonylo-CoA -> bursztynylo-CoA
C. Waliny.
metakrylilo-CoA -> -> metylomalonylo-CoA + β-aminoizomaślan
metylomalonylo-CoA -> bursztynylo-CoA
Koenzymem w tej reakcji jest witamina B
12
.
!!! Izoleucyna, lizyna, fenyloalanina, tryptofan i tyrozyna są aminokwasami zarówno gluko- jak
i ketogennymi !!!
Choroby związane z katabolizmem szkieletów węglowych:
Choroba
Aminokwas Co jest uszkodzone?
Objawy
Hiperprolinemia typu I prolina
dehydrogenaza prolinowa
opóźnienie umysłowe
Hiperprolinemia typu II prolina
dehydrogenaza
semialdehydo-L-
glutaminowa
opóźnianie umysłowe, w
moczu występuje Δ
1
-pirolino-
3-hydroksy-5-karboksylan
Histydynemia
histydyna
amoniakoliaza histydynowa zwiększone stężenie histydyny
we krwi i w moczu
10

Atrofia zakrętowa
siatkówki
ornityna
δ-aminotransferaza
ornitynowa
utrata widzenia obwodowego,
podwyższony poziom ornityny
w osoczu i moczu
Zespół
hiperornitynemii-
hiperamonemii
ornityna
transporter mitochondrialny
dla ornityny i cytruliny
zwiększone stężenie ornityny i
amoniaku we krwi
Glicynuria
glicyna
wchłanianie zwrotne
glicyny w kanalikach
nerkowych
zwiększone wydalanie glicyny
z moczem, szczawianowe
kamienie nerkowe
Pierwotna
hiperoksaluria
glicyna
katabolizm glioksalanu
kamica moczowa, wapnica
nerek, niewydolność nerek,
nadciśnienie
Sulfituria
cysteina
oksydaza siarczanowa
Disulfiduria 3-
merkaptopirogroniano-
cysteinowa
cysteina
siarkotransferaza 3-
merkaptopirogronianowa
cystynuria
(cystynolizynuria)
cystyna,
lizyna,
arginina,
ornityna
wchłanianie zwrotne
wymienionych
aminokwasów
cystynowe kamienie nerkowe,
wydalanie mieszanego
disiaczku L-cysteiny z L-
homocysteiną
Cystynoza
cystyna
funkcjonowanie lizosomów odkładanie się kryształów
cystyny w tkankach,
niewydolność nerek
Hiperfenyloalaninemia
typu I
(fenyloketonuria)
fenyloalanin
a
4-monooksygenaza
fenyloalaninowa
(hydroksylaza
fenyloalaninowa)
wydzielanie alternatywnych
katabolitów fenyloalaniny
(fenylomleczan,
fenylopirogronian, ...),
opóźnienie umysłowe, objawy
neurologiczne, zapach mysi
Hiperfenyloalaninemia
typu II i III
fenyloalanin
a
reduktaza
dihydrobiopterynowa
j.w.
Hiperfenyloalaninemia
typu IV i V
fenyloalanin
a
biosynteza
dihydrobiopteryny
j.w.
Tyrozynemia typu I
(tyrozynoza)
tyrozyna
hydrolaza
fumaryloacetooctanowa
niewydolność wątroby
Tyrozynemia typu II
(zespół Richnera -
Hanharta)
tyrozyna
aminotransferaza
tyrozynowa
Tyrozynemia
noworodków
tyrozyna
hydroksylaza para-hydro-
ksyfenylopirogronianu
Alkaptonuria
tyrozyna
oksydaza (1,2-
dioksygenaza)
homogentyzynianowa
mocz ciemnieje na powietrzu
(przez homogentyzynian),
zapalenie stawów, pigmentacja
tkanki łącznej
11

Okresowa
hiperlizynemia z
hiperamonemią
lizyna
syntaza semialdehydu
aminoadypinowego (I
reakcja)
Trwała hiperlizynemia
bez hiperamonemii
lizyna
syntaza semialdehydu
aminoadypinowego (II
reakcja)
nadmiar sacharopiny we krwi
Choroba Hartnupa
tryptofan
wchłanianie tryptofanu
niedobór niacyny, pelagra -
zapalenie skóry, objawy
neurologiczne
Homocystynuria typu I metionina
β-syntaza cystationinowa
Homocystynuria typu
II
metionina
reduktaza N
5
,N
10
-
metylenotetrahydrofoliano
wa
Homocystynuria typu
III
metionina
synteza metylokobalaminy
Homocystynuria typu
IV
metionina
wchłanianie kobalaminy
Hipermetioninemia
metionina
adenozylotransferaza
metioninowa (w wątrobie)
Cystationuria
metionina
γ-liaza cystationinowa
(cystationaza)
Ketonuria łańcuchów
rozgałęzionych – może
być zwykła lub
nawracająca
(łagodniejsza)
leucyna,
izoleucyna,
walina
dekarboksylaza α-
ketokwasów
mocz o zapachu syropu
klonowego, dużo Leu, Ile, Val,
α-ketokwasów i α-
hydroksykwasów w osoczu i
moczu
acydemia
izowalerianowa
leucyna
dehydrogenaza
izowalerylo-CoA
wymioty, kwasica i śpiączka
po spożyciu nadmiaru białka
acyduria
metylomalonylowa
izoleucyna,
walina,
metionina
mutaza metylomalonylo-
CoA przez niedobór
witaminy B
12
kwas metylomalonowy w
moczu
acydemia
propionianowa
izoleucyna,
walina,
metionina
karboksylaza propionylo-
CoA
podwyższony poziom
propionylo-CoA we krwi
PRZEMIANA AMINOKWASÓW W INNE PRODUKTY O FUNKCJACH
BIOLOGICZNYCH:
1. Katecholaminy.
fenyloalanina + tetrahydrobiopteryna + O
2
-> tyrozyna + dihydrobipteryna + H
2
O
tyrozyna + tetrahydrobiopteryna -> DOPA + dihydrobiopteryna
enzym: 3-monooksygenaza tyrozynowa
12

DOPA -> dopamina + CO
2
enzym: dekarboksylaza DOPA
koenzym: fosforan pirydoksalu (witamina B
6
)
dopamina + O
2
-> noradrenalina
enzym: β-oksydaza dopaminowa
koenzym: witamina C, Cu
2+
noradrenalina + S-adenozylometionina -> adrenalina + S-adenozylohomocysteina
enzym: N-metylotransferaza fenyloetanoloaminowa
- katabolizm:
adrenalina -> metanefryna
enzym: O-metylotransferaza katecholowa (COMT)
metanefryna -> kwas 3-metoksy-4-hydroksymigdałowy
enzym: oksydaza monoaminowa (MAO)
noradrenalina -> normetanefryna
enzym: COMT
normetanefryna -> kwas 3-metoksy-4-hydroksymigdałowy
enzym: MAO
lub
adrenalina/noradrenalina -> kwas dihydroksymigdałowy
enzym: MAO
kwas migdałowy -> kwas 3-metoksy-4-hydroksymigdałowy
enzym: COMT
dopamina -> -> kwas homowanilinowy
enzymy: COMT, MAO
- podczas występowania guza chromochłonnego w rdzeniu nadnerczy wydalane są metanefryna i
kwas 3-metoksy-4-hydroksymigdałowy
2. Serotonina.
tryptofan + H
2
O -> 5-hydroksytryptofan
enzym: hydroksylaza tyrozynowa (w wątrobie)
5-hydroksytryptofan -> 5-hydroksytryptamina (serotonina) + CO
2
- serotonina powoduje skurcz mięśni gładkich i zwężenie naczyń
- serotonina jest metabolizowana przez oksydazę monoaminową (MAO) do 3-octanu 5-
metoksyindolu, który jest wydalany w postaci sprzężonej
- iproniazyd hamuje MAO, przez co wydłuża działanie serotoniny – efektem jest pobudzenie
psychiczne
13

- serotonina może też być przekształcana w melatoninę:
serotonina + acetylo-CoA -> N-acetyloserotonina + CoA-SH
N-acetyloserotonina + CH
3
-> N-acetylometoksyserotonina (melatonina)
- w rakowiaku złośliwym 60% tryptofanu jest przekształcane do serotoniny
3. Spermina i spermidyna.
arginina + H
2
O -> mocznik + ornityna
enzym: arginaza
ornityna -> putrescyna + CO
2
enzym: dekarboksylaza ornitynowa
putrescyna + dekarboksylowana S-adenozylometionina -> spermidyna + metylotioadenozyna
enzym: syntaza spermidynowa
spermidyna + dekarboksylowana S-adenozylometionina -> spermina + metylotioadenozyna
enzym: syntaza sperminowa
- spermidyna składa się z putrescyny i 1,3-diaminopropanu, pochodzącego z metioniny
- spermina składa się z 1 cząsteczki putrescyny i 2 cząsteczek 1,3-diaminopropanu
- chronią DNA plemników przed kwaśnym środowiskiem pochwy
- katabolizm:
spermina -> spermidyna -> putrescyna
enzym: oksydaza poliaminowa
putrescyna -> NH
4
+
+ CO
2
4. Melaniny.
tyrozyna + tetrahydrobiopteryna -> DOPA + dihydrobiopteryna
enzym: 3-monooksygenaza tyrozynowa
DOPA -> dopachinon
enzym: oksydaza katecholowa
Dopachinon przekształca się w eu- i feomelaniny.
- synteza melanin zachodzi w melanocytach
- defekt powoduje albinizm – tyrozynazo-dodatni przechodzi łagodniej niż tyrozynazo-ujemny
5. Kreatyna.
arginina + glicyna -> glikocyjamina (guanidynooctan) + ornityna
enzym: transamidynaza arginino-glicynowa (w nerkach)
14

glikocyjamina + S-adenozylometionina -> kreatyna + S-adenozylohomocysteina
enzym: metylotransferaza guanidynooctanowa (w wątrobie)
- katabolizm:
kreatyna + ATP -> fosforan kreatyny + ADP
enzym: kinaza kreatynowa (w wątrobie)
fosforan kreatyny -> kreatynina + Pi + H
2
O
Ostatnia reakcja zachodzi w mięśniach.
6. γ-aminomaślan (GABA).
α-aminokwas + α-ketoglutaran -> α-ketokwas + glutaminian
enzym: aminotransferaza
koenzym: fosforan pirydoksalu
glutaminian -> γ-aminomaślan + CO2
enzym: dekarboksylaza glutaminianowa
koenzym: fosforan pirydoksalu
GABA jest katabolizowany do semialdehydu bursztynowego, który dalej może przekształcać się w
bursztynian lub w γ-hydroksymaślan.
15

ZWIĄZKI AZOTOWE
PURYNY
Synteza puryn:
rybozo-5-fosforan + ATP -> pirofosforan fosforybozylu (PRPP) + AMP
enzym: syntaza PRPP
kofaktor: Mg
2+
PRPP -> monofosforan inozyny (IMP)
Tutaj jest milion tysięcy etapów przejściowych, więc przejdźmy do meritum:
Skąd pochodzą poszczególne atomy pierścienia purynowego?
In order of appearance:
- N9 – z glutaminy
- C4, C5 i N7 – z glicyny
- C8 - z N
5
,N
10
-metenylotetrahydrofolianu
- N3 – z glutaminy
- C6 – z CO2
- N1 – z asparaginianu
- C2 – z N
10
-formylotetrahydrofolianu
Jak IMP przekształca się w adeninę lub guaninę?
Szlak do adeniny:
IMP + asparaginian -> adenylobursztynian (AMPS) + H
2
O
enzym: syntaza adenylobursztynianowa
kofaktory: GTP, Mg
2+
adenylobursztynian -> monofosforan adenozyny (AMP) + fumaran
enzym: liaza adenylobursztynianowa
Szlak do guaniny:
IMP + NAD
+
+ H
2
O -> monofosforan ksantozyny (XMP) + NADH + H
+
enzym: dehydrogenaza IMP
monofosforan ksantozyny + glutamina -> monofosforan guanozyny (GMP) + glutaminian
enzym: transamidynaza
kofaktor: ATP
Jakie są sposoby regulacji syntezy puryn?
16

- zahamowanie syntezy tetrahydrofolianu -> brak 2 atomów C -> brak syntezy puryn
W ten sposób działają takie leki jak azaseryna i 6-merkaptopuryna.
- syntaza PRPP jest hamowana zwrotnie przez PRPP i rybonukleotydy purynowe
- AMP hamuje zwrotnie syntazę adenylobursztynianową
- GMP hamuje zwrotnie dehydrogenazę IMP
- do syntezy ATP potrzeba GTP i odwrotnie – po to, żeby była między nimi równowaga
Reakcje typu Salvage:
A. puryna + PRPP -> 5’-mononukleotyd puryny + PPi
np.: adenina + PRPP -> AMP + PPi
enzym: fosforybozylotransferaza adeninowa
guanina + PRPP -> GMP + PPi
hipoksantyna + PRPP -> IMP + PPi
enzym: fosforybozylotransferaza hipoksantynowo-guaninowa
B. nukleozyd purynowy + ATP -> nukleotyd purynowy + ADP
np.: adenozyna + ATP -> AMP + ADP
enzym: kinaza adenozynowa
Jak powstają deoksyrybonukleotydy?
difosforan rybonukleozydu + zredukowana tioredoksyna -> difosforan 2’-rybonukleozydu +
utleniona tioredoksyna
enzym: reduktaza rybonukleotydowa
np.: ADP + zredukowana tioredoksyna -> dADP + utleniona tioredoksyna
Regeneracja tioredoksyny:
utleniona tioredoksyna + NADPH + H
+
-> zredukowana tioredoksyna + NADP
+
Katabolizm puryn:
1. adenozyna + H
2
O -> inozyna + NH
4
+
enzym: deaminaza adenozynowa
2. inozyna + Pi -> hipoksantyna + rybozo-1-fosforan
lub
guanozyna + Pi -> guanina + rybozo-1-fosforan
17

3. hipoksantyna + H
2
O + O
2
-> ksantyna + H
2
O
2
lub
guanina -> ksantyna + NH
3
4. ksantyna + H
2
O + O
2
-> kwas moczowy + H
2
O
2
enzym: oksydaza ksantynowa
PIRYMIDYNY
Synteza pirymidyn:
1. CO
2
+ glutamina + ATP -> karbamoilofosforan + glutaminian + ADP
enzym: syntaza karbamoilofosforanowa II (cytoplazmatyczna)
2. karbamoilofosforan + asparaginian -> kwas karbamoiloasparaginowy (CAA) + Pi
enzym: karbamoilotransferaza asparaginianowa
3. kwas karbamoiloasparaginowy -> kwas dihydroorotowy + H
2
O
enzym: dihydroorotaza
4. kwas dihydroorotowy + NAD
+
-> kwas orotowy + NADH + H
+
enzym: dehydrogenaza dihydroorotanowa
5. kwas orotowy + PRPP -> orotydyno-5’-monofosforan (OMP/orotodylan) + PPi
enzym: fosforybozylotransferaza orotanowa
6. OMP -> urydylan (UMP) + CO
2
enzym: dekarboksylaza orotydyno-5’-fosofranowa (dekarboksylaza orotydylanowa)
7. UMP + ATP -> UDP + ADP
UDP może się przekształcać do CTP (5’-trójfosforan cytydyny) lub TMP (5’-trójfosforan
tymidyny).
Szlak do cytozyny:
UDP + ATP -> UTP + ADP
UTP + ATP + glutamina -> CTP + ADP + Pi
enzym: syntaza CTP
Szlak do tyminy:
UDP + NADPH + H+ -> dUDP + NADP+
enzym: reduktaza rybonukleotydowa
18

dUDP + H2O -> dUMP + Pi
dUMP + N
5
,N
10
-metylenotetrahydrofolian -> TMP + dihydrofolian
enzym: syntaza tymidylanowa
Regulacja syntezy pirymidyn:
- metotreksat – hamuje redukcję dihydrofolianu – nie ma tetrahydrofolianu – nie może
powstawać TMP
- analogi zasad: allopurinol i 5-fluorouracyl – blokują fosforybozylotransferazę orotanową
- UTP i puryny hamują syntetazę karbamoilofosforanową II
- PRPP aktywuje syntetazę karbamoilofosforanową II
- karbamoilotransferaza asparaginianowa jest hamowana przez CTP, a aktywowana przez ATP
Reakcje typu salvage:
nukleozyd + ATP -> nukleotyd + ADP:
urydyna + ATP -> UMP + ADP
cytydyna + ATP -> CMP + ADP
enzym: kinaza urydynowo-cytydynowa
tymidyna + ATP -> dTMP + ADP
enzym: kinaza tymidynowa
deoksycytydyna + ATP -> dCMP + ADP
enzym: kinaza deoksycytydynowa
orotan + ATP -> OMP + ADP
enzym: rybozylotransferaza orotanowa
Katabolizm pirymidyn:
Szlak cytozyny i uracylu:
2 cytozyna + O
2
-> 2 uracyl + 2 NH
3
uracyl + NADPH + H+ -> dihydrouracyl
dihydrouracyl + H
2
O -> N-karbamoilo-
β
-alanina (inaczej
β
-ureidopropionian)
N-karbamoilo-
β
-alanina ->
β
-alanina + CO
2
+ NH
3
19

Szlak tyminy:
tymina + NADPH+ H
+
-> dihydrotymina + NADP
+
dihydrotymina + H
2
O -> N-karbamoilo-
β
-aminoizomaślan (
β
-ureidoizomaślan)
N-karbamoilo-
β
-aminoizomaślan ->
β
-aminoizomaślan + CO
2
+ NH
3
* Orotoacyduria – nadmiar kwasu orotowego w cytoplazmie spowodowany niezdolnością
mitochondriów do rozkładania karbamoilofosforanu (towarzyszy zespołowi Reye’a):
- typ I – niedobór fosforybozylotransferazy orotanowej i dekarboksylazy orotydylanowej
- typII – niedobór dekarboksylazy orotydylanowej
BILANS AZOTOWY I CYKL MOCZNIKOWY
Degradacja białek:
- proteazy – hydrolizują wewnętrzne wiązanie peptydowe
- endopeptydazy – rozkładają peptydy powstałe w wyniku działania proteaz do aminokwasów
-sekwencja PEST – region bogaty w prolinę, glutaminian, serynę i treoninę – białko, które go
posiada jest szybciej degradowane
- peptydy z krążenia tracą kwas sjalowy i wtedy są internalizowane do hepatocytów przez receptory
asjaloglikoproteinowe i degradowane przez katepsyny w lizosomach
Katepsyny są proteazami.
- szlak ATP-niezależny – białka pozakomórkowe, błonowe i wewnątrzkomórkowe długożyjące – w
lizosomach
-szlak ATP-zależny – białka wewnątrzkomórkowe krótkożyjące i białka nieprawidłowe – wymaga
ubikwityny, która przyłącza się do grupy
ε
-aminowej lizyny białka i powoduje skierowanie go do
proteasomu.
Reakcja z ubikwityną jest łatwiejsza, gdy na N-końcu znajdują się asparaginian lub arginina, a
trudniejsza, gdy znajdują się tam metionina lub seryna.
T
1/2
białek: 0,5-150 h
- enzymy metabolizmu podstawowego >100 h
- enzymy regulatorowe 0,5-2 h
20

Wydalanie azotu – biosynteza mocznika:
Zwierzęta dzielą się na ammonoteliczne (wydalają amoniak), urykoteliczne (wydalają kwas
moczowy) i ureoteliczne (wydalają mocznik).
My wytwarzamy mocznik w 4 etapach:
1. Transaminacja.
α
-aminokwas +
α
-ketoglutaran <->
α
-ketokwas + L-glutaminian
- nie podlegają jej lizyna, treonina, prolina i hydroksyprolina
- enzymem jest aminotransferaza glutaminianowa, jej koenzymem – fosforan pirydoksalu
(witamina B
6
)
- szkielet węglowy aminokwasu (
α
-ketokwas) jest dalej katabolizowany
-
δ
-aminowa grupa ornityny także ulega transaminacji
- grupa aminowa może być przenoszona także na pirogronian – powstaje wtedy alanina, która i tak
przekształca się w wyniku transaminacji w glutaminian
2. Deaminacja oksydacyjna glutaminianu.
glutaminian + NAD
+
<->
α
-ketoglutaran + NADH + H
+
+ NH
3
- enzymem jest dehydrogenaza L-glutaminianowa (GDH), której inhibitorami są ATP, GTP, NADH,
a aktywatorem jest ADP
- dehydrogenaza L-glutaminianowa może także wykorzystywać NADP
- istnieje też możliwość uzyskania NH
3
poprzez działanie oksydaz aminokwasowych:
α
-aminokwas + flawina <->
α
-iminokwas + flawina-H
2
(zredukowana)
enzym: oksydaza aminokwasowa
α
-iminokwas + H
2
O ->
α
-ketokwas + NH
4
+
Regeneracja flawiny:
flawina-H
2
+ O
2
-> flawina + H
2
O
2
2 H
2
O
2
-> 2 H
2
O + O
2
enzym: katalaza
- amoniak jest toksyczny, ponieważ reaguje z
α
-ketoglutaranem, tworząc glutaminian (odwraca
równowagę reakcji deaminacji) – niedobór
α
-ketoglutaranu hamuje cykl kwasu trikarboksylowego
(TCA) w neuronach
3. Magazynowanie, transport i uwalnianie amoniaku.
21

- amoniak jest magazynowany i transportowany jako azot amidowy glutaminy – reakcja zachodzi w
nerkach
L-glutaminian + NH
3
+ ATP -> L-glutamina + H
2
O + ADP + Pi
enzym: syntetaza glutaminowa
-uwalnianie amoniaku w wątrobie:
L-glutamina + H
2
O -> glutaminian + NH
4
+
enzym: glutaminaza
- od równowagi pomiędzy działaniem syntetazy glutaminowej i glutaminazy zależy równowaga
kwasowo-zasadowa – nadmiar amoniaku powoduje zasadowicę metaboliczną, niedobór – kwasicę
metaboliczną
4. Cykl mocznikowy.
I. CO
2
+ NH
4
+
+ ATP -> karbamoilofosforan + ADP + Pi
enzym: syntetaza kabamoilofosforanowa I (mitochondrialna)
aktywator: N-acetyloglutaminian
II. karbamoilofosforan + ornityna -> cytrulina + Pi
enzym: transkarbamoilaza ornitynowa
III. cytrulina + asparaginian + ATP -> argininobursztynian + AMP + PPi
enzym: syntetaza argininobursztynianowa
IV. argininobursztynian -> arginina + fumaran
enzym: argininobursztynaza (liaza argininobursztynianowa)
- fumaran przechodzi w szczawiooctan, a szczawiooctan w asparaginian
V. arginina + H
2
O -> mocznik + ornityna
enzym: arginaza
- reakcje I i II zachodzą w mitochondrium, reszta w cytoplazmie – CO
2
, NH
4
+
i ornityna są
transportowane do matrix, a cytrulina do cytozolu przez przenośniki w błonie mitochondrialnej
- wydajność cyklu mocznikowego zależy od podaży N-acetyloglutaminianu, który powstaje z
acetylo-CoA i glutaminianu w reakcji katalizowanej przez syntazę N-acetyloglutaminianową
- w trakcie głodowania synteza mocznika jest większa, bo w wyniku rozkładu białek powstaje
więcej amoniaku
Zaburzenia cyklu mocznikowego:
Choroba
Enzym
Hiperamonemia typu I
Syntetaza karbamoilofosforanowa I
22
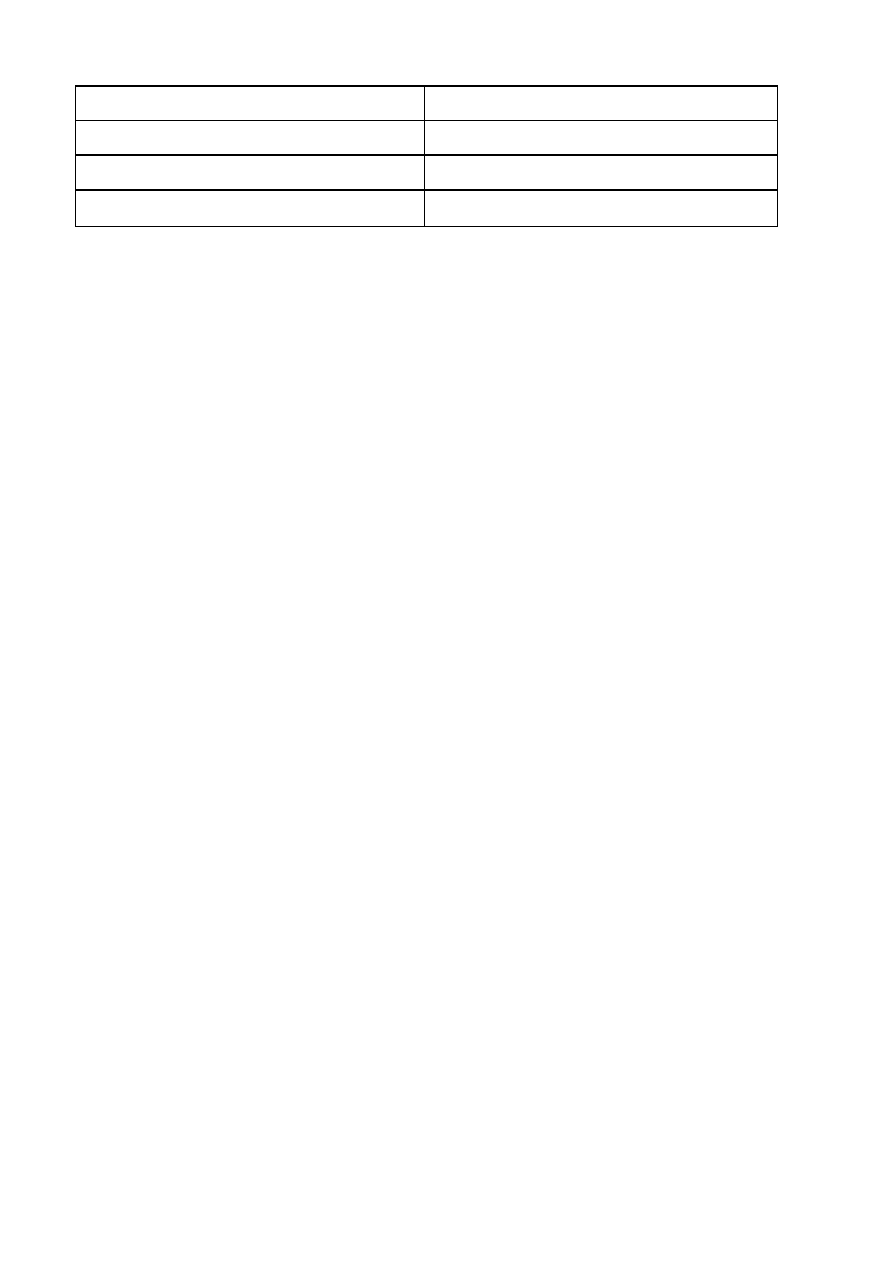
Hiperamonemia typu II
Transkarbamoilaza ornitynowa
Cytrulinemia
Syntetaza argininobursztynianowa
Acyduria argininobursztynianowa
Argininobursztynaza
Hiperargininemia
Arginaza
Kreatynina – inny sposób na wydalanie azotu:
1. arginina + glicyna -> glikocyjamina (guanidynooctan) + ornityna
enzym: transamidynaza arginino-glicynowa
2. glikocyjamina + S-adenozylometionina -> kreatyna + S-adenozylohomocysteina
enzym: metylotransferaza guanidynooctanowa
3. kreatyna + ATP -> fosforan kreatyny + ADP
enzym: kinaza kreatynowa
4. fosforan kreatyny -> kreatynina + Pi + H
2
O
- reakcja 1. zachodzi w nerkach, 2.i 3.- w wątrobie, 4. – w mięśniach
23

WĘGLOWODANY
GLIKOLIZA
- zachodzi w cytozolu
- zaczyna się od tego, że glukoza jest transportowana do komórki przez transportery:
* SGLT 1 – w jelicie cienkim i nerkach – symport glukozy i Na
+
* GLUT 1 – w mózgu i erytrocytach
* GLUT 2 – w wątrobie, trzustce, jelicie cienkim
* GLUT 3 – w mózgu
* GLUT 4 – w tkance tłuszczowej
* GLUT 5 – w jelicie cienkim
1. glukoza + ATP -> glukozo-6-fosforan + ADP
enzym: heksokinaza/glukokinaza
Glukokinaza występuje tylko w hepatocytach i ma mniejsze powinowactwo do glukozy – działa
tylko po posiłku, gdy stężenie glukozy we krwi jest wysokie.
Glukozo-6-fosforan może także powstawać z glikogenu i przekształcać się w niego:
glikogen <-> glukozo-1-fosforan <-> glukozo-6-fosforan
2. glukozo-6-fosforan <-> fruktozo-6-fosforan
enzym: izomeraza fosfoheksozowa
3. fruktozo-6-fosforan + ATP -> fruktozo-1,6-bisfosforan + ADP
enzym: fosfofruktokinaza
kofaktor: Mg
2+
inhibitory: ATP, cytrynian
aktywatory: AMP, fruktozo-6-fosforan, fruktozo-2,6-bisfosforan
4. fruktozo-1,6-bisfosforan <-> fosfodihydroksyaceton (dhiydroksyacetonofosforan) <->
gliceraldehydo-3-fosforan (aldehyd 3-fosfoglicerynowy)
lub: fruktozo-1,6-bisfosforan <-> gliceraldehydo-3-fosforan
enzymy: aldolaza, izomeraza fosfotriozowa
Z 1 cząsteczki heksozofosforanu powstają 2 cząsteczki triozofosforanu.
5. gliceraldehydo-3-fosforan + NAD
+
+ Pi <-> 1,3-bisfosfoglicerynian + NADH + H
+
enzym: dehydrogezaza gliceraldehydo-3-fosforanowa
inhibitor: jodooctan
Aktywność dehydrogenazy gliceraldehydo-3-fosforanowej zależy od podaży NAD
+
.
6. 1,3-bisfosfoglicerynian + ADP <-> 3-fosfoglicerynian + ATP
enzym: kinaza glicerynianowa
24

kofaktor: Mg
2+
Tu powstaje ATP !!!!!!!
Arsenian wciska się w reakcji 5. zamiast Pi i powstaje 1-arseno-3-fosfoglicerynian, który w reakcji
6. przekształca się do 3-fosofglicerynianu bez powstania ATP (bo i skąd wziąć fosforan do tego?).
7. 3-fosfoglicerynian <-> 2-fosfoglicerynian
enzym: mutaza fosfoglicerynianowa
8. 2-fosfoglicerynian <-> fosfoenolopirogronian + H
2
O
enzym: enolaza
kofaktor: Mg
2+
/Mn
2+
inhibitor: fluorki
9. fosfoenolopirogronian + ADP -> pirogronian + ATP
enzym: kinaza pirogronianowa
kofaktor: Mg
2+
inhibitor: glukagon (przez cAMP), alanina
aktywator: fruktozo-1,6-bisfosforan
Tu też powstaje ATP !!!!!!
Pirogronian samorzutnie przechodzi z formy enolowej w ketonową.
Teraz mamy 3 możliwe szlaki przemian:
A. Powstanie mleczanu.
pirogronian + NADH + H
+
<-> mleczan + NAD
+
enzym: dehydrogenaza mleczanowa
-zachodzi w warunkach niedotlenienia tkanki (np. mięśnie szkieletowe w trakcie wysiłku) lub przy
braku mitochondriów (np. erytrocyty).
- celem jest odzyskanie NAD
+
zredukowanego w procesie glikolizy
- mleczan jest pobierany przez wątrobę, korę nerek i serce i tam utleniany do pirogronianu
B. Utlenianie pirogronianu.
* TDP = difosfotiamina
pirogronian + H
+
+ TDP -> TDP-hydroksyetyl + CO
2
enzym: dehydrogenaza pirogronianowa
kofaktor: tiamina
inhibitory: ATP, NADH, acetylo-CoA -> wszystkie przez układ kinazy – bo dehydrogenaza
pirogronianowa jest nieaktywna w formie ufosforylowanej
aktywator: insulina (w tkance tłuszczowej – tam potrzeba dużo acetylo-CoA do lipogenezy – a dupa
rośnie)
25

TDP-hydroksyetyl + utleniony liponoamid -> acetyloliponoamid + TDP
enzym: acetylotransferaza dihydroliponoamidowa
inhibitory: arsenian(III), jony rtęci – reagują z grupami -SH kwasu liponowego
acetyloliponoamid + CoA-SH -> acetylo-CoA + dihydroliponoamid
enzym: acetylotransferaza dihydroliponoamidowa
dihydroliponoamid + FAD -> utleniony liponoamid + FADH
2
enzym: dehydrogenaza dihydroliponoamidowa
FADH
2
+ NAD
+
-> FAD + NADH + H
+
i mamy zregenerowany NADH
C. Powstanie szczawiooctanu.
pirogronian + CO
2
+ ATP -> szczawiooctan + ADP + Pi
enzym: karboksylaza pirogronianowa
kofaktor: Mg
2+
, biotyna
aktywator: acetylo-CoA
Podsumowanie:
- zysk – w wersji z utlenianiem pirogronianu – 38 mol ATP z 1 mol glukozy; w wersji z powstaniem
mleczanu – 2 mol ATP na 1 mol glukozy
- jeżeli jemy dużo i produkujemy więcej pirogronianu niż potrzeba nam szczawiooctanu do
produkcji energii przez napędzanie cyklu Krebsa i łańcucha oddechowego, to pirogronian
przekształca się w acetylo-CoA, który idzie do szlaku lipogenezy
- fruktoza wchodzi do szlaku jako fruktozo-1-fosforan i omija punkty kontrolne – dlatego spożycie
dużej ilości fruktozy powoduje, że wytwarzamy więcej pirogronianu niż potrzebujemy do produkcji
energii – i dupa rośnie
- w erytrocytach są enzymy – mutaza bisfosfoglicerynianowa i fosfataza-2,3-
bisfosfoglicerynianowa – dzięki którym 1,3-bisfosfoglicerynian może przejść w 3-fosfoglicerynian
przez 2,3-bisfosfoglicerynian – a to nie powoduje wytwarzania ATP, ale za to dostarcza 2,3-BPG,
który zmniejsza powinowactwo hemoglobiny do tlenu i powoduje oddawanie go tkankom
- niedobór tiaminy/ zatrucie arsenianem (III) lub rtęcią -> nagromadzenie się pirogronianu ->
kwasica mleczanowa
CYKL KWASU CYTRYNOWEGO (cykl Krebsa/cykl kwasów trikarboksylowych/TCA)
- zachodzi w macierzy mitochondrialnej
- poszczególne procesy mogą mieć miejsce w komórkach różnych tkanek, ale cały cykl od początku
do końca zachodzi głównie w hepatocytach
1. szczawiooctan + acetylo-CoA + H
2
O -> cytrynian + CoA-SH
26

enzym: syntaza cytrynianowa
Wiązanie powstaje między węglem z grupy C=O szczawiooctanu a węglem z grupy CH
3
acetylo-
CoA.
2. cytrynian -> cis-akonitan -> izocytrynian
enzym: akonitaza (hydrataza akonitanowa)
inhibitor: fluorocytrynian (powstaje z fluorooctanu) – dlatego fluor jest toksyczny
3. izocytrynian -> szczawiobursztynian -> α-ketoglutaran + CO
2
enzym: dehydrogenaza izocytrynianowa
kofaktor: Mg
2+
/Mn
2+
Jednocześnie zachodzi redukcja – zależnie od izoenzymu dehydrogenazy:
•
NAD
+
-> NADH + H
+
- tylko w mitochondriach
•
NADP
+
-> NADPH + H
+
- w cytozolu i mitochondriach
4.
α
-ketoglutaran + CoA-SH -> bursztynylo-CoA (sukcynylo-CoA) + CO
2
enzym: dehydrogenaza
α
-ketoglutaranowa
kofaktory: difosfotiamina, liponian, NAD
+
, FAD
+
, CoA
inhibitor: arsenian (III)
- reakcja jednokierunkowa (wszystkie poza tą i 1. są dwukierunkowe)
- jednocześnie zachodzi redukcja NAD
+
NAD
+
-> NADH + H
+
- atomy węgla odpadające jako CO
2
w etapach 3. i 4. pochodzą ze szczawiooctanu – nigdy z
acetylo-CoA !
5. bursztynylo-CoA -> bursztynian + CoA-SH
enzym: tiokinaza bursztynianowa (syntetaza sukcynylo-CoA)
kofaktor: Mg
2+
- jednocześnie zachodzi reakcja:
ADP + Pi -> ATP
lub
GTP + Pi -> GTP
JEDYNA FOSFORYLACJA W CYKLU KREBSA!!!
- w wątrobie i nerkach może powstawać i ATP i GTP (GTP jest zużywane do glukoneogenezy)
- w pozostałych tkankach powstaje tylko ATP
***W tkankach pozawątrobowych w metabolizmie ciał ketonowych zachodzi taka reakcja:
bursztynylo-CoA + acetooctan -> bursztynian + acetoacetylo-CoA
enzymem jest transferaza CoA sukcynylo-CoA:acetooctan
6. bursztynian -> fumaran
enzym: dehydrogenaza bursztynianowa
inhibitor: malonian
- na tym etapie zachodzi również redukcja FAD:
FAD -> FADH
2
- dehydrogenaza bursztynianowa zawiera FAD i białko żelazowo-siarkowe
- dehydrogenaza bursztynianowa redukuje ubichinon w łańcuchu przenoszącym elektrony
27

7. fumaran + H
2
O -> L- jabłczan
enzym: fumaraza (hydrataza fumaranowa)
8. jabłczan -> szczawiooctan
enzym: dehydrogenaza jabłczanowa
- na tym etapie zachodzi też redukcja NAD
+
:
NAD
+
-> NADH + H
+
Podsumowanie:
- zysk: 3 NADH + 1 FADH
2
+ 1 ATP,
ale NADH i FADH idą do łańcucha oddechowego, gdzie powodują powstawanie ATP (1 NADH ->
3 ATP; 1 FADH
2
-> 2 ATP)
w związku z tym zysk energetyczny z cyklu Krebsa to tak naprawdę 12 cząsteczek ATP na każdą
cząsteczkę acetylo-CoA wchodzącą w cykl
- kofaktory:
CoA – zawiera kwas pantotenowy
FAD – zawiera ryboflawinę (witamina B
2
)
NAD – zawiera niacynę (witamina B
3
)
Tiamina (witamina B
1
) – jest kofaktorem dehydrogenazy
α
-ketoglutaranowej
- wszystkie związki cyklu Krebsa poza acetylo-CoA są glukogenne, bo powstaje z nich
szczawiooctan, a z niego w procesie glukoneogenezy powstaje glukoza
- acetylo-CoA nie jest glukogenne – 2 węgle wchodzą do cyklu i 2 wychodzą (jako CO
2
)
- szczawiooctan może powstawać z pirogronianu
- aminokwasy wchodzą do cyklu przez reakcje:
* asparaginian <-> szczawiooctan
* glutaminian <->
α
-ketoglutaran
* alanina <-> pirogronian
W wyniku odwrotnych reakcji metabolity cyklu Krebsa mogą być źródłem szkieletów węglowych
aminokwasów.
Hydroksyprolina, seryna, cysteina, treonina i glicyna także mogą przekształcać się do pirogronianu,
ale działa to tylko w jedną stronę (pirogronian nie może być dla nich źródłem szkieletu
węglowego).
Podobnie arginina, prolina, glutamina i histydyna przekształcają się w
α
-ketoglutaran; izoleucyna,
metionina i walina w bursztynylo-CoA; tyrozyna i fenyloalanina w fumaran – „one way ticket”.
- regulacja cyklu kwasu cytrynowego – kontrola oddechowa – działanie cyklu zależy od podaży
NAD
+
, powstającego w łańcuchu oddechowym i ADP, powstającego w wyniku zużywania energii
- regulacja enzymów cyklu kwasu cytrynowego – dehydrogenaza pirogronianowa, syntaza
cytrynianowa, dehydrogenaza izocytrynianowa, dehydrogenaza
α
-ketoglutaranowa – aktywowane
28

są przez Ca
2+
, których jest więcej w czasie skurczu mięśnia, hamowanie przez ATP/NADH/produkt
– w zależności od enzymu
GLIKOGENOGENEZA
- zachodzi w mięśniach i w wątrobie
1. glukoza + ATP -> glukozo-6-fosforan + ADP
enzym: heksokinaza(w mięśniach)/glukokinaza(w wątrobie)
2. glukozo-6-fosforan <-> glukozo-1-fosforan
enzym: fosfoglukomutaza
kofaktor: Mg2+
3. glukozo-1-fosforan + UTP -> UDPGlc (urydynodifosfoglukoza) + PPi
enzym: pirofosfataza UDPGlc
PPi -> 2 Pi – usuwamy produkt reakcji i dzięki temu zachodzi szybciej !
enzym: pirofosfataza
4. UDPGlc jest dołączane do glikogenu wiązaniem
α
-1-4 i łańcuch jest wydłużany (UDP jest
uwalniany).
enzym: syntaza glikogenowa
inhibitor: cAMP
Na początku UDPGlc reaguje z glikogeniną i tworzy primer glikogenu, do którego są przyłączane
jednostki UDPGlc.
5. Rozgałęzianie łańcucha – enzym rozgałęziający ucina kilka (co najmniej 6) reszt glukozowych z
końca jednego łańcucha i dołącza je do drugiego wiązaniem
α
-1,6.
Gałęzie są dalej wydłużane przez tworzenie wiązań
α
-1,4.
6. Regeneracja UTP.
UDP + ATP -> UTP + ADP
GLIKOGENOLIZA
1. glikogen + Pi -> glukozo-1-fosforan + glikogen krótszy o 1 resztę glukozową
enzym: fosforylaza glikogenowa
aktywator: cAMP
Usuwanie rozgałęzień – gdy jedno z rozgałęzień jest już skrócone do długości 4 reszt, ostatnie 3 z
tych reszt są przenoszone przez transferazę glukanową na koniec drugiego łańcucha. Ostatnia
pozostała reszta (ta połączona z łańcuchem wiązaniem
α
-1,6) jest usuwana przez enzym
usuwający rozgałęzienia jako cząsteczka wolnej glukozy. Na łańcuch dalej działa fosforylaza
glikogenowa.
29
2. glukozo-1-fosforan <-> glukozo-6-fosforan
enzym: fosfoglukomutaza
kofaktor: Mg2+
3. glukozo-6-fosforan + H2O -> glukoza + Pi
enzym: glukozo-6-fosfataza
TYLKO W WĄTROBIE I NERKACH !!! W mięśniach powstaje glukozo-6-fosforan i on wchodzi
do glikolizy.
Podsumowanie:
- glikogen:
* ¾ w mięśniach – źródło glukozy dla mięśni
* ¼ w wątrobie – do utrzymywania stałego poziomu glukozy we krwi
- cAMP aktywuje glikogenolizę (przez fosforylazę glikogenową) i hamuje glikogenogenezę (przez
syntazę glikogenową) – jedno i drugie przez układ kinaz i fosfataz
- insulina hamuje powstawanie cAMP, więc stymuluje glikogenogenezę
- glukagon i adrenalina zwiększają powstawanie cAMP, więc aktywują glikogenolizę
- fosfataza-1-białek inaktywuje fosforylazę glikogenową – czyli hamuje glikogenolizę
Fosfataza -1-białek jest hamowana przez cAMP.
GLUKONEOGENEZA
1. pirogronian + CO
2
+ ATP -> szcawiooctan + ADP
enzym: karboksylaza pirogronianowa
kofaktor: Mg
2+
, biotyna
aktywator: acetylo-CoA
- rola biotyny – wiąże CO
2
i oddaje go pirogronianowi:
biotyna + CO
2
-> karboksybiotyna
karboksybiotyna + pirogronian -> biotyna + szczawiooctan
- karboksylacja pirogronianu zachodzi w mitochondrium, a reszta reakcji glukoneogenezy – w
cytozolu. Żeby przetransportować szczawiooctan do cytozolu, jest on redukowany do jabłczanu,
który przechodzi przez błonę mitochondrialną i jest z powrotem utleniany do szczawiooctanu (obu
reakcjom towarzyszy utlenienie/redukcja NAD).
2. szczawiooctan + GTP -> fosfoenolopirogronian + GDP + CO
2
enzym: karboksylaza fosfoenolopirogronianowa
30

- GTP powstaje w cyklu kwasu cytrynowego w reakcji rozpadu bursztynylo-CoA, katalizowanej
przez tiokinazę bursztynianową, ale tylko w wątrobie i nerkach – w reszcie powstaje ATP.
3. Reakcje od fosfoenolopirogronianu do fruktozo-1,6-bisfosforanu zachodzą w odwrotnym
kierunku do reakcji glikolizy – enzymy są te same.
4. fruktozo-1,6-bisfosforan + H
2
O -> fruktozo-6-fosforan + Pi
enzym: fruktozo-1,6-bisfosfataza
inhibitor: fruktozo-2,6-bisfosforan (cAMP hamuje jego powstawanie), AMP
- fruktozo-1,6-bisfosfataza występuje w wątrobie, nerkach i mięśniach szkieletowych
- tylko komórki posiadające fruktozo-1,6-bisfosfatazę mogą syntetyzować glukozę z pirogronianu,
fosofotrioz i aminokwasów glukogennych
5. Glukozo-6-fosforan może powstawać z fruktozo-6-fosforanu (enzym: izomeraza fosfoheksozowa
– ten sam, co w glikolizie) lub z glikogenu w wyniku glikogenolizy.
6. glukozo-6-fosforan + H
2
O -> glukoza + Pi
enzym: glukozo-6-fosfataza
- glukozo-6-fosfataza występuje tylko w wątrobie i w nerkach
Wejście aminokwasów glukogennych i innych związków do szlaku glukoneogenezy:
-tryptofan -> alanina
alanina <-> pirogronian
enzym: aminotransferaza
- hydroksyprolina / seryna / cysteina / treonina / glicyna -> pirogronian
- histydyna / prolina/ glutamina / arginina -> glutaminian
glutaminian <->
α
-ketoglutaran
enzym: aminotransferaza
α
-ketoglutaran -> szczawiooctan -> fosfoenolopirogronian
- metionina / walina -> bursztynylo-CoA
bursztynylo-CoA -> szczawiooctan -> fosfoenolopirogronian
- tyrozyna / fenyloalanina -> fumaran
fumaran -> szczawiooctan -> fosfoenolopirogronian
- asparaginian <-> szczawiooctan
31

enzym: aminotransferaza
szczawiooctan -> fosfoenolopirogronian
- izoleucyna -> propionian -> ... (patrz niżej)
- mleczan + NAD
+
-> pirogronian + NADH + H
+
enzym: dehydrogenaza mleczanowa
W wyniku przekształcenia mleczanu powstaje pirogronian w formie ketonowej.
- propionian:
propionian + CoA-SH + ATP -> propionylo-CoA + AMP + PPi
enzym: syntetaza acylo-CoA
kofaktor: Mg
2+
propionylo-CoA + CO
2
+ H
2
O + ATP -> metylomalonylo-CoA + ADP + Pi
enzym: karboksylaza propionylo-CoA
kofaktor: biotyna
metylomalonylo-CoA <-> bursztynylo-CoA
enzym: mutaza metylomalonylo-CoA
kofaktor: witamina B
12
bursztynylo-CoA -> szczawiooctan -> fosfoenolopirogronian
Niedobór witaminy B
12
powoduje acydurię metylomalonylową (wysikujemy kwas
metylomalonylowy).
- łańcuch boczny cholesterolu -> propionian -> ...
- kwasy tłuszczowe -> acetylo-CoA / propionian
acetylo-CoA + szczawiooctan -> cytrynian -> jabłczan -> szcawiooctan -> fosfoenolopirogronian
- glicerol + ATP -> glicerolo-3-fosforan + ADP
enzym: kinaza glicerolowa
glicerolo-3-fosforan + NAD
+
<-> fosfodihydroksyaceton + NADH + H
+
enzym: dehydrogenaza glicerolo-3-fosforanowa
fosfodihydroksyaceton <-> fruktozo-1,6-bisfosforan
Regulacja glukoneogenezy:
- glukagon i adrenalina aktywują glukoneogenezę:
•
glukagon/adrenalina aktywuje cyklazę adenylanową
32

•
cAMP aktywuje kinazę białek
•
kinaza białek aktywuje kinazę pirogronianową
- acetylo-CoA aktywuje karboksylazę pirogronianową allosterycznie
- fruktozo-2,6-bisfosforan aktywuje fosfofruktokinazę (pobudza glikolizę) i inaktywuje fruktozo-
2,6-bisfosfatazę – hamuje glukoneogenezę
SZLAK PENTOZOFOSFORANOWY
1. glukozo-6-fosforan + NADP
+
+ H
2
O -> 6-fosfoglukonian + NADPH + H
+
enzym: dehydrogenaza glukozo-6-fosforanowa
2. 6-fosfoglukonian + NADP
+
-> rybulozo-5-fosforan + NADPH + H
+
+ CO
2
enzym: dehydrogenaza 6-fosfoglukonianowa
Reakcje 1. i 2. są NIEODWRACALNE i służą do wytworzenia NADPH, potrzebnego do syntezy
kwasów tłuszczowych i cholesterolu.
3. rybulozo-5-fosforan <-> ksylulozo-5-fosforan
enzym: 3-epimeraza
lub
rybulozo-5-fosforan <-> rybozo-5-fosforan
enzym: ketoizomeraza
Rybozo-5-fosforan może być zużywany do syntezy nukleotydów.
4. ksylulozo-5-fosforan + rybozo-5-fosforan <-> gliceraldehydo-3-fosforan + sedoheptulozo-7-
fosforan
enzym: transketolaza
kofaktory: Mg
2+
, difosforan tiaminy (witamina B
1
)
Gliceraldehydo-3-fosforan posiada 3 atomy węgla, a sedoheptulozo-7-fosforan – 7 atomów węgla –
wcześniej były 2 związki po 5 węgli: 5+5=10=7+3, czyli hajs się zgadza.
5. gliceraldehydo-3-fosforan + sedoheptulozo-7-fosforan <-> fruktozo-6-fosforan + erytrozo-4-
fosforan
enzym: transaldolaza
Fruktozo-6-fosforan ma 6 atomów węgla, a erytrozo-4-fosforan – 4 atomy węgla: 6+4=10, więc
nadal jest wszystko ok.
6. erytrozo-4-fosforan + ksylulozo-5-fosforan <-> fruktozo-6-fosforan + gliceraldehydo-3-fosforan
enzym: transketolaza
Ksylulozo-5-fosforan pochodzi z etapu 3.
33

Fruktozo-6-fosforan i gliceraldehydo-3-fosforan są przekształcane do glukozo-6-fosforanu – reakcje
i enzymy identyczne jak w glukoneogenezie.
Podsumowanie:
- szlak pentozofosforanowy zachodzi w cytozolu praktycznie wszystkich komórek, ale reakcje 1. i
2. tylko w tkankach odpowiedzialnych za metabolizm tłuszczów i steroidów: wątrobie, korze
nadnerczy, tkance tłuszczowej, tarczycy, jądrach, gruczole sutkowym, erytrocytach – reszta
komórek wytwarza rybozę odwracając reakcje 4-6.
- reakcje 1. i 2. zachodzą po to, by wyprodukować NADPH do syntezy kwasów tłuszczowych i
steroidów
- reakcje 4., 5., 6. i przemiana fruktozo-6-fosforanu i gliceraldehydo-3-fosforanu do glukozo-6-
fosforanu są odwracalne – dzięki temu można zachować równowagę między nimi – w zależności,
czy potrzeba więcej rybozo-5-fosforanu do syntezy nukleotydów, czy glukozo-6-fosforanu do
innych szlaków, reakcje mogą biec w odpowiednim kierunku
- transketolaza przenosi jednostkę CH2OH-C=O (czyli jednostkę ketonową) z ketozy na aldozę, w
wyniku czego ketoza przekształca się w aldozę krótszą o 2 atomy węgla (z jednostki ketonowej), a
aldoza w ketozę dłuższą o te same 2 atomy węgla:
ketozaX + aldozaY -> aldozaX + ketozaY
np. ksylulozo-5-fosforan (ketoza C5) + rybozo-5-fosforan (aldoza C5) -> gliceraldehydo-3-fosforan
(aldoza C3) + sedoheptulozo-7-fosforan (ketoza C7)
- transaldolaza przenosi jednostkę CH2OH-C=O-CH-OH z ketozy na aldozę – ketoza zmienia się
w aldozę krótszą o 3 atomy węgla, a aldoza w ketozę dłuższą o te same 3 atomy węgla z jednostki
np. sedoheptulozo-7-fosforan (ketoza C7) + gliceraldehydo-3-fosforan (aldoza C3) -> erytrozo-4-
fosforan (aldoza C4) + fruktozo-6-fosforan (ketoza C6)
- aldozy: rybozo-5-fosforan, gliceraldehydo-3-fosforan, erytrozo-4-fosforan
- ketozy: rybulozo-5-fosforan, ksylulozo-5-fosforan, sedoheptulozo-7-fosforan, fruktozo-6-
fosforan, glukozo-6-fosforan
- brak dehydrogenazy glukozo-6-fosforanowej uniemożliwia wytwarzanie NADPH, przez co nie
można zredukować glutationu. Zredukowany glutation jest potrzebny do usuwania H
2
O
2
z
erytrocytów, więc jego brak powoduje anemię hemolityczną.
SZLAK KWASU URONOWEGO
1. glukozo-6-fosforan <-> glukozo-1-fosforan
enzym: fosfoglukomutaza
2. glukozo-1-fosforan + UTP -> UDP-glukoza + PPi
enzym: pirofosforylaza UDPGlc
34

3. UDP-glukoza + 2 NAD
+
+ H
2
O -> UDP-glukuronian + 2 NADH + 2 H
+
enzym: dehydrogenaza UDPGlc
UDP-glukuronian może być wykorzystywany do syntezy proteoglikanów lub być sprzęgany z
bilirubiną / hormonami steroidowymi / lekami i wydalany z żółcią lub moczem.
4. UDP-glukuronian + H
2
O -> glukuronian + UDP
5. D-glukuronian + NADPH + H
+
<-> L-gulonian + NADP
+
U niektórych zwierząt L-gulonian jest prekursorem kwasu askorbinowego. Nam, naczelnym i
świnkom morskim brakuje oksydazy L-gulonolaktonowej, więc kwas askorbinowy jest dla nas
witaminą.
6. L-gulonian + NAD
+
-> L-ksyluloza + NADH + H
+
+ CO
2
7. L-ksyluloza + NADPH + H
+
<-> ksylitol + NADP
+
Blok tej reakcji prowadzi do samoistnej pentozurii.
8. Ksylitol + NAD
+
<-> D-ksyluloza + NADH + H
+
enzym: reduktaza D-ksylulozowa
9. D-ksyluloza + ATP -> ksylulozo-5-fosforan + ADP
kofaktor: Mg
2+
Ksylulozo-5-fosforan jest metabolizowany w szlaku pentozofosforanowym.
D-ksyluloza może też być przekształcana w szczawian (szlak wiedzie poprzez glikolan) – czyli
jakby było coś nie tak to mamy ryzyko np. kamieni nerkowych.
FRUKTOZA
Szlaki wejścia do glikolizy:
A. fruktoza + ATP -> fruktozo-6-fosforan + ADP
enzym: heksokinaza
B. fruktoza + ATP -> fruktozo-1-fosforan + ADP
enzym: fruktokinaza
fruktozo-1-fosforan <-> fosfodihydroksyaceton + gliceraldehyd
enzym: aldolaza B
fosfodihydroksyaceton <-> gliceraldehydo-3-fosforan
enzym: izomeraza fosfotriozwa
gliceraldehyd + ATP -> gliceraldehydo-3-fosforan
35

enzym: triozokinaza
- fruktoza wchodzi do glikolizy omijając reakcję katalizowaną przez fosfofruktokinazę – etap
regulacyjny – dlatego nadmierne spożycie fruktozy powoduje zwiększoną syntezę kwasów
tłuszczowych i wydzielanie VLDL -> wzrost TAG w surowicy
- heksokinaza chętniej reaguje z glukozą, ale przy braku glukozy/nadmiarze fruktozy reaguje z
fruktozą
- blok fruktokinazy powoduje samoistną fruktozurię.
- fruktoza występuje w płynie nasiennym – powstaje w wyniku utleniania sorbitolu przez
dehydrogenazę sorbitolową
GALAKTOZA
1. laktoza -> glukoza + galaktoza
2. galaktoza + ATP -> galaktozo-1-fosforan + ADP
enzym: galaktokinaza
kofaktor: Mg
2+
3. galaktozo-1-fosforan + UDP-glukoza <-> glukozo-1-fosforan + UDP-galaktoza
enzym: urydylilotransferaza 1-fosfogalaktozowa
Blok urydylilotransferazy 1-fosfogalaktozowej powoduje galaktozemię.
4. UDP-galaktoza <-> UDP-glukoza
enzym: 4-epimeraza UDP-galaktozowa
kofaktor: NAD
+
UDP-glukoza jest wbudowywana do glikogenu.
Synteza laktozy:
UDP-glukoza <-> UDP-galaktoza
enzym: 4-epimeraza UDP-galaktozowa
UDP-galaktoza + glukoza -> laktoza
enzym: syntaza laktozowa
AMINOCUKRY
1. fruktozo-6-fosforan + glutamina -> glukozamino-6-fosforan + glutaminian
enzym: amidotransferaza
inhibitor: N-acetyloglukozoamino-6-fosforan
2.A. glukozamino-6-fosforan + acetylo-CoA -> N-acetyloglukozamino-6-fosforan
36

Z N-acetyloglukozamino-6-fosforanu powstają:
- N-acetyloglukozoamina
- 9-fosforan kwasu neuraminowego (do kwasu sialowego, gangliozydów i glikoprotein)
- UDP-N-acetyloglukozoamina (do glikozaminoglikanów i glikoprotein)
- UDP-N-acetylogalaktozoamina (do glikozaminoglikanów i glikoprotein)
B. glukozamino-6-fosforan <-> glukozamino-1-fosforan -> UDP-glukozoamina (do
glikozaminoglikanów)
37

LIPIDY
BIOSYNTEZA KWASÓW TŁUSZCZOWYCH
•
w cytozolu komórek wątroby, nerek, mózgu, płuc, tkanki tłuszczowej, gruczołu sutkowego
•
kofaktory: NADPH, ATP, Mn
2+
, biotyna, HCO
3
-
acetylo-CoA → palmitynian
e: syntaza kwasu tłuszczowego – 7 enzymów połączonych ze sobą; na jedynm końcu mają cysteinę,
na drugim 4-fosfopanteteinę (pochodną kwasu foliowego); u człowieka – dimer (2 podjednostki
łączą się ze sobą mostkami dwusiarczkowymi);
1. acetylo-CoA + CO2 → malonylo-CoA
e: karboksylaza acetylo-CoA
koenzym: biotyna
2. Acetylo-CoA jest przyłączane do cysteiny syntazy, a malonylo-CoA do pantoteiny.
e: transacylaza acetylowa i malonylowa
3. Grupa acetylowa przyłącza się do malonylo-CoA. Odpada CO
2
.
e: syntaza 3-ketoacylowa
4. Powstała grupa 3-ketoacylowa zostaje zredukowana, odwodniona i jeszcze raz zredukowana.
e: reduktaza 3-ketoacylowa, hydrataza, reduktaza enoilowa
5. Powstała grupa acylowa jest wypierana przez nowe malonylo-CoA i przenosi się na Cys przy
pomocy białka przenoszącego acyl (ACP). Cały cykl powtarza się 6 razy, do powstania reszyt
palmitoilowej. Wtedy tioesteraza odłącza palmitynian, a syntaza zaczyna tworzyć nową cząsteczkę
kwasu.
•
w gruczole sutkowym jest tioesteraza swoista dla C8, C10 i C12
•
źródłem NADPH do redukcji w etapie 4. jest zwykle szlak pentozofosforanowy (może też
być z reakcji: jabłczan → pirogronian lub cytrynian → szczawiooctan)
Źródła acetylo-CoA:
Acetylo-CoA powstaje w mitochondriach z pirogronianu (e: dehydrogenaza pirogronianowa) i
nie przenika przez błony mitochondrialne.
Transport acetylo-CoA do cytozolu:
1. acetylo-CoA + szczawiooctan → cytrynian
2. Cytrynian przenika do cytozolu.
3. cytrynian → acetylo-CoA + szczawiooctan
e: liaza ATP-cytrynianowa
4. Acetylo-CoA służy do syntezy kwasów tłuszczowych. Szczawiooctan jest przekształcany w
jabłczan, który wraca do mitochondrium i jest z powrotem przekształcany w szczawiooctan.
Regulacja biosyntezy kwasów tłuszczowych:
−
karboksylaza acetylo-CoA (etap 1.) jest aktywowana przez cytrynian i insulinę, a
38

hamowana przez glukagon i adrenalinę (insulina i glukagon działają poprzez kinazy i
fosoforylazy)
−
acylo-CoA hamują dekarboksylazę pirogronianową (acylo-, nie acetylo-! - chociaż wg
prezentacji acetylo- też)
Elongacja:
−
w siateczce śródplazmatycznej
−
potrzeba NADPH
−
wydłużanie o parzystą liczbę atomów węgla
−
donorem grupy acetylowej jest malonylo-CoA
−
enzym: elongaza kwasu tłuszczowego
Nienasycone kwasy tłuszczowe:
−
egzogenne – linolowy, α-linolenowy, arachidonowy (częściowo)
−
endogenne:
* palmitooleinowy – powstaje z kwasu palmitynowego
* oleinowy – powstaje z kwasu stearynowego
e: Δ
9
desaturaza
* wielonienasycone kwasy tłuszczowe powstają w wyniku desaturacji i elongacji, np. kwas
arachidonowy może powstawać z kwasu linolowego, gdy jest go dużo
β-OKSYDACJA KWASÓW TŁUSZCZOWYCH
1. „Aktywacja” kwasu tłuszczowego.
WKT + CoA + ATP → acylo-CoA + AMP + Ppi
e: syntaza acylo-CoA (tiokinaza)
−
PPi jest rozkładany z wydzieleniem energii, dzięki czemu proces biegnie w kierunku β-
oksydacji.
−
Zachodzi w siateczce śródplazmatycznej, peroksysomach, matrix, zewn. błonie
mitochondrialnej.
2. Transport acylo-CoA do matrix.
A. Acylo-CoA przechodzi przez zewnętrzną błonę mitochondrialną, ale przez wewnętrzną nie.
B. W przestrzeni międzybłonowej:
acylo-CoA + karnityna → acylokarnityna + CoA
e: palmitoilotransferaza karnitynowa I
C. Wymiana acylokarnityny z przestrzeni międzybłonowej na karnitynę z macierzy
mitochondrialnej.
Enzym: translokaza karnitynoacylokarnitynowa
D. W macierzy mitochondrialnej:
acylokarnityna + CoA → karnityna + acylo-CoA
e: palmitoilotransferaza karnitynowa II
E. Karnityna wraca jak w podpunkcie C.
3. Odłączanie acetylo-CoA od acylo-CoA.
a. Powstanie wiązania podwójnego między C2 a C3.
39

FAD → FADH2 (do łańcucha oddechowego)
enzym: dehydrogenaza acylo-CoA
b. Przyłączenie cząsteczki H
2
O (-OH do C3; H do C2).
c. Odłączenie H z grupy -OH przy C3 → powstaje grupa ketonowa przy C3.
NAD+ → NADH + H+
d. Odłączenie acetylo-CoA od C3, przyłączenie CoA do C3 (tioliza).
3-ketoacylo-CoA + CoA → acetylo-CoA + acylo-CoA
enzym: tiolaza
Acylo-CoA wchodzi znowu w cykl oksydacyjny. Acetylo-CoA idzie do cyklu kwasu cytrnowego.
Gdy kwas tłuszczowy ma nieparzystą liczbę atomów węgla, na końcu powstają acetylo-CoA i
propionylo-CoA, który trafia do cyklu kwasu cytrynowego jako bursztynylo-CoA (czyli jest
jedynym glukogennym fragmentem kwasów tłuszczowych).
Nienasycone kwasy tłuszczowe są utleniane przy użyciu izomeraz cis-trans (tłuszcz z wiązaniem
trans między C2 a C3 to tłuszcz po etapie a.).
β-oksydacja 1 mol palmitynianu daje 106 mol zysku netto!
Niedobór karnityny powoduje hipoglikmię, gromadzenie tłuszczu i osłabienie mięśni.
KETOGENEZA
Ciała ketonowe: aceton, acetooctan, β-hydroksymaślan.
β-hydroksymaślan ↔ acetooctan → aceton
Enzymem przekształcającym β-hydroksymaślan w acetooctan i odwrotnie jest dehydrogenaza β-
hydroksymaślanowa.
Ketogeneza:
1. acetoacetylo-CoA + acetylo-CoA + H
2
O → HMG-CoA + CoA
e: syntaza HMG-CoA (3-hydroksy-3-metyloglutarylo-CoA)
2. HMG-CoA → acetooctan + acetylo-CoA
e: liaza HMG-CoA
−
w mitochondriach hepatocytów
−
acetoacetylo-CoA to produkt przedostatniego etapu β-oksydacji
Zużywanie ciał ketonowych:
1. acetooctan + bursztynylo-CoA → acetoacetylo-CoA + bursztynian
e: transferaza CoA, bursztynian : szczawiooctan
2. acetoacetylo-CoA → acetylo-CoA (idzie do cyklu kwasu cytrynowego)
e: tiolaza
Regulacja ketogenezy:
- zmniejszenie ilości WKT we krwi
40

- malonylo-CoA jest inhibitorem palmitoilotransferazy karnitynowej I w stanie sytośći
- wzrost WKT powoduje, że więcej acetylo-CoA bierze udział w ketogenezie, a mniej w cyklu
kwasu cytrynowego
Ketonemia – wzrost stężenia ciał ketonowych we krwi.
Ketonuria – wydalanie ciał ketonowych z moczem.
BIOSYNTEZA TRIACYLOGLICEROLI I POCHODNYCH LIPIDÓW
Biosynteza triacylogliceroli:
1. Glicerolo-3-fosforan (G-3-P) może powstać z:
−
glicerolu (e: kinaza glicerolowa) – zużywamy ATP
−
fosfodihydroksyacetonu (e: dehydrogenaza glicerolo-3-fosforanowa) – redukcja przy
użyciu NADH + H+, zachodzi np. w mięśniach i tkance tłuszczowej
2. Dwie cząsteczki acylo-CoA („aktywny” WKT) łączą się z G-3-P, tworząc kwas fosfatydowy
(inaczej fosfatydan), (e: acylotransferazy: glicerolo-3-fosforanowa i 1-acylo-G-3-P).
3. Kwas fosfatydowy przyłącza cząsteczkę wody - powstaje 1,2-diacyloglicerol.
4. 1,2-DAG + acylo-CoA → TAG(triacyloglicerol) + CoA
e: acylotransferaza diacyloglicerolowa (DGAT)
−
jest to reakcja swoista dla syntezy triacylogliceroli
−
ta reakcja i dostępność DGAT ograniczają szybkość syntezy TAG
−
etapy 1, 2 i 3 mogą zostać zastąpione w jelicie przez acylowanie 2-monoacyloglicerolu (e:
acylotransferaza monoacyloglicerolowa)
Biosynteza fosfogliceroli:
A. Fosfatydylocholina.
−
etapy 1, 2 i 3 jak wyżej
4A. 1,2-DAG + CDP-cholina → fosfatydylocholina (lecytyna) + CMP
−
w ten sam sposób może powstać fosfatydyloetanolamina (tylko zamiast CDP-choliny jest
CDP-etanoloamina)
−
fosfatydyloseryna powstaje w reakcji fosfatydyloetanoloaminy z seryną
−
lecytyna może powstać z fosfatydyloetanoloaminy (w wątrobie) – kofaktorem jest S-
adenozylometionina
B. Kardiolipina.
−
etapy 1 i 2 jak wyżej
3B. Kwas fosfatydowy przyłącza cząsteczkę CTP – powstaje CDP-diacyloglicerol.
4B. CDP-DAG + glicerolo-3-fosforan → fosfatydyloglicerol
5B. CDP-DAG + fosfatydyloglicerol → kardiolipina
41

C. Fosfatydyloinozytol.
- etapy 1, 2 i 3B jak wyżej
4C. CDP-DAG + inozytol → fosfatydyloinozytol
e: syntaza fosfatydyloinozytolowa
−
kinazy mogą przekształcać fosfatydyloinozytol dalej do 4-fosforanu i 4,5-bisfosforanu
inozytolu
Biosynteza plazmalogenu i PAF:
−
zachodzi w peroksysomach
1. fosfodihydroksyaceton + acylo-CoA → 1-acylofosfodihydroksyaceton
e: acylotransferaza
2. Potem wiązanie estrowe jest zamieniane na eterowe, powstaje 1-alkilofosfodihydroksyaceton.
e: syntaza
3. 1-alkilofosfodihydroksyaceton jest redukowany, acylowany i hydroksylowany – powstaje 1-
alkilo-2-acyloglicerol.
4. 1-akilo-2-acyloglicerol może się przekształcić na 2 sposoby:
−
dodanie etanoloaminy i desaturacja – powstaje plazmalogen
−
dodanie choliny i zamiana reszty acylowej na acetylową – powstaje PAF (jednym z
enzymów jest fosfolipaza A2)
Plazmalogeny:
−
fosfolipidy mitochondrialne
PAF (czynnik aktywujący płytki):
−
powoduje agregację płytek
−
obniża ciśnienie krwi
−
bierze udział w procesach zapalnych, chemotaksji i fosforylacji białek
−
sprzyja powstawaniu wrzodów żołądka
Fosfolipazy:
−
fosfolipaza A2 działa zawsze przed fosfolipazą B
−
fosfolipaza C (w tym wypadku można mówić na nią fosfoinozytaza) działa na
fosfatydyloinozytol i odcina trifosforan inozytolu, który jest ligandem dla kanałów
wapniowych i powoduje aktywację białka C
−
fosfolipaza C – w toksynach bakteryjnych
−
fosfolipaza A2 – w soku trzustkowym i jadzie węża
−
fosfolipid po działaniu fosfoipazy A2 – lizofosfolipid (w ogóle jak coś ma -OH zamiast
kwasu tłuszczowego to jest lizo-)
Biosynteza sfingolipidów:
42

Ceramid:
−
powstaje z palmitoilo-CoA i seryny
−
enzymem 1. etapu jest palmitoilotransferaza serynowa, kofaktorami: fosforan pirydoksalu
(witamina B
6
) i Mn
2+
−
produkt tej reakcji jest redukowany, N-acetylowany i desaturowany – powstaje ceramid
−
ceramid jest cząsteczką sygnałową dla ważnych szlaków komórkowych: cyklu
komórkowego, różnicowania, starzenia, apoptozy
Sfingomieliny:
ceramid + fosfatydylocholina → sfingomielina + diacyloglicerol
−
powstają w aparacie Golgiego i błonie plazmatycznej
Glikosfingolipidy (cerebrozydy):
−
galaktozyloceramid (GalCer) – w mielinie
−
glukozyloceramid (GluCer) – w tkankach pozanerwowych
Powstają w reakcji ceramidu odpowiednio z UDP-galaktozą i UDP-glukozą.
−
sulfogalaktozyloceramid (sulfatyd): GalCer + PAPS („aktywny” siarczan)
−
gangliozydy : ceramid + dużo UDP-galaktozy/UDP-glukozy + kwas sialowy (np. N-
acetyloneuraminowy)
Glikosfingolipidy powstają w aparacie Golgiego, są składnikami zewnętrznej warstwy błony
plazmatycznej, odgrywają ważną rolę w przyleganiu i rozpoznawaniu komórek, mogą być
antygenami (np. układu AB0), receptorami dla toksyn bakteryjnych (np. toksyny cholery, która
aktywuje cyklazę adenylanową).
Metabolizm nienasyconych kwasów tłuszczowych:
Syntetyzujemy de novo nienasycone kwasy tłuszczowe tylko do Δ
9
(czyli takie, które mają wiązanie
podwójne przy 9. atomie węgla, licząc od grupy COOH lub przy <9. atomie). Te, które mają
wiązenie podwójne przy atomie >9 musimy sobie skonsumować, albo wytwarzać jedne z drugich.
Z kwasu oleinowego powstaje rodzina ω-9.
Z kwasu linolowego – rodzina ω-6.
Z kwasu α-linolenowego – rodzina ω-3.
Najczęściej syntetyzujemy kwasy o wiązaniu podwójnym przy 9. atomie węgla – enzym: Δ
9
–
desaturaza.
Niezbędne nienasycone kwasy tłuszczowe: linolowy i α-linolenowy.
W syntezie np. kwasu arachidonowego z linolowego (albo przechodzeniu innych nienasyconych w
drugie), biorą udział desaturazy i elongazy.
Kwas dokozaheksaenowy – DHA (ω:3, 22:6) – występuje w tłuszczu ryb, ale może też powstawać z
kwasu α-linolenowego. Jest potrzebny do rozwoju siatkówki oka i kory mózgu, ponadto występuje
43

w jądrach i w nasieniu.
Kwas arachidonowy może powstawać z kwasu linolowego, dlatego nie jest niezbędny w diecie,
jeżeli używamy np. oleju słonecznikowego, który zawiera dużo linolanu. Występuje w błonach
komórkowych.
Egzogenne kwasy tłuszczowe występują w pozycji sn-2 fosfolipidów.
Tłuszcze trans utrudniają metabolizm tłuszczów cis stymulują powstawanie LDL.
Biosynteza eikozanoidów:
Eikozanoidy dzielą się na 3 grupy:
- prostanoidy: prostaglandyny (PG), prostacykliny (PGI) i tromboksany (TX)
- leukotrieny (LT)
- lipoksyny (LX).
Eikozanoidy powstają z nienasyconych kwasów tłuszczowych C20 – arachidonowego,
ikozapentaenowego lub kwasów powstających z kwasu linolowego i α-linolenowego.
Są dwa szlaki syntezy ikozanoidów:
1. Szlak cyklooksygenazy (dla prostaglandyn, prostacyklin i tromboksanów).
- cyklooksygenaza (inaczej syntaza prostaglandyny H) ma 2 aktywności: cyklooksygenazy i
peroksydazy
- ma 2 izoenzymy: COX-1 i COX-2
- oba izoenzymy są blokowane przez aspirynę
- oba izoenzymy są hamowane kompetycyjnie przez ibuprofen i indometacynę
- kortykosteroidy przeciwzpalne hamują transkrypcję tylko COX-2
A. Prostanoidy grupy 1. (te z indeksem
1
na końcu – np. TXA
1
) powstają z ikozatrienoanu –
pochodnej linolanu.
B. Prostanoidy grupy 2 powstają z arachidonianu.
C. Prostanoidy grupy 3 powstają z ikozapentaenoanu, który powstaje z α-linolenianu.
A w jaki sposób powstają?
Najpierw na substrat (np. arachidonian) działa 1. aktywność COX – cyklooksygenaza. Na tym
etapie działają inhibitory (np. aspiryna). Potem działa peroksydaza (2. aktywność COX) i powstaje
w zależność od grupy: PGH
1
lub PGH
2
lub PGH
3
(ogólnie prostaglandyna H :) ). PGH jest
substratem do syntezy prostanoidów, w zależności od enzymu powstają:
- prostaglandyny – PGD i PGE (enzym: izomeraza)
- prostacykliny (enzym: syntaza prostacyklinowa)
- tromboksany – TXA i TXB (enzym: syntaza tromboksanowa, inhibitor: imidazol) – produktami
ubocznymi są malonodialdehyd i HHT
PGF powstaje z PGE (enzym: reduktaza).
TXB powstaje z TXA (enzymu Harper nie podaje).
Funkcje prostanoidów:
44

- Tromboksany działają naczynioskurczowo i prozakrzepowo (powodują agregację płytek krwi) –
najbardziej TXA
2
.
- Prostacykliny rozszerzają naczynia i działają przeciwzakrzepowo – hamują zlepianie się płytek
krwi.
- Prostaglandyny:
* Zapobieganie zapłodnieniu, przerywanie ciąży, prowokowanie porodu.
* Hamują wydzielanie soku żołądkowego – ulga dla chorych na wrzody żołądka.
* Zmniejszają stężenie cAMP w komórkach kanalików nerkowych i tkanki tłusczowej – w innych
miejscach zwiększają.
Dlaczego aspiryna działa przeciwzakrzepowo?
Blokuje cyklooksygenazę, która odpowiada za syntezę prostacyklin i tromboksanów, ale
tromboksany są syntetyzowane w płytkach, które nie mają jądra komórkowego, więc nie są w stanie
sobie zsyntetyzować nowej cyklooksygenazy i dlatego blokada jest trwała. Natomiast komórki
śródbłonka syntetyzują sobie nową cyklooksygenazę i mogą produkować prostacykliny, które
działają przeciwzakrzepowo.
2. Szlak lipooksygenazy (dla leukotrienów i liposkyn).
- leukotrieny też dzielą się na 3 grupy: grupa 1 powstaje z ikozatrienoanu, grupa 2 powstaje z
arachidonianu, a grupa 3 – z ikozapentaenoanu.
Tylko UWAGA – grupa 1 ma indeks
3
(np. LTA
3
), grupa 2 ma indeks
4
, a grupa 3 ma indeks
5
- lipoksyny powstają tylko z arachidonianu – indeks
4
- są 3 różne lipooksygenazy:
* 5 – lipooksygenaza – syntetyzuje leukotrieny A
* 12 – lipooksygenaza i 15 – lipooksygenaza syntetyzują lipoksyny
Ich działanie polega na przyłączaniu tlenu do kwasu arachidonowego w pozycji odpowiednio: 5, 12
lub 15.
Leukotrieny A -> leukotrieny B.
Leukotrieny A -> leukotrieny C -> leukotrieny D -> leukotrieny E.
Funkcje:
- leukotrieny C
4
, D
4
i E
4
wchodzą w skład SRS-A (wolno reagującej substancji anafilaksji) –
zwężają oskrzela
- leukotrieny B
4
, C
4
, D
4
i E
4
zwiększają przepuszczalność naczyń krwionośnych, aktywują
leukocyty i wywołują chemotaksję – regulacja stanów zapalnych i reakcji anafilaktycznych
- lipoksyny mają działanie przeciwzapalne i hamują namnażanie komórek układu
immunologicznego
TRAWIENIE LIPIDÓW
W świetle jelita:
45

A. TAG → 2-monoacyloglicerol + 2 WKT
e: lipaza trzustkowa
B. 2-monoacyloglicerol → 1-monoacyloglicerol
e: izomeraza
C. 1-monoacyloglicerol → glicerol + WKT
e: lipaza trzustkowa
Glicerol jest wchłaniany przez enterocyty do żyły wrotnej.
2-monoacyloglicerol może być też użyty do resyntezy TAG szlakiem jelitowym (e: acylotransferaza
monoacyloglicerolowa) – wtedy są też syntetyzowane białka i fosfolipidy – powstają chylomikrony.
Lipaza trzustkowa potrzebuje kolipazy.
CHOLESTEROL
Cholesterol jest substratem do syntezy:
- kwasów żółciowych
- witaminy D
3
(kalcytriolu)
- hormonów steroidowych
- mineralokortykoidów
- glikokortykoidów
- androgenów
- gestagenów
- estrogenów
Cholesterol zestryfikowany z resztami długołańcuchowych kwasów tłuszczowych jest składnikiem
błon komórkowych, bo jest amfipatyczny.
Połowa cholesterolu pochodzi z diety, a połowa jest syntytyzowana przez nas. Sitosterole
zmniejszają wchłanianie cholesterolu o 10-15% - czyli te wszystkie margaryny chyba jednak
działają :)
Cholesterol jest wydalany z żółcią – w połowie jako sole kwasów żółciowych, a w połowie jako
cholesterol. Błonnik wspomaga wydalanie cholesterolu i chroni przed rozwojem raka jelita
grubego.
Przenoszenie cholesterolu:
- LDL z wątroby do tkanek obwodowych
- HDL z tkanek obwodowych do wątroby
Biosynteza cholesterolu:
- w cytozolu i siateczce śródplazmatycznej
- we wszystkich komórkach jądrzastych
- głównie w skórze, wątrobie i jelitach
- regulowana jest głównie synteza w wątrobie
5 etapów:
46

1. Synteza mewalonianu – najważniejszy, bo regulowany.
A. 2 acetylo-CoA są kondensowane przez tiolazę do acetoacetylo-CoA.
Podobnie wygląda synteza ciał ketonowych, ale ona zachodzi tylko w mitochondriach hepatocytów,
a to w cytozolu i w różnych komórkach.
B. acetoacetylo-CoA + acetylo-CoA + H
2
O -> HMG-CoA + CoA
enzym: syntaza HMG-CoA
HMG-CoA = 3-hydroksy-3-metyloglutarylo-CoA
C. HMG-CoA -> mewalonian
enzym: REDUKTAZA HMG-CoA
Reduktaza HMG-CoA to najważniejszy enzym w syntezie cholesterolu, bo możemy ją reglować.
Jest hamowana przez: cholesterol, kwasy żółciowe, mewalonian, glukagon, glikokortykoidy i
statyny (mewastatyna, lowastatyna). Aktywują ją insulina i hormony tarczycy.
Poziom cholesterolu powinien być regulowany dietą, ale gdy to nie pomaga, podajemy statyny.
Reduktaza HMG-CoA jest aktywna w formie zdefosforylowanej, czyli aktywuje ją fosfataza, a
dezaktywuje kinaza. Glukagon inaktywuje fosfatazę, więc hamuje też reduktazę. Z kolei insulina
inaktywuje kinazę, więc aktywuje reduktazę.
Cholesterol hamuje transkrypcję reduktazy HMG-CoA, bo hamuje uwalnianie białka SREBP
(białko wiążące sterolowy element regulacyjny), które jest przyczepione do błony komórki. Jego
brak uniemożliwia indukcję transkrypcji reduktazy HMG-CoA.
2. Wytworzenie jednostek izoprenoidowych z mewalonianu.
Mewalonian jest fosforylowany przez 3 kinazy: najpierw 2x przy węglu 5, a potem raz przy 3.
Później traci grupę COOH i grupę PO4 od 3. węgla, powstaje wiązanie podwójne, następnie ulega
jeszcze jakimś drobnym modyfikacjom i z 2 cząsteczek difosforanu pentnylu powstaje difosforan
geranylu. Gdy do difosforanu geranylu dołączymy jeszcze jeden difosforan izopentenylu to
otrzymamy difosforan farnezylu.
Difosforan farnezylu jest substratem do syntezy dolicholu (e: cis-prenylotransferaza), łańcucha
bocznego ubichinonu i hemu a (e: trans-prenylotransferaza). Służy też do prenylowania białek.
3. Powstanie skwalenu.
2 difosforan farnezylu -> skwalen
enzym: syntetaza skwalenu
kofaktory: NADPH, Mg
2+
, Mn
2+
4. Cyklizacja skwalenu.
47

skwalen -> lanosterol (i chyba tyle nam wystarczy :) )
5. Powstanie cholesterolu.
lanosterol -> zymosterol -> desmosterol -> cholesterol
W ostatnim etapie enzymem jest reduktaza Δ
24
, hamowana przez triparanol.
Biosynteza kwasów żółciowych:
1. cholsterol -> 7α-hydroksycholesterol
enzym: 7α-hydroksylaza
kofaktor: witamina C
7α-hydroksylaza jest aktywowana przez cholesterol, a hamowana przez kwasy żółciowe i niedobór
witaminy C. Kwasy żółciowe wiążą się z FXR (farnezoidowy X receptor) w jądrze komórkowym i
hamują transkrypcję genu 7α-hydroksylazy.
2. To jest etap, na którym bywa różnie:
A. 7α-hydroksycholesterol -> choloilo-CoA -> kwas glikocholowy lub taurocholowy
B. 7α-hydroksycholesterol -> chenodeoksycholoilo-CoA -> kwas glikochenodeoksycholowy lub
taurochenodeoksycholowy
Ostatni etap obu szlaków to reakcja sprzęgania z tauryną lub glicyną.
C. Powstawanie wtórnych kwasów żółciowych.
kwas gliko-/taurocholowy -> kwas deoksycholowy
kwas gliko-/taurodeoksycholowy -> kwas litocholowy (słabo rozpuszczalny w wodzie i słabo
reabsorbowany)
To wszystko ma miejsce w jelicie, przy pomocy flory bakteryjnej.
Prawidłowe stężenia cholesterolu i lipoprotein:
Cholesterol całkowity (T-C): <190 mg/dl (5,2 mmol/l)
LDL: <130 mg/dl
HDL: >40 mg/dl faceci, >50mg/dl kobiety
LIPOPROTEINY
- zawierają apoproteiny:
apo A-I – w HDL, kofaktor LCAT
apo A-II – inhibitor LPL (LCAT podobno też – są różne wersje)
apo B-48 – w chylomikronach, strukturalna
apo B-100 – w VLDL i LDL, strukturalna, ligand dla receptora LDL
48

apo C-I – kofaktor dla białka przenoszącego estry cholesterolu, produkowana w wątrobie
apo C-II – kofaktor LPL, produkowana w wątrobie
apo C-III – inhibitor LPL, produkowana w wątrobie
apo E – w VLDL i HDL, ligand dla receptora LDL, produkowana w wątrobie
Lipaza lipoproteinowa (LPL) – jest zakotwiczona w błonie komórek śródbłonka przy pomocy
siarczanu heparanu, powoduje 2 procesy, uwalniające TAG:
VLDL → IDL
chylomikron → remnant chylomikronu (mniej TAG, brak apo C)
Uwolnione TAG są w większości wchłaniane do otaczającej tkanki.
Kofaktory LPL: fosfolipdy, apo C-II
Inhibitory LPL: apo A-II, apo C-III
W adipocytach insulina pobudza syntezę LPL.
Sercowa LPL ma większe powinowactwo do TAG od LPL tkanki tłuszczowej → transport TAG do
serca w stanie głodu.
Lipaza wątrobowa:
•
katalizuje hydrolizę TAG i fosfolipidów
•
jest ligandem dla receptora apo E, który przyłącza remnanty chylomikronów
Acylotransferaza lecytyna:cholesterol (LCAT):
−
estryfikuje cholesterol, obecny w błonie HDL, przez co trafia on do wnętrza cząsteczki, co
powoduje:
* przejście HDL
3
w HDL
2
* przejście natywnego HDL do HDL
3
HDL:
- apo A-I, apo C, apo E
- powstają w wątrobie i w jelitach
- HDL wątobowe oddają część swoich apo C i apo E HDL jelitowym, VLDL i chylomikronom
- chroni przed zwiększeniem T-C -> odbiera cholesterol z tkanek i przekazuje do wątroby i nerek,
gdzie jest on wykorzystywany do syntezy hormonów steroidowych. Zarówno przy odbieraniu
cholesterolu z tkanek, jak i przy oddawaniu go tkankom steroidogennym bierze udział SR-B1.
HDL
2
– większe, o mniejszej gęstości, transportują cholesterol z obwodu do tkanek
steroidogennych i wątroby, gdzie go oddaje
HDL
3
– mniejsze, o większej gęstości, przejmuje cholesterol z tkanek obwodowych
Receptor oczyszczający klasy B (SR-B1) – ma 2 funkcje:
−
w tkankach steroidogennych i wątrobie wiąże apo A-I HDL
2
i wyciąga z niego estry
cholesterolu
−
w tkankach obwodowych pośredniczy w oddawaniu cholesterolu do HDL
3
przez komórki
49

LDL:
−
apo B-100
−
jest źródłem cholesterolu dla komórek tkanek obwodowych
−
jest pobierany do komórek przy użyciu receptora swoistego dla apo B-100, którego defekt
jest przyczyną rodzinnej hipercholesterolemii
VLDL:
−
apo B-100, apo C, apo E
−
powstaje w wątrobie
−
jest źródłem TAG dla tkanek obwodowych
Chylomikrony:
−
apo B-48, apo C, apo E, jakieś apo A
−
powstają w enterocytach
−
transportują egzogenne TAG, fosfolipidy i cholesterol z jelita do wątroby
Triacyloglicerole:
- powstają w wątrobie
- WKT zestryfikowane z glicerolem
- fruktoza stymuluje ich syntezę
Zmniejszenie stężenia triacylogliceroli:
- probukol
- witamina B
3
- klofibrat
- gemfibrozil
POCHODNE CHOLESTEROLU
Witamina D
3
:
- zwiększa wchłanianie Ca
2+
i PO
4
3-
w przewodzie pokarmowym
- skutki niedoboru:
* u dzieci – krzywica
* u dorosłych – osteomalacja
* infekcje autoimmunologiczne
* częstsza zapadalność na nowotwory
* zaburzenia gospodarki węglowodanowej
Biosynteza:
- w skórze, wątrobie i nerkach
1. 7-dehydrocholesterol -> prowitamina D
3
-> witamina D
3
- zachodzi w skórze pod wpływem światła słonecznego (fotoliza)
- witaminę D
3
możemy przyswajać w diecie
50

2. witamina D
3
-> 25-hydroksycholekalcyferol (25-OH-D
3
)
-zachodzi w wątrobie
- enzym: 25-hydroksylaza
3. 25-OH- D
3
-> 1,24,25-(OH)
3
- D
3
(kalcytriol)
- zachodzi w nerkach
- enzymy: 24-hydroksylaza i 1α-hydroksylaza
Parathormon zwiększe ekspresję 1α-hydroksylazy i w ten sposób zwiększa wchłanianie wapnia.
24-hydroksylaza zmniejsza aktywność witaminy D
3
– chroni organizm przed jej nadmiernym
działaniem.
Kalcytriol reguluje swoją syntezę – hamuje 1α-hydroksylazę i aktywuje 24-hydroksylazę –
powstaje 1,24-(OH)
2
-D
3
, która jest nieaktywna.
Działanie na komórki:
- kalcytriol wiąże się z receptorem jądrowym, który zawiera motyw palca cynkowego
- jego receptor należy do nadrodziny receptorów tarczycowych
- w komórkach jelita indukuje biosyntezę białka wiążącego wapń (CBP)
- zwiększa wychwyt wapnia z przewodu pokarmowego przez enterocyty, ich transport do wnętrza
komórki i uwalnianie do płynu pozakomórkowego
Osteodystrofia nerkowa – choroba miąższu nerek – zaburzenie ostatniego etapu syntezy kalcytriolu
– degradacja i zmniejszenie masy kości
Hormony kory nadnerczy:
- warstwa kłębkowata – mineralokortykoidy
- warstwa pasmowata – glikokortykoidy
- warstwa siatkowata – androgeny (wg prezentacji pasmowata i siatkowata wytwarzają
glikokortykoidy i androgeny, ale ja pamiętam z histo taką wersję)
21 atomów węgla we wszystkich tych związkach – pierścień cyklopentano – perhydrofenantrenowy
Glukokortykoidy – najważniejszy kortyzol (ale myszki mają kortykosteron)
Mineralokortykoidy – najważniejszy aldosteron
Androgeny – powstają z dehydroepiandrosteronu (DHEA) i androstendionu.
Biosynteza hormonów kory nadnerczy:
- cholesterol pochodzi głównie z osocza krwi, bardzo mało z syntezy de novo
1. Transport cholesterolu z cytoplazmy do mitochondriów.
2. Białko stymulujące steroidogenezę, zależne od ACTH (StAR) przenosi cholesterol na
wewnętrzną błonę mitochondrium.
3. Tam znajduje się enzym rozszczepaijący łańcuch boczny, zawierający cytochrom P-450 (P-
51

450
scc
), który katalizuje taką reakcję:
cholesterol -> pregnenolon + aldehyd izokapronowy
Cholesterol jest tu podwójnie hydroksylowany (C22 i C20) i traci łańcuch boczny – powstaje
związek 21-węglowy – pregnenolon.
4. Dalsze rekacje zachodzą różnie.
4.1. Synteza aldosteronu – w siateczce śródplazmatycznej gładkiej warstwy kłębkowatej.
A. Pregnenolon pod wpływem dehydrogenazy 3β-hydroksysteroidowej i Δ
5,4
izomerazy
przekształca się w progesteron (czyli na tym etapie mamy załatwioną przy okazji syntezę jednego
z hormonów płciowych). Polega to na tym, że przy węglu 3. grupa -OH jest zamieniona na =O i rzy
okazji wiązanie podwójne się przemieszcza.
B. Progesteron jest najpierw hydroksylowany w pozycji 21 (powstaje 11-deoksykortykosteron – już
aktywny mineralokortykoid), a potem w pozycji 11 (powstaje kortykosteron – ten od myszek – ma
aktywność glikokortykoidową).
enzymy: 21-hydroksylaza, 11β-hydroksylaza
C. Kortykosteron jest najpierw hydrkosylowany w pozycji 18., a potem ta grupa -OH w pozycji 18.
jest przekształcana w grupę -CHO – powstaje aldosteron.
enzymy: 18-hydroksylaza, 18-hydroksydehydrogenaza
Regulacja – układ renina-angiotensyna-aldosteron:
Spadek stężenia Na+ we krwi stymuluje komórki przykłębuszkowe nerki do uwalniania reniny.
Renina powoduje konwersję angiotensynogenu do angiotensyny I. Angiotensyna I jest w płucach
przekształcana w angiotensynę II, która stymuluje wydzielanie aldosteronu przez komórki warstwy
kłębkowatej nadnerczy (a przy okazji zwęża naczynia).
Choroby: pierwotny hiperaldosteronizm (Conna), wtórny hiperaldosteronizm.
W retikulum gładkim komórek warstwy kłębkowatej jest 18-hydroksylaza, ale nie ma 17α-
hydroksylazy, dlatego powstaje aldosteron, a nie może powstać kortyzol.
4.2. Synteza kortyzolu – w siateczce śródplazmatycznej gładkiej warstwy pasmowatej (tu z kolei
jest 17α-hydroksylaza, a nie ma 18-hydroksylazy).
A. (1) Pregnenolon -> progesteron -> 17-hydroksyprogesteron, lub
(2) Pregnenolon -> 17- hydroksypregnenolon -> 17-hydroksyprogesteron
W opcji (1) najpierw działa dehydrogenaza 3β-hydroksysteroidowa, a potem 17α-hydroksylaza, w
opcji (2) – odwrotnie.
B. 17-hydroksyprogesteron -> 11-deoksykortyzol
enzym: 21-hydroksylaza
C. 11-deoksykortyzol -> kortyzol
enzym: 11β-hydroksylaza
52

Z ciekawszych rzeczy:
- 21-hydroksylaza nadaje aktywność mineralokortykosteroidową
- 11β-hydroksylaza nadaje aktywność glikokortykosteroidową
- W siateczce śródplazmatycznej warstwy kłębkowatej nia ma 17α-hydroksylazy, a w warstwie
pasmowatej nie ma 18-hydroksylazy – dlatego są wyspecjalizowane w produkowaniu jednej grupy
hormonów.
- Za transport kortyzolu w osoczu odpowiadają albuminy, α-globulina i transkortyna globulina
wiążąca kortykosteroidy - CBG). CBG jest głównym białkiem transportującym kortyzol.
Inaktywuje go, ale wydłuża jego okres półtrwania. W takiej nieaktywnej formie jest 92% kortyzolu
– czyli tylko 8% wykazuje aktywność biologiczną.
- receptor dla glikokortykoidów zawiera motyw palca cynkowego i należy do nadrodziny
receptorów steroidowo – tarczycowych. Jest podobny do receptora mineralokortykoidowego, więc
gliko- i mineralokortykoidy mogą dublować swoje działanie.
- choroby: pierwotna niewydolność kory nadnerczy (Addisona), wtórna niewydolność kory
nadnerczy, nadczynność kory nadnerczy (Cushinga)
4.3. Synteza androgenów.
A. Znowu mamy 2 opcje:
(1) 17-hydroksypregnenolon -> dehydroepiandrosteron (DHEA) -> Δ
4
androsten-3,17-dion
(2) 17-hydroksyprogesteron -> Δ
4
androsten-3,17-dion (czuli po prostu androstendion)
W (1) przypadku działa 17,20-liaza i dehydrogenaza 3β-hydroksysteroidowa, w (2) tylko 17,20-
liaza.
DHEA jest słabym androgenem, prohormonem androstendionu – jego wytwarzanie nasia się w
zespole nadnerczowo – płciowym.
Zespół nadnerczowo – płciowy jest spowodowany w 90% niedoborem 21-hydroksylazy, a w
pozostałych 10% - niedoborem 11β-hydroksylazy.
B. Powstawanie testosteronu:
- z DHEA:
DHEA -> Δ5- androstendiol -> testosteron
enzymy: dehydrogenaza 17β-hydroksysteroidowa, dehydrogenaza 3β-hydroksysteroidowa
- z androstendionu:
androstendion -> testosteron
enzym: dehydrogenaza 17β-hydroksysteroidowa
Szlak przez Δ5- androstendiol, zwany szlakiem Δ5 jest u ludzi bardziej prawdopodobny.
LH pobudza steroidogenezę w komórkach Leydiga.
Testosteron jest najsilniejszym androgenem. Powstaje głównie w wyniku konwersji w taknkach (w
nadnerczach powstaje głównie androstendion). 97-99% wiąże się z SHBG (Sex Hormone Binding
Globulin) i jest nieaktywna biologicznie. Estrogeny zwiększają produkcję SHBG, dlatego ich
nadmiar prowadzi do spadku stężenia testosteronu i ginekomastii, ale z drugiej strony są w pewnym
stężeniu potrzebne do produkcji plemników.
53

Testosteron działa anabolicznie na kości, zęby, mięśnie, reguluje spermatogenezę, wpływa na
dodatni bilans azotowy.
Nadczynność tarczycy zwiększa syntezę testosteronu, niedoczynność zminiejsza.
17α-hydroksylaza i 17,20-liaza są częściami tego samego enzymu – P450
C17
.
Inaktywacja testosteronu – oksydacja w pozycji 17 – powstają mało aktywne lub w ogóle
nieaktywne 17-ketosteroidy.
Powstawanie dihydrotestosteronu:
testosteron -> dihydrotestosteron (DHT)
enzym: 5α-reduktaza
Proces polega na redukcji wiązania podwójnego i grupy ketonowej przy 3. atomie węgla.
DHT jest bardzo aktywny, powstaje w tkankach docelowych (pęcherzyki nasienne, prostata, skóra
w okolicach narządów płciowych).
Niedobór 5α-reduktazy – obojniactwo.
Niefunkcjonalne receptory dla DHT – zespół feminizujących jąder (niewrażliwość na androgeny).
4.4 Synteza estrogenów.
A. testosteron -> 17β-estradiol (E2)
enzym: aromataza
B. 17β-estradiol <-> estron (E1)
Estron może także powstawać z androstendionu pod wpływem aromatazy. Estradiol i estron mogą
przechodzić w siebie nawzajem.
C. Estron -> estriol
enzym: 16α-hydroksylaza
Aromataza zawiera P-450 monooksydazę.
Głównym estrogenem u kobiet jest 17β-estradiol. W czasie ciąży łożysko wytwarza także estriol.
Tkanka tłuszczowa także wytwarza estrogeny.
Estrogeny wiążą się z SHBG słabiej niż testosteron, ale za to nie osłabia to ich działania. Najsilniej
wiąże się estradiol (ale i tak 5x słabiej od testosteronu), najsłabiej estriol.
4.5 Synteza progesteronu.
Progesteron powstaje w ciałku żółtym z pregnenolonu pod wpływem dehydrogenazy 3β-
hydroksysteroidowej.
Progesteron może się wiązać z CBG (transkortyną).
Progesteron podawany doustnie jest metabolizowany w wątrobie do pregnandiolu, dlatego
podajemy pochodne progesteronu, które nie są metabolizowane, a mają aktywność progestynową –
np. 17α-hydroksyprogesteron. Natomiast estrogeny można podawać doustnie.
54

Nadnercza płodu syntetyzują kortyzol z progesteronu produkowanego przez łóżysko, bo maleństwo
nie ma jeszcze dehydrogenazy 3β-hydroksysteroidowej i Δ
5,4
izomerazy i nie mogą produkować
kortyzolu klasycznym szlakiem.
Gonadotropina kosmówkowa jest produkowana od 2. tygodnia – jest dowodem na ciążę.
Pierwotny hipogonadyzm – uszkodzenie jajników.
Wtórny hipogonadyzm – probemy z gonadotropiną lub z przysadką.
Zespół Turnera – kariotyp X0 – dysgeneza gonad.
55

ŁAŃCUCH ODDECHOWY
Łańcuch oddechowy jest zbudowany z 4 kompleksów białkowych, osadzonych w wewnętrznej
błonie mitochondrialnej:
1. Oksydoreduktaza NADH-CoQ (kompleks I).
- przenosi elektrony z NADH na koenzym Q
- zawiera FMN/FAD i białka żelazowo-siarkowe
- ma kształt litery L
- droga elektronu: NADH -> FMN -> białka Fe-S -> CoQ
- transport elektronów jest sprzężony z przeniesieniem 4 H
+
z matrix do przestrzeni
międzybłonowej
2. Reduktaza busztynian-CoQ (kompleks II).
- przenosi elektrony z bursztynianu na CoQ
- jest wykorzystywana zamiast kompleksu I przez związki o wyższym (bardziej dodatnim)
potencjale red-ox od NADH
- zawiera FMN/FAD i białka żelazowo-siarkowe
- droga elektronu: bursztynian -> FADH
2
-> białka Fe-S -> CoQ
3. Oksydoreduktaza CoQ-cytochrom c (kompleks III).
- przenosi elektrony z koenzymu Q na cytochrom c
- zawiera białka żelazowo-siarkowe
- w przenoszeniu elektronu biorą udział: cytochrom c
1
, cytochrom b
L
, cytochrom b
H
i białko
Rieske Fe-S
- CoQ przenosi 2 elektrony, a na cytochromie c jest miejsce tylko na 1, dlatego utlenienie 1
cząsteczki CoQ powoduje redukcję 2 cząsteczek cytochromu c
- transport elektronu powoduje przeniesienie 4 H
+
do przestrzeni międzybłonowej
4. Oksydaza cytochromu c (kompleks IV).
- przekazuje elektrony z cytochromu c na tlen:
56

O
2
+ 4H
+
+ 4e
-
-> 2H
2
O (w uproszczeniu oczywiście)
- reakcja wymaga hemu a i a
3
oraz jonów miedzi
- droga elektronu: cytochrom c -> centrum Cu
A
-> hem a -> hem a
3
-> centrum Cu
B
-> O
2
- jednocześnie 2 H
+
są przenoszone z matrix do przestrzeni międzybłonowej
Teoria chemiosmotyczna Mitchella:
- wewnętrzna błona mitochondrialna jest nieprzepuszczalna dla jonów
- w wyniku transportu H
+
przez wewnętrzną błonę mitochondrialną w trakcie reakcji łańcucha
oddechowego powstaje gradient protonowy pomiędzy przestrzenią międzybłonową a macierzą
mitochondrium (jony H
+
gromadzą się po stronie przestrzeni międzybłonowej)
- jest to gradient chemiczny (stężenie H
+
w przestrzeni międzybłonowej jest większe) i
elektryczny (ładunek przestrzeni międzybłonowej jest wyższy)
- kompleksy I, III i IV łańcucha oddechowego są pompami protonowymi i odpowiadają za
utrzymanie gradientu protonowego
- syntaza ATP znajduje się w wewnętrznej błonie mitochondrialnej i jest kanałem umożliwiającym
protonom powrót do macierzy mitochondrialnej zgodnie z gradientem stężeń
- syntaza ATP składa się z 2 sztywno połączonych kompleksów białkowych: F
o
– błonowego kanału
protonowego i F
1
– znajdującego się w matrix, odpowiadającego za zamianę energii kinetycznej
protonów na energię chemiczną zmagazynowaną w ATP
- kompleks F
o
składa się z podjednostek C
- kompleks F
1
składa się z ułożonych naprzemiennie 3 podjednostek α i 3 podjednostek β oraz
znajdującej się w środku pojedynczej podjednostki γ, która odpowiada za połączenie z kompleksem
F
o
- przepływ protonów przez kompleks F
o
powoduje jego obrót, przez co obraca się również
kompleks F
1
- w trakcie obrotu zmienia się konformacja podjednostek β kompleksu F
1
, dzięki czemu jedna z
nich uwalnia gotową cząsteczkę ATP, a inna wiąże do siebie ADP i Pi, z których w następnym
obrocie powstanie ATP, a w kolejnym zostaną uwolnione
- obrót syntazy ATP o 180° powoduje powstanie 3 cząsteczek ATP, bo każda z 3 podjednostek β
obraca się o 180°, czyli przechodzi 1 pełny cykl, kończący się uwolnieniem cząsteczki ATP
- jest to proces fosforylacji oksydacyjnej, w przeciwieństiwe do zachodzącej w glikolizie i cyklu
kwasu cytrynowego fosforylacji substratowej
57

Inhibitory łańcucha oddechowego:
- hamujące przenoszenie elektronów na kompleksach łańcucha oddechowego:
* związki blokujące kompleks I: barbiturany (blokują przenoszenie elektronów z białek Fe-S na
CoQ), pierycydyna A, rotenol
* związki blokujące kompleks II: malonian (hamuje go kompetycyjnie), karboksyna, TTFA
* związki blokujące kompleks III: antymycyna A, BAL, dimerkaprol
* związki blokujące kompleks IV: siarkowodór (H
2
S), tlenek węgla (CO), cyjanek (CN
-
)
- hamujące fosforylację oksydacyjną:
* atraktylozyd – hamuje przenśnik nukleotydów adeninowych – ADP nie dostaje się do
mitochondrium
- rozprzęgające fosforylację oksydacyjną – powodują powrót protonów do matrix w inny sposób niż
przez syntazę ATP:
* 2,4-dinitrofenol
* termogenina – występuje w brunatnej tkance tłuszczowej
* oligomycyna
Wahadłowce substratowe:
- przenoszą substraty i produkty łańcucha oddechowego przez wewnętrzną błonę mitochondrialną
- wahadłowiec glicerolofosforanowy:
* przenosi do matrix równoważniki redukujące
* występuje w mózgu i mięśniach białych
* sposób działania:
1. W cytozolu zachodzi reakcja:
NADH + H
+
+ fosfodihydroksyaceton -> NAD
+
+ glicerolo-3-fosforan
2. Glicerolo-3-fosforan przechodzi przez zewnętrzną błonę mitochondrialną.
3. Na wewnętrznej błonie mitochondrialnej zachodzi reakcja:
glicerolo-3-fosforan + FAD -> fosfodihydroksyaceton + FADH
2
I mamy równoważnik redukujący w matrix !
Enzymem dla obu reakcji jest dehydrogenaza glicerolo-3-fosforanowa, która ma 2 izoformy –
58

cytozolową i mitochondrialną.
- wahadłowiec jabłczanowo-asparaginianowy
* występuje we wszystkich komórkach organizmu
* sposób działania:
1. W cytozolu zachodzi reakcja:
NADH + H
+
+ szczawiooctan -> NAD
+
+ jabłczan
enzym: dehydrogenaza jabłczanowa
2. Jabłczan przechodzi przez obie błony mitochondrialne.
3. W macierzy mitochondrialnej zachodzi reakcja:
jabłczan + NAD
+
-> szczawiooctan + NADH + H
+
enzym: dehydrogenaza jabłczanowa
Szczawiooctan nie przechodzi przez wewnętrzną błonę mitochondrialną.
4. W matrix zachodzi reakcja:
szczawiooctan + glutaminian -> α-ketoglutaran + asparaginian
enzym: aminotransferaza
5. α-ketoglutaran przechodzi przez błony mitochondrialne na zasadzie antyportu - jest
wymieniany na jabłczan, a asparaginian – na jon wodorowy.
6. W cytozolu zachodzi reakcja:
α-ketoglutaran + asparaginian -> szczawiooctan + glutaminian
enzym: aminotransferaza
- wahadłowiec fosfokreatynowy
* występuje w mięśniu sercowym i w mięśniach szkieletowych
* pozwala na szybkie przeniesienie wysokoenergetycznego fosforanu z mitochondriów do cytozolu
* zasada działania:
1. ATP przechodzi z macierzy mitochondrialnej do przestrzeni międzybłonowej przy pomocy
przenośnika nukleotydów adeninowych.
2. W przestrzeni międzybłonowej zachodzi reakcja:
ATP + kreatyna -> ADP + fosfokreatyna
enzym: izoenzym mitochondrialny kinazy kreatynowej (CK
m
)
3. Fosfokreatyna przechodzi przez pory białkowe w zewnętrznej błonie mitochondrialnej do
cytozolu.
4. W cytozolu zachodzi reakcja:
fosfokreatyna + ADP -> kreatyna + ATP
enzym: izoenzym kinazy kreatynowej ułatwiający procesy wysokoenergetyczne (CK
a
)
59

Choroby związane z defektami łańcucha oddechowego:
- miopatia mitochondrialna niemowląt – śmiertelna
- dysfunkcja nerek
- mitochondrialna encefalopatia, kwasica mleczanowa i udar (MELAS) – dziedziczny niedobór
kompleksu I lub kompleksu IV łańcucha oddechowego – mutacja mitochondrialnego DNA
60

ENZYMY
Klasyfikacja enzymów:
L.p.
Klasa enzymu
Rodzaj katalizowanej reakcji
1.
Oksydoreduktazy
Reakcje utleniania i redukcji.
2.
Transferazy
Przenoszenie jednostek i grup funkcyjnych.
3.
Hydrolazy
Hydroliza wiązań np. C-C.
4.
Liazy
Rozszczepienie wiązań z pozostawieniem wiązania
podwójnego, np. CH
2
-CH
2
-> CH=CH
5.
Izomerazy
Przejście jednego izomeru w drugi na skutek zmian
geometrycznych lub strukturalnych cząsteczki.
6.
Ligazy
Utworzenie wiązania pomiędzy cząsteczkami przy udziale
energii powstałej w wyniku hydrolizy ATP.
Budowa enzymu:
- miejsce katalityczne – tam zachodzi katalizowana reakcja
- miejsce allosteryczne – nie pasuje kształtem do substratu, za to mogą się tam wiązać inne
cząsteczki, np. regulatory
- apoenzym – białkowa część enzymu
- część niebiałkowa enzymu:
* kofaktor – związany nietrwale z apoenzymem lub substratem
* koenzym – wiąże się nietrwale z substratami i przenosi je do miejsca aktywnego
* grupa prostetyczna – trwale związana z apoenzymem za pomocą wiązań kowalencyjnych lub
niekowalencyjnych
apoenzym + kofaktor/koenzym/grupa prostetyczna = holoenzym
Rodzaje koenzymów:
- przenoszące H
+
, np.: NAD
+
, NADP
+
, FMN, FAD, kwas liponowy, koenzym Q
- przenoszące inne grupy, np.: fosforany cukrów, CoA-SH, pirofosforan tiaminy, fosforan
pirydoksalu, koenzymy folianowe, biotyna, koenzymy kobamidowe, kwas liponowy
61

Entalpia swobodna:
∆
G =
∆
G
prod.
-
∆
G
substr.
∆
G = 0 -> reakcja odwracalna (stan równowagi)
∆
G < 0 -> reakcja biegnie w prawą stronę (samorzutnie)
∆
G > 0 -> reakcja biegnie w lewą stronę lub w prawą stronę w przy nakładzie energii z rozpadu
ATP (reakcja wymuszona)
[
∆
G] = [J] -> czyli entalpia swobodna to pewien rodzaj energii
Stała równowagi reakcji:
nA + mB <-> xC + yD
K = [A]
n
* [B]
m
/ [C]
x
* [D]
y
K =
[ A]
n
∗
[ B]
m
[C ]
x
∗
[ D]
y
Dlatego usuwanie produktu przyspiesza reakcję (zmniejszamy mianownik, substraty
przekształcają się w produkty – to zmniejsza licznik i zwiększa mianownik, więc ułamek wraca do
normalnej wartości).
Stan przejściowy:
1. A-B + C <-> A-B-C
∆
G
1
(energia aktywacji reakcji)
2. A-B-C <-> A + B-C
∆
G
2
Ogółem:
A-B + C <-> A + B-C
∆
G =
∆
G
1
+
∆
G
2
Na podstawie
∆
G nie da się wywnioskować ile jest stanów przejściowych, ani jakie one są.
Szybkość reakcji:
Żeby 2 cząsteczki mogły ze sobą przereagować, muszą się ze sobą zderzyć i mieć w trakcie
zderzenia energię kinetyczną wyższą/równą energii aktywacji przejścia w stan przejściowy.
Dlatego na szybkość reakcji wpływają:
- temperatura – im wyższa, tym wyższą energię kinetyczną mają cząsteczki, więc więcej zderzeń
kończy się wejściem w stan przejściowy, czyli reakcja zachodzi szybciej
- stężenie – im wyższe, tym więcej jest cząsteczek, więc tym częstsze są zderzenia – reakcja
zachodzi szybciej
62

Enzymy:
- stabilizują stan przejściowy
- obniżają energię aktywacji reakcji
- przyspieszają reakcję
- wiążą się z substratami przejściowo – po reakcji są wracają do stanu początkowego:
A + B + E <-> C + D + E
- nie wpływają na stałą równowagi reakcji
K= [A]*[B]*[E] / [C]*[D]*[E] = [A]*[B] / [C]*[D]
K =
[ A]
∗
[B]
∗
[E ]
[C ]
∗
[ D]
∗
[ E ]
=
[ A]
∗
[B]
[C ]
∗
[ D]
- zbyt wysoka temperatura powoduje denaturację enzymu
- pH – wpływając na ładunek enzymu i substratów może zmieniać szybkośc reakcji, może także
powodować denaturację enzymu, gdy jest zbyt wysokie albo zbyt niskie
Mechanizmy działania katalitycznego enzymów:
1. Kataliza przez sąsiedztwo.
- cząsteczki substratu przyłączają się w centrum aktywnym enzymu i są ustawiane w taki sposób,
żeby najłatwiej było im oddziaływać między sobą
- szybkość reakcji rośnie co najmniej 1000 x
2. Kataliza kwasowo-zasadowa.
- grupy prostetyczne i wolne grupy –COOH i –NH
2
reszt aminokwasowych działają na substrat jako
kwasy lub zasady
- kataliza specyficzna – biorą w niej udział tylko jony H
3
O
+
lub OH
-
i tylko ich stężenie warunkuje
aktywność enzymu (czyli też szybkość reakcji)
- kataliza ogólna – jej szybkość zależy od stężenia wszystkich kwasów/zasad
- przykłady katalizy kwasowo-zasadowej: pepsyna, katepsyny, proteaza HIV (wszystkie należą do
rodziny proteaz asparaginianowych)
3. Kataliza przez odkształcenie cząsteczki substratu.
- enzym przyłącza substrat w taki sposób, żeby wywołać naprężenia w konkretnym wiązaniu i
czynią je bardziej podatnym na rozerwanie
- działają tak enzymy katalizujące reakcje lizy (np. liazy)
63

4. Kataliza kowalencyjna.
- powstaje wiązanie kowalencyjne między enzymem a substratem/substratami
- kompleks enzym-substrat staje się substratem katalizowanej reakcji, jednocześnie obniżając jej
energię aktywacji
- po zakończeniu reakcji enzym odłącza się od substratu
- często do wiązania substratu są wykorzystywane reszty cysteiny i seryny, czasami histydyny
- przykłady katalizy kowalencyjnej: chymotrypsyna, fruktozo-2,6-bisfosfataza
Równanie Michaelisa – Menten:
v
i
= v
max.
* [S] / K
m
+ [S]
vi =
vmax.
∗
[S ]
Km+[ S ]
v
i
– szybkość reakcji
v
max.
– maksymalna szybkość reakcji
[S] – stężenie substratu
K
m
– stała Michaelisa – Menten – stężenie substratu, przy którym v
i
= 0,5 v
max
Jeżeli [S] jest dużo mniejsze od K
m
, to:
K
m
+ [S] ≈ K
m
v
i
= v
max.
* [S] / K
m
vmax. i K
m
są stałymi, więc szybkość reakcji zależy od [S].
Jeżeli [S] jest dużo większe od K
m
, to:
K
m
+ [S] ≈ [S]
v
i
= v
max.
* [S] / [S] = v
max.
Dlatego przy wzroście stężenia substratu szybkość reakcji rośnie w kierunku szybkości
maksymalnej. Gdy v
i
= v
max.
, dalszy wzrost stężenia substratu nie wpływa na szybkość reakcji.
Jeżeli [S] = K
m
, to:
K
m
+ [S] = 2 [S]
v
i
= v
max.
* [S] / 2[S] = 0,5 v
max.
Wykres Lineweavera – Burka:
1/ v
i
= K
m
/ v
max.
*[S] + 1/ v
max.
1
vi
=
Km
vmax.
∗
[S ]+
1
vmax.
- służy do wyznaczania v
max.
i K
m
(przy x=0, y=1/ v
max.
; przy y=0, x=1/ K
m
)
Równanie Hilla:
- służy do opisu kinetyki reakcji katalizowanych przez enzymy multimeryczne (takie, które wiążą
64

substrat w więcej niż 1 miejscu, czyli mogą wiązać więcej niż 1 cząsteczkę substratu jednocześnie –
przyłączanie kooperatywne)
Inhibitory:
1. Inhibitory kompetycyjne.
- w budowie podobne do substratów (analogi substratów)
- zajmują miejsce substratu w centrum katalitycznym enzymu i blokują go – zmniejszają liczbę
cząsteczek enzymu gotowych do katalizowania reakcji
- ich działanie można osłabić poprzez zwiększenie stężenia substratu – wtedy cząsteczki substratu
mają większą szansę na wygranie rywalizacji o centrum katalityczne enzymu, bo jest ich więcej
- nie mają wpływu na v
max.
, ale zwiększają K
m
– większe stężenie substratu jest potrzebne do
osiągnięcia szybkości maksymalnej
2. Inhibitory niekompetycyjne.
- przyłączają się do enzymu poza centrum katalitycznym
- zmniejszają zdolność enzymu do przekształcania substratu w produkt, natomiast zwykle nie
wpływają na zdolność enzymu do przyłączania substratu
- zmniejszają v
max.
, ale nie mają wpływu na K
m
, dlatego zwiększenie stężenia substratu nic nie
daje
Regulacja aktywności enzymów:
- wolna:
* regulacja syntezy enzymu – na zasadzie operonu (fragment DNA podlega transkrypcji dopiero,
gdy do nici przyłączy się odpowiedni związek - induktor)
* regulacja degradacji enzymu
* regulacja hormonalna
- szybka:
* modyfikacje kowalencyjne (proteoliza i fosforylacja – mogą być odwracalne lub nieodwracalne)
* modyfikacje allosteryczne (np. sprzężenie zwrotne)
65

WITAMINY
Witamina B
1
(tiamina):
- bierze udział w przemianie węglowodanów
- difosforan tiaminy jest koenzymem dehydrogenaz: pirogronianowej,
α
-ketoglutarowej,
dehydrogenazy ketokwasów o rozgałęzionym łańcuchu (leucyny, izoleucyny i waliny) – ich
produktem jest acetylo-CoA
- difosforan tiaminy jest też koenzymem transketolazy w szlaku pentozofosforanowym – przenosi
aktywną grupę aldehydową
- niedobór tiaminy powoduje:
* chorobę beri-beri (zapalenie nerwów obwodowych, niewydolność serca, obrzęki)
* encefalopatię Wernickiego z psychozą Korsakowa
* kwasicę mleczanową (przy diecie wysokowęglowodanowej – nie można przekształcić
pirogronianu w acetylo-CoA, więc odkłada się mleczan)
- oznacza się ją badając aktywność transketolazy erytrocytów
Witamina B
2
(ryboflawina):
- występuje w mleku
- jest światłoczuła
- jest źródłem mononukleotydu flawinowego (FMN) i dinukleotydu flawinowego (FAD)
- FMN i FAD są koenzymami oksydaz i dehydrogenaz - przenośnikami elektronów w reakcjach
red-ox np. w cyklu Krebsa czy w utlenianiu kwasów tłuszczowych
- jej zawartość można ocenić oznaczając aktywność reduktazy glutationowej erytrocytów
Witamina B
3
(niacyna):
- może być wytwarzana z tryptofanu (czyli jeśli mamy wystarczająco dużo tryptofanu, to w sumie
nie jest witaminą)
- może występować w postaci kwasu nikotynowego lub amidu kwasu nikotynowego
- amid kwasu nikotynowego wchodzi w skład NAD i NADP
- NAD i NADP są koenzymami w reakcjach utleniania i redukcji – przenoszą proton
- NAD jest źródłem ADP-rybozy w procesie ADP-rybozylacji białek podczas naprawy DNA
66

- niedobór niacyny i tryptofanu powoduje pelagrę (światłowrażliwe zapalenie skóry, demencja,
biegunki)
- niedobór niacyny może być spowodowany zarówno zbyt niską podażą, jak i wadami
genetycznymi – zespołem Hartnupa lub zespołem rakowiaka złośliwego
- kwas nikotynowy obniża stężenie cholesterolu w osoczu
- nadmiar niacyny powoduje napadowe rozszerzenie naczyń krwionośnych
Witamina B
6
:
- występuje w postaci pirydoksyny, pirydoksaminy, pirydoksalu oraz ich 5’-fosforanów – aktywny
jest 5’-fosforan pirydoksalu
- fosforan pirydoksalu występuje głównie w mięśniach
- jest koenzymem dla enzymów przekształcających aminokwasy – transaminaz i dekarboksylaz
- jest kofaktorem fosforylazy glikogenowej w procesie glikogenolizy
- przerywa działanie hormonów steroidowych – odłącza kompleks hormon-receptor od DNA
- niedobór witaminy B
6
powoduje:
* zwiększoną wrażliwość na hormony steroidowe – zwiększa ryzyko hormonozależnego raka
piersi, macicy lub prostaty
* zaburzenia przemiany tryptofanu i metioniny
- niedobór może być spowodowany leczeniem izoniazydem
- nadmiar fosforanu pirydoksalu powoduje neuropatię sensoryczną
- jej zawartość oznacza się badając aktywność aminotransferaz w erytrocytach
Witamina B
12
(kobalamina):
- zawiera kobalt w pierścieniu korynowym
- jej źródłem jest pokarm pochodzenia zwierzęcego
- w żołądku jest wiązana z kobalofiliną, która oddziela się od niej w dwunastnicy
- niewydolność zewnątrzwydzielnicza trzustki – brak enzymu hydrolizującego kompleks
kobalofilina-kobalamina – niedobór witaminy B
12
- jest wchłaniana w jelicie, gdy jest związana z czynnikiem wewnętrznym – niedobór czynnika
wewnętrznego powoduje niedobór witaminy B
12
67

- jest magazynowana w wątrobie jako: hydroksykobalamina (nieaktywna), metylokobalamina i
adenozylokobalamina (aktywne)
- niedobór witaminy B
12
powoduje złośliwą niedokrwistość megaloblastyczną
- od witaminy B
12
zależy aktywność 3 enzymów:
* mutazy metylomalonylo-CoA – w glukoneogenezie, katabolizmie waliny, izoleucyny,
cholesterolu i propionylo-CoA (czyli też kwasów tłuszczowych o nieparzystej liczbie atomów
węgla)
* aminomutazy leucynowej
* syntazy metioninowej – w reakcji metylacji homocysteiny przez metylotetrahydrofolian
(regeneracja S-adenozylometioniny) – jeśli ta reakcja jest zablokowana z powodu niedoboru
witaminy B
12
, to mamy do czynienia z „pułapką folianową” - gromadzeniem się
metylotetrahydrofolianu, którego nie można wykorzystać, bo syntaza metioninowa nie działa
- jej zawartość w osoczu mierzy się oznaczając ilość kwasu metylomalonylowego w moczu
Kwas foliowy:
- jego aktywną postacią jest tetrahydrofolian
- tetrahydrofolian może mieć grupę jednowęglową (np. metylową) przyłączoną do atomu N
5
, N
10
lub do obydwu jednocześnie jako coś na kształt mostu (w Harperze jest ładnie narysowane)
- 5-formylotetrahydrofolian (kwas folinowy/leukoworyna) – lek przeciwnowotworowy, często
łączony z 5-fluorouracylem – umożliwia syntezę DNA w wypadku zastosowania metotreksatu
- tetrahydrofolian jest przenośnikiem grup jednowęglowych w procesach syntezy puryn i
powstawania tyminy – jest przekształcany do dihydrofolianu, który jest regenerowany przez
reduktazę dihydrofolianową
- metotreksat (analog 10-metylotetrahydrofolianu) hamuje reduktazę dihydrofolianową –
uniemożliwia syntezę DNA, dlatego jest lekiem przeciwnowotworowym
- trimetoprim – lek przeciwbakteryjny – blokuje reduktazę dihydrofolianową u bakterii
- pyrimetamina – lek przeciwmalaryczny – też blokuje reduktazę dihydrofolianową
- niedobór folianów powoduje niedokrwistość megaloblastyczną
- prawidłowa suplementacja kwasem foliowym zmniejsza ryzyko miażdżycy, zmian zakrzepowych
i nadciśnienia tętniczego, a prowadzona przez rodziców przed poczęciem dziecka zmniejsza
prawdopodobieństwo wystąpienia defektów cewy nerwowej (np. rozszczepu kręgosłupa)
Biotyna:
68

- wytwarzana przez florę bakteryjną jelit
- wiązana przez awidynę – białko występujące w jajkach – dlatego jedzenie dużej ilości surowych
jaj może powodować niedobór biotyny
- występuje w 3 formach: biotyna, biocytyna, karboksybiocytyna
- jest koenzymem karboksylaz – jest przenośnikiem CO2, wiąże się z resztą lizynową apoenzymu
- uczestniczy w regulacji cyklu komórkowego – stymuluje kluczowe jego białka
- niedobór biotyny – depresja, halucynacje, bóle mięśniowe, zapalenie skóry
Kwas pantotenowy:
- jest składnikiem koenzymu A – bierze udział w cyklu Krebsa, β-oksydacji kwasów tłuszczowych,
syntezie cholesterolu i reakcjach acetylacji
- jest składnikiem białka przenoszącego reszty acylowe (ACP) – bierze udział w syntezie kwasów
tłuszczowych
Witamina C (kwas askorbinowy/dehydroaskorbinowy):
- ma właściwości redukujące, dlatego niszczy wolne rodniki (jest przeciwutleniaczem)
- jest koenzymem dla :
* β-hydroksylazy dopaminowej – w syntezie noradrenaliny i adrenaliny (enzym zawierający
miedź)
* hydroksylazy peptydoglicynowej – w procesie tworzenia grupy amidowej z końcowej reszty
glicynowej w białkach (enzym zawierający miedź)
* wielu hydroksylaz zawierających żelazo (np. hydroksylaz prolinowej i lizynowej w syntezie
kolagenu)
- niedobór witaminy C powoduje szkorbut – upośledzoną syntezę kolagenu
KOENZYMY
Dinukleotyd niotynoamidoadeninowy (NAD):
- zawiera amid kwasu nikotynowego (witaminę B
3
)
- może być przenośnikiem protonów lub elektronów
69

- jest utleniany w kompleksie I łańcucha oddechowego
Fosforan dinukleotydu nikonynoamidoadeninowego (NADP):
- zawiera amid kwasu nikotynowego (witaminę B
3
)
- może być przenośnikiem protonów lub elektronów
- jest redukowany w szlaku pentozofosforanowym
- jest wykorzystywany w biosyntezie kwasów tłuszczowych i cholesterolu (w formie
zredukowanej)
Mononukleotyd flawinowy (FMN):
- powstaje z ryboflawiny (witaminy B
2
)
- jest grupą prostetyczną niektórych oksydaz (np. oksydazy aminokwasowej)
Dinukleotyd flawinoadeninowy (FAD):
- zawiera ryboflawinę (witaminę B
2
)
- może być przenośnikiem protonów lub elektronów
- bierze udział w cyklu kwasu cytrynowego (reakcja: bursztynian -> fumaran)
S-adenozylometionina:
- jest donorem grupy metylowej w procesach metylacji
Koenzym A:
- jest zbudowany z: cysteaminy, kwasu pantotenowego i 3'-β-fosforanu ADP
- jest przenośnikiem grup acylowych
- bierze udział w biosyntezie kwasów tłuszczowych i cholesterolu, β-oksydacji kwasów
tłuszczowych, cyklu kwasu cytrynowego
3'-fosfoadenozyno-5'-fosfosiarczan (PAPS):
- nazywany „aktywnym siarczanem”
70

- jest donorem grupy siarczanowej np. w procesie biosyntezy cysteiny
71

HORMONY PRZYSADKI
Dzielą się na 3 grupy:
1. Hormony białkowe.
A. Hormon wzrostu (GH).
- zwiększa syntezę białka w mięśniach, pobieranie aminokwasów przez mięśnie, proliferację
komórek mięśniowych – ogólnie jest dobry na bajceps :)
- zmniejsza katabolizm aminokwasów i stężenie mocznika we krwi
- zwiększa lipolizę, hamuje lipogenezę
- zwiększa glkogenolizę i glukoneogenezę
- indukuje produkcję IGF – I, który odpowiada za wzrost kośći na długość i wzrost apozycyjny
- daje też podobny efekt do prolaktyny
- jest produkowany przez komórki kwasochłonne przedniego płata przysadki
- jego synteza jest regulowana przez podwzgórze przy pomocy liberyn i statyn
- u różnych gatunków jest podobny, ale u nas działa tylko ten od naczelnych
Karłowatość z niedoboru GH – niskie stężenie wszystkich 3 czynników (GH, IGF-I, IGF-II) –
dodatnia reakcja na podanie egzogennego GH.
Pigmeje – niedobór tylko IGF-I – defekt wytwarzania IGF-I – ujemna reakcja na podanie
egzogennego GH.
Karłowatość typu Larona – defekt receptorów dla GH w wątrobie – dużo GH, mało IGF-I i IGF-II –
ujemna reakcja na podanie egzogennego GH.
Nadmiar GH:
- spowodowany przez gruczolaki przedniego płata przysadki
- przed zamknięciem nasad kości długich – gigantyzm
- po zamknięciu nasad kości długich – akromegalia
- powoduje też zwiększenie poziomu glukozy we krwi i zwiększoną ketogenezę
B. Prolaktyna (PRL).
- produkowana przez przedni płat przysadki
- hamowana przez prolaktostatynę
- inicjuje i utrzymuje laktację
- guzy przysadki – nadmiar prolaktyny – mlekotok (u kobiet), ginekomastia i impotencja (u
mężczyzn)
C. Somatomammotropina kosmówkowa (CS).
- produkowana przez syncytium łożyska
- funkcja podobna do hormonu wzrostu
2. Hormony glikoproteinowe.
- zbudowane z 2 podjednostek: α – wspólnej dla wszystkich hormonów i β – decydującej o
72

aktywności biologicznej hormonu.
- łączą się z receptorem i powodują syntezę cAMP
A. Folitropina (FSH).
- pobudza dojrzewanie pęcherzyków Graafa
- zwiększa produkcję estrogenów
- wydzielanie zwiększa się pod wpływem folikuloliberyny (FSH-RH)
- hamowana przez sprzężenie zwrotne ujemne
B. Lutropina (LH).
- zwiększa syntezę testosteronu
- odpowiada za owulację
- odpowiada za przekształcenie komórek ziarnistych w komórki luteinowe, które wytwarzają
progesteron
- odpowiada za przekształcenie komórek warstwy wewnętrznej pęcherzyka w komórki
paraluteinowe, które produkują estrogeny
- podtrzymuje produkcję estrogenów i progesteronu przez ciałko żółte
- wydzielanie jest zwiększane przez gonadotropinę (GnRH)
- niedobór może być spowodowany niedoczynnością tarczycy
C. Gonadotropina kosmówkowa (hCG).
- produkowana przez syncytiotrofoblast łożyska
- funkcje podobne do LH
- utrzymuje funkcje ciałka żółtego
D. Tyreotropina (TSH).
- wiąże się z receptorem błonowym i indukuje syntezę cAMP, co aktywuje wszystkie etapy syntezy
hormonów tarczycy
- powoduje zwiększenie masy tarczycy
- pobudzana przez tyreoliberynę (TRH), stres, zimno
- hamowana przez sprzężenie zwrotne, dopaminę i somatostatynę
3. Peptydy rodziny proopiomelanokortyny (POMC).
- POMC dzieli się w pośrednim płacie przysadki na ACTH, β-lipotropinę (β-LPH) i N-koniec, z
którego powstaje γ-MSH.
- ACTH może rozpaść się na α-MSH i CLIP.
- Z β-LPH powstają β-MSH i β-endorfina.
- β-endorfina jest skracana do pochodnych, które nie mają właściwości opioidowych.
- To wszystko może zachodzić także w przewodzie pokarmowym, łożysku i narządach płciowych
męskich.
A. Kortykotropina (ACTH).
- działa na komórki kory nadnerczy
- wiąże się z receptorem i aktywuje cyklazę adanylanową – pobudza produkcję cAMP
- cAMP indukuje przemiany cholesterolu do kortyzolu i DHEA
B. β-lipotropina (β-LPH).
- pobudza lipolizę
- uwalnia WKT z tkanki tłuszczowej
- powstaje z karboksylowej części prekursora
73

C. Endorfiny.
- regulują odczuwanie bólu poprzez działanie na receptory morfinowe (działają o wiele silniej od
morfiny)
- są acetylowane w pośrednim płacie przysadki, ale powstają gdzie indziej
D. Melanotropina (MSH).
- odpowiada za rozproszenie zianistości melaniny, czyli za kolor skóry
- nadmiar w chorobie Addisona – powoduje przebarwienia
4. Hormony tylnego płata przysadki.
- produkowane przez podwzgórze, uwalniane przez przysadkę
- transportowane dzięki neurofizynom – omijają barierę krew - mózg
- mają wiązanie cykliczne – 2 cysteiny połączone wiązaniem dwusiarczkowym
A. Wazopresyna (ADH).
- produkowana w jądrze nadwzrokowym podwzgórza
- zwiększa wchłanianie zwrotne wody w cewkach zbiorczych poprzez wbudowywanie w nie
akwaporyn – działanie przez receptor V2
- powoduje skurcz naczyń krwionośnych, działając na receptory V1 (pobudza fosfolipazę C)
- powoduje wzrost ciśnienia tętniczego
- wydzielana pod wpływem zwiększenia osmolarności osocza – przywraca prawidłową
osmolarność
- receptory V2 (w nerkach) działają przez cAMP
- receptory V1 (wszędzie indziej) działają przez IP
3
(trifosforan inozytolu)
- sekrecja jest blokowana przez alkohol
- niedobór – moczówka prosta:
* zaburzenia syntezy/ sekrecji
* nerkowopochodna – brak receptorów dla ADH – może być powodowany przez sole litu,
wykorzystywane w leczeniu psychozy maniakalno – depresyjnej
B. Oksytocyna.
- produkowana w jądrze przykomorowym podwzgórza
- wydzielana pod wpływem rozszerzenia macicy w trakcie porodu i pod wpływem drażnienia
gruczołów sutkowych
- powoduje skurcz mięśni gładkich macicy – przyspieszenie porodu i skurcz komórek nabłonkowo
– mięśniowych otaczających pęcherzyki w gruczole sutkowym – wydzielanie mleka
- ilość receptorów dla oksytocyny zwiększa się pod wpływem estrogenów, a zmniejsza pod
wpływem progesteronu
GOSPODARKA WAPNIOWA
47% w formie zjonizowanej – najbardziej aktywne
47% związane z albuminami
6% związane z anionami cytrynianowymi i fosforanowymi
Parathormon (PTH):
W siataczce śródplazmatycznej szorstkiej odcinana jest sekwencja sygnalna, w aparacie Golgiego –
sekwencja pro – i mamy parathormon.
74

Synteza PTH jest stała – regulujemy sekrecję. Nadmiar Ca
2+
zwiększa degradację PTH i przez to
jest go mniej. Ogólnie ok. 80-90% PTH jest degradowane i w tym przedziale zachodzi regulacja.
Z kolei spadek stężenia Ca
2+
powoduje wzrost stężenia cAMP, który zmniejsza degradację PTH.
PTH działa przez cyklazę adenylanową.
PTH oddziaływuje na nerki – powoduje dojrzewanie kalcytriolu.
PTH zmniejsza wydalanie Ca
2+
z moczem, za to zwiększa wydalanie PO
4
3-
.
75
Wyszukiwarka
Podobne podstrony:
proj sygnalizacja by JJ id 3975 Nieznany
notatki inż ruchu by JJ
MK proj by JJ
BIOCHEMIA cw.2 made by Tomek - białka, biochemia
proj sygnalizacja by JJ id 3975 Nieznany
biochemia pytania z forum by ściech
Some tips on drying foods at home By Jj Fallick
BIOCHEMIA II termin egzaminu 06 i 07 LEK i STOMA by KaMilka
zgapa egzam JJ by Chickas
biochem k2 by sweeet, biochemia koła
Egzamin biochemia - stomatologia 2009 - I termin by ja, BIOCHEMIA
Confocal optics microscopy for biochemical and cellular high throughput screening by Lenka Zemanová,
11 BIOCHEMIA horyzontalny transfer genów
Biochemia z biofizyką Seminarium 2
więcej podobnych podstron