Jaka grupa w chymotrypsynie powoduje katalizę
Za katalize w chymotrypsynie jest odpoweidzialna tzw. TRIADA KATALITYCZNA. Traida ta zbudowana jest z łańcucha bocznego SER195 połączonej z pierścieniem imidazolowym HIS57, zaś grupa NH pierścienia imidazolowego połączona jest z grupą karboksylową ASN102.
Centrum reaktywnym triady jest reszta SER195[tzw. reaktywna grupa seryny],a na aktywność tej części mają wpływ:
reszta HIS [działa jako uniwersalny katalizator zasadowy - akceptor protonów], która umożlwia odpowiednie ułożenie się łańcucha SER poprzez polaryzjację jej grupy -OH [spolaryzowana SER gr.-OH ulega deprotononacji - powstający jon alkoholanowy jest silnym nukleofilem!]
reszta ASN, która zapewnia odpowiednią orientację reszt HIS, co poprawia jej działanie jako akceptora protonów
Reakcja katalizowana ta grupą biegnie w 2 etapach:
ETAP A: reaktywna grupa OH atakuje grupę karbonylową substratu [S] tworząc intermediat
ETAP B: intermediat jest hydrolizowany ale jego tworzenie jeszcze nie zachodzi.
Co łączy karbopeptydaze, trypsyne i subtilizyne--proteazy
są enzymami hydrolitycznymi posiadającymi triady katalityczne [różne]
KARBOKSYPEPTYDAZA - aktywny postać zymogenu trzustki prokarboksypeptydazy;
enzym z klasy hydrolaz rozszczepiających wiązanie peptydowe w białkach; karboksypeptydazy są egzopeptydazami działającymi na karboksylowy koniec łańcucha peptydowego; biorą udział w procesach trawienia białka w jelicie cienkim; używany do badania sekwencji białek
TRYPSYNA - jeden z enzymów proteolitycznych soku trzustkowego enzym o dużej specyficzności substatowej należący do rodziny enzymów proteaz [rozcinają wiązania peptydowe w białakch] serynowych; endopeptydaza; masa cząsteczkowa 24 000, łańcuch zbudowany z 223 reszt aminokwasowych; hydrolizuje specyficznie wiązania peptydowe, amidowe i estrowe utworzone przez grupy karboksylowe reszt argininy i lizyny (optymalna aktywność przy pH ok. 8,0); u ssaków powstaje w jelicie z wydzielanego przez komórki trzustki nieczynnego trypsynogenu; stosowana w lecznictwie w niektórych schorzeniach przewodu pokarmowego, także do badania sekwencji białek
SUBTILIZYNA- jest enzymem proteolitycznym [proteaza serynowa], z bakterii Bacillus subtilis lub B.amyloliquefacenis; miejsce aktywne tego enzymu zawiera triade katalityczną [nieco swoistą] oraz dziurę oksyanionową; dzięki badaniom tego enzymu wyrożniono nową grupę proteaz ;)
Co powoduje nukleofil w proteazie cysteinowej, aspartylowej i metaloproteazie:
Nukleofil w tych enzymach proteolitycznych atakuje wiązanie peptydowe [dokładniej grupę karbonylową tego wiązania] < taka jest strategia ich działania.
Rolę nukelofia pełnią:
/PROTEAZY CYSTEINOWE/ reszta CYS aktywowana resztą HIS
/PROTEAZY ASPARTYLOWE/ pareę reszt ASP oddziałujących ze sobą, co aktywuje cząsteczkę wody do ataku na wiązanie pep.
METALOPROTEAZY - w miejscu aktywnym [MA] aktywujący cząsteczkę wody jon metalu
Co powoduje anhydraza weglanowa
Enzym ten (EC 4.2.1.1) katalizująca odwracalnie reakcję uwodnienia dwutlenku węgla: CO2 + H2O <=> H+ + HCO3- ; występuje powszechnie w organizmach, szczególnie w erytrocytach i tkance mięśniowej, w skrzelach ryb, a także u roślin, np. u glonów; uczestniczy w transporcie dwutlenku węgla; inhibitorami a.w. są m.in. cyjanki.
Jest jednym z najszybciej działających enzymów, przyspieszającym reakcję 106 raza.
Co powoduje karbaminotransferaza asparaginowa
Karboamoilotransferaza asparaginowa katalizuje pierwszy etap biosyntezy pirymidyn. Reakcja katalizowana przez ten enzym polega na kondensacji ASN i karbamoilofosforanu, w wyniku czego powstaje N-karbamoiloasparaginian i ortofosforan.
Co może być kofaktorem
KOFAKTOR jest mała jednostką niebiałkową enzymu wymagana do jego prawidłowego działania. Kofaktorami może być jeden lub więcej jonów nieorganicznych, np. Zn2+ lub Fe2+,
lub złożona cząsteczką organiczna, zwana juzż KOENZYMEM. Taki metal lub koenzym, kowalencyjnie związany z enzymem nazywa się grupą prostetyczną.
wykres dla michaelisa menten i dla nie spełniających tego modelu
Kinetykę enzymów opisuje wzór i wykres Michaelisa-Menten ..i pewnie jest gdzieś w tych sjadach;)
Ogołnie model Michalelisa-Menten opiera się na koncepcji katalizy enzymatycznej: ![]()
Enzym wiąże się z substratem tworząc kompleks przejściowy ES, który może dysocjować spowrotem do E+S lub przekształcać się w sam E i produkt P. Stałe szybkości k1,k2,k3 opisują szybkość przebiegu każdego z tych etapów itd...
Obserwacje M-M odprowadziły do wyprowadzenia równania Michaelisa-Menten;
![]()
<< równanie to opisuje krzywą hiperboliczną !
Zasadom kinetyki Michalelisa- Menten nie podlegają enzymy allosteryczne - dla nich krzywa szybkości ma zależność sigmoidalną.
ATCaza—regulacja allosteryczna, krzywa sigmoidalna
teoria dopasowania indukowanego
Model dopasowania indukowanego wyjaśnia jak E może wiązać swój S i został zaproponowany w 1958 roku przez Daniela E. Koshlanda Jr ;). Związanie S indukuje zmianę konformacyjną w miejscu aktywnym [MA] enzymu. Poza tym E może zniekształcić S wymuszając w nim konformację podobną do stanu przejściowego.
Na przykład związanie glukozy z heksokinazą indukuje taką konformacyjną zmianę w str. E, że jego MA przyjmuje kształt komplementarny do S [glukozy] tylko po związaniu z E.
co oznacza gdy kkat/Km jest duże
Stosunek kkat/Km wyraża stosunek szybkości oddziaływania S i E - jest miarą wydajności katalitycznej.
Gdy jest duży świadczy o perfekcji kinetycznej [rzędu 10^8-10^10 1/sM], tzn. ze każde spotkanie E z S jest produktywne, a szybkość katalityczną ogranicza jedynie szybkość spotykania się s i E.
Perfekcja kinetyczna char. m.in. dysmutazę ponadtlenkową, estereazę acetylocholonową i izomerazę triozofosforanową
! duża wartość Km wskazuje na słabe wiązanie S [k2 przeważa nad k1], mała wartość Km wskazuje silne wiązanie S [k1 przeważa nad k2]
CIEKAWOSTKA :) występuje tzw. EFEKT KIRKE tzn przyciągające S do MA siły elektrostatyczne
reakcje z wieloma substratami i produktami << `precyzja' pytania może mieć wpływ na nieprecyzyjność odpowiedzi
większość r-cji biochemicznych dotyczy kilku substratów
![]()
< r-cja dwusubstratowa z dwoma produktami
Reakcje z kilkoma S mogą zachodzić wg dwóch modeli:
A: PRZENIESIENIA SEKWENCYJNEGO - przed uwolnieniem jakiegokolwiek produktu wszystkie substraty wiążą się z E, powstaje KOMPLEKS TRÓJSKŁADNIKOWY E z 2ma S.
Występują dwa mechanizmy sekwencyjne:
uporządkowany [określona sekwencja wiązania E-S], np. NAD+ lub NADH, dehydrogenaza mleczanowa; opisany diagramem Wallence'a CLELANDA [s.207 podr.]
przypadkowy [sekwencyjna kolejność lączenia S i uwalniania P jest przypadkowa] np. kinaza kreatynowa, opisany diagramem CLELANDA
B. PODWÓJNEGO PRZENIESIENIA [PING-PONG] jeden lub więcej produktów jest uwalnianych przed związaniem S z E /istnieje pośrednia forma E z podstawioną grupą/; np. przenoszenie gr.aminowej pomiędzy aminokwasami i ketokwasami [kat. przez aminotransferazę ASN]; opisywany diagramem CLELANDA [S wydaje się uderzać i odbijać od E]
Jaka inhibicja może być odwracalna
Inhibicja odwracalna [możliwa dysocjacja kompleksu EI] to inaczej inhibicja kompetencyjna, tzn. że E może wiązać S [ES] lub I [EI], lecz nie powstaje kompleks ESI. Inhibitor kompetencyjny jest podobny do S, wnika w MA. Można go przezwyciężyć poprzez zwiększenie stężęnia substratu [S]; np. metotreksat
Jak hamowana jest chymotrypsyna
Chymotrypsyna może być hamowana poprzez działanie na nią inhibitorem nieodwracalnym DIPF [diizopropylofluorofosoran], który modyfikuje resztę SER195, co prowadzi do zaniku aktywności enzymatycznej .
Funkcje węglowodanów
Węglowodany spełniają w organizmach następujące funkcje:
Ważne funkcje w funkcjonowaniu organizmów spełniają także pochodne węglowodanów.
Cykliczne formy fruktozy i glukozy
D - Glukoza D - Fruktoza
Glukoza i fruktoza w postaci cyklicznej:
Obie formy, cykliczna i łańcuchowa występują obok siebie w równowadze i w roztworach mają zdolność przechodzenia jedna w drugą.
Podać 5 przykładów oligo i polisacharydów
OLIGOSACHARYDY - krótkie łańcuchy monosacharydów połaczonych wiązaniami glikozydowymi. W przypadku oligosacharydów zw. z białkami [glikoproteiny] lub lipidami [glikolipidy], nie składają się z powtarzających się jednostek, lecz zawierają wiele rozmaitych monosacharydów połaczonych różnego typu wiązanimi.
Dwa główne typy glikoprotein oligosacharydowych:
związanie O-glikozydowo - przyłaczone do białka przez wiąż. O-glikozydowe utworzone pomiędzy gr. OH łańcuchów bocznych SER i TRE
zw. N-glikozydowo, przyłączone przez wiązania N-glikozydoweutw. z grupami NH2 łańcuchów bocznych ASN ...
Np. GLIKOZAMINOGLIKANY - anionowe łańcuchy polisach. utworzone przez powtarzające się jednostki dwucukreowe:
6-siarczan chondroityny
siarczan keratanu
heparyna
sarczan dermatanu
kwas hialuronowy
oligo---rafinoza,celibioza
POLISACHARYDY - długie łańcuchy połaczonych jednostek cukrowych. W zależności od polisacharydu łańcuchy mogą być liniowe lub rozgałęzione.
Przykłady:
glikogen - forma magazynowa [duży rozgałężiony polimer]nadmiaru glukozy u zwierząt
skrobia -forma zapasowa roślin
dekstran - forma zapasowa u bakterii
celuloza
chityna,inulina,pektyny,agar-agar
Jaką funkcję spełniają glikozaminoglikany
Glikozaminoglikany sa anionowymi łańcuchami polisacharydowymi utworzonymi przez powtarzające się jednostki dwucukrowe [zawierają pochodną aminocukru: glikozaminę lub galaktozaminę], występują na powierzchni komórek i zewnątrzkomórkowej substancji postawowej organizmów zwierzęcych. Przynajmniej jeden z cukrów w powtarzającej się jednostce disacharydu ma ujemnie naładowaną grupę karboksylową bądź siarczanową.
Glikozaminoglikany są zwykle przyłączone do białek tworząc PROTEOGLIKANY , np:
heparyna - zapobiega krzepnięciu krwi
proteoglikany [95% masy to węglowodany] zmniejszają tarcie ze środowiskiem zewnętrznym komórek, działają jako składniki strukturalne w tkance łącznej [wspomagają adhezję]; wiążą skladniki stymulujące proliferację komórek.
Jaka glikozylacja zachodzi w retikulum endoplazmatycznym
W świetle ER [i AG] zachodzi glikozylacja białek, a więc w organellach biorących udział w syntezie, obróbce i kierowaniu białek do miejsc docelowych.
Przykłady glikoprotein:
* ELASTAZA - enzym proteolityczny wydz. przez trzustkę w postaci zymogenu; zsyntet. na rybosomach przył. do cytoplazmatycznej części ER. Rosnący łańcuch peptydowy jest wprow. do światła ER [odp.za to 29aminokwas. sekw. sygnałowa na N końcu pep., odcinana po wejściu do ER], gdzie zaczyna się proces glikozylacji >> przyłaczanie węglowodanów wiązaniami N-glikozydowymi rozpoczyna się w ER [i jest kontynuowany w AG, gdzie zachodzi też przył. eglowodanów wiązaniami O-glikozydowymi].
Co to są lizosomy
LIZOSOMY - otoczone pojedynczą błoną są organellami komórek zwierzęcych [tylko!!] . Ich wnętrze jest kwaśne [pH 4-5] dzięki działaniu w błonie pompy białkowej wprowadzającej jony H+. Wewnątrz lizosomów znajdują się hydrolazy kwaśne [nieaktywne w obojętnym pH cytozolu i płynu międzykomórkowego]- enzymy czynne podczas degradacji makrocząsteczek, w tym wchłoniętych w drodze endocytozy, makrocząsteczekdo ich monomerycznych podjednostek:
proteazy - degradują białka
lipazy - degradują lipidy
fosfatazy -usuwają gr fosforanowe z nukleotydów i fosfolipidów
nukleazy - degradują DNA i RNA
Co to jest 6-fosforan mannozy—marker białek-enzymów hydrolitycznych kierowanych do lizosomów
Co jest siłą napędową tworzenia podwójnej warstwy błony
21. Jakie alkohole wchodzą w skład lipidów błonowych
22. Ile razy enzym przyspiesza reakcje, co hamuje powstawanie ....(chodzi o szybkość powstawania [ES];
Tempo przebiegu reakcji katalizowanej przez E to szybkość reakcji. Szybkość działania E podaje się zazwyczaj w czasie zerowym, ponieważ jest wtędy największa, ponieważ:
- nie wyst. hamowanie przez sprzężenie zwrotne - brak produktu, reakcja nie przebiega w kierunku odwrotnym
>> patrz odp. na pyt. 9
> stosunek dodziaływania ES nie może być większy niż szybkość [częśtość] dyfuzji, z jaką spotykają się E i S na skutek dyfuzji [k1 < 10^8 -10^9 1/sM]
23. Wymienić typy enzymów
ZE WZGLĘDU NA DZIAŁANIE enzymy podzielono na trzy grupy:
1. hydrolazy, które powodują rozkład złożonych substancji na prostsze, przy czym zostaje przyłączona woda. Do tej grupy należą proteazy, czyli enzymy proteolityczne rozszczepiające białka, lipazy czyli enzymy lipolityczne rozkładające tłuszcze, ureazy rozkładające mocznik na amoniak i dwutlenek węgla;
2. dehydrazy odszczepiające wodór, co ma podstawowe znaczenie dla procesów oddychania i fermentacji;
3. desmolazy powodujące przerwanie tzw. łańcuchów węglowych, czyli połączeń między atomami węgla w jednej cząsteczce.
Do obu ostatnich grup należą enzymy oddechowe, szczególnie ważne w procesie przemiany materii. Materiał ulegający w organizmie utlenianiu i dostarczający mu w tym procesie energii, np. cukier, nie spala się w ustroju bezpośrednio na dwutlenek węgla i wodę, lecz przechodzi przez szereg reakcji, w których pośredniczą coraz inne enzymy, np. dehydraza, oksydaza itd.
Enzymy umożliwiają trawienie - proces fizjologiczny występujący u istot cudzożywnych, polegający na rozkładaniu złożonych wielkich cząsteczek (białek, tłuszczy, węglowodanów) na elementy prostsze. Rozbijanie to odbywa się za pomocą enzymów wytwarzanych przez odżywiający się organizm.
Odpowiednio do typu związków pokarmowych, odróżnia się:
enzymy proteolityczne - rozszczepiające białka,
enzymy amylolityczne - rozkładające skrobię i wiele innych węglowodanów oraz
enzymy lipolityczne - działające na tłuszcze.
Zazwyczaj w organizmie występuje po kilka enzymów z każdej grupy, czynnych w różnych odczynach środowiska, co gwarantuje bardzo dokładny rozkład określonego związku.
Klasyfikacja enzymów wg. EC [Enzyme Commision]
Klasa |
NAZWA |
TYP katalizowanej reakcji |
przykład |
1 |
oksydoreduktazy |
przenoszenie e |
dehydrogenaza alkoholowa |
2 |
transferazy |
przenoszenie gr.funkcyjnych |
heksokinaza |
3 |
hydrolazy |
reakcje hydrolizy |
trypsyna |
4 |
liazy |
rozszczepienie wiazan CC,CO,CN i in., tworzenie wiaz. C=C |
dekarboksylaza pirogronianowa |
5 |
izomerazy |
przen.gr, w obrębie cząsteczki |
izomeraza malenianowa |
6 |
ligazy /syntetazy |
tworzenie wiązań sprzężonych z hydrolizą ATP |
karboksylaza pirogronianowa |
24. Wymienić trzy enzymy i co je katalizuje
UREAZA - katalizuje hydrolizę mocznika
FRUKTOZO-1,6-BISFOSFATAZA - hydrlizuje fruktozo-1,6-bisfosforan
ptyalina w ślinie - rozkłada skrobię na glikozę działając w środowisku zasadowym,
pepsyna w soku żołądkowym - rozkłada białka na albumozy i peptony działając w środowisku kwaśnym w skutek obecności kwasu solnego,
trypsyna w dwunastnicy rozkłada cząsteczki białek na aminokwasy w środowisku zasadowym,
lipaza rozszczepia tłuszcze na glicerynę i kwasy tłuszczowe,
amylaza podejmuje działalność ptyaliny,
enzym białkowy - erypsyna w jelicie cienkim (gdzie następuje wchłanianie), rozkłada albumozy i peptony (kontynuacja działalności pepsyny)
25. Co to jest PALA i z czego jest zbudowane
PALA [N-fosforoacetylo-L-asparaginian] - silny inhibior ACTazy; analog dwusubstratowy, przypomina produkt pośredni powstający w trakcie reakcji
26. Struktura beta kartki - jak wygląda? << jest w slajdach...
uzupełnienie...
BETA KARTKA jest strukura II rzedową białek.. Termin "struktura drugorzędowa" określa wzajemne, przestrzenne ułożenie aminokwasów w łańcuchu białkowym o określonej sekwencji. Badania prowadzone metodami rentgenowskimi udowodniły, że nie wszystkie możliwe struktury łańcucha białkowego są jednakowo cenne pod wzgledem trwałości.
Najtrwalsze muszą zawierać maksymalną liczbę wiązań wodorowych między grupami karbonylowymi -C=O i grupami -N-H występującymi w wiązaniu peptydowym. Wiązania wodorowe będą silnie stabilizować strukturę, jednakże aby mogły powstać, odpowiednie grupy muszą znaleźć się w odległości oddziaływań wodorowych.
W przypadku białek z grupy skleroproteidów trwała struktura osiągana jest dzięki oddziaływaniom wodorowym między dwoma łańcuchami białkowymi biegnącymi równolegle do siebie. Tworzą one wtedy tzw. strukturę "pofałdowanej kartki (harmonijki)". Taka struktura nazywana jest również strukturą beta.
To pofałdowanie powstaje w wyniku ściągnięcia łańcuchów peptydowych, przez co zmienia się geometria wiązania peptydowego aminokwasu z płaskiej na pofałdowaną (rysunek 13.4). Uzykujemy wtedy bardziej korzystną strukture do rozmieszczenia małych lub średnich łańcuchów bocznych.
Na rysunku 13.4 przedstawiono płaskie wiązanie peptydowe w kolorze czarnym, natomiast kolorem różowym efekt ściągnięcia łańcuchów peptydowych w strukturze beta.
Zmiana geometrii wiązania peptydowego podczas tworzenia strubtury beta
Na rysunku 13.5 przedstawiono pełny obraz struktury harmonijkowej (beta). W tej strukturze każdy łańcuch jest połączony z innymi łańcuchami wiązaniem wodorowym (=O -- H-). Na rysunku wiązanie wodorowe zaznaczone jest kolorem różowym.
Struktura harmonijkowa (struktura beta). Ściągnięte łańcuchy stwarzają miejsce dla małych łańcuchów bocznych; sąsiednie łańcuchy są rozwinięte w przeciwnych kierunkach
Struktura pofałdowana jest korzystna dla białek w których łańcuchy boczne są małe
27. Co to są analogi substratów
ANALOGI SUBSTRATÓW - znaczniki powinowacta [affinity labels] są cząsteczkami strukturalnie podobnymi do substratów enzymów, które kowalencyjnie modyfikują reszty w MA enzymu. Są zatem bardziej specyficzne w stos do MA niż związki reagujące ze specyficznymi grupami.
np. analog substratowy dla chymotrypsyny --> keton chlorometylowy tosylo-L-fenyloalaniny TPCK
28. Podstawienie sekwencyjne i podwójne
29. Podział enzymów na grupy
patrz. pyt #23
30. Jak substrat wiąże się w miejscu aktywnym enzymu
w wiązaniu S z E bierze udział wiele słabych oddziaływań:
oddziaływania elektrostatyczne
wiązania wodorowe
siły van der Waalsa
interakcje hydrofobowe
KES ~ 10^-2 - 10^-8 >> Δ G 50 kJ/mol
Ponadto wiązanie E i S w MA może zajść wg dwóch modeli:
zamka i klucza -zaproponowany przez E.Fischera w 1894 r. - kształt S i MA pasują do siebie jak klucz do zamka, a oba kształty są uważane za sztywne i pasują do siebie idealnie po odpowiednim zestawieniu
model indukowanego dopasowania --> patrz pyt. 8
31. Gdzie znajdują się glikoproteiny w komórce
na zawnątrzkomórkowej powierzchni błony komórkowej [cukrowe reszty związane z hydroksylową grupą SER lub THR tworząc oligosacharydy powiązane w. O-glikozydowym, albo z grupą aminową przył. w. N-glikozydowym ...] >> tworzą płaszcz ochronny na powierzchni komórki i biorą udział w rozznawaniu się komórek
32. Witaminy rozpuszczalne w tłuszczach
Witamina A - ritinol jest grupą związków o działaniu wzrostowym i przeciwinfekcyjnym.
Pobudza tworzenie się nowych komórek i tkanek, utrzymuje skórę i błony śluzowe w prawidłowym stanie, jest niezbędna do prawidłowego funkcjonowania wzroku, bierze udział w syntezie hormonów i enzymów.
Niedobór objawia się zmianami na skórze i w oczach oraz zahamowaniem wzrostu, światłowstrętem i ślepotą zmierzchową, skłonnością do infekcji i paradontozy.
Brak przejawia się całkowitym wyschnięciem rogówki ocznej, jej rozmiękczeniem, co upośledza wzrok, aż do jego całkowitej utraty.
Witamina D - kalcyferol zapobiega krzywicy.
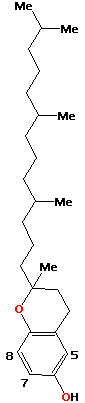
Jest niezbędna w gospodarce wapniowo-fosforowej organizmu, konieczna do odbudowy kośca, wzmagając wchłanianie wapnia.
Brak wiedzie do cieżkiej choroby - krzywicy.
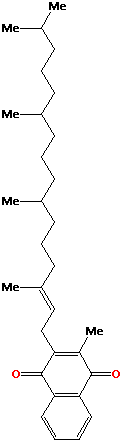
<<<<Witamina E - tokoferol to grupa związków, mających wpływ na rozrodczość i prawidłową funkcję mięśni.
Zapobiegając ich degeneracji, zapobiega też martwicy wątroby.
Pełniąc rolę wewnątrzkomórkowego przeciwutleniacza zapobiega miażdżycy i chorobom nowotworowym. Chroni nienasycone kwasy tłuszczowe i witaminę A przed utlenianiem, chroni błonę krwinek czerwonych i ściany naczyń przed uszkodzeniami.
Niedobór objawia się zaburzeniami płodności, układzie nerwowym i mięśniowym.
Brak prowadzi do całkowitego zaniku mięśni szkieletowych.
Witamina K - filochinon jest czynnikiem przeciwkrwotocznym. >>>>
Brak objawia się krwawieniem podskórnym z błon śluzowych, a w razie skaleczenia nie wytwarza się prawidłowo skrzep, co jest związane z obniżeniem poziomu protrombiny we krwi.
33. Przykłady wielocukrów i oligosacharydów
patrz pyt # 15
polisacharydy [gr.-łac.] (cukry złożone, wielocukry), polimery monosacharydów połączonych wiązaniami glikozydowymi; wyróżnia się homo- i heteropolisacharydy; powszechne w organizmach żywych; pełnią różne funkcje; np.: skrobia, glikogen, celuloza, chityna
34. Na czym polega hydroliza wiązania przez peptydazy
katalizują rozszczepianie wiązań peptydowych; dzielą się na egzo- i endopeptydazy; biorą udział w trawieniu białka, np. pepsyna, trypsyna, w krzepnięciu krwi, np. trombina, plazmina; u roślin np. papaina
35. Analogi stanu przejściowego
Zaproponowane przez L.PAULINGA w 1946 roku inhibitory enzymów, przypominające stan przejściowy katalizowanej reakcji [s 213 > przykład]
36. Co to są enzymy restrykcyjne
RESTRYKTAZY - tną DNA tworząc powtarzalny komplet fragmentów.
Restryktazy (inaczej enzymy restrykcyjne , endonukleazy restrykcyjne) - to enzymy izolowane z bakterii , zdolne do rozpoznawania specyficznych sekwencji w DNA (z reguły są to sekwencje palindromowe) i do przecinania dwuniciowej cząsteczki DNA w ściśle określonym miejscu , w obrębie lub okolicy sekwencji rozpoznawanej. Otrzymywane fragmenty DNA nie są losowe a w każdym prążku na żelu znajdują się cząsteczki DNA o identycznej sekwencji nukleotydowej. Z reguły różne enzymy rozpoznają odmienne sekwencje DNA. Istnieją jednak wyjątki - tzw. izoschizomery - enzymy izolowane z różnych organizmów ale rozpoznające te same sekwencje. Zdarza się także , że dwa enzymy wytwarzają takie same lepkie końce , mimo rozpoznawania różnych sekwencji DNA. Umożliwia to klonowanie DNA strawionego jednym enzymem w wektorze strawionym innym , dającym takie same lepkie końce.
Zastosowania :
Konstrukcja map restrykcyjnych. Analizując na żelach produkty trawienia danego DNA różnymi enzymami restrykcyjnymi , stosowanymi pojedynczo , w kombinacjach oraz w ilościach wystarczających lub niewystarczających do pełnego strawienia preparatu , można ustalić wzajemne położenie i odległości pomiędzy sekwencjami rozpoznawanymi przez te enzymy. Mapa restrykcyjna to obraz cząsteczki DNA , na którym zaznaczone są miejsca rozpoznawane przez różne enzymy restrykcyjne z uwzględnieniem odległości między nimi wyrażonej w nukleotydach.
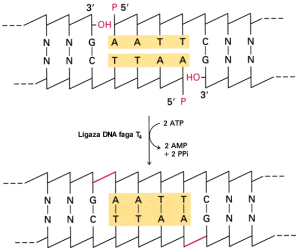
Klonowanie i obróbka DNA.
DNA pocięty enzymami restrykcyjnymi można poddawać ligacji z wektorem. W ten sposób tworzone są zrekombinowane plazmidy czyli plazmidy zawierające sklonowany DNA , który można później poddawać różnym manipulacjom przy użyciu odpowiednich enzymów restrykcyjnych.
Badanie polimorfizmu miejsc restrykcyjnych (RFLP).
LIGAZY - trwale łączą pocięte fragmenty [powyżej rys!].
Ligazy DNA katalizują formowanie wiązań fosfodiestrowych pomiędzy końcem hydroksylowym 3` a końcem fosforowym 5` DNA. Pozwala to na reperowanie jednoniciowych przerw w dupleksie DNA , łączenie fragmentów restrykcyjnych posiadających homologiczne lepkie czy też nawet tępe końce.
Dwa najczęściej stosowane enzymy to ligaza DNA E.coli i ligaza DNA z faga T4. Tylko ta ostatnia jest w stanie wydajnie łączyć tępe końce , nawet w normalnych warunkach reakcji. Wadą jest jej mniejsza specyficzność rozpoznawania struktury końców , co daje większe tło w doświadczeniach spowodowane nieprawidłowymi ligacjami.
37. Co mają wspólnego Asp-Ala-Thr, Asp-Val-Ser
białka łączą się przez Ser i Thr i tworzą wiązanie O-glikozydowe z cukrem
38. Kinazy..., który z wymienionych przenosi grupę
39. Jak w laktozie połączone są cukry
jak w innych disacharydach kowalencyjnym wiązaniem zwanym wiązaniem glikozydowym. W laktozie wiązanie to jest utworzone pomiędzy anomerycznym węglem C1 D-galaktozy a węglem C4 glukozy. Uczestniczący w wiązaniu anomeryczny C cząsteczki galaktozy występuje w konfig. beta, więc wiązanie nazywa się beta 1,4, w skrócie β 1->4
40. Po której stronie błony występują cukry
na zewnątrz :) >>> patrz pyt:
41. Jaką konformacje tworzy pierścień furanozowy --koperta
42. Schemat blokowy fosfolipidów
43. Wymień dwa białka (enzymy??!!) ulegające proteolizie
BIAŁKA PROSTE: np. hisotny,a lbuminu, globuliny
BIAŁKA ZŁOŻONE: np. kazeina, fosfolipidy
44. Jakie aminokwasy wchodzą w skład miejsca aktywnego chymotrypsyny
W MA chymotrypsyna ma reszty aminokwasów o krótkich łańcuchach bocznych takie jak: GLY, SER, co umożliwia wejście do tych MA dużych łańcuchów bocznych S.
45. Jak odróżnić skrobie od glikogenu
SKROBIA |
GLIKOGEN |
- roślinna substancja zapasowa - występuje w dwóch formach: amylozy [bez rozgałęzień, reszty glukozy pow. w. α-1,4-glikozydowymi], amylopektyny [rozgałęziona, na 1 w. α-1,6-glikozydowe przyda 30 α-1,4] |
- homopolimer zwierzęcy - zapasowa forma glukozy -duży rozgałęziony polimer zbudowany z reszt glukozy, większość z nich powiązanych jest w. α-1,4-glikozydowymi, rozgałęzienia powstają w miejscu wiązań α-1,6-glikozydowymi, występuje przeciętnie co 10 reszt glukozy |
46. Dlaczego tworzy się błona dwuwarstwowa a nie micela
BIOCHEMIA KII
1
1
Wyszukiwarka
Podobne podstrony:
koło 1 odp, biochemia koła
kolokwium II wersja A, biochemia koła
wszystkie pytania do koła I z biochemii, biochemia koła
Pytania z koła z biochemii I kołoo, biochemia koła
kolo 1, biochemia koła
biochemia koło 2, biochemia koła
koło 1, biochemia koła
4 koło różowe, biochemia koła
BIOCHEMIA II termin egzaminu 06 i 07 LEK i STOMA by KaMilka
BIOCHEMIA DŻEJ DŻEJA by JJ Jernajczyk
Egzamin biochemia - stomatologia 2009 - I termin by ja, BIOCHEMIA
BIOCHEMIA cw.2 made by Tomek - białka, biochemia
pytania biochemia k2, SGGW Technologia żywności i żywienie człowieka, III semestr, Biochemia, kolokw
KOLA BIOCHEMIA
biochemia pytania z forum by ściech
Confocal optics microscopy for biochemical and cellular high throughput screening by Lenka Zemanová,
więcej podobnych podstron