1
Indywidualizacja
dietetycznego leczenia
przewlekłej choroby nerek
Andrzej Rydzewski
Klinika Chorób Wewnętrznych i
Nefrologii CSK MSWiA
Czynniki wpływające na
indywidualizację dietety
• Wpływ diety na progresję PChN
• Stopień zaawansowania PChN
• Niedożywienie jako konsekwencja PChN
• Typ schorzenia (ZN)
• Choroby współistniejące z PChN
• Powikłania metaboliczne PChN
• Metoda leczenia nerkozastępczego
2
Czynniki wpływające na
indywidualizację dietety
• Wpływ diety na progresję PChN
• Stopień zaawansowania PChN
• Niedożywienie jako konsekwencja PChN
• Typ schorzenia (ZN)
• Dieta a współchorobowość w PChN
• Powikłania metaboliczne
• Metoda leczenia nerkozastępczego
BIAŁKO
• Dieta z dużą zawartością białka
przyśpiesza progresję PChN
• Hiperfiltracja (glukagon, IGF-1, kininy,
mechanizmy wewnątrznerkowe)
• Dieta niskobiałkowa (
↓ włóknienia, ↓ TGF,
↓ cytokin)
• Białkomocz niezależny czynnik progresji
PChN
3
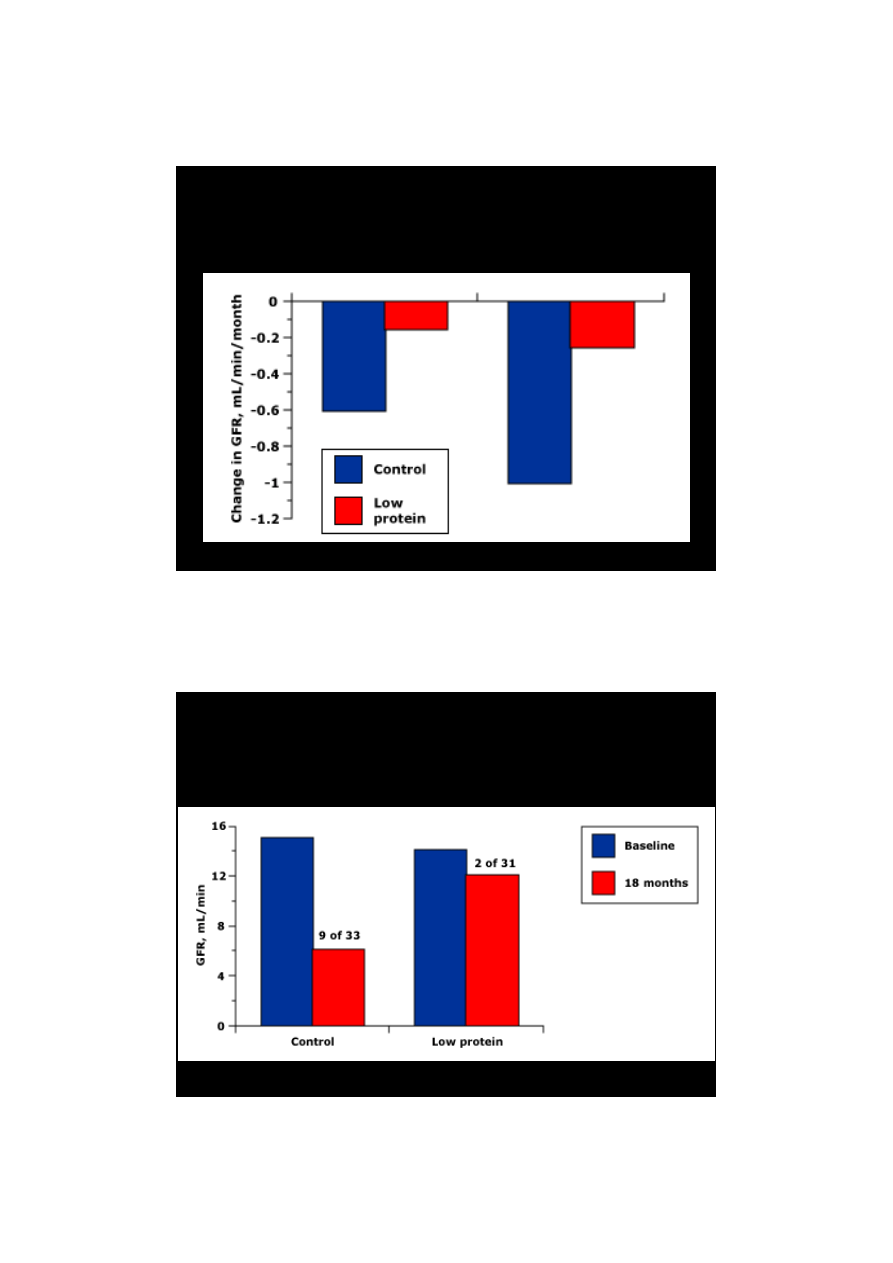
Wpływ diety 0,6 g/B/24h na
nefropatię cukrzycową
Walker i wsp. Lancet 1989
18 m
36 m
Wpływ restrykcji białka na
progresję PChN w V stadium
Ihle i wsp. N Engl J Med 1989
4
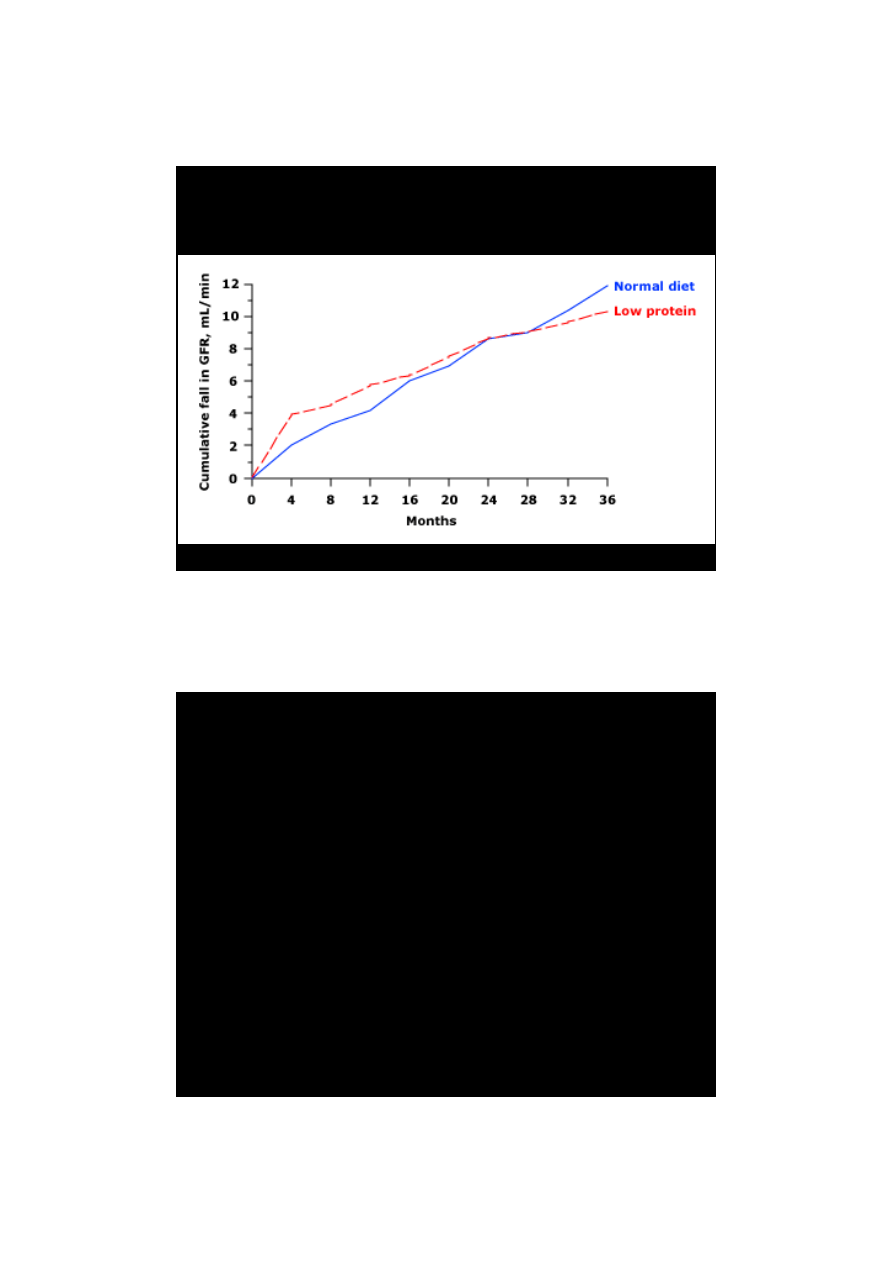
MDRD
Klahr wsp. N Engl J Med 1994
Ograniczenie zawartości białka
w diecie
• Korzyści ze znacznego ograniczenia białka (0,6
-1,0 g/kg) i jego nasilenie pozostają niepewne
• Większość badań przeprowadzona przed
powszechnym stosowaniem ACEI i ARB
• Mimo, że mogą one opóźnić potrzebę leczenia
nerkozastępczego to tylko nielicznym
pacjentom udaje się przestrzegać diety przez
długi czas
• Niewykluczone, że w nefropatii cukrzycowej
efekt jest lepszy
5
Ograniczenie zawartości białka
w diecie - niepewności
• Ilość białka w diecie
• Rodzaj białka (roślinne, białko jaj)
• Suplementacja aminokwasami, analogami
aminokwasów
Czynniki wpływające na
indywidualizację dietety
• Wpływ diety na progresję PChN
• Stopień zaawansowania PChN
• Niedożywienie jako konsekwencja PChN
• Typ schorzenia (ZN)
• Dieta a współchorobowość w PChN
• Powikłania metaboliczne
• Metoda leczenia nerkozastępczego
6
Patogeneza niedożywienia w PChN
• Ograniczenia dietetyczne
• Upośledzone łaknienie
• Hiperkatabolizm (kwasica metaboliczna, oporność
na hormony anaboliczne )
• Jawne infekcje, stan „mikrozapalenia” (cytokiny)
• Toksyny mocznicowe
• Choroby współistniejące
• Depresja
• Utrata aminokwasów przy HD; Utrata białka w
CADO
• „Niedodializowanie”
Niedożywienie w PChN
Białko
Ccr
• 1,1 g/kg
>50 ml/min
• 0,85 g/kg
25-50 ml/min
• 0,70 g/kg
10-25 ml/min
• 0,54 g/kg
<10 ml/min
Zaburzenia odżywienia w V stadium PChN
• Zmniejszone zasoby białkowe
≈40%
• Zmniejszone zasoby t. tłuszczowej
≈60%
• Obniżona masa ciała
≈50%

7
Typy niedożywienia wg
Stenvinkela
Trudna
Łatwa
Korekcja
↑
=
Wsp
ółchorobowość
↑
=
CRP, IL-1, IL-6
=
↓
Beztłuszczowa mc
=
↓
Białko w diecie
↓
=
Albuminy
Typ 2 (MIA)
Typ 1
Cele leczenia dietetycznego w
PChN są następujące
• Uzyskanie i utrzymanie optymalnego stanu
odżywienia i masy ciała
• Optymalizacja leczenia współistniejących
stanów chorobowych jak kontrola glikemii w
cukrzycy, wolemii i gospodarki sodowej w
nadciśnieniu, hiperfosfatemii przy nadczynności
przytarczyc, stężenia lipidów itp.
• Normalizacja i stabilizacja biochemicznych
markerów stanu odżywienia
• Stabilizacja masy tkanki mięśniowej (oceniana
za pomocą metod obiektywnych)
8
DEFINICJA STANU
ODŻYWIENIA
• Stan organizmu odnoszący się do
przyjmowania pożywienia, wchłaniania i
wykorzystania zawartych w nim
składników oraz wpływu czynników
patologicznych na te procesy.
Postępowanie
• Zwiększenie spożycia składników
odżywczych
– Konsultacja dietetyczna !
– Korekcja niedokrwistości
– Suplementacja doustna
– Suplementacja parenteralna
– PEG
– Adekwatna dializoterapia
• Dostarczenie witamin
9
Zasady postępowania
• „Wyłączenie” katabolizmu
– Korekcja kwasicy
– Kontrola stanu „mikrozapalenia” -> infekcje,
ogniska
– Biozgodne błony dializacyjne
– Ultraczysty dializat
– Adekwatna dializa
• „Włączenie” anabolizmu (eksperymentalne
GH, IGF-1)
• Zmniejszenie anoreksji
– Czynniki psychosocjalne
Energia
• >35 kcal/kg (BMI 18,5-25) poniżej 60 r.ż.
• 30-35 kcal/kg powyżej 60 r.ż
• Modyfikacje w zależności od katabolizmu,
aktywności fizycznej, sposobu leczenia,
BMI
10
BIAŁKO
• Zarówno u dorosłych zdrowych ludzi jak i u
chorych na PChN spożycie 0,55 – 0,6 g białka
/kg m.c./24h zapewnia równowagę bilansu
azotowego. Jednak indywidualne
zapotrzebowanie na białko jak i inne składniki
odżywcze może być bardzo zróżnicowane,
dlatego też na podstawie zmienności
indywidualnej wyliczany jest margines
bezpieczeństwa (równy 2 SD), dzięki któremu
pokrywane jest zapotrzebowanie 97,5%
populacji. Wyliczona w ten sposób „bezpieczna“
norma dla zdrowych dorosłych wynosi 0,8 g
białka/kg m.c./dobę.
Białko
• Umiarkowane ograniczenie podaży białka (0,6-
1,0 g/kg/d)
• Znaczna redukcja ilości białka w diecie i
suplementacja niezbędnymi aminokwasami lub
mieszanką analogów aminokwasów (0,3-0,4
g/kg/d)
• Ilość białka w diecie powinna być wyliczana na
podstawie należnej masy ciała (IBW – ideal
body weight)
– BMI w normie, rzeczywista masa = IBW
– Niedowaga - IBW = masa ciała przy której BMI = 20
– Nadwaga i otyłość IBW = m.c. przy której BMI = 25
11
SKŁADNIKI MINERALNE
• Sód
• Potas
• Wapń
• Fosfor
Witaminy
•
↓ kwasu askorbinowego, folianów, ryboflawiny,
tiaminy i pirydoksyny
• Przyczyny: anoreksja i niskie spożycie,
zaburzone wchłanianie i metabolizm
• Suplementacja u osób na diecie z zawartością
białka mniejszą niż 0,75 g/kg m.c./d
• Tiamina (>1 mg/d)
• Ryboflawina (1-2 mg/d)
• Wit. B6 (1,5-2 mg/d)
• Do rozważenia wit. C w ilości 30 – 50 mg/d (max
60 mg/d), ze względu na ryzyko hiperoksalurii.

12
Zalecenia i standardy dotyczące
postępowania dietetycznego w leczeniu
zachowawczym PChN
• Zalecenia Zespołu Krajowego Konsultanta Medycznego
w Dziedzinie Nefrologii
• European Society of Parenteral and Enteral Nutrition
(ESPEN)
• National Kidney Foundation Kidney Disease Outcomes
Quality Initiative (NKF/KDOQI)
• American Dietetic Association - Renal Practice Group
(ADA/RPG)
• European Dialysis and Transplantation Nurses
Association - European Renal Care Association
(EDTNA/ERCA)
• Dietetitians Association of Australia (DAA)
Płyny
Sód
Potas
Białko
Brak danych
800 + obj.
moczu+UF
Utrzymać bilans
CADO
Brak danych
500 + obj. moczu
500-700 +obj. moczu
HD
Bez ograniczeń
Bez ograniczeń
Bez ograniczeń
PChN zachow.
2,6-4,3g
1,8-2,5g
2-4g
CADO
2,6-4,3g
1,8-2,5g
2-3g
HD
2,6-4,3g
1,8-2,5 g
1-3g
Zachow.
≤ 1 mEq/kg
↑K
2000-2500 mg/d
40 mg/kg
HD
2000-2500 mg/d
Indywidualnie
PChN zachow.
1,2-1,5
1,0-1,5
1,2-1,5
CADO
1,2-1,4
1,0-1.2
1.1-1,4
HD
0,8-1,0
-
-
ZN
0,55-0,6
0,6-1,0
0,6-1,0
PChN zachow.
ESPEN
EDNA/ERCA
ADA

13
Indywidualizacja w zależności od obrzęków i ciśnienia
Płyny (ml)
800-1000 i/lub leki wiążące
gdy fosfor > 4,61 mg/dl (lub
PTH > docelowe)
800-1000 i/lub leki wiążące
gdy fosfor > 4,6 mg/dl (lub
PTH > docelowe)
Fosfor (mg/24h)
Restrykcja jeżeli K> 6 mmol/L
Restrykcja jeżeli K> 6
mmol/L
Potas
<100 mmol (2,3 g) jeżeli NT,
progresja PChN
<100 mmol (2,3 g) jeżeli
NT
3
, progresja PChN
Sód (mmol/24h)
0,75-1,0; >50% o WWB
0,75-1,0
Białko (g/kg
IBW/24h)
1
Wynikająca z bilansu ilości
energii
Wynikająca z bilansu ilości
energii
Węglowodany
<30% kalorii
<10% tł. nasyconych
<30% kalorii
<10% tł. nasyconych
Tłuszcze
>35 kcal/kg (BMI 18,5-25);
30-35 powyżej 60 r.
Wyliczona na podstawie
zapotrzebowania
Energia (kcal/kg
IBW/24h) w tym
Stadium 4
Stadium 3
Wg Dietitians Association of Australia 2006
800 ml + obj. moczu
500 ml + obj. moczu
Płyny (ml)
800-1000 i/lub leki wiążące
gdy fosfor >5,51 mg/dl (lub
PTH > docelowe)
800-1000 i/lub leki wiążące gdy
fosfor > 5,5 mg/dl) (lub PTH
> docelowe)
Fosfor (mg/24h)
Indywidualizacja
Indywidualizacja
Potas
Indywidualizacja; jeżeli
restrykcja to 80-110 mmol
Indywidualizacja; jeżeli
restrykcja to 80-110 mmol
Sód (mmol/24h)
Min. 1,2; >50% o WWB
>1,3 gdy katabolizm
>1,5 gdy peritonitis
1,2-1,4; >50% o WWB2
>1,2 gdy katabolizm
Białko (g/kg
IBW/24h)
1
50-60% kalorii
50-60% kalorii
Węglowodany
<7% kalorii z nienasyconych
<20% z nienasyconych
<7% kalorii z nienasyconych
<20% z nienasyconych
Tłuszcze
30-35 (BMI 22-25) włączając
glukozę z dializatu
>35 gdy katabolizm
30-35 (BMI 22-25)
>35 gdy katabolizm (<60 l)
>30 gdy katabolizm (>60 l.)
Energia (kcal/kg
IBW/24h) w tym
Stadium 5 (PD)
Stadium 5 (HD)

14
Ocena BMI i „suchej“ m.c. co
miesiąc, badania j.w. co 1-3
m.; częściej jeżeli objawy
niedożywienia, choroba
współtowarzysząca, GFR
<15 ml/min, SGA co 6-12m.
Ocena BMI i „suchej“ m.c. co
miesiąc, badania j.w. co 6-
12 m.; częściej jeżeli objawy
niedożywienia
Częstość
wizyt
kontr.
„Sucha“ m.c., BMI, %IBW,
SGA, ocena diety, lub nPNA,
aktywność życiowa i jej
upośledzenie
„Sucha“ m.c., BMI, %IBW,
SGA, ocena diety, lub
nPNA, aktywność życiowa i
jej upośledzenie
Ocena stanu
odżywienia
albuminy, potas, fosforany,
kreatynina, glukoza, HbA1c
(cukrzyca), PTH, lipidy, Hb,
GFR, ciśnienie krwi
albuminy, potas, fosforany,
kreatynina, glukoza, HbA1c
(cukrzyca), PTH, lipidy, Hb,
GFR, ciśnienie krwi
Badania
45-60 min
45-60 min
Czas kons.
GFR < 30 ml/min
GFR < 60 ml/min
Moment
Stadium 4
Stadium 3
Wg Dietitians Association of Australia 2006
Ocena BMI i „suchej“ m.c.,
albumin co miesiąc
badania j.w.+ Kt/V co 6
m., lub częściej jeżeli
wskazane
Ocena BMI i „suchej“ m.c.,
albumin co miesiąc, badania
j.w. + Kt/V co 3-6 m., lub
częściej jeżeli wskazane
Częstość wizyt
kontrolnych
„Sucha“ m.c., BMI, %IBW,
SGA, ocena diety, lub
nPNA
„Sucha“ m.c., BMI, %IBW,
SGA, ocena diety, lub nPNA
Ocena stanu
odżywienia
Albuminy, mocznik,
kreatynina, potas,
fosforany, Ca x PO4,
lipidy, PTH, Kt/V, bilans
płynów
Przed HD: albuminy, mocznik,
potas, fosforany, Ca x PO4,
lipidy, PTH; Po HD: mocznik,
HbA1c (cukrzyca) ciśnienie,
Kt/V, bilans płynów
Badania
45-60 min
45-60 min
Czas kons.
Początek leczenia
Początek leczenia
Moment kons.
Stadium 5 (PD)
Stadium 5 (HD)
Wg Dietitians Association of Australia 2006
15
Czynniki wpływające na
indywidualizację dietety
• Wpływ diety na progresję PChN
• Stopień zaawansowania PChN
• Niedożywienie jako konsekwencja PChN
• Typ schorzenia (ZN)
• Dieta a współchorobowość w PChN
• Powikłania metaboliczne
• Metoda leczenia nerkozastępczego
Energia
35 kcal/kg/d
Białko
0,8-1,0 g/kg/d !
1,0-1,1 g/kg/d, submikroskopowe KZN ?
Tłuszcze
< 30% energii może pochodzić z tłuszczu
Cholesterol < 200 mg/d
Sód
< 2 g/d
Wapń
Gdy laboratoryjne objawy niedoboru wit D
Kalcytriol Gdy laboratoryjne objawy niedoboru
Żelazo
Gdy laboratoryjne objawy niedoboru
Cynk
Gdy laboratoryjne objawy niedoboru
Zespół nerczycowy
16
Zalecenia żywieniowe po transplantacji
nerki (wg Mitch i Klahr, 2005)
Pierwszy miesiąc po transplantacji i w
trakcie leczenia ostrego odrzucania
Energia
30-35 kcal/kg/d
Białko
1,3-1,5 g/kg/d
Po pierwszym miesiącu
Energia Dobrana dla osiągnięcia
optymalnej masy ciała
Białko
1,0 g/kg/d
Zalecenia żywieniowe po transplantacji
nerki (wg Mitch i Klahr, 2005)
Niezależnie od okresu
Tłuszcze
< 30% energii
Cholesterol < 300 mg/d
Węglowodany
50% energii
Sód
3-4 g/d (czczególnie leczeni CsA)
Fosfor
Około 1200 mg/d
Wapń
Około 1200 mg/d
Magnez
Gdy lab. cechy niedoboru
(inhibitory kalcyneuryny predysponują)
17
Metody oceny stanu odżywienia
• Służą do identyfikacji pacjentów
niedożywionych lub zagrożonych
niedożywieniem, podejmowaniu decyzji o
leczeniu dietetycznym i monitorowania
skuteczności interwencji terapeutycznych.
Polegają na: badaniu klinicznym (ocena
składu diety, wywiad, badanie
przedmiotowe), badaniach laboratoryjnych
i obiektywnych metodach analizy składu
ciała.
Metody oceny stanu
odżywienia
• Badanie kliniczne
• Badania laboratoryjne
• Badanie składu ciała
18
Ocena składu diety
• W indywidualnej terapii dietetycznej najbardziej
przydatne są metody bezpośrednie
– Analityczne
– Inwentarzowo-zapisujące
– Wywiadu
• Szacują ilość rzeczywiście spożytej żywności, z
uwzględnieniem strat występujących przy obróbce
kulinarnej i technologicznej.
• Przestrzeganie diety przez pacjenta
można oszacować wyliczając szybkość
tworzenia się azotu białkowego (PNA –
protein nitrogen appearance).
• PNA (g/24h) = Dobowe wydalanie azotu
mocznikowego (g/24h) + 0,031 × m.c. (kg)
• Ilość białka wylicza się mnożąc PNA przez
6,25.
19
Subjective Global Assessment
(SGA)
• Wywiad chorobowy (zaburzenia
żołądkowo-jelitowe)
• Wywiad żywieniowy
• Utrata masy ciała
• Obrzęki
• Zaniki mięśni
• Zmiany w codziennym funkcjonowaniu
Pomiary antropometryczne
• Wzrost
• Masa ciała
• BMI
• MAC (mid arm circumference)
• TSF (triceps skin fold)
• MAMC (mid arm muscle)
20
Metody obiektywne
• BIA
• DEXA
• CT
• MRI
Proponowane wskaźniki złego
stanu odżywienia u pacjentów z
PChN
• Niska ilość białka w diecie (dobowe
wydalanie azotu mocznikowego <0,7
g/kg/dobę)
• Stały spadek „suchej” masy ciała
• Masa ciała niższa niż 80-85% należnej
• Zmniejszone parametry pomiarów
antropometrycznych
21
Proponowane wskaźniki złego
stanu odżywienia u pacjentów z
PChN
• Niskie stężenia mocznika i kreatyniny przed
dializą u osób bez resztkowej diurezy
• Stężenie albumin w surowicy < 3,5 g/dl
• Liczba limfocytów < 1500/mikrol
• Stężenie cholesterolu < 150 mg/dl
• Stężenie prealbuminy < 30 mg/dl
• Stężenie transferyny < 150 mg/dl
• Stężenie IGF-1 < 300 mg/l
• Leczenie dietetyczne stanowi istotny składnik
prawidłowego prowadzenia pacjenta z PChN
• Dieta wymaga indywidualnego doboru z
uwzględnieniem aktualnych wyników badań
dodatkowych
• Powinny funkcjonować zespoły terapeutyczne
lekarz, pielęgniarka, dietetyk, fizykoterapeuta i
psycholog
• Zadaniem zespołu powinno być opracowanie
zasad oraz praktycznych aspektów terapii
żywieniowej, obejmującej różne modyfikacje w
zakresie zawartości poszczególnych składników
odżywczych i monitorowanie skutków
postępowania żywieniowego.
Wyszukiwarka
Podobne podstrony:
nefrologia niemczyk id 316786 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron