
Chemia
Chemia
Dr hab. Joanna Łojewska
Zakład Chemii Nieorganicznej
1669 r
Odkrycie fosforu przez Henninga Branda
4
TERMODYNAMIKA
60
Razem
12
CHEMIA NIEORGANICZNA
20
ATOM, CZĄTECZKA
2
KINETYKA
3
ELEKTROCHEMIA
6
RÓWNOWAGA CHEMICZNA
- roztwory
3
RÓWNOWAGA CHEMICZNA
2
TERMOCHEMIA
3
GAZY
5
STECHIOMETRIA
liczba
godzin
Lista wykładów
Wyk
Wyk
ł
ł
ady z podstaw
ady z podstaw
chemii
chemii
Podręczniki
L. Jones, P. Atkins, „Chemia
Ogólna. Cżasteczki, materia,
reakcje”, Wydawnictwo
naukowe PWN, Warszawa
2004
A.Bielański "Chemia ogólna i
nieorganiczna" PWN

Chemia
Chemia
Nauka
Nauka
• o materii
• doświadczalna
• stosowana
metoda naukowa
Metoda naukowa
Metoda naukowa
Klasyfikacja materii
Klasyfikacja materii
Atomy
Atomy
–
–
modele i dowody eksperymentalne
modele i dowody eksperymentalne
–
–
w
w
ł
ł
asno
asno
ś
ś
ci
ci
–
–
masa atomowa
masa atomowa

Metoda naukowa
Metoda naukowa
1.
1.
Obserwacje
Obserwacje
–
–
do
do
ś
ś
wiadczenia wst
wiadczenia wst
ę
ę
pne
pne
-
-
jako
jako
ś
ś
ciowe
ciowe
-
-
ilo
ilo
ś
ś
ciowe
ciowe
2.
2.
Hipotezy
Hipotezy
-
-
mo
mo
ż
ż
liwe wyja
liwe wyja
ś
ś
nienia obserwacji
nienia obserwacji
3.
3.
Do
Do
ś
ś
wiadczenia sprawdzaj
wiadczenia sprawdzaj
ą
ą
ce
ce
-
-
zbieranie nowych informacji w celu
zbieranie nowych informacji w celu
sprawdzenia hipotezy
sprawdzenia hipotezy
Metoda naukowa
Metoda naukowa
Teoria i model (dlaczego si
Teoria i model (dlaczego si
ę
ę
dzieje?)
dzieje?)
wyja
wyja
ś
ś
nienie praw lub obserwacji,
nienie praw lub obserwacji,
uporz
uporz
ą
ą
dkowany uk
dkowany uk
ł
ł
ad postulat
ad postulat
ó
ó
w w spos
w w spos
ó
ó
b
b
ca
ca
ł
ł
o
o
ś
ś
ciowy
ciowy
wyja
wyja
ś
ś
niaj
niaj
ą
ą
cych
cych
obserwacje
obserwacje
Prawo naturalne (co si
Prawo naturalne (co si
ę
ę
dzieje?)
dzieje?)
prawid
prawid
ł
ł
owo
owo
ść
ść
wyst
wyst
ę
ę
puj
puj
ą
ą
ca w naturze
ca w naturze
–
–
ta sama
ta sama
obserwacja stosuj
obserwacja stosuj
ą
ą
ca si
ca si
ę
ę
do r
do r
ó
ó
ż
ż
nych uk
nych uk
ł
ł
ad
ad
ó
ó
w,
w,
podsumowanie
podsumowanie
obserwacji
obserwacji
Metoda naukowa
Metoda naukowa
prawo
teoria/model
doświadczenie
hipoteza
obserwacja
wnioski i przewidywania
doświadczenie
Klasyfikacja materii
Klasyfikacja materii
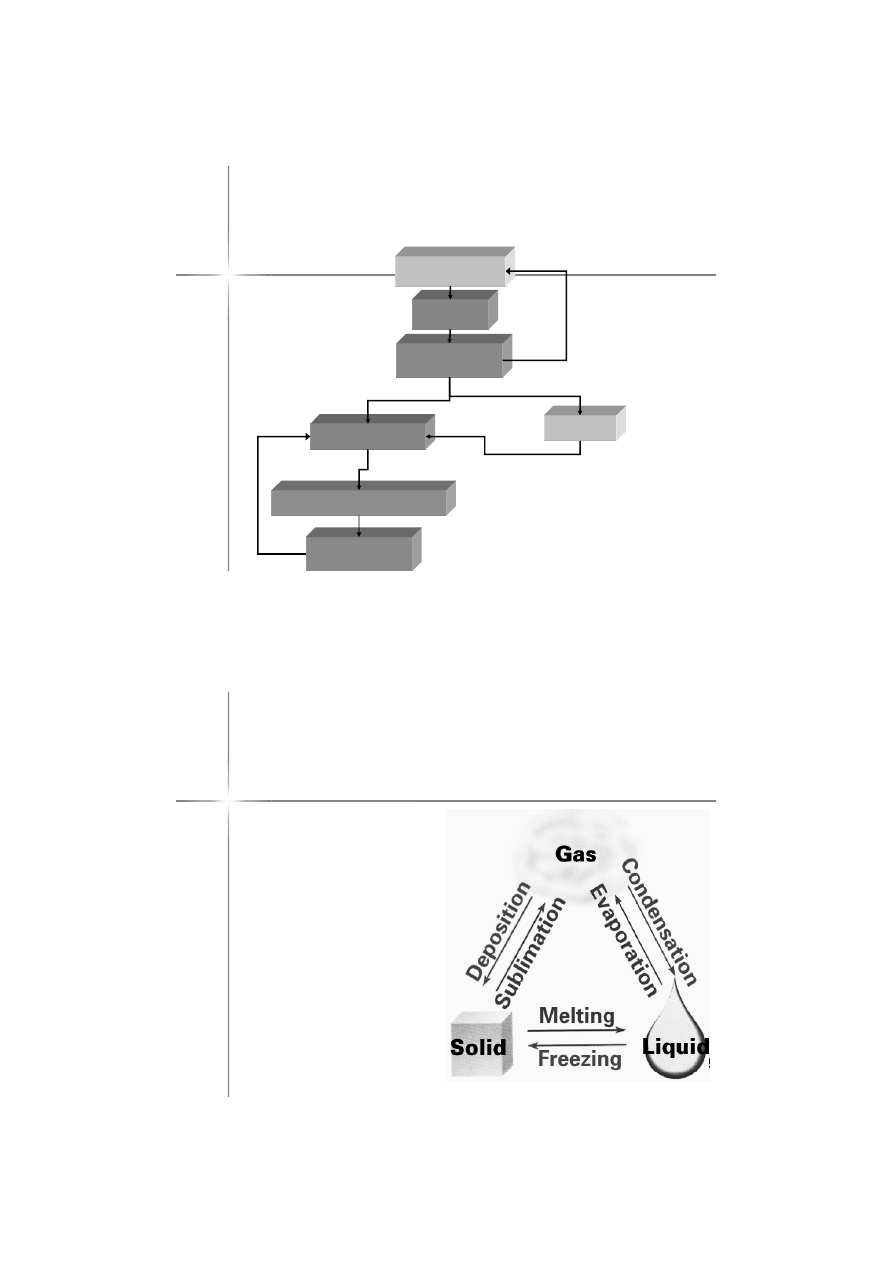
Stany skupienia:
Stany skupienia:
Sta
Sta
ł
ł
y (solid):
y (solid):
rigid
rigid
-
-
fixed
fixed
volume
volume
and
and
shape
shape
Ciecz (
Ciecz (
liquid
liquid
):
):
definite
definite
volume
volume
but
but
assumes
assumes
the
the
shape
shape
of
of
its
its
container
container
Gazowy (
Gazowy (
gaseous
gaseous
):
):
no
no
fixed
fixed
volume
volume
or
or
shape
shape
-
-
assumes
assumes
the
the
shape
shape
of
of
its
its
container
container
Klasyfikacja materii
Klasyfikacja materii
homogeniczne
związki
pierwiastki
heterogeniczne
atomy
elektrony
protony
neutrony
kwarki
kwarki
substancje czyste
mieszaniny
jądra
materia
metody fizyczne
metody fizyczne
metody fizyczne
metody chemiczne
Klasyfikacja Materii
Klasyfikacja Materii
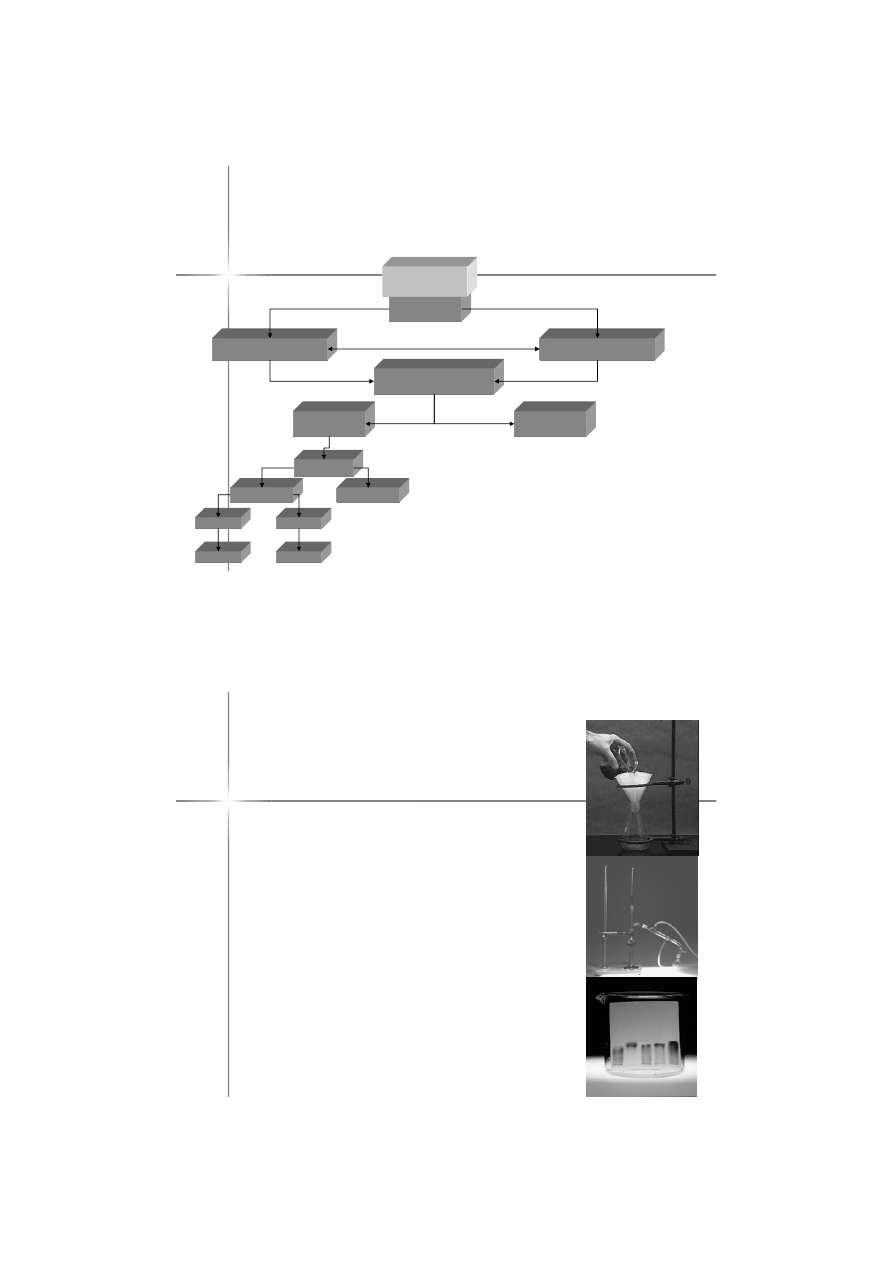
Metody rozdzia
Metody rozdzia
ł
ł
u mieszanin:
u mieszanin:
Filtracja
Filtracja
Destylacja
Destylacja
Chromatografia
Chromatografia
Klasyfikacja materii
Klasyfikacja materii
Pierwiastki:
Pierwiastki:
substancje, kt
substancje, kt
ó
ó
rych nie
rych nie
mo
mo
ż
ż
na roz
na roz
ł
ł
o
o
ż
ż
y
y
ć
ć
w przemianie
w przemianie
chemicznej
chemicznej
Zwi
Zwi
ą
ą
zki:
zki:
substancje o sta
substancje o sta
ł
ł
ym sk
ym sk
ł
ł
adzie,
adzie,
kt
kt
ó
ó
re mo
re mo
ż
ż
na rozdzieli
na rozdzieli
ć
ć
na pierwiastki w
na pierwiastki w
przemianie chemicznej.
przemianie chemicznej.
Metal
electrode
Metal
electrode
(-)
(+)
(+)
(-)
Applied
electric field
Atomy
Atomy
-
-
dowody
dowody
eksperymentalne
eksperymentalne
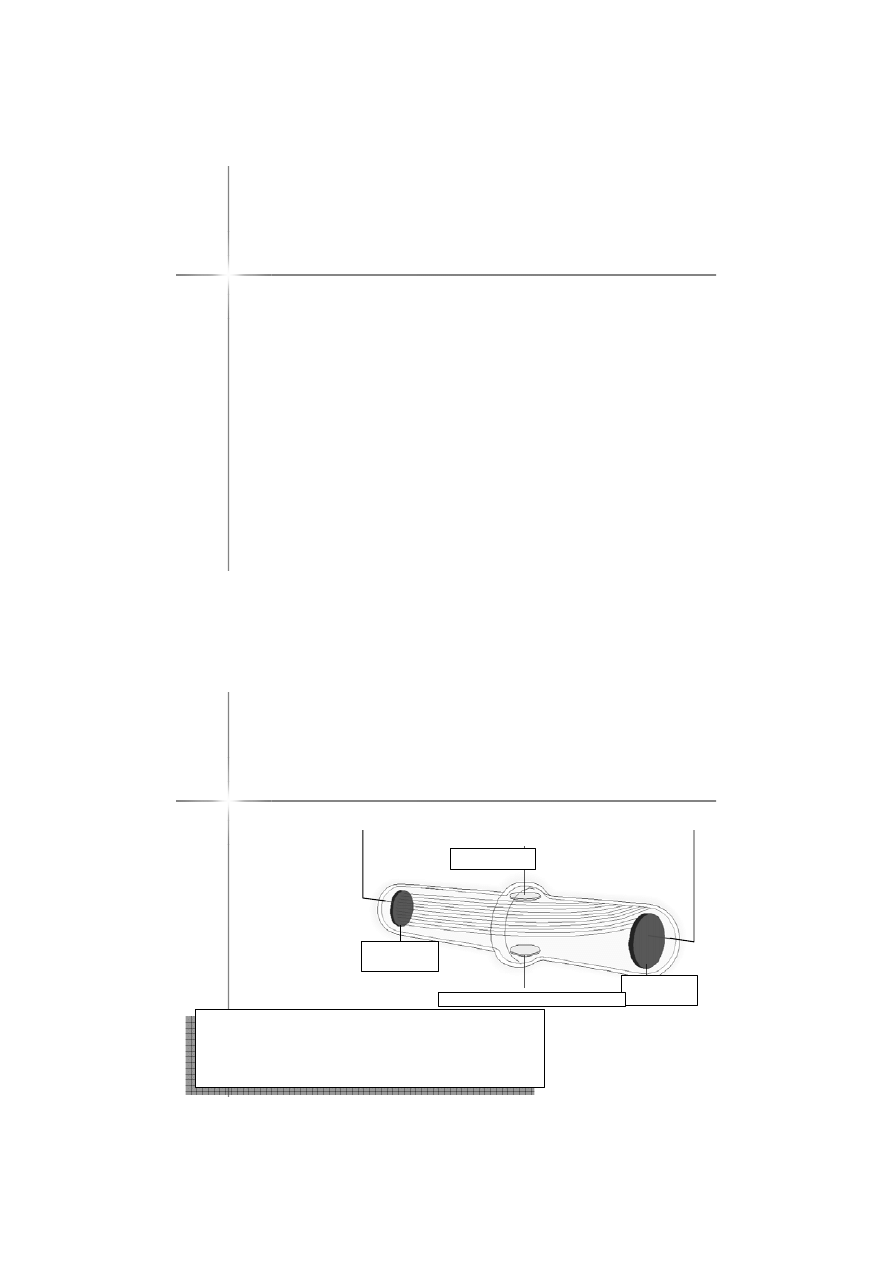
Do
Do
ś
ś
wiadczenie Thomsona (1898
wiadczenie Thomsona (1898
-
-
1903)
1903)
pole elektr.
metalowa
elektroda
metalowa
elektroda
bańka szklana - próżnia
Wnioski:
-atomy zawierają ujemnie naładowane cząstki
-naładowane cząstki mają zawsze stały stosunek
ładunku do masy
Atom
Atom
–
–
model
model
Model atomu wg Thomsona
Model atomu wg Thomsona
+
-
-
-
-
-
-
+
Atomy
Atomy
-
-
dowody
dowody
eksperymentalne
eksperymentalne
Radioaktywno
Radioaktywno
ść
ść
Do
Do
ś
ś
wiadczenie Marii Sk
wiadczenie Marii Sk
ł
ł
odowskiej (1903,
odowskiej (1903,
1911 r. nagrody Nobla)
1911 r. nagrody Nobla)
Do
Do
ś
ś
wiadczenie
wiadczenie
Rutheforda
Rutheforda
1911 r.
1911 r.
Atomy
Atomy
-
-
dowody
dowody
eksperymentalne
eksperymentalne
α
folia Au
ekran
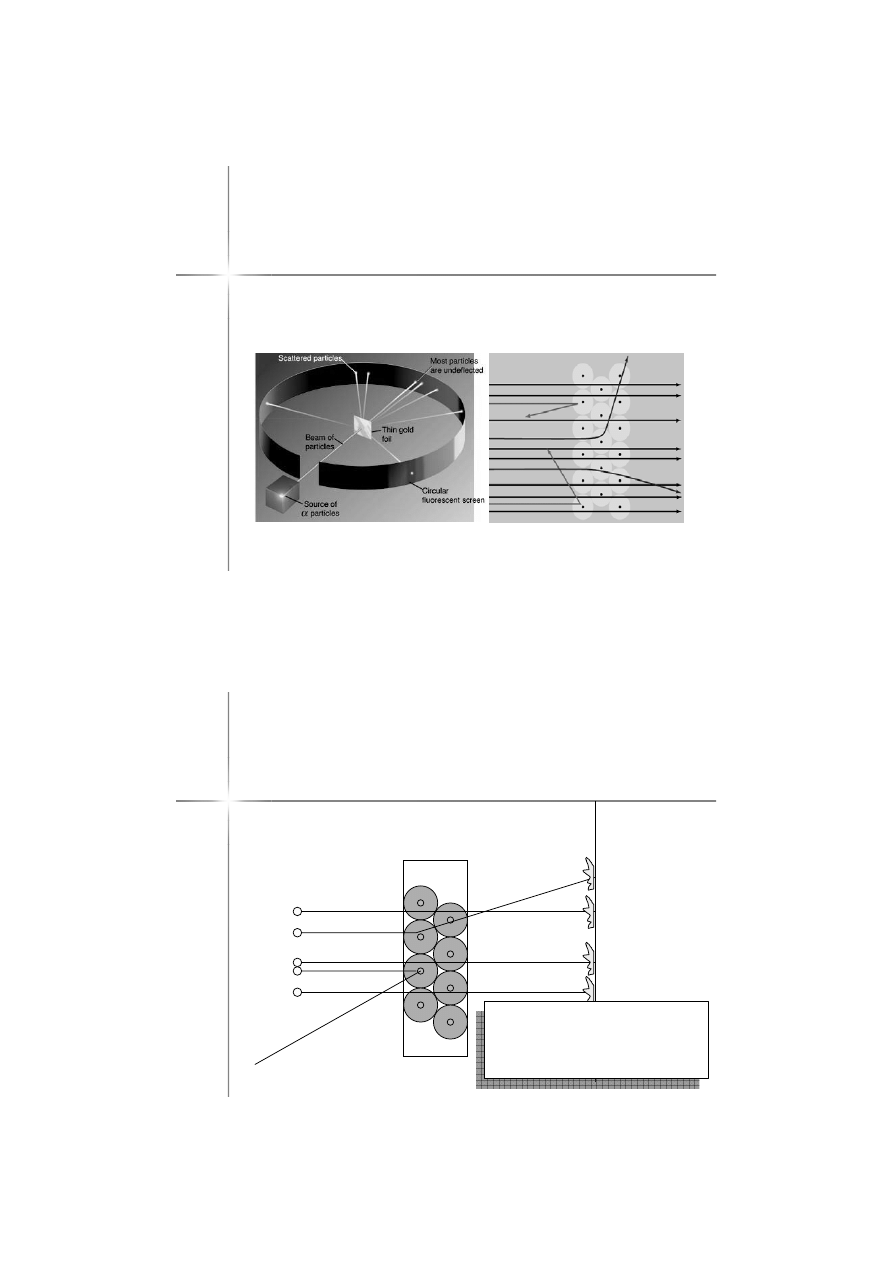
Do
Do
ś
ś
wiadczenie
wiadczenie
Rutheforda
Rutheforda
1911 r.
1911 r.
Atomy
Atomy
-
-
dowody
dowody
eksperymentalne
eksperymentalne
Wnioski:
- materia nie jest ciągła
- wewnątrz atomów jądra o
masie większej niż elektrony
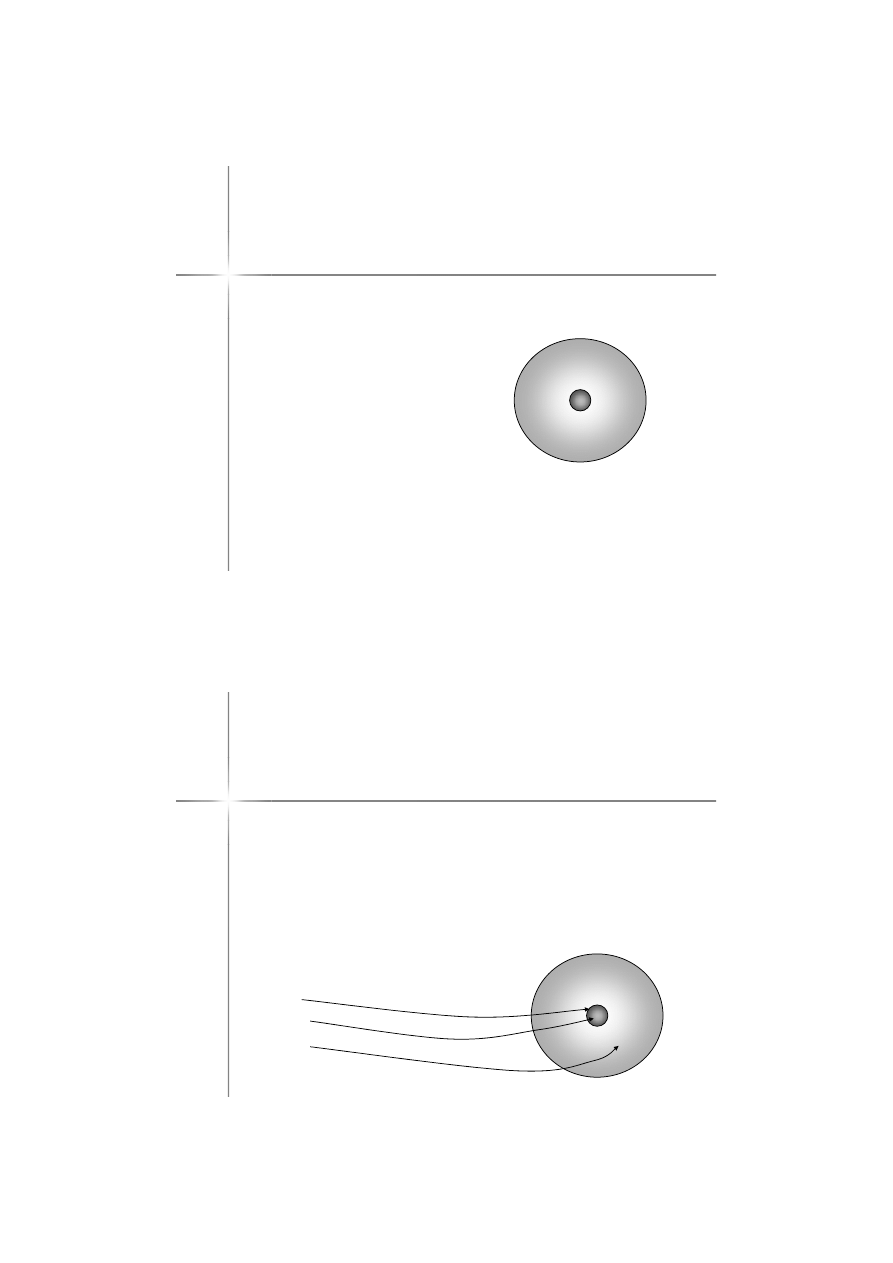
Atom
Atom
–
–
model
model
Model atomu wg
Model atomu wg
Rutheforda
Rutheforda
+
-
-
-
-
-
-
-
-
-
-
+
-
-
-
-
-
-
-
-
-
-
Atom
Atom
–
–
model wsp
model wsp
ó
ó
ł
ł
czesny
czesny
Teoria kwant
Teoria kwant
ó
ó
w
w
–
–
Zasada nieoznaczono
Zasada nieoznaczono
ś
ś
ci
ci
Heisenberga
Heisenberga
–
–
Dualizm korpuskularno falowy
Dualizm korpuskularno falowy
–
–
R
R
ó
ó
wnanie
wnanie
Schroedingera
Schroedingera
–
–
Funkcje falowe
Funkcje falowe
protony
protony
neutrony
neutrony
elektrony
elektrony

Atom
Atom
-
-
pomiar masy
pomiar masy
atomowej
atomowej
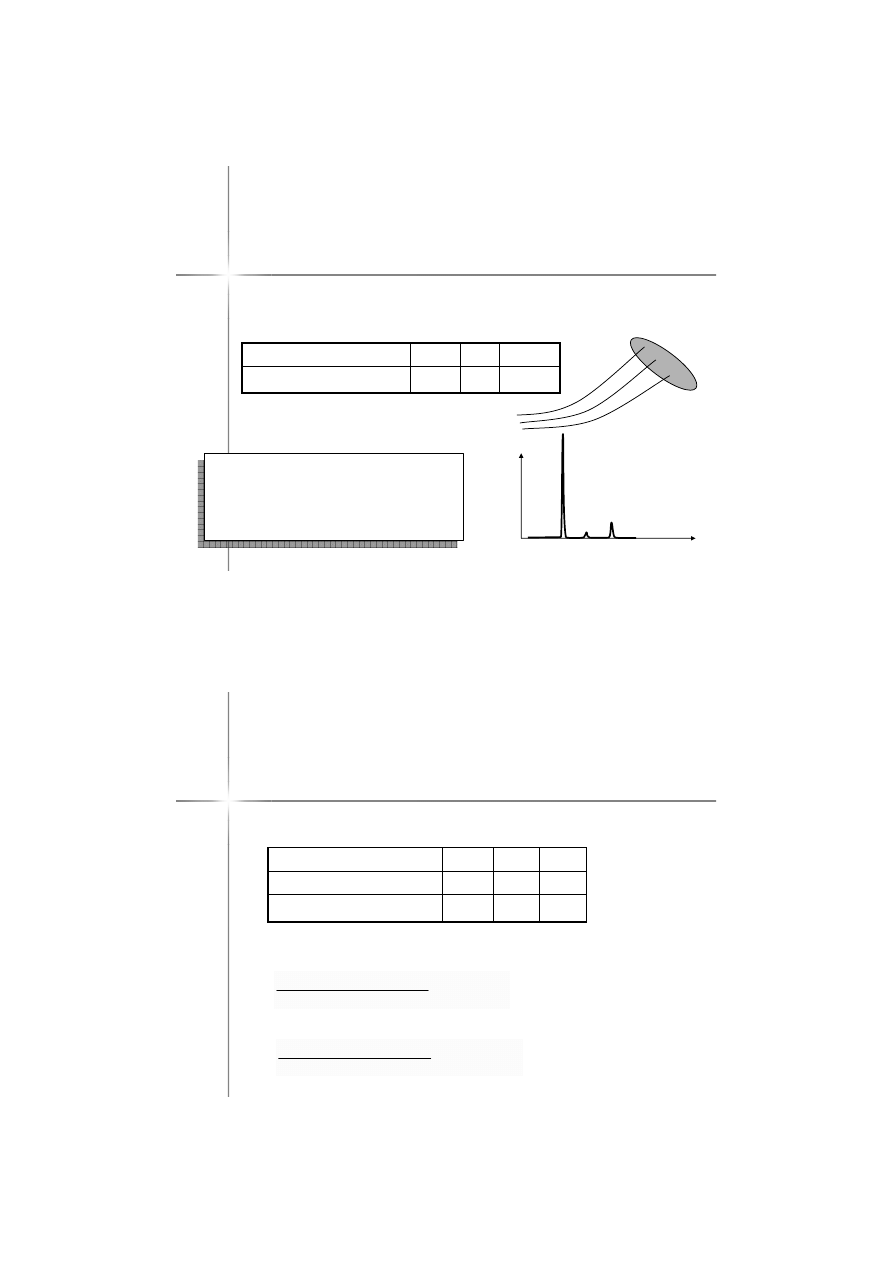
03_34
Slits
Sample
Positive ions
Electron beam
Heating device
to vaporize sample
Ion-accelerating
electric field
Accelerated
ion beam
Magnetic field
Detector
plate
Least massive ions
Most
massive
ions
Spektrometr masowy
1 a.j.m.= 1/12 m
12
C
Masa atomowa
Masa atomowa
definicja
Izotopy
Izotopy
8.8
8.8
0.3
0.3
90.9
90.9
rozpowszechnienie, %
rozpowszechnienie, %
22
22
21
21
20
20
masa atomowa, a.j.m.
masa atomowa, a.j.m.
Jak interpretować wyniki?
- 3 izotopy neonu
- intensywność proporcjonalna do ilości
- położenie proporcjonalne do masy
20 21 22
masa
sy
gn
. de
tekto
ra
dete
ktor
Wyniki pomiarów masy neonu
Masa atomowa
Masa atomowa
a.j.m.
100
3
3
2
2
1
1
M
%
M
p
M
p
M
p
=
⋅
+
⋅
+
⋅
Średnia ważona
3
3
2
2
1
1
Nr izotopu
Nr izotopu
8.8
8.8
0.3
0.3
90.9
90.9
rozpowszechnienie, %
rozpowszechnienie, %
22
22
21
21
20
20
masa atomowa, a.j.m
masa atomowa, a.j.m
a.j.m.
20.2
100
22
8.8
21
0.3
20
90.9
=
⋅
+
⋅
+
⋅
Wyniki pomiarów masy neonu
Carbon
Carbon
=
=
98.89%
98.89%
12
12
C
C
1.11%
1.11%
13
13
C
C
<0.01%
<0.01%
14
14
C
C
atomic
atomic
mass = 12.01
mass = 12.01
amu
amu
Masa atomowa
Masa atomowa
przykład
Pierwiastki
Pierwiastki
0 2 _ 2 9
1
H
3
L i
1 1
N a
1 9
K
3 7
R b
5 5
C s
8 7
F r
4
B e
1 2
M g
2 0
C a
3 8
S r
5 6
B a
8 8
R a
2 1
S c
3 9
Y
5 7
L a *
8 9
A c
†
2 2
T i
4 0
Z r
7 2
H f
1 0 4
U n q
2 3
V
4 1
N b
7 3
T a
1 0 5
U n p
2 4
C r
4 2
M o
7 4
W
1 0 6
U n h
2 5
M n
4 3
T c
7 5
R e
1 0 7
U n s
2 6
F e
4 4
R u
7 6
O s
1 0 8
U n o
2 7
C o
4 5
R h
7 7
Ir
1 0 9
U n e
1 1 0
U u n
1 1 1
U u u
2 8
N i
4 6
P d
7 8
P t
2 9
C u
4 7
A g
7 9
A u
3 0
Z n
3
4
5
6
7
8
9
1 0
1 1
1 2
4 8
C d
8 0
H g
3 1
G a
4 9
In
8 1
T l
5
B
1 3
A l
3 2
G e
5 0
S n
8 2
P b
6
C
1 4
S i
3 3
A s
5 1
S b
8 3
B i
7
N
1 5
P
3 4
S e
5 2
T e
8 4
P o
8
O
1 6
S
9
F
1 7
C l
3 5
B r
5 3
I
8 5
A t
1 0
N e
1 8
A r
3 6
K r
5 4
X e
8 6
R n
2
H e
5 8
C e
9 0
T h
5 9
P r
9 1
P a
6 0
N d
9 2
U
6 1
P m
9 3
N p
6 2
S m
9 4
P u
6 3
E u
9 5
A m
6 4
G d
9 6
C m
6 5
T b
9 7
B k
6 6
D y
9 8
C f
6 7
H o
9 9
E s
6 8
E r
1 0 0
F m
6 9
T m
1 0 1
M d
7 0
Y b
1 0 2
N o
7 1
L u
1 0 3
L r
1 A
2 A
T ra n s itio n m e ta ls
3 A
4 A
5 A
6 A
7 A
8 A
1
2
1 3
1 4
1 5
1 6
1 7
1 8
Al
ka
li m
et
als
A lk a lin e
e a rth m e ta ls
H a lo g e n s
N o b le
g a s e s
*L a n th a n id e s
†
A c tin id e s
Wyszukiwarka
Podobne podstrony:
Psychologia ogólna - Historia psychologii - wykład 4 - Psychologia jako nauka o świadomości, Wykład
Wykład I Antropologia jako nauka, ANTROPOLOGIA
Metodologia badań z logiką dr Karyłowski wykład 1 Psychologia jako nauka empiryczna
Wykład 2 Socjologia jako nauka, Studia licencjackie- Resocjalizacja, Wprowadzenie do socjologii
Socjologia wyklady, 1 - socjologia jako nauka - 2 h
Wykład I Pedagogoka jako nauka
KONSPEKT wyklad 1 Ergonomia jako nauka interdyscyplinarna
Wykład 1 Socjologia jako nauka
wykład I Pojęcie finansów Finanse jako nauka
Psychologia jako nauka wykład
zachomikowane notatki i wyklady, Estetyka - przedmiot nauki, Estetyka jako nauka funkcjonuje od XVII
prezentacja do wykładu pt Antropologia jako nauka
więcej podobnych podstron