2013-06-10
1
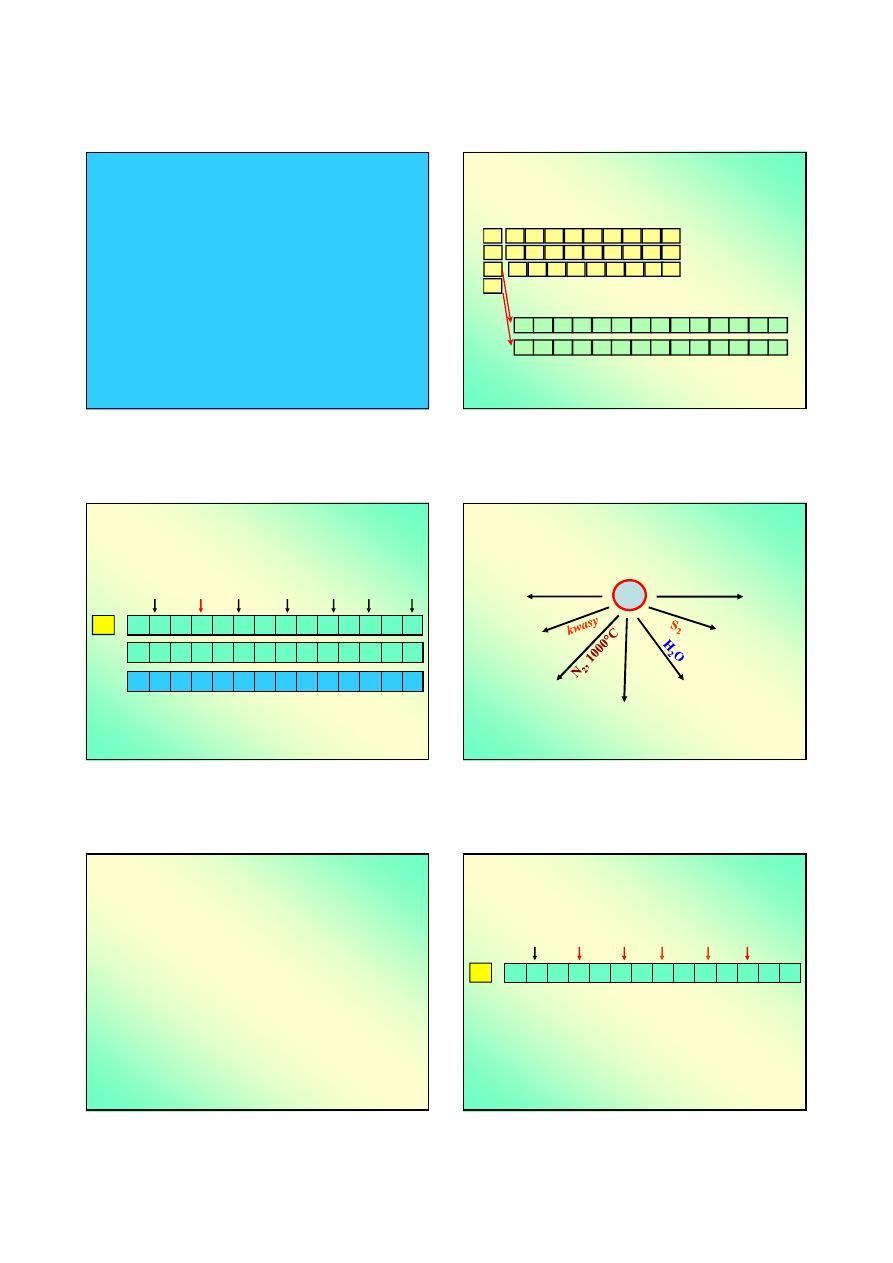
Związki pierwiastków (metali)
„przejściowych”
Chemia pierwiastków przejściowych
Pierwiastki wewnętrznoprzejściowe (blok f), lantanowce i
aktynowce, konfiguracja elektronowa:
[g.szl.] ns
2
(n-1)d
1
(n-2) f
m
(m=1,2,.....14)
Sc Ti V Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo
Tc
Ru Rh Pd Ag Cd
La
Hf Ta W Re Os Ir Pt Au Hg
Ce Pr
Ac
Ac
Nd
Pm
Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U
Np Pu Am Cm
Cf Es Fm Md No Lr
Bk
Pierwiastki przejściowe – niecałkowicie zapełniona
podpowłoka d (i/lub f). Grupy 3-12; pierwiastki
zewnętrznoprzejściowe konfiguracja elektronowa:
[g.szl.] ns
2
(n-1)d
n
(n=1,2,.....10)
Chemia lantanowców – pierwiastków
wewętrznoprzejściowych
Pierwiastki wewnętrznoprzejściowe w szóstym okresie
noszą nazwę
lantanowców
. Inna nazwa to:
metale ziem
rzadkich.
Ich konfiguracja elektronowa
[Xe]6s
2
5d
1
4f
m
Ce Pr Nd
Pm
Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
La
Prazeodym
Promet
Europ Terb Holm Tul Lutet
Lantan Cer
Neodym
Samar Gadolin Dysproz Erb Iterb
f
1
f
2
f
3
f
4
f
5
f
6
f
7
f
8
f
9
f
10
f
11
f
12
f
13
f
14
6s
2
5d
1
4
103101 100
96 95 94 92 91 89 88 87 86 85
r
j
3+
[pm]
Pierwiastki metaliczne, tworzą sieci o symetrii
regularnej lub heksagonalnej.
Występują zazwyczaj na +3 stopniu utlenienia, tworząc
wiązania o przeważającym charakterze jonowym
Związki lantanowców
Charakter chemiczny lantanowców - podobieństwo do
glinowców i berylowców
Ln
O
2
Ln
2
O
3
LnX
3
X
2
halogeny
sole + H
2
↑↑↑↑
Ln
2
S
3
LnN
Ln(OH)
3
+ H
2
↑↑↑↑
powoli
+ C
LnC
2
metanek
Związki lantanowców (2)
o
Zastosowania lantanowców i ich związków:
o
metaliczne jako dodatki do stopów (zwiększenie
wytrzymałości wysokotemperaturowej, twardości);
o
tlenki – luminofory w ekranach telewizyjnych;
o
katalizatory;
o
nadprzewodniki wysokotemperaturowe;
o
elektrolity stałe (najczęściej w tlenkach złożonych);
o
moderatory w reaktorach atomowych.
Aktynowce
Pierwiastki wewnętrznoprzejściowe w siódmym okresie
noszą nazwę
aktynowców
. Ich konfiguracja elektronowa
[Rn]7s
2
6d
1
5f
m
Th Pa U
Np Pu AmCm Bk Cf Es Fm Md No Lr
Ac
Protaktyn Neptun
Ameryk Berkel Einstein Mendelew
Law-
Aktyn Tor Uran
Pluton Kiur Kaliforn Ferm Nobel
rans
Pierwiastki metaliczne, tworzą sieci o symetrii regularnej
lub heksagonalnej. Pierwiastki o nietrwałych izotopach,
cięższe od uranu, noszą też nazwę transuranowców, i
otrzymuje się je na drodze sztucznych przemian
promienitwórczych.
2013-06-10
2
Aktynowce
Np
U
U
239
93
min
5
,
23
,
239
92
1
0
238
92
2
/
1
→
→
+
=
−
t
n
β
Pu
Np
239
94
239
93
→
−
β
239
Pu , podobnie jak
235
U jest izotopem rozszczepialnym.
Aktynowce tworzą związki na +III stopniu utlenienia
(elektrony (n-1)d i ns);
U, Np, Pu tworzą związki na stopniach +III do +VI z
udziałem elektronów z podpowłoki f. Podobnie jak w
lantanowcach promienie jonowe maleją ze wzrostem
liczby atomowej.
Pierwiastki zewnętrznoprzejściowe
Grupy 3-12 (IIIB do II B); pierwiastki
zewnętrznoprzejściowe konfiguracja elektronowa:
[g.szl.] ns
2
(n-1)d
n
(n=1,2,.....10)
III B
3
IV B
4
VB
5
VI B
6
VII B
7
VIII B
8 9 10
I B
11
II B
12
Sc
3d
1
4s
2
Ti
3d
2
4s
2
V
3d
3
4s
2
Cr
3d
5
4s
1
Mn
3d
5
4s
2
Fe
3d
6
4s
2
Co
3d
7
4s
2
Ni
3d
8
4s
2
Cu
3d
10
4s
1
Zn
3d
10
4s
2
Y
4d
1
5s
2
Zr
4d
2
5s
2
Nb
4d
3
5s
2
Mo
4d
5
5s
1
Te
4d
5
5s
2
Ru
4d
7
5s
1
Rh
4d
8
5s
1
Pd
4d
10
5s
0
Ag
4d
10
5s
1
Cd
4d
10
5s
2
La
5d
1
6s
2
Hf
5d
2
6s
2
Ta
5d
3
6s
2
W
5d
5
6s
1
Re
5d
5
6s
2
Os
5d
6
6s
2
Ir
5d
7
6s
2
Pt
5d
9
6s
1
Au
5d
10
6s
1
Hg
5d
10
6s
2
(n-1)d
4
ns
2
→
(n-1)d
5
ns
1
(n-1)d
9
ns
2
→
(n-1)d
10
ns
1
↑↓
↑↓
↑↓
↑↓
↑↑↑↑ ↑↑↑↑ ↑↑↑↑ ↑↑↑↑
↑↑↑↑
↑↑↑↑ ↑↑↑↑ ↑↑↑↑ ↑↑↑↑
↑↑↑↑
→
→
→
→
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓↑↓
↑↓
↑↓
↑↓↑↓
↑↓
↑↓
↑↓ ↑↓
↑↓
↑↓
↑↓ ↑↑↑↑
→
→
→
→
↑↑↑↑
↑↓
↑↓
↑↓
↑↓ ↑↓
↑↓
↑↓
↑↓↑↓
↑↓
↑↓
↑↓ ↑↓
↑↓
↑↓
↑↓ ↑↑↑↑
↓↓↓↓
Metale zewnętrznoprzejściowe
WŁAŚCIWOŚCI FIZYCZNE
☻
Sieci przetrzenne
regularne
lub
heksagonalne
;
☻
Temperatury topnienia
pierwiastków zmieniają
się w funkcji konfiguracji
elektronowej
☻
Promienie atomowe:
☻
są najwyższe na początku
każdego okresu (>170 pm);
☻
są najniższe w środku
każdego okresu (<130 pm);
☻
rosną w obrębie każdej
grupy
3
4
5
6
7
8
9 10 11 12
NUMER GRUPY
1000
2000
3000
4000
4
5
6
Metale zewnętrznoprzejściowe
WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE
Gęstość pierwiastków:
zwykle gęstość d > 5 gcm
-3
;
najlżejsze: Sc - 3,0 Y - 4,5 Ti - 4,5
najcięższe: Pt - 21,5 Os - 22,6 Ir - 22,7
Elektroujemność
- niska, choć znacznie wyższa niż
metali grup głównych
W związkach ten sam metal przejściowy występuje
na wielu stopniach utlenienia, od
+I
do
+VIII
. W
obrębie grupy ze wzrostem masy molowej rośnie
trwałość związków na wyższych stopniach
utlenienia, a maleje na niższych stopniach utlenienia.
W wyjątkowych przypadkach (tylko w związkach
koordynacyjnych) stopień utlenienia może wynosić
0
,
-I
lub
-II
.
Metale zewnętrznoprzejściowe
WŁAŚCIWOŚCI OPTYCZNE
Zabarwienie związków metali przejściowych
(w roztworach wodnych i w stanie stałym) –
absorpcja światła w zakresie promieniowania
widzialnego zależy od obecności elektronów d,
a więc także od stopnia utlenienia;
Zabarwienie roztworów wodnych związków
tytanu:
♦
Ti
4+
(brak elektronów d) bezbarwny
♦
Ti
3+
(1 elektron d)
ciemnoniebieski
♦
Ti
2+
(2 elektrony d)
fioletowy
Tlenki metali zewnętrznoprzejściowych
WŁAŚCIWOŚCI CHEMICZNE
Ze wzrostem stopnia utlenienia metalu przejściowego w tlenku
rośnie udział charakteru kowalencyjnego we wiązaniach
(równocześnie maleje udział wiążania jonowego).
Me
+
Me
3+
Me
+V
Me
+VII
wiązanie
jonowe
w
zr
o
st
u
d
zi
a
łu
w
ią
za
n
ia
k
o
w
a
le
n
c
y
jn
e
g
o
własności
zasadowe
własności
kwasowe
własności
amfote-
ryczne
własności
redukujące
własności
utleniające
wiązanie
kowalencyjne

2013-06-10
3
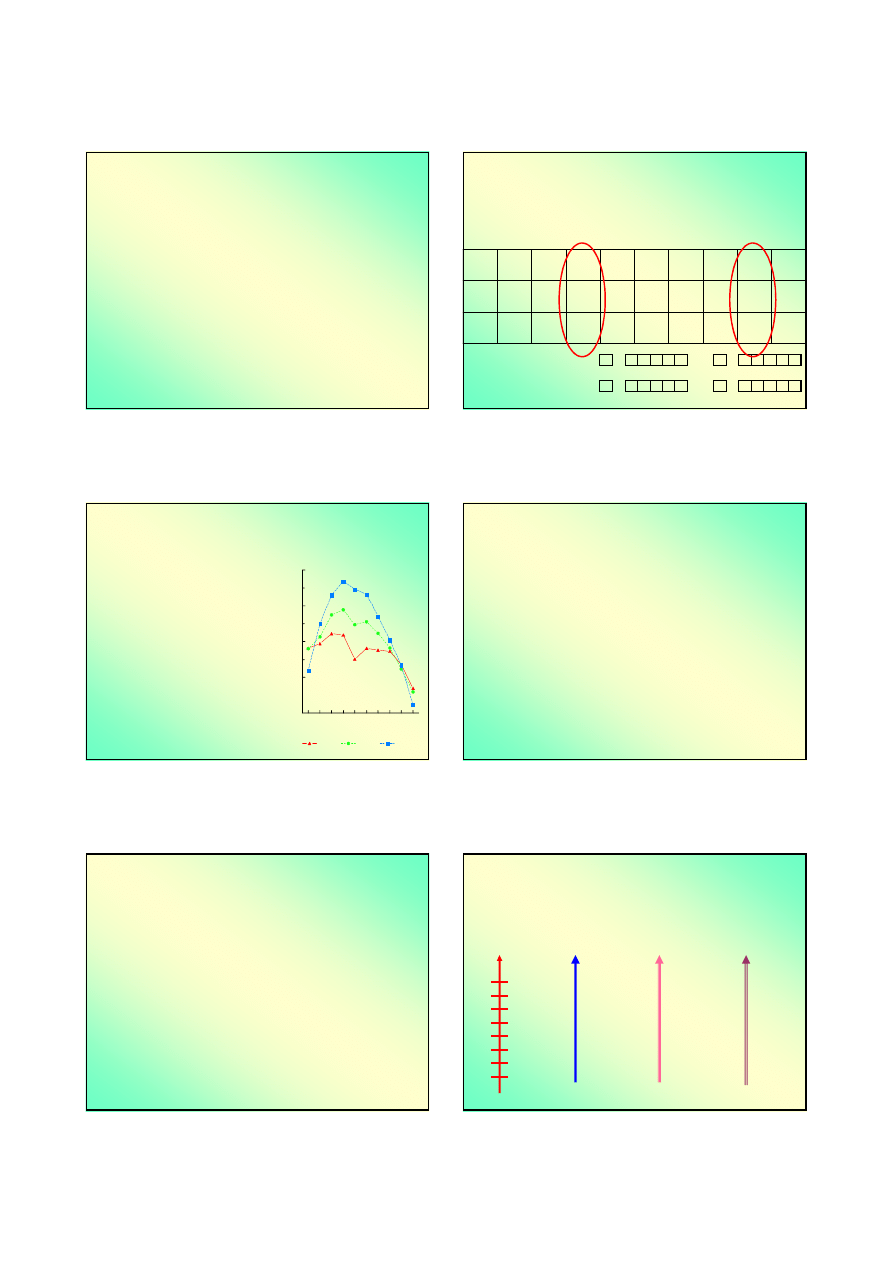
Chemia związków chromu
o
Konfiguracja elektronowa: 3d
5
4s
1
Stopień
utlenienia
ZWIĄZEK
Właściwości chemiczne
+2
CrCl
2
zasadowe
silnie redukujące
+III
Cr
2
O
3
Cr(OH)
3
amfoteryczne
+IV
CrO
2
amfoteryczne
+VI
CrO
3
CrO
4
2-
Cr
2
O
7
2-
kwasowe
silnie utleniające
Chemia związków chromu
Związki
Cr
2+
można otrzymać tylko na drodze
elektroredukcji. Jon
Cr
2+
jest bardzo silną zasadą:
↑
+
+
→
+
+
+
+
2
2
1
2
3
3
2
H
O
H
Cr
O
H
Cr
Cr
2+
Cr
3+
−
+
+
+
→
←
→
←
+
−
+
3
6
3OH
3
3H
2
3
Cr(OH)
Cr(OH)
O
3H
Cr
Cr
2
O
3
amfoteryczny
chromiany (III)
MgCr
2
O
4
, FeCr
2
O
4
Cr
+VI
CrO
3
utleniacz i
bezwodnik
kwasowy
4
2
2
3
CrO
H
O
H
CrO
→
+
-
2
4
3
2
4
2
CrO
O
H
2
O
H
2
CrO
H
+
↔
+
+
O
H
OH
O
Cr
O
H
2CrO
2
-
2
7
2
3
-
2
4
+
+
↔
+
−
+
O
3H
O
Cr
N
NH
CrO
2
3
2
2
3
3
+
+
→
+
środowisko
zasadowe
środowisko
kwaśne
Chemia związków manganu
o
Konfiguracja elektronowa: 3d
5
4s
2
Stopień
utlenienia
ZWIĄZEK
Właściwości
+2
MnSO
4
, MnCl
2
zasadowe
+3
Mn
2
O
3
amfoteryczne
+IV
MnO
2
, MnO(OH)
2
amfoteryczne
+V
MnO
4
3-
, Li
3
MnO
4
kwasowe,
utleniające
+VI
MnO
4
2-
, K
2
MnO
4
kwasowe,
utleniające
+VII
MnO
4
-
, KMnO
4
kwasowe
silnie utleniające
Chemia związków manganu (2)
Mn
O
2
Mn
3
O
4
X
2
halogeny
MnX
2
S
2
MnS
kwasy
sole Mn
2+
+ H
2
↑↑↑↑
N
2
Mn
3
N
2
C
Mn
3
C
Manganiany (V,VI,VII)
−
−
−
+
+
→
+
4OH
MnO
MnO
O
2H
2MnO
2
2
4
2
3
4
O
2H
O
Mn
O
2Mn
4H
O
3Mn
2
2
IV
4
VII
2
4
VI
+
+
→
+
−
+
−
e
+
→
−
−
4
2
4
MnO
MnO
Manganiany (VI)
można otrzymać na drodze reakcji w
powietrzu pomiędzy MnO
2
i wodorotlenkami lub węglanami
litowców
Manganiany (VII)
otrzymuje się przez elektrolityczne
utlenianie
manganianów (VI)
Manganiany (V, VI) ulegają reakcji dysproporcjonowania:
Potencjał utleniający manganianu (VII)zależy od środowiska:
O
4H
Mn
5
8H
O
Mn
2
2
4
VII
+
→
+
+
+
−
−
e
−
−
+
→
+
+
4OH
O
Mn
3
O
2H
O
Mn
2
IV
2
4
VII
e
−
−
→
+
2
4
VI
4
VII
O
Mn
O
Mn
e
E=1,55 V
E=0,59 V
E=0,56 V
Prawo stałości składu ?
♦
Daltonidy
– związki spełniające prawo stałości
składu (nazwa pochodzi od nazwiska Johna
Daltona).
♦
Bertolidy
– związki nie spełniające prawa
stałości składu. Odstępstwo od stechiometrii
jest mierzalne (nazwa pochodzi od nazwiska
Claude’a Louisa Bertholleta).
J.L.Proust
J.Dalton
C.L.Berthollet
2013-06-10
4
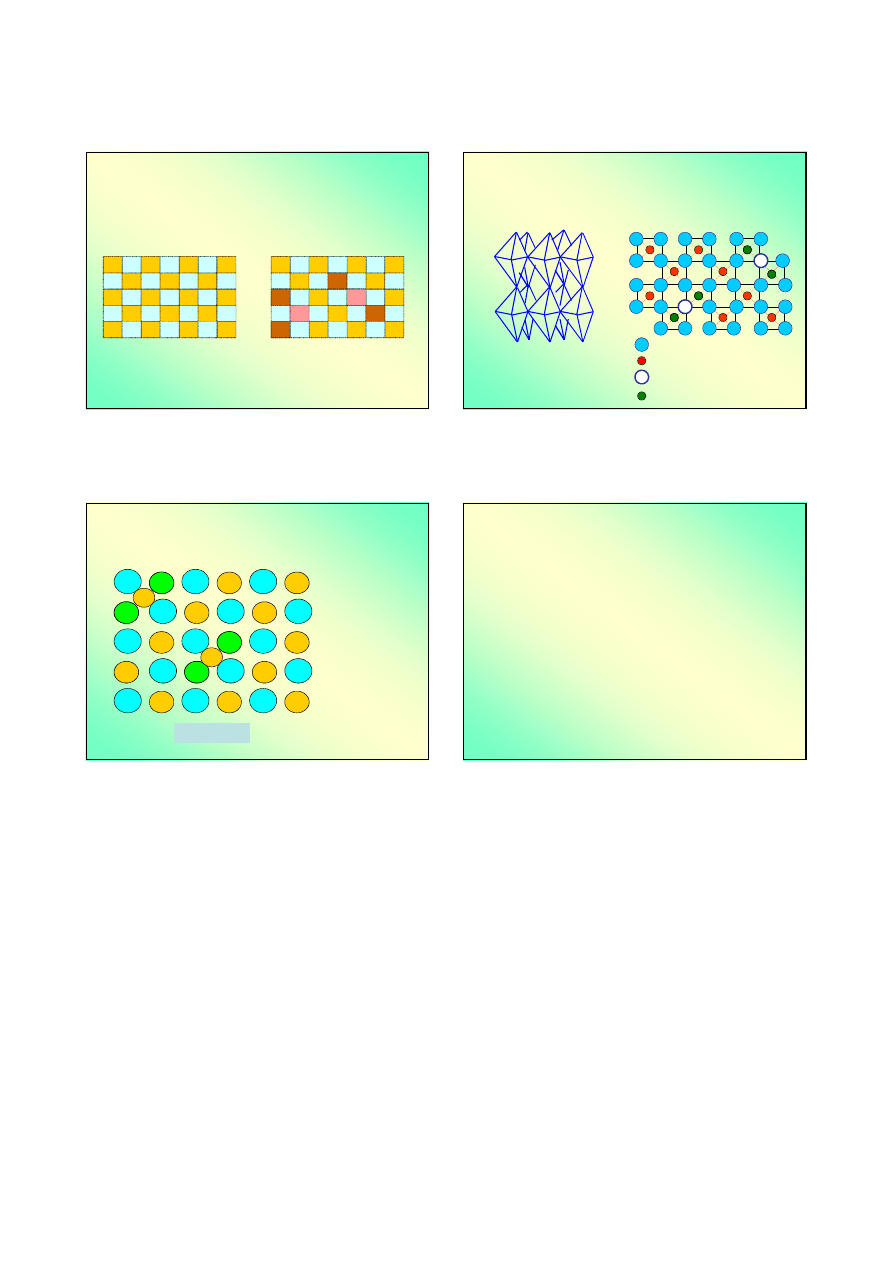
Związki niestechiometryczne (1)
Związki niestechiometryczne
wykazują odchylenia od składu
molowego w pewnym zakresie bez zmiany struktury
kryształów.
Tlenki żelaza: Fe
II
O, Fe
2
III
O
3
, Fe
3
O
4
[Fe
II
Fe
2
III
O
4
];
Wüstyt FeO wykazuje odstępstwa od stechiometrii – jego
prawdziwy wzór Fe
1-x
O [0 ≤ x ≤ 0,2] – jest to rzeczywisty
niedomiar metalu.
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
Fe
2+
O
2-
Fe
2+
O
2-
Fe
2+
O
2-
O
2-
FeO
Fe
3+
Fe
3+
Fe
3+
Fe
3+
Fe
1-x
O
O
Fe
Fe
III
2x
II
3x
1
+
+
−
Pojawieniu się każdej
luki kationowej
towarzyszy pojawienie się
dwóch jonów
Fe
+III
. Sumaryczny ładunek sieci nie zmienia się ...
Związki niestechiometryczne (2)
Tlenek wolframu (VI),
WO
3
,,
wykazuje luki (nieobsadzone
miejsca) w podsieci anionowej. Aniony tworzą sieć oktaedrów
ze wspólnymi wierzchołkami, kationy W
+VI
znajdują się w ich
ś
rodkach. Wzór uwzględniający niestechiometrię:
WO
3-x
Wyidealizowana (pod)sieć
anionów
O
2-
w
WO
3
O
2-
W
+VI
luka tlenowa
W
+V
WO
3-x
x
-
3
V
2x
VI
2x
1
O
W
W
+
+
−
Związki niestechiometryczne (3)
Tlenek cynku (II),
ZnO
,,
przejawia odstępstwa od stechiometrii
związane z pojawieniem się nadmiarowych atomów metalu:
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
O
2-
Zn
2+
Zn
+
Zn
2+
Zn
2+
Zn
+
Zn
+
Zn
+
W sieci
krystalicznej ZnO
pojawiają się
nadmiarowe jony
cynku, zwane
międzywęzłowymi.
Powoduje to także
obniżenie ładunku
innych jonów
cynku.
ZnO
Zn
1+x
O
Związki niestechiometryczne (4)
Występowanie odstępstwa od stechiometrii jest
charakterystyczne dla związków zawierających kationy
metali o zmiennym stopniu utlenienia (związki metali
przejściowych – tlenki, siarczki, halogenki):
rzeczywisty niedomiar metalu:
→
w sieci krystalicznej pozostają nieobsadzone miejsca kationów
(luki kationowe), a stopień utlenienia pozostałych kationów
ulega podwyższeniu
rzeczywisty niedomiar utleniacza:
→
w sieci krystalicznej pozostają nieobsadzone miejsca anionów
(luki anionowe), a stopień utlenienia kationów ulega
odpowiednio obniżeniu
rzeczywisty nadmiar metalu:
→
w sieci krystalicznej pojawiają się dodatkowe kationy metalu
(atomy międzywęzłowe), a stopień utlenienia pozostałych
kationów ulega odpowiednio obniżeniu
Wyszukiwarka
Podobne podstrony:
12 T 11id 13625 Nieznany (2)
OPI wyklad 12 wersja 20080227 p Nieznany
lab1 12 id 258878 Nieznany
12 WzmOperid 13315 Nieznany
DGP 2014 12 29 rachunkowosc i a Nieznany
15 11id 15945 Nieznany (2)
II CSK 330 12 1 id 209820 Nieznany
12 PompySmigloweid 13567 Nieznany
Ek w 12, Przyczyny wzrostu, l Nieznany
11 12 2012id 12071 Nieznany (2)
12 pradid 13571 Nieznany
Cwiczenie 12 id 99084 Nieznany
Calki, IB i IS, 2011 12 id 1073 Nieznany
zestaw 12 id 587976 Nieznany
Automatyka (wyk 11 12) ppt [try Nieznany
ldm rozmaite 12 id 264070 Nieznany
2007 12 Szkola konstruktorowid Nieznany (2)
02 11id 3346 Nieznany (2)
więcej podobnych podstron