
62 Â
WIAT
N
AUKI
Listopad 1998
U
k∏ad okresowy pierwiastków to
jeden z najpot´˝niejszych sym-
boli nauk Êcis∏ych – tablica obej-
mujàca znacznà cz´Êç naszej wiedzy che-
micznej wisi na Êcianie niemal ka˝dej
pracowni chemicznej lub sali wyk∏ado-
wej na Êwiecie. ˚adna inna dziedzina
nauki nie dysponuje podobnym narz´-
dziem. Poczàtki uk∏adu okresowego ja-
ko metody klasyfikacji pierwiastków si´-
gajà ponad 200 lat wstecz. W czasie
swojej d∏ugiej historii – w miar´ rozwo-
ju nauki i odkrywania nowych pier-
wiastków – by∏ modyfikowany, udosko-
nalany, a czasem nawet podawano w
wàtpliwoÊç jego podstawy [patrz: Peter
Armbruster i Fritz Peter Hessberger,
„Tworzenie nowych pierwiastków”;
strona 56].
Jednak mimo ogromnych zmian, ja-
kie zasz∏y w nauce w naszym stuleciu –
rozwoju teorii wzgl´dnoÊci i mechaniki
kwantowej – w samej istocie uk∏adu
okresowego nie nastàpi∏ ˝aden zasadni-
czy przewrót. Kilka razy nowe odkry-
cia wydawa∏y si´ z poczàtku kwestio-
nowaç podstawy teoretyczne uk∏adu
okresowego, ale zawsze naukowcom
udawa∏o si´ w koƒcu dopasowaç nowe
wyniki do podstawowej struktury tabli-
cy. Notabene temu w∏aÊnie uk∏ad okre-
sowy zawdzi´cza zarówno swà d∏ugà
tradycj´, jak i przydatnoÊç we wspó∏cze-
snej nauce.
Poj´cie „okresowy” odzwierciedla fakt,
˝e we w∏aÊciwoÊciach chemicznych pier-
wiastków pojawiajà si´ w regularnych
odst´pach pewne prawid∏owoÊci. Gdyby
nie uproszczenie, które wprowadza ta-
blica, uczàcy si´ chemii musieliby zapa-
mi´taç w∏aÊciwoÊci wszystkich 112 pier-
wiastków. Na szcz´Êcie dzi´ki uk∏adowi
okresowemu chemikom wystarczy opa-
nowanie typowych dla ca∏ej grupy w∏a-
ÊciwoÊci kilku jedynie pierwiastków (we
Ewolucja
uk∏adu okresowego
Pierwsze próby jego stworzenia przypadajà
na koniec XVIII wieku – dziÊ bez tablicy pierwiastków
nie wyobra˝amy sobie nowoczesnej chemii
Eric R. Scerri

Â
WIAT
N
AUKI
Listopad 1998 63
wspó∏czesnej wersji uk∏adu okresowego
grupy tworzà kolumny).
Uk∏ad okresowy pierwiastków u∏o˝o-
no w wyniku na∏o˝enia si´ kilku osià-
gni´ç naukowych; nie by∏ on przeb∏y-
skiem geniuszu jednostki. Mimo to za
dat´ formalnych narodzin wspó∏czesnej
tablicy okresowej historycy uznajà naj-
cz´Êciej 17 lutego 1869 roku – wtedy ro-
syjski profesor chemii Dmitrij Iwanowicz
Mendelejew ukoƒczy∏ pierwszy ze swo-
ich licznych uk∏adów okresowych. Ta-
blica zawiera∏a 63 znane wówczas pier-
wiastki uporzàdkowane zgodnie ze
wzrastajàcà masà atomowà; Mendele-
jew pozostawi∏ równie˝ miejsca na pier-
wiastki jeszcze nie odkryte, których ma-
sy atomowe przewidzia∏.
Systemy porzàdkujàce pierwiastki
usi∏owano opracowaç równie˝ przed
Mendelejewem. Na przyk∏ad w roku
1787 francuski chemik Antoine Lavoi-
sier, wspó∏pracujàcy z Antoinem Four-
croyem, Louis-Bernardem Guyton de
Morveau i Claudem-Louis Bertholletem,
przedstawi∏ spis 33 znanych naonczas
pierwiastków. Spisy te by∏y tylko jed-
nowymiarowe. Si∏a wspó∏czesnej ta-
blicy okresowoÊci le˝y w dwu-, a nawet
trójwymiarowym przedstawieniu wszy-
stkich znanych pierwiastków (równie˝
tych, których jeszcze nie odkryto) w
uk∏adzie precyzyjnie i logicznie rozmie-
szczonych rz´dów i kolumn.
Niemiecki chemik Johann Döbereiner
we wczesnej próbie uporzàdkowania
pierwiastków w sensownà tablic´ wy-
kaza∏, ˝e wiele znanych pierwiastków
mo˝na po∏àczyç ze wzgl´du na ich po-
dobieƒstwo w trzyelementowe grupy,
które nazwa∏ triadami. Wydzieli∏ on tria-
d´ litu, sodu i potasu oraz chloru, bromu
i jodu. Dostrzeg∏ te˝, ˝e jeÊli pierwiast-
ki w triadzie uporzàdkuje si´ zgodnie
ze wzrastajàcà masà atomu, Êrodkowy
b´dzie mia∏ w∏aÊciwoÊci poÊrednie po-
mi´dzy w∏aÊciwoÊciami pierwszego
i trzeciego. Na przyk∏ad lit, sód i potas
∏atwo reagujà z wodà. Lit, najl˝ejszy
z triady, reaguje jednak mniej gwa∏-
townie ni˝ dwa pozosta∏e, najci´˝szy
natomiast potas wybucha raptownie.
Döbereiner spostrzeg∏ tak˝e, ˝e masa
atomowa Êrodkowego pierwiastka jest
mniej wi´cej Êrednià arytmetycznà mas
pierwszego i trzeciego.
Praca Döbereinera zach´ci∏a innych
do poszukiwaƒ zwiàzków mi´dzy che-
micznymi w∏aÊciwoÊciami pierwiast-
ków a ich masami atomowymi. W XIX
wieku kontynuowa∏ podejÊcie triadowe
m.in. Peter Kremers z Kolonii, który za-
sugerowa∏, ˝e niektóre pierwiastki mo-
gà nale˝eç do dwóch triad umieszczo-
nych prostopadle do siebie. Kremers
zapoczàtkowa∏ zatem nowy kierunek –
porównywanie pierwiastków w dwóch
wymiarach – który okaza∏ si´ póêniej
istotà systemu Mendelejewa.
W roku 1857 francuski chemik Jean-
-Baptiste-André Dumas zrezygnowa∏
z koncepcji triad i skoncentrowa∏ si´ na
stworzeniu uk∏adu równaƒ matema-
tycznych, które mog∏yby opisaç wzrost
masy atomowej w kilku grupach podob-
nych pierwiastków. ˚adna jednak pró-
ba uporzàdkowania pierwiastków we-
d∏ug ich mas atomowych nie mog∏a si´
powieÊç, poniewa˝ to nie masa atomo-
wa jest podstawowà w∏aÊciwoÊcià cha-
rakteryzujàcà pierwiastek, o czym wie
dziÊ ka˝dy chemik.
W∏aÊciwoÊci okresowe
Najwa˝niejszà cechà uk∏adu Men-
delejewa by∏o to, ˝e ukazywa∏ on okre-
sowoÊç, czyli powtarzanie si´ w∏aÊci-
woÊci pierwiastków w pewnych okre-
Êlonych odst´pach. By∏o jà widaç tak˝e
we wczeÊniejszym usystematyzowaniu
pierwiastków wed∏ug mas atomowych,
zaproponowanym w 1862 roku przez
francuskiego geologa Alexandra-Emila
de Chancourtois. System ten opiera∏ si´
na doÊç skomplikowanej konstrukcji
geometrycznej: de Chancourtois u∏o˝y∏
pierwiastki zgodnie z ich wzrastajàcà
masà atomowà na – nachylonej pod kà-
tem 45° do podstawy walca – spirali bie-
gnàcej po jego powierzchni bocznej [ilu-
stracja na nast´pnej stronie].
Pierwszy pe∏ny skr´t spirali przypa-
da∏ na tlen, drugi – na siark´. Pierwiast-
ki znajdujàce si´ na tej samej pionowej li-
nii na powierzchni cylindra odznacza∏y
si´ podobnymi w∏aÊciwoÊciami, w kon-
strukcji tej uda∏o si´ zatem uchwyciç
pewne cechy, które mia∏y si´ staç pod-
stawà póêniejszej tablicy Mendeleje-
wa. Mimo to z wielu przyczyn uk∏ad de
Chancourtois nie wywar∏ wielkiego
wp∏ywu na ówczesnà nauk´: pierwszy
prezentujàcy go artyku∏ nie zawiera∏ ry-
sunku tablicy, system by∏ doÊç skompli-
kowany, a podobieƒstwa w∏aÊciwoÊci
chemicznych pierwiastków nie zosta∏y
przedstawione zbyt przekonujàco.
W latach szeÊçdziesiàtych XIX wieku
swoje wersje uk∏adu okresowego zapro-
ponowa∏o kilku innych badaczy. Pos∏u-
gujàc si´ nowymi, standaryzowanymi
masami atomowymi, w roku 1864 an-
gielski chemik John Newlands zasuge-
rowa∏, ˝e gdy u∏o˝yç wed∏ug nich pier-
wiastki, ka˝dy wyka˝e w∏aÊciwoÊci po-
dobne do wykazywanych przez pier-
wiastek znajdujàcy si´ osiem miejsc do
przodu lub do ty∏u. Cech´ t´ Newlands
nazwa∏ „prawem oktaw”.
TRÓJWYMIAROWA TABLICA przekszta∏ca tradycyjny uk∏ad okresowy w wielowarstwo-
wà struktur´. Dawne pionowe kolumny, odpowiadajàce grupie pierwiastków, biegnà tu-
taj w dó∏ równolegle do g∏ównej osi konstrukcji (np. H, Li, Na itd.), a tak˝e poprzez warstwy.
Pierwiastki umieszczone w warstwach jeden nad drugim, na przyk∏ad He, Ne, Ar, nale˝à
do tej samej grupy, majà zatem zbli˝one w∏aÊciwoÊci chemiczne. Poziome rz´dy, czyli okre-
sy, tradycyjnej tablicy odpowiadajà wielu warstwom uk∏adu trójwymiarowego. Tablica
unaocznia symetri´ uk∏adu okresowego, zw∏aszcza regularnie zwi´kszajàcy si´ okres, w∏a-
ÊciwoÊç, której na razie nie uda∏o si´ w pe∏ni wyjaÊniç na gruncie mechaniki kwantowej.
DAN WAGNER

W swej pierwszej tablicy pozostawi∏
on miejsca na brakujàce pierwiastki, ale
jej bardziej rozpowszechniona wersja
z roku 1866 ju˝ ich nie zawiera∏a. Inni
chemicy natychmiast zakwestionowali
tablic´, poniewa˝ nie dawa∏a mo˝liwo-
Êci w∏àczenia do niej nowych pierwiast-
ków, które ewentualnie zosta∏yby od-
kryte. Cz´Êç naukowców nawet otwarcie
kpi∏a z pomys∏u Newlandsa. Na spotka-
niu Chemical Society w Londynie w ro-
ku 1866 George Carey Foster z Universi-
ty College London spyta∏ go, czy nie
rozwa˝a∏ przypadkiem u∏o˝enia pier-
64 Â
WIAT
N
AUKI
Listopad 1998
JEDNÑ z pierwszych wersji
systemu klasyfikujàcego zna-
ne pierwiastki zaproponowa∏
w 1862 roku francuski geolog
Emile Béguyer de Chancour-
tois. Tzw. Êruba telluryczna
jest najwczeÊniejszà wersjà
uk∏adu okresowego.
PIERWSZY UK¸AD OKRESOWY opracowa∏ w lutym 1869 roku rosyjski
chemik Dmitrij Iwanowicz Mendelejew. Na tym szkicu pierwiastki sà u∏o˝o-
ne poziomo, a nie w znajomych kolumnach. Mendelejew sporzàdzi∏ wiele ta-
blic obu typów.
SCIENCE & SOCIETY PICTURE LIBRARY/SCIENCE MUSEUM, LONDON
OESPER COLLECTION, UNIVERSITY OF CINCINNATI
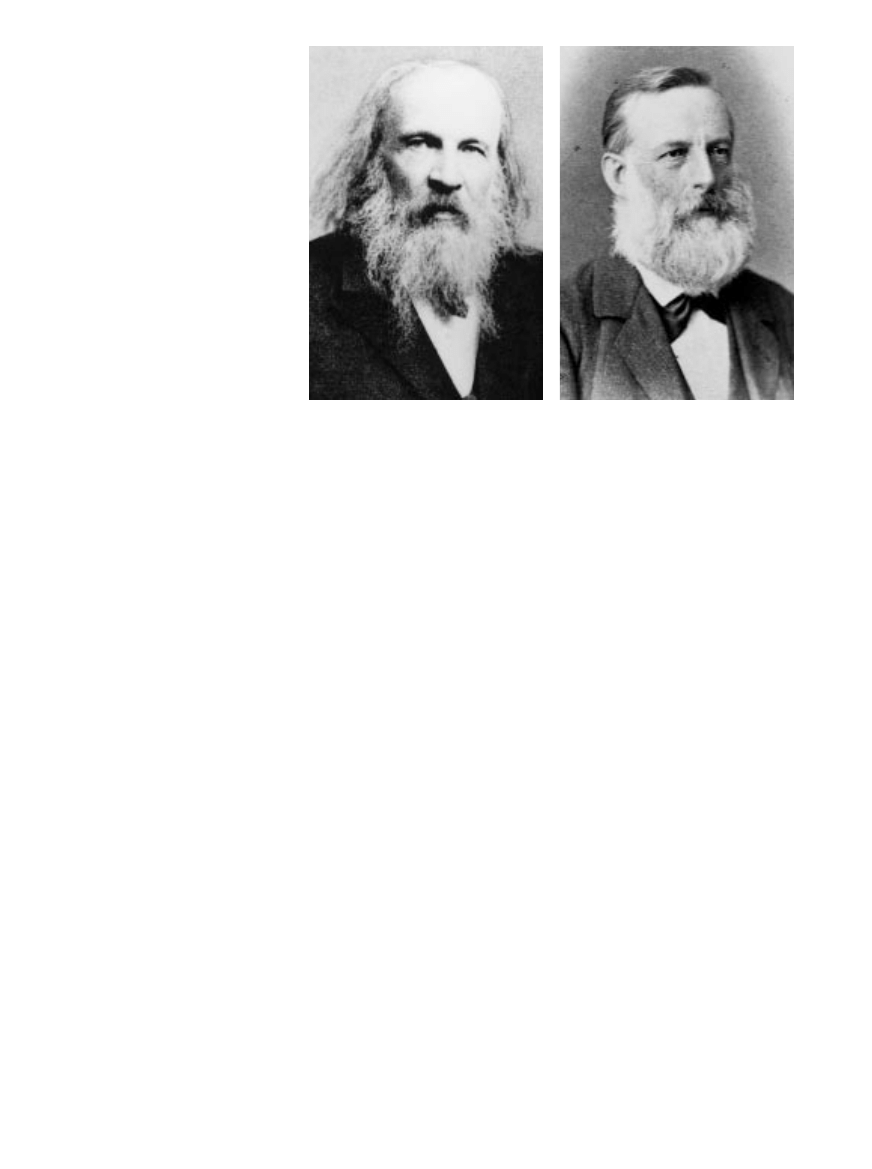
wiastków alfabetycznie, bo przecie˝ ka˝-
de uporzàdkowanie mo˝e prowadziç
do przypadkowych zbie˝noÊci. W re-
zultacie Chemical Society odmówi∏a pu-
blikacji artyku∏u Newlandsa.
Mimo niech´tnego przyj´cia jego pra-
ca jest pierwszym przypadkiem u˝ycia
sekwencji liczb naturalnych (opartej na
masach atomowych) do klasyfikacji pier-
wiastków. Pod tym wzgl´dem New-
lands ubieg∏ autorów wspó∏czesnego
uk∏adu okresowego, którzy pos∏u˝yli si´
sekwencjà tzw. liczb atomowych. (Poj´-
cie liczby atomowej, oznaczajàcej liczb´
dodatnio na∏adowanych czàstek, czyli
protonów w jàdrze atomowym, powsta-
∏o dopiero na poczàtku XX wieku.)
Wspó∏czesny uk∏ad okresowy
Julius Lothar Meyer, niemiecki che-
mik z Breslau Universität, podczas uzu-
pe∏niania w 1868 roku swojego pod-
r´cznika chemii przedstawi∏ uk∏ad okre-
sowy, który okaza∏ si´ zdumiewajàco po-
dobny do s∏ynnej wersji Mendelejewa
z roku 1869, choç Meyer nie wszystkie
pierwiastki sklasyfikowa∏ poprawnie.
Z powodu opóênieƒ wydawniczych jego
tablica ukaza∏a si´ jednak drukiem do-
piero w roku 1870, co doprowadzi∏o do
ostrego sporu o pierwszeƒstwo mi´dzy
Meyerem a Mendelejewem.
Mniej wi´cej w tym samym czasie
Mendelejew, równie˝ piszàc podr´cz-
nik chemii, przygotowa∏ swojà wersj´
tablicy. W przeciwieƒstwie do poprzed-
ników uczony by∏ tak pewny swego
uk∏adu okresowego, ˝e pos∏u˝y∏ si´ nim
do przewidzenia kilku nowych pier-
wiastków, a tak˝e w∏aÊciwoÊci ich
zwiàzków. Wprowadzi∏ równie˝ po-
prawki w masach atomowych paru ju˝
znanych pierwiastków. Co ciekawe,
Mendelejew przyzna∏, ˝e widzia∏ nie-
które wczeÊniejsze tablice, na przyk∏ad
Newlandsa, twierdzi∏ jednak, ˝e gdy
przygotowywa∏ swój uk∏ad, nie zna∏
pracy Meyera.
Chocia˝ praca rosyjskiego chemika
przewidywa∏a istnienie nie odkrytych
pierwiastków, co by∏o z pewnoÊcià jej
wielkà zaletà, historycy zbyt pochopnie
uznajà ten fakt za decydujàcy o akcep-
tacji uk∏adu Mendelejewa. W uzasad-
nieniu nadania Mendelejewowi w 1882
roku medalu Davy’ego przez Royal So-
ciety of London nie wspomniano o tych
przewidywaniach. Wydaje si´, ˝e do
przyj´cia tablicy Mendelejewa w rów-
nej mierze co b∏yskotliwe prognozy
przyczyni∏a si´ jego umiej´tnoÊç klasyfi-
kacji znanych ju˝ pierwiastków. Mimo
i˝ bardzo wielu naukowców przyczy-
ni∏o si´ do opracowania uk∏adu okreso-
wego, zas∏ug´ przypisuje si´ Mendeleje-
wowi jako temu, który nada∏ owemu
odkryciu rang´ prawa przyrody, a po-
nadto reszt´ ˝ycia sp´dzi∏ na odwa˝-
nym badaniu implikacji tego systemu
i obronie tezy o jego prawdziwoÊci.
Obrona ta nie by∏a ∏atwym zadaniem
– w wyniku kolejnych odkryç cz´sto
kwestionowano poprawnoÊç uk∏adu
okresowego. Powa˝nie zagro˝ony by∏
m.in. w roku 1894, kiedy William Ram-
say z University College London i lord
Rayleigh (John William Strutt) z Royal
Institution w Londynie odkryli argon.
W ciàgu nast´pnych kilku lat Ramsay
zidentyfikowa∏ cztery inne pierwiastki:
hel, neon, krypton i ksenon – znane ja-
ko gazy szlachetne. (Ostatni z nich, ra-
don, odkry∏ w roku 1900 niemiecki fi-
zyk Friedrich Ernst Dorn.)
Nazwa „szlachetne” wzi´∏a si´ stàd,
˝e wszystkie te gazy wydajà si´ wyró˝-
niaç spoÊród innych pierwiastków,
rzadko wchodzàc z nimi w reakcje pro-
wadzàce do powstania zwiàzków. W
rezultacie niektórzy chemicy sugero-
wali, i˝ gazy szlachetne wr´cz nie na-
le˝à do uk∏adu okresowego. Ich istnie-
nia nie przewidzia∏ ani Mendelejew,
ani nikt inny. Dopiero po szeÊciu latach
intensywnych wysi∏ków chemików i
fizyków uda∏o si´ w∏àczyç je do uk∏a-
du. Nowa wersja tablicy zawiera∏a do-
datkowà kolumn´ pomi´dzy fluorow-
cami (grupà gazowych pierwiastków
z fluorem, chlorem, bromem, jodem i
astatem) a metalami alkalicznymi (li-
tem, sodem, potasem, rubidem, cezem
i fransem).
Kwestià kontrowersyjnà by∏o tak-
˝e dok∏adne u∏o˝enie pierwiastków.
W oryginalnej tablicy Mendelejewa
pierwiastki rozmieszczone zosta∏y ze
wzgl´du na swojà mas´ atomowà, w ro-
ku 1913 jednak holenderski fizyk teo-
retyczny-amator Anton van den Broek
zasugerowa∏, ˝e pierwiastki powin-
ny byç u∏o˝one wed∏ug wielkoÊci ∏a-
dunku jàdra atomu. Hipotez´ t´ spraw-
dzi∏ w tym samym roku fizyk Henry
Moseley z University of Manchester, na
krótko przed swà Êmiercià podczas
I wojny Êwiatowej.
Moseley rozpoczà∏ prac´ od sfoto-
grafowania widm rentgenowskich 12
pierwiastków, z których 10 zajmowa∏o
kolejne pozycje w uk∏adzie okresowym.
Odkry∏ on, ˝e cz´stoÊci, przy których
pojawia si´ w widmach ró˝nych pier-
wiastków tzw. linia K, sà wprost pro-
porcjonalne do kwadratu liczby ca∏ko-
witej okreÊlajàcej miejsce ka˝dego z
pierwiastków w uk∏adzie okresowym.
Jak sformu∏owa∏ to Moseley, by∏ to do-
wód, ˝e „atomy charakteryzuje pod-
stawowa wielkoÊç, która zwi´ksza
si´ w regularny sposób przy przejÊciu
od jednego pierwiastka do drugiego”.
W 1920 roku Ernest Rutherford, wów-
czas z University of Cambridge, okre-
Êli∏ jà po raz pierwszy jako liczb´ ato-
mowà; obecnie jest interpretowana jako
liczba protonów w jàdrze.
Â
WIAT
N
AUKI
Listopad 1998 65
UK¸AD OKRESOWY PIERWIASTKÓW w jego wspó∏czesnej postaci opracowali niemal
jednoczeÊnie chemicy Dmitrij Iwanowicz Mendelejew (z lewej) i Julius Lothar Meyer
(z prawej) pod koniec lat szeÊçdziesiàtych XIX wieku. Tablica Mendelejewa zosta∏a opu-
blikowana najpierw i to on zebra∏ laury za odkrycie chemicznej okresowoÊci, po pierwsze,
dlatego ˝e dzi´ki niej uda∏o mu si´ przewidzieç istnienie kilku pierwiastków, a po drugie,
˝e bardzo energicznie broni∏ poprawnoÊci swojej koncepcji.
CORBIS
-BETTMANN
(z
lewej)
; VAN PELT
-DIETRICH, UNIVERSITY OF PENNSYLVANIA
(z
prawej)
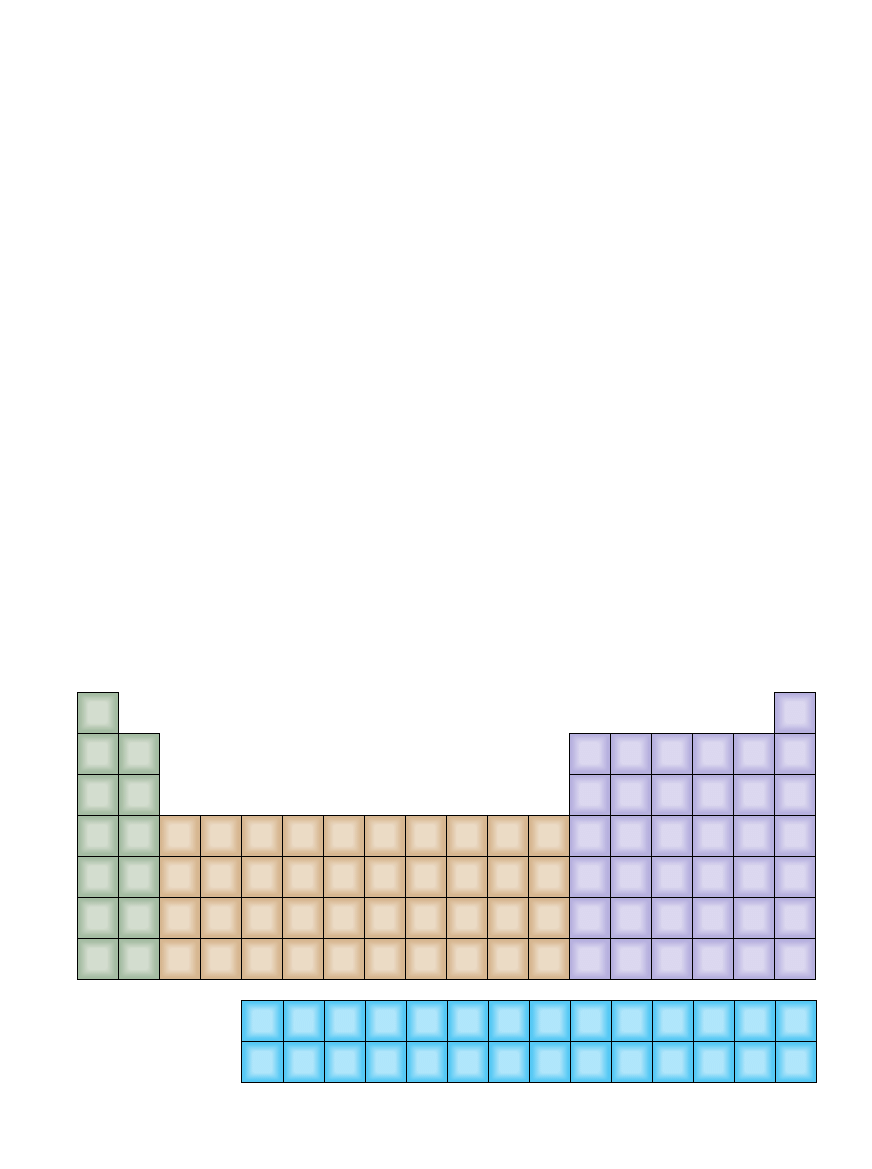
Praca Moseleya dostarczy∏a metod´,
która pozwala∏a dok∏adnie ustaliç, ile
wolnych miejsc pozosta∏o w uk∏adzie
okresowym. Po tym odkryciu chemicy
zacz´li u˝ywaç liczby, a nie masy ato-
mowej, jako podstawowej wielkoÊci
okreÊlajàcej porzàdek w uk∏adzie okre-
sowym. Rozwiàza∏o to wiele proble-
mów z u∏o˝eniem pierwiastków. Na
przyk∏ad gdyby jod i tellur zosta∏y upo-
rzàdkowane zgodnie z ich masà atomo-
wà (jod by∏by pierwszy), ze wzgl´du na
swoje w∏aÊciwoÊci chemiczne wydawa-
∏yby si´ u∏o˝one nieprawid∏owo. Gdy
jednak u∏o˝y si´ je zgodnie z ich liczbà
atomowà (tellur pierwszy), znajdà si´
na w∏aÊciwych pozycjach.
Zrozumienie atomu
Uk∏ad okresowy inspirowa∏ nie tyl-
ko chemików, ale równie˝ fizyków dà-
˝àcych do zrozumienia struktury ato-
mu. W 1904 roku pracujàcy w Cam-
bridge Joseph J. Thomson (który by∏ po-
nadto odkrywcà elektronu) opracowa∏
model atomu, zwracajàc szczególnà
uwag´ na okresowoÊç pierwiastków.
Wysunà∏ on hipotez´, ˝e atom danego
pierwiastka zawiera okreÊlonà liczb´
elektronów rozmieszczonych na kon-
centrycznych pierÊcieniach. Twierdzi∏
te˝, ˝e pierwiastki o zbli˝onych konfi-
guracjach elektronowych powinny mieç
podobne w∏aÊciwoÊci. Thomson opra-
cowa∏ zatem wyjaÊnienie okresowoÊci
pierwiastków. Chocia˝ wyobra˝a∏ so-
bie, ˝e pierÊcienie elektronów le˝à we-
wnàtrz g∏ównej struktury atomu, a nie
okrà˝ajà jàdro, jak uwa˝a si´ dzisiaj,
pierwszy zajà∏ si´ w swym modelu roz-
mieszczeniem elektronów w atomie –
zagadnieniem podstawowym dla ca∏ej
wspó∏czesnej chemii.
Duƒski fizyk Niels Bohr, który po raz
pierwszy zastosowa∏ teori´ kwantowà
w zwiàzku z budowà atomu, równie˝
inspirowa∏ si´ u∏o˝eniem pierwiastków
w uk∏adzie okresowym Mendelejewa.
W jego modelu atomu, opracowanym
w 1913 roku, elektrony zajmowa∏y ciàg
koncentrycznych pow∏ok okalajàcych
jàdro. Bohr rozumowa∏, ˝e pierwiastki
z tej samej grupy uk∏adu okresowego
majà prawdopodobnie identyczne kon-
figuracje elektronowe najbardziej ze-
wn´trznej pow∏oki i ˝e ich w∏aÊciwoÊci
chemiczne sà w znacznej mierze zale-
˝ne od u∏o˝enia elektronów w tej w∏a-
Ênie pow∏oce.
Model atomu Bohra pos∏u˝y∏ równie˝
do wyjaÊnienia, dlaczego gazy szlachet-
ne sà nieaktywne chemicznie. Poniewa˝
majà one ca∏kowicie zape∏nione elektro-
nami pow∏oki zewn´trzne, sà niezwy-
kle trwa∏e, a zatem niech´tnie tworzà
zwiàzki. W istocie – wi´kszoÊç innych
pierwiastków wchodzi w reakcje, aby
w pe∏ni obsadziç elektronami pow∏oki
zewn´trzne. Niedawno przeÊledzono
drog´ rozumowania, która pozwoli∏a
Bohrowi dojÊç do konfiguracji elektrono-
wych. Okaza∏o si´, ˝e wbrew temu, co
sàdzono, rozumowa∏ on raczej jak che-
mik. Nie wyprowadzi∏ konfiguracji elek-
tronowych z teorii kwantowej, lecz do-
szed∏ do nich na podstawie znanych
chemicznych i spektroskopowych w∏a-
ÊciwoÊci pierwiastków.
W 1924 roku inny fizyk, pochodzàcy
z Austrii Wolfgang Pauli, zabra∏ si´ do
wyjaÊnienia d∏ugoÊci rz´du, czyli okre-
su, w uk∏adzie okresowym. Rezulta-
tem by∏ tzw. zakaz Pauliego, zgodnie
z którym dwa elektrony nie mogà jed-
noczeÊnie istnieç w tym samym stanie
kwantowym, opisanym przez parame-
try zwane liczbami kwantowymi. D∏u-
goÊci nast´pujàcych po sobie okresów
wynikajà z doÊwiadczalnych dowodów
dotyczàcych kolejnoÊci zape∏niania po-
w∏ok elektronowych oraz z kwantowo-
-mechanicznych ograniczeƒ dotyczà-
cych czterech liczb kwantowych, któ-
re okreÊlajà stan elektronu.
Modyfikacje teorii kwantowej doko-
nane przez Wernera Heisenberga i Erwi-
na Schrödingera w po∏owie lat dwudzie-
stych nada∏y mechanice kwantowej jej
obecnà postaç. Wp∏yw tych zmian na
uk∏ad okresowy by∏ jednak raczej mini-
malny. Mimo wysi∏ków wielu fizyków
i chemików mechanika kwantowa nie
potrafi dok∏adniej wyjaÊniç podstaw
uk∏adu okresowego. Jej prawa nie t∏u-
maczà na przyk∏ad kolejnoÊci, w jakiej
elektrony zape∏niajà ró˝ne pow∏oki elek-
tronowe. Wykorzystujàc mechanik´
kwantowà, nie mo˝emy bezpoÊrednio
otrzymaç konfiguracji elektronowej ato-
mów, na której jest oparta wspó∏czesna
koncepcja uk∏adu okresowego. Po pier-
wsze, dlatego ˝e nie daje si´ uzyskaç
dok∏adnego rozwiàzania podstawowe-
66 Â
WIAT
N
AUKI
Listopad 1998
H
1
3
11
2
10
57
89
58
90
59
91
61
93
62
94
63
95
64
96
65
97
66
98
67
99
68
100
69
101
70
102
60
92
18
9
17
8
16
7
15
6
14
5
13
19
37
55
87
4
12
20
38
56
88
21
39
71
103
22
40
72
104
Na
Mg
Si
Al
P
Cl
S
Ar
Li
Be
C
B
N
F
O
Ne
Mn
Co
Fe
Ni
Zn
Cu
Ga
Ca
K
Sc
V
Ti
Cr
Er
Yb
Tm
La
Hf
Rf
23
41
73
105
24
42
74
106
25
43
75
107
26
44
76
108
27
45
77
28
46
78
29
47
79
30
48
80
31
49
81
32
50
82
33
51
83
34
52
84
35
53
85
36
54
86
109
Db
Sg
Bh
Hs
Mt
110*
111*
112*
113
†
114
†
115
†
116
†
117
†
118
†
Eu
Sm
Gd
Dy
Td
Ho
Lu
Pr
Ce
Nd
Pm
Tl
Bi
Pb
Po
Rn
At
Os
Re
Ir
Au
Pt
Hg
Ta
W
Cs
Ba
Fm
No
Md
Ac
Am
Pu
Cm
Cf
Bk
Es
Lr
Pa
Th
U
Np
Fr
Ra
Ge
Se
As
Br
Kr
Tc
Rh
Ru
Pd
Cd
Ag
In
Sr
Rb
Y
Nb
Zr
Mo
Sn
Te
Sb
I
Xe
He
POPULARNA WERSJA UK¸ADU OKRESOWEGO – znana ja-
ko forma d∏uga – znajduje si´ w ka˝dej niemal pracowni che-
micznej lub sali wyk∏adowej na Êwiecie. Zaletà tej tablicy jest
klarowne przedstawienie w postaci kolumn grup pierwiastków
o podobnych w∏aÊciwoÊciach chemicznych, nie ukazuje ona na-
tomiast symetrii uk∏adu. (Kolorami oznaczono pierwiastki o tym
samym typie zewn´trznej pow∏oki elektronowej.)
* Pierwiastki odkryte,
ale jeszcze oficjalnie
nie nazwane
† Pierwiastki jeszcze
nie odkryte
LAURIE GRACE
H
Na Mg
Si
Al
P
Cl
S
Ar
Li Be
C
B
N
F
O
Ne
Mn
Co
Fe
Ni
Zn
Cu
Ga
Ca
K
Sc
V
Ti
Cr
Er
Yb
Tm
Lu Hf
Eu
Sm
Gd
Dy
Td
Ho
La
Pr
Ce
Nd Pm
Tl
Bi
Pb
Po
Rn
At
Os
Re
Ir
Au
Pt
Hg
Ta W
Cs Ba
Fm
No
Md
Lr Rf
Am
Pu
Cm
Cf
Bk
Es
Ac
Pa
Th
U Np
113
†
115
†
114
†
116
†
118
†
117
†
Hs
Bh
Mt
111*
110*
112*
Db Sg
Fr Ra
Ge
Se
As
Br Kr
Tc
Rh
Ru
Pd
Cd
Ag
In
Sr
Rb
Y
Nb
Zr
Mo
Sn
Te
Sb
I
Xe
He
go równania mechaniki kwantowej –
równania Schrödingera – dla atomów
innych ni˝ atom wodoru). Po drugie,
nawet w ramach przybli˝eƒ, które sà
rutynowo stosowane w chemii kwan-
towej nikomu nie uda∏o si´ jak na razie
otrzymaç prawid∏owej kolejnoÊci wy-
pe∏nienia pow∏ok elektronowych. W re-
zultacie o mechanice kwantowej mo˝-
na jedynie powiedzieç, ˝e za pomocà
przybli˝eƒ matematycznych potrafi ona
odtworzyç pierwotne odkrycie Mende-
lejewa – nie umie natomiast przewidzieç
uk∏adu okresowego.
Wariacje na temat
W nieco ju˝ mniej odleg∏ych czasach
naukowcy proponowali najrozmaitsze
sposoby przedstawiania uk∏adu okre-
sowego. Na przyk∏ad Fernando Du-
four, emerytowany profesor chemii z
Colle`ge Ahuntsic w Montrealu, opraco-
wa∏ trójwymiarowà tablic´ okresowo-
Êci wykazujàcà – w przeciwieƒstwie do
zwyk∏ej dwuwymiarowej – elementar-
nà symetri´ uk∏adu. T´ samà cech´ mo˝-
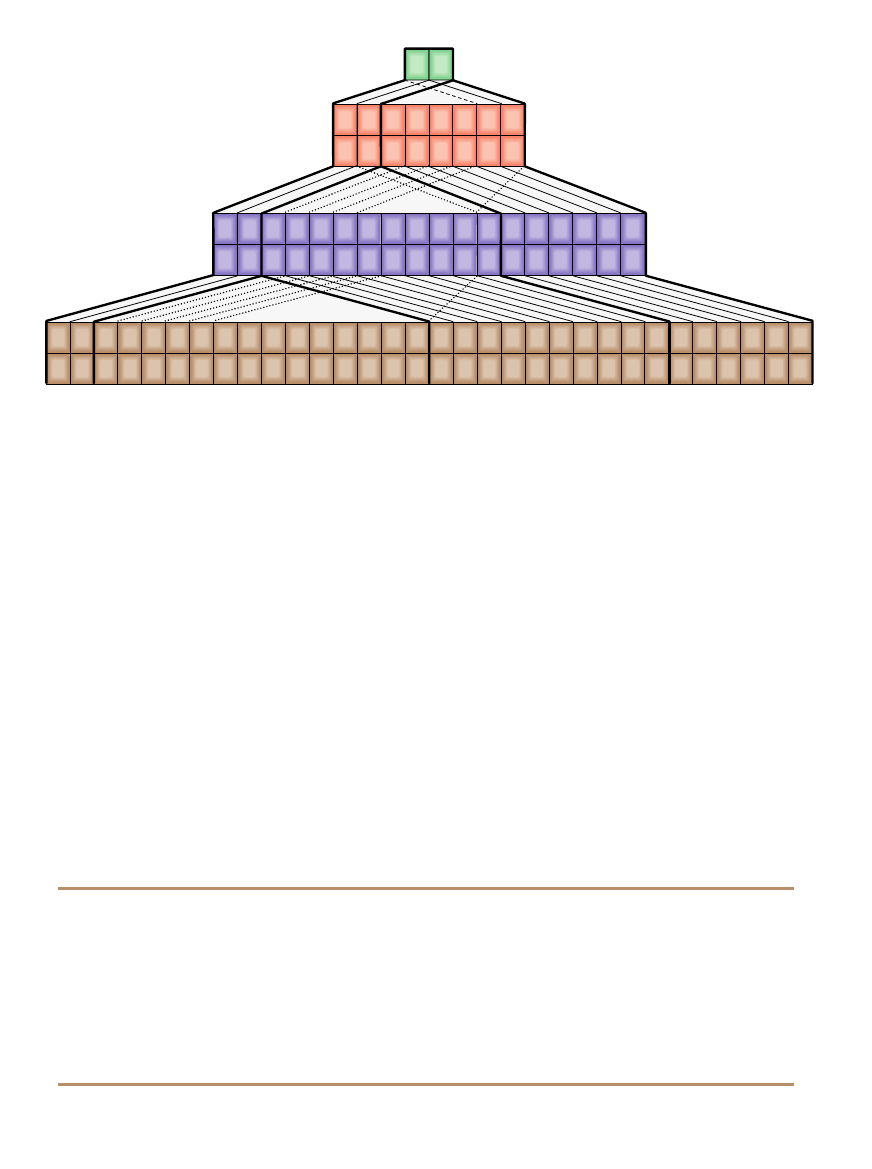
na zauwa˝yç w piramidalnej wersji ta-
blicy, wielokrotnie proponowanej, a
dopracowanej niedawno przez Willia-
ma B. Jensena z University of Cincinna-
ti [ilustracja powy˝ej].
Innym pomys∏em jest uk∏ad okreso-
wy, który uwzgl´dnia w∏aÊciwoÊci nie
pierwiastków, lecz zwiàzków. W roku
1980 Ray Hefferlin, fizyk z Southern
Adventist University w Collegedale
(Tennessee), opracowa∏ uk∏ad okreso-
wy dla wszystkich mo˝liwych czàste-
czek dwuatomowych, które da∏oby si´
utworzyç z pierwszych 118 pierwiast-
ków (na razie odkryto tylko 112). Z ta-
blicy Hefferlina wynika, ˝e niektóre
w∏aÊciwoÊci czàsteczek – jak odleg∏oÊç
mi´dzyatomowa czy energia potrzeb-
na do jonizacji czàsteczki – równie˝ wy-
kazujà pewnà regularnoÊç. Umo˝liwi∏a
ona naukowcom poprawne przewidy-
wanie w∏aÊciwoÊci dwuatomowych
czàsteczek.
Kierujàc si´ podobnymi przes∏anka-
mi, Jerry R. Dias, chemik z University
of Missouri w Kansas City, opracowa∏
okresowà klasyfikacj´ czàsteczek orga-
nicznych zwanych benzenoidowymi
w´glowodorami aromatycznymi. Naj-
prostszym ich przyk∏adem jest naftalen
(C
10
H
8
), znany jako naftalina. Klasyfi-
kacja Diasa jest analogiczna do triad
pierwiastków Döbereinera – ca∏kowita
liczba atomów w´gla i wodoru ka˝dej
ze Êrodkowych czàsteczek triady jest
Êrednià liczby tych atomów w otacza-
jàcych jà czàsteczkach zarówno w pio-
nie, jak i w poziomie. System ten zasto-
sowano do systematycznego badania
benzenoidowych w´glowodorów aro-
matycznych, a w po∏àczeniu z teorià
grafów pos∏u˝y∏ do przewidywania
trwa∏oÊci i reaktywnoÊci niektórych
z tych zwiàzków.
Jednak najwi´kszy i najtrwalszy
wp∏yw na nauk´ wywar∏ uk∏ad okreso-
wy pierwiastków. Po 200 latach prze-
kszta∏ceƒ pozostaje jàdrem chemii. Na-
le˝y do najbardziej zap∏adniajàcych
koncepcji naukowych i porównywalny
jest chyba tylko z teorià ewolucji Char-
lesa Darwina. Inaczej ni˝ w przypadku
teorii takich jak mechanika Newtona
post´py wspó∏czesnej fizyki nie pod-
wa˝y∏y prawdziwoÊci uk∏adu okreso-
wego ani go istotnie nie zmieni∏y – roz-
winà∏ si´ i dojrza∏, pozostajàc w zasadzie
nienaruszony.
T∏umaczy∏a
Magdalena Pecul
Â
WIAT
N
AUKI
Listopad 1998 67
Informacje o autorze
ERIC R. SCERRI studiowa∏ chemi´ na uniwersytetach
w Londynie, Cambridge i Southampton. Uzyska∏ na-
st´pnie doktorat z historii i filozofii nauki w King’s Col-
lege w Londynie. Od czasu przybycia do USA pracuje
w California Institute of Technology, a ostatnio wyk∏a-
da chemi´ w Bradley University w Peorii (Illinois).
W styczniu 1999 roku obejmie posad´ na Wydziale Che-
micznym Purdue University. Zainteresowania naukowe
Scerriego obejmujà histori´ i filozofi´ chemii; jest on
równie˝ wydawcà interdyscyplinarnego czasopisma
Foundations of Chemistry (http://www.cco.caltech.edu/
~scerri/ na World Wide Web). Jego adres e-mailowy to
scerri@bradley.edu
Literatura uzupe∏niajàca
THE PERIODIC SYSTEM OF CHEMICAL ELEMENTS: A HISTORY OF THE FIRST HUNDRED YEARS
. J.
W. van Spronsen; Elsevier, 1969.
THE SURPRISING PERIODIC TABLE: TEN REMARKABLE FACTS
. Dennis H. Rouvray, Chemical
Intelligencer, vol. 2, nr 3, ss. 39-47, VII/1996.
CLASSIFICATION, SYMMETRY AND THE PERIODIC TABLE
. William B. Jensen, Computing and
Mathematics with Applications, vol. 12B, nr 1-2, ss. 487-510, 1989.
PLUS ‚A CHANGE
. E. R. Scerri, Chemistry in Britain, vol. 30, nr 5, ss. 379-381, V/1994
(równie˝ inne artyku∏y w tym numerze).
THE ELECTRON AND THE PERIODIC TABLE
. Eric R. Scerri, American Scientist, vol. 85, ss. 546-
-553, XI-XII/1997.
HISTORYCZNY ROZWÓJ POJ¢å CHEMICZNYCH
. Roman Mierzecki; PWN, Warszawa1985.
Informacje o trójwymiarowym uk∏adzie Fernanda Dufoura mo˝na uzyskaç pod
adresem e-mailowym: fernduf@aei.ca
* Pierwiastki odkryte,
ale jeszcze oficjalnie nie nazwane
† Pierwiastki jeszcze nie odkryte
TABLICA PIRAMIDALNA jest innà postacià
uk∏adu okresowego, który ukazuje symetri´
prawa okresowoÊci, zw∏aszcza jeÊli chodzi
o d∏ugoÊç kolejnych okresów. Pokazana tutaj
jest zmodyfikowanà wersjà tablicy opracowa-
nej ostatnio przez Williama B. Jensena z Univer-
sity of Cincinnati. Grube ciàg∏e linie oddziela-
jà pierwiastki o tym samym typie zewn´trznej
pow∏oki elektronowej, linie cienkie – pier-
wiastki nale˝àce do tych samych
grup. Linie przerywane uka-
zujà drugorz´dne zwiàzki
pomi´dzy w∏aÊciwoÊciami
chemicznymi.
LAURIE GRACE
Wyszukiwarka
Podobne podstrony:
1998 01 str 10 Egzotyczne mezony
10. Fosfor -odmiany alotropowe, charakterystyka poszczególnych grup układu okresowego
ewolucja praktyki i teorii zarządzania personelem (10 str), Zarządzanie(1)
1998 01 str 10 Egzotyczne mezony
Pomiar napięć okresowo zmiennych metodą analogowego przetwarzania w przyrządach analogowych i cyfrow
Pomiar napięć okresowo zmiennych metodą analogowego przetwarzania w przyrządach analogowych i cyfrow
Budowa Układu Okresowego Pierwiastków
1998 10 03 prawdopodobie stwo i statystykaid 18585
otrzymywanie tlenu i siarki, charakterystyka poszczególnych grup układu okresowego
rynki kapitałowe w polsce (10 str), Bankowość i Finanse
1998 08 str 56 61 Gradientometria grawitacyjna
3 str 42 67
rynek kapitałowy (10 str)(1), Bankowość i Finanse
LIST INTENCYJNY 10 STR , Inne
bankowosść (10 str)(1), Bankowość i Finanse
11) Fosfan, charakterystyka poszczególnych grup układu okresowego
więcej podobnych podstron