
2010-10-12
1
Elektrotechnika
-
dział techniki zajmujący się praktycznym
zastosowaniem wiedzy dotyczącej elektryczności.
Główne zagadnienia, którymi się zajmuje:
• wytwarzanie energii elektrycznej
• przesyłanie energii elektrycznej
• użytkowanie energii elektrycznej
Zalety energii elektrycznej:
• łatwość przemiany na inny rodzaj energii
• łatwość przesyłania na duże odległości
• łatwość rozdziału między odbiorców
• gotowość do wykorzystania w dowolnej chwili
Podstawowe
działy elektrotechniki:
• elektroenergetyka
• maszyny i napędy elektryczne
• technika świetlna
• elektrotermia
• elektrochemia
Elektronika
– rozwinęła się na podłożu elektrotechniki.
Zajmuje się praktycznym wykorzystaniem zjawisk
związanych ze sterowanym ruchem elektronów.
Podstawowe dziedziny elektroniki:
• telekomunikacja
• informatyka
• energoelektronika
• automatyka

2010-10-12
2
Prąd elektryczny
Jest to uporządkowany ruch ładunków elektrycznych
wywołany różnicą potencjałów.
Warunki powstania prądu elektrycznego:
• nośniki ładunku muszą mieć możliwość poruszania
się w przestrzeni
(tzn. nie mogą być np. unieruchomione w sieci krystalicznej)
• musi istnieć przyczyna ruchu
(np. siła elektryczna F
E
=qE, dyfuzja, unoszenie)
Nośniki prądu elektrycznego
substancja przewodząca
nośnik
przewodnik
elektrony walencyjne
elektrolit
jony
gaz
jony i elektrony
półprzewodnik
elektrony i dziury
próżnia
dowolny rodzaj ładunków

2010-10-12
3
Podział ciał pod względem właściwości elektrycznych
a) przewodniki
•
I klasy - metale
Podczas przepływu prądu nie podlegają zmianom chemicznym
•
II klasy - roztwory
Podczas przepływu prądu podlegają zmianom chemicznym
b) dielektryki
Nie przewodzą prądu (elektrony silnie związane z atomem).
c) półprzewodniki
Ich przewodnictwo zmienia się pod wpływem różnych czynników
(np. domieszki, temperatura, pole elektryczne)
Struktura obwodu elektrycznego
Elementy obwodu elektrycznego:
a) aktywne -
dostarczają do obwodu energię elektryczną
-
źródło napięcia
napięcie źródłowe (SEM) nie zależy od natężenia prądu
-
źródło prądu
natężenie prądu nie zależy od napięcia
b) pasywne
– odbiorniki, zamieniają na inny rodzaj energii (np. rezystory) lub
magazynują energię pod postacią energii pola w polu elektrycznym
(kondensatory) lub w polu magnetycznym (indukcyjności)
Obwód elektryczny tworzą elementy połączone ze sobą w taki sposób,
że istnieje co najmniej jedna droga zamknięta dla przepływu prądu.
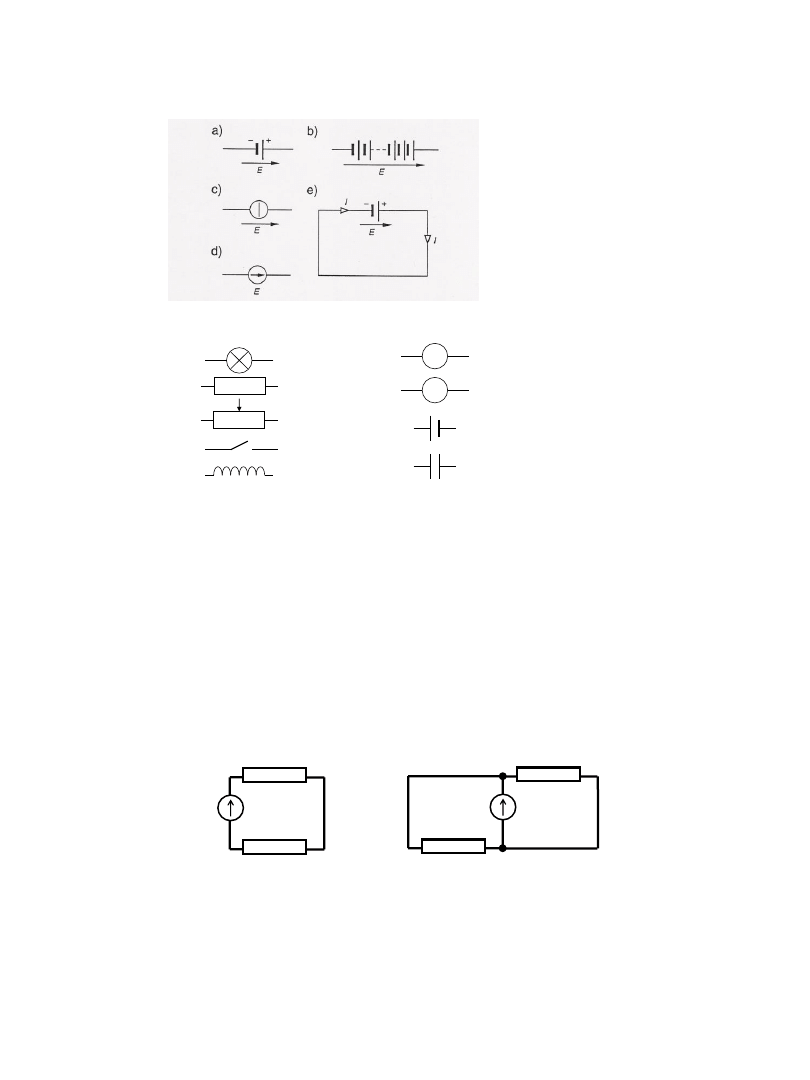
2010-10-12
4
żarówka
woltomierz
amperomierz
A
V
opornik stały
opornik suwakowy
źródło napięcia
kondensator
wyłącznik
cewka
a) ogniwo lub akumulator
b) bateria ogniw
c) i d)
oznaczenia źródeł
napięcia
e)
oznaczenie strzałki źródła
napięcia
obwód rozgałęziony:
Schematy najprostszych obwodów elektrycznych
odbiornik
E
odbiornik
E
odbiornik
obwód nierozgałęziony:

2010-10-12
5
Prawo Ohma
Natężenie prądu zależy wprost proporcjonalnie od napięcia
i odwrotnie proporcjonalnie od rezystancji:
gdzie:
R - rezystancja
U -
różnica potencjałów (napięcie)
I -
natężenie prądu
Prawo Ohma jest spełnione tylko wtedy, gdy rezystancja nie zależy od napięcia ani od
natężenia prądu.
Prawo Ohma dla obwodu zamkniętego:
gdzie:
R -
rezystancja obciążenia
E -
siła elektromotoryczna ogniwa
I -
natężenie prądu
r
W
-
rezystancja wewnętrzna ogniwa
V
A
R
U
I
w
r
R
E
I
Opór elektryczny (rezystancja)
-
opór właściwy (rezystywność)
Opór elektryczny ma wartość 1 , gdy natężenie przy napięciu 1 V
ma wartość 1 A.
Jest to
zależność empiryczna i obowiązuje w ograniczonym zakresie, gdyż
rezystancja
elementów zależy od wielu czynników takich jak temperatura,
wartość napięcia i prądu, częstotliwość itd. Zależność ta jest bardzo
często nieliniowa.
]
[
S
l
R
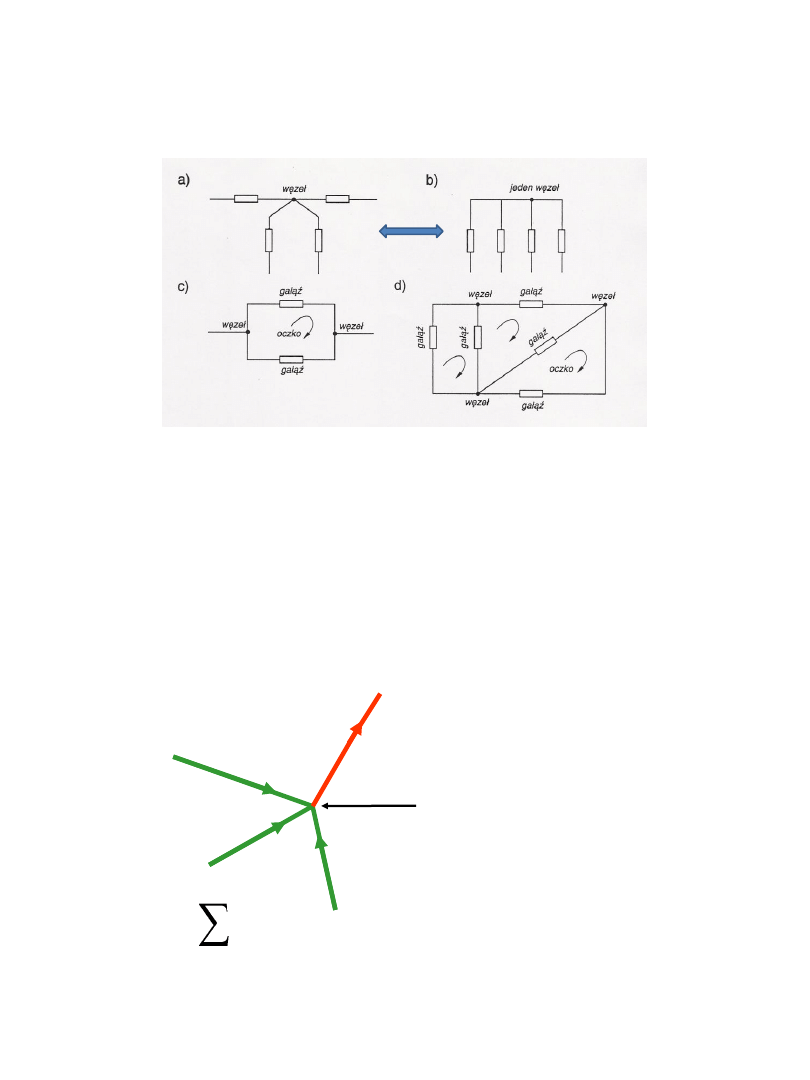
2010-10-12
6
a) i b)
węzeł obwodu elektrycznego
c)
połączenie dwóch gałęzi
d)
przykładowy schemat obwodu elektrycznego
Obwody rozgałęzione
schematy
równoważne
Prawa Kirchhoffa
I prawo (tzw. prądowe):
suma natężeń prądów dopływających do węzła jest równa
sumie natężeń prądów wypływających z węzła
0
=
I
k
k
I
2
=I
1
+I
3
+I
4
I
2
I
1
I
4
I
3
węzeł
2010-10-12
7
II prawo (tzw. napięciowe) :
suma sił elektromotorycznych w oczku jest równa
sumie spadków napięć na rezystancjach
∑
i
U
i
= 0
3
2
1
U
U
U
E
U
1
+
_
E
+
_
+
_
U
2
_
+
U
3
2010-10-12
8
R
1
R
2
R
3
R= R
1
+ R
2
+ R
3
R
1
R
2
2
1
1
1
1
R
+
R
=
R
rezystancja zastępcza:
równoległe
2
1
2
1
R
R
R
R
R
Łączenie rezystorów
szeregowe
rezystancja zastępcza:
Najbardziej rozpowszechnione źródła prądu stałego:
ogniwa elektrochemiczne (baterie i akumulatory)
Typy ogniw:
• ogniwa nieodwracalne (tzw. pierwotne)
w wyniku przemian chemicznych zachodzących podczas przepływu
prądu elektrycznego powstają w nich nieodwracalne zmiany
(a
więc: jednorazowe wykorzystanie)
• ogniwa odwracalne (tzw. wtórne)
można je wielokrotnie ładować i rozładowywać

2010-10-12
9
Ogniwo Leclanche’go
bateria cynkowo
– węglowa
A
– szczelne, nieprzewodzące zamknięcie
B
– katoda (biegun dodatni)
pr
ęt grafitowy z metalową końcówką
C
– anoda (biegun ujemny)
cylinder cynkowy
D
– elektrolit, najczęściej mieszanina:
MnO
2
, NH
4
Cl (salmiak) i ZnCl
2
Bezpośrednim źródłem SEM są reakcje utlenienia cynku (elektroda cynkowa):
i redukcji jonów amonowych (elektroda węglowa):
napięcie nominalne: 1.5 V
e
Zn
Zn
2
2
2
3
4
2
2
2
H
NH
e
NH
Powstający amoniak jest wiązany przez kationy cynkowe:
powstający wodór jest wiązany przez tlenek manganu,
który pełni rolę depolaryzatora:
2
4
3
3
2
]
)
(
[
4
NH
Zn
NH
Zn
O
H
O
Mn
H
MnO
2
3
2
2
2
2
Bateria alkaliczna
Nazwa tego typu baterii bierze się od alkalicznych (zasadowych)
roztworów, stosowanych w charakterze elektrolitu.
Anoda
– sproszkowany Zn (zwiększa to powierzchnię anody,
zmniejsza wewnętrzny opór baterii, zwiększa gęstość energii).
Katoda
– sproszkowany dwutlenek manganu MnO
2
Elektrolit
– wodorotlenek potasu KOH
Baterie alkaliczne charakteryzują się lepszymi od baterii cynkowo-węglowych parametrami:
większą gęstością energii, dłuższym czasem przydatności do użycia, odpornością na wycieki,
lepszą wydajnością zarówno w pracy ciągłej jak i z przerwami, niższym oporem wewnętrznym
pozwalającym na pobór większych mocy oraz funkcjonowanie w szerszym zakresie temperatur.
bateria cynkowo-
węglowa
bateria alkaliczna
2010-10-12
10
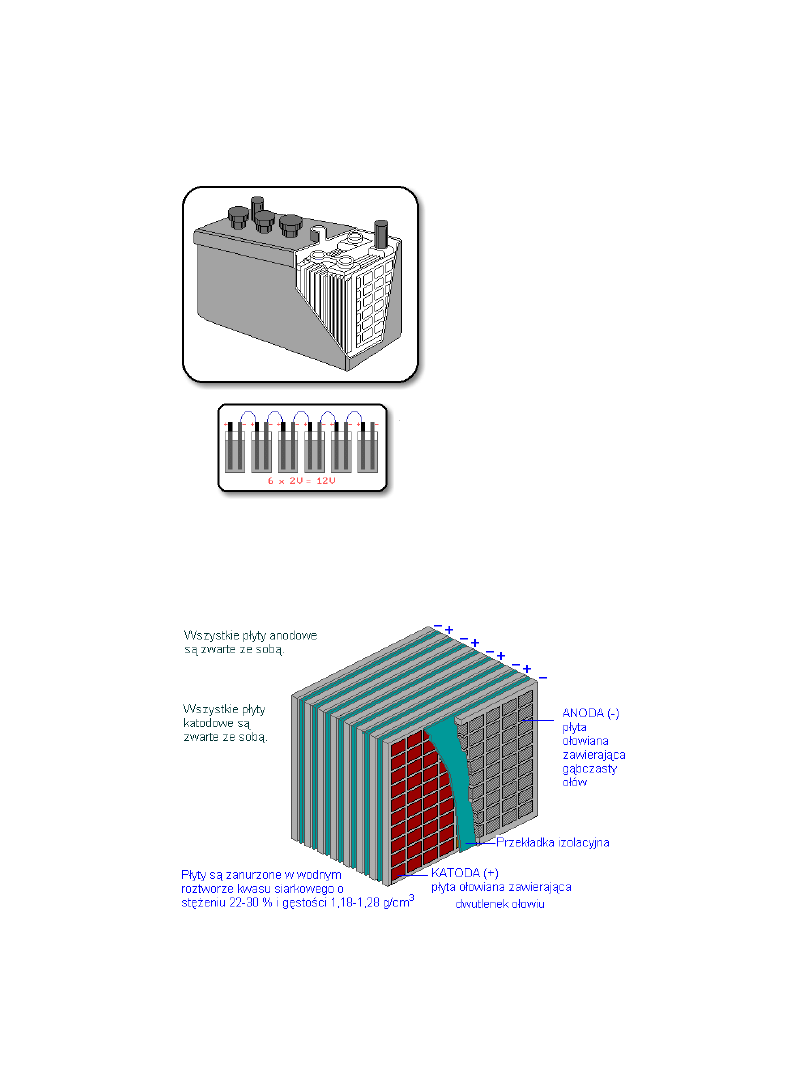
Akumulator ołowiowy
kwasowy
Pojemność akumulatora –
ilość energii pobranej z
naładowanego akumulatora
przy wyładowaniu go w
określonym czasie do
dozwolonej granicy napięcia.
Pojemność znamionowa –
wyładowanie w ciągu 10
godzin.
2010-10-12
11
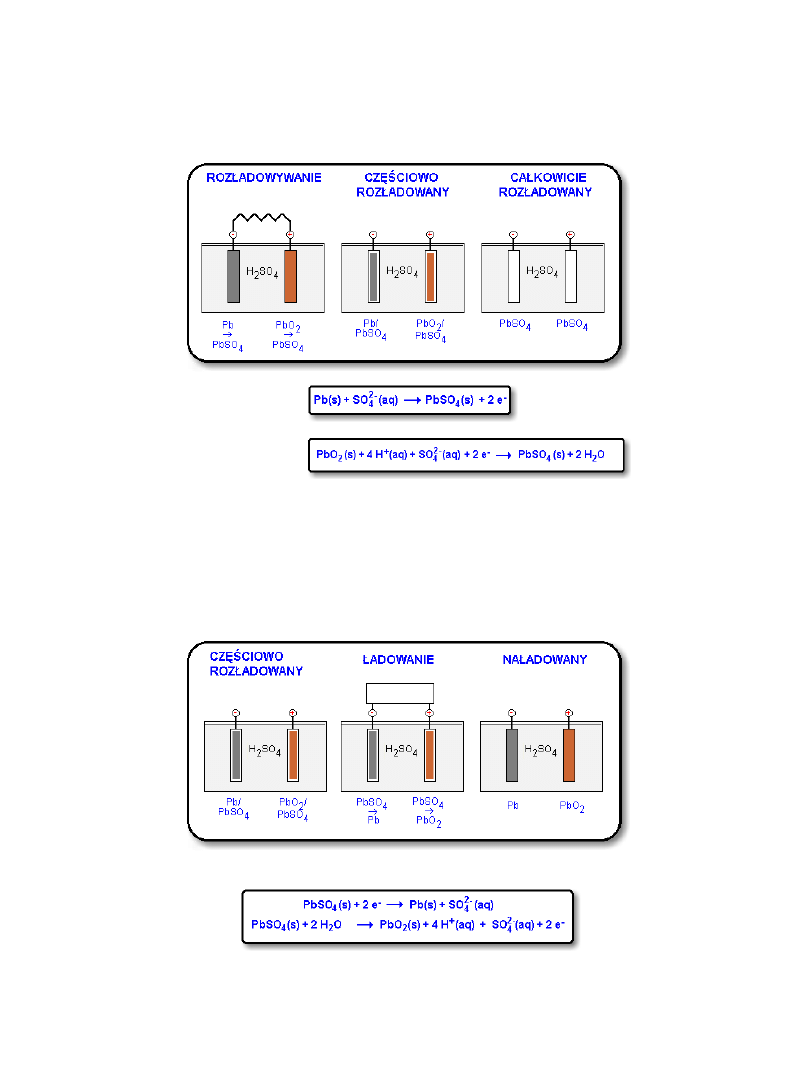
Roz
ładowywanie akumulatora
reakcja na anodzie:
reakcja na katodzie:
Ładowanie akumulatora
2010-10-12
12
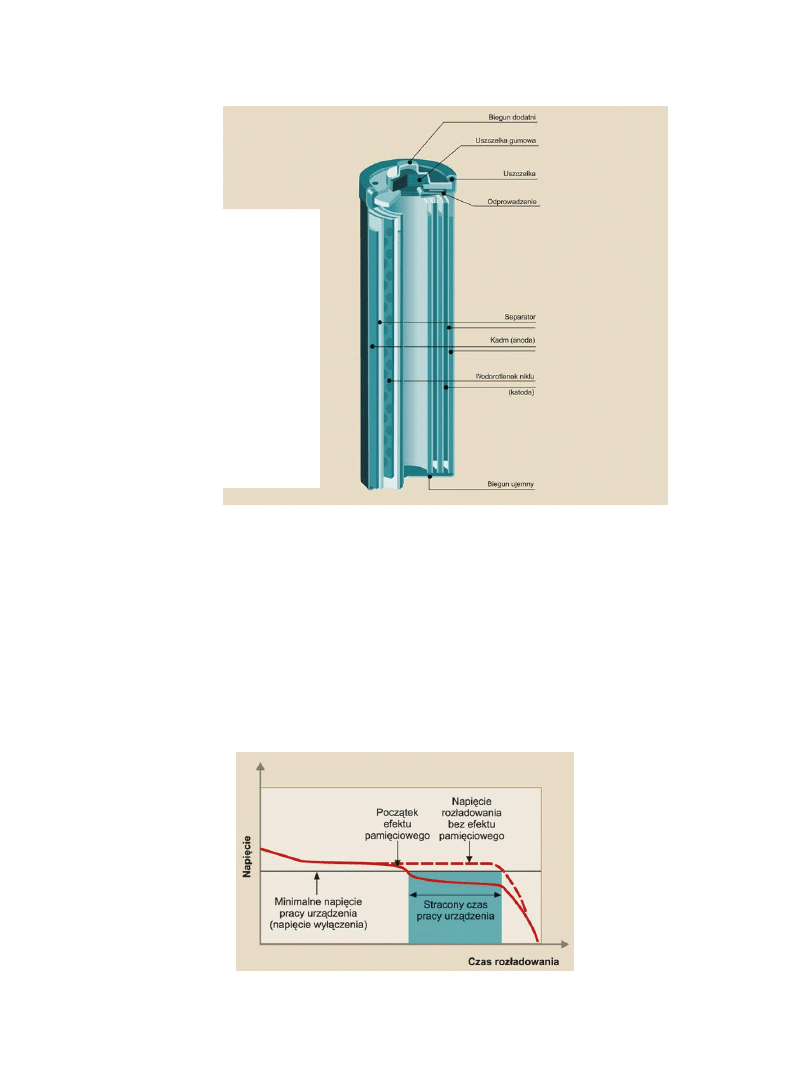
Elektrolit:
substancje półpłynne lub stałe,
najczęściej wodorotlenek potasu
napięcie nominalne: 1.2 V
Akumulator NiCd
Może dostarczyć w krótkim czasie
duży prąd (prąd rozładowania
może 20x przekraczać jego
pojemność znamionową).
Charakteryzuje się dużą trwałością
przy niskich kosztach
wytwarzania, bo podstawowe
materiały - nikiel i kadm - są
stosunkowo niedrogie.
Kadm stanowi problem z punktu
widzenia ochrony środowiska.
To silnie toksyczny metal ciężki,
wymagający stosowania
gazoszczelnej obudowy i
specjalnych procedur utylizacji.
Traci energię, kiedy nie pracuje,
ok. 20 % na miesiąc.
Nieużywany – może ulec
uszkodzeniu, bo nie powinno się
go całkowicie rozładowywać.
tzw. efekt pamięciowy
Powód: kadm ma tendencję do krystalizacji.
Zjawisko to wyst
ępuje wówczas, gdy akumulator jest ponownie ładowany przed
ca
łkowitym rozładowaniem. W wyniku krystalizacji kadmu zmniejsza się pojemność
akumulatora, a od punktu wyst
ąpienia efektu pamięciowego na linii rozładowania spada
dostarczane napi
ęcie.
Efekt pami
ęciowy można usunąć poprzez wielokrotne rozładowanie/ładowanie
(funkcja ładowarek: DISCHARGE lub REFRESH)

2010-10-12
13
napięcie nominalne: 1.2 V
Anoda: stop metalu, kt
óry może
wi
ązać wodór.
Akumulator NiMH
Gąbczasta struktura nasączona
substancjami alkalicznymi (jako
elektrolit) oraz złożonym
chemicznie katalizatorem.
Może dostarczyć w krótkim
czasie duży prąd.
System elektrochemiczny jest
zdolny do absorpcji
wydzielających się podczas
ładowania gazów, szczególnie
wodoru, dzięki czemu
akumulator może być całkowicie
szczelny i charakteryzować się
długą żywotnością.
Duże samorozładowanie, nawet
do 30 % na miesiąc.
tzw. efekt leniwego akumulatora
(lazy battery effect)
Powód: na dodatniej elektrodzie wykonanej z wodorotlenku niklu tworzą się kryształy .
Efekt powstaje w wyniku nieca
łkowitego rozładowania akumulatora w trakcie pracy lub
d
ługotrwałego ładowania prądem o zbyt małym natężeniu.
Efekt pami
ęciowy można usunąć poprzez 2-, 3-krotne całkowite rozładowanie.
2010-10-12
14
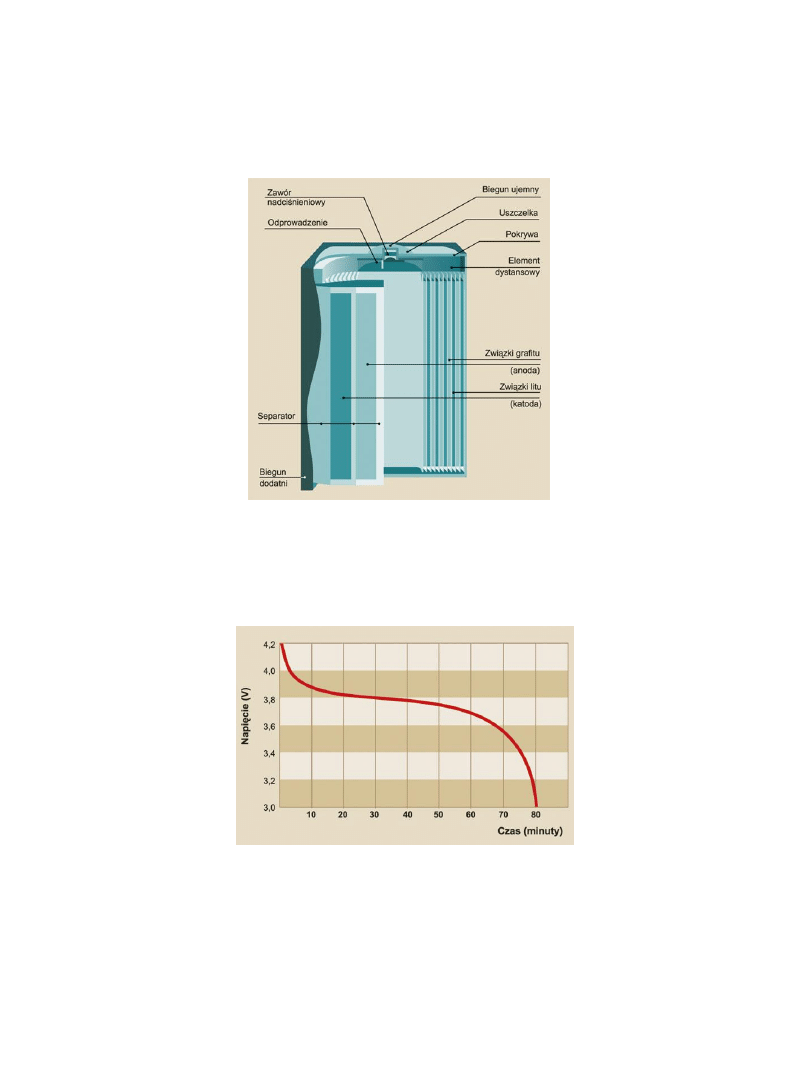
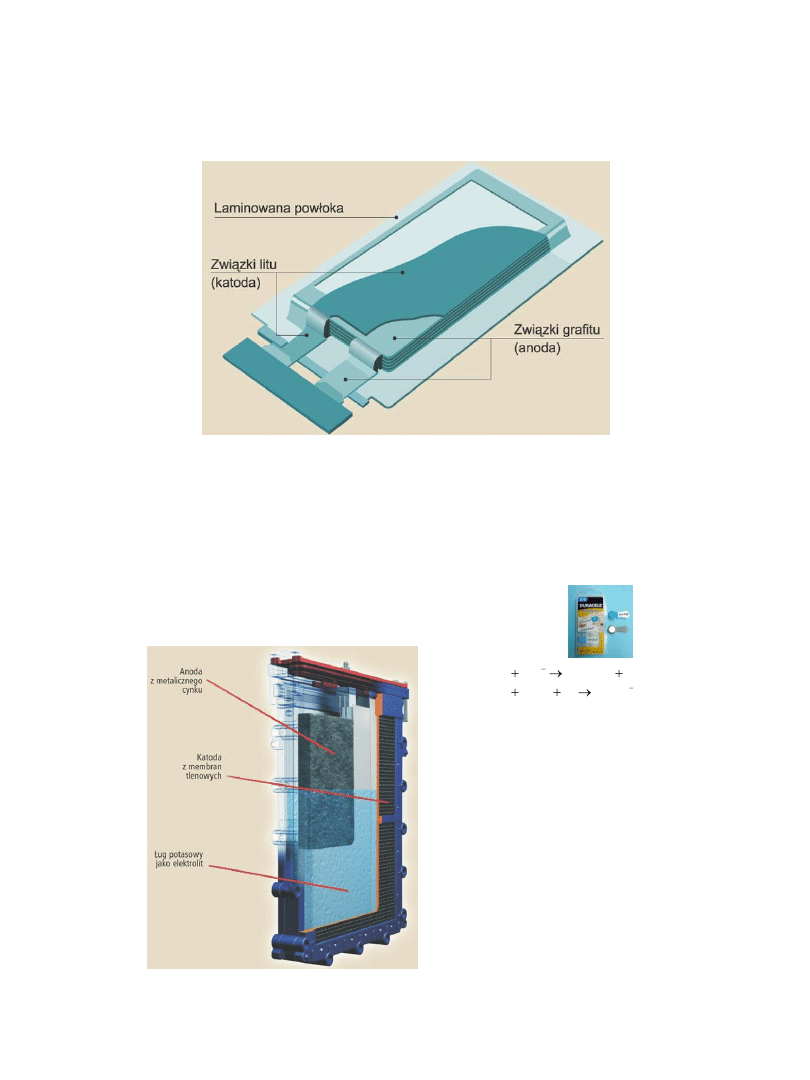
Akumulator Li-Ion
Elektrolit (ciekły):
z
łożone chemicznie
sole litowe
rozpuszczone w
mieszaninie
organicznych
rozpuszczalnik
ów.
Separator między
membranami stanowi
mikroprzepuszczalna
membrana z tworzywa
sztucznego.
napięcie nominalne: 3.6 V
Zaleta: niewielkie
samorozładowanie,
a więc długi czas
przechowywania bez
ponownego ładowania.
Lit to silnie reagujący
metal lekki, a więc
mocno nagrzany
mógłby eksplodować.
Z tego powodu
akumulatory zawierają
organiczny elektrolit.
Mimo to każdy
akumulator litowy jest
wyposażony w zawór
bezpieczeństwa i ma
szczególnie solidną
obudowę.
Dodatkowo, zawiera
układy elektroniczne
nadzorujące prądy
ładowania i
rozładowania
(zabezpieczenie przed
przegrzaniem).
Napięcie w trakcie niemal całego okresu rozładowania akumulatora Li-Io
przekracza napięcie znamionowe 3,6 V.
Brak efektu pami
ęciowego, brak efektu leniwego akumulatora.
2010-10-12
15
Akumulator litowo-polimerowy
napięcie nominalne: 3.6 – 3.7 V
sta
ły lub żelowy elektrolit polimerowy
wykonany np. z g
ąbek na bazie
poliakrylonitrylu
Niskie samorozładowanie, poniżej 10 % na miesiąc.
Brak efektu pamięciowego, brak efektu leniwego akumulatora.
Daje się niemal dowolnie formować, co zwiększa możliwości zastosowania.
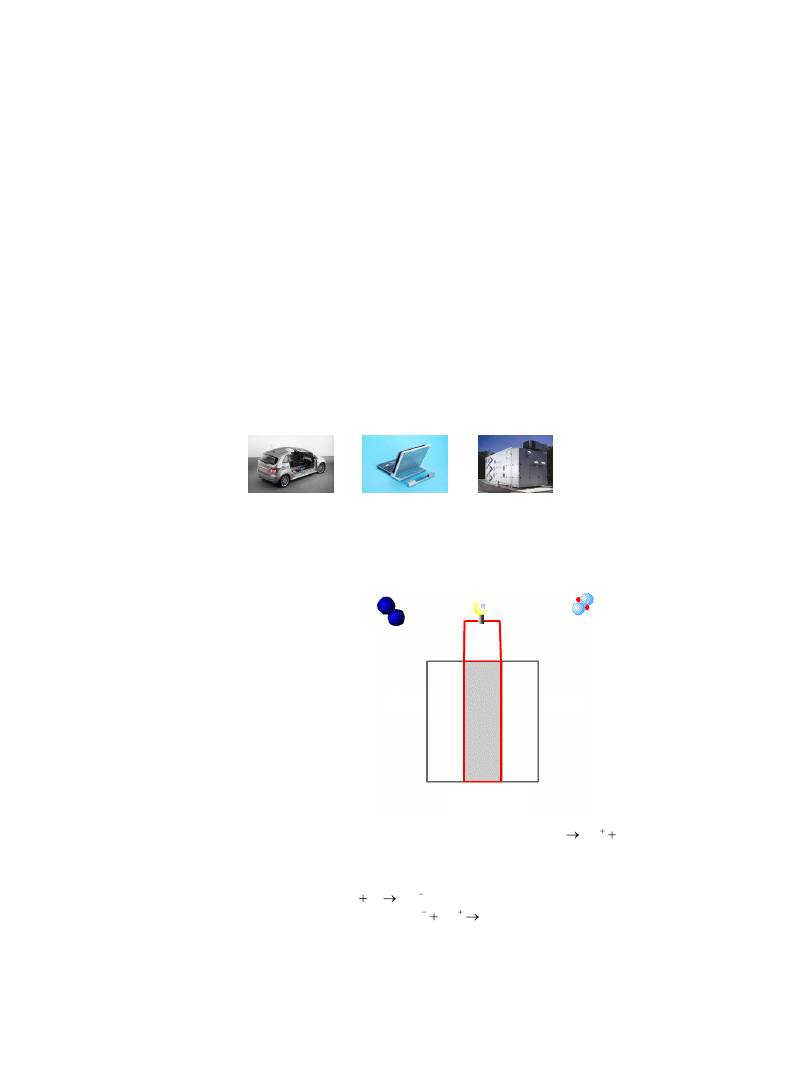
Akumulator cynkowo-powietrzny
Katodą w procesie rozładowania jest tlen
atmosferyczny absorbowany na membranie z
węgla aktywnego i ulegający reakcji w kontakcie
ze środowiskiem elektrolitu. Stan całkowitego
rozładowania akumulatora polega na całkowitym
przekształceniu elektrody cynkowej w
wodorotlenek cynku.
W procesie ładowania, z akumulatora jest
uwalniany tlen do atmosfery.
Wada: tworzy otwarty system chemiczny.
Podczas rozładowania powierzchnia, na której
zachodzi reakcja, musi mieć zapewniony dopływ
powietrza z otoczenia, a podczas ładowania
trzeba odprowadzać uwolniony tlen.
Obecne modele z reguły nie są stosowane
w pomieszczeniach zamkniętych.
napięcie nominalne: 1.4 – 1.65 V
e
OH
Zn
OH
Zn
2
)
(
2
Zachodzące reakcje
anoda:
katoda:
W trakcie ładowania: reakcje w drugą stronę.
)
(
4
4
2
2
2
OH
e
O
H
O
2010-10-12
16
Ogniwo paliwowe
Generuje energię elektryczną z reakcji utleniania stale dostarczanego do niego
z zewnątrz paliwa.
W odróżnieniu od baterii i akumulatorów, ogniwa paliwowe nie gromadzą
wewnątrz energii (nie muszą być ładowane). Bez dostarczania paliwa proces
wytwarzania prądu zatrzymuje się.
Większość ogniw paliwowych do produkcji energii elektrycznej wykorzystuje
wodór na anodzie oraz tlen na katodzie (ogniwo wodorowo-tlenowe).
Proces produkcji energii nie zmienia chemicznej natury elektrod oraz
wykorzystywanych elektrolitów.
Jedynym ograniczeniem ilości energii, którą może wytworzyć ogniwo paliwowe,
jest pojemność zbiornika na paliwo.
Zaleta: brak zanieczyszczenia powietrza. Powstające w ogniwie spaliny
składają się wyłącznie z pary wodnej.
Wodór dopływa do anody, gdzie rozpada się na jony protonowe H
+
oraz elektrony:
Półprzepuszczalna membrana jest przewodnikiem tylko dla protonów. Elektrony płyną do katody przez
zewnętrzny obwód elektryczny wytwarzając prąd pozwalający na zasilanie urządzeń, zaś protony dyfundują
przez elektrolit.
Na katodzie tlen reaguje z elektronami :
Następnie jony H
+
reagują ze zjonizowanym tlenem:
Końcowym produktem jest więc woda (w postaci ciekłej lub para).
Membrana
– polimer rozdzielający anodę
i katodę, przewodzący protony lecz
uniemożliwiający przepływ elektronów.
Elektrody
– najczęściej nawęglony papier
pokryty platyną, która jest katalizatorem
reakcji.
e
H
H
4
4
2
2
2
2
2
4
O
e
O
O
H
H
O
2
2
2
4
2
Anoda
Katoda
Membrana
elektrolityczna
Wyszukiwarka
Podobne podstrony:
1 obwody pradu stalegoid 9513 Nieznany (2)
Kolo1 obwody prądu stałego
Model silnika pradu stalego id Nieznany
Obwody prądu stałego
cw1 Obwody pradu stalego
1M obwody pradu stalego
Ćw.2 - Obwody prądu stałego, sem2
cw1 Obwody pradu stalego
Ćw.2 - Obwody prądu stałego, sem2
Obwody pradu stalego
Obwody prądu stałego, SPARWOZDANIE
cw1-obwody pradu stalego pomiar rezystancji, Elektrotechnika, Sprawozdania elektrotechnika, Sprawozd
Ćw.2 - Obwody prądu stałego, sem2
05 Obwody Pradu Stalego
obwody prądu stałego
Nieliniowe obwody pradu stałego, Szkoła, Elektrotechnika
więcej podobnych podstron