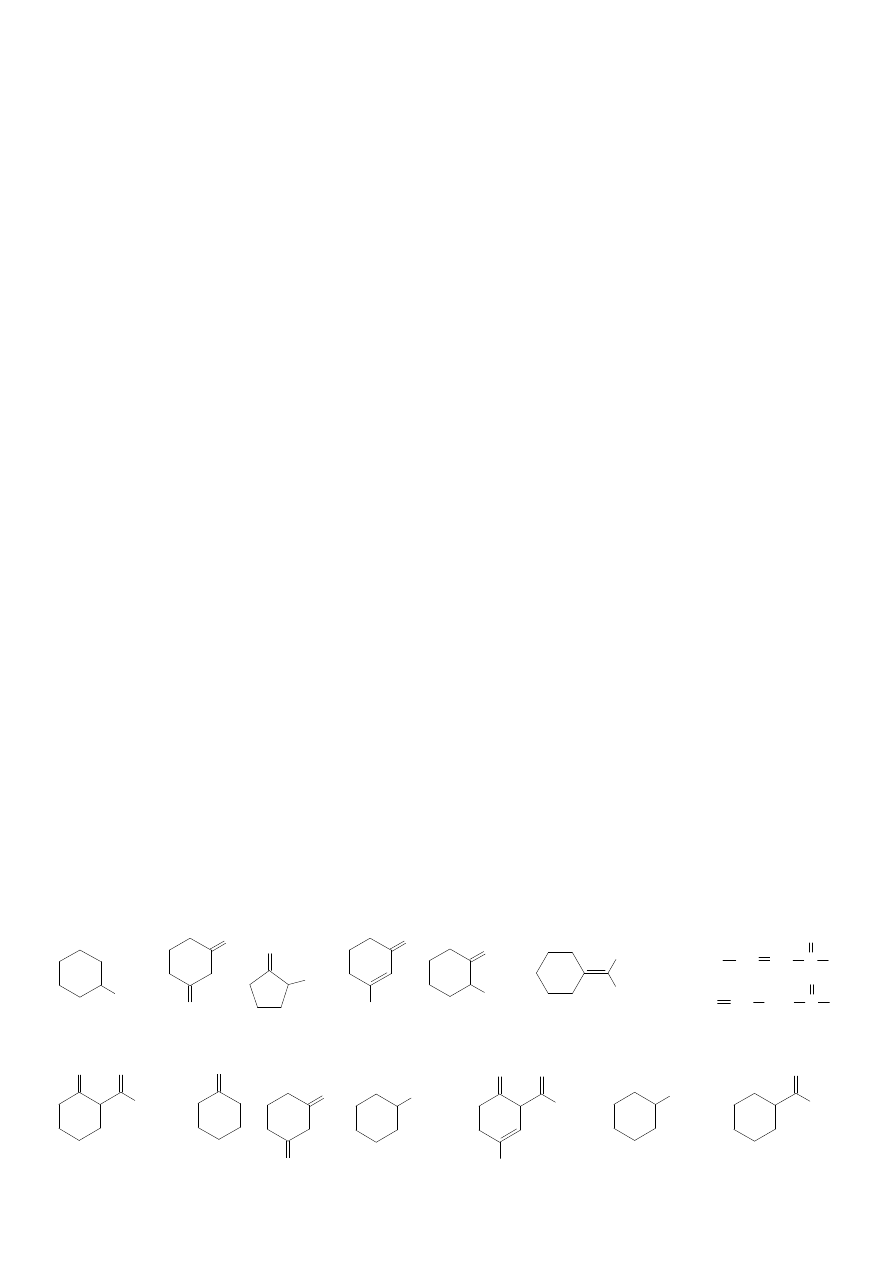
1
16. Substytucja w pozycji
α
α
α
α
do grupy karbonylowej. Reakcje kondensacji związków
karbonylowych.
(konwersatorium, gr. D1 – Chemia, II rok, 2011/2012Z)
Zagadnienia
a) Tautomeria keto-enolowa. Tworzenie enolu katalizowane kwasem oraz zasadą. Kwasowość atomów
wodoru
α
– tworzenie jonu enolanowego.
b) Mechanizm oraz reakcje substytucji w pozycji
α
: a)
α
-halogenowanie ketonów (katalizowane kwasem lub
zasadą; w tym również reakcja haloformowa-halogenowanie wielokrotne); b)
α
-bromowanie kwasów
karboksylowych /reakcja HVZ: Hella-Volharda-Zielińskiego/; c) alkilowanie jonów enolanowych (i. keton
lub ester+I-rz. halogenek alkilowy+zasada: diizopropyloamidek litu, LDA, (i-Pr)
2
N
-
Li
+
/metoda przydatna
również do alkilowania nitryli w pozycji
α
/; ii. alkilowanie z wykorzystaniem estru malonowego (malonian
dietylu+zasada: etanolan sodu CH
3
CH
2
O
-
Na
+
+halogenek alkilowy→alkilowa lub dialkilowa pochodna
estru malonowego, która po hydrolizie i dekarboksylacji /H
3
O
+
, ogrzew./ daje podstawiony kwas
monokarboksylowy); iii. alkilowanie z wykorzystaniem estru acetylooctowego (acetylooctan etylu+zasada:
etanolan
sodu
CH
3
CH
2
O
-
Na
+
+halogenek
alkilowy→alkilowa
lub
dialkilowa
pochodna
estru
acetylooctowego, która po hydrolizie i dekarboksylacji /H
3
O
+
, ogrzew./ daje
α
-monopodstawiony lub
α,α
-dipodstawiony aceton).
c) Mechanizm oraz reakcje kondensacji związków karbonylowych: a) kondensacja aldolowa: „symetryczna”
/autokondensacja/, krzyżowa /mieszana/ oraz wewnątrzcząsteczkowa (aldehyd lub keton /względnie zw.
dikarbonylowy/+zasada:
CH
3
CH
2
O
-
Na
+
lub
NaOH→
β
-hydroksyaldehyd
lub
β
-hydroksyketon
/otwartołańcuchowy lub cykliczny/; aldole w dalszym etapie mogą dehydratować do
α
,
β
-nienasyconych
związków karbonylowych /kat. H
3
O
+
lub OH
-
/); ii. kondensacja Claisena: „symetryczna” i krzyżowa
/mieszana/ (ester+zasada: CH
3
CH
2
O
-
Na
+
→
β
-oksoester); iii. wewnątrzcząsteczkowa kondensacja Claisena
/tzw. cyklizacja Dieckmanna/ (diester+zasada: CH
3
CH
2
O
-
Na
+
→cykliczny
β
-oksoester); iv. reakcja
Michaela (addycja sprzężona C-H kwasu (m. in. połączeń enolizujących) do karbonylowego związku
α
,
β
-nienasyconego); v. reakcja enaminowa Storka (III etapy: I. tworzenie enaminy z ketonu, II. addycja
typu Michaela do
α
,
β
-nienasyconego związku karbonylowego /enaminy mogą ulegać również substytucji
do halogenków acylowych lub reaktywnych halogenków alkilu/, III. hydroliza powstałej enaminy
z odtworzeniem ketonu).
d) Annulacja Robinsona (reakcja Michaela oraz następująca po niej wewnątrzcząsteczkowa kondensacja
aldolowa, →tworzenie związków cyklicznych).
e) Przewidywanie produktów reakcji kondesacji zwiazków karbonylowych. Analiza retrosyntetyczna
produktów powstałych w wyniku kondensacji zw. karbonylowych (rozpoznawanie substratów na podstawie
struktury produktów).
Zadania
1. W każdej z poniższych cząsteczek wskaż najbardziej kwasowy atom wodoru, oraz narysuj najważniejsze
struktury rezonansowe dla anionu powstałego po usunięciu tego protonu.
a)
COOH
b)
O
O
c)
CN
O
O
OH
d)
e)
O
COOCH
3
f)
COOCH
3
CN
g) CH
3
CH CH
C
O
H
h) CH
2
CH CH
2
C
O
H
2. Uszereguj przedstawione związki w kolejności wzrastającej kwasowości.
a)
b)
c)
d)
e)
f)
g)
O
O
OCH
3
O
O
O
COOH
O
O
OCH
3
CN
CH
2
OH
O
OCH
3
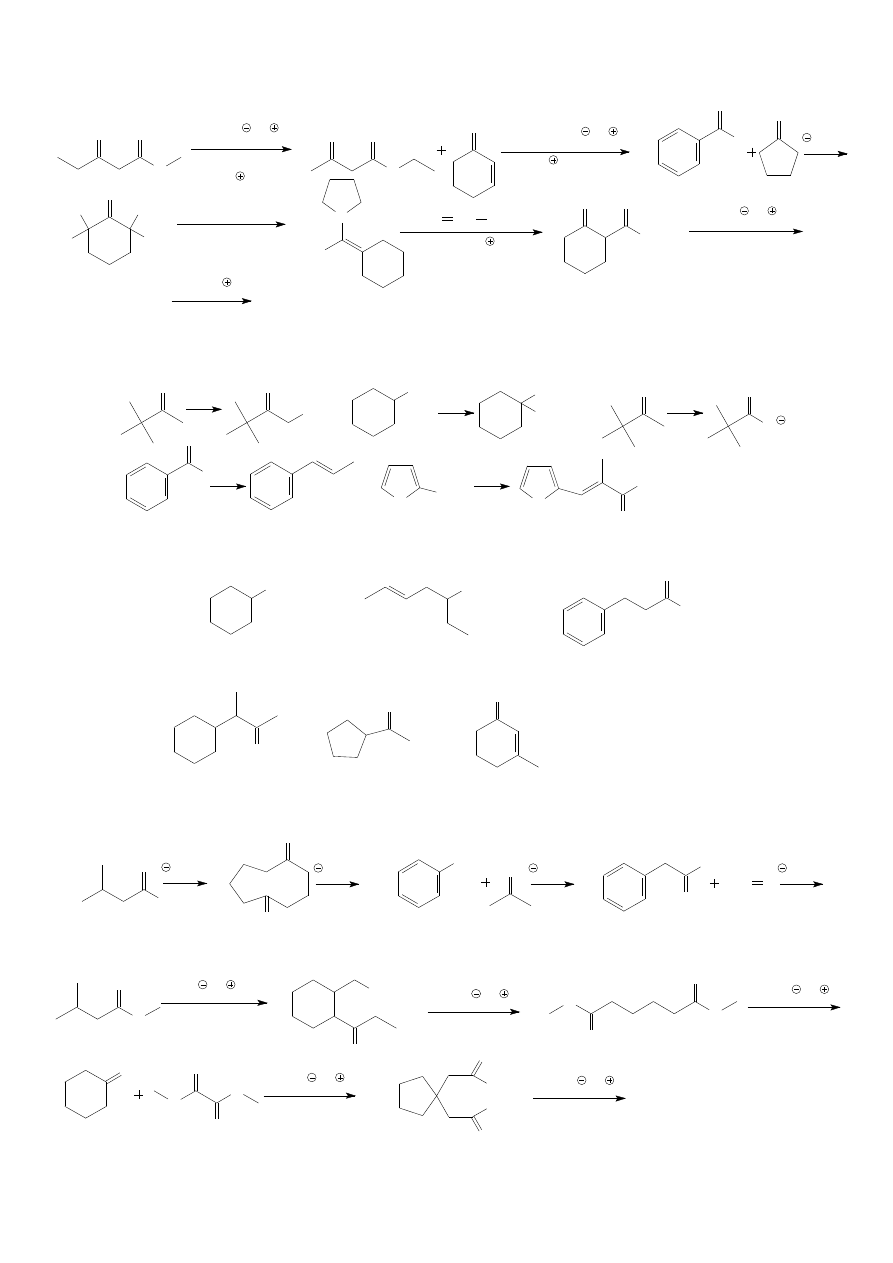
2
3. Przedstaw produkty poniższych reakcji.
a)
O
O
O
1.CH
3
O Na
2. CH
3
I
3. H
3
O , ogrzew.
b)
O
O
O
1.CH
3
CH
2
O Na
2. H
3
O , ogrzew.
c)
O
H
Ph
CH
3
CH
3
1. LDA
2. CH
3
(CH
2
)
2
Br
d)
O
H
O
OH
e)
N
Ph
O
1. H
2
C
CH CH
2
Br
2. H
3
O
f)
O
O
OCH
3
1.CH
3
O Na
2. CH
3
(CH
2
)
3
Br
g) produkt reakcji f)
H
3
O
ogrzew
(dekarboksylacja)
4. Zaproponuj sposób wydajnego przeprowadzenia poniższych syntez używając dowolnych, niezbędnych
reagentów.
O
a)
O
Br
b)
COOH
COOH
Br
O
O
c)
O
d)
O
H
e)
O
CHO
O
O
Ph
5. Przedstaw sposób syntezy poniższych związków wykorzystując w tym celu malonian dietylu.
a)
b)
c)
COOH
COOH
O
OH
6. Przedstaw sposób syntezy poniższych związków wykorzystując w tym celu acetylooctan etylu.
O
a)
b)
O
c)
O
(rozważyć heptano-2,6-dion
jako związek pośredni)
7. Przedstaw produkty poniższych kondensacji aldolowych (przed i po dehydratacji). Podaj dokładny
mechanizm reakcji a).
a)
O
H
OH
b)
O
O
OH
c)
CHO
O
2
OH
d)
H
O
H
2
C O
OH
8. Przedstaw produkty przedstawionych poniżej kondensacji Claisena. Podaj dokładny mechanizm reakcji a).
O
O
a)
b)
CH
3
O Na
CH
3
OH
COOCH
3
O
CH
3
OH
CH
3
O Na
c)
O
O
O
O
CH
3
O Na
CH
3
OH
(cykl. Dieckmanna)
d)
O
O
O
O
O
CH
3
OH
CH
3
O Na
e)
O
O
OCH
3
CH
3
CH
3
O Na
CH
3
OH
(1 mol)
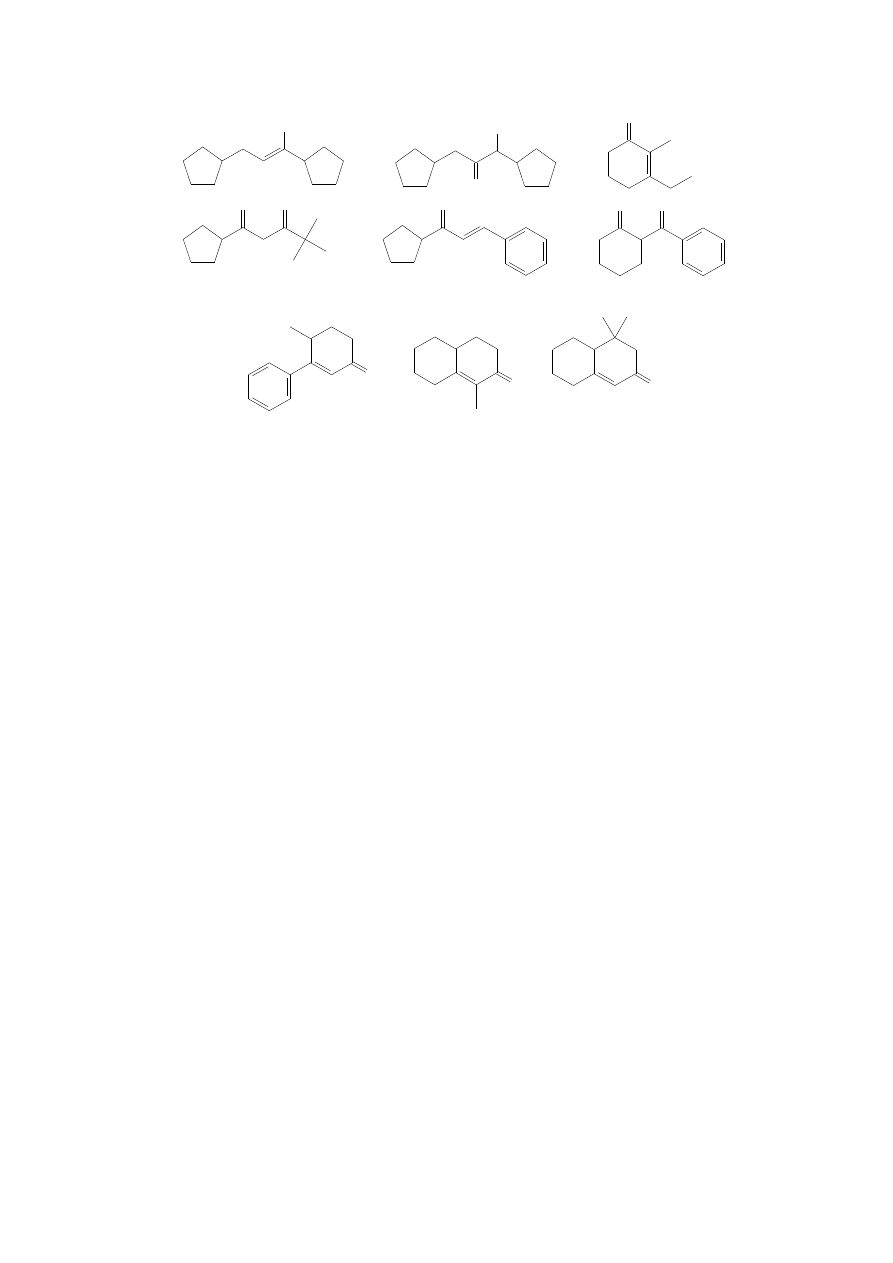
3
9. Zaproponuj substraty z jakich można zsyntetyzować przedstawione produkty na drodze kondensacji
aldolowej, Claisena lub innych.
a)
CHO
b)
COOC
2
H
5
O
c)
O
O
O
d)
e)
O
f)
O
O
10. Przedstaw substraty z jakich można zsyntetyzować przedstawione produkty na drodze annulacji Robinsona.
a)
b)
c)
O
O
O
11. Zapisz równania reakcji pokazujące spodziewane produkty addycji Michaela przedstawionych enamin do
α
,
β
-nienasyconych związków karbonylowych.
a) 1. N-(cykloheks-1-enylo)pirolidyna + pent-1-en-3-on; 2. H
3
O
+
(hydroliza soli iminowej);
b) 1. N-(cykloheks-1-enylo)piperydyna + propenian etylu; 2. H
3
O
+
(hydroliza).
Wyszukiwarka
Podobne podstrony:
Instrukcja do ćw 16 Jednostka pozycjonująca
Instrukcja do ćw 16 Jednostka pozycjonująca
Ćw nr 16. Kondensator, Kondensatorem nazywa si? dwa przewodniki elektryczne, odizolowane od siebie n
Substytucje Nukleofilowe w Pochodnych Karbonylowych
INSTRUKCJE, Ćw nr 16. Kondensator, Kondensatorem nazywa się dwa przewodniki elektryczne, odizolowane
ZW Pol pien PP 2011 2012 odcinek 1 dla studentów slides z wykładów w dniach 02 16 10 2011
16 Pomiar pojemnosci kondensatora metoda mostka Wheatstone'a
POZYCJA SOCJOMETRYCZNA, SOCJOMETRIA (16), DZIECI ODRZUCANE I IZOLOWANE W GRUPIE ROWIEŚNICZEJ - GENEZ
Stowarzyszenie Niezalenych Wytwrcw Energii Skojarzonej Wykorzystywanie dominujcej pozycji tak to u
16 niedz zw
akumulator do alfa romeo 75 162b 16 18 18 turbo 18 turbo ie
akumulator do alfa romeo 156 932 16 16v t spark 18 16v t spark
akumulator do alfa romeo mito 16 jtdm 16v
Substytucje Nukleofilowe w Pochodnych Karbonylowych
JAIVA DHARMA , Rozdział 16 Pozycja Jivy w Tatastha
więcej podobnych podstron