1
RJC
Substytucje Nukleofilowe
Substytucje Nukleofilowe
w Pochodnych Karbonylowych
w Pochodnych Karbonylowych
Substytucje Nukleofilowe
Substytucje Nukleofilowe
w Pochodnych Karbonylowych
w Pochodnych Karbonylowych
Slides 1 to 21
C
O
R
Nu
Y
+
C
O
R
Y
Nu
+
Nu
C
O
R
Y
2
RJC
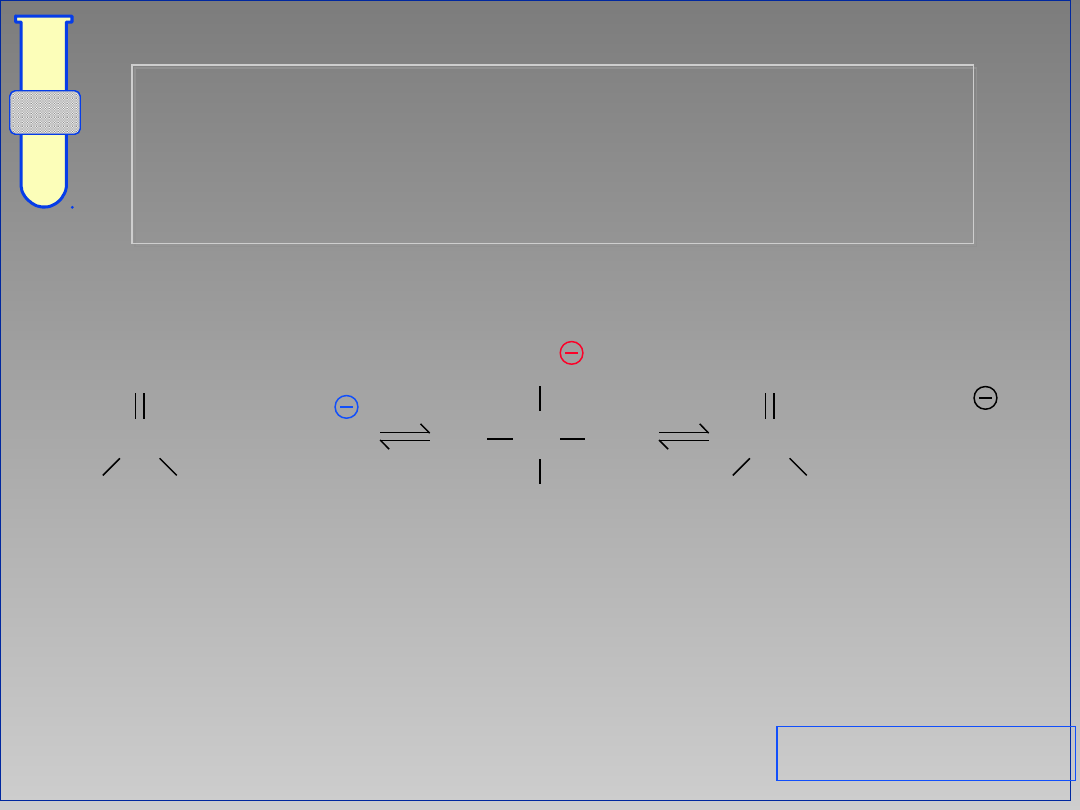
Addycje vs Podstawienia
Addycje vs Podstawienia
Ładunek
Ładunek
+
+
zlokalizowany na atomie węgla
zlokalizowany na atomie węgla
grupy karbonylowej powoduje, że atak
grupy karbonylowej powoduje, że atak
nukleofila może doprowadzić do utworzenia
nukleofila może doprowadzić do utworzenia
produktu addycji lub substytucji.
produktu addycji lub substytucji.
C
O
+
-
Nu
X
R
C
O
Nu
R
C
OH
R
X
Nu
add
n
sub
n

3
RJC
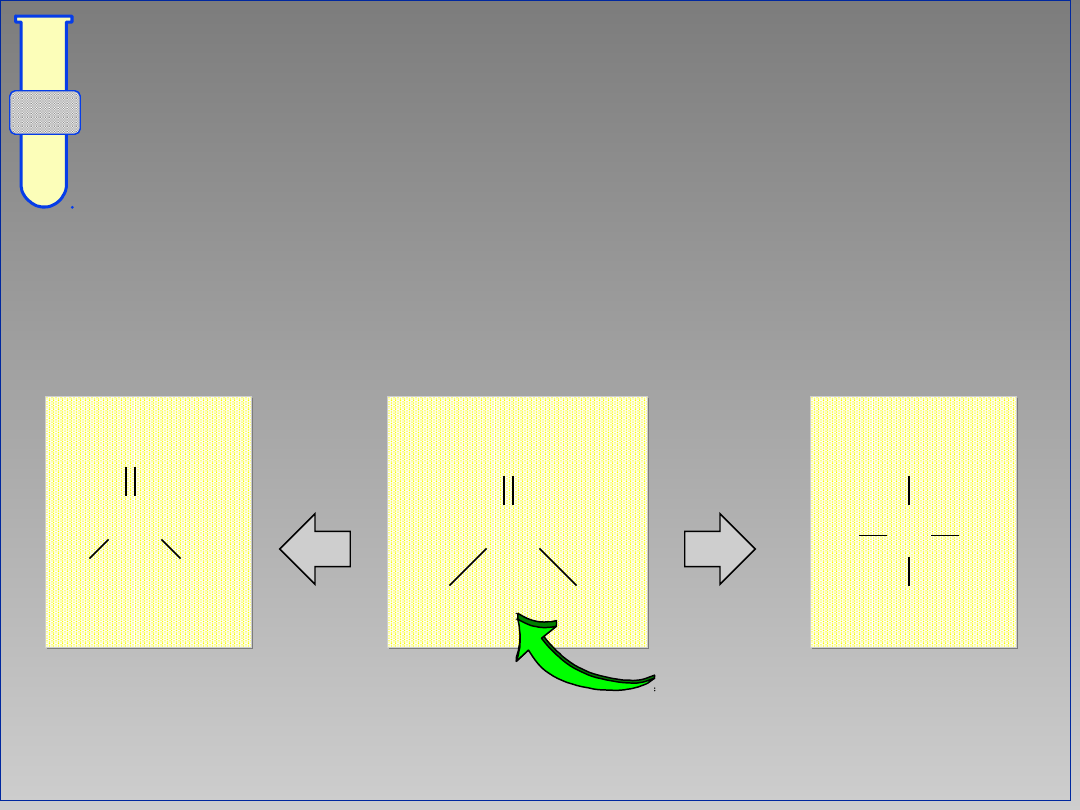
Podstawienie (substytucja)
Podstawienie (substytucja)
Jeżeli grupa Y jest dobrą grupą
Jeżeli grupa Y jest dobrą grupą
odchodzącą to preferowane jest
odchodzącą to preferowane jest
powstawanie produktu substyttucji.
powstawanie produktu substyttucji.
C
O
R
Nu
Y
+
C
O
R
Y
Nu
+
Nu
C
O
R
Y
4
RJC
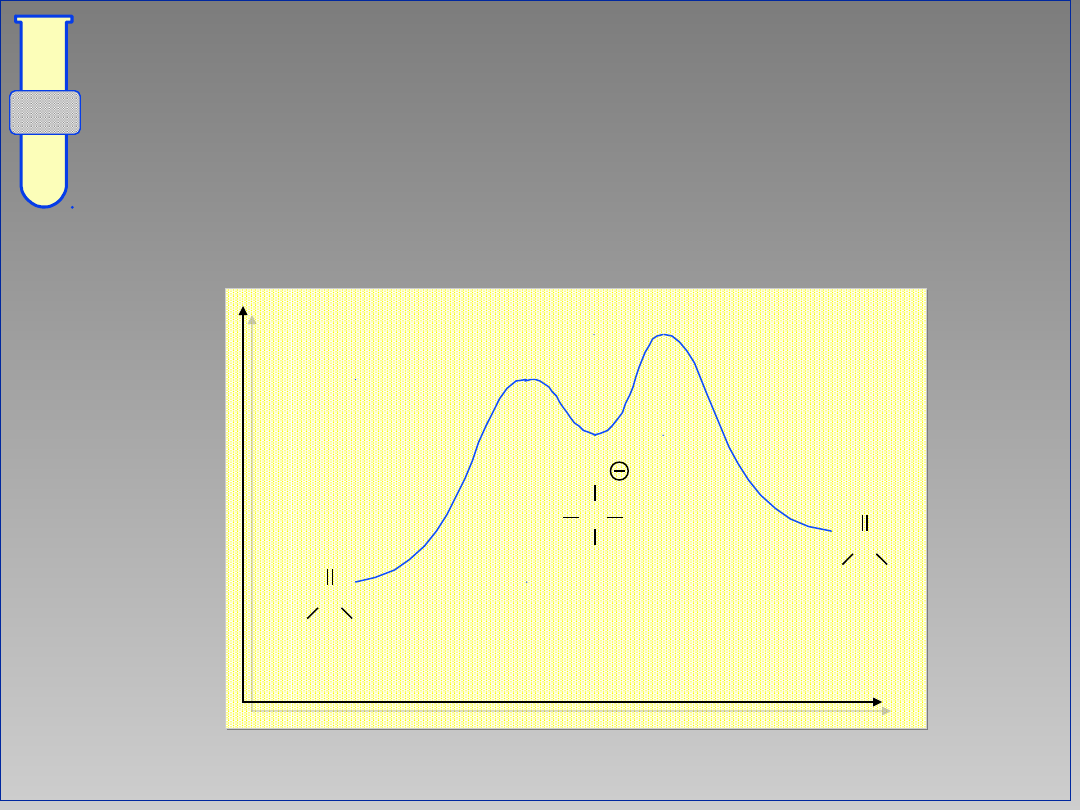
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Podstawienie przy grupie karbonylowej
Podstawienie przy grupie karbonylowej
jest reakcją dwuetapową.
jest reakcją dwuetapową.
Energia
Postęp reakcji
C
O
R
Nu
C
O
R
Y
Nu
C
O
R
Y
5
RJC
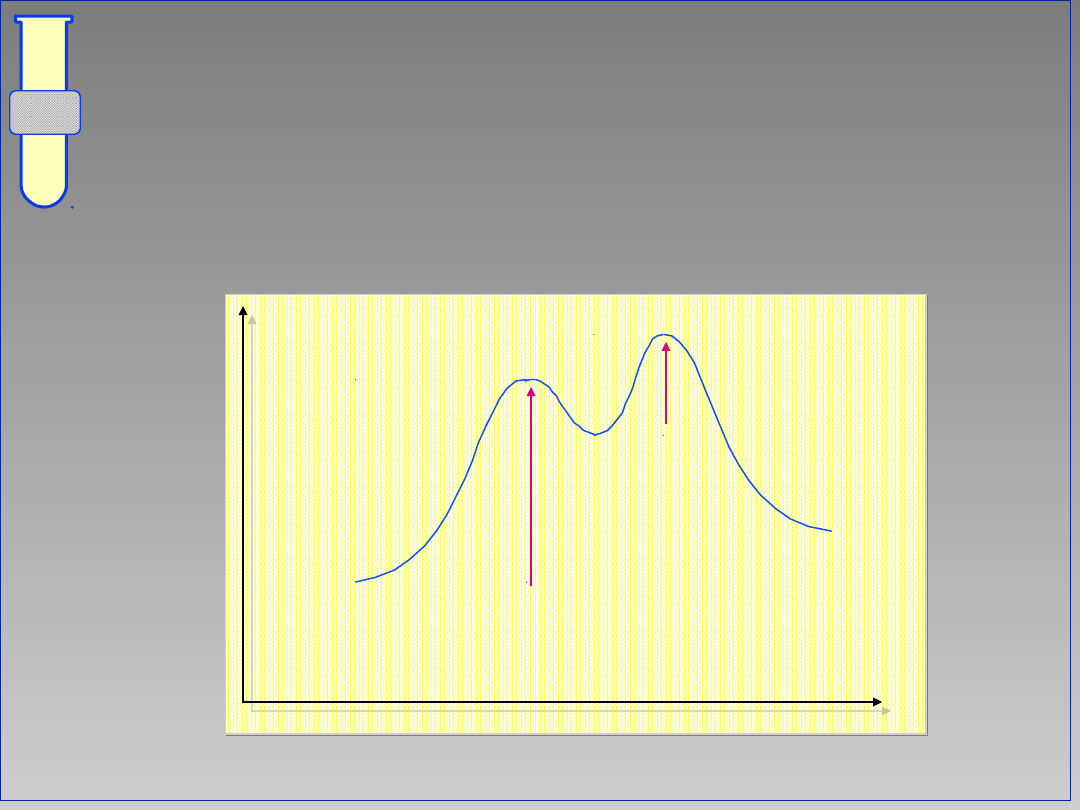
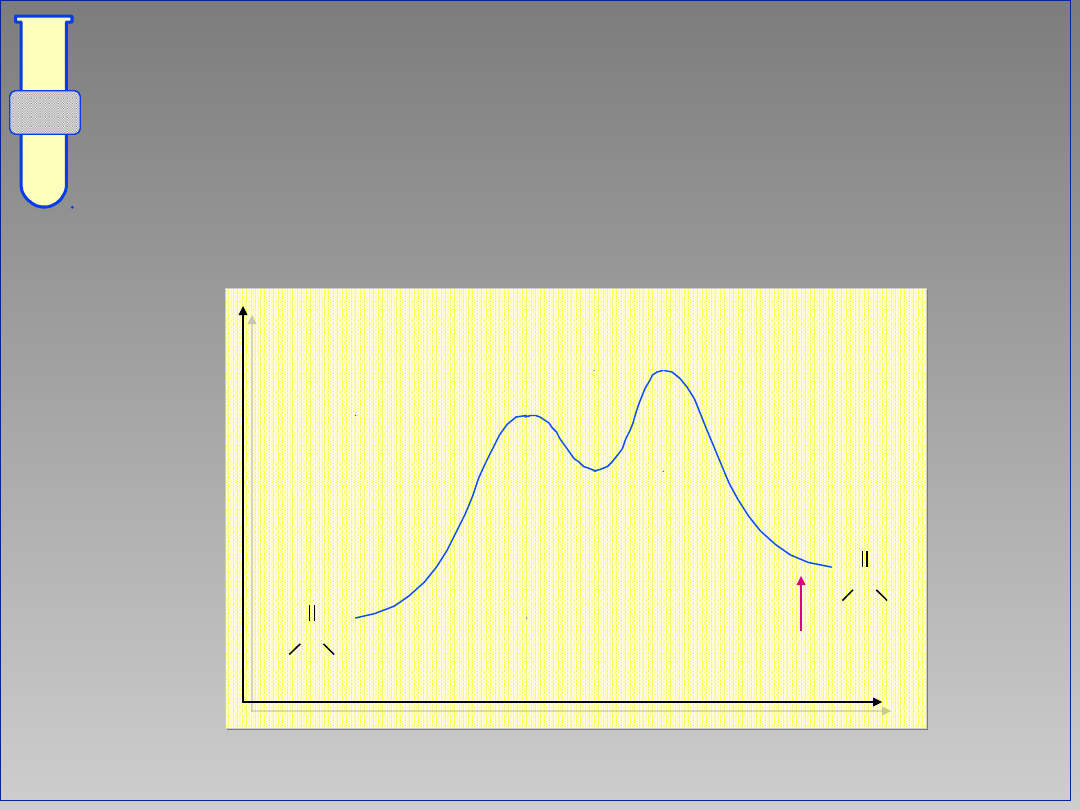
Etap określający szybkość
Etap określający szybkość
reakcji
reakcji
...addycja cząsteczki Nu zazwyczaj
...addycja cząsteczki Nu zazwyczaj
określa szybkość reakcji; niemniej,
określa szybkość reakcji; niemniej,
odejście grupy Y może również
odejście grupy Y może również
wyznaczać najwolniejszy etap reakcji.
wyznaczać najwolniejszy etap reakcji.
Energia
Postęp reakcji
+Nu
-Y
6
RJC
Stan równowagi
Stan równowagi
Stan równowagi jest określony przez
Stan równowagi jest określony przez
różnicę względnych energii produktów
różnicę względnych energii produktów
oraz substratów,
oraz substratów,
G
G
o
o
.
.
Energia
Postęp reakcji
G
o
C
O
R
Nu
C
O
R
Y

7
RJC
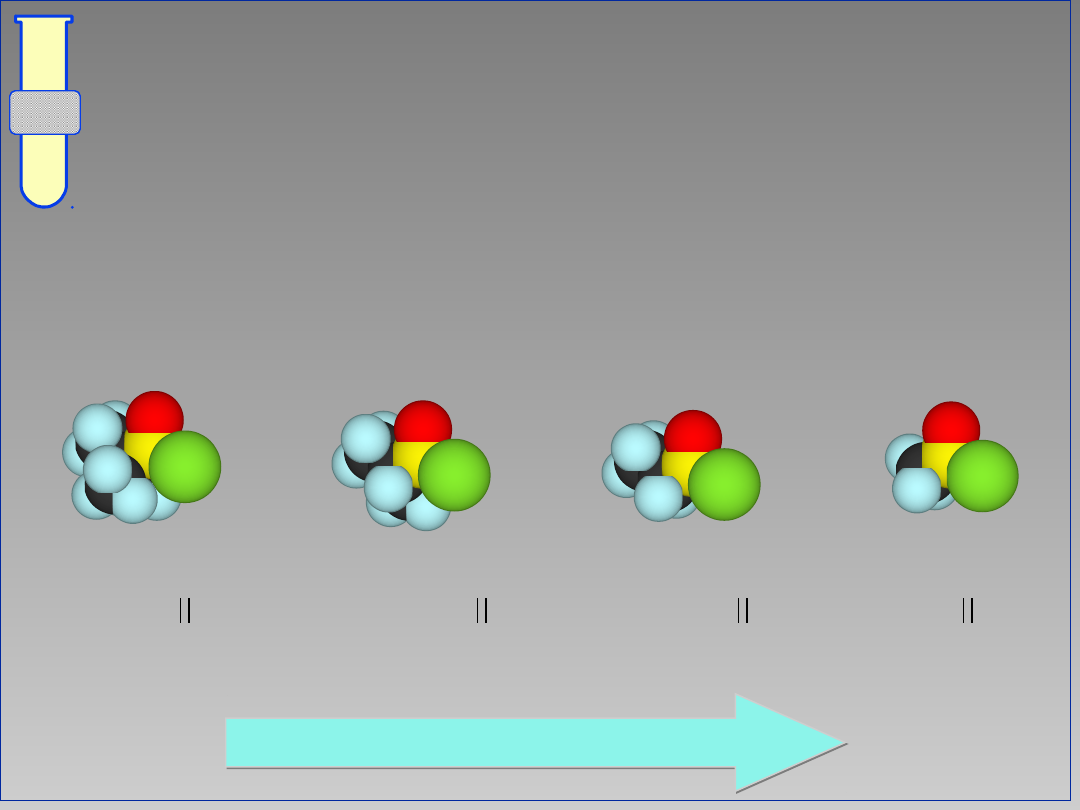
Czynniki określające możliwość
Czynniki określające możliwość
ataku nukleofilowego
ataku nukleofilowego
Dwa czynniki mające zasadnicze
Dwa czynniki mające zasadnicze
znaczenie dla ataku nukleofila Nu to;
znaczenie dla ataku nukleofila Nu to;
Oddziaływania steryczne
(przestrzenne)
Czynniki elektronowe
(elektroujemność)
8
RJC
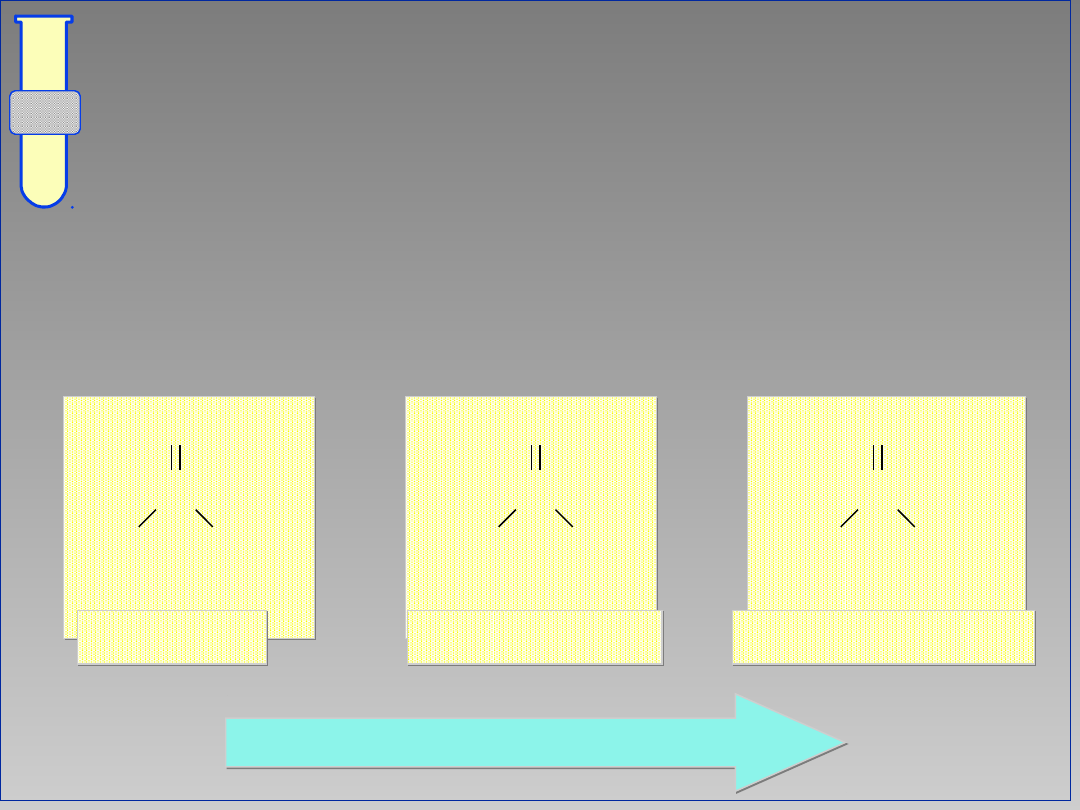
Czynniki steryczne
Czynniki steryczne
(przestrzenne)
(przestrzenne)
Sterycznie zatłoczone (wysoce
Sterycznie zatłoczone (wysoce
podstawione) związki karbonylowe są
podstawione) związki karbonylowe są
mniej podatne na atak odczynnika
mniej podatne na atak odczynnika
nukleofilowego Nu.
nukleofilowego Nu.
O
(CH
3
)
3
CCCl (CH
3
)
2
CHCCl
O
CH
3
CH
2
CCl
O
CH
3
CCl
O
wzrastająca reaktywność
wzrastająca reaktywność
9
RJC
Czynniki elektronowe
Czynniki elektronowe
(elektroujemność)
(elektroujemność)
Im większy ładunek
Im większy ładunek
+
+
na
na
karbonylowym atomie węgla, tym
karbonylowym atomie węgla, tym
bardziej jest on podatny na atak
bardziej jest on podatny na atak
odczynnika nukleofilowego Nu.
odczynnika nukleofilowego Nu.
C
O
CH
3
NH
2
C
O
OH
CH
3
C
O
Cl
CH
3
acetamid
acetamid
kwas octowy
kwas octowy
chlorek acetylu
chlorek acetylu
wzrastająca reaktywność
wzrastająca reaktywność

10
RJC
Otrzymywanie chlorków
Otrzymywanie chlorków
kwasowych
kwasowych
Kwasy karboksylowe reagują z
Kwasy karboksylowe reagują z
chlorkiem tionylu (SOCl
chlorkiem tionylu (SOCl
2
2
) dając chlorki
) dając chlorki
kwasowe (COCl).
kwasowe (COCl).
C
O
R
Cl
HCl
+ SO
2
+
C
O
R
OH
SOCl
2
+

11
RJC
Wykorzystanie chlorków
Wykorzystanie chlorków
kwasowych
kwasowych
Chlorki kwasowe są niezwykle
Chlorki kwasowe są niezwykle
użytecznymi odczynnikami, które łatwo
użytecznymi odczynnikami, które łatwo
ulegają reakcjom prowadzącym do...
ulegają reakcjom prowadzącym do...
Kwasów
Kwasów
Estrów
Amidów

12
RJC
Otrzymywanie kwasów karboksylowych
Otrzymywanie kwasów karboksylowych
z chlorków kwasowych
z chlorków kwasowych
Hydroliza chlorku kwasowego (COCl)
Hydroliza chlorku kwasowego (COCl)
(przy użyciu wody H
(przy użyciu wody H
2
2
O) prowadzi do
O) prowadzi do
regeneracji kwasu karboksylowego
regeneracji kwasu karboksylowego
(CO
(CO
2
2
H).
H).
C
O
R
OH
+ HCl
C
O
R
Cl
H
2
O
+
••
••

13
RJC
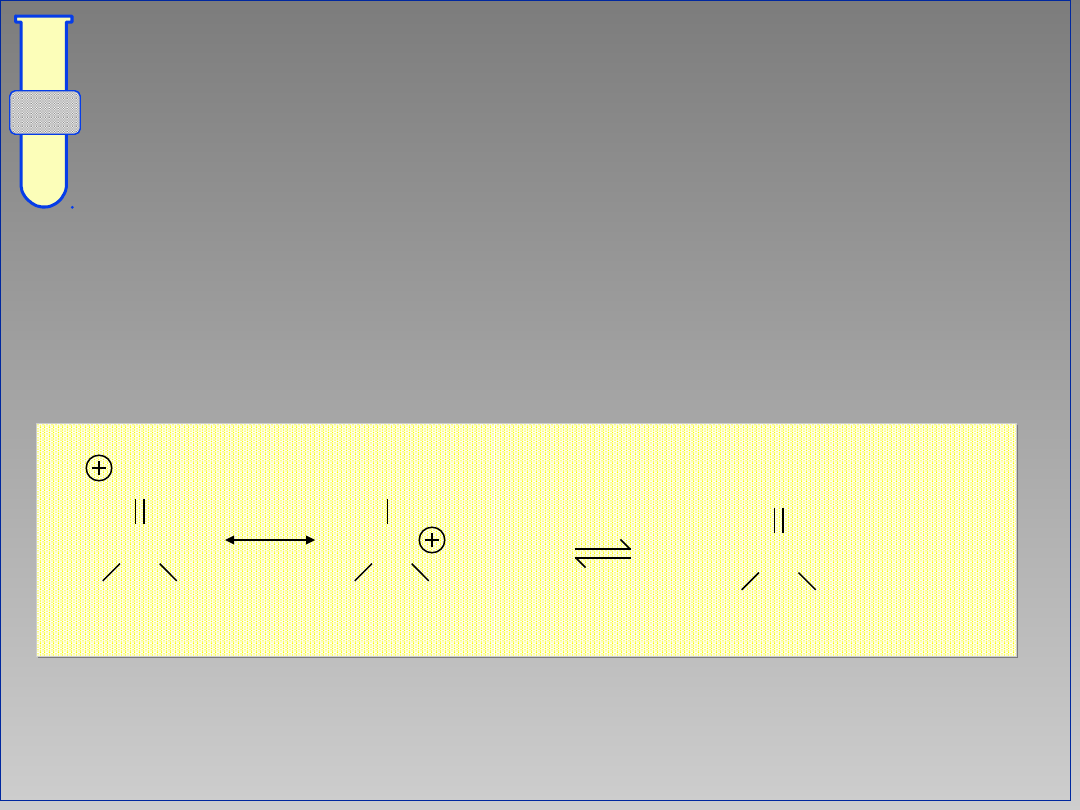
Otrzymywanie estrów z chlorków
Otrzymywanie estrów z chlorków
kwasowych
kwasowych
Reakcje chlorków kwasowych (COCl) z
Reakcje chlorków kwasowych (COCl) z
alkoholami (ROH) prowadzą do estrów
alkoholami (ROH) prowadzą do estrów
(CO
(CO
2
2
R).
R).
C
O
R
O
R
+ HCl
C
O
R
Cl
R
OH
+
••
••
14
RJC
Niemniej ... najważniejsza
Niemniej ... najważniejsza
metoda otrzymywania estrów to
metoda otrzymywania estrów to
…
…
reakcje kwasów karboksylowych (CO
reakcje kwasów karboksylowych (CO
2
2
H) z
H) z
alkoholami (ROH) w obecności katalizatora
alkoholami (ROH) w obecności katalizatora
kwasowego.
kwasowego.
C
O
R
O
R
+ H
2
O
C
O
H
R
OH
R
OH
••
••
C
O
H
R
OH
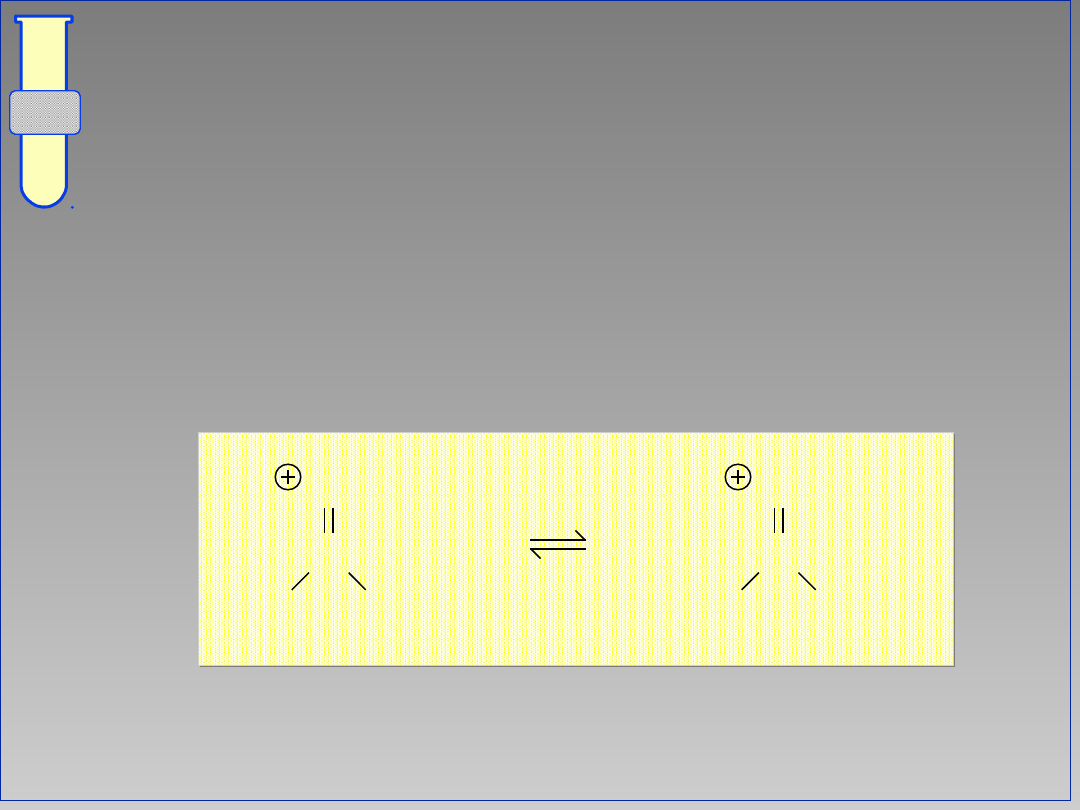
15
RJC
Stan równowagi w reakcji
Stan równowagi w reakcji
estryfikacji
estryfikacji
Równowaga pomiędzy estrem (CO
Równowaga pomiędzy estrem (CO
2
2
R) i
R) i
kwasem karboksylowym (CO
kwasem karboksylowym (CO
2
2
H), w
H), w
warunkach katalizy kwasowej, zależy od
warunkach katalizy kwasowej, zależy od
względnych stężeń alkoholu [ROH] oraz
względnych stężeń alkoholu [ROH] oraz
wody [H
wody [H
2
2
O].
O].
C
O
H
R
O
R
R
OH
••
••
C
O
H
R
OH
HOH
••
••

16
RJC
Otrzymywanie amidów z chlorków
Otrzymywanie amidów z chlorków
kwasowych
kwasowych
Amidy I-rzędowe (CONH
Amidy I-rzędowe (CONH
2
2
) można łatwo
) można łatwo
otrzymać w reakcji chlorków
otrzymać w reakcji chlorków
kwasowych (COCl) z amoniakiem (NH
kwasowych (COCl) z amoniakiem (NH
3
3
).
).
C
O
R
NH
2
+ HCl
C
O
R
Cl
NH
3
+
••
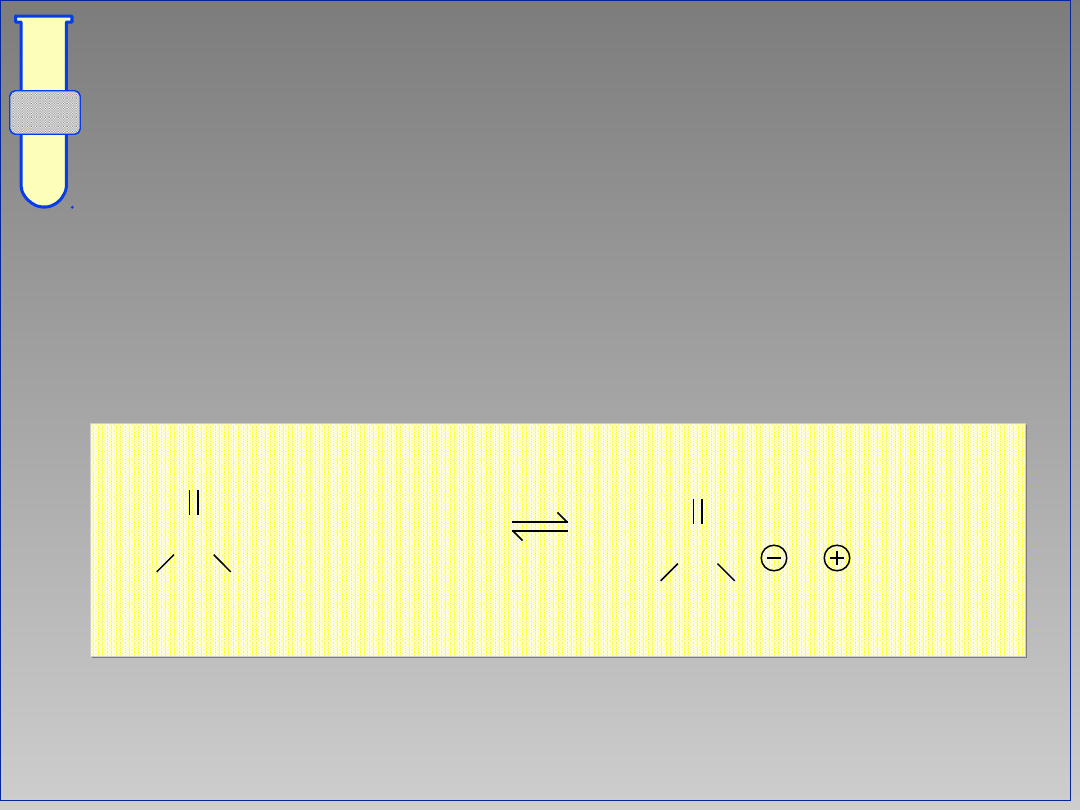
17
RJC
Otrzymywanie amidów bezpośrednio
Otrzymywanie amidów bezpośrednio
z kwasów
z kwasów
Reakcja kwasu karboksylowego (CO
Reakcja kwasu karboksylowego (CO
2
2
H)
H)
z amoniakiem (NH
z amoniakiem (NH
3
3
) nie prowadzi
) nie prowadzi
bezpośrednio do amidu (CONH
bezpośrednio do amidu (CONH
2
2
) z
) z
powodu konkurencyjnej reakcji kwas-
powodu konkurencyjnej reakcji kwas-
zasada.
zasada.
C
O
R
O
C
O
R
OH
NH
3
+
••
NH
4
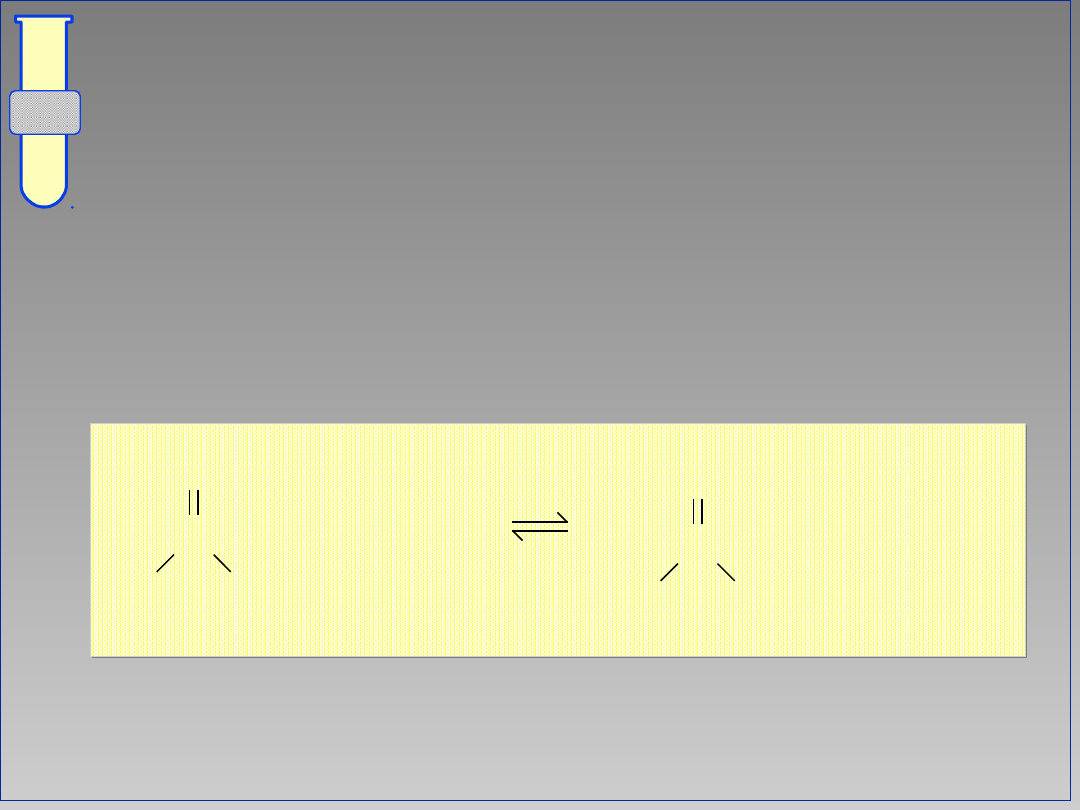
18
RJC
Otrzymywanie amidów z estrów
Otrzymywanie amidów z estrów
Amidy I-rzędowe (CONH
Amidy I-rzędowe (CONH
2
2
) można
) można
otrzymać na drodze reakcji estrów
otrzymać na drodze reakcji estrów
(CO
(CO
2
2
R) z amoniakiem (NH
R) z amoniakiem (NH
3
3
) (tzw.
) (tzw.
aminoliza estrów).
aminoliza estrów).
C
O
R
NH
2
C
O
R
OR
NH
3
+
••
ROH
+
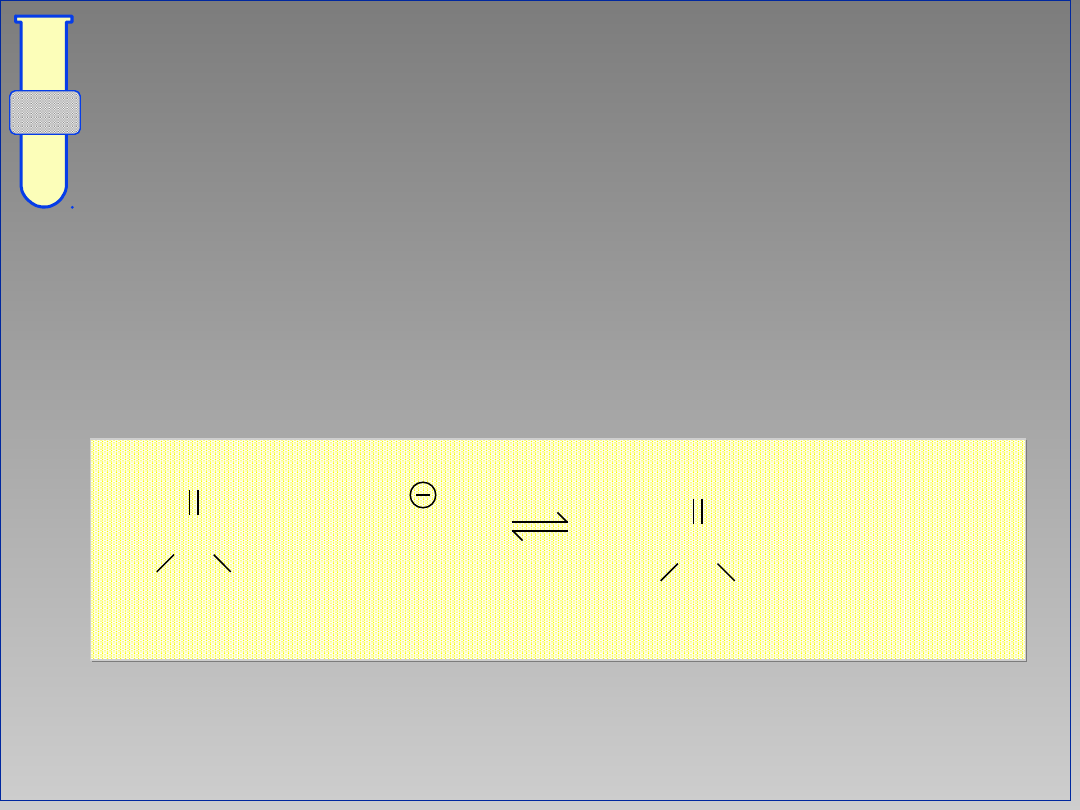
19
RJC
Zasadowa hydroliza
Zasadowa hydroliza
estrów/amidów/chlorków kwasowych
estrów/amidów/chlorków kwasowych
Hydroliza pochodnych kwasowych COX
Hydroliza pochodnych kwasowych COX
(gdzie X = OR, NH
(gdzie X = OR, NH
2
2
lub Cl) w
lub Cl) w
środowisku zasadowym (zmydlanie) i
środowisku zasadowym (zmydlanie) i
następne zakwaszenie roztworu
następne zakwaszenie roztworu
prowadzą do odpowiedniego kwasu
prowadzą do odpowiedniego kwasu
karboksylowego (CO
karboksylowego (CO
2
2
H). Zasadowa
H). Zasadowa
hydroliza pochodnych kwasowych jest
hydroliza pochodnych kwasowych jest
nieodwracalna !
nieodwracalna !
C
O
R
OH
C
O
R
X
HO
+
HX
+
20
RJC
Kwasowa hydroliza
Kwasowa hydroliza
estrów/amidów/chlorków
estrów/amidów/chlorków
kwasowych
kwasowych
Hydroliza pochodnych kwasowych COX
Hydroliza pochodnych kwasowych COX
(gdzie X = OR, NH
(gdzie X = OR, NH
2
2
lub Cl) w
lub Cl) w
środowisku kwasowym prowadzi
środowisku kwasowym prowadzi
bezpośrednio do odpowiedniego kwasu
bezpośrednio do odpowiedniego kwasu
karboksylowego (CO
karboksylowego (CO
2
2
H). Jest to reakcja
H). Jest to reakcja
odwracalna !
odwracalna !
C
O
R
OH
C
O
H
R
X
H
2
O
HX
+
C
O
H
R
X

21
RJC
Podsumowanie
Podsumowanie
Podstawienie nukleofilowe przy grupie C=O
Etap określający szybkość reakcji i równowagi
Szybkość reakcji : czynniki steryczne vs
czynniki elektronowe
Chlorki kwasowe
Kwasy
Amidy
Estry
Hydroliza : zasadowa (zmydlanie) vs
kwasowa
Podstawienie nukleofilowe przy grupie C=O
Etap określający szybkość reakcji i równowagi
Szybkość reakcji : czynniki steryczne vs
czynniki elektronowe
Chlorki kwasowe
Kwasy
Amidy
Estry
Hydroliza : zasadowa (zmydlanie) vs
kwasowa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
3 Halogenoalkany Substytucja nukleofilowa
Substytucja nukleofilowa SN (2)
Zadania z reakcji substytucji nukleofilowej i eliminacji w halogenkach alkilowych
Halogenki alkilowe – substytucja nukleofilowa – grupa opuszczająca – kwasy i zasady
substytucja nukleofilowa, ochrona środowiska UJ, IV semestr, chemia ograniczna, sprawozdania
Halogenoalkany Substytucja nukleofilowa2
Substytucja Nukleofilowa SN (1)
pochodne związków karbonylowych zadania
Addycje Nukleofilowe do Grupy Karbonylowej
16 Substytucja w pozycji alfa kondensacje zw karbonylowych
pochodne związków karbonylowych zadania
2 Pochodna calkaid 21156 ppt
Rozpuszczalniki organiczne pochodne alifatyczne (oprócz metanolu
potencjal spoczynkowy i jego pochodzenie
Klastry turystyczne, pochodzenie nazwy, co to
Naturalne źródła węglowodorów i ich pochodne
aldehydy i ketony addycja nukleofilowa
więcej podobnych podstron