http://www.chemia.sos.pl
- 1 -
1.
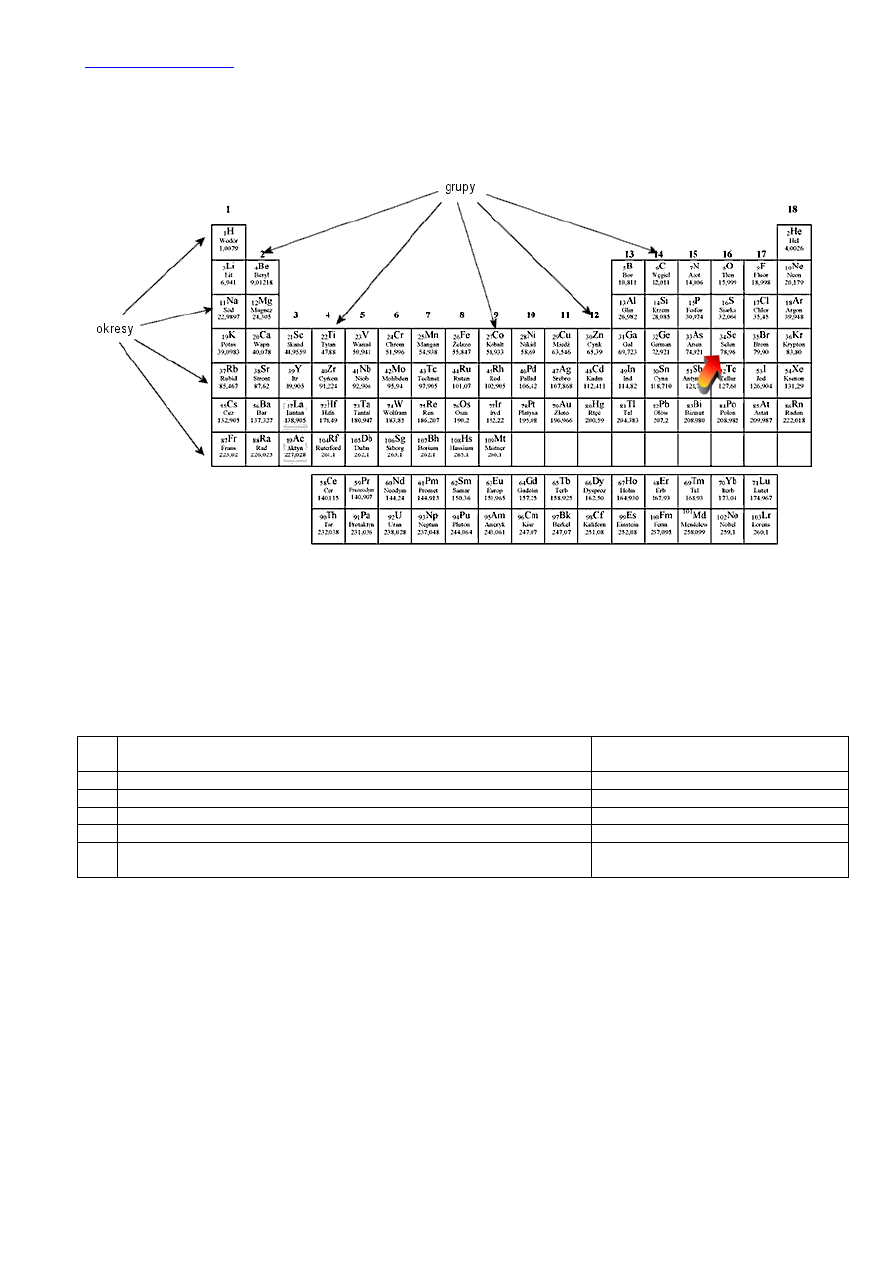
Z położenia selenu w układzie okresowym pierwiastków: IV okres i 16 grupa wnioskujemy, że selen posiada 4 powłoki
elektronowe, na ostatniej powłoce znajduje się 16-10=
6 elektronów
walencyjnych (liczba elektronów walencyjnych równa jest
nr grupy dla pierwiastków z grup od 1 do 10, oraz nr grupy pomniejszony o 10 dla pierwiastków leżących w grupach od 11 do
18). 6 elektronów walencyjnych będzie rozmieszczone na orbitalach s i p.
Aby przyjąć konfigurację gazu szlachetnego selen musi otrzymać 2 elektrony, a więc jego najniższy stopień utlenienia będzi –II.
Konfigurację gazu szlachetnego może również uzyskać oddając 6 elektronów walencyjnych. Jego najwyższy stopień utlenienia
będzie zatem VI. W inny sposób można uzyskać te dane, a zarazem odpowiedzi na dalsze pytania rozpatrując max.
wartościowość selenu względem tlenu, oraz wartościowość względem wodoru, czyli wartościowość w połączeniu z tlenem i
wartościowość w połączeniu z wodorem.
Maksymalna wartościowość względem tlenu równa dla pierwiastków grup głównych równa jest nr grupy lub nr grupy
pomniejszony o 10 dla pierwiastków z grup od 13 do 17. Czyli maksymalna wartościowość względem tlenu dla selenu wynosi
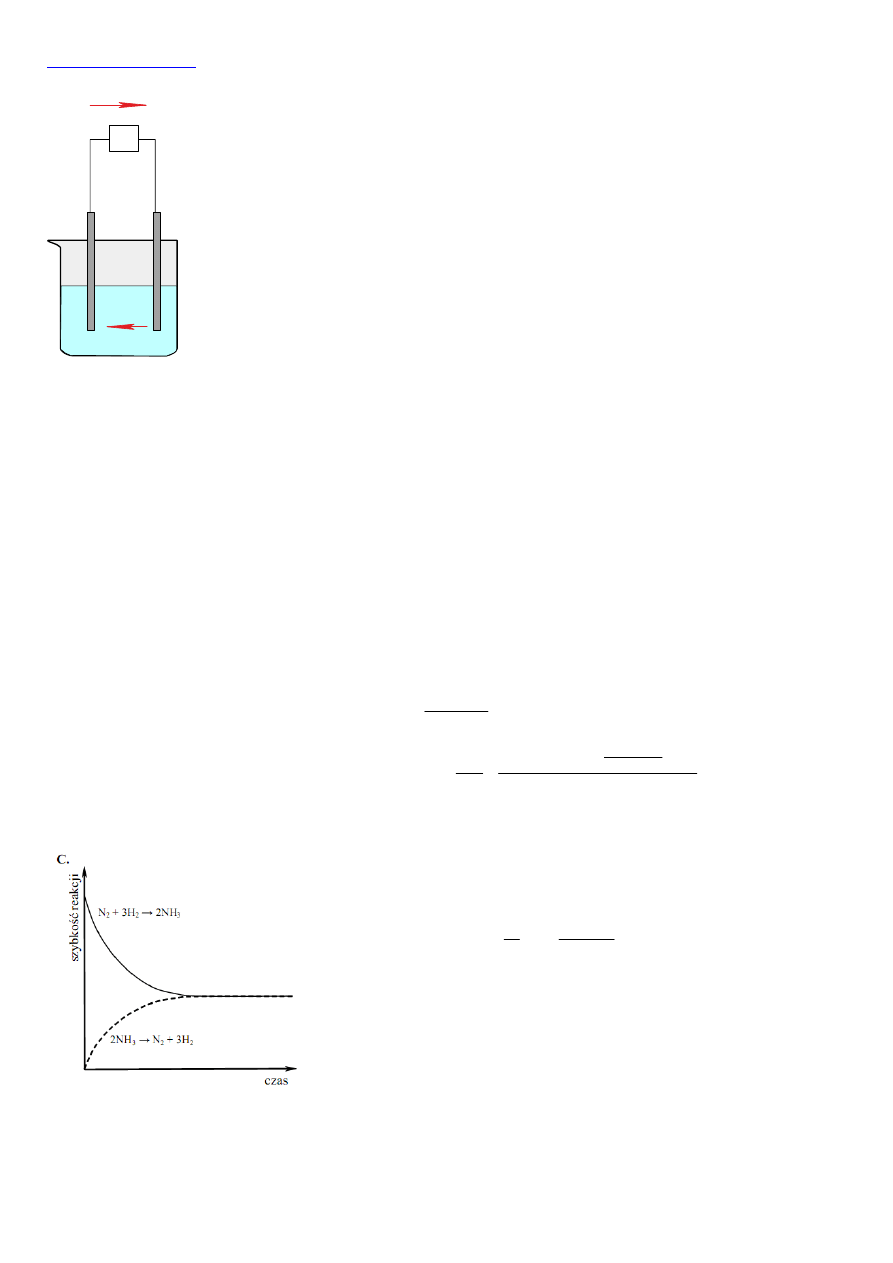
VI, a wzór tlenku będzie SeO
3
. Wartościowość względem wodoru dla pierwiastków grup głównych zmienia się w szeregu: 1, 2,
3, 4, 3, 2, 1 odpowiednio dla pierwiastków z grup 1, 2, 13, 14, 15, 16, 17. Selen jest więc II wartościowy względem wodoru,
wzór związku z wodorem to H
2
Se i selen jest w nim na –II stopniu utlenienia. Selen jest niemetalem, więc jego tlenki mają
charakter kwasowy.
1
Konfiguracja elektronów walencyjnych atomu selenu w stanie
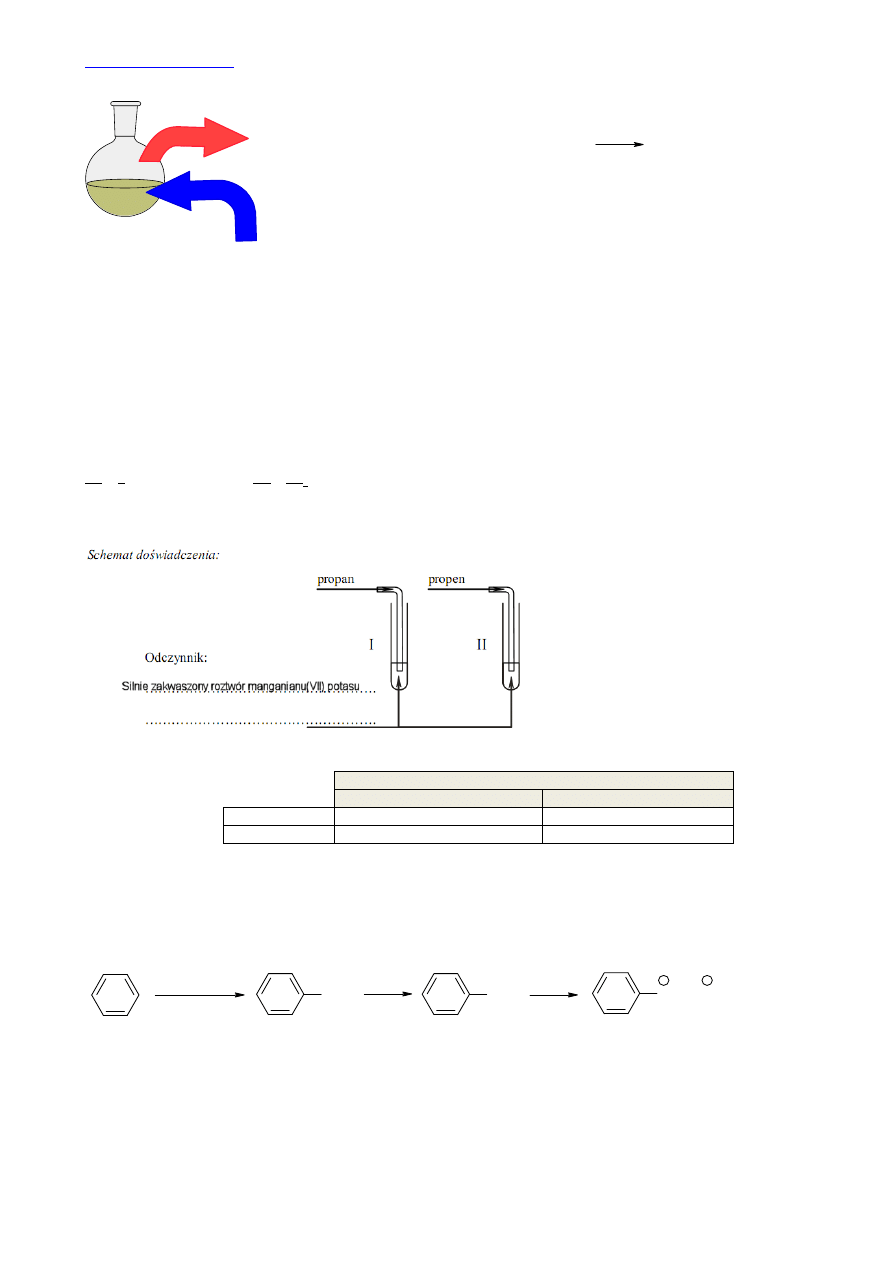
podstawowym (z uwzględnieniem podpowłok)
4s
2
4p
4
2 Najniższy stopień utlenienia selenu w związkach chemicznych
-II
3 Najwyższy stopień utlenienia selenu w związkach chemicznych
VI
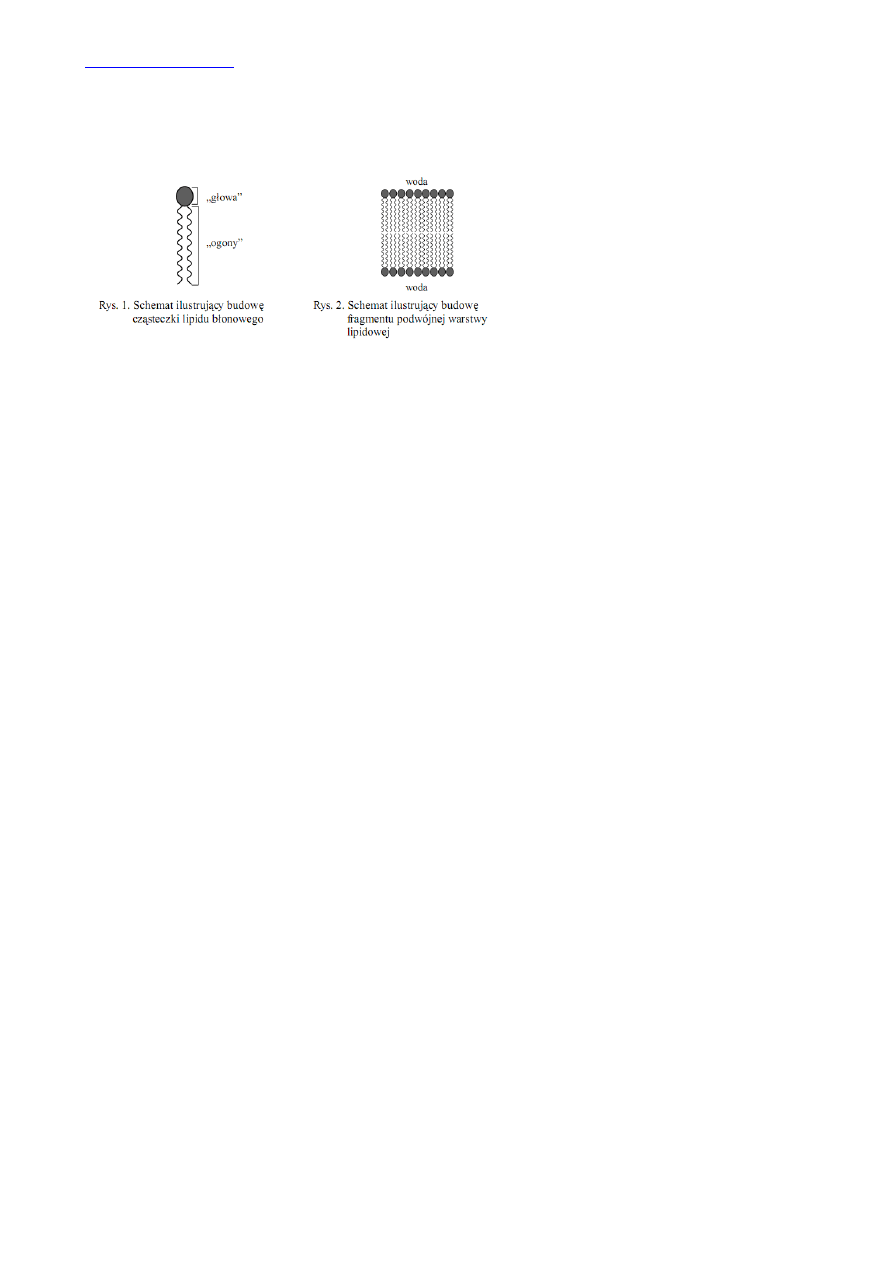
4 Wzór
związku selenu z wodorem
H
2
Se
5
Wzór tlenku, w którym selen przyjmuje najwyższy stopień utlenienia
SeO
3
6
Przewidywany charakter chemiczny (zasadowy, amfoteryczny, kwasowy,
obojętny) tlenku selenu, o którym jest mowa w p. 5
kwasowy
2.
Związki jonowe to związki w których różnica elektroujemności pomiędzy pierwiastkami jest większa
Δ>1,7. W podanych
związkach warunek ten spełniony jest dla Ba(OH)
2
, KHCO
3
, Na
2
SO
4
, NH
4
NO
3
, Rb
2
O. Wiązanie jonowe występuje pomiędzy
barem a tlenem grupy hydroksylowej, potasem a tlenem w jonie węglanowym, sodem a tlenem w jonie siarczanowym(VI),
azotem jonu amonowego a tlenem w jonie azotanowym(V), rubidem a tlenem. Atom azotu w jonie amonowym tworzy 4
wiązania kowalencyjne z atomami wodoru, nie może już utworzyć piątego wiązania z atomem tlenu, dlatego tworzy wyłącznie
wiązania jonowe. Czasami mówi się, że w jonie amonowym występują 3 wiązania kowalencyjne i jedno koordynacyjne. Należy
jednakże pamiętać, że wiązanie koordynacyjne jest odmianą wiązania kowalencyjnego, dlatego również poprawne jest
powiedzenie, że w jonie tym występują 4 wiązania kowalencyjne. Dla bezpieczeństwa jednak lepiej jest zaznaczyć, że 4
wiązanie powstaje w inny sposób.
http://www.chemia.sos.pl
- 2 -
3.
Ca
Ca(OH)
2
CaCO
3
CaCl
2
1
2
3
Wapń leży w 2 grupie układu okresowego, jest więc metalem bardzo aktywnym. Wodorotlenek wapnia można łatwo otrzymać
w reakcji wapnia z wodą.
1.
Ca + 2H
2
O → Ca(OH)
2
+ H
2
↑
Węglan wapnia – sól może być otrzymana w reakcji wodorotlenku w kwasem węglowym, ewentualnie wodorotlenku wapnia z
bezwodnikiem (tlenkiem węgla(IV)). Oczywiście kwas węglowy nie istnieje, dlatego powinniśmy wybrać reakcję wodorotlenku
wapnia z tlenkiem węgla(IV):
2.
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O
Węglan wapnia jest solą bardzo słabego kwasu węglowego. Chlorek wapnia można więc otrzymać w reakcji węglanu wapnia z
kwasem solnym. Mocny kwas wyprze z soli słaby kwas. Oczywiście kwas węglowy natychmiast rozłoży się na tlenek węgla(IV)
i wodę:
3.
CaCO
3
+ 2HCl → CaCl
2
+ H
2
O + CO
2
↑
4.
Z podanych soli widzimy, że słabo rozpuszczalny jest chlorek ołowiu(II), PbCl
2
, oraz siarczan(VI) ołowiu(II), który jest
praktycznie nierozpuszczalny. Chcąc z roztworu wytrącić całkowicie jony ołowiu(II) należy użyć soli, która zwiera jony
siarczanowe(VI). Solą taką jest siarczan(VI) sodu Na
2
SO
4
. Z tabeli możemy odczytać, że siarczan sodu jest bezbarwnym
roztworem, roztwór zawierający rozpuszczoną sól ołowiu(II) jest również bezbarwny.
Po zmieszaniu bezbarwnych roztworów, wytrąca się biały osad.
Równanie jonowe zachodzącej reakcji po zmieszaniu roztworów zawiera tylko jony, które biorą udział w reakcji:
Pb
2+
+ 2Na
+
+ SO
4
2-
→ PbSO
4
+ 2Na
+
(siarczan(VI) sodu jako sól jest mocnym elektrolitem, czyli zdysocjowany w 100%). Po
skróceniu wyrazów powtarzających się otrzymamy:
Pb
2+
+ SO
4
2-
→ PbSO
4
↓
5.
Erozja skał wapiennych polega na rozpuszczaniu się wapienia. Wskaźnikiem, że wapń przechodzi do roztworu jest zdanie, że
„woda staję się twarda”. Twardość wody powodują między innymi rozpuszczone sole wapnia i magnezu. Wiemy, że wapień,
CaCO
3
rozpuszcza się pod wpływem CO
2
i wody:
CaCO
3
+ CO
2
+ H
2
O → Ca
2+
+ 2HCO
3
-
6.
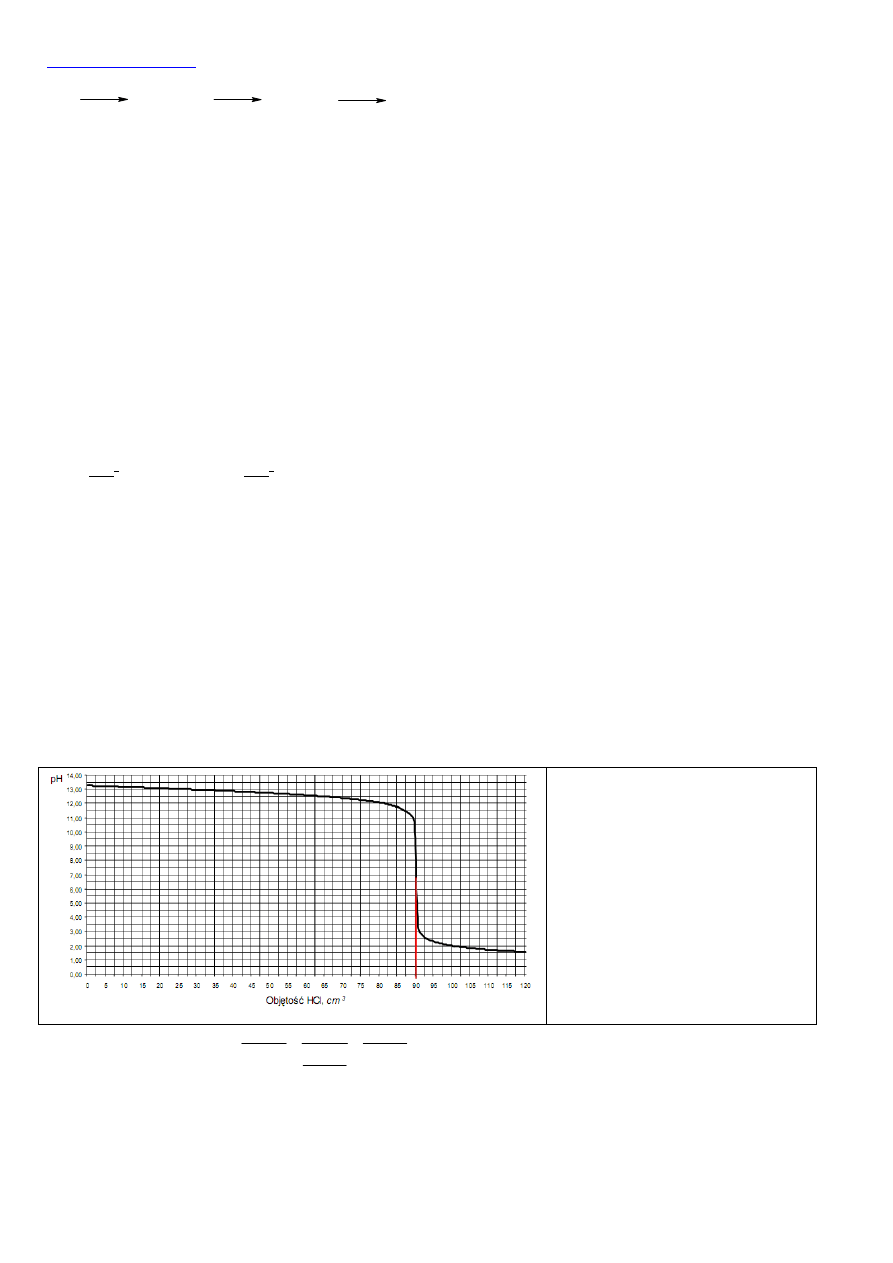
Z wykresu możemy odczytać, że po dodaniu 120cm
3
roztworu kwasu solnego, pH roztworu wynosi około 1,5, czyli środowisko
jest kwaśne. W środowisku takim nie ma już wodorotlenku sodu, który całkowicie przereagował z kwasem solnym dając chlorek
sodu, NaCl. Obok chlorku sodu w roztworze znajduje się nadmiar kwasu solnego HCl. Zarówno chlorek sodu, jak i kwas solny
są mocnymi elektrolitami (całkowicie zdysocjowanymi). W roztworze znajdą się zatem jony Na
+
, Cl
-
i H
3
O
+
(H
+
).
7.
Z wykresu możemy odczytać, że do
miareczkowania tej próbki zasady
potrzeba 90cm
3
0,2M roztworu kwasu
solnego.
Kwas solny z wodorotlenkiem sodowym
reaguje wg równania reakcji:
NaOH + HCl → NaCl + H
2
O
Z równania reakcji wynika, że związki te
reagują ze sobą w stosunku mol:mol.
C
M
(HCl)=0,2M, V
HCl
=90cm
3
. W podanej
objętości znajduje się (C
M
=n/V)
n=C
M
V=0,2M
.
90cm
3
=18mmoli kwasu.
Identyczna ilość mmoli NaOH znajduje się
w 100cm
3
zasady.
C
M
=18mmol/100cm
3
=0,18mol/dm
3
.
Wzór na stężenie molowe
M
3
3
3
n
n
1000n
C
V[dm ]
V[cm ]
V[cm ]
1000
=
=
=
. Wyrażenie 1000n nazywane jest molem (milimolem). Dlatego
posługując się wielkością mmol nie ma potrzeby zamieniać objętości na dm
3
.

http://www.chemia.sos.pl
- 3 -
8.
Tlen w związkach jest (poza nielicznymi wyjątkami) na –II stopniu utlenienia. Aby podane tlenku były obojętne (nie posiadały
ładunku) mangan musi w nich być na dodatnim stopniu utlenienia i odpowiednio na II, (2
.
2) IV, oraz (7
.
2/2) VII stopniu
utlenienia. Istnieje zasada, że tlenki metali na wysokim stopniu utlenienia mają charakter kwasowy, na najniższym zasadowy,
czyli na pośrednich stopniach utlenienia mają charakter amfoteryczny. Dla niemetali, tlenki niemetali na niskich stopniach
utlenienia mają często charakter obojętny (CO, N
2
O):
Wzór tlenku
Stopień utlenienia manganu
Charakter chemiczny tlenku
MnO II
Zasadowy
MnO
2
IV
Amfoteryczny
Mn
2
O
7
VII Kwasowy
9.
Mangan otrzymywany jest w reakcji:
3MnO
2
+ 4Al
3Mn + 2Al
2
O
3
temp.
Jeżeli w piroluzycie znajduje się 95% tlenku manganu(IV) (c%=100%
.
m
s
/m
rozt
), to w 55g piroluzytu znajduje się
m
s
=95%
.
55g/100%=
52,25g
tlenku manganu(IV). Z równania reakcji możemy odczytać, że:
Do redukcji 260,8g (3 mole) tlenku manganu(IV) potrzeba 107,9g (4mole) glinu, to
do redukcji 52,25g tlenku manganu(IV) potrzeba x g glinu, czyli
52,25g 107,9g
x
260,8g
21,62g
⋅
=
=
. Do redukcji 55g piroluzytu potrzeba 21,62g glinu.
10.
Kwasem według teorii Brønsteda nazywamy związek oddający proton, natomiast zasadą związek mogący przyjąć proton od
kwasu. Według tej teorii wskaźnik InH oddaje proton (jest kwasem) cząsteczce wody (jest ona zasadą). Anion wskaźnika In
-
jest sprzężoną zasadą kwasu InH, natomiast jon hydroniowy H
3
O
+
jest sprzężonym kwasem dla zasady H
2
O.
Zasada Brønsteda
Kwas Brønsteda
In
-
, H
2
O InH,
H
3
O
11.
Stała równowagi reakcji
InH + H
2
O
In
-
+ H
3
O
+
3
2
[In ][H O ]
k
[InH][H O]
−
+
=
. Stężenie molowe wody w wodzie jest stałe i
wynosi [H
2
O]=55,55mol/dm
3
. Po wymnożeniu stron przez stałą wartość, czyli przez [H
2
O] otrzymamy:
2
3
[I
k
n ][H O ]
K
[
]
H]
O
In
H
[
−
+
=
=
12.
Jeżeli wskaźnik InH jest kwasem, to po dodaniu mocnej zasady stan równowagi zostanie przesunięty w kierunku tworzenia
anionu In
-
:
InH + OH
-
In
-
+ H
2
O
13.
Z informacji o błękicie bromometylowym wynika, że w środowisku kwaśnym ma barwę żółtą, a w środowisku zasadowym
błękitną. W środowisku kwaśnym występuje forma InH, natomiast w środowisku zasadowym forma In
-
.
Postać błękitu bromometylowego
Barwa
Kwasowa (InH)
Zółta
Zasadowa (In
-
) Błękitna
14.
Z informacji o błękicie bromometylowym wynika, że:
6
7
7,6
Dla roztworów o pH<6 przeważa barwa kwasowa wskaźnika
InH, natomiast w środowisku o pH>7,6 przeważa forma
anionowa wskaźnika In
-
. W środowisku o 6<pH<7,6 forma
kwasowa i zasadowa wskaźnika współistnieją ze sobą. W
takim środowisku [InH]≈[In
-
], czyli barwa wskaźnika w tym
środowisku jest barwą powstałą z wymieszania barwy żółtej i
błękitnej – czyli zielona.
http://www.chemia.sos.pl
- 4 -
15.
Propionian sodu CH
3
CH
2
COONa jest solą i w wodzie jest zdysocjowany w 100%. Reszta kwasowa – anion propanianowy
pochodzi od słabego kwasu propanowego, zgodnie z teorią kwasów i zasad Brønsteda ma charakter zasady, woda natomiast
w tej reakcji zachowuje się jak kwas Brønsteda – oddaje zasadzie proton:
CH
3
CH
2
COO
-
+ H
2
O
CH
3
CH
2
COOH + OH
-
Do roztworu wprowadzono proanian sodu. Jest to sól, a więc z definicji jest mocnym elektrolitem i w wodzie jest zdysocjowany
w 100%, nie ma więc cząsteczek CH
3
COONa, w roztworze można natomiast znaleźć jony propanianowe CH
3
CH
2
COO
-
oraz
jony Na
+
. W wyniku hydrolizy pojawiają się również jony OH
-
i cząsteczki kwasu CH
3
CH
2
COOH, na co wskazuje równanie
reakcji hydrolizy.
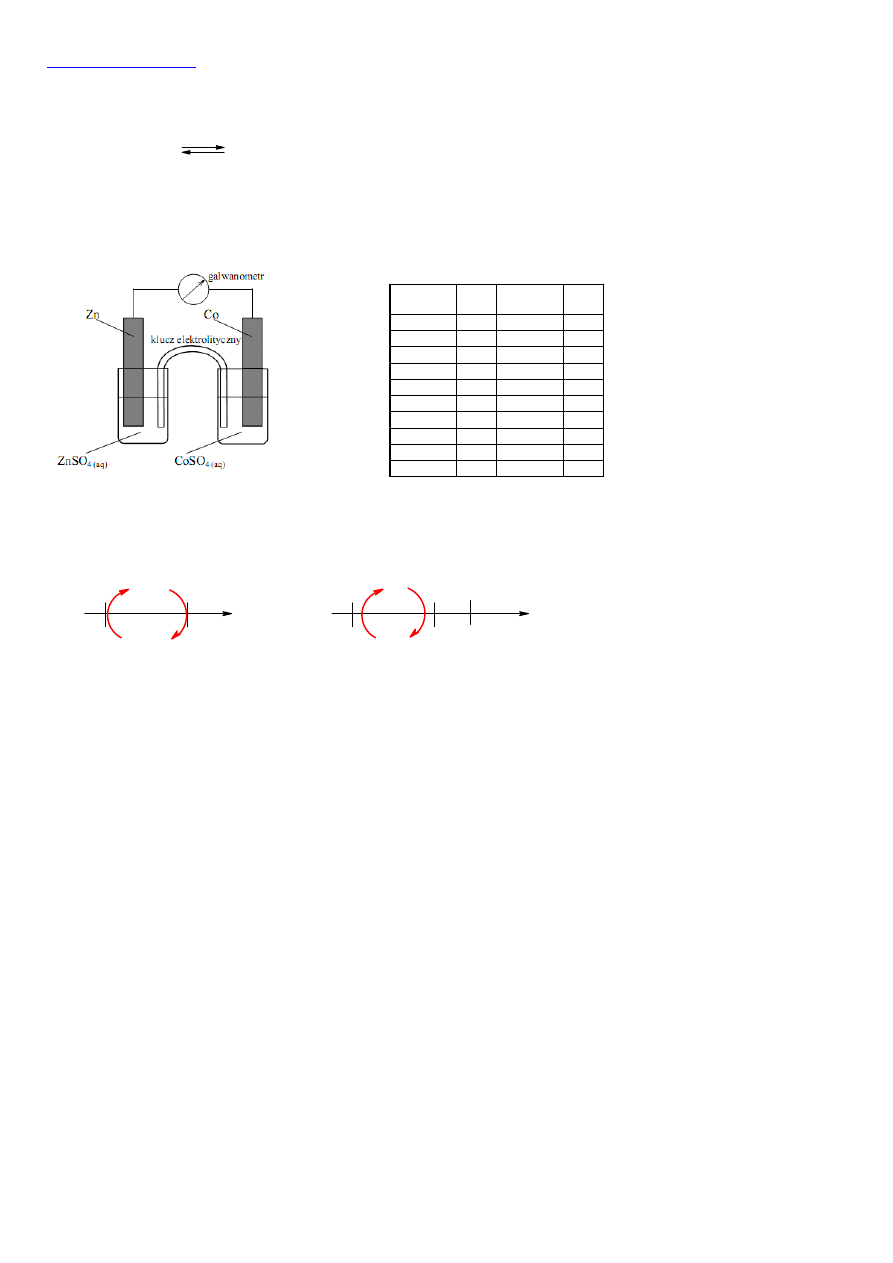
16.
Z szeregu elektrochemicznego metali widzimy, że kobalt ma wyższy potencjał utleniający od cynku. Zapisując odpowiednie
potencjały na osi i posługując się metodą zegarową będziemy mogli przewidzieć kierunek reakcji:
forma
utleniona
forma
zredukowana
forma
utleniona
forma
zredukowana
Zn
Zn
2+
Co
Co
2+
0
sposób rozmieszczenia
półogniw na osi
Z reguły zegarowej (zegarowa ponieważ
poruszamy się zgodnie z ruchem
wskazówek zegara) widzimy, że cynk
przechodzi do roztworu (utlenia się) w
postaci jonów Zn
2+
, natomiast jony CO
2+
są redukowane do kobaltu.
Utlenianie na ogniwie lub podczas
elektrolizy zachodzi zawsze na anodzie.
Cynki przechodząc do roztworu oddaje
elektrony: Zn → Zn
2+
+ 2e, stanowi więc
ujemny biegun ogniwa Zn/Zn
2+
.
17.
Cynk utlenia się do jonów Zn
2+
, natomiast jony kobaltu Co
2+
redukują się do kobaltu, co możemy zapisać w postaci
połówkowych równań reakcji:
Zn → Zn
2+
+ 2e
Co
2+
+ 2e → Co
i sumarycznie:
Zn + Co
2+
→ Zn
2+
+ Co
18.
Silniejszym reduktorem jest ten metal, który sam się utlenia, a redukuje inny metal. W rozpatrywanym przypadku jest to cynk.
Podobne wnioski można wyciągnąć z szeregu elektrochemicznego metali. Te metale, które mają mniejsze potencjały
utleniające są silniejszymi reduktorami. Zn/Zn
2+
E
0
=-0,76V, Co/Co
2+
E
0
=-0,27V.
Szereg elektrochemiczny metali
Elektroda E
0
[V] Elektroda E
0
[V]
Li/ Li
+
-3,02
Ni/
Ni
2+
-0,23
Ca/ Ca
2+
-2,84
Sn/
Sn
2+
-0,14
Mg/ Mg
2+
-2,38
Pb/ Pb
2+
-0,13
Al/Al
3+
-1,66
Fe/
Fe
3+
-0,04
Mn/Mn
2+
-1,05
H
2
/2H
+
0,00
Zn/ Zn
2+
-0,76
Bi/Bi
3+
+0,23
Cr/ Cr
3+
-0,74
Cu/Cu
2+
+0,34
Fe/ Fe
2+
-0,44
Ag/Ag
+
+0,80
Cd/ Cd
2+
-0,40
Hg/Hg
2+
+0,85
Co/Co
2+
-0,27
Au/Au
+
+1,70
http://www.chemia.sos.pl
- 5 -
19.
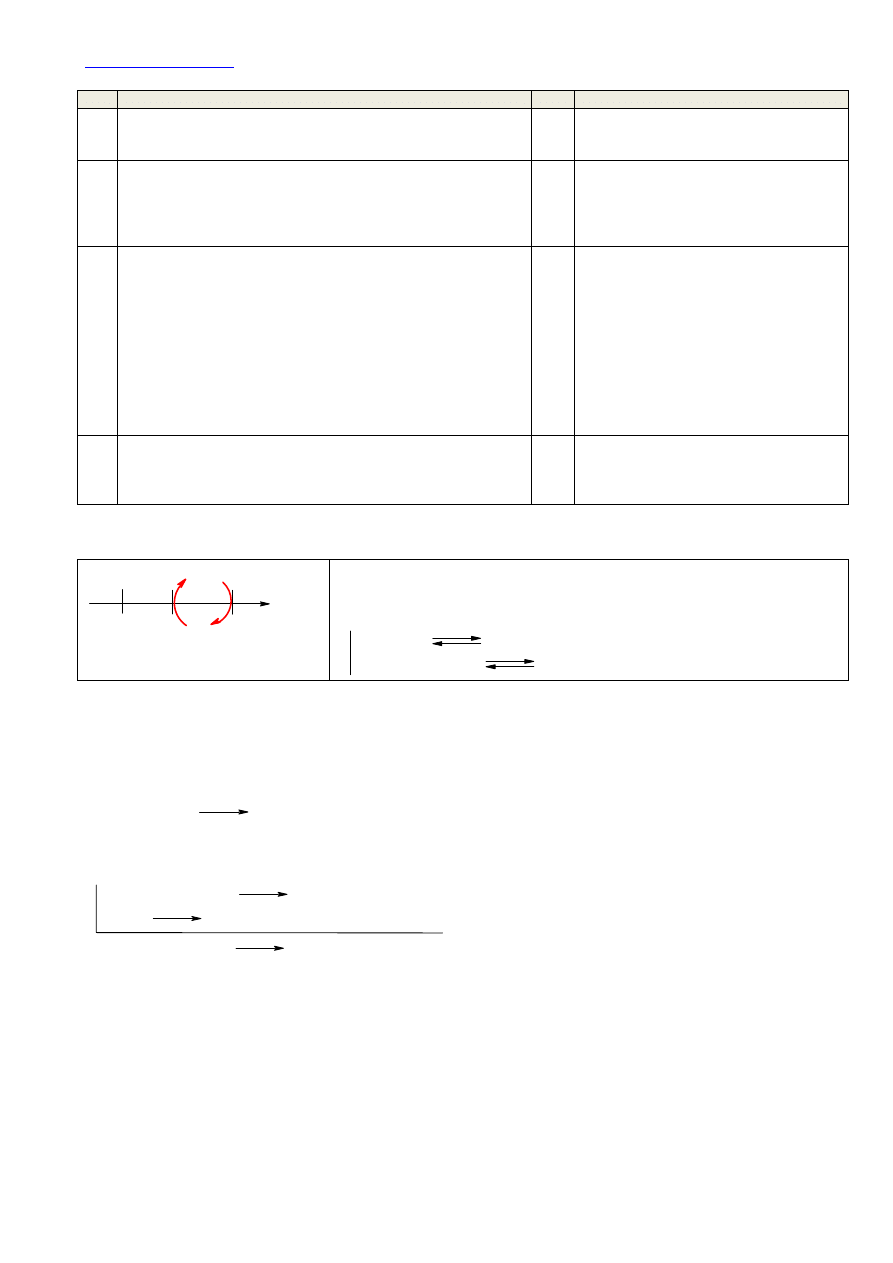
Lp.
Zdanie
P/F
1
W czasie pracy ogniwa elektrony przepływają kluczem
elektrolitycznym od półogniwa cynkowego do półogniwa
kobaltowego
F Przepływ prądu może być elektronowy lub
jonowy. Elektronowy (ruch elektronów)
może odbywać się wyłącznie w metalu.
2
W czasie pracy ogniwa elektrony przepływają zewnętrznym
przewodnikiem elektrycznym w kierunku od cynku do kobaltu
P Jeżeli cynk jest ujemnym biegunem
ogniwa, to elektrony muszą płynąć od
cynku do kobaltu zewnętrznym
przewodnikiem elektryczności. Oczywiście
umownie prąd płynie od kobaltu do cynku.
3 Klucz
elektrolityczny
łączy półogniwa umożliwiając przepływ jonów
między roztworami, zamyka obwód elektryczny
P
Klucz elektrolityczny stanowi roztwór soli,
najczęściej KCl. Zamyka on obwód
elektryczny i umożliwia przepływ prądu.
Jeżeli cynk przechodzi do roztworu, a
kobalt wydziela się, to stężenie jonów
siarczanowych(VI) w przestrzeni anodowej
(w półogniwie cynkowym) jest za małe w
stosunku do jonów cynkowych, a w
przestrzeni katodowej za duże w stosunku
do jonów Co
2+
. Poprzez klucz
elektrolityczny stężenia te wyrównują się.
4
W czasie pracy ogniwa masa blaszki cynkowej rośnie, a masa
blaszki kobaltowej maleje
F Jeżeli cynk przechodzi do roztworu, to
masa cynku musi maleć, a masa elektrody
kobaltowej musi wzrastać, ponieważ kobalt
się na niej wydziela.
20.
W celu określenia kierunku reakcji posłużymy się metodą zegarową:
0
V
Fe
3+
Fe
2+
MnO
4
-
+ 4H
+
MnO
2
+ 2H
2
O
Na osi u góry zapisujemy formę utlenioną, na dole zredukowaną. Kierunek reakcji
określamy poruszając się zgodnie z ruchem wskazówek zegara. Aby zapisać
sumaryczne równanie reakcji ilość elektronów w każdej reakcji połówkowej musi
być równa:
Fe
3+
+ 1e
Fe
2+
MnO
4
-
+ 4H
+
+ 3e
MnO
2
+ 2H
2
O
3
1
Sumarycznie:
3Fe
3+
+ MnO
4
-
+ 4H
+
→ 3Fe
2+
+ MnO
4
+ 2H
2
O
21.
W celu dobrania współczynników reakcji musimy odnaleźć pierwiastki, które zmieniły swój stopień utlenienia. W tym celu
obliczamy stopnie utlenienia poszczególnych pierwiastków:
Cr
2
O
7
2-
+ I
-
+ H
+
Cr
3+
+ I
2
+ H
2
O
VI
III
-I
0
W kolejnym kroku zapisujemy równania połówkowe dla tych pierwiastków, które zmieniły swój stopień utlenienia. Brakujące
atomy tlenu lub wodoru pobieramy z wody lub z jonów wodorowych. Równania bilansujemy dobierając jednakową ilość
elektronów w równaniach połówkowych:
Cr
2
O
7
2-
+ 6e + 14H
+
2Cr
3+
+ 7H
2
O
2I
-
I
2
+ 2e
3
1
Cr
2
O
7
2-
+ 14H
+
+ 6I
-
2Cr
3+
7H
2
O + 3I
2
Utleniaczem jest związek, który zmniejszył swój stopień utlenienia, natomiast reduktorem ten, który zwiększył swój stopień
utlenienia:
Utleniacz: Cr
2
O
7
2-
Reduktor: I
-
.
http://www.chemia.sos.pl
- 6 -
22.
+ -
Aby możliwy był przepływ prądu i elektroliza obwód musi być zamknięty. W tym celu
elektrolizerze musi znajdować się elektrolit, który umożliwi przepływ prądu elektrycznego
23.
Aby podczas elektrolizy następował elektrolityczny rozkład wody musimy użyć soli składającej się z jonów metalu leżącego w
szeregu elektrochemicznym na lewo od cynku (metal musi mieć potencjał utleniający mniejszy od potencjału utleniającego
cynku), oraz reszty kwasowej pochodzącej od kwasu tlenowego. Solą spełniającą ten warunek jest siarczan(VI) sodu,
Na
2
SO
4
.
24.
W czasie elektrolizy wody następuje redukcja jonów wodorowych do wodoru, oraz utlenienie tlenu(-II) do tlenu
cząsteczkowego. Pisząc równania zachodzące na elektrodach musimy pamiętać, żeby zgadzała się ilość elektronów
pobieranych przez anodę i oddawanych przez katodę, oraz to, że na anodzie zawsze zachodzi utlenianie. Równania
połówkowe łatwiej będzie zapisać wiedząc, że suma ładunków po lewej stronie równania musi być równa sumie ładunków po
prawej stronie równania:
(Anoda): 4H
2
O +4e → 2H
2
+ 4OH
-
(Katoda): 2H
2
O → 4H
+
+ O
2
+ 4e
25.
Z równania rozkładu wody: 2H
2
O → 2H
2
+ O
2
możemy odczytać:
W wyniku rozkładu 36g (2mole) wody powstają 1mole tlenu, to
w wyniku rozkładu 100g wody powstanie x moli tlenu, czyli
100g 1mol
x
3
2,77
6g
8mol
⋅
=
=
tlenu. Podstawiając dane do wzoru
Clapeyrona PV=nRT i przekształcając względem V otrzymamy:
3
3
hPa dm
2,778mol 83,14h
295K
nRT
mol K
V
P
1000h
68 1 d
Pa
, 3 m
⋅
⋅
⋅
=
=
=
tlenu.
26.
Szybkość tworzenia amoniaku opisana jest równaniem: V
T
=k
1
[N
2
][H
2
]
3
,
natomiast szybkość rozkładu amoniaku równaniem V
R
=k
2
[NH
3
]
2
. Jeżeli układ
osiągnął stan równowagi (równowagi dynamicznej) to szybkość tworzenia
amoniaku jest równa szybkości rozkładu amoniaku V
T
=V
R
(wtedy
k
1
[N
2
][H
2
]
3
= k
2
[NH
3
]
2
, oraz
2
3
1
3
2
2
2
[NH ]
k
K
k
[N ][H ]
= =
). Z podanych wykresów od
razu możemy odrzucić wykresy A i B ponieważ na tych wykresach szybkość
rozkładu i szybkość tworzenia amoniaku nie są sobie równe. Wykres D
również należy odrzucić, ponieważ w chwili rozpoczęcia doświadczenia „W
zamkniętym reaktorze zmieszano znane ilości azotu i wodoru. Utrzymując
wysoką, stałą temperaturę, mierzono zmiany stężeń azotu, wodoru i
amoniaku aż do osiągnięcia przez układ stanu równowagi i pewien czas po
tym momencie
”, czyli w czasie t=0 stężenie amoniaku wynosiło 0 mol/dm
3
i
wzrastało w czasie. Warunki powyższe spełnia jedynie wykres C.
http://www.chemia.sos.pl
- 7 -
27.
energia wydzielana do otoczenia
(
ΔE<0) - reakcja egzo
energia pobierana od otoczenia
(
ΔE>0) - reakcja endo
Gdy energia jest wydzielana do otoczenia w postaci ciepła,
energia układu maleje (
ΔH<0). W podanym przykładzie:
CH
2
=CH
2
+ H
2
kat.
CH
3
-CH
3
ΔH=-137kJ/mol
ΔH<0, a więc reakcja jest egzotermiczna.
28.
W celu obliczenia entalpii reakcji najlepiej reakcje potraktować jak równania matematyczne:
• Standardowa entalpia tworzenia propanu: 3C + 3H
2
→ C
2
H
6
ΔH
0
=-104,7kJ/mol
(1)
• Standardowa entalpia tworzenia propenu: 3C + 2H
2
→ C
2
H
4
ΔH
0
=20,0kJ/mol
(2)
• Standardowa entalpia uwodornienia propenu: C
2
H
4
+ H
2
→ C
2
H
6
ΔH
0
=x (3)
Dodając (odejmując) stronami równania z daną wartością entalpii powinniśmy otrzymać równanie z wartością entalpii
poszukiwanej. Zauważmy, że w poszukiwanym równaniu (3) eten jest po lewej stronie równania reakcji, natomiast w równaniu
(2) znajduje się po prawej stronie równania reakcji. Zgodnie z prawem Laplace’a ( molowa entalpia reakcji rozkładu związku
chemicznego na pierwiastki jest równa molowej entalpii reakcji tworzenia się tego związku, wziętej ze znakiem przeciwnym
)
możemy zapisać: C
2
H
4
→ 3C + 2H
2
ΔH
0
=-20,0kJ/mol
(4)
Dodając stronami równanie (1) i (4) otrzymamy:
3C + 3H
2
+ C
2
H
4
→ C
2
H
6
+ 3C + 2H
2
ΔH
0
=-104,7kJ/mol-20,0kJ/mol, a po redukcji wyrazów podobnych otrzymamy:
C
2
H
4
+ H
2
→ C
2
H
6
ΔH
0
=-124,7kJ/mol
29.
Propen CH
3
-CH=CH
2
posiada wiązanie
podwójne C=C w swojej cząsteczce, takiego
wiązania nie posiada propan CH
3
-CH
2
-CH
3
.
Z proponowanych odczynników, z wiązaniem
wielokrotny C=C reaguje tylko silnie
zakwaszony roztwór manganianu(VII)
potasu
. Zawiesina świeżo strąconego Cu(OH)
2
jest odczynnikiem na grupę karbonylową w
aldehydach (po podgrzaniu) lub na alkohole
wielowodorotlenowe. Wodny roztwór FeCl
3
daje
barwny kompleks z fenolami.
Zakwaszony roztwór KMnO
4
(roztwór barwy fioletowej) utlenia alkeny do kwasów karboksylowych, sam redukuje się do
manganu(II), który jest bezbarwny. Roztwór KMnO
4
w żadnym środowisku nie reaguje z alkanami.
Barwa zawartości probówki
Przed
zmieszaniem reagentów
Po
zmieszaniu reagetnów
Probówka I
Fioletowa
Fioletowa
Probówka II
Fioletowa
Bezbarwna (brak barwy)
30.
W reakcji pierwszej benzen reaguje ze stężonym kwasem azotowym(V) i stężonym kwasem siarkowym(VI). Mieszanina tych
kwasów nosi nazwę mieszaniny nitrującej i produktem jest oczywiście nitrobenzen. W kolejnej reakcji jest on redukowany
(uwodorniany, symbol [H] wskazuje na redukcję) do aniliny. Anilina wywodzi się od amoniaku w którym jeden atom wodoru
został zastąpiony grupą fenylową. Ma więc właściwości podobne do amoniaku – właściwości zasadowe. Reaguje z kwasem
solny tworząc sól – chlorek aniliniowy (chlorowodorek aniliny):
NO
2
NH
2
NH
3
Cl
+
-
HNO
3
/H
2
SO
4
[H]
HCl
benzen
nitrobenzen
amilina
chlorek aniliniowy
http://www.chemia.sos.pl
- 8 -
31.
W pierwszej reakcji otrzymujemy z alkanu chloroalkan. Oczywiście alkany są związkami mało reaktywnymi. Jedynymi
reakcjami jakim ulegają to reakcje z chlorem lub bromem na świetle. Ulegają wtedy substytucji rodnikowej. W reakcji III alkohol
2-rzędowy utleniany jest di chromianem(VI). W tych warunkach alkohole utleniają się do ketonów:
CH
3
CH
2
CH
2
CH
3
CH
3
CH
2
CH CH
3
Cl
CH
3
CH
2
CH CH
3
Cl
CH
3
CH
2
CH CH
3
OH
CH
3
CH
2
C CH
3
O
+ Cl
2
+ HCl
h
ν(światło)
butan
2-chlorobutan
NaOH
aq
-NaCl
K
2
Cr
2
O
7
/H
+
butan-2-ol
butanon
-Cr
3+
32.
Izomery są to związki posiadające identyczny wzór cząsteczkowy. Z tego względu związek II nie może być brany pod uwagę
(inny wzór cząsteczkowy). Związek I jest 2-chlorobutanem, a więc również nie może być rozpatrywany. W związku IV
zmienione jest położenie atomu chloru w łańcuchu – mamy do czynienia z izomerią położenia podstawnika (izomeria
położenia), natomiast związek nr III ma zmieniony łańcuch węglowy – izomeria szkieletowa.
Typ izomerii
Nr wzoru
Izomeria szkieletowa
III
Izomeria położenia podstawnia
IV
2-chlorobutan nie posiada wiązania podwójnego C=C, ani pierścienia co jest warunkiem występowania izomerii geometrycznej.
Natomiast drugi atom węgla połączony jest z czterema różnymi podstawnikami – asymetryczny atom węgla, to związek ten
posiada niepokrywane się z nim odbicie lustrzane, występuje w postaci pary enancjomerów:
L.p. Zdanie
P/F
1 2-chlorobutan
występuje w postaci dwóch izomerów geometrycznych cis i trans (Z i E), ponieważ w
jego cząsteczce drugi atom węgla połączony jest z atomem chloru, atomem wodoru i grupą
metylową, a trzeci atom węgla – z dwoma atomami wodoru i grupą metylową.
F
2 2-chlorobutan
występuje w postaci pary enancjomerów, ponieważ w jego cząsteczce istnieje atom
węgla połączony z czterema różnymi podstawnikami.
P
33.
Alkohole 1-rzędowe można łatwo utlenić do kwasu karboksylowego. W alkoholu salicylowym utlenienu uegnie grupa
hydroksymetylowa do grupy karboksylowej:
CH
2
OH
OH
OH
COOH
[O]
W kolejnej reakcji grupa hydroksylowa połączona z pierścieniem ulega estryfikacji. Estryfikację alkoholi można prowadzić
kwasem karboksylowym w środowisku kwaśnym, natomiast fenole estryfikuje się chlorkiem kwasowym lub bezwodnikiem
kwasowym (fenole są zbyt mało reaktywne by można było przeprowadzić estryfikację kwasem):
OH
COOH
CH
3
C
O
O
C
CH
3
O
O
COOH
C
CH
3
O
+
+ CH
3
COOH
34.
„Woski to mieszaniny
estrów
długołańcuchowych kwasów tłuszczowych i długołańcuchowych alkoholi monohydroksylowych
”.
Dlatego woski ulegają hydrolizie do kwasów karboksylowych i alkoholi. Oczywiście w środowisku alkalicznym (w takim
środowisku reakcja hydrolizy nosi nazwę reakcji zmydlania) kwas karboksylowy istnieje w postaci soli:
C
H
3
(CH
2
)
14
C
O
O (CH
2
)
29
CH
3
C
H
3
(CH
2
)
14
C
ONa
O
C
H
3
(CH
2
)
29
OH
+ NaOH
H
2
O
+
http://www.chemia.sos.pl
- 9 -
W sieci krystalicznej cząsteczki muszą być regularnie ułożone. Cząsteczki mające długie łańcuchy węglowodorowe (tłuszcze,
woski) nie mogą być regularnie ułożone w sieci krystalicznej i dlatego nie tworzą kryształów. Związki te są albo cieczami, albo
mają konsystencję plastyczną. Ze względu na swoje długie łańcuchy węglowodorowe i brak grup hydrofilowych (OH, COOH,
COO
-
) związki te nie są hydrofilowe, są hydrofobowe, czyli rozpuszczają się w rozpuszczalnikach organicznych.
35.
„Błony komórkowe składają się głównie z fosfolipidów –
związków zbudowanych z małej, polarnej „głowy” i
dwóch długich, węglowodorowych „ogonów”. W
środowisku wodnym cząsteczki fosfolipidów
samorzutnie układają się w podwójną warstwę
lipidową
”
Z powyższego tekstu i z rysunku ułożenia fosfolipidów
w wodzie wynika, że głowa ma duże powinowactwo
do wody („lgnie do wody”), czyli musi być hydrofilowa
(lubi wodę), natomiast ogony odpychane są od wody,
są hydrofobowe (nie lubi wody) i słabo z nią
oddziaływają.
Wyszukiwarka
Podobne podstrony:
kom odp pp2005m(1)
kom odp pr2006m(1)
kom odp pp2006m(1)
kom odp pr2007m(1)
kom odp pp2007m(1)
ch pp odp 2008 kom(1)
Narzady i kom u imm, antyg i Ab, mech odp swoistej i niesw
odp z bioli kom
wykaz odp egz kom
więcej podobnych podstron