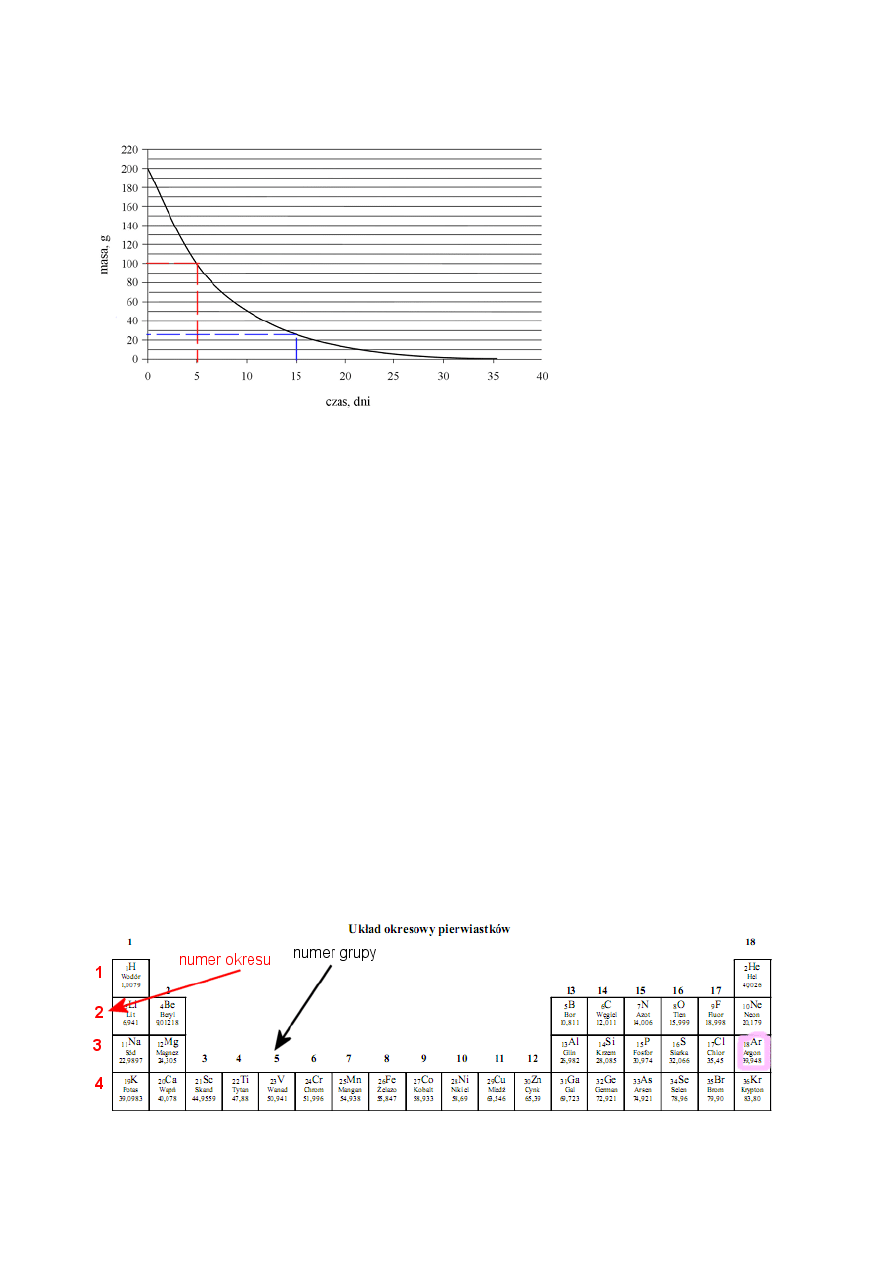
1.
Okres półtrwania to czas po którym masa promieniotwórczego izotopu zmniejszy się o połowę (połowa atomów ulegnie
przemianie promieniotwórczej). W chwili t=0 masa próbki wynosiła 200g. Połowa tej masy, czyli 100g pozostanie po około 5
dniach.
2.
Z wykresu odczytujemy, że po 15 dniach pozostało około 25 g promieniotwórczego izotopu
3.
W zapisie
235 oznacza liczbę masową
,
92 liczbę atomową (porządkową)
. W równaniach reakcji przemian
promieniotwórczych zawsze suma liczby masowej lewej strony musi być równa sumie liczb masowych prawej strony, oraz
suma liczb atomowych lewej strony równania reakcji musi być równa sumie liczb atomowych prawej strony:
92
235
U
235
A
4
92
Z
2
U
X
H
→
+
235
231
4
92
92
2
U
Th
→
+
e
e
, czyli:
235=A+4, A=231
92=Z+2, Z=90
Liczba atomowa 90 (z układu okresowego pierwiastków) wskazuje ,że pierwiastkiem X jest technet Th:
H
4.
Jeżeli pierwiastek tworzy wodorek typu EH
4
, oraz tlenek (na najwyższym stopniu utlenienia) EO
2
, to znaczy, że pierwiastek E
leży w 14 grupie układu okresowego pierwiastków.
Jeżeli w stanie podstawowym elektrony rozmieszczone są na dwóch powłokach, to pierwiastek ten leży w 2 okresie. Z układu
okresowego pierwiastków odnajdujemy, że pierwiastkiem tym jest węgiel C.
Elektrony na dwóch powłokach, czyli K i L. Na powłoce K mogą być 2 elektrony, a na powłoce L muszą być 4 elektrony.
Wskazuje na to typ wodorku EH
4
. Liczba atomów wodoru wskazuje liczbę elektronów walencyjnych brakującą do 8 (jeśli 4
brakuje do 8, to atom musi posiadać 4 elektrony walencyjne).
5.
1) W 13 grupie i w 3 okresie, w układzie okresowym pierwiastków odnajdujemy, że jest to glin, Al
2) Konfigurację argonu (argon leży w 3 okresie układu okresowego) przyjmują jony metali z 4 okresu (K
+
, Ca
2+
), oraz jony
niemetali z 3 okresu (S
2-
, Cl
-
). Jonem tym jest Cl
-
.
http://www.chemia.sos.pl
-1-
3) Po oderwaniu 2 elektronów od atomu powstaje jon z ładunkiem 2+ (atom jest elektrycznie obojętny, a elektron posiada
ładunek -, 0-(-2)=+2). Warunek ten spełnia jedynie jon magnezowy Mg
2+
.
4) Cząstki elkementarne to e, p, n. Neutron jak sama nazwa wskazuje (neutralny) jest elektrycznie obojętny
1
0
n
5) Stan podstawowy K
2
L
8
M
8
N
1
wskazuje, że atom leży w
1
grupie (1 elektron walencyjny), oraz w 4 okresie (4 powłoki).
Atomem tym jest potas K.
6) Wodorki typu H
2
X tworzą pierwiastki z 2 i 16 grupy. Tlenki pierwiastków 2 grupy mają charakter zasadowy (w 2 grupie
układu okresowego znajdują się metale), natomiast w grupie 16 znajdują się niemetale i chi tlenki mają charakter kwasowy.
Pierwiastkiem tym jest siarka S.
6.
Jeżeli różnica elektroujemności pomiędzy pierwiastkami jest
Δ>1,7 to tworzy się wiązanie jonowe. W przeciwnym przypadku
tworzą się wiązania kowalencyjne, bardziej lub mniej spolaryzowane.
RbCl Rb Cl
0,8
3
wiązanie jonowe
Δ=2,2
CO
2
C
O
2,5
3,5
kowalencyjne
spolaryzowane
Δ=1
PH
3
P H
2,1
2,1
kowalencyjne
Δ=0
7.
Magnez z parą wodną reaguje gwałtownie (magnez jest reaktywnym metalem) i powstaje wodorotlenek magnezu:
Mg + 2H
2
O → Mg(OH)
2
+ H
2
Wodorotlenek magnezu ma charakter zasadowy (reaguje z kwasami)
8.
Palący się magnez wytwarza bardzo duże ilości ciepła i reaguje z wodą:
Mg + 2H
2
O → Mg(OH)
2
+ H
2
Czyli magnez nadal będzie się palił, nawet w wodzie. Dodatkowo wydzielający się wodór z powietrzem tworzy mieszaninę o
silnych właściwościach wybuchowych.
9.
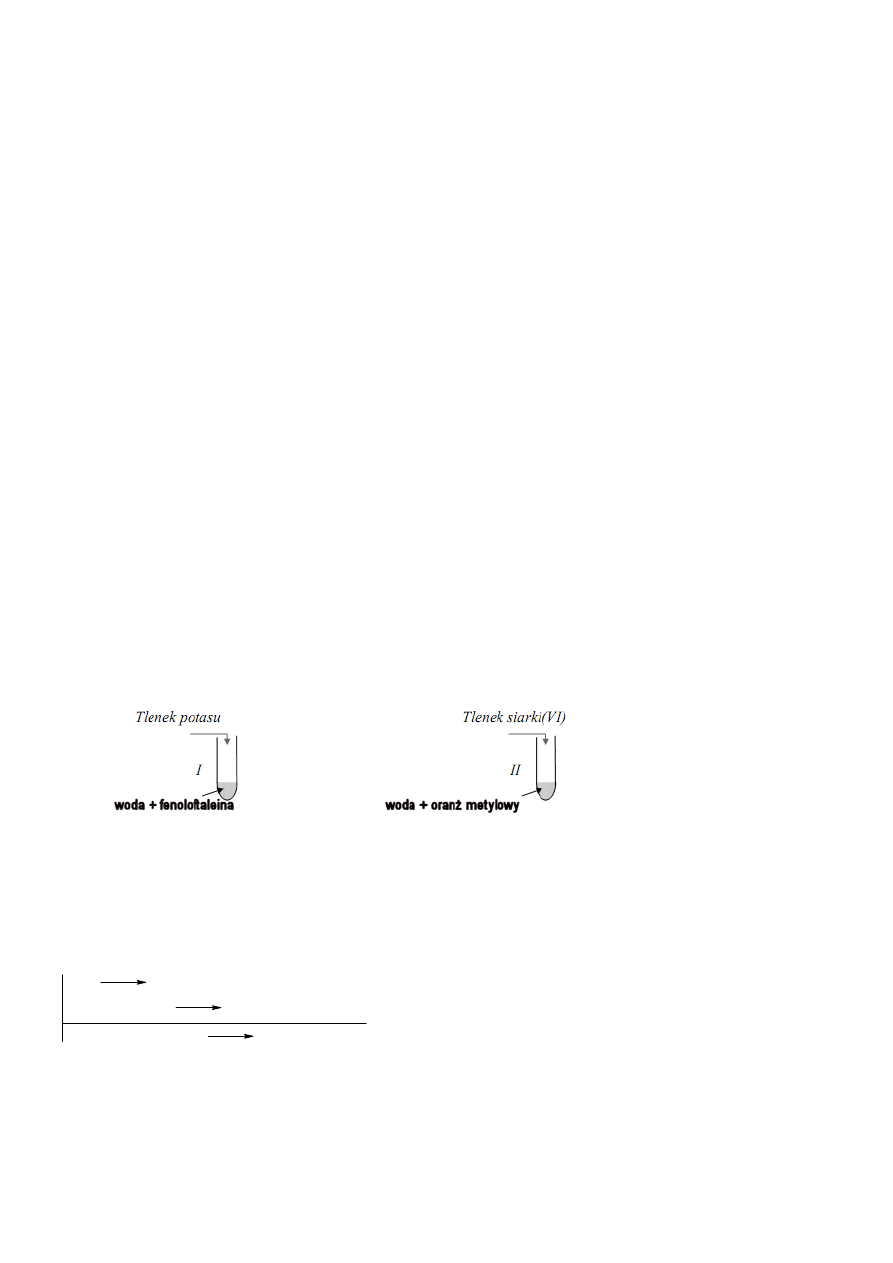
Tlenek potasu jest tlenkiem metalu i w reakcji z wodą tworzy wodorotlenek potasu. Roztwory KOH barwią fenoloftaleinę na
malinowo.
a)
b)
I zawartość probówki I zabarwiła się na malinowo
II zawartość probówki II zabarwiła się na czerwono
c)
I K
2
O + H
2
O → 2KOH
II SO
2
+ H
2
O → H
2
SO
4
10.
CuS + HNO
3
→ Cu(NO
3
)
2
+ S + NO + H
2
O
CuS
Cu
2+
+ S + 2e
NO
3
-
+ 4H
+
+ 3e
NO + 2H
2
O
3
2
3CuS + 2NO
3
-
+ 8H
+
3Cu
2+
+ 3S + 2NO + 4H
2
O
Jony wodorowe mogą pochodzić jedynie od kwasu azotowego(V):
3CuS + 8HNO
3
→ 3Cu(NO
3
)
2
+ 3S + 2NO + 4H
2
O
http://www.chemia.sos.pl
-2-

11.
M
n
C
V
=
Stężenie molowe liczone jest ze wzoru
, czyli n=C
M
V. Z równania reakcji:
Ca(OH)
2
+ 2HCl → CaCl
2
+ 2H
2
O
Wynika, że potrzebujemy dwukrotnie większą ilość moli kwasu od ilości moli wodorotlenku wapnia.
W 100cm
3
(0,1dm
3
) 0,2M roztworu Ca(OH)
2
znajduje się n=C
M
V=0,1dm
3.
0,2mol/dm
3
=0,02mol wodorotlenku wapnia. Na jego
zobojętnienie potrzebujemy 0,04mol chlorowodoru. Ta ilość chlorowodoru znajduje się w
3
3
dm
M
n
0,04mol
V
C
0,5,
0,08
ol / dm
=
=
=
12.
I. W reakcji Na
2
CO
3
+ 2HNO
3
→ 2NaNO
3
+ CO
2
+ H
2
O wydziela się tlenek węgla(IV), CO
2
, gaz bez zapachu.
II. W reakcji CaC
2
+ 2H
2
O → Ca(OH)
2
+ C
2
H
2
wydziela się etyn (acetylen), gaz o charakterystycznym zapachu, ale nie o
przykrym.
III. W reakcji K
2
S + 2HCl → 2KCl + H
2
S wydziela się siarkowodór, silnie trujący gaz, o przykrym zapachu (zgniłych jaj)
IV W tej rakcji wydziela się wodór, gaz bez zapachu: 2Na + 2H
2
O → 2NaOH + H
2
13.
1. Kwaśne deszcze pochodzą od tlenków siarki i azotu w powietrzu. Tlenki te z wodą tworzą kwasy:
SO
2
+ H
2
O → H
2
SO
4
2NO
2
+ H
2
O → HNO
2
+ HNO
3
Powstałe kwasy siarkowy(IV) i azotowy(III) mogą być również utleniane do mocnych kwasów siarkowego(VI) i azotowego(V)
2. Eutrofizację wody powoduje nadmiar fosforu(V) (w postaci fosforanów) w wodzie. Przy nadmiarze jonów fosforanowych(V)
następuje zachwiany stosunek N:P.
3. Efekt cieplarniany powoduje CO
2
(tlenek węgla(IV), oraz metan.
14.
I. Dodanie do wody zawierającej jony Cl
-
i SO
4
2-
jonów Ag
+
powodujemy wytrącenie się trudnorozpuszczalnej soli AgCl (zobacz
tablice rozpuszczalności), potwierdzamy obecność jonów chlorkowych Cl
-
. Ag
+
+ Cl
-
→ AgCl
II Jony Ba
2+
powodują wytrącenie się BaSO
4
, potwierdzamy obecność jonów siarczanowych(VI) SO
4
2-
. Ba
2+
+ SO
4
2-
→ BaSO
4
.
III Jony CO
3
2-
powodują wytrącenie się CaCO
3
, potwierdzamy obecność jonów wapnia Ca
2+
. Ca
2+
+ CO
3
2-
→ CaCO
3
15.
Z równania reakcji:
2
NaOH +
1
H
2
SO
4
→ Na
2
SO
4
+ 2H
2
O widzimy, że: (w równaniu reakcji współczynnik stechiometryczny lub indeks
stechiometryczny równy 1 pomija się, ale to nie znaczy, że on nie istnieje, podobnie jak w równaniach matematycznych x+ 4=5,
przed x jest 1, której po prostu się nie zapisuje)
2
mole wodorotlenku sodu reagują z
1
molem kwasu siarkowego(VI), czyli stosunek molowy n
NaOH
:n
H2SO4
=
2:1
2 mole NaOH, to n=m/M m=nM=2mol
.
40g/mol=80g. 1mol H
2
SO
4
to m=M=98g. Stosunek masowy wodorotlenku do kwasu
m
NaOH
:m
H2SO4
=
80:98
.
16.
Forma cząsteczkowa równania reakcji, oznacza że w równaniu reakcji reagenty i produkty występują w postaci cząsteczek:
I. Na
2
O + 2HNO
3
→ 2NaNO
3
+ H
2
O (powstaje azotan(V) sodu)
II. SO
3
+ 2KOH → K
2
SO
4
+ H
2
O (powstaje siarczan(VI) potasu,
lub gdy wprowadzimy nadmiar tlenku siarki(VI): SO
3
+ KOH → KHSO
4
(powstaje wodorosiarczan(VI) potasu
III. LiOH + HCl → LiCl + H
2
O (powstaje chlorek litu)
17.
2,2,4-
tri
metylo
pent
an
oznacza, że mamy do czynienia z węglowodorem nasyconym (an), składającym się z 5 atomów węgla
(pent), przy 2, 2 i 4 atomie węgla znajdują się 3 (tri) grupy metylowe (metylo):
CH
3
C CH
2
CH CH
3
CH
3
CH
3
CH
3
1
2
3
4
5
18.
1. Wzór ogólny alkenów to C
n
H
2n
– prawda
2. Związki o takim samym wzorze cząsteczkowym są izomerami - prawda
3. Węglowodory różniące się o grupę CH
2
lub jej wielokrotność należą do tego samego szeregu homologicznego.
Węglowodory C
3
H
8
i C
4
H
8
nie różnią się o grupę CH
2
, nie należą do tego samego szeregu homologicznego – fałsz
4. Węglowodory łańcuchowe z jednym wiązaniem podwójnym nazywane są alkenami. Ich wzór ogólny to C
n
H
2n
. C
6
H
10
nie
spełnia tej zależności, nie może zawierać więc jednego wiązania podwójnego – fałsz
http://www.chemia.sos.pl
-3-
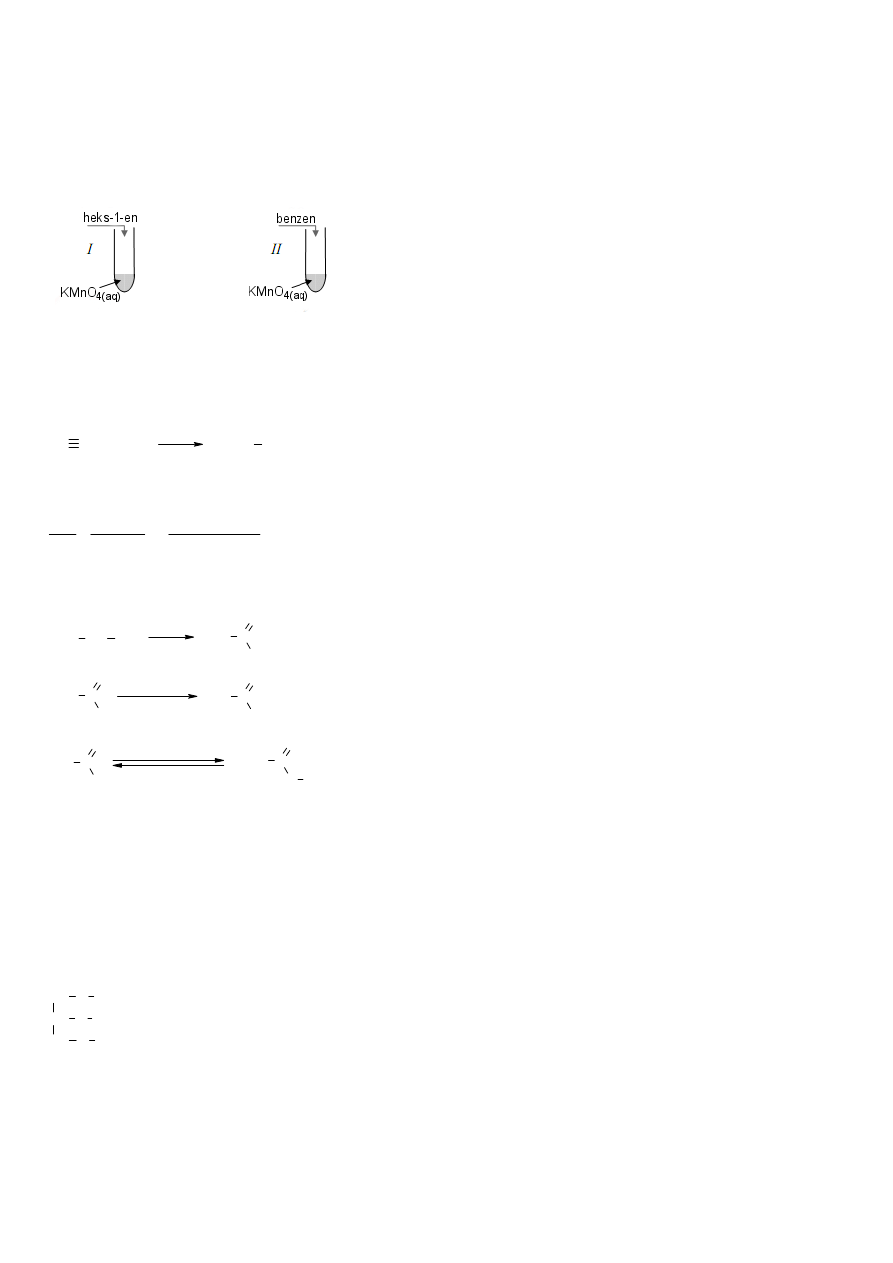
19.
Heks-1-en należy do węglowodorów nienasyconych. Wiązanie podwójne łatwo utleniane jest roztworem manganianu(VII)
potasu:
3CH
2
=CH-CH
2
CH
2
CH
2
CH
3
+ 2KMnO
4
+ 4H
2
O→ 3HOCH
2
CH(OH)CH
2
CH
2
CH
2
CH
3
+ 2MnO
2
+ 2KOH
Benzen jest związkiem aromatycznym, biernym wobec roztworu manganianu(VII) potasu:
C
6
H
6
+ KMnO
4
→ reakcja nie zachodzi.
Opis doświadczenia: Do roztworu KMnO
4
w probówce dodano kilka kropli heks-1-enu. Do roztworu KMnO
4
w drugiej
probówce dodano kilka kropel benzenu.
Obserwacje: W probówce zawierającej heks-1-en roztwór manganianu(VII) potasu uległ odbarwieniu. Wytrącił się brunatny
osad.
W probówce zawierającej benzen nie zaobserwowano żadnych zmian.
20.
Etyn ulega uwodornieniu zgodnie z równaniem reakcji:
C
H
CH
C
H
3
CH
3
+ 2H
2
kat, T
Zgodnie z równaniem reakcji do uwodornienia
1 mola (26g) acetylenu potrzeba 2 mole (44,8dm
3
) wodoru, to do uwodornienia
6,5g acetylenu potrzeba x dm
3
wodoru, czyli:
3
3
3
26g
44,8dm
6,5g 44,8dm
x
6,5g
x
26
11,2dm
g
×
=
=
=
21.
Równania reakcji są już zapisane. Wystarczy pamiętać, że atom węgla jest zawsze 4-wiązalny:
C
H
3
CH
2
OH
C
H
3
C
H
O
C
H
3
C
H
O
C
H
3
C
OH
O
C
H
3
C
OH
O
C
H
3
C
O
O
CH
2
CH
3
CuO
-Cu
Ag
2
O/NH
3
-Ag
CH
3
CH
2
OH/H
2
SO
4
-H
2
O
22.
Mydło jest solą sodową wyższych kwasów tłuszczowych (kwasów zawierających co najmniej 4 atomy węgla w cząsteczce).
Parafina i stearyna są węglowodorami, natomiast tłuszcz roślinny i zwierzęcy są estrami wyższych kwasów tłuszczowych i
gliceryny. Tłuszcze te z NaOH ulegają reakcji hydrolizy (zmydlania). Produktami są sole sodowe wyższych kwasów
tłuszczowych (mydła) i gliceryna. Mydła powstają w probówkach nr I i II.
23.
Jeżeli woda bromowa odbarwiła się, oznacza to, że w cząsteczce tłuszczu znajdowało się wiązanie podwójne (przynajmniej
jedno). Tłuszcze można opisać ogólnym wzorem:
CH
2
CH
O
O
CH
2
O
CO-R
CO-R
CO-R
Gdzie R oznacza rodnik alkilowy powstały z węglowodoru przez oderwanie jednego atomu wodoru.
Gdy rodnik pochodzi od alkanu (jest nasycony) jego wzór ogólny C
n
H
2n+1
, gdy zawiera wiązanie
podwójne: C
n
H
2n-1
, gdy obecne są dwa wiązania podwójne: C
n
H
2n-3
.
W probowce A R=C
17
H
35
– brak wiązań podwójnych – woda bromowa nie odbarwia się
W probówce B R=C
15
H
31
– brak wiązań podójnych - – woda bromowa nie odbarwia się
W probówce C znajduje się rodnik R=C
17
H
31
– jedno wiązanie podwójne – woda bromowa odbarwi się
W probówce D wszystkie rodniki są nasycone - – woda bromowa nie odbarwia się
http://www.chemia.sos.pl
-4-

24.
W białkach wiązanie łączące dwa aminokwasy nazywa się wiązaniem peptydowym. Wiązanie to łączy grupę aminową jednego
aminokwasu z grupą karbonylową drugiego aminokwasu. W przytoczonym przykładzie:
O
N
H
N
H
2
NH
2
O
wiązanie peptydowe
25.
W reakcji tej łączą się dwie mniejsze cząsteczki, z wydzieleniem innej, prostej cząsteczki (NH
3
). Zgodnie z definicją jest to
reakcja kondensacji (reakcja polimeryzacji jest reakcją podobnego typu, lecz nie wydziela się w tej reakcji inna, prosta
cząsteczka).
- 5 -
http://www.chemia.sos.pl
-5-
Document Outline
Wyszukiwarka
Podobne podstrony:
kom odp pp2005m(1)
kom odp pr2006m(1)
kom odp pp2006m(1)
kom odp pr2007m(1)
kom odp pr2008(1)
ch pp odp 2008 kom(1)
Narzady i kom u imm, antyg i Ab, mech odp swoistej i niesw
odp z bioli kom
wykaz odp egz kom
CW 7 odp swoista kom cz 1
Biol kom cz 1
więcej podobnych podstron