http://www.chemia.sos.pl
- 1 -
28.
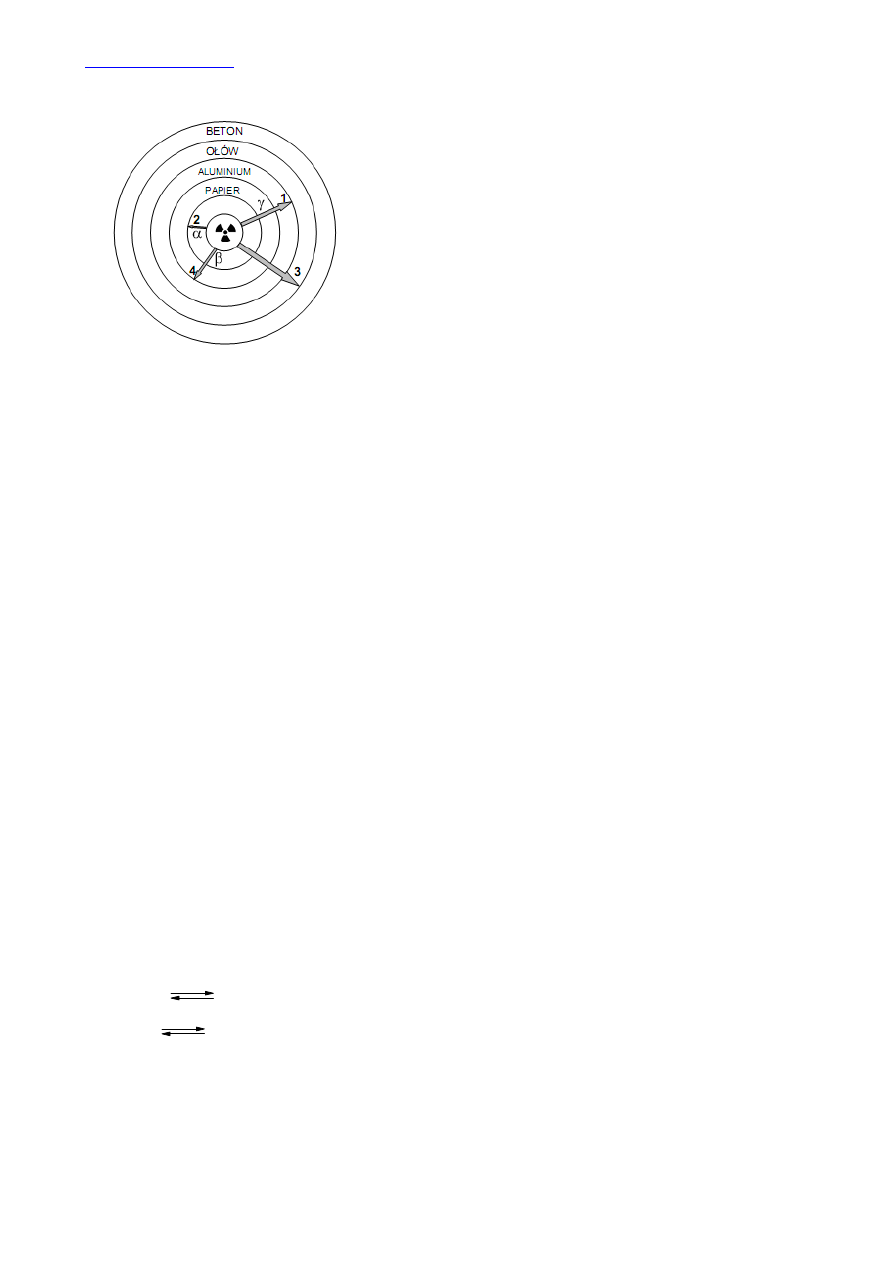
Promieniowanie
α czyli jądra helu
4
2
He obdarzone są ładunkiem +2 i mają
masę 4u. Ze względu na swój duży ładunek charakteryzują się małą
przenikalnością. Zatrzymuje je nawet kartka papieru.
Promieniwanie
β - czyli elektrony mają ładunek (-1). Mniejszy ładunek
powoduje, że są nieco bardziej przenikliwe. Zatrzymuje je dopiero folia
aluminiowa.
Promieniowanie
γ - promieniowanie elektromagnetyczne jest bardziej
przenikliwe od promieniowania
α i β, ale mniej przenikliwe od
promieniowania neutronowego.
29.
Okres półtrwania izotopu (czas połowicznego rozpadu),
τ, to czas po którym połowa promieniotwórczego izotopu ulegnie
rozpadowi. Jeżeli dla
14
C czas połowicznego rozpadu
τ=5730 lat, to po tym czasie zawartość izotopu
14
C zmalała dwukrotnie.
Po kolejnych 5730 latach (w sumie po 11460 latach) zawartość promieniotwórczego izotopu węgla zmalała ponownie
dwukrotnie, czyli w sumie
4 krotnie
.
Całość możemy zapisać w postaci szeregu:
t=0 masa m
0
1
τ masa 1/2m
0
2
τ masa 1/2(1/2m
0
)=2
-2
m
0
3
τ masa 1/2(1/2(1/2m
0
))=2
-3
m
0
n
τ masa 2
-n
m
0
t=11460lat,
τ=5730lat. n=t/τ=2, m=2
-2
m
0
=1/4m
0
30.
a) Sole, sacharoza i etanol dobrze rozpuszczają się w wodzie tworząc roztwory właściwe. Natomiast białko jaja kurzego nie
rozpuszcza się w wodzie. Białko zbudowane jest z tysięcy aminokwasów połączonych ze sobą wiązaniem peptydowym,
dlatego nie rozpuszcza się w wodzie lecz tworzy roztwór koloidalny. W roztworach koloidalnych cząsteczki w rozpuszczalniku
mają rozmiar od 1 do 200nm, natomiast w roztworach właściwych poniżej 1nm.
b) Aby wydzielić substancję z roztworu właściwego należy odparować rozpuszczalnik.
31.
W przypadku metali istnieje zasada, że tlenki metali na najwyższym stopniu utlenienia mają charakter kwasowy, na najniższym
stopniu utlenienia charakter zasadowy, natomiast na pośrednim charakter amfoteryczny. Podobna zasada obowiązuje w
przypadku wodorotlenków. Wodorotlenki metali na najniższym stopniu utlenienia mają charakter zasadowy, natomiast na
pośrednim stopniu utlenienia charakter amfoteryczny. Z dwóch wodorotlenków Cr(OH)
2
i Cr(OH)
3
wodorotlenek chromu(III) ma
charakter amfoteryczny, czyli reaguje zarówno z mocnymi kwasami jak i z mocnymi zasadami:
Cr(OH)
3
+ 3H
+
→ Cr
3+
+ 3H
2
O
Cr(OH)
3
+ OH
-
→ [Cr(OH)
4
]
-
Sprawdzenie równania jonowego polega na policzeniu ładunku lewej i prawej strony. Suma ładunków lewej i prawej strony
równania reakcji musi być równa.
32.
Sole słabych kwasów i mocnych zasad, słabych zasad i mocnych kwasów, oraz słabych kwasów i słabych kwasów ulegają w
wodzie reakcji hydrolizy. Odczyn roztworu pochodzi od składnika „mocnego”.
I ZnCl
2
– sól słabej zasady i mocnego kwasu. Odczyn wodnego roztworu jest kwaśny:
Zn
2+
+ 2H
2
O
Zn(OH)
2
+ 2H
+
II Na
2
S – sól słabego kwasu i mocnej zasady – odczyn alkaliczny
S
2-
+ 2H
2
O
H
2
S + 2OH
-
Reakcje hydrolizy są reakcjami odwracalnymi.
http://www.chemia.sos.pl
- 2 -
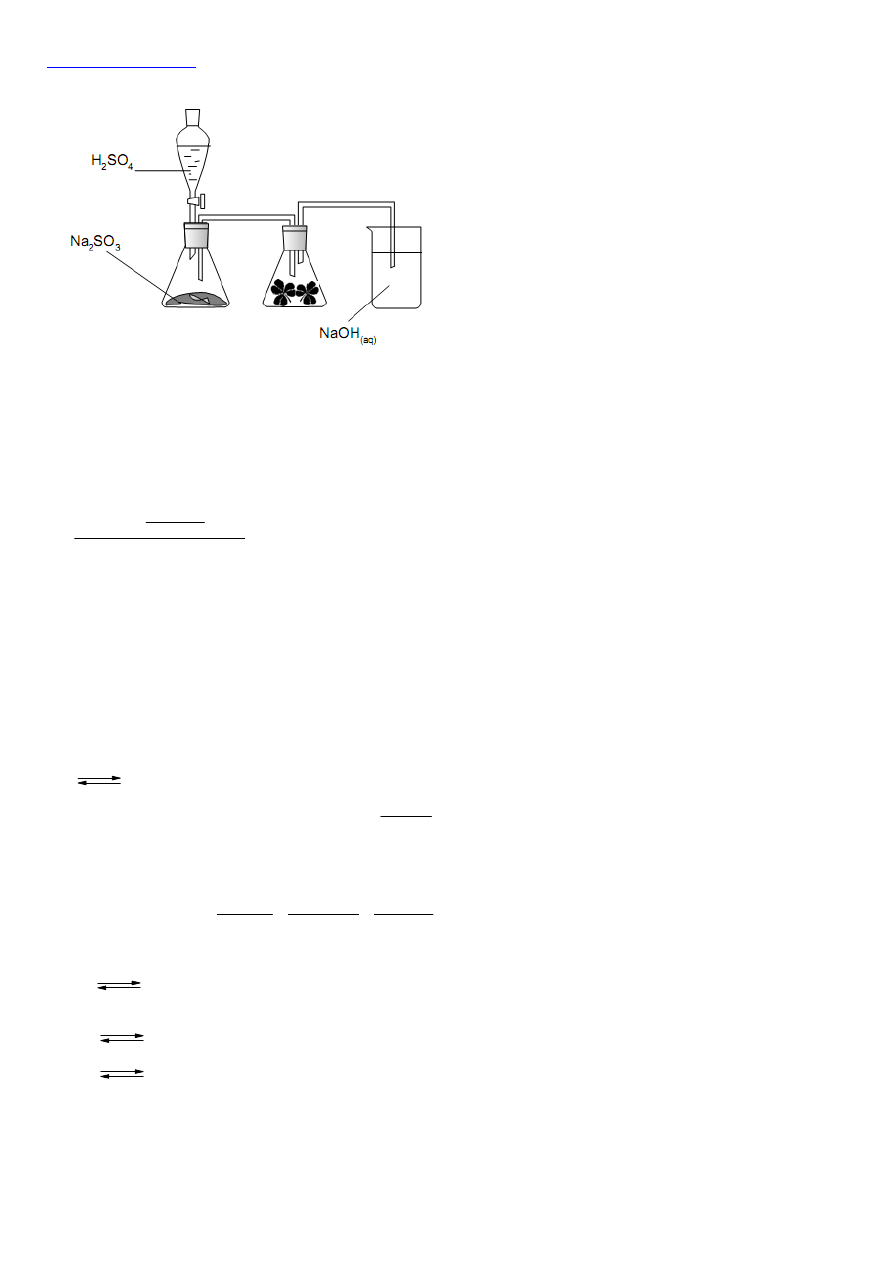
33.
Kwas siarkowy(VI) jest mocnym kwasem, natomiast
siarczan(IV) sodu jest solą słabego kwasu, a więc mocny
kwas wypiera słaby kwas z jego soli:
Na
2
SO
3
+ H
2
SO
4
→ Na
2
SO
4
+ [H
2
SO
3
]
Powstający kwas siarkowy(IV) jest nietrwały i rozkłada się
na tlenek siarki(IV) i wodę:
H
2
SO
3
→ H
2
O + SO
2
Reakcje te można zapisać w jednym schemacie:
Na
2
SO
3
+ H
2
SO
4
→ Na
2
SO
4
+ H
2
O + SO
2
34.
Wydzielony tlenek siarki(IV) pochłaniany jest w roztworze NaOH. W zlewce zachodzi reakcja:
SO
2
+ 2NaOH → Na
2
SO
3
Zgodnie z równaniem reakcji
1mol SO
2
reaguje z 2 molami NaOH, to
x moli SO
2
przereaguje z 3 molami NaOH, czyli x=
1,5mol
. Wykorzystując równanie stanu gazu doskonałego (równanie
Clapeyrona) PV=nRT otrzymamy: V=nRT/P. Podstawiając dane do wzoru otrzymamy:
3
3
hPa dm
1,5mol 83,1
298K
mol K
V
1013hPa
36,67dm
⋅
⋅
⋅
⋅
=
=
35.
pH definiowanie jest jako pH=-log[H
+
]. Podstawiając dane do wzoru otrzymamy: pH=-log(0,00001)=
5
.
Z tabeli można odczytać, że przy tym pH opady deszczowe zaliczane są do opadów o lekko obniżonym pH.
36.
Zainstalowanie urządzeń do odsiarczania gazów kominowych spowoduje, że spalinach znajdzie się mniej tlenku siarki(IV),
związku odpowiedzialnego za kwaśne deszcze. Stężenie jonów wodorowych w opadach deszczowych zmniejszy się, a
wykładnik stężenia jonów wodorowych (pH) zwiększy się i opady będą klasyfikowane pod względem odczynu jako normalne.
37.
Jeżeli jest to kwas jednoprotonowy to jego dysocjację możemy opisać równaniem reakcji:
HR
H
+
+ R
-
(przez R oznaczono resztę kwasową)
Stała dysocjacji tego kwasu opisana jest wzorem:
a
[H ][R ]
K
[HR]
+
−
=
. Z równania reakcji dysocjacji widzimy, że [H
+
]=[R
-
]. Stężenie
jonów wodorowych możemy obliczyć z wartości pH. pH=-log[H
+
], czyli [H
+
]=10
-pH
=
10
-4
mol/dm
3
. Stężenie kwasu będącego w
równowadze równe jest stężeniu początkowemu pomniejszonemu o stężenie kwasu, który uległ dysocjacji. Ponieważ stężenie
kwasu, który uległ dysocjacji równe jest stężeniu powstałych jonów, to [HR]=C
0
-[H
+
]. Podstawiając dane do wzoru na stałą
dysocjacji otrzymamy:
2
4 2
4 2
4
0
7
a
[H ]
(1 10
)
(1 10
)
K
0,1
C
[H ]
0,1
1 10
1 10
+
−
−
−
+
−
⋅
⋅
=
=
=
⋅
≈
−
− ⋅
38.
Stałe dysocjacji dla kwasu ortofosforowego(V):
H
3
PO
4
H
2
PO
4
-
+ H
+
K
a1
=7,1
.
10
-3
oznacza, że tylko niewielka część kwasu ortofosforowego(V) dysocjuje z
utworzeniem jonów wodorowych i jonów diwodoroortofosforanowych(V).
W kolejnym stopniu dysocjacji:
H
2
PO
4
-
HPO
4
2-
+ H
+
K
a2
=6,3
.
10
-8
wytwarzane są ponownie jony wodorowe i jony wodoroortofosforanowe(V).
W trzecim stopniu dysocjacji:
HPO
4
2-
PO
4
3-
+ H
+
K
a3
=4,4
.
10
-13
wytwarzane są bardzo niewielkie ilości jonów wodorowych i jonów
ortofosforanowych(V)
a) jony wodorowe H
+
powstają w każdym stopniu dysocjacji i ich stężenie będzie największe.
b) jony fosforanowe(V), PO
4
3-
, powstają tylko w trzecim stopniu dysocjacji i ich stężenie będzie najmniejsze.
39.
http://www.chemia.sos.pl
- 3 -
Jon diwodoroortofosforanowy, H
2
PO
4
-
w 2 równaniu reakcji odłącza jon wodorowy, jest donorem jonu wodorowego. Wg teorii
Brønsteda jest więc kwasem.
40.
Ortofosforan(V) wapnia przekształcany jest w diwodoroortofosforan(V) wapnia:
Ca
3
(PO
4
)
2
→ Ca(H
2
PO
4
)
2
Ze schematu reakcji widzimy, że w diwodoroortofosforanie(V) wapnia znajduje się większa ilość reszt kwasowych, niż w
ortofosforanie(V) wapnia, dodatkowo znajdują się w nim atomy wodoru. Musimy więc dodać do ortofosforanu(V) wapnia reszty
kwasowe i atomy wodoru. Najprościej to zrobić dodając kwas ortofosforowy(V):
Ca
3
(PO
4
)
2
+ 4H
3
PO
4
→ 3Ca(H
2
PO
4
)
2
41.
I
N
2(g)
+ O
2(g)
2NO
(g)
ΔH=182,5kJ
II
2NO
(g)
+ O
2(g)
2NO
2(g)
ΔH=-114,1kJ
a) reakcja I jest reakcją endotermiczną, czyli przebiega z pochłonięciem energii na sposób ciepła (wskazuje na to dodatnia
wartość entalpii reakcji). Zgodnie z regułą Le Chatliera Brauna (regułą przekory), wzrost temperatury układu spowoduje takie
przesunięcie stanu równowagi by przeciwdziałać wzrostowi temperatury. Oznacza to, że stan równowagi układu zostanie
przesunięty w prawo, w kierunku tworzenia produktów. Takie przesunięcie stanu równowagi spowoduje, że układ „zrobi nam
na złość” i reakcja będzie przebiegała w takim kierunku by temperatura układu zmalała. Ilość produktu wzrośnie.
b) Reakcja II przebiega ze zmniejszeniem objętości (współczynniki reakcji 3 → 2), czyli reakcja przebiega ze zmniejszeniem
ciśnienia. Wzrost ciśnienia spowoduje zgodnie z reguła przekory taki przebieg reakcji by przeciwdziałać bodźcowi reakcji
(wzrostowi ciśnienia), czyli reakcja przebiegnie w kierunku tworzenia tlenku azotu(IV) - w prawo, czyli ilość produktu
wzrośnie.
42.
Mając reakcje termochemiczne:
I
N
2(g)
+ O
2(g)
2NO
(g)
ΔH=182,5kJ
II
2NO
(g)
+ O
2(g)
2NO
2(g)
ΔH=-114,1kJ
i reakcję dla której mamy obliczyć entalpię:
III
N
2(g)
+ 2O
2(g)
2NO
2(g)
ΔH=?
Równania reakcji traktujemy jak równania matematyczne, czyli reakcje I i II tak przekształcamy (doajemy do siebie, mnożymy
stronami przez dowolną liczbę), by otrzymać reakcję III.
Zauważmy, że w reakcji III tlen i azot znajdują się po lewej stronie, tak jak w reakcji I, oraz tlenek azotu(IV) w reakcji III znajduje
się po prawej stronie, tak jak w reakcji II. Wystarczy więc stronami dodać do siebie reakcję I i II:
N
2(g)
+
O
2(g)
+ 2NO
(g)
+
O
2(g)
2NO
(g)
+ 2NO
2(g)
ΔH=182,5kJ+(-114,1kJ)
po zredukowaniu wyrazów podobnych otrzymamy:
N
2(g)
+ 2O
2(g)
2NO
2(g)
ΔH=68,4kJ
43.
Zgodnie z opisem, reakcja przebiega zgodnie z równaniem reakcji:
KMnO
4
+ HCl → MnCl
2
+ Cl
2
+ KCl + H
2
O
Widzimy, że mangan w manganianie(VII) potasu, KMnO
4
, jest na +VII stopniu utlenienia, a w chlorku manganu(II) na +II
stopniu utlenienia. Zmniejszył on swój stopień utlenienia, jest więc utleniaczem.
Chlor w chlorowodorze jest na –I stopniu utlenienia, a w chlorze na 0 stopniu utlenienia. Chlorowodór HCl, utlenił się, czyli
zredukował mangan w manganianie(VII) potasu. Jest więc reduktorem.
Reakcję zbilansujemy za pomocą bilansu elektronowego równań połówkowych:
MnO
4
-
+ 8H
+
+ 5e
Mn
2+
+ 4H
2
O
2Cl
-
Cl
2
+ 2e
2
5
2MnO
4
-
+ 16H
+
+ 10Cl
-
2Mn
2+
+ 8H
2
O + 5Cl
2
16 jonów wodorowych musi pochodzić od kwasu solnego. Możemy więc zapisać:
2KMnO
4
+ 16HCl → 2MnCl
2
+ 5Cl
2
+ 2KCl + 8H
2
O
44.
W solach kwasów tlenowych, reszta kwasowa ma bardzo duży potencjał utlenienia. Zamiast reszty kwasowej utlenieniu ulega
woda (tlen zawarty w wodzie utlenia się do tlenu cząsteczkowego). Redukcja kationu do metalu zachodzi tylko wtedy, gdy
kation pochodzi od metalu znajdującego się w szeregu aktywności metali za cynkiem (na elektrodzie grafitowej). Dlatego jon
sodowy nie będzie w tych warunkach redukowany. Redukcji ulegnie wodór zawarty w wodzie:
Reakcja na anodzie: 2H
2
O → 4H
+
+ O
2
+ 4e
Reakcja na katodzie: 4H
2
O + 4e → 2H
2
+4OH
-
http://www.chemia.sos.pl
- 4 -
Zauważmy, że na anodzie zawsze zachodzi reakcja utleniania (podczas elektrolizy jak i w ogniwie). Ładunek lewej i prawej
strony każdej reakcji elektrodowej musi być sobie równy. Reakcje dobrze jest zapisywać w taki sposób, by ilości pobranych i
oddanych elektronów były sobie równe. Wtedy od razu widać stosunek molowy wydzielanych produktów.
45.
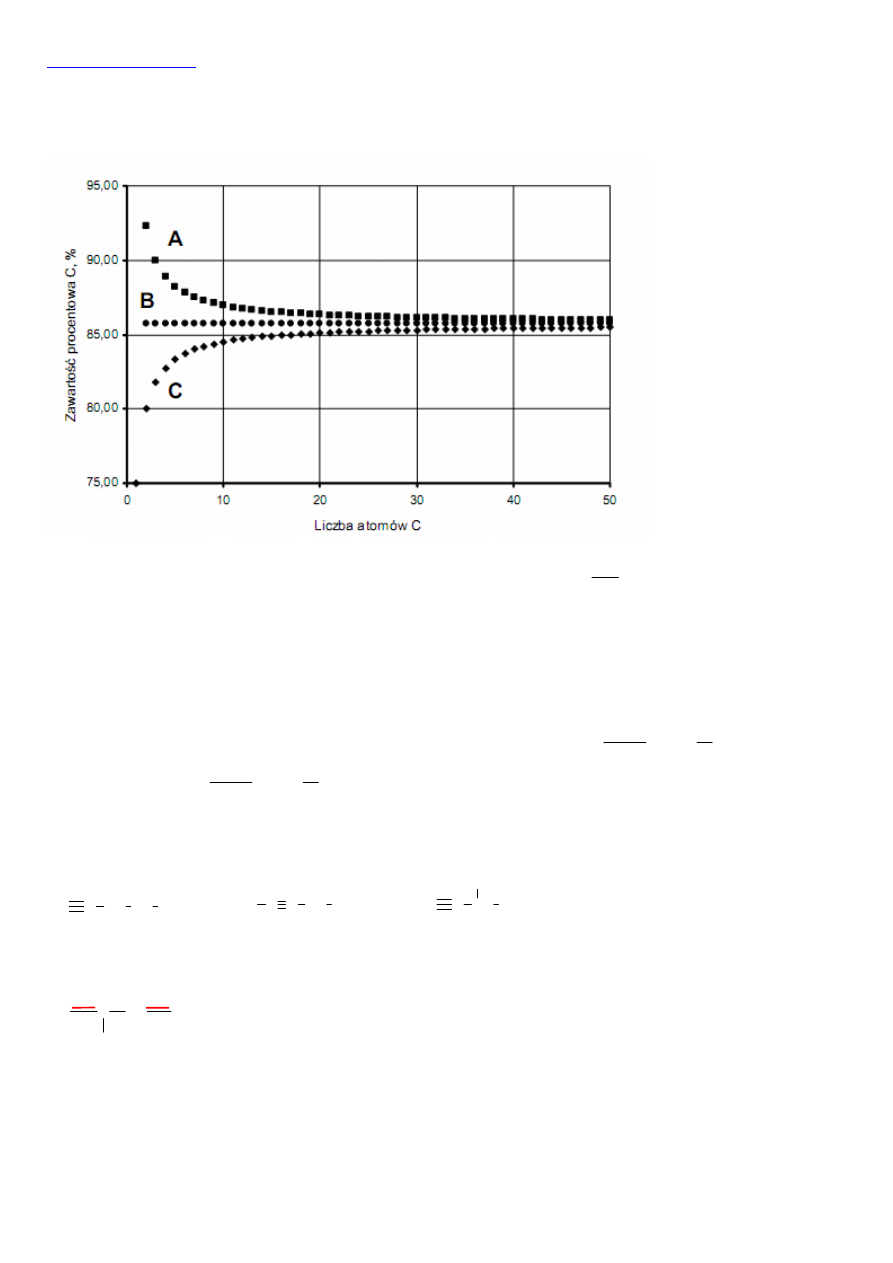
Zawartość procentową pierwiastka w związku wylicza się ze wzoru na stężenie procentowe, w którym masę substancji traktuje
się jako masę pierwiastka, a masę roztworu jako masę cząsteczkową związku:
p
cz
nM
c% 100%
M
=
. W przypadku alkanu wzór
ogólny C
n
H
2n+2
, zawartość procentowa węgla: c
C
%=100%
.
12n/(14n+2). Dla n=2 otrzymamy 80%. Odpowiada to krzywej C.
W przypadku alkenu C
n
H
2n
zawartość procentowa węgla c
C
%=100%
.
12n/14n. Dla n=2 otrzymamy 85,7%. Odpowiada to
krzywej B na wykresie. Więc krzywa A opisuje zawartość węgla w alkinach.
46.
Zawartość procentowa węgla w alkenach nie zależy od ilości atomów węgla w cząsteczce, ponieważ
c
C
%=100%
.
12n/14n=100%
.
12/14=
85,7%.
Dla alkanów gdy n→∞ , zawartość procentową węgla obliczymy ze wzoru:
C
n
12n
12
c %
lim 100%
100%
14n 2
14
85,7%
→∞
=
=
=
+
, a dla
alkinów:
C
n
12n
12
c %
lim 100%
100%
14n 2
14
85,7%
→∞
=
=
=
−
47.
Alkin, końcówka –in (-yn) wskazuje, że mamy do czynienia z węglowodorem, w którym znajduje się wiązanie potrójne C-C.
Węglowodór zawiera 5 atomów węgla:
C
H
C CH
2
CH
2
CH
3
C
H
3
C C CH
2
CH
3
C
H
C CH CH
3
CH
3
pent-1-yn
pent-2-yn
3-metylobut-1-yn
48.
Każde wiązanie pojedyncze jest wiązaniem typu
σ, natomiast wiązanie podwójne składa się z wiązania typu σ i typu π:
CH
2
C
CH
3
CH
CH
2
Widzimy, że w cząsteczce znajdują się 4 wiązania typu
σ, oraz 2 wiązania typu π.
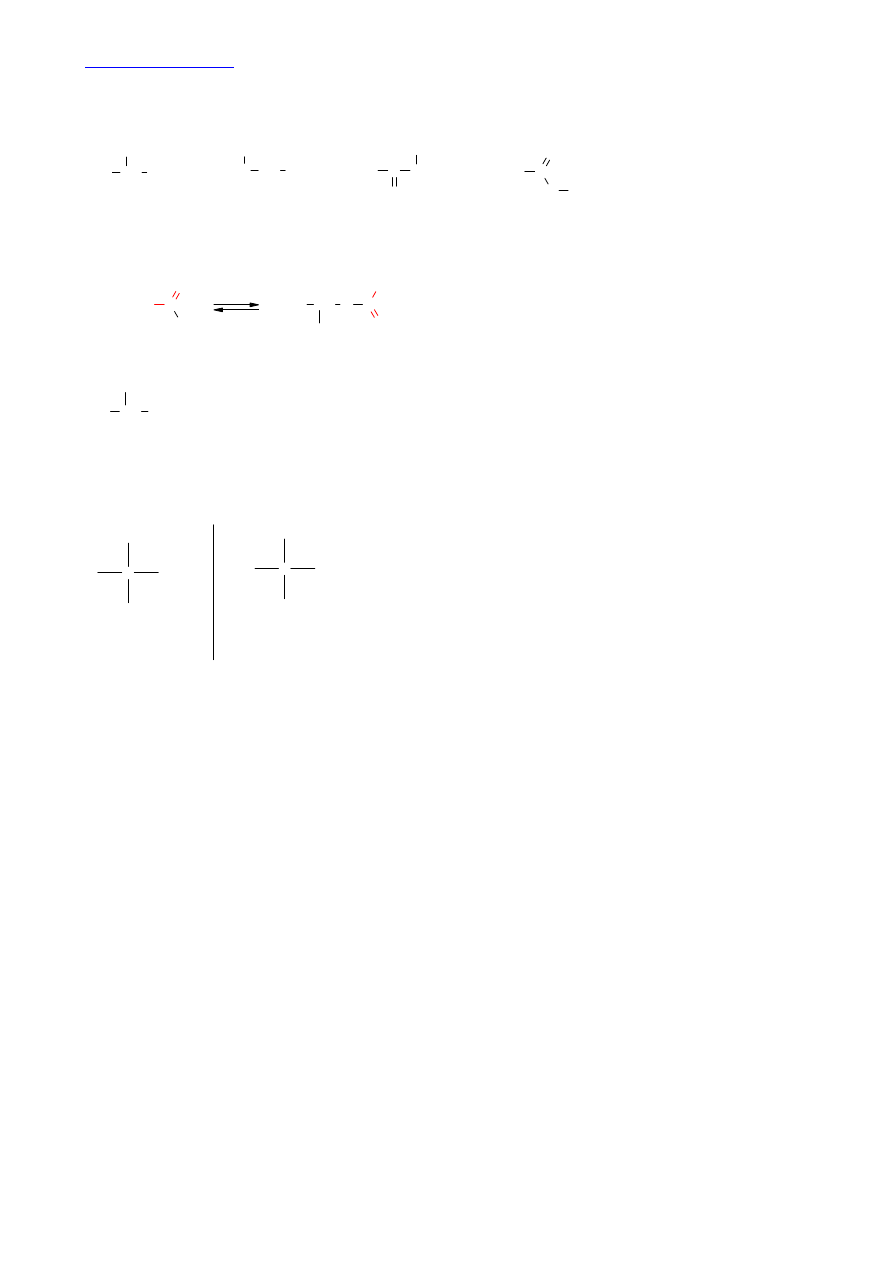
http://www.chemia.sos.pl
- 5 -
49.
Izomery, są to związki mające identyczny wzór cząsteczkowy. Dla propanonu możemy zapisać następujące izomery:
CH
3
-CH
2
-CHO oraz CH
2
=CH-CH
2
OH
Natomiast dla kwasu propanowego:
C
H
3
CH CHO
OH
C
H
2
CH
2
CHO
OH
C
H
3
C CH
2
O
OH
C
H
3
C
O
O
CH
3
50.
Zadanie to najlepiej rozwiązywać od końca. Końcowym produktem jest ester, otrzymany w reakcji kwasu octowego i alkoholu.
Należy odnaleźć część pochodzącą od kwasu octowego i część pochodzącą od alkoholu:
C
H
3
C
OH
O
CH
3
CH
CH
3
O
C
O
CH
3
B +
H
+
Widzimy, że ester ten powstał z alkoholu izopropylowego (propan-2-olu). Alkohol ten powstał z chlorowcopochodnej, w reakcji
substytucji (podstawienia) atomu chloru grupą hydroksylową. Atom chloru musiał zatem znajdować się przy 2 atomie węgla:
CH
3
CH
Cl
CH
3
2-chloropropan
51.
Enancjomery to wzajemne lustrzane odbicia nienakładalne na siebie. Wzór kwasu mlekowego CH
3
CH(OH)COOH oznacza, że
składa się z 3 atomów węgla, przy drugim znajduje się grupa hydroksylowa:
C
H
OH
CH
3
COOH
C
O
H
H
CH
3
COOH
Jeżeli brak Ci wyobraźni przestrzennej, w celu znalezienia
enancjomeru można pomóc sobie lusterkiem. Rysujemy
jeden związek, a jego enancjomer zobaczymy w lusterku.
Należy tylko dokładnie przerysować, to co widzimy.
52.
Aby związek mógł występować w formie enancjomerów, jego odbicie lustrzane musi być nienakładalne na związek. Tak się
dzieje gdy cząsteczka związku nie posiada płaszczyzny symetrii (w uproszczeniu gdy posiada asymetryczny atom (atom
połączony z 4 różnymi podstawnikami)). W cząsteczce etanolu nie ma asymetrycznego atomu węgla, dlatego etanol nie może
występować w formach enancjomerycznych, nie ma enancjomeru.
53.
Reakcją charakterystyczną na skrobie, jest jej reakcja z jodem (I
2
). Preparaty w których znajduje się skrobia zabarwiają się na
intensywny, granatowy kolor. Dysponujemy jedynie jodkiem potasu i bromem. Należy otrzymać jod. Brom jest bardziej
reaktywny od jodu i wypiera go z jego soli (w myśl zasady bardziej reaktywny, lub mocniejszy wypiera mniej reaktywny lub
słabszy):
2KI + Br
2
→ 2KBr + I
2
Powstały roztwór nanosi się na przekrojoną bulwę ziemniaka.
Opis słowny doświadczenia: Do roztworu jodku potasu dodajemy kilka kropli bromu i wstrząsamy. Kilka kropli powstałego
roztworu nanosimy na przekrojoną bulwę ziemniaka.
Obserwacje: w miejscu naniesienia roztworu pojawia się granatowe zabarwienie.
54.
Jeżeli głównym składnikiem preparatów jest wodorotlenek sodu, to w kontakcie z aluminiowym przedmiotem (glinoym) zajdzie
reakcja:
2Al + 2OH
-
+ 6H
2
O → 2[Al(OH)
4
]
-
+ 3H
2
Dobór współczynników tej reakcji będzie łatwy gdy zbilansujemy sobie elektrony. Wodór pobiera 2e, glin oddaje 3e, NWW=6, a
więc muszą być dwa atomy glinu i 3 cząsteczki wodoru. 2 atomy glinu tworzą 2 cząsteczki tetrahydroksyglinianu. Każda ma
ładunek ujemny, czyli ładunek prawej strony wynosi (-2). Lewej również musi wynosić (-2), więc muszą być dwie grupy
wodorotlenowe. Teraz łatwo uzupełnić ilość cząsteczek wody, by było zachowane prawo zachowania masy.

http://www.chemia.sos.pl
- 6 -
55.
Tłuszcze to estry kwasów tłuszczowych i gliceryny (kwasy tłuszczowe, to kwasy karobksylowe o co najmniej 4 atomach węgla).
Jako estry hydrolizują w środowisku alkalicznym. Reakcja hydrolizy w środowosku alkalicznym nosi nazwę reakcji zmydlania:
C
H
2
C
H
C
H
2
O
O
O CO-C
17
H
35
CO-C
17
H
35
CO-C
17
H
35
C
H
2
C
H
C
H
2
OH
OH
OH
+ 3NaOH
+ 3C
17
H
35
COONa
W celu zapisania wzoru estru pomocne mogą być informacje, że kwasy występujące w przyrodzie mają zawsze parzystą liczbę
atomów węgla. Kwas stearynowy – zaczyna się na literę s, ma więc siedemnaście atomów węgla + grupa karboksylowa. Kwas
p
almitynowy ma piętnaście atomów węgla + grupę karboksylową.
56.
W reakcji zmydlania tłuszczu tworzą się sole sodowe kwasów tluszczowych (sole te nazywane są mydłami). Tak jak większość
soli są rozpuszczalne w wodzie.
Wyszukiwarka
Podobne podstrony:
kom odp pp2005m(1)
kom odp pp2006m(1)
kom odp pr2007m(1)
kom odp pp2007m(1)
kom odp pr2008(1)
ch pp odp 2008 kom(1)
Narzady i kom u imm, antyg i Ab, mech odp swoistej i niesw
odp z bioli kom
wykaz odp egz kom
CW 7 odp swoista kom cz 1
Biol kom cz 1
więcej podobnych podstron