
WICZENIE NR 18
EFEKT SZILARDA-CHALMERSA.
ZALE NO WYDZIELANIA
56
Mn OD pH ROZTWORU.
Z chemicznego punktu widzenia reakcje j drowe mo na podzieli na dwie grupy:
w wyniku reakcji j drowej powstaje nowy pierwiastek (np. reakcja n, ) lub izotop tego
samego pierwiastka (np. reakcje n, ). Chemiczne rozdzielenie izotopów jest w zasadzie
niemo liwe. Pomimo to w wielu przypadkach da si wydzieli powstały izotop z reszty
substancji macierzystej dzi ki zjawisku wykrytemu w 1934 r przez Szilarda i Chalmersa.
Okazało si , e je eli j dro atomu wchodz cego w skład jakiego poł czenia chemicznego
ulegnie przemianie ( n, ), to emisja kwantów towarzysz ca wychwytowi neutronu udziela
j dru pewnej energii odskoku zgodnie z prawem zachowania p du. Ta energia odskoku jest w
stanie zerwa wi zanie chemiczne atomu z cz steczk . Je eli tak wyrwany atom nie ulegnie
rekombinacji z cz steczk , mo na go wydzieli z substancji macierzystej. Energi kinetyczn
atomu odskoku mo na policzy w nast puj cy sposób.
Z zasady zachowania p du wynika, e:
c
E
Av
γ
=
(1)
gdzie:
A-
masa atomu promieniotwórczego powstaj cego w wyniku wychwytu neutronu
termicznego
v- pr dko atomu odskoku
E - energia kwantu
c- pr dko wiatła
Znaczy to, e p d unoszony przez kwant jest co do swej wielko ci równy p dowi
otrzymanemu przez atom odrzutu. Zakłada si przy tym, e warto p du wniesion przez
neutrony termiczne mo na zaniedba . Podnosz c obie strony równania (1) do kwadratu i
przekształcaj c otrzymujemy:
od
2
2
E
Ac
2
E
Av
2
1
2
=
=
γ
(2)
gdzie:
E
od
– energia odskoku j dra

W fizyce j drowej cz sto jest stosowana jednostka energii- elektronowolt (eV). Jeden
elektronowolt odpowiada energii, jak uzyskuje lub traci cz stka o jednostkowym ładunku
elementarnym przebywaj c odcinek drogi w polu elektrycznym o ró nicy potencjałów równej
1V (1 eV= 1,602x10
-19
J ). Jednej jednostce masy atomowej odpowiada energia 931,5 MeV=
1,5x10
-10
J. P d cz stki wyra a si w jednostkach energii / c, a mas w jednostkach energii /c
2
.
St d
]
[
10
3
]
[
1863
10
2
2
J
A
E
MeV
A
E
E
od
−
⋅
=
=
γ
γ
(3)
Energia odskoku uzyskana przez atom w wyniku emisji kwantu przechodzi
w energi ruchów: oscylacyjnego, rotacyjnego i translacyjnego. Najwi ksze znaczenie ma ta
cz
energii odskoku, która zu ywa si na zwi kszenie ruchów oscylacyjnego i rotacyjnego.
Pocz tkowo cała energia odskoku skupiona jest w atomie, który wyemitował kwant .
Atom ten zwi zany jest jednak z pozostał cz ci cz steczki i gdy zaczyna si porusza
w kierunku przeciwnym do wyemitowanego kwantu poci ga za sob pozostał cz
cz steczki. W ten sposób pewna cz
energii zostaje przekazana cz steczce. Je eli atom
odskoku porusza si dalej wzgl dem pozostałej cz ci cz steczki, odległo mi dzy nimi
zaczyna si zwi ksza ( wi zanie „si rozci ga”). Gdy wi zanie nie jest dostatecznie silne, to
cz steczka si rozpada.
W przypadku gdy masa pozostałej cz ci cz steczki jest du a w porównaniu z mas atomu
promieniotwórczego praktycznie cała energia odskoku jest zu ywana na zerwanie wi za .
Je eli natomiast masa reszty cz steczki jest mała w porównaniu z mas atomu odskoku, ta
cz
energii, która została zu yta na zerwanie wi za chemicznych jest bliska zeru. Cała
energia zostaje zu yta na zwi kszenie ruchu post powego cz steczki.
Podczas na wietlania neutronami termicznymi soli kwasów tlenowych zachodzi
rozbicie cz steczki na fragmenty, co mo na prze ledzi na przykładzie tworzenia si
promieniotwórczego manganu. Podczas na wietlania roztworu nadmanganianu atom
manganu pochłania neutron. Tworz cy si atom promieniotwórczego manganu
56
Mn
(T
1/2
=2,57 godz., E = 2,36 MeV, E = 0,845 MeV), emituje kwant i otrzymuje energi
odrzutu, która rozbija jon MnO
4
-
z jednoczesnym utworzeniem Mn
+7
, MnO
+5
, MnO
2
+3
, lub
MnO
3
+
. Wszystkie te jony:
1.
s silnymi utleniaczami w odniesieniu do wody i wchodz w reakcje chemiczne drugiego
rz du nast puj cego typu:
2
56
MnO
3
+
+ 4H
2
O = 3H
2
O
2
+ 2H
+
+ 2 MnO
2
↓ (4)
2.
reaguj z jonami hydroksylowymi w my l równania:
56
MnO
3
+
+ OH
-
=
56
MnO
4
-
+ H
+
(5)
3.
bior udział w reakcjach wymiany izotopowej:
56
MnO
3
+
+ MnO
4
-
=
56
MnO
4
-
+ MnO
3
+
(6)
Dwie ostatnie reakcje prowadz do utworzenia si promieniotwórczego jonu MnO
4
-
, pierwsza
za reakcja do utworzenia dwutlenku manganu. W ten sposób w wyniku reakcji wtórnych
zachodzi rozdział promieniotwórczego manganu na cz steczk macierzyst i dwutlenek
manganu.
Oddzielenie promieniotwórczego manganu w postaci MnO
2
od nadmanganianu mo na
prowadzi za pomoc filtracji na wietlonego roztworu przez s czek bibułowy. Na ilo
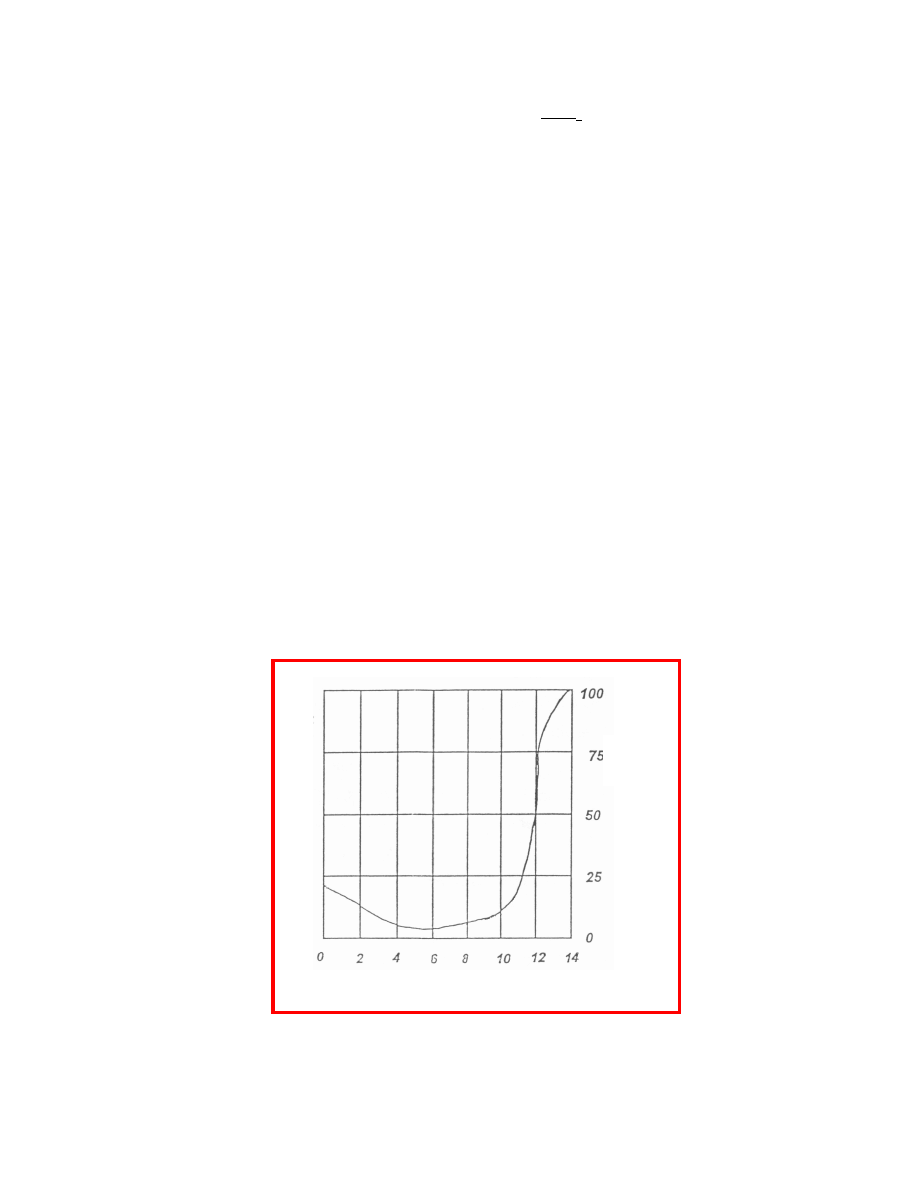
manganu pozostaj cego pod postaci macierzyst silnie wpływa kwasowo na wietlonego
roztworu (rys.1).
%
56
Mn
w MnO
4
-
pH rozpuszczalnika

Je eli w roztworze kwa nym jest ona równa w przybli eniu 5% to przy pH = 14 dochodzi ona
prawie do 100%. W rodowisku alkalicznym przewa a reakcja (2) i du a cz
promieniotwórczego manganu pozostaje w postaci jonów MnO
4
-
. W silnie kwa nym
rodowisku tworzenie aktywnego dwutlenku manganu według reakcji (1), jest zahamowane
i bardziej prawdopodobna staje si reakcja (3).
Aparatura:
urz dzenie do pomiaru aktywno ci z licznikiem scyntylacyjnym lub licznikiem G-M,
ródło neutronów termicznych
Odczynniki:
3 % roztwór KMnO
4
Wykonanie wiczenia:
Trzy kolby do na wietla zawieraj ce 3 % roztwór KMnO
4
o pH rozpuszczalnika 7 i 12
umieszcza si w bloku parafinowym i na wietla neutronami w ci gu 10 godzin.
1.
Zmierzy tło naczyniek pomiarowych napełnionych 3 % roztworem KMnO
4
(nie
na wietlonym neutronami) ze wzgl du na promieniotwórczo potasu
40
K znajduj cego
si w potasie naturalnym. B dzie to tło dla pomiarów aktywno ci na wietlonego KMnO
4
.
2.
Ka dy z na wietlonych roztworów wymiesza dokładnie, tak aby powstały dwutlenek
manganu MnO
2
był zawieszony w całej obj to ci roztworu. Z ka dego z wymieszanych
roztworów pobra po 4 cm
3
do naczyniek pomiarowych, aby zmierzy cz sto zlicze
proporcjonaln do całkowitej zawarto ci
56
Mn, to znaczy
56
Mn znajduj cego si w MnO
2
i
w KMnO
4
.
3.
Zmierzy pozostał obj to ka dego z dwóch na wietlonych roztworów i przes czy .
Przes cz przela do zlewki. Pozostały na s czku dwutlenek manganu wypłuka
kilkakrotnie wod , aby uwolni go od jonów MnO
4
-
. S czki z osadami zwin i umie ci
w naczy kach pomiarowych. Aktywno osadów b dzie proporcjonalna do ilo ci
56
MnO
2
,
a wi c do wydajno ci efektu Szilarda-Chalmersa. Do naczyniek pomiarowych odmierzy
po 4 cm
3
przes czu.
4.
Zmierzy aktywno wszystkich otrzymanych preparatów, w warunkach pomiaru i czasie
wskazanym przez prowadz cego wiczenie.
Opracowanie wyników

a) Na podstawie otrzymanych wyników obliczy wydajno efektu Szilarda-Chalmersa
(mierzon wzgl dn ilo ci powstałego
56
MnO
2
) dla rozpuszczalników o ró nych pH.
Wykona rachunek bł dów.
b) Sprawdzi , czy zawarto
56
Mn w mieszaninie MnO
2
i roztworu KMnO
4
(2) punkt
wiczenia) jest sum zawarto ci tego izotopu (w granicach niepewno ci pomiaru) w osadzie i
w przes czu (bilans
56
Mn).
c) Na podstawie równania (3) obliczy energi odskoku atomu
56
Mn, przyjmuj c energi
kwantów = 2MeV.
Wyszukiwarka
Podobne podstrony:
instrukcja cw 20 id 216489 Nieznany
cw nr 20 id 122299 Nieznany
cw med 5 id 122239 Nieznany
7 20 id 44744 Nieznany (2)
cw excel3 id 166408 Nieznany
cw 6 podobienstwo id 122439 Nieznany
OPCJE NA INDEKS WIG 20 id 33601 Nieznany
cw 13 id 121763 Nieznany
Cw mikrob 2 id 122249 Nieznany
CW K2 id 217375 Nieznany
cw mocz id 100534 Nieznany
cw med 2 id 122233 Nieznany
cw 11 id 122151 Nieznany
3 20 id 32892 Nieznany (2)
Instrukcja cw 3 PI id 216486 Nieznany
cw 1 ZL id 100327 Nieznany
więcej podobnych podstron