Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
AMINY
5 godz.
1.
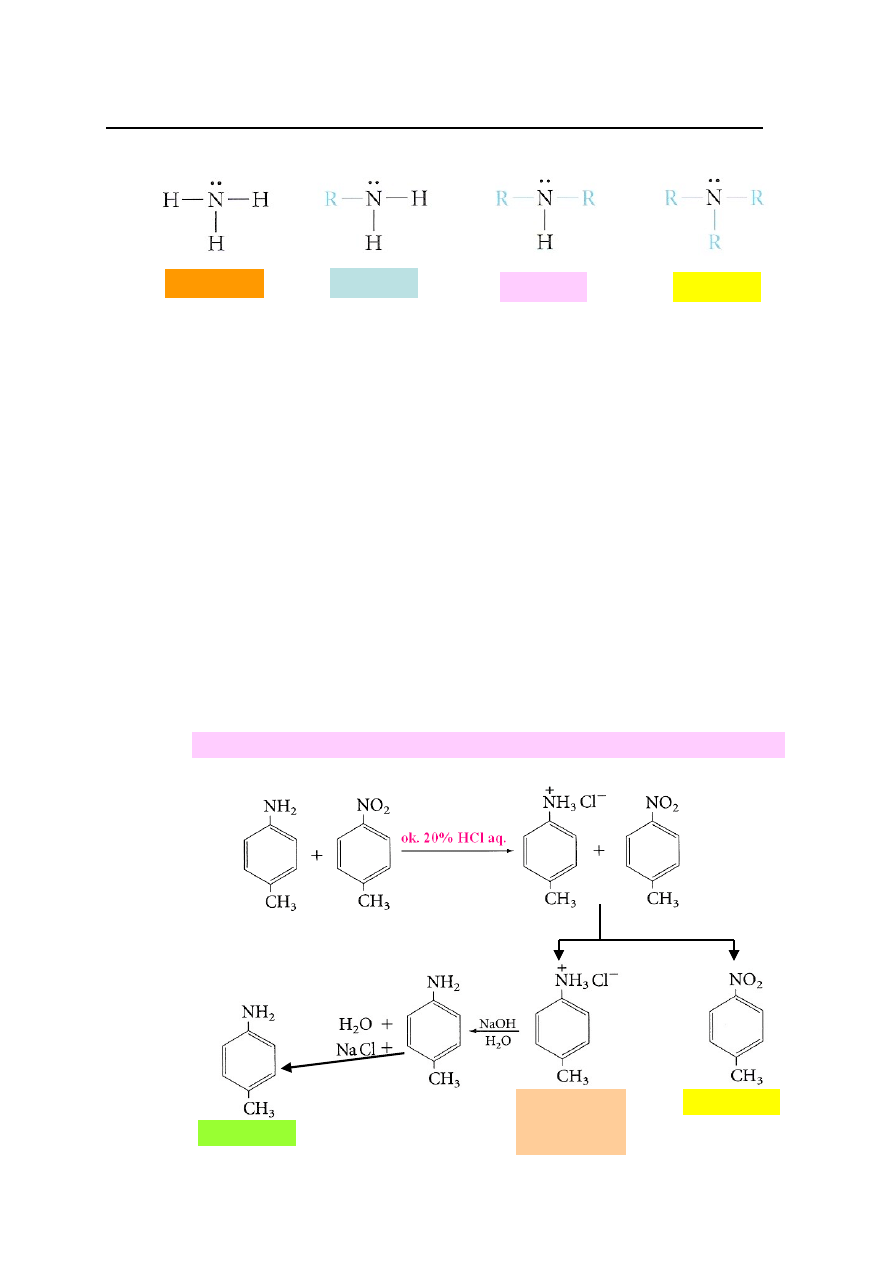
Klasyfikacja
1.1.
1° (pierwszorzędowe), np. izopropyloamina.
1.2.
2° (drugorzędowe), np. pirolidyna.
1.3.
3° (trzeciorzędowe), np. N,N-dimetyloanilina.
2.
Hybrydyzacja atomu azotu i tetraedryczna budowa amin
3.
Nukleofilowość na przykładzie reakcji z halogenkami alkilowymi (jodkiem
metylu)
Aminy wykazują właściwości nukleofilowe ze względu na obecność wolnej
pary elektronowej na atomie azotu (tj. reagują z halogenkami alkilowymi w
reakcji substytucji nukleofilowej).
4.
Zasadowość
4.1.
Reakcja amin z kwasem protonowym.
Aminy wykazują właściwości zasadowe (tj. mają zdolność do reakcji z
kwasami) ze względu na obecność wolnej pary elektronowej na atomie azotu.
4.1.a.
Reakcja amin z kwasami mineralnymi i karboksylowymi na przykładzie
otrzymywania chlorku propyloamoniowego, wodorosiarczanu trietyloamoniowego
oraz octanu pirydyniowego.
4.1.b.
Wydzielanie amin z ich soli z kwasami i wykorzystanie soli amin do oddzielania
amin od innych związków organicznych na przykładzie rozdzielania mieszaniny
anilina/nitrobenzen.
1
destylacja z parą wodną
destylacja
z parą wodną
toluidyna p-nitrotoluen
T
wrz.
200°C
T
wrz.
238°C
w destylacie
pozostałość
w kolbie
destylacyjnej
w destylacie
Sole amin wykorzystuje się do oddzielania amin od innych związków organicznych.
amoniak
amina 1°
amina 2°
amina 3°
amoniak
amina 1°
amina 2°
amina 3°
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
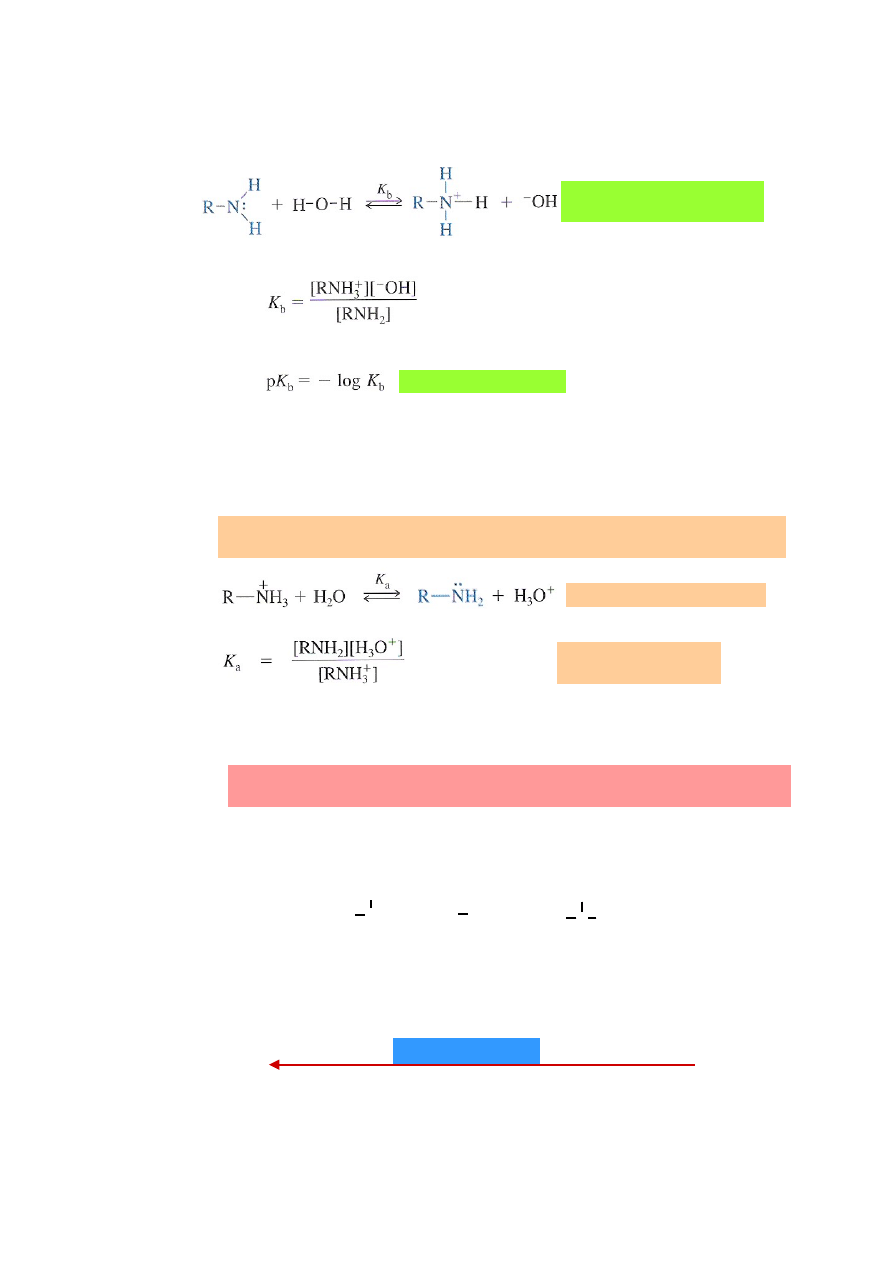
4.2.
Stała równowagi reakcji amin z wodą (K
b
) i pK
b
jako miara ich zasadowości.
4.3.
Stała równowagi reakcji kationu amoniowego z wodą (K
a
) i pK
a
jako miara jego
kwasowości.
Zależność między pK
b
aminy i pK
a
odpowiedniego kationu amoniowego
(sprzężonego kwasu).
4.4.
Porównanie zasadowości amin w roztworach wodnych, w zależności od ich
rzędowości.
2
roztwory wodne amin mogą
wykazywać odczyn zasadowy
amina kation amoniowy
miara zasadowości amin
kation amoniowy jako kwas
miara kwasowości
kationu amoniowego
W nowszych pracach zasadowość amin opisuje się pośrednio, poprzez podawanie
wartości pK
a
czyli stałej kwasowości odpowiedniego kationu amoniowego.
pK
a
=
−
log K
a
pK
b
= 14
−
pK
a
pK
a
+ pK
b
= 14
Im wyższa wartość pK
a
, tj. im słabszy kwas (kation amoniowy), tym mocniejsza
zasada z nim sprzężona (amina).
CH
3
NH
2
CH
3
NH
CH
3
CH
3
N
CH
3
CH
3
pK
a:
10.72 10.65 9.70
9.25
amina: 2° 1° 3°
amoniak
zasadowość: 2°
>
1°
>
3°
>
NH
3
NH
3
CH
3
NH
2
CH
3
NH
CH
3
CH
3
N
CH
3
CH
3
pK
a:
10.72 10.65 9.70
9.25
amina: 2° 1° 3°
amoniak
zasadowość: 2°
>
1°
>
3°
>
NH
3
NH
3
wzrost zasadowości
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
4.5.
Porównanie zasadowości amin aromatycznych i alifatycznych.
Aminy aromatyczne są słabszymi zasadami od amin alifatycznych tej samej
rzędowości.
Podstawniki elektronoakceptorowe w pozycjach orto i para względem grupy
aminowej obniżają zasadowość amin aromatycznych.
Podstawniki elektronodonorowe w pozycjach orto i para względem grupy
aminowej podwyższają zasadowość amin aromatycznych.
5.
Nomenklatura
6.
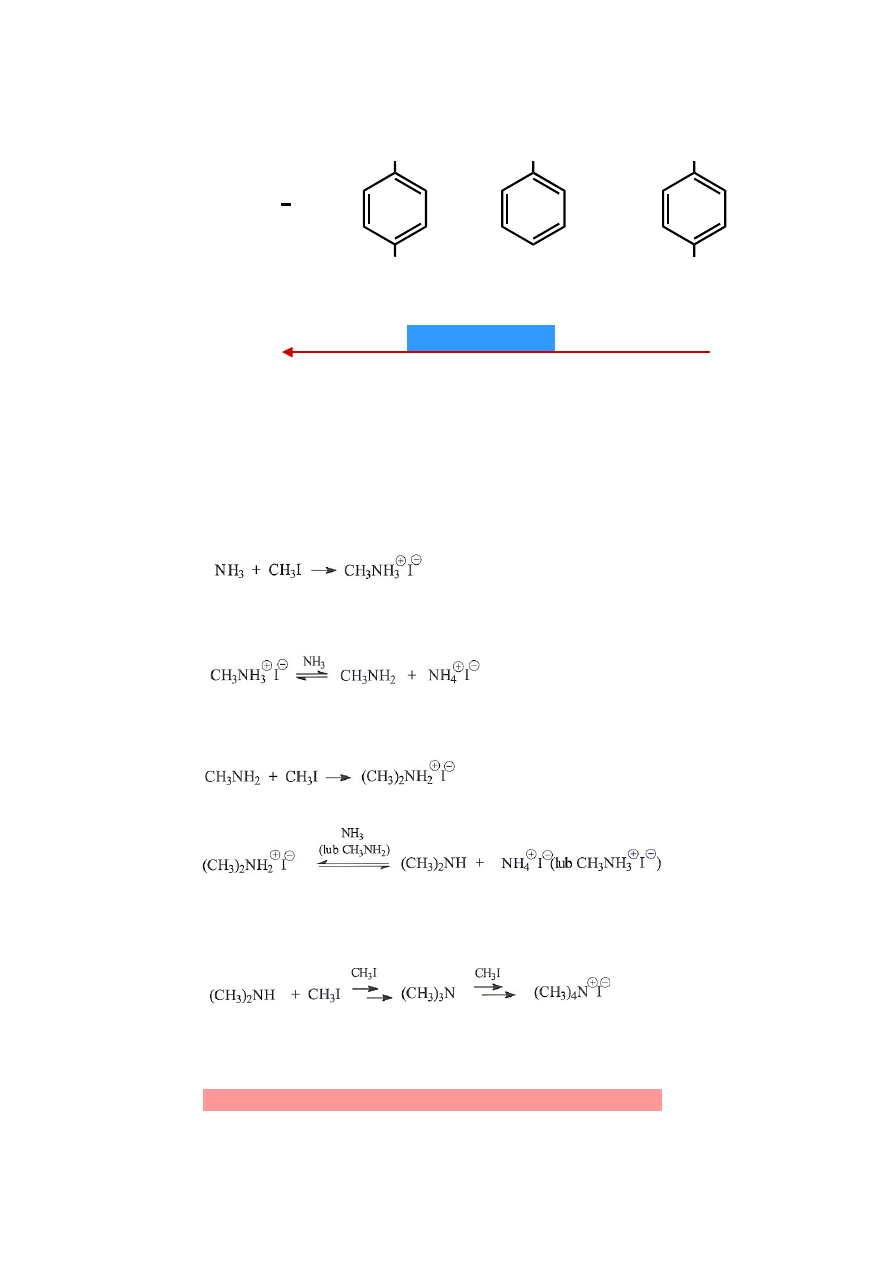
Przemysłowa metoda otrzymywania amin - alkilowanie amoniaku i amin
3
NH
2
NH
2
NO
2
NH
2
OCH
3
CH
3
NH
2
pK
a
: 10.65 5.30 4.58
1.00
wzrost zasadowości
amoniak
jodek metyloamoniowy
amoniak
jodek metyloamoniowy
metyloamina
(amina 1°)
jodek dimetyloamoniowy
dimetyloamina
(amina 2°)
trimetyloamina
jodek tetrametyloamoniowy
(amina 3°)
Nie można otrzymać danej aminy bez domieszek amin o wyższej rzędowości.

Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
7.
Metody laboratoryjne otrzymywania amin 1° (pierwszorzędowych)
7.1.
Redukcja nitrozwiązków na przykładzie otrzymywania:
o-Toluidyny z o-nitrotoluenu;
p-Toluidyny z p-nitrotoluenu;
p-Chloroaniliny z p-nitrochlorobenzenu;
m-Nitroaniliny z m-dinitrobenzenu;
1-Metylobutyloaminy z 2-nitropentanu.
7.2.
Redukcja nitryli na przykładzie otrzymywania:
2-Fenyloetyloaminy z benzonitrylu;
Butyloamina z butanonitrylu;
o-Metylobenzyloaminy z o-toluonitrylu;
1-(Metyloamino)cyklopenanolu z cyjnohydryny cyklopentanonu.
7.3.
Redukcja azydków na przykładzie otrzymywania:
Cykloheksyloamina z azydku cykloheksylu;
2-Fenyloetyloaminy z azydku 2-fenyloetylu;
7.4.
Redukcja oksymów na przykładzie otrzymywania:
1-Metylobutyloaminy z oksymu pentan-2-onu;
Benzyloaminy z oksymu benzaldehydu.
7.5.
Synteza Gabriela na przykładzie otrzymywania:
3-Metylobutyloaminy z 1-bromo-3-metylopentanu;
Benzyloaminy z bromku benzylu;
Kwasu 4-aminomasłowego z 4-chlorobutyronitrylu.
7.6.
Przegrupowanie Hofmanna (przegrupowanie amidów 1
°
) na przykładzie
otrzymywania pentyloaminy z heksanoamidu.
7.6.a.
Wykorzystanie metody do otrzymywania amin 1°, w których grupa –NH
2
jest
przyłączona do 3° atomu węgla na przykładzie syntezy:
3-Fenylo-2-metylo-2-propyloaminy z 3-fenylo-2,2-dimetylopropanoamidu;
tert-Butyloamina z 2,2-dimetylopropanoamidu.
7.6.b.
Wykorzystanie metody do otrzymywania aromatycznych amin 1° (zamiast redukcji
aromatycznej –NO
2
) na przykładzie syntezy p-nitroaniliny z p-nitrobenzamidu.
7.7.
Redukcja amidów 1
°
na przykładzie otrzymywania 3-metylobutyloaminy z 3-
metylobutanoamidu.
7.8.
Aminowanie redukcyjne aldehydów i ketonów (reakcja z amoniakiem) na
przykładzie otrzymywania benzyloaminy z benzaldehydu i amoniaku.
8.
Metody laboratoryjne otrzymywania amin 2° (drugorzędowych)
8.1.
Redukcja amidów 2
°
na przykładzie otrzymywania N-fenylobutanoaminy z N-
fenylobutanoamidu.
8.2.
Aminowanie redukcyjne aldehydów i ketonów (reakcja z aminą 1
°
) na przykładzie
otrzymywania:
N-Fenyloizopropyloaminy z acetonu i aniliny;
N-Etylobenzyloaminy z benzaldehydu i etyloaminy;
N-Benzylo-m-nitroaniliny z benzaldehydu i m-nitroaniliny.
9.
Metody laboratoryjne otrzymywania amin 3° (trzeciorzędowych)
9.1.
Redukcja amidów 3
°
na przykładzie otrzymywania N-etylo-N-metyloaniliny z N-
fenylo-N-metyloacetamidu.
9.2.
Aminowanie redukcyjne aldehydów i ketonów (reakcja z aminą 2
°
) na przykładzie
otrzymywania N,N-dimetylocykloheksyloaminy cykloheksanonu z cykloheksanonu
i dimetyloaminy.
4
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
10.
Podsumowanie redukcji amidów kwasowych do syntezy amin o różnej
rzędowości
11.
Podsumowanie reakcji aminowania redukcyjnego aldehydów lub ketonów do
syntezy amin o różnej rzędowości
12.
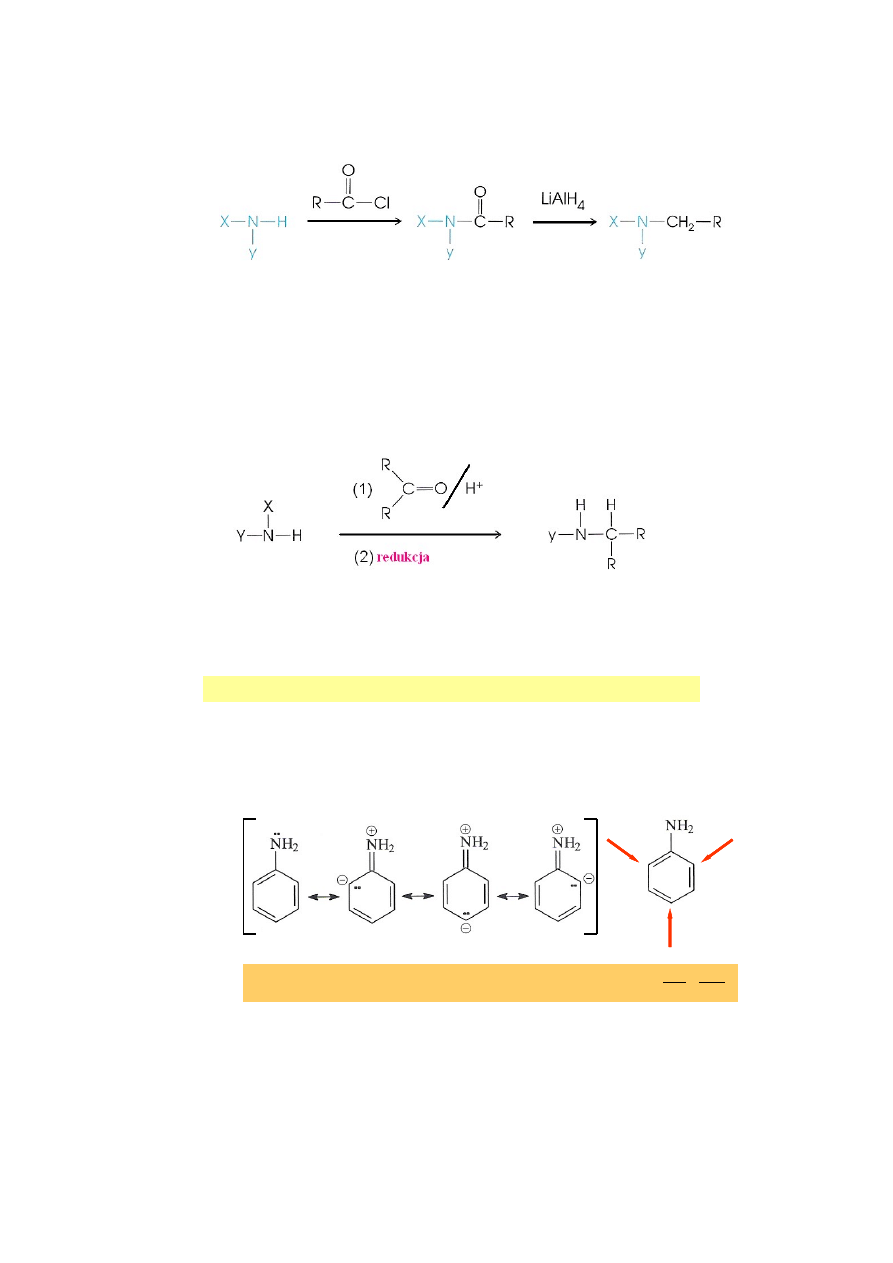
Wpływ grupy aminowej na reaktywność pierścienia aromatycznego w reakcji
substytucji elektrofilowej (S
E
)
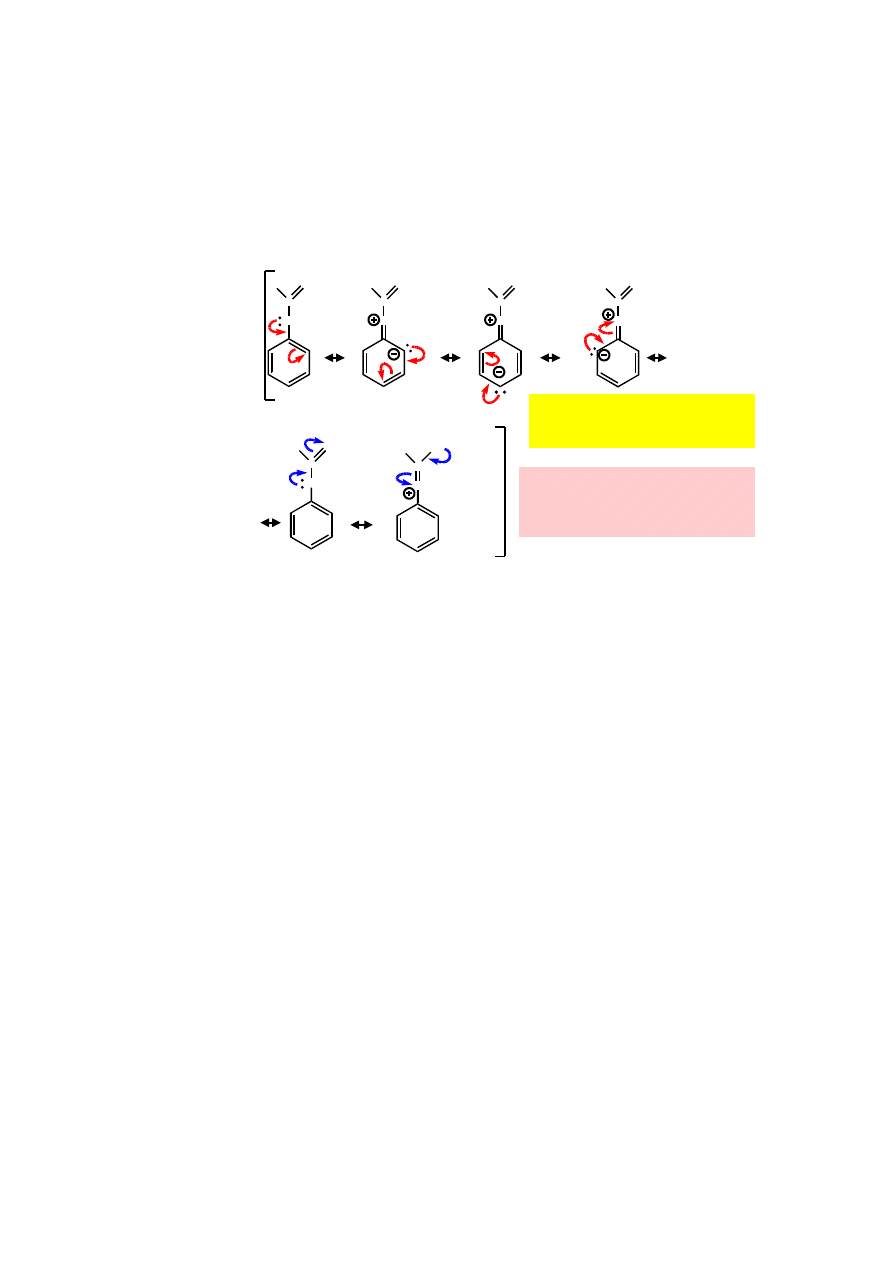
12.1.
Rozkład ładunków w cząsteczce aniliny i miejsca podstawienia pierścienia
aromatycznego.
12.2.
Reakcje aromatycznej substytucji elektrofilowej z udziałem aniliny
12.2.a.
Sulfonowanie aniliny na przykładzie otrzymywania kwasu sulfanilowego z aniliny.
12.3.a.
Nitrowanie: aniliny nie poddaje się bezpośredniemu nitrowaniu, ponieważ kwas
azotowy ma właściwości utleniające, a pierścień aromatyczny wzbogacony w
elektrony jest szczególnie podatny na utlenianie, które prowadzi do jego destrukcji.
12.3.b.
Bromowanie na przykładzie otrzymywania 2,4,6-tribromoaniliny.
5
amoniak
amid 1°
amina 1°
amina 1°
amid 2° amina 2°
amina 2°
amid 3° amina 3°
chlorek
kwasowy
aldehyd lub keton
amina 3°
amina 2°
amina 2°
amina 1°
amina 1°
amoniak
amina 3°
amina 2°
amina 2°
amina 1°
amina 1°
amoniak
czynniki redukujące : H
2
/Ni, NaBH
4
, LiAlH
4
, NaBH
3
CN, LiNaBH
3
CN
Grupa aminowa (-NR
2
) – grupa elektronodonorowa; wzbogaca pozycje orto i para
w elektrony.
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
12.3.c.
Alkilowanie lub acylowanie Friedla-Craftsa: bezpośrednia reakcja ma nieduże
znaczenie preparatyne, ponieważ wymaga stosowania specyficznych reagentów lub
warunków; najwygodniej jest ja zrealizować pośrednio poprzez alkilowanie bądź
acylowanie anilidów.
13.
Wpływ grupy acyloaminowej (R-C(=O)-NH-) na reaktywność pierścienia
aromatycznego w reakcji substytucji elektrofilowej (S
E
)
13.1.
Rozkład ładunków w cząsteczce acetanilidu.
13.2.
Alkilowanie i acylowanie anilidów metodą Friedla-Craftsa na przykładzie
otrzymywania ketonu cyklopentylowo-p-aminofenylowego oraz 4-
aminobenzofenonu.
13.3.
Nitrowanie i bromowanie anilidów na przykładzie otrzymywania p-nitroacetanilidu
i b-bromoacetanilidu, wykorzystanie reakcji do syntezy odpowiednio p-nitroaniliny
i p-bromoaniliny.
14.
Utlenianie amin - metodę stosuje się do utleniania amin 1° aromatycznych i 1°
alifatycznych z grupą –NH
2
połączoną z 3° atomem węgla, na przykładzie
otrzymywania 1,2,4-trinitrobenzenu z 2,4-dinitroaniliny oraz 1,3,5-
tribromonitrobenzenu z 2,4,6-tribromoaniliny.
Utlenianie 1° i 2° amin alifatycznych prowadzi najczęściej do mieszaniny
różnych produktów. Dlatego metoda ma ograniczone znaczenie preparatywne.
15.
Eliminacja Hofmanna – otrzymywanie alkenów niżej podstawionych (reguła
Hofmanna) w wyniku eliminacji 4° wodorotlenków amoniowych na przykładzie
otrzymywania:
But-1-enu z 2-butyloaminy;
Pent-2-enu z 2-chloropentanu.
16.
Reakcja 1
°
amin aromatycznych z kwasem azotawym - aromatyczne sole
diazoniowe
16.1.
Generowanie kwasu azotawego - kwas azotawy [azotowy(III)] jest nietrwały;
rozkłada się w temperaturze pokojowej, dlatego generuje się go w środowisku
reakcji.
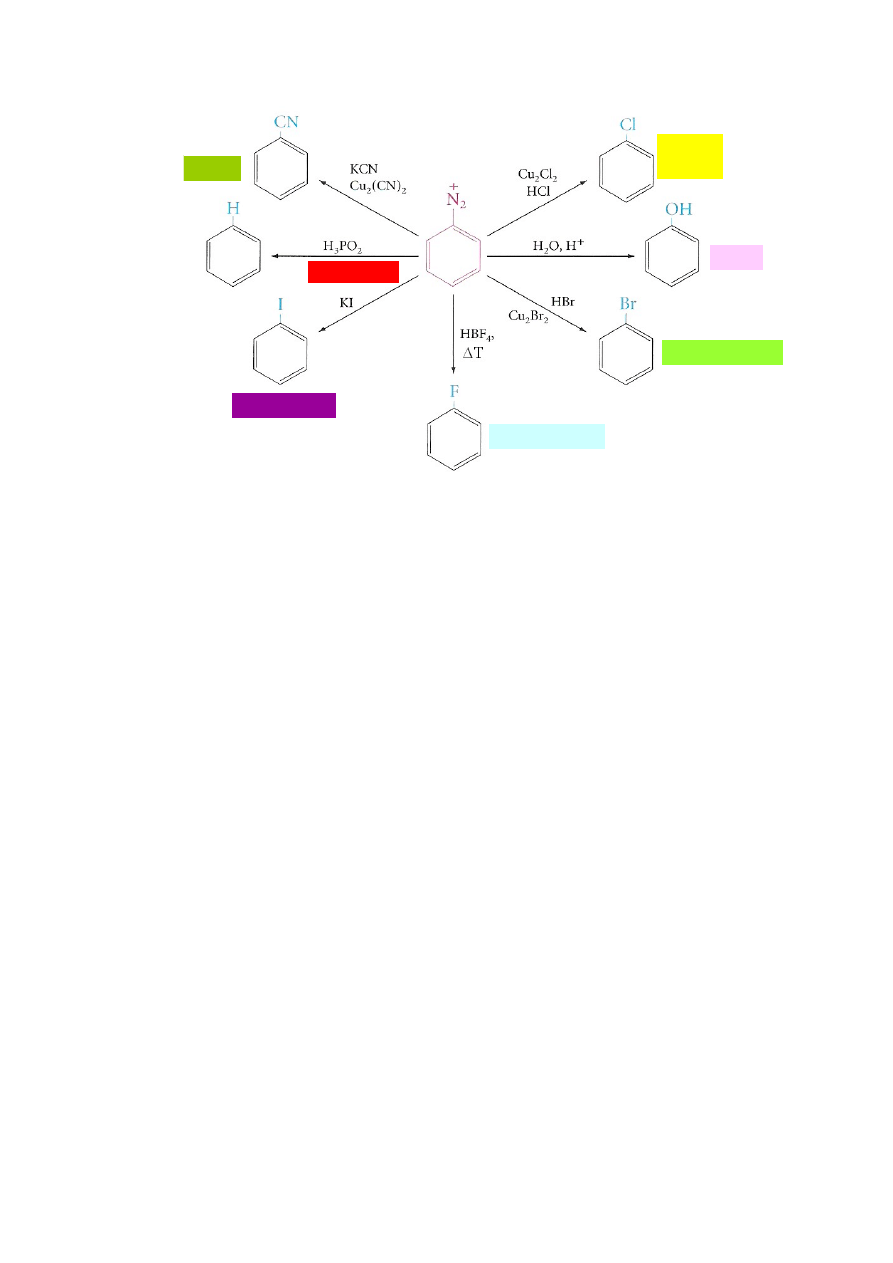
16.2.
Generowanie kationu nitrozoniowego i mechanizm tworzenia aromatycznych soli
diazoniowych.
16.3.
Przekształcanie aromatycznych soli diazoniowych w inne związki organiczne.
6
NH
C
R
O
NH
C
R
O
NH
C
R
O
NH
C
R
O
NH
C
R
O
−
Grupa acylowa [RC(=O)
−
] osłabia
własności elektronodonorowe grupy
aminowej.
Pierścień fenylowy w anilidach (czyli
amidach aniliny) jest mniej podatny na
podstawienie elktrofilowe niż w
anilinie.
NH
C
R
O
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
16.4.
Wykorzystanie aromatycznych soli diazoniowych w syntezie organicznej na
przykładzie syntezy:
m-Dibromobenzenu z nitrobenzenu;
3,5-Dibromotolueny z toluenu;
Kwasu o-toluilowego z o-toluidyny;
1,3,5-Tribromobenzenu z aniliny;
m-Hydroksyacetofenonu z m-aminoacetofenonu;
o-Bromotoluenu z o-toluidyny;
p-Nitrobenzonitrylu z p-nitroaniliny;
m-Bromochlorobenzenu z m-bromonitrobenzenu.
16.5.
Sprzęganie aromatycznych soli diazomiowych - aromatyczne sole diazoniowe
wykazują właściwości elektrofilowe i biorą udział w reakcji aromatycznej
substytucji elektrofilowej (S
E
) z pochodnymi fenolanów i aniliny; tj. związkami
posiadającymi podstawniki silnie aktywujące pierścień aromatyczny na
podstawienie elektrofilowe.
16.5.a.
Otrzymywanie barwników azowych:
”żółcieni masłowej;
żółcieni alizarynowej.
16.5.b.
Wykorzystanie barwników azowych na przykładzie oranżu metylowego -
wskaźnika kwasowo-zasadowego.
7
chlorki
arylowe
fenole
bromki arylowe
fluorki arylowe
jodki arylowe
(deaminacja)
nitryle
Document Outline
- Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
- AMINY 5 godz.
Wyszukiwarka
Podobne podstrony:
AMINY 3 id 59158 Nieznany
AMINY 7 id 59165 Nieznany (2)
Aminy i amidy id 59174 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron