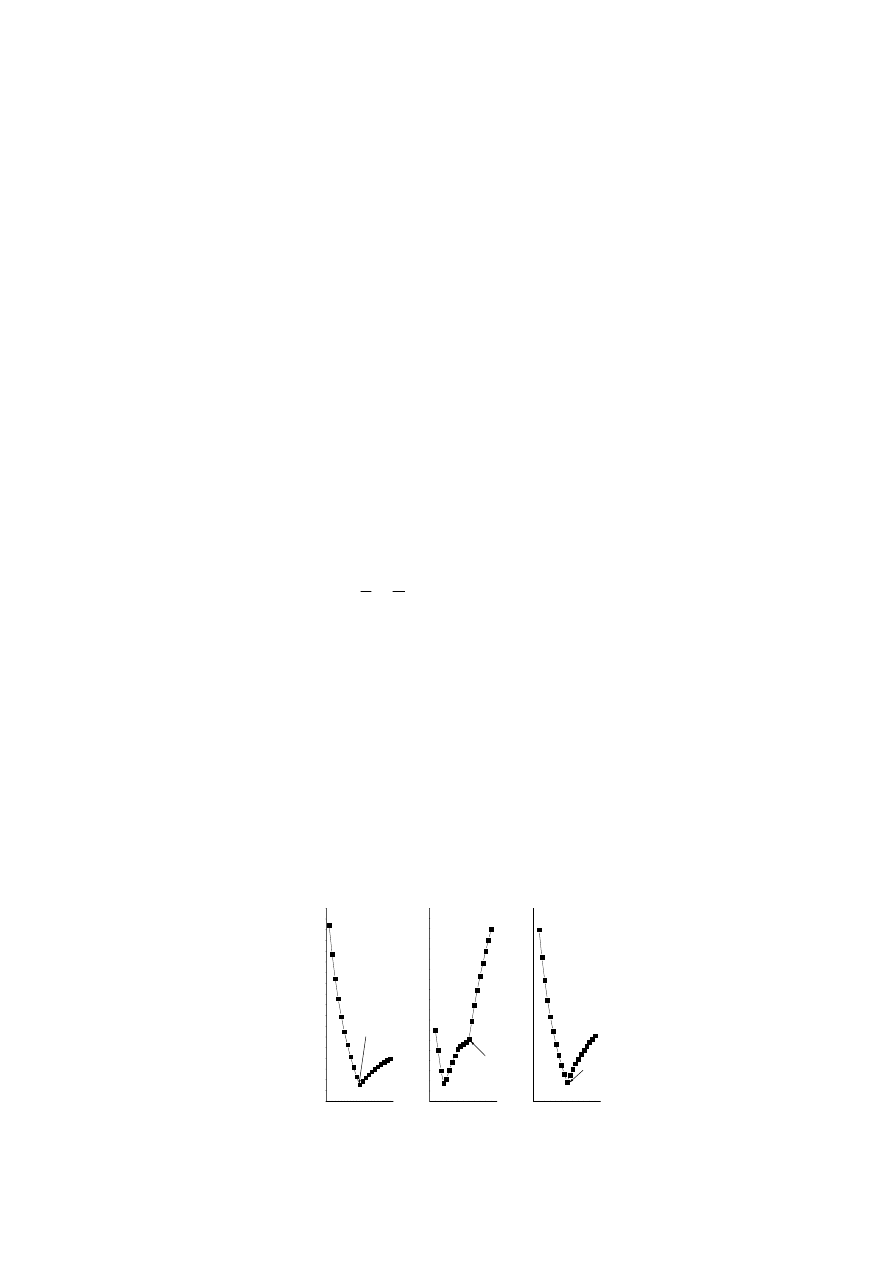
ĆWICZENIE Nr 43
MIARECZKOWANIE KONDUKTOMETRYCZNE.
Cel ćwiczenia: Wykorzystanie pomiaru przewodnictwa do oznaczenia
zawartości kwasu w próbce.
Roztwór elektrolitu jest dobrym przewodnikiem prądu. Nośnikami ładunku
elektrycznego w roztworze są jony. Zdolność roztworu elektrolitu do przewodzenia
prądu określa przewodnictwo elektryczne roztworu
Γ, które jest odwrotnością oporu
stawianego przez roztwór elektrolitu.
Do pomiaru przewodnictwa elektrolitu wykorzystuje się specjalne naczynia,
zawierające wtopione elektrody platynowe, pokryte czernią platynową, co powoduje
znaczne zwiększenie efektywnej powierzchni elektrody, nazywane naczyńkami
konduktometrycznymi. Celem zmierzenia przewodnictwa roztworu elektrolitu
elektrody naczyńka konduktometrycznego połączyć z konduktometrem, który jest
zmodyfikowanym mostkiem Wheatstone’a, umożliwiającym automatyczny pomiar
przewodnictwa elektrycznego roztworu
Γ.
Przewodnictwo elektryczne roztworu
Γ jest wprost proporcjonalne do
efektywnej powierzchni elektrody s i odwrotnie proporcjonalne do długości słupa
elektrolitu, która jest równa odległości pomiędzy elektrodami l i zależy od właściwości
roztworu, którą charakteryzuje przewodnictwo właściwe
κ:
k
l
s
κ
≡
⋅
κ
=
Γ
(1)
Przewodnictwem właściwym elektrolitu
κ nazywamy zdolność przewodzenia
prądu przez jednostkową objętość roztworu umieszczoną pomiędzy elektrodami
o jednostkowej powierzchni efektywnej. Stosunek odległości pomiędzy elektrodami l
do efektywnej powierzchni elektrody s, jest wielkością charakterystyczną dla każdego
naczyńka konduktometrycznego i jest nazywany stałą naczyńka k. Stałą naczyńka k
wyznacza się doświadczalnie mierząc przewodnictwo
Γ dla roztworu wzorcowego,
dla którego znane jest przewodnictwo właściwe
κ. Najczęściej stosowanym wzorcem
są roztwory KCl.
Przewodnictwo roztworu
Γ silnie zależy od stężenia jonów w próbce i może
być wykorzystane do oznaczenia stężenia roztworu elektrolitu i jego zmian wskutek
dodania odczynnika miareczkującego. Krzywe miareczkowania mocnych i słabych
kwasów mocnymi zasadami oraz miareczkowania strąceniowego pokazano na
poniższym rysunku.
a
PR
Γ
v NaOH
b
PR
v NaOH
PR
c
v MgSO
4

Miareczkowanie mocnych kwasów mocną zasadą (rysunek a)
Podczas miareczkowania mocnych kwasów mocnymi zasadami, które
przedstawia schemat (2), dodanie niewielkich porcji zasady powoduje znaczne
zmiany przewodnictwa:
O
H
Cl
Na
Cl
H
OH
Na
2
+
+
→
+
−
+
+
−
+
−
+
(2)
Przed osiągnięciem punktu równoważnikowego miareczkowania (punkt PR) dodanie
mocnej zasady do roztworu mocnego kwasu nie zmienia całkowitej liczby jonów w
roztworze, natomiast bardzo ruchliwe jony H
+
, których przewodnictwo molowe w
298K wynosi 34,96 mSm
2
mol
-1
, są zastępowane przez jony Na
+
, o znacznie
mniejszym przewodnictwie molowym, (5,01
mSm
2
mol
-1
). Jednocześnie roztwór
miareczkowany ulega rozcieńczeniu, gdyż zwiększa się jego objętość. Skutkiem obu
zjawisk jest spadek przewodnictwa roztworu. Po przekroczeniu punktu
równoważnikowego miareczkowania przewodnictwo
Γ wzrasta, gdyż wzrasta
całkowita liczba jonów w roztworze, w tym bardzo ruchliwych jonów OH
-
, których
przewodnictwo molowe wynosi 19,91
mSm
2
mol
-1
.
Miareczkowanie słabych kwasów mocną zasadą (rysunek b)
Miareczkowanie słabego kwasu mocną zasadą można przedstawić na
przykładzie miareczkowania kwasu octowego:
O
H
COO
CH
Na
CH
OH
Na
2
3
3
COOH
+
+
→
−
+
+
−
+
(3)
Skutkiem słabej dysocjacji kwasu octowego jest niewielkie stężenie jonów
w roztworze i małe przewodnictwo. W wyniku miareczkowania powstaje octan sodu,
który jest elektrolitem jonoforowym, złożonym z jonów. Efektem miareczkowania jest
początkowe nieznaczne obniżenie przewodnictwa, a następnie wyraźny, stopniowy
wzrost przewodnictwa. Nieznaczne obniżenie przewodnictwa odzwierciedla cofnięcie
dysocjacji (zmniejszenie stopnia dysocjacji) elektrolitu jonogennego -kwasu
octowego, spowodowane obecnością wspólnego jonu, anionu octanowego,
pochodzącego z elektrolitu jonoforowego – octanu sodu. Po osiągnięciu punktu
równoważnikowego zależność
Γ zmienia swój charakter i następuje silny wzrost
przewodnictwa wskutek wzrostu stężenia ruchliwych jonów OH
-
.
Miareczkowanie mieszaniny kwasów mocną zasadą
Miareczkując mieszaninę kwasów o różnej mocy mocną zasadą otrzymuje
się krzywą miareczkowania konduktometrycznego z dwoma punktami załamania.
Pierwszy z nich odpowiada zobojętnieniu kwasu mocniejszego, a drugi słabszego.
Miareczkowanie strąceniowe (rysunek c).
Pomiar przewodnictwa można wykorzystać do oznaczenia stężenia
dowolnych jonów w roztworze. Jako przykład pokazano miareczkowanie strąceniowe
roztworu MgSO
4
roztworem Ba(OH)
2
, które zachodzi zgodnie ze schematem:
↓
+
+
→
+
−
+
+
−
+
−
+
)
s
(
BaSO
OH
Mg
OH
Ba
SO
Mg
4
2
2
2
2
2
4
2
Skutkiem dodania roztworu MgSO
4
do roztworu zawierającego jony baru(II)
jest wytrącenie trudnorozpuszczalnej soli BaSO
4
. Przewodnictwo roztworu maleje
wskutek zastąpienia jonu Ba
2+
, którego przewodnictwo graniczne wynosi
6,36 mSm
2
mol
-1
,
mniej ruchliwym jonem Mg
2+
, którego przewodnictwo graniczne
wynosi 5,30 mSm
2
mol
-1
. Jednocześnie roztwór zwiększa swoja objętość, co
powoduje zmniejszenie stężenia. Po przekroczeniu punktu równoważnikowego
zwiększa się całkowita liczba jonów w roztworze i przewodnictwo wzrasta.
Wykonanie ćwiczenia.
1. Pobrać zanurzeniowe naczyńko konduktometryczne.
2. Biuretę napełnić 0,2 M NaOH.
3. Do zlewki odmierzyć pipetą 5 ml roztworu HCl i dodać tyle wody destylowanej,
aby zanurzeniowe naczyńko konduktometryczne było całkowicie zanurzone.
Roztwór wymieszać i odczytać początkową wartość przewodnictwa.
Miareczkować, dodając roztwór NaOH porcjami po 0,5 ml. Po dodaniu każdej
porcji roztwór wymieszać i zmierzyć jego przewodnictwo
Γ. Miareczkować tak
długo, aż przewodnictwo osiągnie wartość większą od początkowej. Wyniki
zanotować w Tabeli.
4. Zlewkę przepłukać, odpipetować 5 ml roztworu CH
3
COOH i postępować
w sposób opisany w poprzednim punkcie. Miareczkować aż przewodnictwo
roztworu będzie około 5 razy większe od początkowego.
5. Do przepłukanej zlewki dodać 5 ml roztworu HCl i 5 ml roztworu CH
3
COOH
i postępować jak opisano w punkcie 3. Miareczkować aż przewodnictwo
będzie około 5 razy większe od przewodnictwa początkowego. Wyniki
zanotować w Tabeli.
HCl CH
3
COOH
HCl + CH
3
COOH
V
NaOH
(ml)
Γ
1
, S
V
NaOH
(ml)
Γ
2
, S
V
NaOH
(ml)
Γ
3
, S
Opracowanie wyników:
1. Dla każdego miareczkowanego roztworu sporządzić wykres zależności
Γ od
objętości dodanej zasady V
NaOH
. Z wykresu odczytać punkt równoważnikowy.
2. Dla każdego miareczkowania obliczyć liczbę moli i stężenie kwasu
w roztworze.
Document Outline
Wyszukiwarka
Podobne podstrony:
ćwiczeniee 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opraco
Ćwiczenie 43, cw43wstep (1), Uniwersytet Wrocławski, Instytut Fizyki Doświadczalnej, I Pracownia
cwiczenie 43 FIZYKA H1, Politechnika Wrocławska, W-5 Wydział Elektryczny, Fizyka G2, fiza laborki, f
Ćw nr 24, Lab fiz 24, Ćwiczenie 43
CWICZENIE 43, Studia, AAAASEMIII, 3. semestr, Elektrotechnika II
43, Cwiczenie 43 c, FIZYKA
cwiczenie 43
ćwiczenie 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opracow
43, Cwiczenie 43 a, POLITECHNIKA WROC?AWSKA
43, Cwiczenie 43 e, TARASIUK
CWICZENIE 43 A (2) DOC
tematy ćwiczeń laboratoryjnych fizyka Cwicz 43
Ćwiczenie nr 43(1)
43 -kopia, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr43
ćwiczeniee 43Aneta Łoboda, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizy
Ćwiczenie nr 43, Studia, Semestr 1, Fizyka, Sprawozdania
43, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr43
Ćwiczenie 41, cw41, WŁASNOŚCI ELEKTRYCZNE DRUTU OPOROWEGO 43
więcej podobnych podstron