1
ZWIĄZKI ORGANICZNE ZAWIERAJĄCE ATOMY AZOTU
7
N
1s
2
2s
2
2p
3
okres 2; grupa V
(sp
3
)
2
(sp
3
)
1
(sp
3
)
1
(sp
3
)
1
2p
x
1
p
y
1
p
z
1
HYBRYDYZACJA sp
3
N
GEOMETRIA CZĄSTECZKI PIRAMIDALNA
niewiążąca para elektronów
N
R
R
1
R
2
N
R
R
1
R
2
N
R
R
1
R
2
INWERSJA AMIN
AMINY
formalnie są to pochodne amoniaku NH
3
R
NH
R
1
R
N
R
1
R
2
R
N
R
1
R
2
R
3
R NH
2
R: alkil, aryl
1°
2°
3°
kation ammoniowy
NOMENKLATURA AMIN
do nazwy alkilu dodaje się końcówkę „
-amina
”
pierwszorzędowych
CH
3
NH
2
metylo
amina
CH
3
CH
2
CH
2
CH
2
NH
2
n-
butylo
amina
NH
2
α-naftylo
amina
CH
3
CH
CH
3
NH
2
i-
propylo
amina
NH
2
anilina
AMINY
NOMENKLATURA AMIN
traktuje się je jako pochodne amin 1°
drugo- i trzeciorzędowych
trimetylo
amina
N
-
etylo-
N
-metylo-
n-
butylo
amina
N
-benzylo-
α-naftylo
amina
N
-
metylo-
i-
propylo
amina
N
-
i-
propylo
anilina
amina 1° – z najbardziej złożonym podstawnikiem
CH
3
CH
CH
3
NH
CH
3
CH
3
CH
2
CH
2
CH
2
N
CH
3
CH
2
CH
3
(CH
3
)
3
N
NH
CH(CH
3
)
2
NH
CH
2
N
-
α-naftylo-
benzylo
amina
CH
3
N
CH
2
H
3
C
N,N
-dimetylo
benzylo
amina
AMINY
NOMENKLATURA SOLI AMMONIOWYCH
wymienia się nazwy podstawników na atomie azotu w kolejności
alfabetycznej i dodaje się końcówkę „
-ammoniowy
”
określa się rodzaj anionu, np. bromek
chlorek
etylometylo-
i-
propylo
ammoniowy
H
N
H
3
C
CH
2
CH
3
CH(CH
3
)
2
Cl
H
3
C
NH
2
H
3
C
OH
wodorotlenek
dimetylo
ammoniowy
Br
(CH
3
CH
2
)
4
N
bromek
tetraetylo
ammoniowy
AMINY
OTRZYMYWANIE AMIN
NH
3
S
N
2
H
3
C
I +
H
3
C
I
S
N
2
CH
3
NH
2
+
H
3
C
I (CH
3
)
2
NH
S
N
2
+
(CH
3
)
3
N
H
3
C
I +
S
N
2
(CH
3
)
4
N
I
METODA NIEJEDNOZNACZNA
REAKCJE SUBSTYTUCJI NUKLEOFILOWEJ
AMINY
OTRZYMYWANIE AMIN
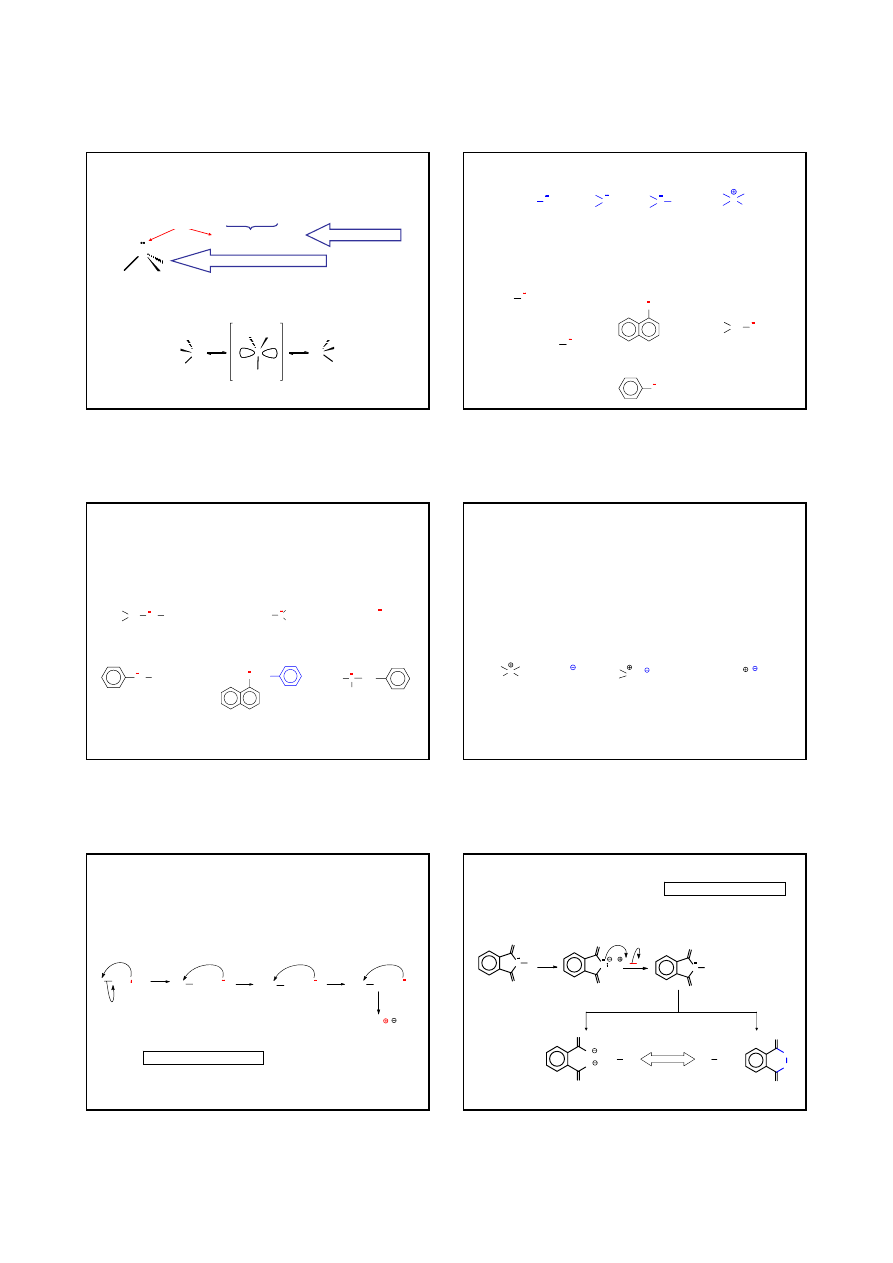
REAKCJE SUBSTYTUCJI NUKLEOFILOWEJ – METODA GABRIELA
N
O
O
H
KOH
N
O
O
K
ftalimid
R
X
N
O
O
R
(-KX)
N-
alkiloftalimid
OH
-
/H
2
O
NH
2
NH
2
/EtOH,
∆
NH
NH
O
O
R
NH
2
+
O
O
O
O
R
NH
2
+
AMINA 1
°
METODA JEDNOZNACZNA
R: ALKIL
X: Cl, Br lub I
2
AMINY
OTRZYMYWANIE AMIN
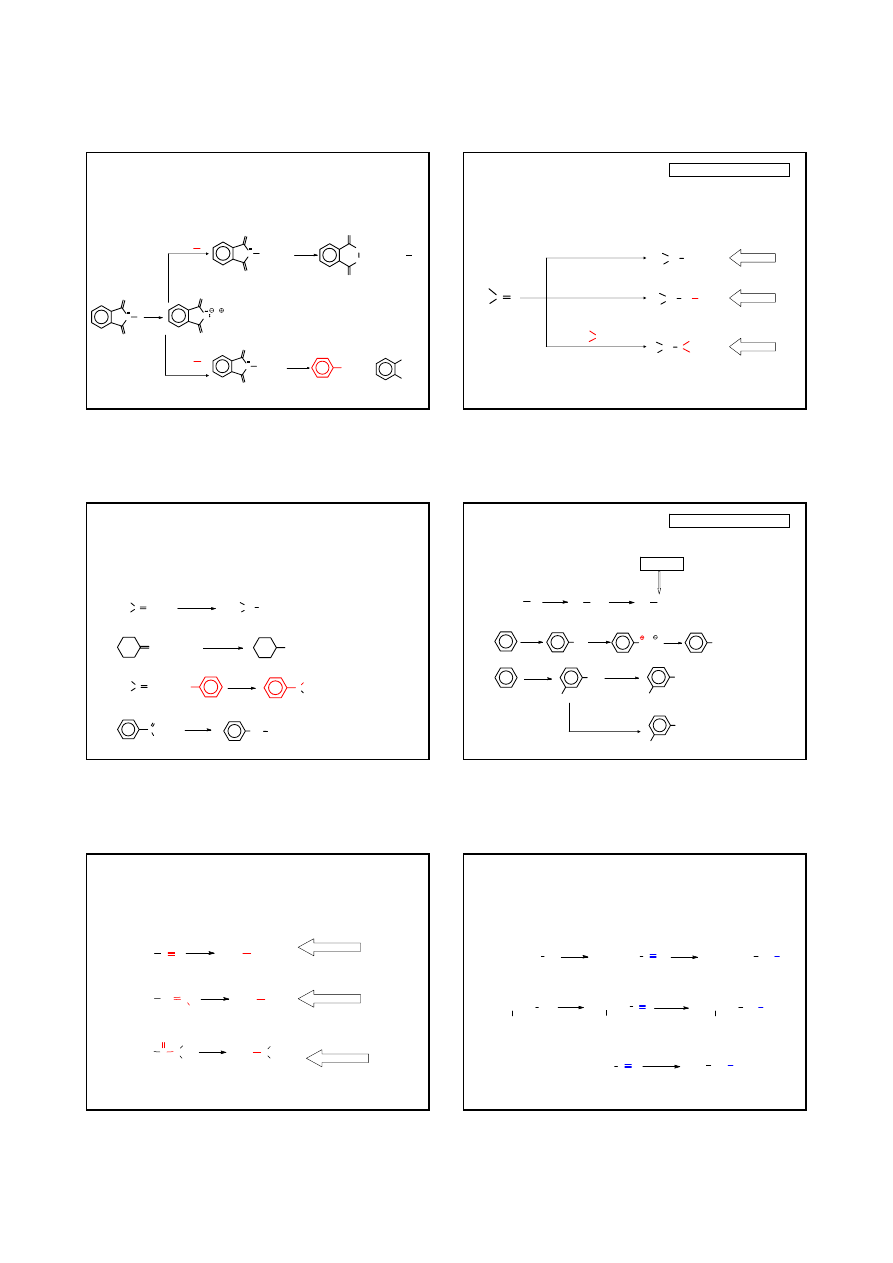
REAKCJE SUBSTYTUCJI NUKLEOFILOWEJ – METODA GABRIELA
PRZYKŁADY
N
O
O
H
KOH
N
O
O
K
(CH
3
)
2
CH
Br
N
O
O
CH(CH
3
)
2
(-KBr)
NH
2
NH
2
EtOH
NH
NH
O
O
(CH
3
)
2
CH
NH
2
+
ftalimid
ftalimidek potasu
N-
i
-propylo
ftalimid
CH
2
NH
2
+
COO
-
COO
-
C
6
H
5
CH
2
Cl
N
O
O
CH
2
C
6
H
5
(-KCl)
OH
-
/H
2
O
N-
benzylo
ftalimid
i
-propylo
amina
benzylo
amina
AMINY
OTRZYMYWANIE AMIN
METODA JEDNOZNACZNA
METODA REDUKCYJNEGO AMINOWANIA
R'
C
R"
O
R'
CH
R"
NH R
RNH
2
[H]
NH
3
[H]
R'
CH
R"
NH
2
R'
CH
R"
N
R
R
NH
R
R
[H]
[H]: H
2
/Ni, 90 atm, 40–70°C
NaBH
3
CN lub LiBH
3
CN
AMINA 1°
AMINA 2°
AMINA 3°
AMINY
OTRZYMYWANIE AMIN
METODA REDUKCYJNEGO AMINOWANIA
PRZYKŁADY
NH
3
H
3
C
C
H
3
C
O +
H
3
C
CH
H
3
C
NH
2
NaBH
3
CN
i-
propylo
amina
CH
3
NH
2
+
LiBH
3
CN
O
NHCH
3
N-
metylo
cykloheksylo
amina
H
3
C-NH
+
H
3
C
C
H
3
C
O
H
2
/Ni
90 atm
40–70°C
N
CH
3
CH(CH
3
)
2
N-
metylo-N-
i-
propylo
anilina
H
2
/Ni
90 atm
40–70°C
C
O
H
+
NH
3
CH
2
NH
2
benzylo
amina
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja związków nitrowych
Ar
H
HNO
3
H
2
SO
4
Ar
NO
2
[H]
Ar
NH
2
[H]: Sn/HCl lub Fe/HCl
H
2
S, CH
3
CH
2
OH, NH
3
PRZYKŁADY
NO
2
HNO
3
H
2
SO
4
Sn/HCl
NH
3
Cl
NH
2
OH
-
anilina
m
-nitro
anilina
HNO
3
H
2
SO
4
,
∆
NO
2
O
2
N
H
2
S
NH
3
, EtOH
70-80%
NH
2
O
2
N
NH
2
H
2
N
1.
Fe/HCl
2.
OH
-
m
-fenylenodi
amina
METODA JEDNOZNACZNA
AMINY 1°
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
R
C N
R
CH
2
NH
2
[H]
[H]
R
CH
2
NH
2
R
CH N
OH
R
C N
R
O
R'
R
CH
2
N
R'
R
[H]
redukcja oksymów
redukcja nitryli
redukcja amidów
AMINA 1
°, 2°, 3°
R: alkil, aryl
H
2
, katalizator
LiAlH
4
[H]:
AMINA 1
°
AMINA 1
°
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja nitryli
PRZYKŁADY
CH
3
CH
2
CH
2
Br
Na
CN
CH
3
CH
2
CH
2
C N
Ni/Raney
140°C
CH
3
CH
2
CH
2
CH
2
NH
2
bromopropan
n
-butyloamina
2-metylo-1-bromopropan
3-metylobutyloamina
CH
3
CHCH
2
Br
CH
3
Na
CN
CH
3
CHCH
2
C N
CH
3
1.LiAlH
4
2. H
2
O
CH
3
CHCH
2
CH
2
NH
2
CH
3
CH
3
CH
2
NH
2
1.LiAlH
4
2. H
2
O
CH
3
C N
acetonitryl
etyloamina
H
2
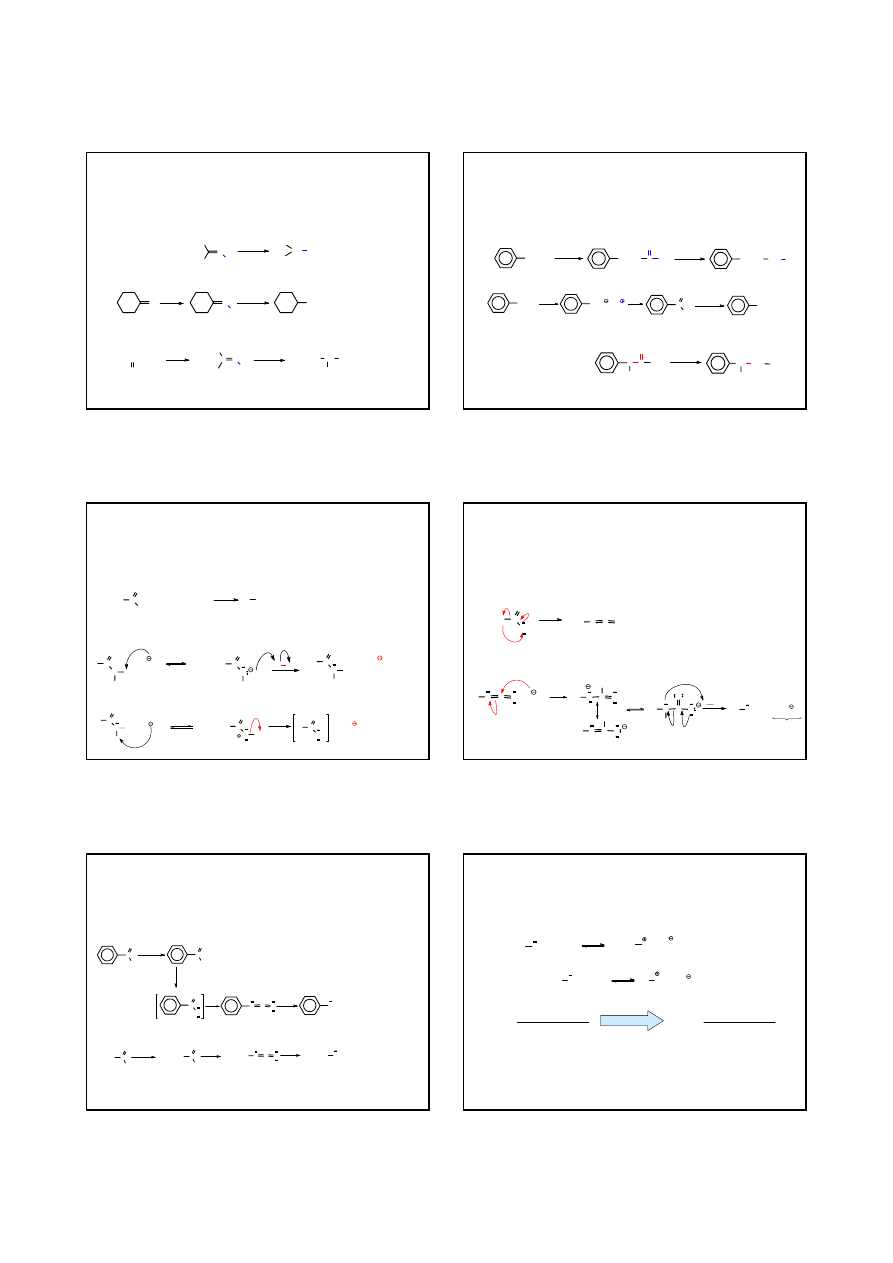
3
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja oksymów
PRZYKŁADY
cykloheksanon
cykloheksyloamina
2-butanon
sec
-butyloamina
H
3
C
H
3
C
N
OH
1.LiAlH
4
2. H
2
O
CH
3
CH
NH
2
CH
3
oksym acetonu
i
-propyloamina
CH
3
CCH
2
CH
3
O
NH
2
OH
CH
3
CH
2
C
H
3
C
N
OH
55%
Na, EtOH
CH
3
CH
2
CH CH
3
NH
2
NH
2
OH
O
N
OH
Na, EtOH
NH
2
60%
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja amidów
PRZYKŁADY
CH
2
NH
2
CH
3
COCl
TEA
CH
2
NH
C CH
3
O
1.LiAlH
4
2. H
2
O
CH
2
NH
CH
2
CH
3
N
-benzylo
acetamid
N
-
etylo
benzyloamina
N C
CH
3
O
CH
3
1.
LiAlH
4
2. H
2
O
NH CH
2
CH
3
CH
3
N
-metylo
acet
anilid
N
-etylo-
N
-metyloanilina
NH
3
COOH
COO
NH
4
∆
C
O
NH
2
1. LiAlH
4
2. H
2
O
C
H
2
NH
2
benz
amid
benzylo
amina
AMINY
OTRZYMYWANIE AMIN
METODY DEGRADACYJNE
przegrupowanie Hofmanna
R
C
O
NH
2
+
Br
2
+ NaOH
H
2
O
R
NH
2
+ 2Na
Br
+ Na
2
CO
3
+ 2H
2
O
MECHANIZM
R
C
O
N
H
H
+ OH
H
2
O +
R
C
O
N
H
Br Br
R
C
O
N
H
Br
+
Br
ETAP 1 – N-bromowanie amidu
AMID
N
-
BROMO
AMID
ETAP 2 – Eliminacja E
1,1
bromowodoru pod wpływem zasady
N
-
BROMO
AMID
NITREN
R
C
O
N
H
Br
+ OH
R
C
O
N
Br
H
2
O +
R
C
O
N
+
Br
ETAP 3 – Przegrupowanie grupy alkil/aryl z atomu węgla na atom azotu z deficytem elektronowym
NITREN
AMINY
OTRZYMYWANIE AMIN
METODY DEGRADACYJNE
przegrupowanie Hofmanna
R
C
O
N
R
N C O
IZOCYJANIAN
ETAP 4 – Hydroliza i dekarboksylacja izocyjanianu pod działaniem zasady
+ OH
R
N C O
R
N C O
OH
R
N C O
OH
R
N C O
O
H
H
OH
R
NH
2
CO
2
+ OH
+
HCO
3
-
AMINY
OTRZYMYWANIE AMIN
METODY DEGRADACYJNE
przegrupowanie Hofmanna
PRZYKŁADY
C
O
OH
1.SOCl
2
2. NH
3
C
O
NH
2
Br
2
NaOH
C
O
N
N C O
H
2
O
NaOH
NH
2
+ 2NaBr + Na
2
CO
3
+ 2H
2
O
KWAS BENZOESOWY
ANILINA
(CH
3
)
2
CH C
O
OH
1.SOCl
2
2. NH
3
(CH
3
)
2
CH C
O
NH
2
NaOH
Br
2
(CH
3
)
2
CH N C O
H
2
O
NaOH
(CH
3
)
2
CH NH
2
+ 2NaBr + Na
2
CO
3
+ 2H
2
O
KWAS 2-METYLOPROPANOWY
i-
PROPYLOAMINA
AMINY
WŁAŚCIWOŚCI AMIN
CH
3
CH
2
NH
2
+ H
2
SO
4
HSO
4
CH
3
CH
2
NH
3
ZASADOWOŚĆ AMIN – zdolność amin do wiązania protonu
odszczepionego od cząsteczki kwasu przez atom azotu
K =
[RNH
3
+
][HO
-
]
[RNH
2
][H
2
O]
K
b
=
[RNH
3
+
][HO
-
]
[RNH
2
]
[H
2
O]
≈ 1
p
K
b
= - log K
b
R
NH
2
H
2
O
+
+ HO
R
NH
3
K
4
AMINY
WŁAŚCIWOŚCI AMIN
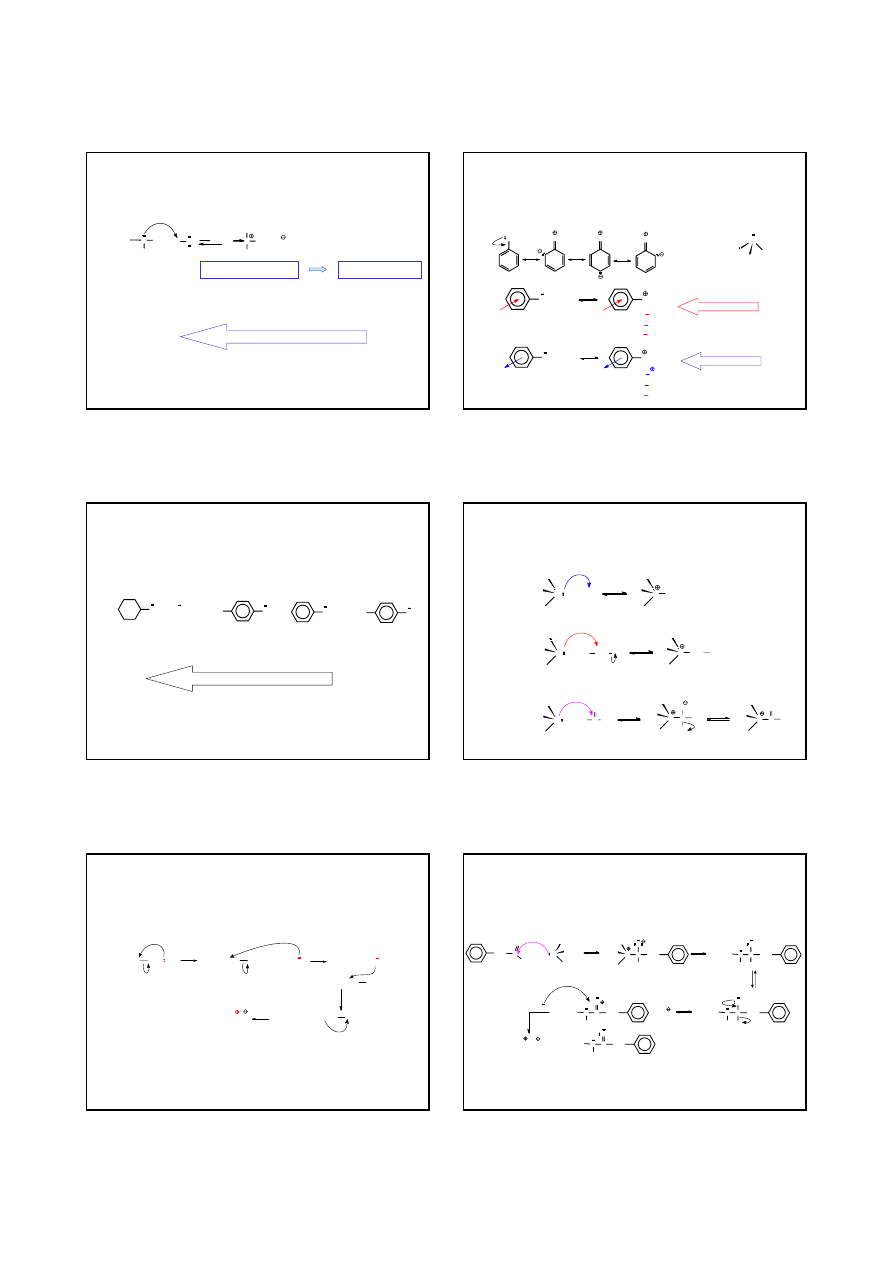
ZASADOWOŚĆ AMIN ALIFATYCZNYCH
R
N
H
H + H OH
R
N
H
H
H
+ OH
efekt +I grupy alkilowej
stabilizuje kation ammoniowy
FAZA GAZOWA
(CH
3
)
3
N (CH
3
)
2
NH CH
3
NH
2
NH
3
>
>
>
RNH
2
SILNIEJSZE ZASADY
OD AMONIAKU
ROZTWÓR WODNY
(CH
3
)
2
NH CH
3
NH
2
(CH
3
)
3
N NH
3
>
>
>
MOC ZASADY
pK
b
3.29
3.36
4.28
4.74
AMINY
WŁAŚCIWOŚCI AMIN
ZASADOWOŚĆ AMIN AROMATYCZNYCH
NH
2
NH
2
NH
2
NH
2
N
R
R
1
R
2
NH
2
G
+ H
+
G
NH
3
G: NH
2
OCH
3
CH
3
stabilizacja kationu
G: NH
3
NO
2
COOH
NH
2
G
+ H
+
G
NH
3
destabilizacja kationu
AMINY
WŁAŚCIWOŚCI AMIN
ZASADOWOŚĆ AMIN AROMATYCZNYCH
pK
b
3.38
4.74
8.70
9.42
13.0
>
>
>
>
NH
2
NH
3
O
2
N
NH
2
NH
2
CH
3
O
NH
2
ZASADOWOŚĆ AMINY
AMINY
REAKCJE AMIN
N
+ H
+
N
H
amina atakuje jako zasada
amina atakuje jako nukleofil w reakcjach alkilowania
S
N
amina atakuje jako nukleofil w reakcjach acylowania
S
Nacyl
N
+
N
CH
2
R
R CH
2
X
N
+
N
C R
O
R C Cl
O
N
C R
O
Cl
AMINY
REAKCJE AMIN
reakcje alkilowania
S
N
– przykłady
NH
3
S
N
2
CH
3
CH
2
CH
2
I +
CH
3
CH
2
CH
2
I
S
N
2
(CH
3
CH
2
CH
2
)
2
NH
CH
3
CH
2
CH
2
NH
2
+
CH
3
CH
2
CH
2
I
+
(CH
3
CH
2
CH
2
)
3
N
CH
2
CH
2
CH
3
I
S
N
2
S
N
2
(CH
3
CH
2
CH
2
)
4
N
I
jodek tetrapropyloammoniowy
AMINY
REAKCJE AMIN
reakcje acylowania
S
Nacyl
– przykłady
CH
2
C
Cl
O
+
N
CH
2
CH
3
H
H
N
CH
3
CH
2
C
CH
2
OH
Cl
H
N
CH
3
CH
2
H
H
C
CH
2
O
Cl
N
CH
3
CH
2
C
CH
2
OH
Cl
H
Cl
CH
3
CH
2
N
H
2
+
N
CH
3
CH
2
C
CH
2
O
H
H
CH
3
CH
2
N
H
3
Cl
+
N
CH
3
CH
2
C
CH
2
O
H
N
-etylofenyloacetamid
chlorek fenyloacetylu
5
dla amin aromatycznych
grupa
–NH
2
ZWIĘKSZA GĘSTOŚĆ ELEKTRONOWĄ W PIERŚCIENIU;
KIERUJE PODSTAWNIK W POZYCJĘ orto- LUB para-
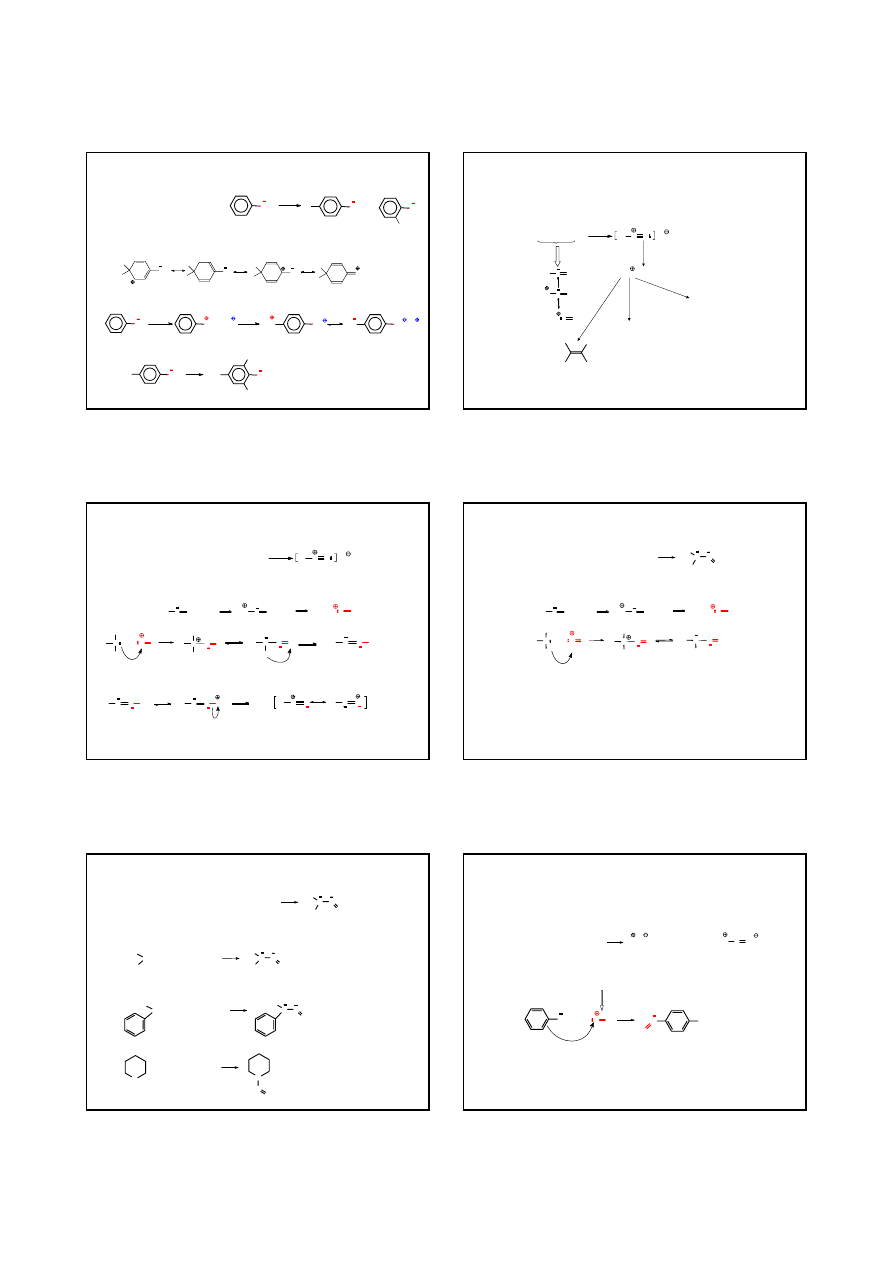
PRZYKŁADY
ANILINA
KWAS
p
-AMINO
BENZENO
SULFONOWY
KWAS SULFANILOWY
AMINY
REAKCJE AMIN
E
+
NH
2
NH
2
E
NH
2
E
+
H
2
SO
4
NH
2
∆
180-200°C
SO
3
Na
H
2
N
SO
3
H
3
N
NH
3
HSO
4
OH
-
NH
2
H
3
C
Br
2
NH
2
H
3
C
Br
Br
p-
TOLUIDYNA
2,6-DI
BROMO
-4-METYLO
ANILINA
NH
2
H
E
NH
2
H
E
NH
2
H
E
NH
2
H
E
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
1° aminy alifatyczne
R N N
Cl
+ NaCl + 2 H
2
O
HO
N
O
H
2
O
N
O
N
O
H
2
O +
R + N
2
S
N
Cl
-
R – Cl
S
N
H
2
O
R – OH
E
RNH
2
+ NaNO
2
+ 2 HCl
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
1° aminy aromatyczne
ArNH
2
+ NaNO
2
+ 2 HCl
Ar N N
Cl
+ NaCl + 2 H
2
O
0-5°C
chlorek arenodiazoniowy
sól stabilna w temp. 0–5 °C
MECHNIZM
H
2
O
N
O
HO
N
O + H
3
O
+
+ H
2
O
N
O
2 H
2
O +
Ar N
H
H
N O
- H
+
Ar N
H
H
O
N
Ar N
H
O
N
1° amina
aromatyczna
N
-nitrozoamina
tautom eria
Ar N
O
H
N
kwas fenylodiazowy
Ar N
O
H
N
+ H
+
Ar N
O
H
2
N
Ar N
N
H
2
O +
Ar N
N
kation arenodiazoniowy
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
2° aminy
MECHNIZM
H
2
O
N
O
HO
N
O + H
3
O
+
+ H
2
O
N
O
2 H
2
O +
Ar N
H
R
N O
- H
+
Ar N
H
R
O
N
Ar N
R
O
N
2° amina
N
-nitrozoamina
N
-nitrozoamina
RR'NH + NaNO
2
+ 2 HCl
R
N
R'
N
O
+ NaCl + H
2
O
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
2° aminy
N
-nitrozoamina
PRZYKŁADY
+ NaNO
2
+ 2 HCl
H
3
C
N
H
3
C
N
O
+ NaCl + H
2
O
H
3
C
NH
H
3
C
N
-nitrozodimetyloamina
N
-nitrozo-N-metyloanilina
N
-metyloanilina
dimetyloamina
piperydyna
N
-nitrozopiperydyna
RR'NH + NaNO
2
+ 2 HCl
R
N
R'
N
O
+ NaCl + H
2
O
+ NaNO
2
+ 2 HCl
+ NaCl + H
2
O
H
3
C
NH
H
3
C
N N
O
N
H
+ NaNO
2
+ 2 HCl
N
N
O
+ NaCl + H
2
O
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
3° aminy
R
3
N N O
2 R
3
N + NaNO
2
+ 3 HCl
+ NaCl + H
2
O +
R
3
NH Cl
Cl
ALE
N(CH
3
)
2
N O
N(CH
3
)
2
N
O
SE
8°C, 90%
NaNO
2
+ HCl
p
-nitrozo-N,N-dimetyloanilina
gdy co najmniej jeden podstawnik jest fenylem
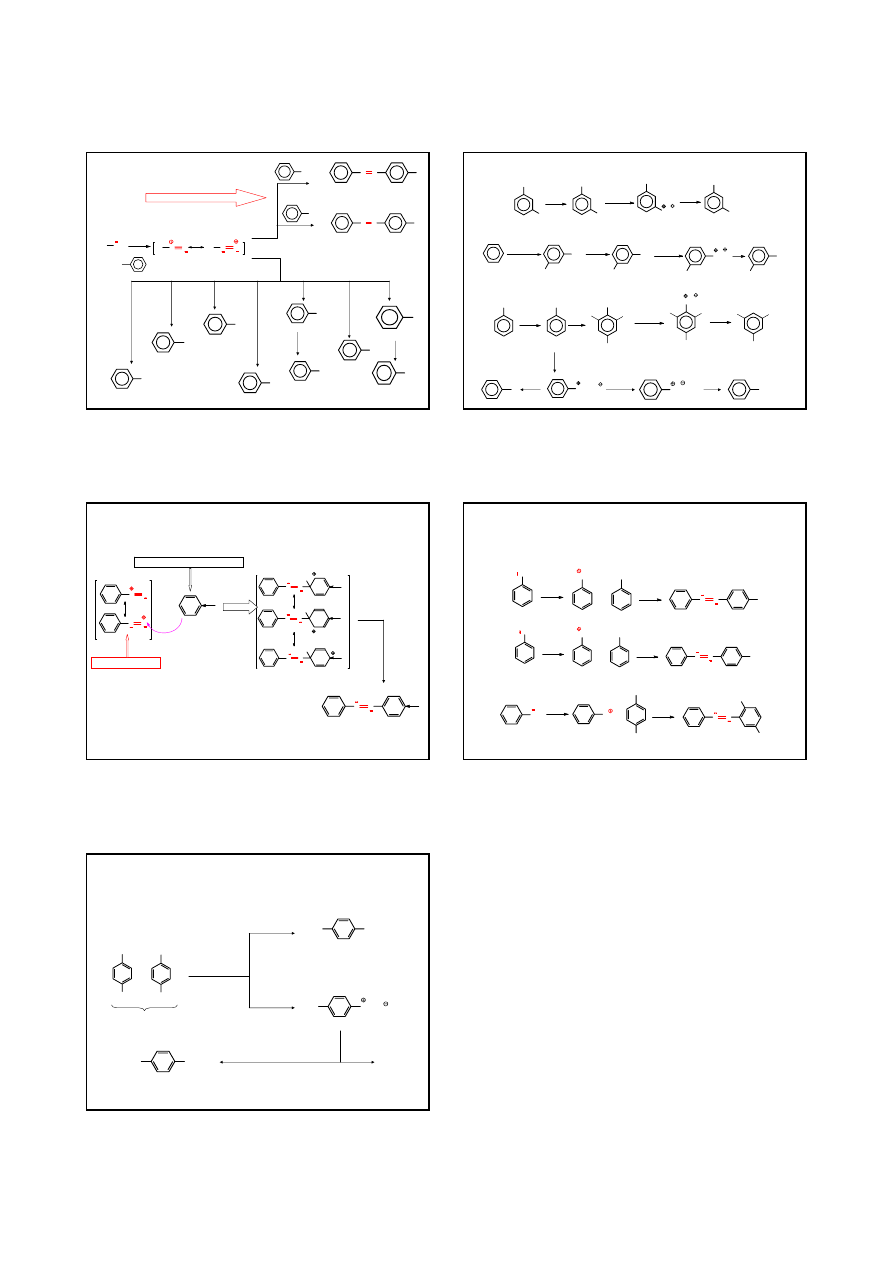
6
REAKCJE SOLI DIAZONIOWYCH
Ar
NH
2
HNO
2
0-5°C
Ar
N
N
Ar
N
N
–N
2
∆, H
2
O
OH
FENOL
dla Ar =
CuCl
Cl
CHLOROBENZEN
CuBr
KI
Br
BROMOBENZEN
I
JODOBENZEN
CuCN
H
3
O
+
CN
BENZONITRYL
COOH
KWAS
BENZOESOWY
H
3
PO
2
H
NaBF
4
N
2
+
BF
4
-
∆
F
FLUOROBENZEN
NH
2
OH
REAKCJE SPRZĘGANIA
p
-(fenyloazo)fenol
N N
OH
p
-(fenyloazo)anilina
N N
NH
2
REAKCJE SOLI DIAZONIOWYCH
REAKCJE Z WYDZIELANIEM SIĘ AZOTU – PRZYKŁADY
HNO
3
/H
2
SO
4
∆
NO
2
O
2
N
NH
3
/H
2
S
C
2
H
5
OH
NH
2
O
2
N
NaNO
2
/HCl
H
2
O, 0-5°C
N
2
Cl
O
2
N
∆
OH
O
2
N
Br
NO
2
1. Sn/HCl
2. OH
-
Br
NH
2
NaNO
2
/HCl
H
2
O, 0-5°C
Br
N
2
Cl
∆
CuCl
Br
Cl
m
-
bromo
chloro
benzen
m
-
bromo
nitro
benzen
m
-dinitrobenzen
m
-nitrofenol
NO
2
1. Sn/HCl
2. OH
-
NH
2
NaNO
2
/HCl
H
2
O, 0-5°C
∆
H
3
PO
2
Br
2
NH
2
Br
Br
Br
N
2
Cl
Br
Br
Br
Br
Br
Br
anilina
1,3,5-tri
bromo
benzen
NaNO
2
/H
2
SO
4
N
2
HSO
4
KI,
∆
I
jodo
benzen
fluoro
benzen
∆
F
HBF
4
N
2
BF
4
REAKCJE SOLI DIAZONIOWYCH
REAKCJE
BEZ
WYDZIELANIA AZOTU, tzw. SPRZĘGANIA
N
N
N
N
SŁABY ELEKTROFIL
G
–NH
2
, –NHR, –NR
2
–OH
G:
‘AKTYWOWANY’ PIERŚCIEŃ NA S
E
N
N
H
G
N
N
H
G
N
N
H
G
S
Earom
G
N
N
– H
+
ZWIĄZEK AZOWY
REAKCJE SOLI DIAZONIOWYCH
REAKCJE
BEZ
WYDZIELANIA AZOTU, tzw. SPRZĘGANIA – PRZYKŁADY
N
2
NH
2
NaNO
2
/HCl
0-5°C
+
OH
CH
3
0°C
NaOH/H
2
O
N
N
HO
CH
3
p
-krezol
4-metylo-2-(fenyloazo)fenol
N
2
NH
2
NaNO
2
/HCl
0-5°C
+
OH
0°C
NaOH/H
2
O
OH
N
N
p
-(fenyloazo)fenol
(oranż)
N
2
NH
2
NaNO
2
/HCl
0-5°C
+
N(CH
3
)
2
0°C
CH
3
COO
-
/H
2
O
N(CH
3
)
2
N
N
N,N-
dimetylo-p-(fenyloazo)anilina
(żółta, tzw. żółcień masłowa)
N,N-
dimetyloanilina
chlorek benzenodiazoniowy
ROZDZIELANIE MIESZANIN ZWIĄZKÓW NITROWYCH I AMIN
NH
2
CH
3
NO
2
CH
3
+
1.
HCl/H
2
O
2.
eter etylowy
WARSTWA ETEROWA
WARSTWA WODNA
NO
2
CH
3
NH
3
Cl
CH
3
NH
2
CH
3
1.
NaOH/H
2
O
2.
eter etylowy
WARSTWA ETEROWA
WARSTWA WODNA
NaCl
MIESZANINA ZWIĄZKÓW
CHEMICZNYCH
Wyszukiwarka
Podobne podstrony:
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
ZP wyklad1 id 592604 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
or wyklad 1 id 339025 Nieznany
II Wyklad id 210139 Nieznany
cwiczenia wyklad 1 id 124781 Nieznany
BP SSEP wyklad6 id 92513 Nieznany (2)
MiBM semestr 3 wyklad 2 id 2985 Nieznany
algebra 2006 wyklad id 57189 Nieznany (2)
olczyk wyklad 9 id 335029 Nieznany
Kinezyterapia Wyklad 2 id 23528 Nieznany
AMB ME 2011 wyklad01 id 58945 Nieznany (2)
AWP wyklad 6 id 74557 Nieznany
PRAWO SPORTOWE Wyklady(1) id 38 Nieznany
AGH Wyklad 4 id 52883 Nieznany (2)
więcej podobnych podstron