Alkany
1
Alkany
Alkany (łańcuchowe węglowodory nasycone, parafiny od łac. parum affinis – mało reaktywne) — organiczne
związki chemiczne zbudowane wyłącznie z atomów węgla i wodoru, przy czym atomy węgla połączone są ze sobą
wyłącznie wiązaniami pojedynczymi.
Według obowiązującej systematyki IUPAC łańcuchy atomów węgla w cząsteczkach alkanów mogą być zarówno
ogólny wzór sumaryczny alkanów ma postać C
n
H
2n+2
.
Grupa alkanów, uszeregowana według długości łańcucha węglowego, stanowi szereg homologiczny alkanów.
Rodzaje łańcuchów alkanów
Alkany zawierające więcej niż trzy atomy węgla mogą tworzyć wiele różnych izomerów konstytucyjnych,
różniących się rozgałęzieniami łańcuchów węglowych.
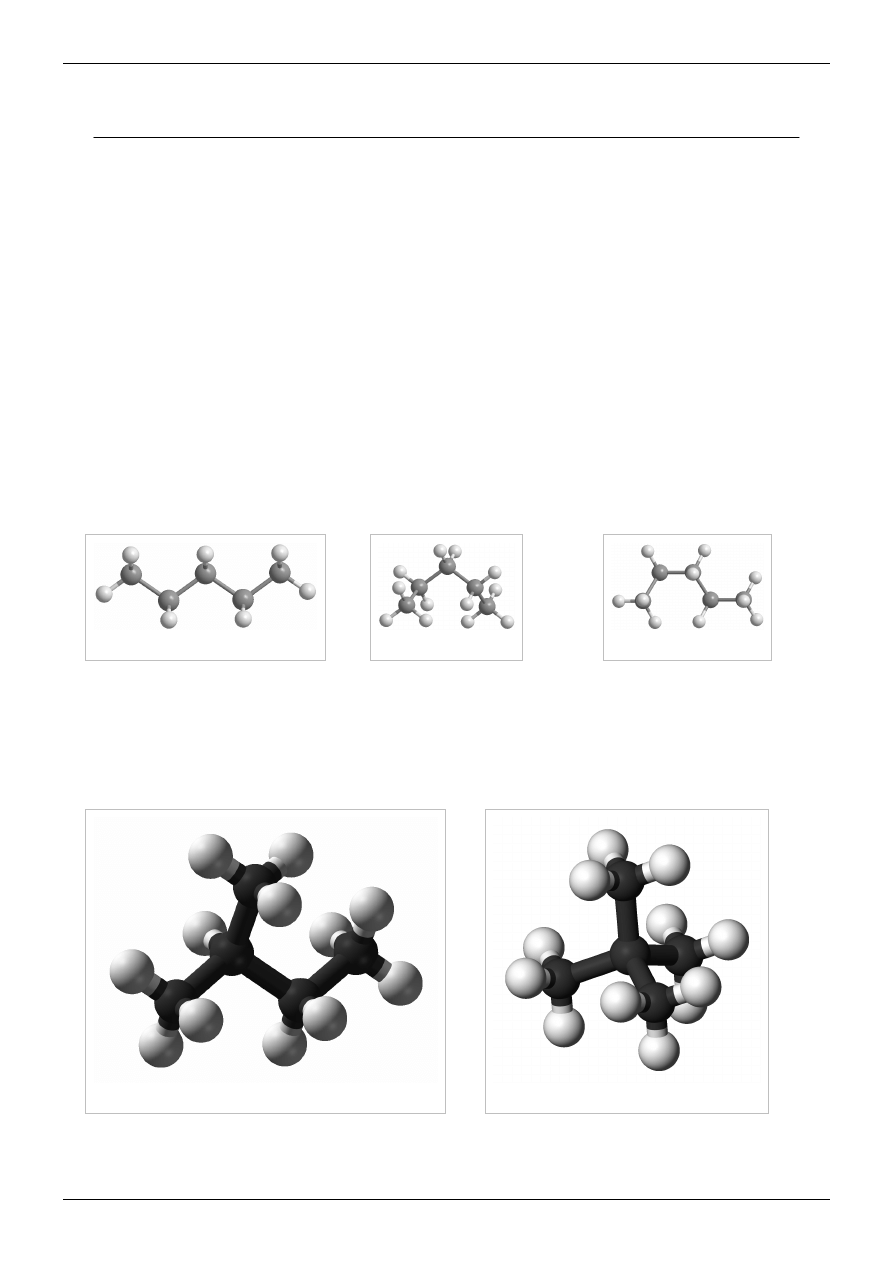
Łańcuchy proste
Atomy węgla tworzą jeden, nierozgałęziony łańcuch, na którego obydwu końcach znajdują się grupy metylowe.
Przykład dla pięciu atomów węgla – izomery konformacyjne n-pentanu:
n-pentan trans-gauche
Łańcuchy rozgałęzione
Co najmniej jeden z atomów węgla jest związany z więcej niż dwoma innymi atomami węgla, cała cząsteczka
zawiera więcej niż dwie grupy metylowe.
Przykłady dla pięciu atomów węgla – rozgałęzione izomery konstytucyjne pentanu:
Alkany
2
Liczba istniejących izomerów konstytucyjnych węglowodorów o łańcuchach rozgałęzionych rośnie bardzo szybko
wraz z liczbą atomów węgla tworzących cząsteczkę. W powyższym przykładzie alkanów zawierających 5 atomów
węgla, są to 3 izomery: n-pentan, izopentan i neopentan. Proste obliczenia kombinatoryczne (stabelaryzowane w
OEIS) pozwalają wyznaczyć teoretyczną liczbę takich izomerów konstytucyjnych dla dowolnej liczby atomów
węgla
[1]
. Przykładowo:
• C
6
H
14
ma 5 izomerów konstytucyjnych (wraz z liniowym n-heksanem)
• C
10
H
22
• C
16
H
34
(heksadekan) ma 10359 izomerów
• C
39
H
80
(nonatriakontan) ma 23647478933969 izomerów
• C
100
H
202
39
izomerów
W praktyce część izomerów jest jednak niestabilna.
Łańcuchy cykliczne
Zgodnie z systematyką IUPAC, cząsteczki zawierające łańcuchy cykliczne (cykloalkany, nazywane czasem
alkanami cyklicznymi) formalnie nie należą do alkanów.
Właściwości
Alkany są słabo rozpuszczalne w wodzie (rozpuszczalność rzędu kilkudziesięciu miligramów na litr), rozpuszczają
się w rozpuszczalnikach organicznych. Są mało reaktywne ze względu na dużą trwałość wiązań C-C i C-H. Podobne
właściwości do alkanów mają również cykloalkany (z wyjątkiem cyklopropanu i cyklobutanu, które są nietrwałe z
powodu silnych naprężeń w małych pierścieniach ich cząsteczek).
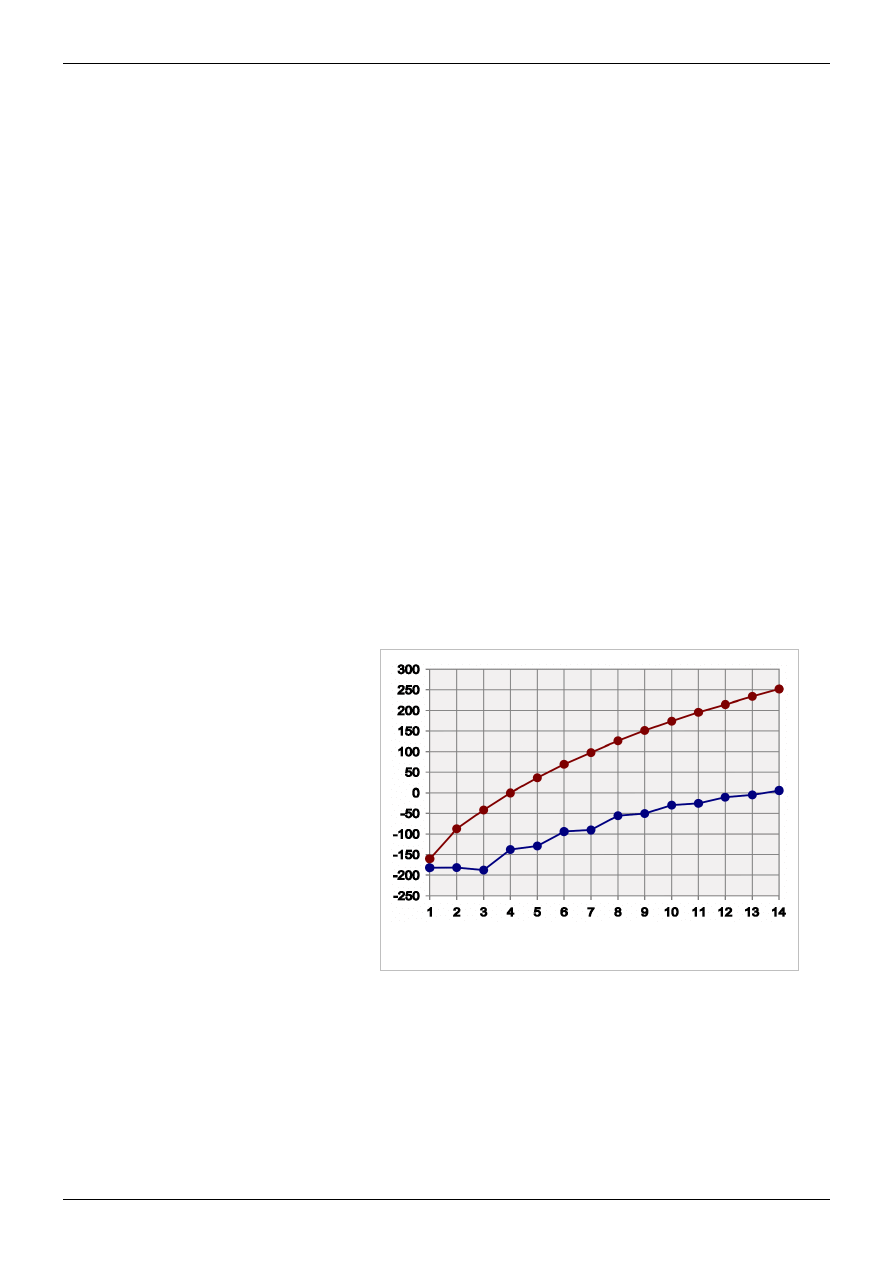
Stany skupienia
Temperatury topnienia (kolor niebieski) oraz wrzenia (czerwony) w °C dla
pierwszych czternastu alkanów prostych pod ciśnieniem atmosferycznym.
W zależności od temperatury oraz ciśnienia
każdy z alkanów może być gazem, cieczą
lub ciałem stałym. Temperatury przejść
fazowych pomiędzy tymi stanami skupienia
dla pierwszych czternastu alkanów o
łańcuchach prostych przedstawia rysunek.
Jak widać, temperatura wrzenia tych
związków rośnie monotonicznie ze
wzrostem długości łańcucha (liczby atomów
węgla), natomiast temperatura topnienia
rośnie monotonicznie począwszy od
Spośród alkanów i cykloalkanów o tej samej
liczbie atomów węgla, temperatura wrzenia
cykloalkanu jest wyższa, niż odpowiedniego
alkanu liniowego, natomiast temperatury wrzenia alkanów o łańcuchach rozgałęzionych są niższe, niż alkanu
liniowego. Można to wytłumaczyć istnieniem „zamrożonych” stopni swobody cząsteczek cyklicznych oraz
zależnością sił van der Waalsa od efektywnej powierzchni cząsteczek, która w przypadku cząsteczek liniowych jest
większa, niż dla cząsteczek rozgałęzionych
[2]
.
Spośród alkanów liniowych cieczami w warunkach normalnych są związki zawierające od 5 do 13 atomów węgla,
zaś w warunkach standardowych od 5 do 17 atomów węgla. Alkany liniowe lżejsze od pentanu (a zatem zawierające
od 1 do 4 atomów węgla są gazami zarówno w warunkach normalnych, jak i standardowych. Alkany liniowe

Alkany
3
zawierające 14 i więcej atomów węgla (warunki normalne) lub 18 i więcej (warunki standardowe) są ciałami
stałymi.
Najważniejsze reakcje
Nazwa węglowodory nasycone wynika z faktu pełnego wysycenia atomów węgla wiązaniami pojedynczymi, co
odróżnia je od węglowodorów nienasyconych, posiadających wiązania podwójne i/lub potrójne.
Ze względu na dużą trwałość pojedynczych wiązań C-C i C-H alkany są mało reaktywnymi związkami
chemicznymi, a reakcje z ich udziałem wymagają drastycznych warunków (wysoka temperatura i ciśnienie).
Generalnie wyróżnia się cztery typy reakcji, którym ulegają alkany:
• spalanie
• spalanie całkowite – produkty spalania to dwutlenek węgla i para wodna (woda); na przykładzie metanu:
CH
4
+ 2O
2
→ CO
2
+ 2H
2
O
• półspalanie – produkty spalania to tlenek węgla i para wodna (woda); na przykładzie etanu:
2C
2
H
6
+ 5O
2
→ 4CO + 6H
2
O
• spalanie niecałkowite – produkty spalania to para wodna (woda), sadza (węgiel (pierwiastek)); na przykładzie
butanu:
2C
4
H
10
+ 5O
2
→ 8C + 10H
2
O
• halogenowanie wolnorodnikowe (substytucja) – powstają dzięki niej pochodne alkanów np.
CH
4
+ Cl
2
→ CH
3
Cl + HCl – reakcja metanu z chlorem, w wyniku której powstaje chlorometan i
• piroliza prowadząca do zmniejszenia długości łańcuchów węgla w cząsteczkach oraz do ich izomeryzacji.
Reakcje te mają duże znaczenie praktyczne przy produkcji paliw ciekłych (→ kraking, reforming).
Nazewnictwo alkanów
Nazwa alkanu składa się z trzech części: przedrostka, rdzenia i przyrostka.
• przedrostek – lokant podstawnika
• rdzeń – liczba atomów węgla w łańcuchu głównym.
• przyrostek – właściwy dla danego szeregu homologicznego. Dla alkanów jest to „-an”
Etapy nazywania alkanu
1. Wyszukanie macierzystego związku.
• Znajdź najdłuższy łańcuch węglowy.
• Jeżeli dwa różne łańcuchy mają identyczną długość, wybierz ten w którym jest więcej rozgałęzień.
2. Numeracja w łańcuchu głównym:
• Numerujemy od końca najbliższego pierwszemu rozgałęzieniu.
• Jeżeli rozgałęzienia występują w równej długości od końców to numerujemy od końca bliższego drugiemu
rozgałęzieniu.
3. Określenie i numeracja podstawników:
• Każdy podstawnik oznaczamy zgodnie z miejscem przyłączenia do łańcucha głównego.
• Jeżeli do danego atomu węgla są przyłączone dwa lub więcej podstawników to przypisujemy im tą samą cyfrę.
4. Zapis nazwy związku
• Podstawniki podajemy w kolejności alfabetycznej.
1. Przy nazwach typu „izo-” (np izobutyl) pierwszą literą jest „i”
Alkany
4
2. Przy nazwach typu iBU pierwszą literą jest „b”
• Całą nazwę zapisz w postaci jednego słowa.
1. Do rozdzielenia przyrostów użyj łączników „-”.
2. Do rozdzielenia cyfr użyj przecinka „,”
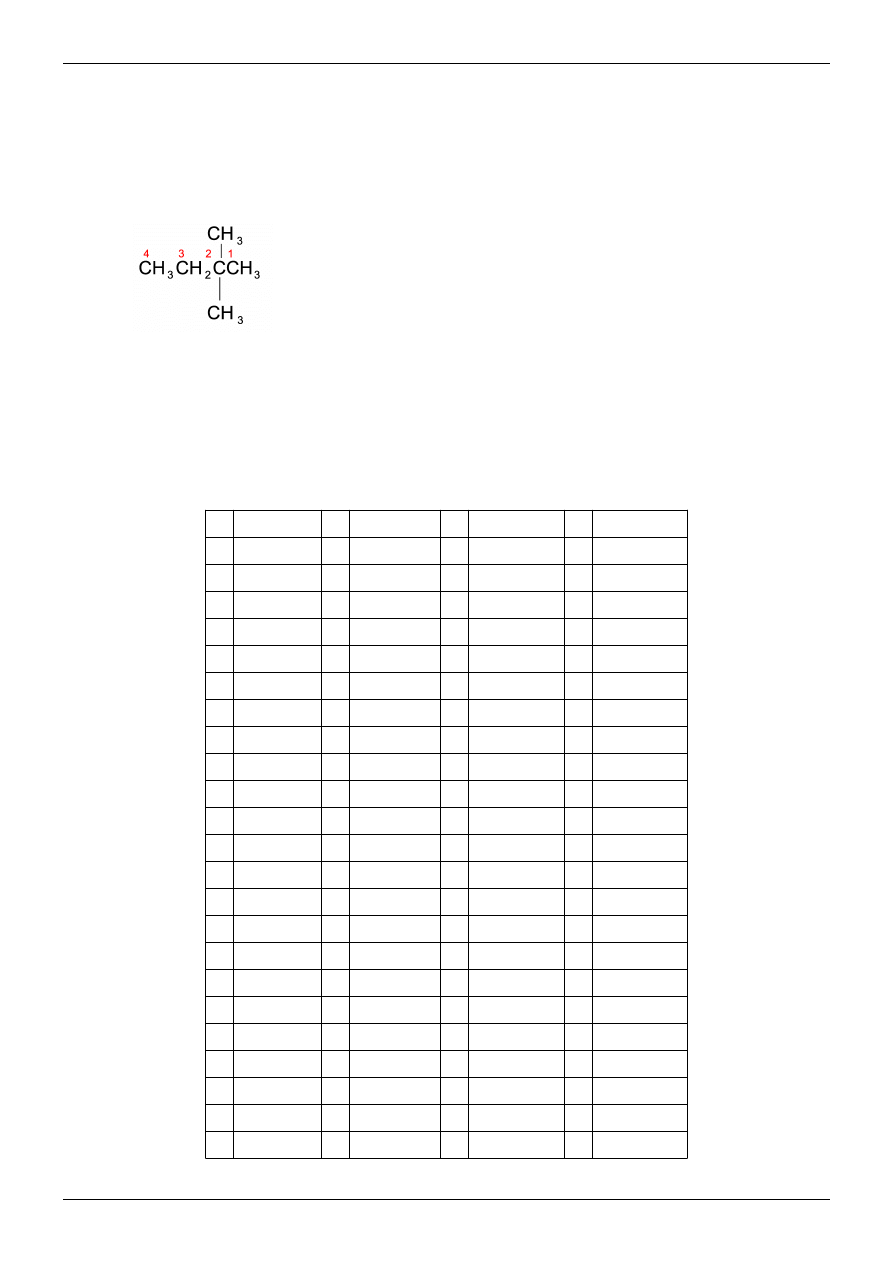
Przykład: 2,2-dimetylobutan
• „2,2” – lokanty podstawników. Dwa podstawniki są przy tym samym węglu, dlatego przypisujemy im tą samą
cyfrę
• „di” – ilość podstawników danego rodzaju przy konkretnym węglu („di-”, „tri-”, „tetra-”)
• „metylo” – nazwa podstawników. W tym wypadku są to grupy metylowe
• „butan” – nazwa alkanu, który ma tyle samo atomów węgla ile łańcuch główny
Przykładowe nazwy alkanów
l.p. Nazwa alkanu l.p. Nazwa alkanu l.p.
Nazwa alkanu
l.p.
Nazwa alkanu
1
26
51
henpentakontan
76
heksaheptakontan
2
27
52
dopentakontan
77
heptaheptakontan
3
28
53
tripentakontan
78
oktaheptakontan
4
29
54
tetrapentakontan
79
nonaheptakontan
5
30
55
pentapentakontan 80
oktakontan
6
31
56
heksapentakontan 81
henoktakontan
7
32
57
heptapentakontan 82
dooktakontan
8
33
58
oktapentakontan
83
trioktakontan
9
34
59
nonapentakontan
84
tetraoktakontan
10
35
60
heksakontan
85
pentaoktakontan
11
36
61
henheksakontan
86
heksaoktakontan
12
37
62
doheksakontan
87
heptaoktakontan
13
38
63
triheksakontan
88
oktaoktakontan
14
39
64
tetraheksakontan
89
nonaoktakontan
15
40
65
pentaheksakontan 90
nonakontan
16
41
hentetrakontan
66
heksaheksakontan 91
hennonakontan
17
42
dotetrakontan
67
heptaheksakontan 92
dononakontan
18
43
tritetrakontan
68
oktaheksakontan
93
trinonakontan
19
44
tetratetrakontan
69
nonaheksakontan
94
tetranonakontan
20
45
pentatetrakontan 70
heptakontan
95
pentanonakontan
21
46
heksatetrakontan 71
henheptakontan
96
heksanonakontan
22
47
heptatetrakontan 72
doheptakontan
97
heptanonakontan
23
48
oktatetrakontan
73
triheptakontan
98
oktanonakontan

Alkany
5
24
49
nonatetrakontan
74
tetraheptakontan
99
nonanonakontan
25
50
pentakontan
75
pentaheptakontan 100 hektan
Przypisy
[1] The On-Line Encyclopedia of Integer Sequences (http:/
(
)
. [dostęp 2010-10-04].
[2] R. T. Morrison, R. N. Boyd: Organic Chemistry. Wyd. VI. New Jersey: Prentice Hall, 1992. ISBN 0-13-643669-2.
Linki zewnętrzne

Źródła i autorzy artykułu
6
Źródła i autorzy artykułu
Alkany Źródło: http://pl.wikipedia.org/w/index.php?oldid=25327612 Autorzy: A-nobel-S, Adrian.s6, Andre Engels, Arek1979, Argentum, Ataleh, BartekChom, Beno, BlackPhoton, Buldożer,
Chemmix, Companicus, Dude, Dwimenor, EMeczKa, Filip em, Franek13, Fraximus, Gregul, Harkew, Hashar, Hqb, Interfector, Jarekt, Joa, KES47, Kacka, Karol007, Kereish, Kocio,
Kosiarz-PL, Koń, Kpjas, Krisofis, Litawor, Makawity, Marcin Suwalczan, Marraskuu, Masur, Michał Sobkowski, Monopol, Nitrogenium, NólanisMorna, Pawmak, Polimerek, S99, Saper, Stepa,
Stok, Taw, Tescobar, Udev, Wilczekpl, Wostr, Yarl, Yarpen Zirgin, conversion script, prosie3.acn.pl, 52 anonimowych edycji
Źródła, licencje i autorzy grafik
Image:N-Pentane conformation trans trans.png Źródło: http://pl.wikipedia.org/w/index.php?title=Plik:N-Pentane_conformation_trans_trans.png Licencja: Public Domain Autorzy:
User:Balabinrm
Image:N-Pentane conformation gauche(+) gauche(+).png Źródło: http://pl.wikipedia.org/w/index.php?title=Plik:N-Pentane_conformation_gauche(+)_gauche(+).png Licencja: Public
Domain Autorzy: User:Balabinrm
Image:N-Pentane conformation trans gauche.png Źródło: http://pl.wikipedia.org/w/index.php?title=Plik:N-Pentane_conformation_trans_gauche.png Licencja: Public Domain Autorzy:
User:Balabinrm
Image:Isopentane-3D-balls.png Źródło: http://pl.wikipedia.org/w/index.php?title=Plik:Isopentane-3D-balls.png Licencja: Public Domain Autorzy: Benjah-bmm27
Image:Neopentane-3D-balls.png Źródło: http://pl.wikipedia.org/w/index.php?title=Plik:Neopentane-3D-balls.png Licencja: Public Domain Autorzy: Benjah-bmm27, Dbc334
Plik:Alkanschmelzundsiedepunkt.svg Źródło: http://pl.wikipedia.org/w/index.php?title=Plik:Alkanschmelzundsiedepunkt.svg Licencja: Public Domain Autorzy: User:KES47
Plik:2,2-dimetylobutan.svg Źródło: http://pl.wikipedia.org/w/index.php?title=Plik:2,2-dimetylobutan.svg Licencja: Creative Commons Attribution-Sharealike 2.5 Autorzy: Edgar181, Hystrix,
MesserWoland
Licencja
Creative Commons Attribution-Share Alike 3.0 Unported
http:/
Document Outline
Wyszukiwarka
Podobne podstrony:
Alkany (2)
Alkany(2)
Alkany 3 id 57982 Nieznany (2)
Alkany, Szkoła
ściągi chemia szereg homologiczny alkany, alkeny, alkiny
I ALKANY
ALKANY
alkany i spółka b dobree notatki
Alkany i cykloalkany(1)
alkany liniowe
Alkany
Alkany nie reag, CHEMIA, Chemia organiczna
Alkany 2
2 Alkany
Alkany (1)
alkany alkeny alkiny id 57988 Nieznany
Alkany, alkeny, alkiny i SE do aromatu
alkany
Alkany, sciągi, chemia
więcej podobnych podstron