
ALKANY I
CYKLOALKANY

Chemia organiczna
-
chemia związków węgla
z wyłączeniem węgla pierwiastkowego i jego
nieorganicznych pochodnych, takich jak
CO
,
CO
2
,
H
2
CO
3
,
węglany
,
mocznik
czy
węgliki
.

Alkany
– węglowodory nasycone (związki węgla i wodoru posiadają tylko
wiązania pojedyncze,
sigma
s
) o ogólnym wzorze
C
n
H
2n+2
(n - liczba naturalna).
Alkany tworzą szereg homologiczny (związki różniące się liczbą grup –CH
2
-).
Związki należące do szeregu homologicznego to
homologi
, np. metan, etan,
propan, butan, pentan, heksan, heptan, oktan, itd..
CH
4
metan
CH
3
CH
2
H
etan
CH
3
CH
2
CH
2
H
CH
3
CH
2
CH
2
CH
2
H
propan
butan
CH
3
CH
2
CH
2
CH
2
CH
2
H
pentan
homologi
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
H
heksan

Źródła alkanów
●
ropa naftowa (różnorodność alkanów, od gazowych poprzez ciekłe do stałych);
●
gaz ziemny (metan –
gaz suchy
(90%), metan + etan + propan + butan –
gaz mokry
);
●
łupki bitumiczne (wydobywa się je przez wytlewanie);
●
produkty wytlewania węgla (niskotemperaturowa piroliza węgla kopalnego -
proces technologiczny polegający na ogrzewaniu węgla bez dostępu powietrza
w temperaturze 450-700
o
C);
●
synteza chemiczna.
Zastosowanie alkanów
Alkany C
1
-C
2
– składniki gazu ziemnego stosowane jako paliwo, w przemyśle
chemicznym do produkcji wodoru, nawozów sztucznych i w gospodarstwach
domowych do ogrzewania budynków.
Alkany C
3
-C
4
– składniki ciekłego gazu napędowego (LPG), stosowane jako gaz
nośny w rozpylaczach.
Alkany C
5
-C
8
– składniki benzyny.
Alkany C
9
-C
16
–
składniki nafty, paliwa lotniczego i oleju napędowego.
Mieszaniny alkanów C
16
-C
34
– oleje smarowe, a C
20
-C
34
– wosk parafinowy.

Właściwości fizyczne alkanów
- nierozpuszczalne w wodzie (właściwości hydrofobowe);
- dobrze rozpuszczalne w niepolarnych i słabo polarnych rozpuszczalnikach;
- gęstość ok. 0,7 g/cm
3
;
- temperatura wrzenia wzrasta wraz ze wzrostem liczby atomów węgla w
cząsteczce;
izo
-alkany mają niższe temp. wrzenia niż odpowiednie alkany
nierozgałęzione;
- temperatura topnienia wzrasta wraz ze wzrostem liczby atomów węgla w
cząsteczce, także zależna od kształtu łańcucha węglowego;
w miarę wzrostu masy cząsteczkowej różnice temp. top. maleją.
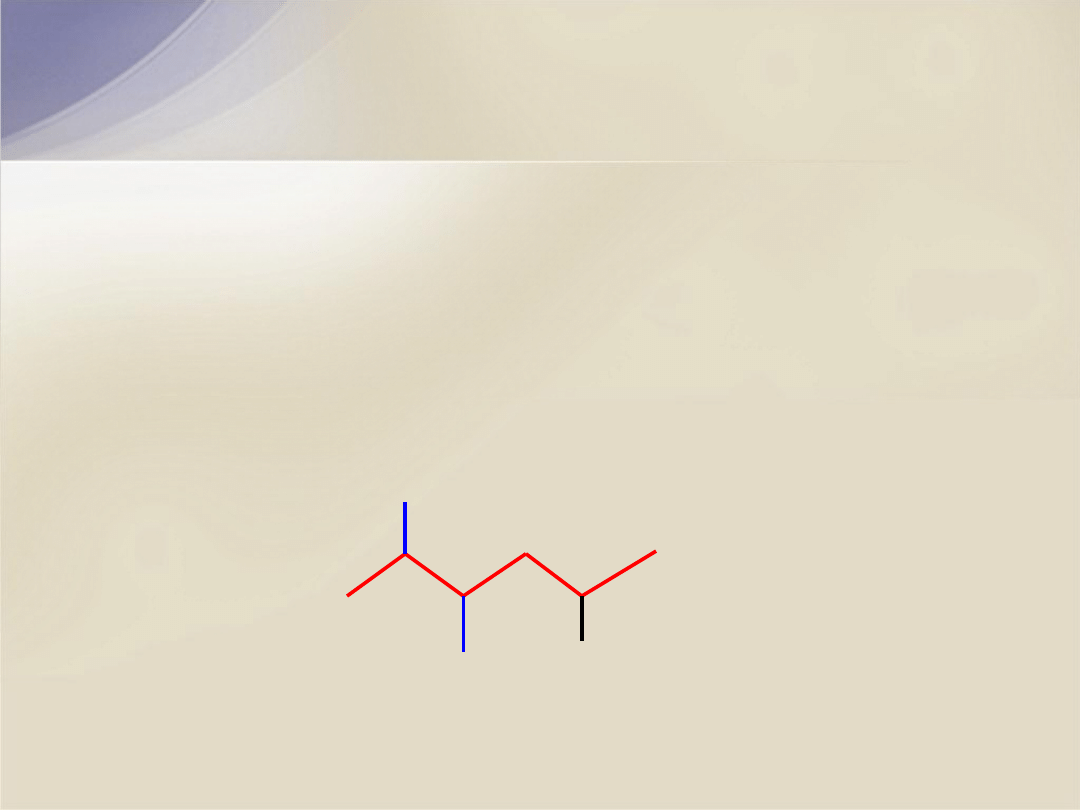
CH
4
metan
CH
3
CH
3
etan
CH
3
CH
2
CH
3
CH
3
CH
2
CH
2
CH
3
propan
butan
(CH
3
)
2
CH
izobutan
temp. wrz.
temp. top.
- 161
o
C
- 89
o
C
- 42
o
C
- 0,5
o
C
- 10,2
o
C
- 182
o
C
- 183
o
C
- 188
o
C
- 138
o
C
- 160,9
o
C
Nomenklatura
IUPAC
–
I
nternational
U
nion of
P
ure
and
A
pplied
C
hemistry
OH
4,5-dimetylo
heksan
-2-
ol
6
1
5
4
3
2
miejsce (lokant), liczba
i nazwa podstawników
Przedrostek
-
Rdze
ń
-
Przyrostek
nazwa
łańcucha
głównego
lokanty i symbole grup
funkcyjnych

1. Identyfikacja najdłuższego łańcucha (łańcuch główny), który będzie
podstawą nazwy rdzenia.
2. Zasada najniższego zestawu lokantów; lokanty - liczby określające
położenie podstawników w łańcuchu głównym.
3. Podstawniki w łańcuchu głównym wymienia się w kolejności alfabetycznej.
4. Jeżeli podstawniki są połączone z tym samym atomem węgla to muszą
mieć przyporządkowany taki sam lokant.
5. Jeżeli w łańcuchu głównym znajdują się dwa lub więcej takich samych
podstawników, to po wymienieniu lokantów należy podać ich liczbę
przedrostkiem: di, tri, tetra, penta, itd..
Ustalanie nazwy
CH
3
-CH
2
-CH
2
-CH
2
-CH
3
CH
2
CH
3
CH
2
CH
2
CH
3
7
6
5
4
3
2
1
5-etylo-4-metyloheptan
nieprawidłowa nazwa
CH
3
-CH
2
-CH
2
-CH
2
-CH
3
CH
2
CH
3
CH
2
CH
2
CH
3
1
2
3
4
5
6
7
3-etylo-4-metyloheptan
prawidłowa nazwa
zestaw lokantów
3,4
4,5

6. Nazwę alkilu czyli reszty organicznej utworzonego przez formalne
„oderwanie” atomu wodoru, tworzy się z nazwy macierzystego alkanu
poprzez zamianę końcówki
an
na
yl
lub
il
(po spółgłoskach g, k, l)
CH
3
-
metyl
CH
3
CH
2
-
etyl
CH
3
CH
2
CH
2
-
propyl
CH
3
CH
2
CH
2
CH
2
-
butyl
CH
3
(CH
2
)
8
CH
2
-
de
c
yl
od de
k
anu
7. Dla prostych podstawników przyjęto nazwy bez lokantów:
CH
3
-CH-CH
3
izopropyl (
izo-Pr
)
CH
3
-CH-CH
2
CH
3
izobutyl (
izo-Bu
)
CH
3
-CH-CH
2
-CH
3
sec-butyl (
sec-Bu
lub
s-Bu
)
CH
3
-C
CH
3
CH
3
tert-butyl (
tert-Bu
)
CH
3
-CH-CH
2
-CH
2
CH
3
izopentyl
CH
3
-C
CH
3
CH
3
CH
2
neopentyl

CH
3
-CH
2
-CH-CH
2
-CH
2
-CH-CH
2
-CH
2
-CH-CH
2
-CH
2
-CH
2
-CH
2
-CH
3
C
1
3
2
3
4
1
2
2
1
14
13
12
11
10
9
8
7
6
5
H
3
C
CH
3
CH
3
CHCH
2
CH
3
CH
3
CH
2
CH
2
CHCH
3
CH
3
1
2
3
3-(1,1-dimetyloetylo)-6-(1-metylopropylo)-9-(3-metylobutylo)tetradekan
3-tert-butylo-6-sec-butylo-9-izopentylotetradekan
4

Otrzymywanie alkanów
Uwodornienie alkenów lub alkinów
Hydroliza związków Grignarda
+
+
Mg
CH
3
CH
2
Cl
CH
3
CH
2
MgCl
HOH
CH
3
CH
3
MgClOH
Et
2
O
chlorek etylu
chlorek etylomagnezu
etan
C
n
H
2n
+
H
2
kat. (Pt, Pd lub Ni)
C
n
H
2n+2
C
n
H
2n-2
+
2 H
2
C
n
H
2n+2
alken
alkin
alkan
alkan
kat. (Pt, Pd lub Ni)

Redukcja aldehydów i ketonów
Reakcja halogenków alkilowych z dialkilomiedzianami litu
Reakcja Würtza
(otrzymywanie alkanów o parzystej liczbie atomów węgla)
2 C
3
H
7
Li
+
Cul
(C
3
H
7
)
2
CuLi
C
6
H
13
Br
+
C
9
H
20
C
3
H
7
Li
+
LiBr
propylolit
dipropylomiedzian litu
jodek
miedzi(I)
nonan
2 CH
3
CH
2
CH
2
Br
1-bromopropan
n-heksan
+
2 Na
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
+
2 NaBr
(lub Li, K)
a/ redukcja Clemmensena
RCOR
'
+
Zn(Hg)
RCH
2
R
'
H
+
/HOH
b/ redukcja Wolffa-Kiżnera
RCOR
'
+
H
2
NNH
2
RCH
2
R
'
KOH
+
N
2
+
HOH

Alkany są mało reaktywne, mogą jednak reagować gwałtownie.
Reakcje alkanów:
1. spalanie
2. chlorowanie i bromowanie (wymagają inicjacji);
z fluorem reagują wybuchowo (nawet w ciemnościach i w niskich temp.)
3. nitrowanie
4. sulfonowanie
5. rozkładają się pod wpływem wysokiej temp. (piroliza, kraking, izomeryzacja).
Właściwości chemiczne alkanów
C
n
H
2n+2
+
O
2
(nadmiar)
nCO
2
+
(n+1) HOH
n-C
5
H
12
+
8 O
2
5 CO
2
+
6 HOH
Spalanie
- 3 538 kcal
Półspalanie
CH
4
+
O
2
+
HOH
2 CO
+
H
2
gaz syntezowy

Kraking termiczny
Hydrokraking
Izomeryzacja
+
H
2
C
14
H
30
450
o
C
C
9
H
20
+
CH
4
+
C
2
H
6
+
C
3
H
8
+
.......
15 Mpa, kat. glinokrzem.
CH
3
(CH
2
)
5
CH
3
90-120
o
C
CH
3
CH C
H
3
C
H
3
C
CH
3
CH
3
2 Mpa, AlCl
3
n-heptan
2,2,3-trimetylobutan
450
o
C
RCH
2
CH
2
CH
2
CH
2
CH
3
np.
RCH
2
CH
3
+
CH
2
=CHCH
3
katalizator
glinokrzemianowy

Nitrowanie
Chlorosulfonowanie
Sulfoutlenianie
C
n
H
2n+1
CH
2
CH
2
C
m
H
2m+1
+
SO
2
+
0,5 O
2
25-30
o
C
C
n
H
2n+1
CHCH
2
C
m
H
2m+1
h
, 300 nm
kwas alkanosulfonowy
SO
3
H
CH
3
CH
2
CH
3
+ HNO
3
CH
3
CH
2
CH
2
NO
2
(
25%
)
CH
3
CHNO
2
CH
3
(
40%
)
CH
3
CH
2
NO
2
(
10%
)
CH
3
NO
2
(
25%
)
+
+
+
n-propan
Alk-H + SO
2
+ Cl
2
15-35
o
C
Alk-SO
2
Cl
80
o
C
NaOH/HOH
Alk-SO
2
Na
mersole
mersolany
(surfaktanty)
- HCl
Reakcje chlorowania i bromowania alkanów
Homoliza wiązania
Heteroliza wiązania
lub h
Cl
2
CH
4
CH
3
Cl
metan
chlorek
metylu
lub h
Cl
2
CH
2
Cl
2
chlorek
metylenu
lub h
Cl
2
CHCl
3
chloroform
lub h
Cl
2
CCl
4
tetrachlorek
w
ęgla
A
B
A
+
lub h
B
A
B
A
+
+
B
-
Energia dysocjacji (
Δ
H
o
)
–
minimalna energia potrzebna do rozerwania
wiązania. Może ona być dostarczona w postaci ciepła (odpowiednio wysokiej
temperatury) czy promieniowania, np. UV.
A-B
→
A
.
+ B
.
Energia
dysocjacji

Cl Cl
2 Cl
lub h
inicjacja
H
o
= + 58 kcal/mol
H
o
= - 58 kcal/mol
Cl
+
Cl
Cl Cl
CH
3
+
CH
3
CH
3
CH
3
Cl
+
CH
3
Cl
CH
3
chlorek metylu
etan
terminacja
H
o
= - 88 kcal/mol
H
o
= - 83,5 kcal/mol
Reaktywność halogenów
F
2
Cl
2
Br
2
l
2
Cl
+
CH
4
CH
3
+
HCl
rodnik metylowy
Cl
2
+
CH
3
+
CH
3
Cl
chlorek metylu
Cl
Cl
+
CH
4
CH
3
+
HCl
propagacja
itd

Szybkość reakcji halogenowania alkanów
zależy od rzędowości atomu węgla związanego z reagującym
atomem wodoru i rodzaju halogenu.
+
CH
3
CH
2
CH
3
propan
+
HBr
Br
2
h
CH
3
CH
2
CH
2
Br
CH
3
CHCH
3
Br
1-bromopropan
(
3%
)
2-bromopropan
(
97%
)
+
CH
3
CH
2
CH
3
propan
+
HCl
Cl
2
h
CH
3
CH
2
CH
2
Cl
CH
3
CHCH
3
Cl
1-chloropropan
(
45%
)
2-chloropropan
(
55%
)
W propanie atomy wodoru są nierównocenne, różnią się energią wiązania
C-H
(dla H
1
o
wynosi ona 98 kcal/mol, a dla H
2
o
wynosi 95 kcal/mol). Ta różnica
zwiększa szybkość wymiany atomu
H
2
o
na atom halogenu dlatego
1-halogenopropan powstaje z mniejszą wydajnością niż 2-halogenopropan.
Rzędowość atomu węgla
C
H
H
R
H
1
o
atom w
ęgla
C
R
H
R
H
2
o
atom w
ęgla
C
R
R
R
H
3
o
atom w
ęgla

+
CH
3
CHCH
3
izobutan
+
HCl
Cl
2
h
1-chloro-2-metylopropan
chlorek izobutylu
(
64%
)
2-chloro-2-metylopropan
chlorek tert-butylu
(
36%
)
CH
3
CH
3
CHCH
3
CH
2
Cl
CH
3
CCH
3
CH
3
Cl
izobutan
+
CH
3
CHCH
3
+
HBr
Br
2
h
1-bromo-2-metylopropan
bromek izobutylu
(
0,1%
)
2-bromo-2-metylopropan
bromek tert-butylu
(
99,9%
)
CH
3
CH
3
CHCH
3
CH
2
Br
CH
3
CCH
3
CH
3
Br
+
CH
3
CH
2
CH
2
CH
3
n-butan
+
HCl
Cl
2
h
CH
3
CH
2
CH
2
CH
2
Cl
CH
3
CHCH
2
CH
3
Cl
1-chlorobutan
(
28%
)
2-chlorobutan
(
72%
)
Brom jest znacznie mniej reaktywny niż chlor, dlatego bromowanie
alkanów biegnie z mniejszą szybkością, a przez to z większą
selektywnością niż chlorowanie.
+
CH
3
CH
2
CH
2
CH
3
n-butan
+
HBr
Br
2
h
CH
3
CH
2
CH
2
CH
2
Br
CH
3
CHCH
2
CH
3
Br
1-bromobutan
(
2%
)
2-bromobutan
(
98%
)
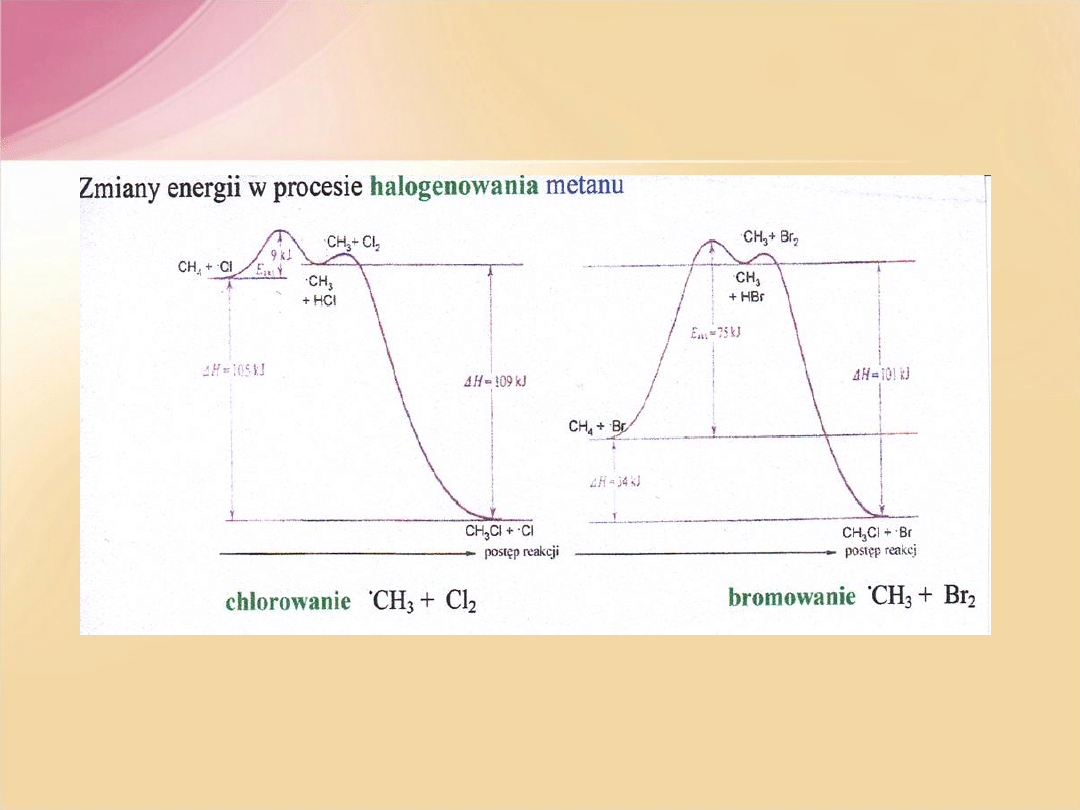
A. Kołodziejczyk,
Chemia Organiczna
, Gdańsk 2009;
http://www.pg.gda.pl/chem/Katedry/Organa/pl-main.htm
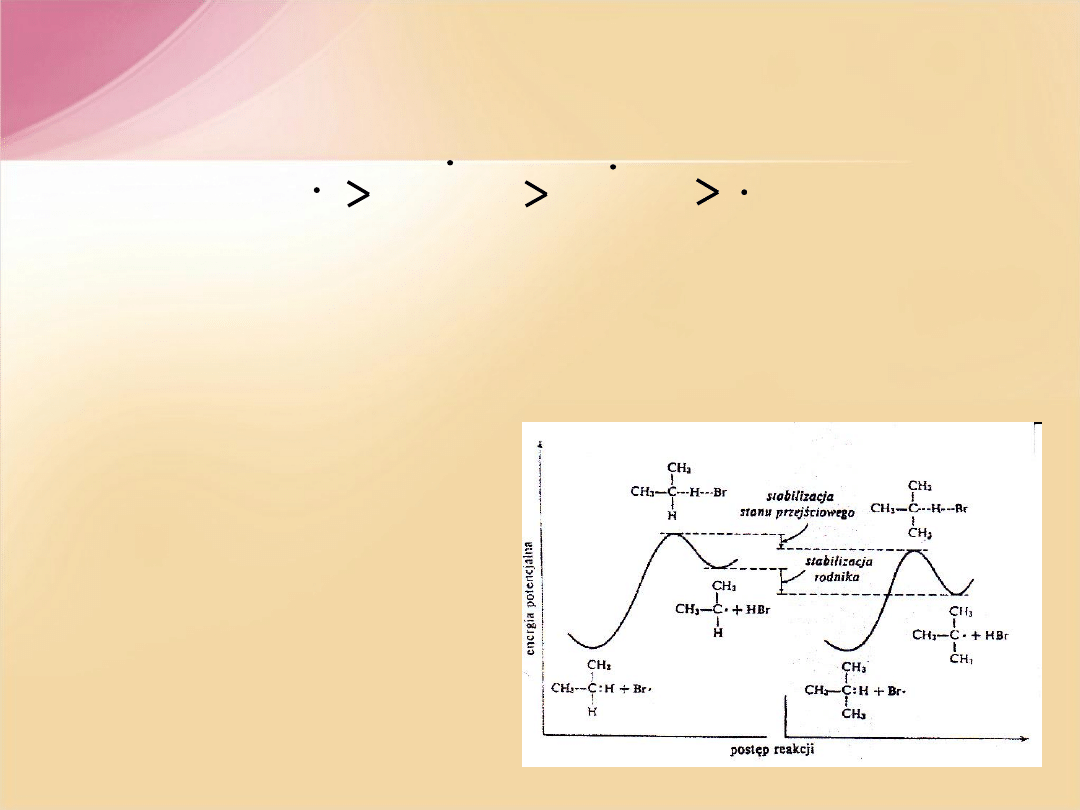
Wraz ze wzrostem rzędowości rośnie trwałość rodników. Rodniki obdarzone są
wysoką energią, a przez to są bardzo reaktywne. Reszty alkilowe związane z atomem
węgla posiadającym niesparowany elektron stabilizują go poprzez rozłożenie tej
energii w przestrzeni. Im więcej reszt alkilowych związanych z rodnikowym atomem
węgla tym rodnik jest stabilniejszy, trwalszy, szybciej się tworzy.
CH
3
R
3
C
R
2
CH
RCH
2
Trwałość rodników węglowych
W reakcjach z węglowodorami
obdarzony wysoką energią
rodnik
chloru
,może wyrwać równie łatwo atom
H
1
o
czy
2
o
, natomiast dla mniej
aktywnego
rodnika bromu
znacznie
łatwiejsze jest oderwanie atomu H
związanego z atomem o wyższej
rzędowości.
A. Kołodziejczyk,
Chemia Organiczna, Gdańsk 2009;
http://www.pg.gda.pl/chem/Katedry/Organa/pl-main.htm
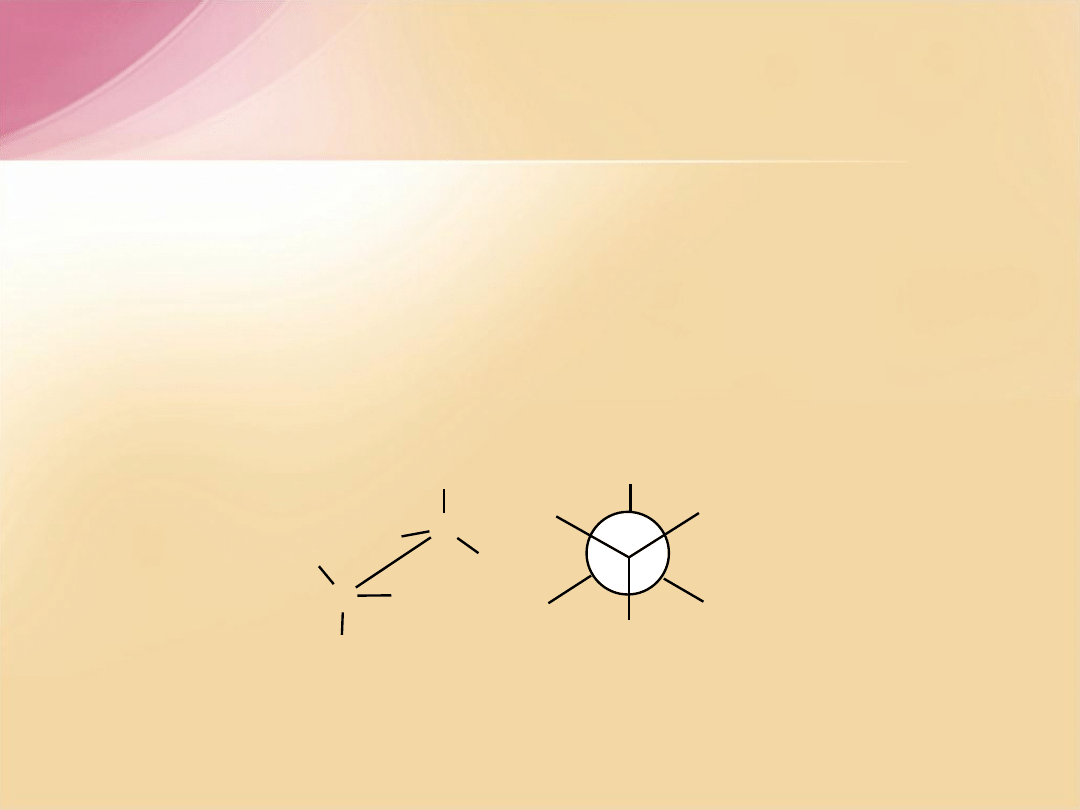
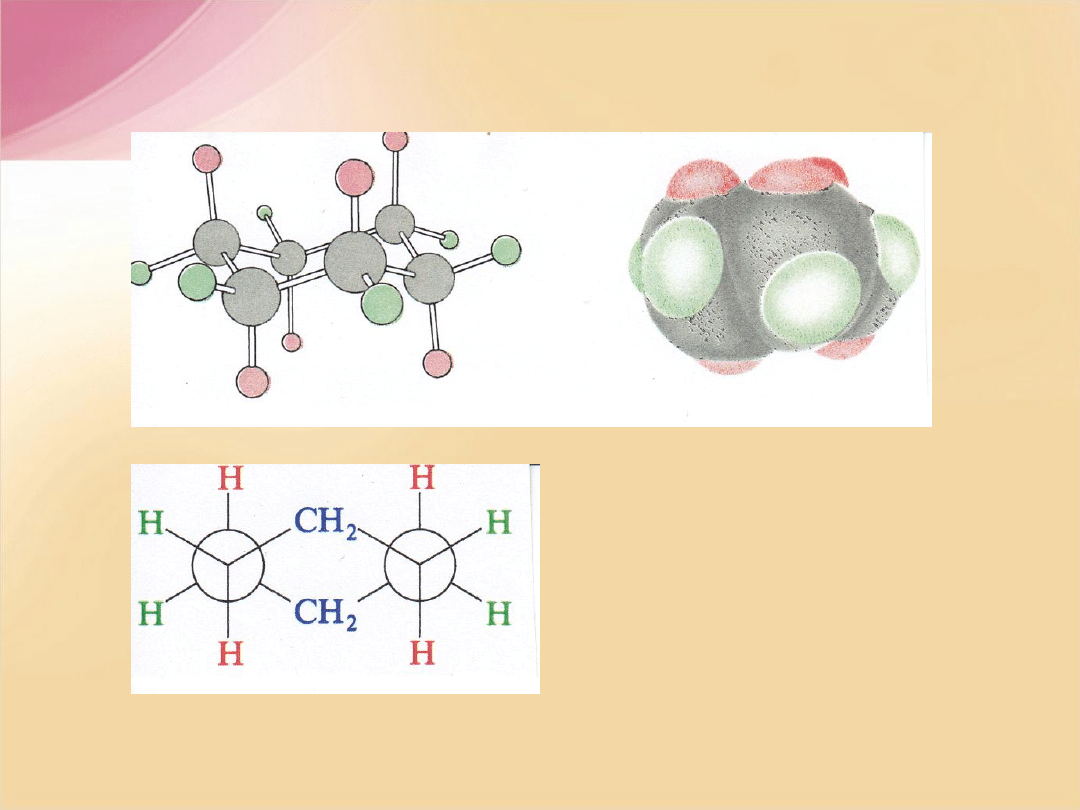
Konformacje alkanów
Konformacje –
przestrzenne ułożenie podstawników w przestrzeni
wynikające z obrotu wokół wiązania pojedynczego
s
.
Konformacja antiperiplanarna
(naprzemianległa)
- największe podstawniki
przy sąsiednich atomach węgla są najbardziej od siebie oddalone (najtrwalsza
konformacja). Kąt dwuścienny tworzony przez wiązania łączące rozpatrywane
podstawniki z atomami węgla wynosi 180
o
.
X
X
konformacja
antiperiplanarna
naprzemianleg
ła
C
C
X
H
H
X
H
H
=180
o
C
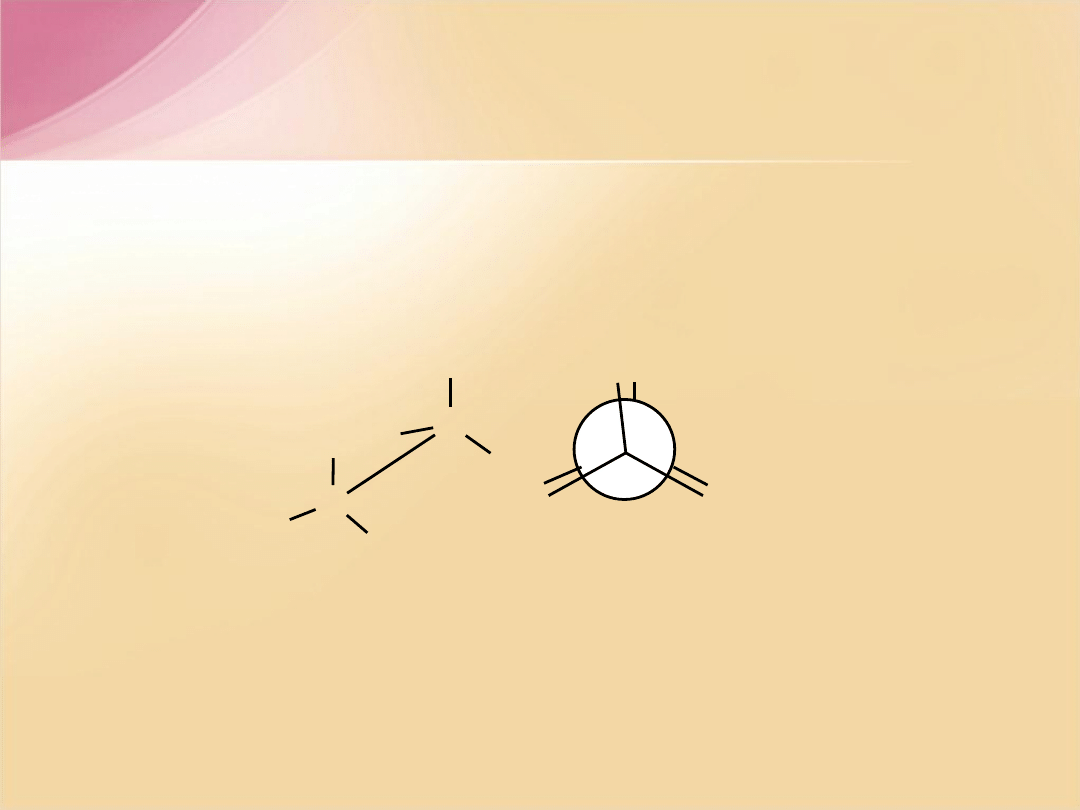
Konformacja synperiplanarna
(naprzeciwległa)
- największe podstawniki
przy sąsiednich atomach węgla znajdują się najbliżej siebie (najmniej trwała
konformacja). Kąt dwuścienny tworzony przez wiązania łączące rozpatrywane
podstawniki z atomami węgla wynosi 0
o
.
= 0
o
C
XX
konformacja
synperiplanarna
naprzeciwleg
ła
C
C
X
H
H
X
H
H
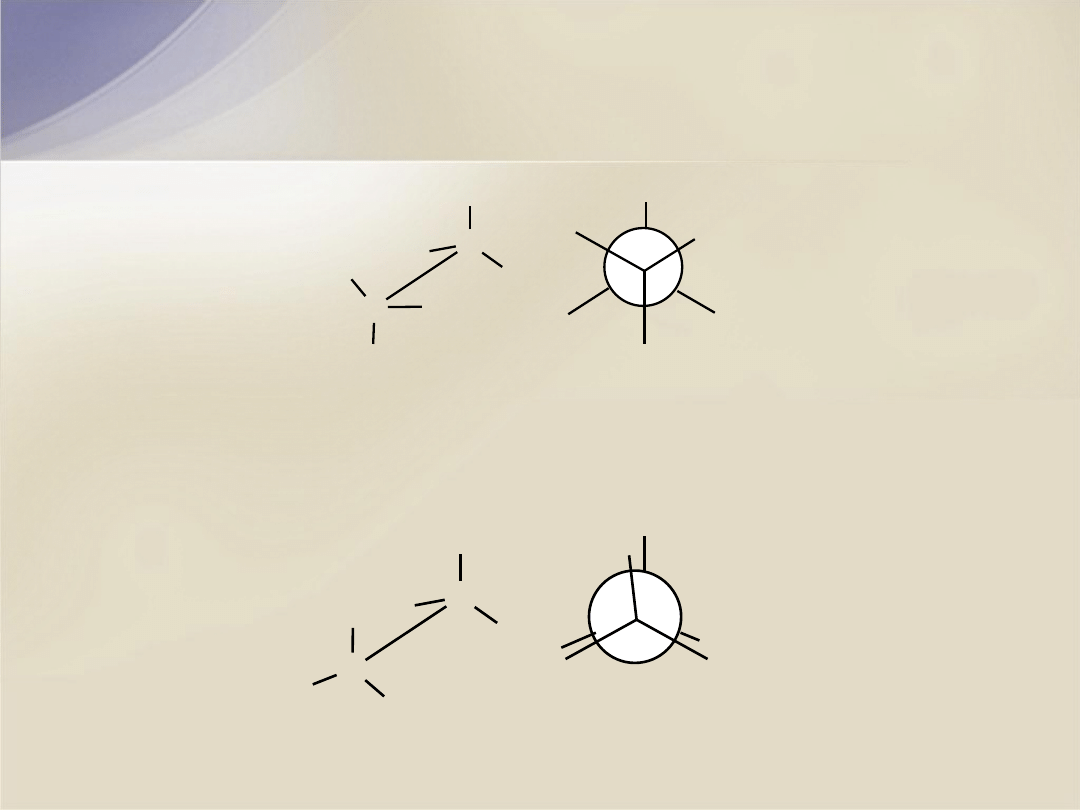
Konformacja antyklinalna
- konformacja, w której mniejsze podstawniki
leżą naprzeciwko największych.
Konformacja synklinalna
(skośna)
- konformacja, w której kąt dwuścienny
tworzony przez wiązania łączące największe podstawniki z atomami węgla wynosi 60
o
.
X
X
konformacja
synklinalna
sko
śna
C
C
H
H
X
X
H
H
= 60
o
C
X
X
konformacja
antyklinalna
C
C
X
H
H
H
H
X
Konformacje etanu
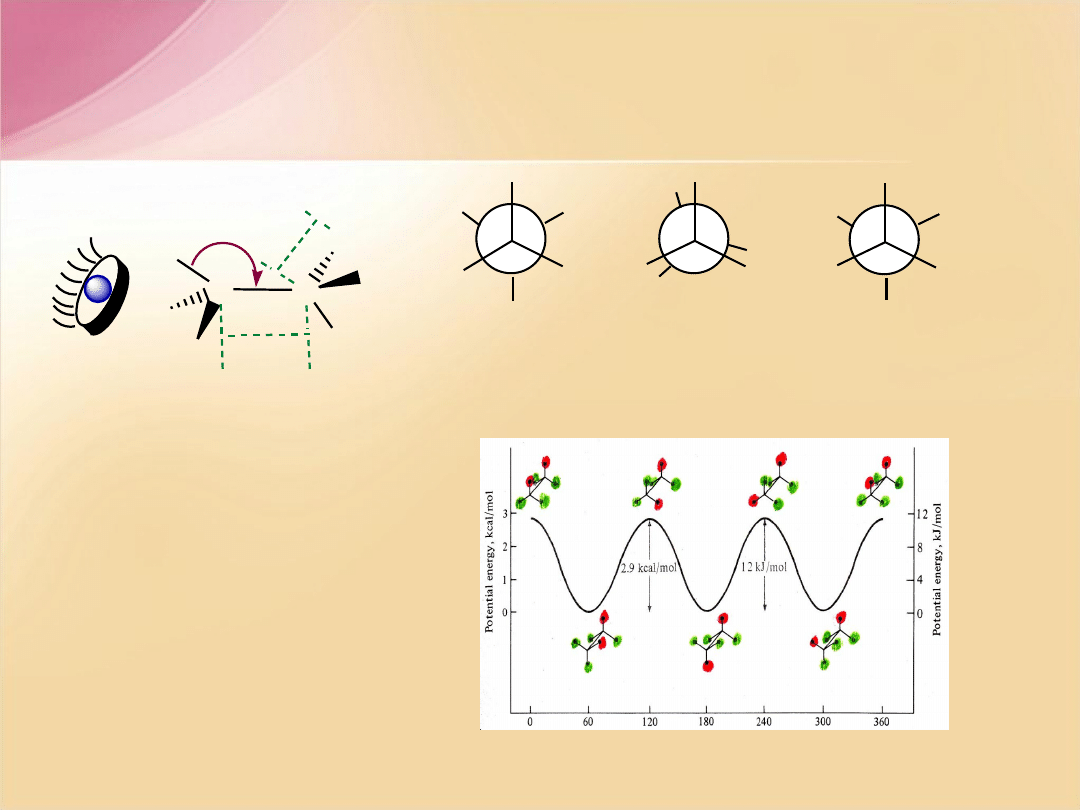
F.A. Carey, Organic Chemistry, 2nd ed, McGRAW-HILL, INC, New York 1992
Zmiany energii potencjalnej podczas
rotacji wokół wiązania C-C w etanie
C
C
H
H
H
H
H
H
1,54 A
1,
10
A
109,5
o
o
o
1
6
5
4
3
2
= 0
o
C
konformacja
synperiplanarna
naprzeciwleg
ła
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
konformacja
antiperiplanarna
naprzemianleg
ła
= 60
o
C
konformacja
naprzemianleg
ła
= 60
o
C
1
2
3
5
4
6
1
2
3
6
4
5
1
3
2
5
6
4
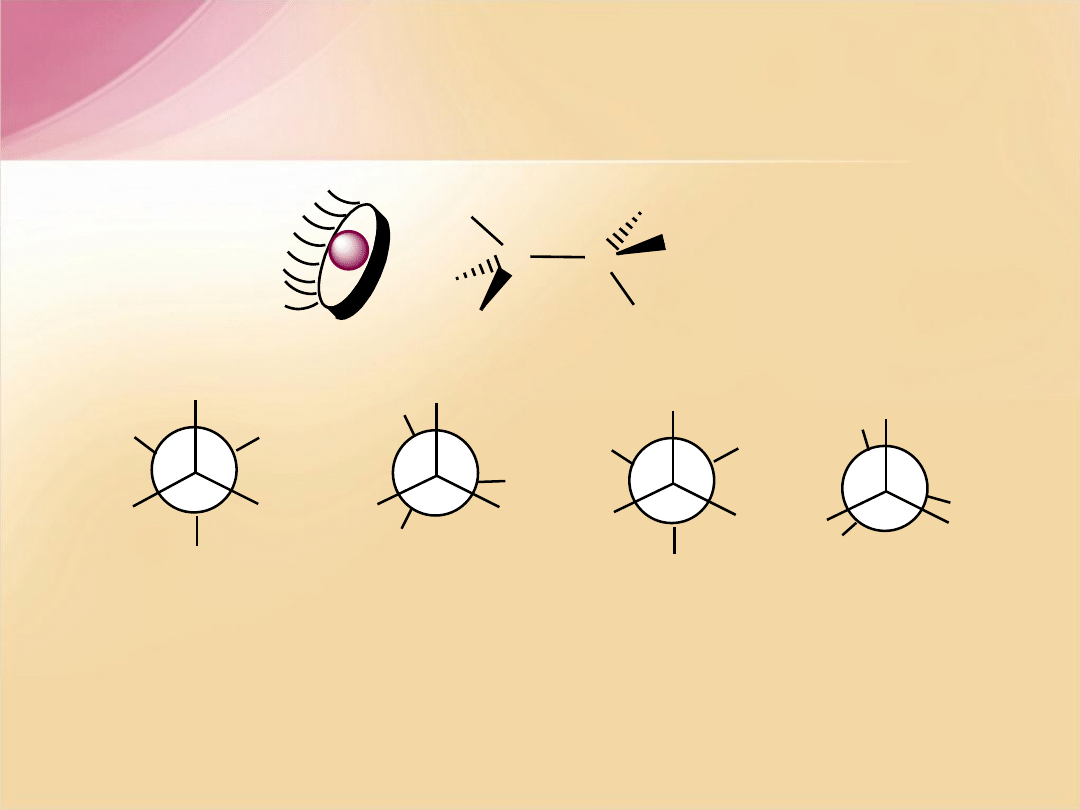
Konformacje butanu
konformacja
antiperiplanarna
naprzemianleg
ła
= 0
o
C
konformacja
synperiplanarna
naprzeciwleg
ła
= 180
o
C
konformacja
synklinalna
= 60
o
C
CH
3
H
H
H
H
CH
3
konformacja
antyklinalna
= 120
o
C
CH
3
H
H
H
H
H
3
C
CH
3
H
H
H
3
C
H
H
CH
3
H
H
H
3
C
H
H
C
C
H
H
3
C
H
H
CH
3
H
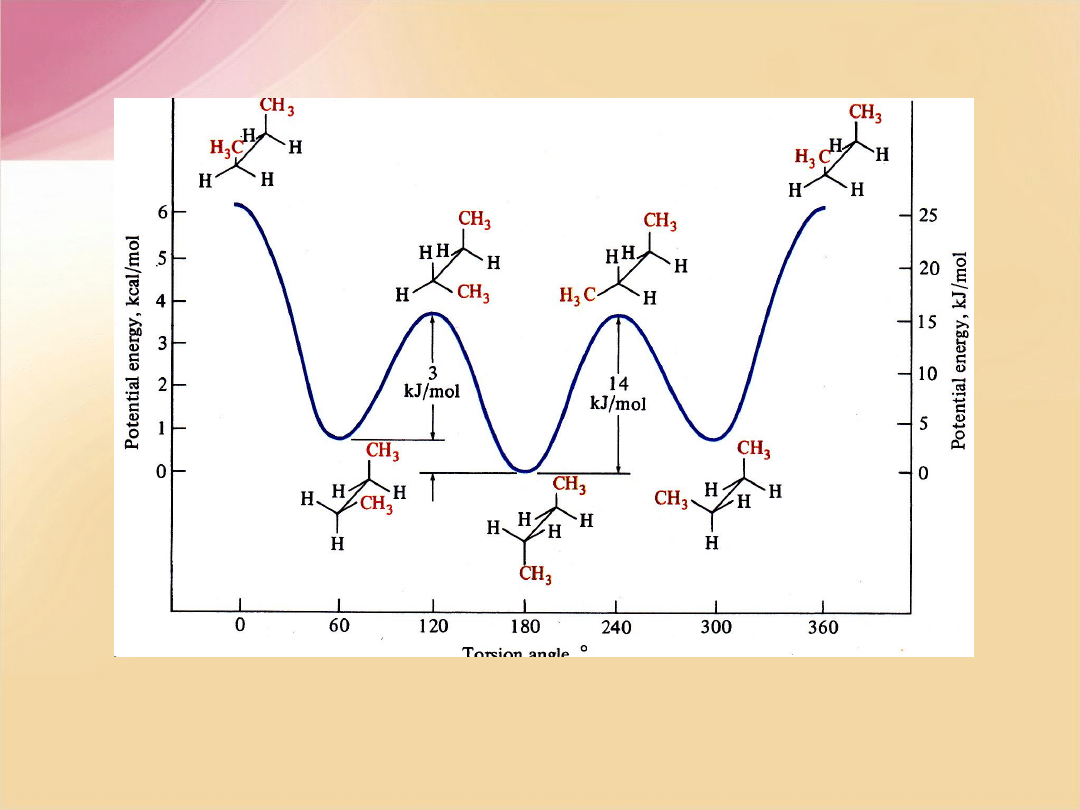
Zmiany energii potencjalnej podczas rotacji wokół wiązania C-C w butanie
F.A. Carey, Organic Chemistry, 2nd ed, McGRAW-HILL, INC, New York 1992
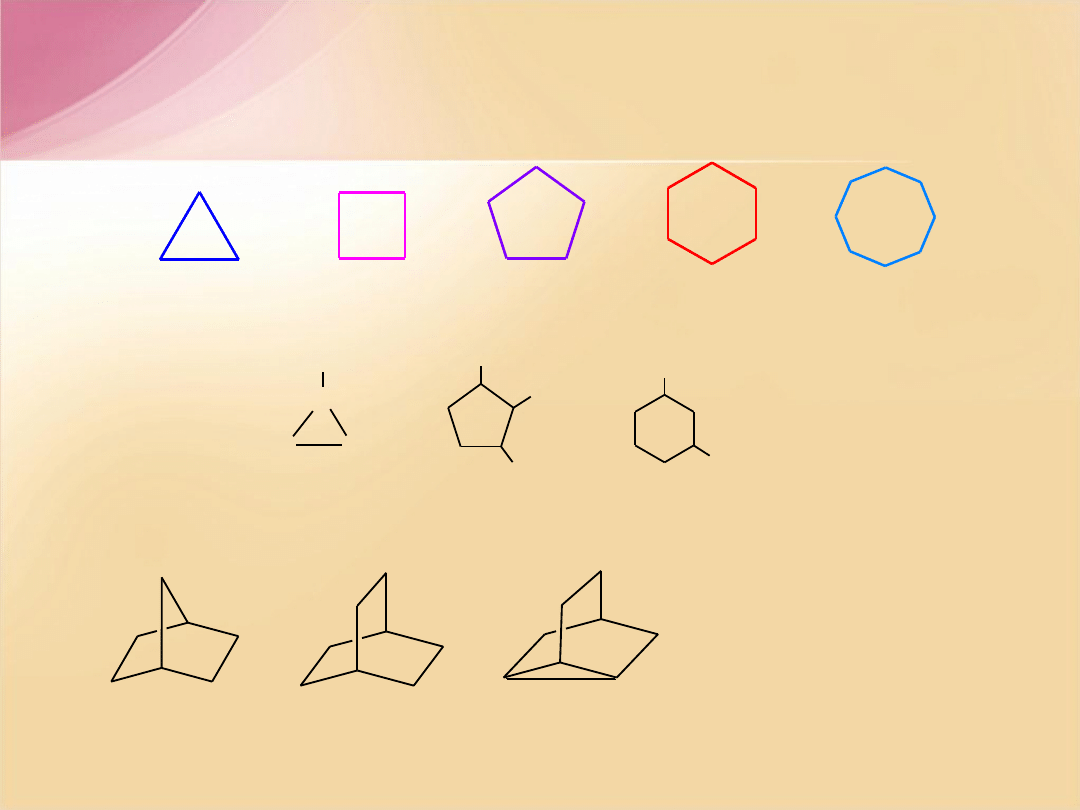
Cykloalkany
W nazwie podajemy liczbę pierścieni:
bicyklo-, tricyklo, idt. Następnie w
nawiasie kwadratowym podajemy liczbę
atomów węgla w poszczególnych mostkach
pomiędzy atomami przyczółkowymi, np.
[2.1.2] i nazwę rdzenia tworzącego
cząsteczkę.
H
2
C
CH
2
CH
2
CH
3
CH
CH
2
CH
3
CH
3
C
3
H
7
etylocyklopropan
1-etylo-2-metylo-3-
-propylocyklopentan
1-butylo-3-etylo-
cykloheksan
CH
2
CH
3
C
4
H
9
6
5
7
4
3
2
1
6
5
7
8
4
3
2
1
6
5
7
8
4
3
2
1
bicyklo[2.2.1]heptan bicyklo[2.2.2]oktan tricyklo[2.2.2.0
2,6
]oktan
cyklopropan cyklobutan cyklopentan cykloheksan cykloheptan
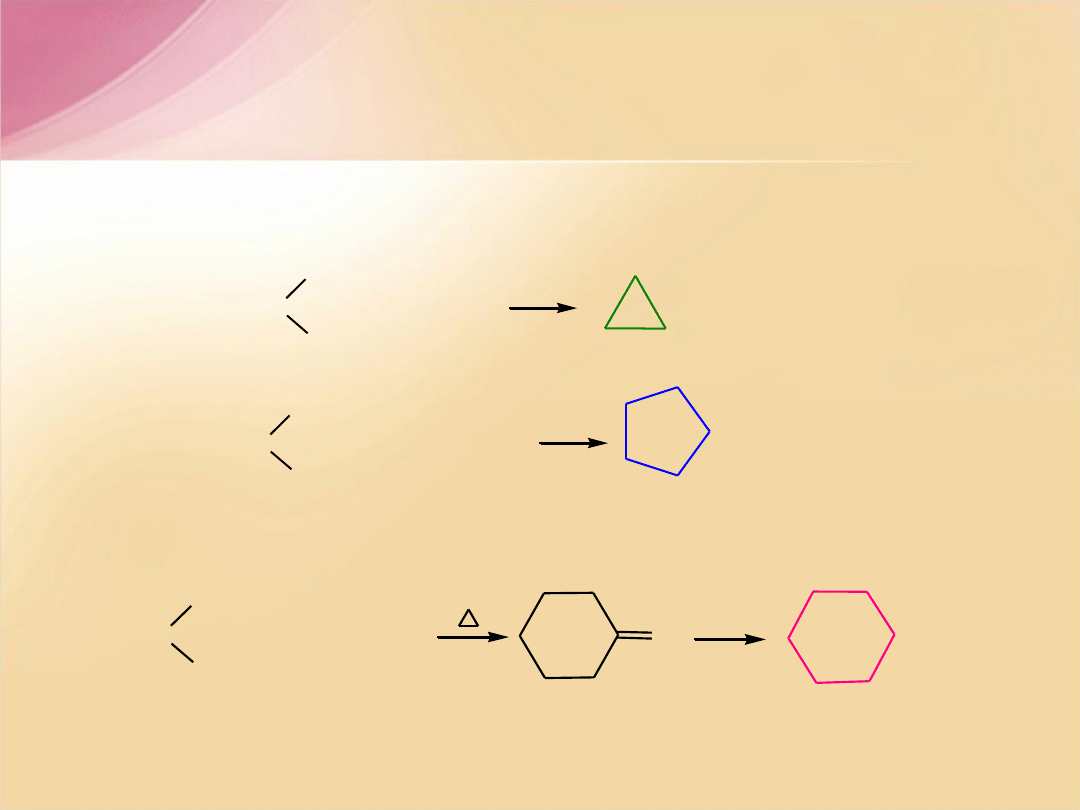
Otrzymywanie cykloalkanów
Zn(Hg)
H
2
C
CH
2
-CH
2
-COO
-
CH
2
-CH
2
-COO
-
Ca
+2
O
H
+
/H
2
O
cykloheksan
pimelinian wapnia
dekarboksylacja
redukcja, np. Clemmensena
cykloheksanon
Cyklizacja dihalogenoalkanów
(eliminacja halogenów z halogenków oligometylenów za pomocą metali)
H
2
C
CH
2
-Cl
CH
2
-Cl
+ Zn
cyklopropan
H
2
C
CH
2
-CH
2
-Br
CH
2
-CH
2
-Br
+ 2Na
cyklopentan

Cykloalkany
są hydrofobowe, łatwo palne i tworzą
mieszanki wybuchowe z powietrzem.
Cyklopropan
i
cyklobutan
są w temp. pokojowej gazami.
Od
cyklopentanu
do
cyklodekanu
to ciecze, a wyższe ciała stałe.
Właściwości chemiczne cyklopentanu i wyższych cykloalkanów są zbliżone
do alkanów, natomiast cyklopropan i cyklobutan zachowują się jak związki
nienasycone, tzn. ulegają reakcjom addycji z równoczesnym otwarciem pierścienia.
Rodnikowe przyłączenie bromu
+ Br
2
h
Br-CH
2
-CH
2
-CH
2
-Br
1,3-dibromopropan
Addycja elektrofilowa chloru
+ Cl
2
Cl-CH
2
-CH
2
-CH
2
-Cl
FeCl
3
1,3-dichloropropan
Addycja jodowodoru w podwyższonej temperaturze
+ HI
CH
3
-CH
2
-CH
2
-I
1-jodopropan
Reakcja z kwasem siarkowym
+ H
2
SO
4
stężony
CH
3
-CH
2
-CH
2
-OH
propan-1-ol
+ H
2
CH
3
-CH
2
-CH
3
n
-propan
Uwodornienie cyklopropanu
80
o
C
Ni
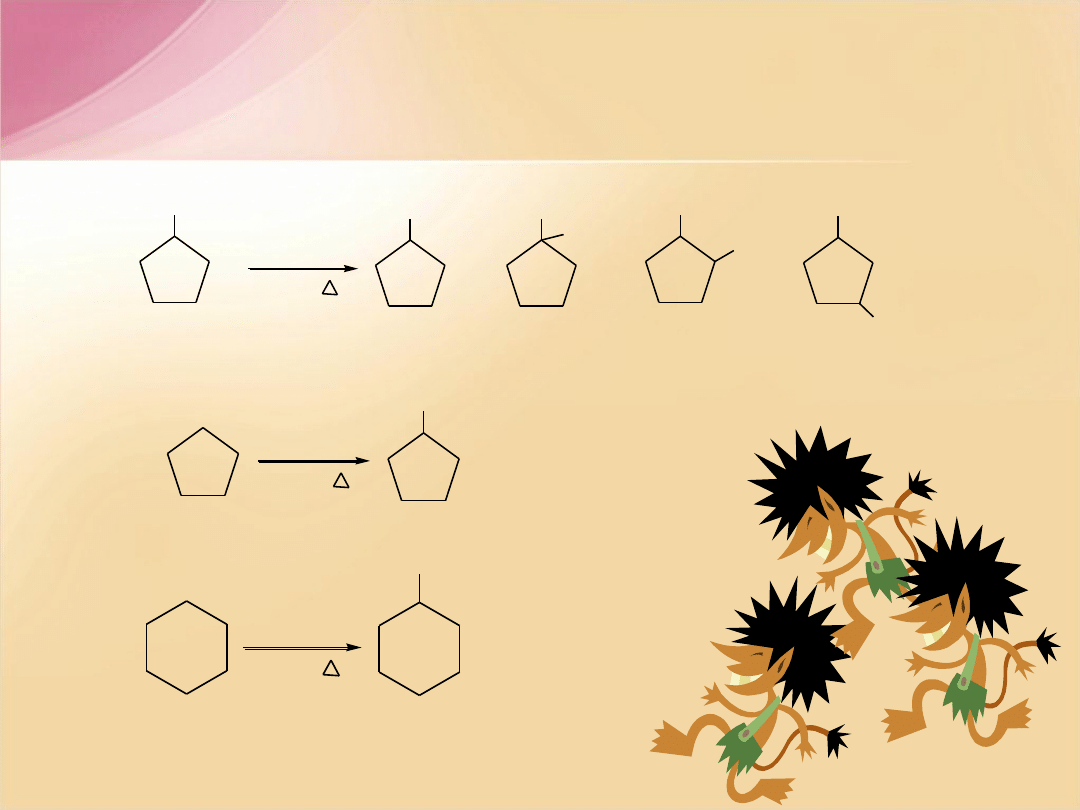
Alkilocykloalkany tworzą z halogenami mieszaninę
izomerycznych monopochodnych:
CH
3
Cl
2
- HCl
h
lub
CH
2
Cl
+
CH
3
+
CH
3
+
CH
3
Cl
Cl
Cl
metylocyklopentan
chlorometylo-
cyklopentan
1-chloro-1-metylo-
cyklopentan
1-chloro-2-metylo-
cyklopentan
1-chloro-3-metylo-
cyklopentan
Nadmiar węglowodoru
zmniejsza wydajność
polipochodnych.
Br
2
h
lub
Br
cyklopentan
(
nadmiar
)
bromocyklopentan
Cl
2
h
lub
Cl
cykloheksan
(
nadmiar
)
chlorocykloheksan
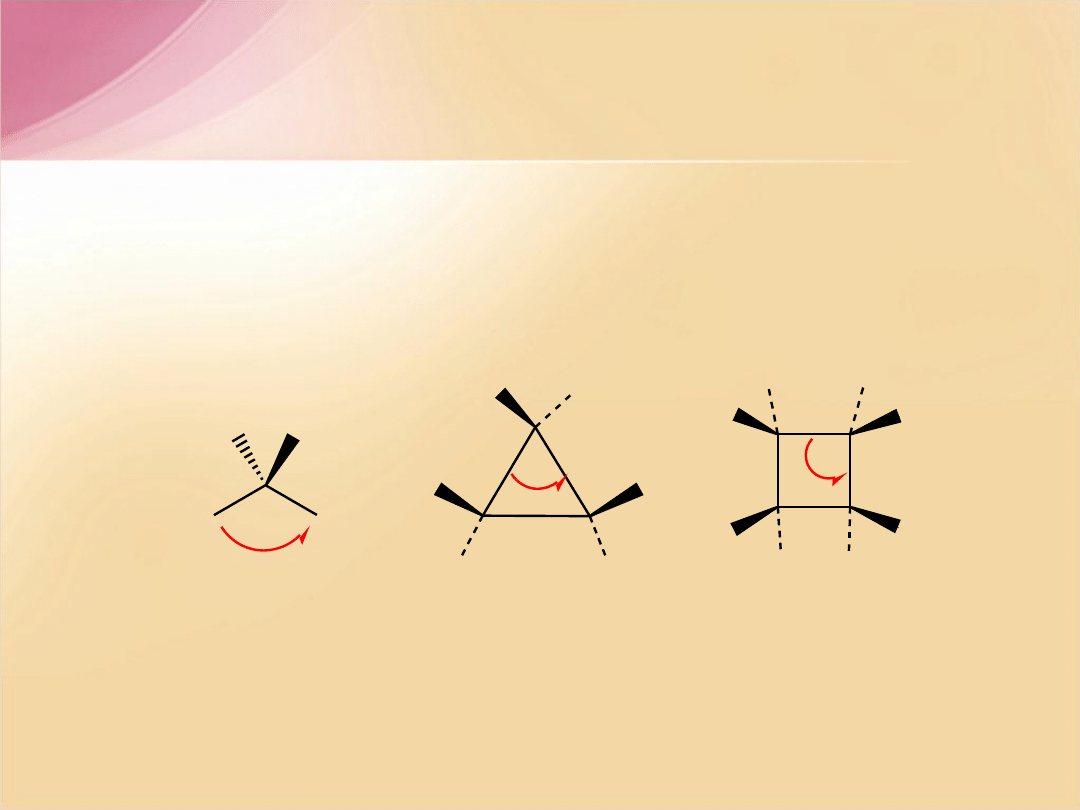
Utworzenie mniejszych pierścieni wymaga zmniejszenia kąta
tetraedrycznego pomiędzy wiązaniami C-C, a to obniża energię
tych wiązań i zmniejsza trwałość związków; łatwiej ulegają
rozerwaniu wiązania pomiędzy atomami w pierścieniu.
H
H
H
H
H
H
H
H
90
o
60
o
cyklobutan
H
H
H
H
H
H
cyklopropan
H
3
C
H
H
CH
3
109,5
o
n
-propan

Ciepło spalania
– ilość ciepła wydzielonego podczas spalania
1 mola węglowodoru do
CO
2
i
H
2
O
. Ciepło spalania (
Δ
H
) odzwierciedla
energię wewnętrzną cząsteczki ulegającej spalaniu. Im mniejsza
wartość
Δ
H
, tym niższa energia wewnętrzna cząsteczki (związek
bardziej stabilny) czyli wiązania C-C są silniejsze.
-CH
2
- + 3/2 O
2
→
CO
2
+ H
2
O + ciepło
ΔH
CH2
dla układu beznapięciowego = 157,4 kcal
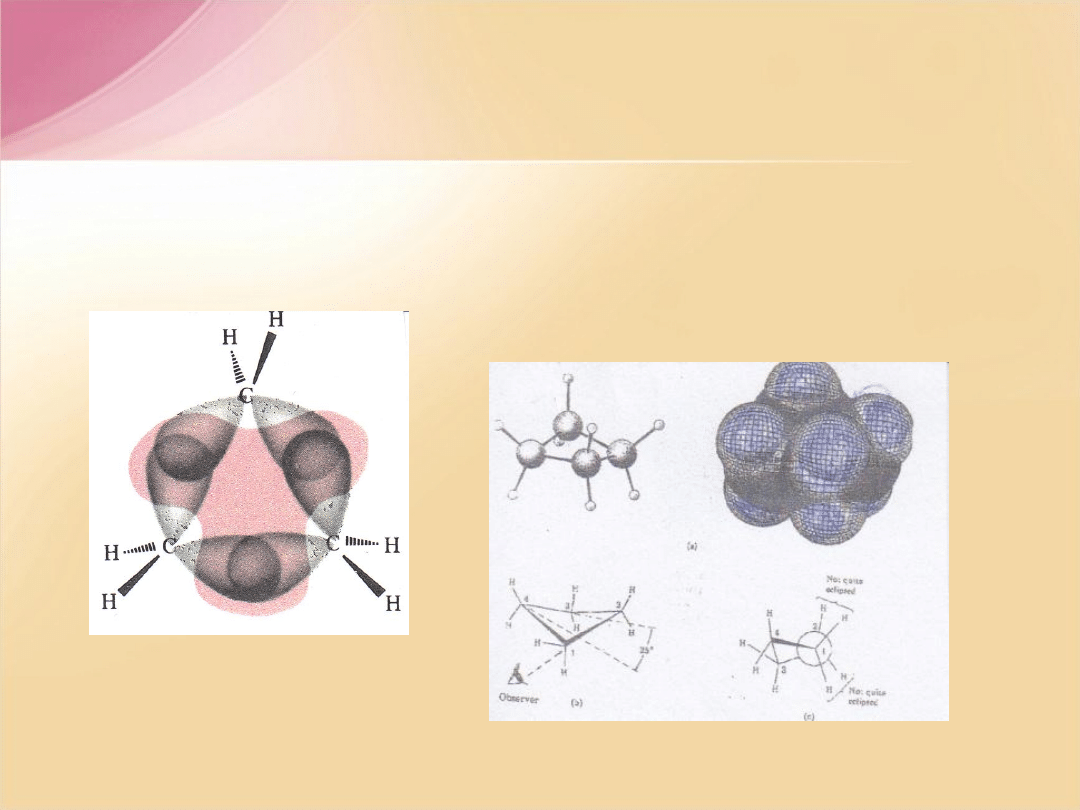
Cyklopropan
-
energia wiązania
C-C
w cząsteczce cyklopropanu jest
mniejsza ponieważ orbitale atomowe tworzące wiązanie
s
nie nakładają się
osiowo lecz pod pewnym kątem, stopień nałożenia jest mniejszy. Energia
wewnętrzna cyklopropanu obliczona na podstawie ciepła spalania jest o 8,8
kcal/równoważnik –CH
2
– wyższa niż w alkanach alifatycznych czy cykloheksanie.
Cyklobutan
–
atomy wodoru na sąsiednich
atomach węgla układają się naprzemianlegle.
F.A. Carey, Organic Chemistry, 2nd ed, McGRAW-HILL, INC, 1992
Cyklopentan
– kąt wewnętrzny wynosi 108
o
, ciasno upakowane
atomy w cząsteczce cyklopentanu odpychają się i deformują ją. Nie jest
ona zupełnie płaska. Energia wewnętrzna cyklopentanu jest o 1,3
kcal/równoważnik –CH
2
– wyższa niż w strukturach beznapięciowych.
F.A. Carey, Organic Chemistry, 2nd ed, McGRAW-HILL, INC. 1992
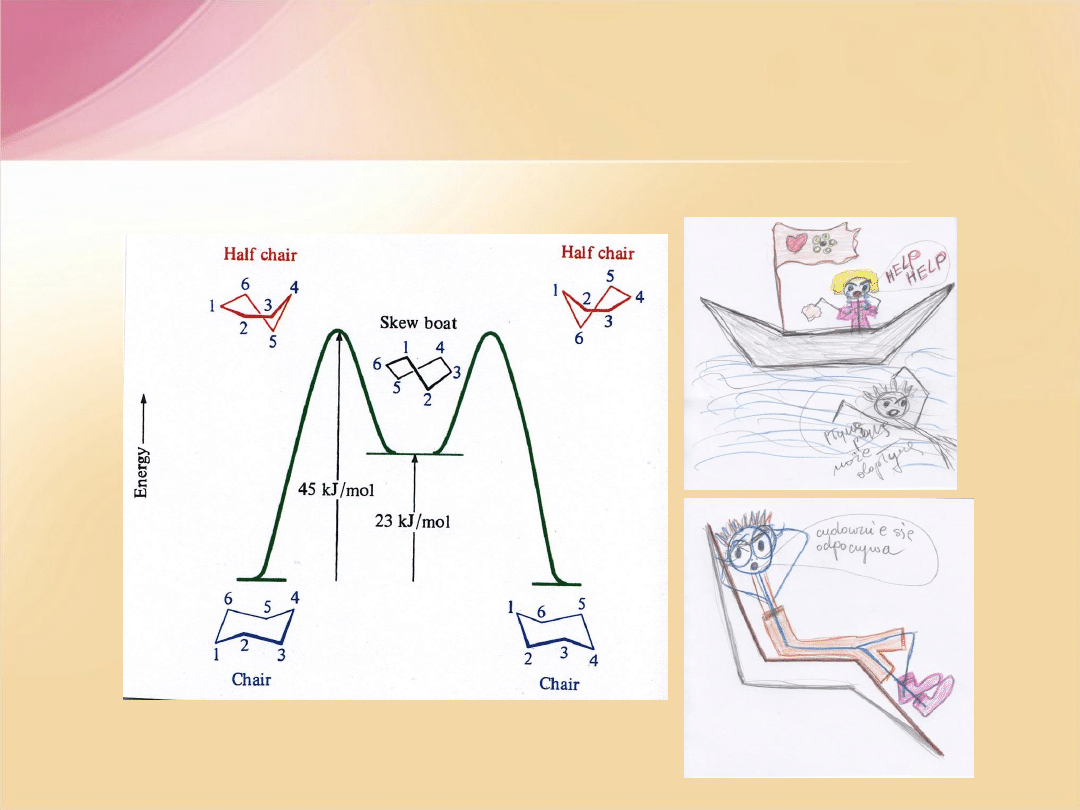
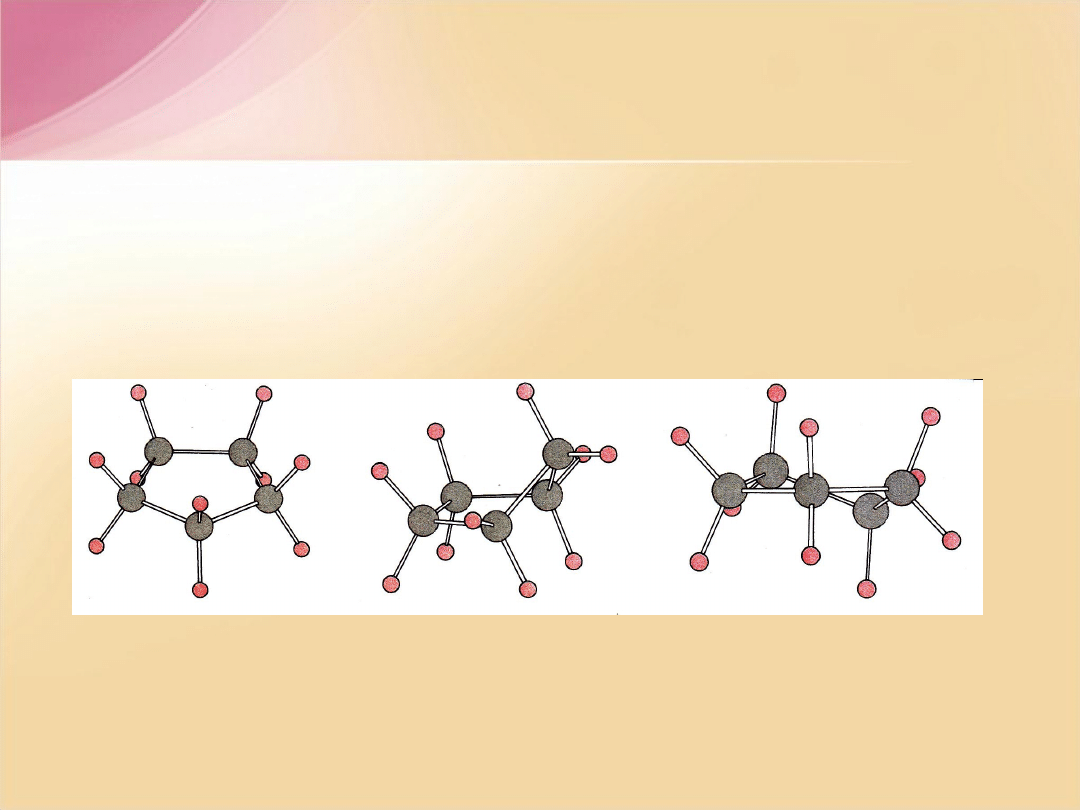
Cykloheksan
– nie jest płaski. Dzięki możliwości swobodnego obrotu
wokół wiązań
C-C
cząsteczka przyjmuje konformacje zapewniające
kąt
tetraedryczny
pomiędzy wiązaniami atomów węgla. Takich konformacji jest
bardzo dużo, np.
krzesłowa, półkrzesłowa, łódkowa czy skręconej łódki.
Różnią się one trwałością.
Najbardziej trwała (
o najniższej energii
) jest
konformacja krzesłowa
.
F.A. Carey, Organic Chemistry, 2nd ed, McGRAW-HILL, INC, New York 1992
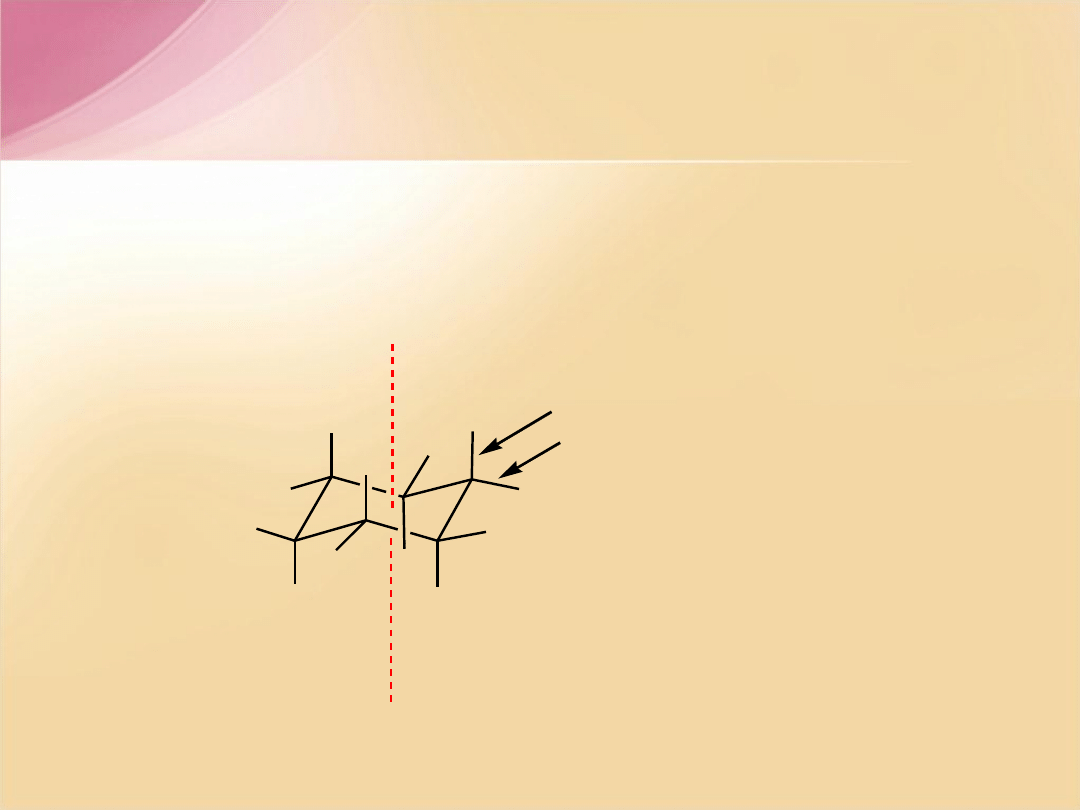
Dwie połówki cząsteczki
cykloheksanu, mają taką samą
konformację jak konformer
synklinalny
n
-butanu.
F.A. Carey, Organic Chemistry, 2nd ed, McGRAW-HILL, INC, New York 1992
Cykloheksan
– dwa atomy wodoru związane z tym samym atomem
węgla w cząsteczce nie są równocenne; wiązanie jednego jest równoległe do
pionowej osi cząsteczki (wiązanie
aksjalne
), a drugiego lekko odchylone od
płaszczyzny cząsteczki (wiązanie
ekwatorialne
).
W cząsteczce cykloheksanu znajduje się 6 atomów wodoru w położeniu
aksjalnym i 6 atomów wodoru w położeniu ekwatorialnym.
H
H
H
H
H
H
H
H
H
H
H
H
oś cząsteczki
wiązanie aksjalne
wiązanie ekwatorialne
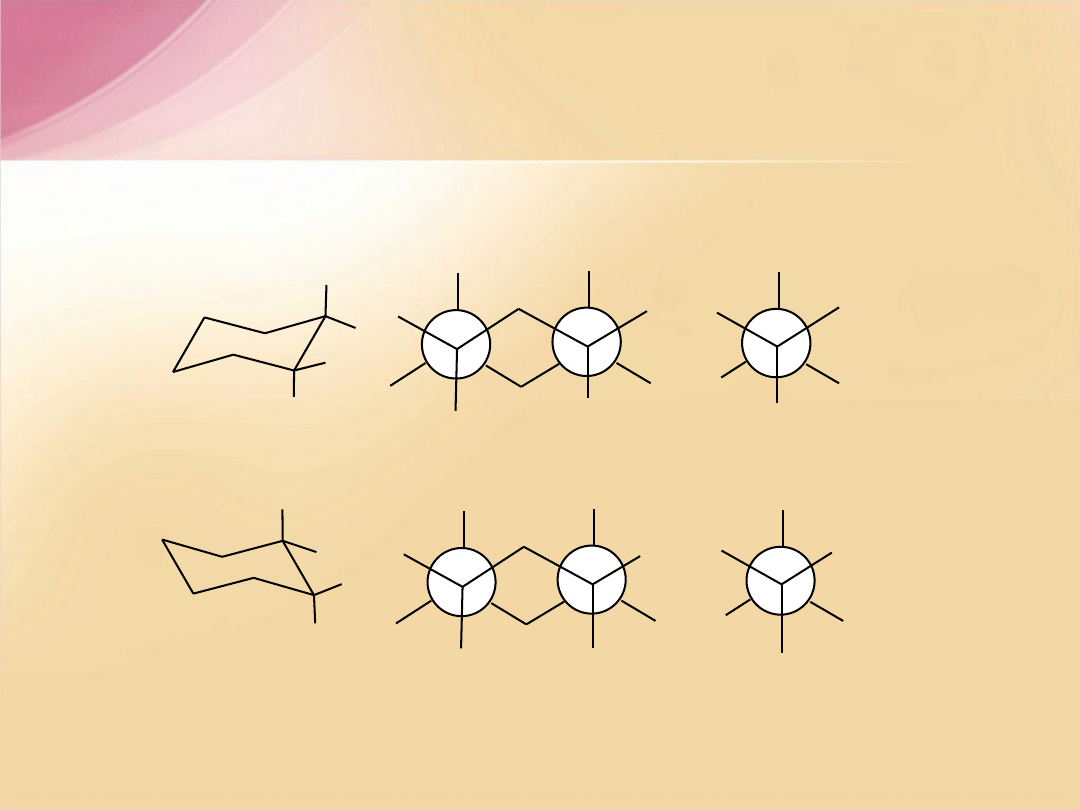
Konformer
, w którym większy podstawnik zajmuje pozycję aksjalną
jest mniej trwały
(podobny destabilizujący układ jak w
synklinalnej
konformacji
n
-butanu
)
od tego z dużym podstawnikiem w pozycji ekwatorialnej
(
podobny układ jak w
naprzemianległej
konformacji
n
-butanu
)
.
CH
3
1
6
5
4
3
2
CH
3
CH
3
H
3
C
1
2
3
6
5
4
n-butan
w konformacji
synklinalnej
1
6
5
4
3
2
CH
3
H
3
C
CH
3
1
2
3
6
5
4
n-butan
w konformacji
naprzemianleg
łej
CH
3
Izomeria
cis-trans
dipodstawionych cykloalkanów
Podstawione cykloalkany mogą występować w postaci dwóch izomerów:
cis
(oba podstawniki znajdują się po tej samej stronie pierścienia)
lub
trans
(oba podstawniki znajdują się po przeciwnej stronie pierścienia)
.
Stereoizomery
cis
/
trans
są różnymi związkami, różnią się
właściwościami fizycznymi i chemicznymi.
60
o
H
H
H
H
CH
3
H
3
C
cis
-
1,2-dimetylocyklopropan
60
o
H
H
CH
3
H
H
H
3
C
trans
-1,2-dimetylocyklopropan
H
H
H
H
H
H
H
3
C
H
CH
3
H
cis
-
1,2-dimetylocyklopentan
H
H
H
H
H
H
H
3
C
H
H
CH
3
trans
-
1,2-dimetylocyklopentan
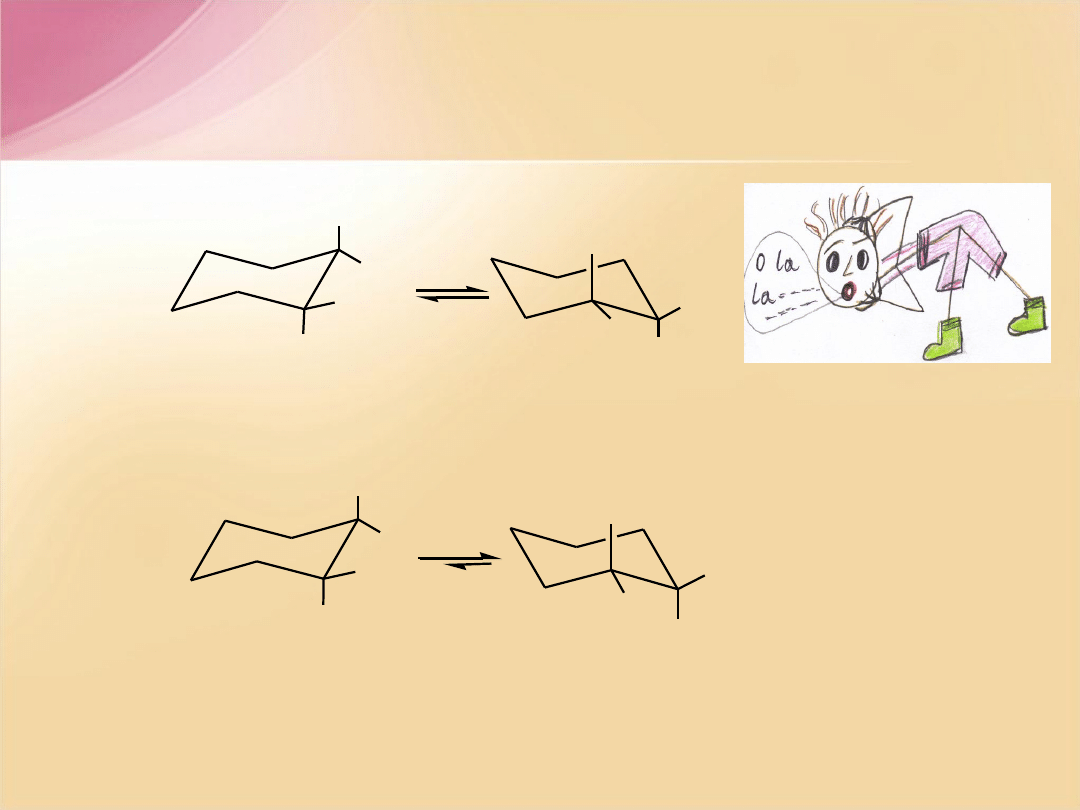
Konformacja dipodstawionych pochodnych
cykloheksanu
CH
3
H
CH
3
H
cis
-1,2-dimetylocykloheksan
e
,
e
(diekwatorialny)
a
,
a
(diaksjalny)
trans
-1,2-dimetylocykloheksan
e
,
a
(ekwatorialno-aksjalny)
a
,
e
(aksjalno-ekwatorialny)
CH
3
H
CH
3
H
H
CH
3
H
CH
3
CH
3
H
CH
3
H
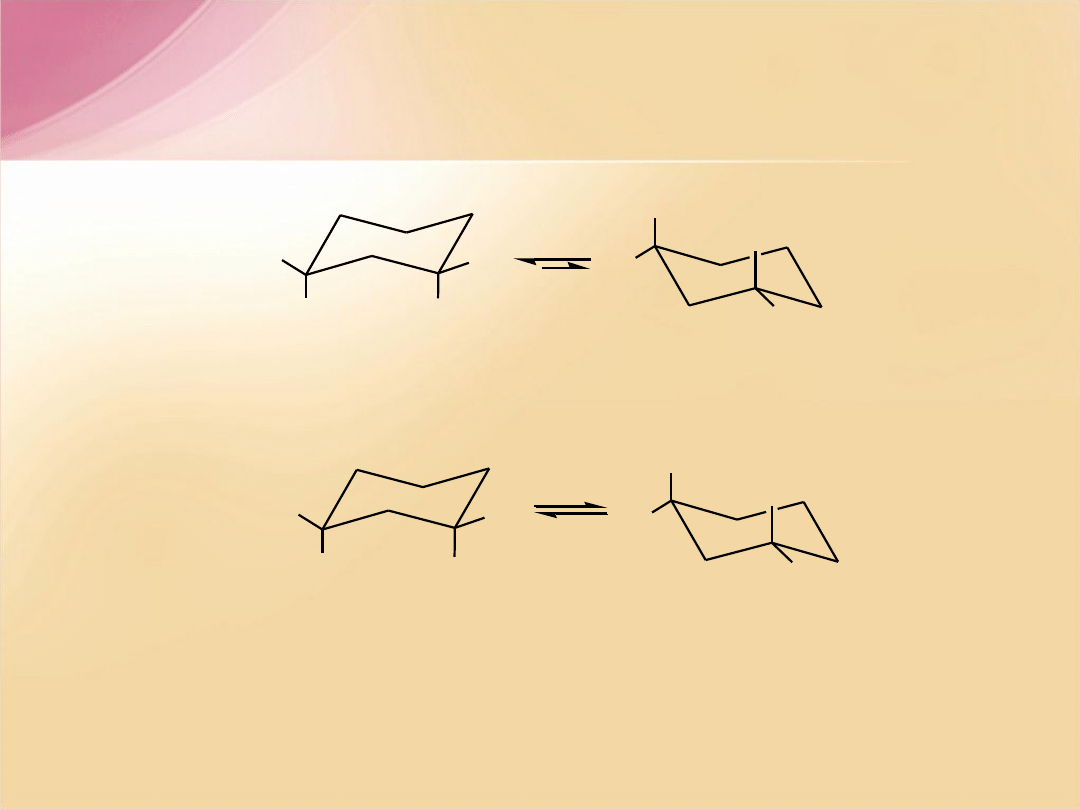
(CH
3
)
2
CH
H
Cl
H
Cl
H
CH(CH
3
)
2
H
cis
-1-chloro-3-izopropylocykloheksan
e
,
e
(diekwatorialny)
a
,
a
(diaksjalny)
(CH
3
)
2
CH
H
H
Cl
H
Cl
CH(CH
3
)
2
H
trans
-1-chloro-3-izopropylocykloheksan
e
,
a
(ekwatorialno-aksjalny))
a
,
e
(aksjalno-ekwatorialny)
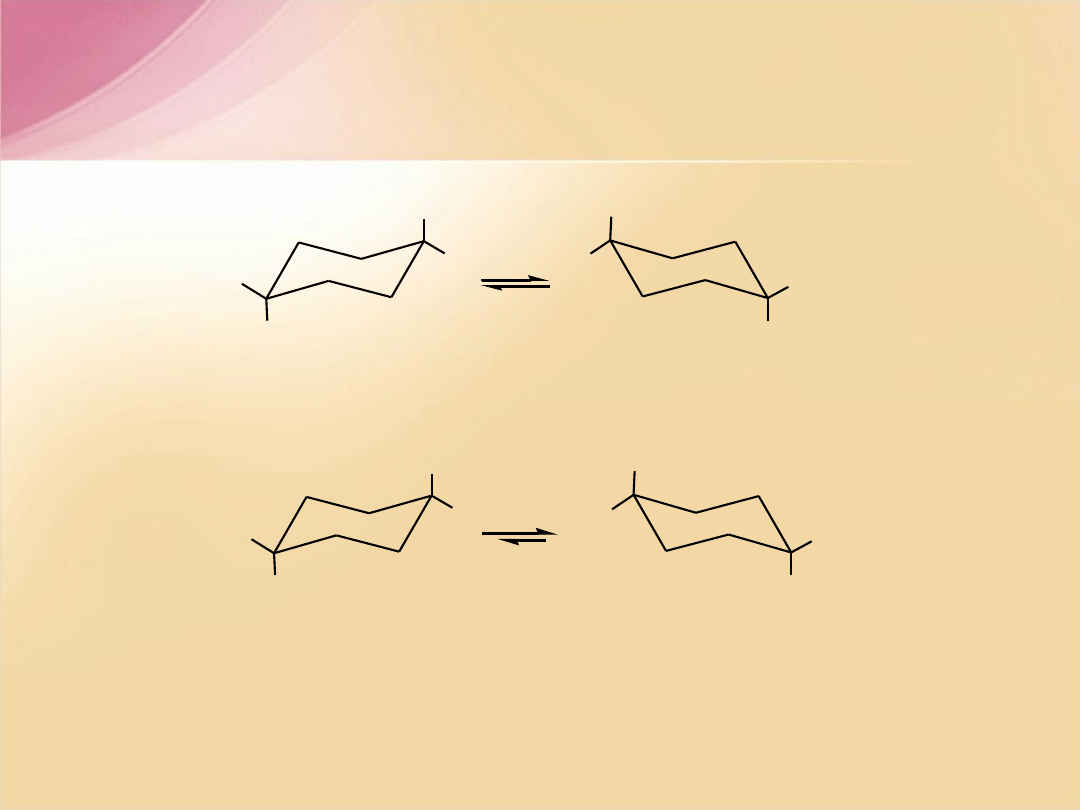
cis
-1,4-dimetylocykloheksan
e
,
e
(diekwatorialny)
a
,
a
(diaksjalny)
trans
-1,4-dimetylocykloheksan
e
,
a
(ekwatorialno-aksjalny)
a
,
e
(aksjalno-ekwatorialny)
CH
3
H
CH
3
H
H
3
C
H
CH
3
H
CH
3
H
CH
3
H
H
CH
3
H
H
3
C

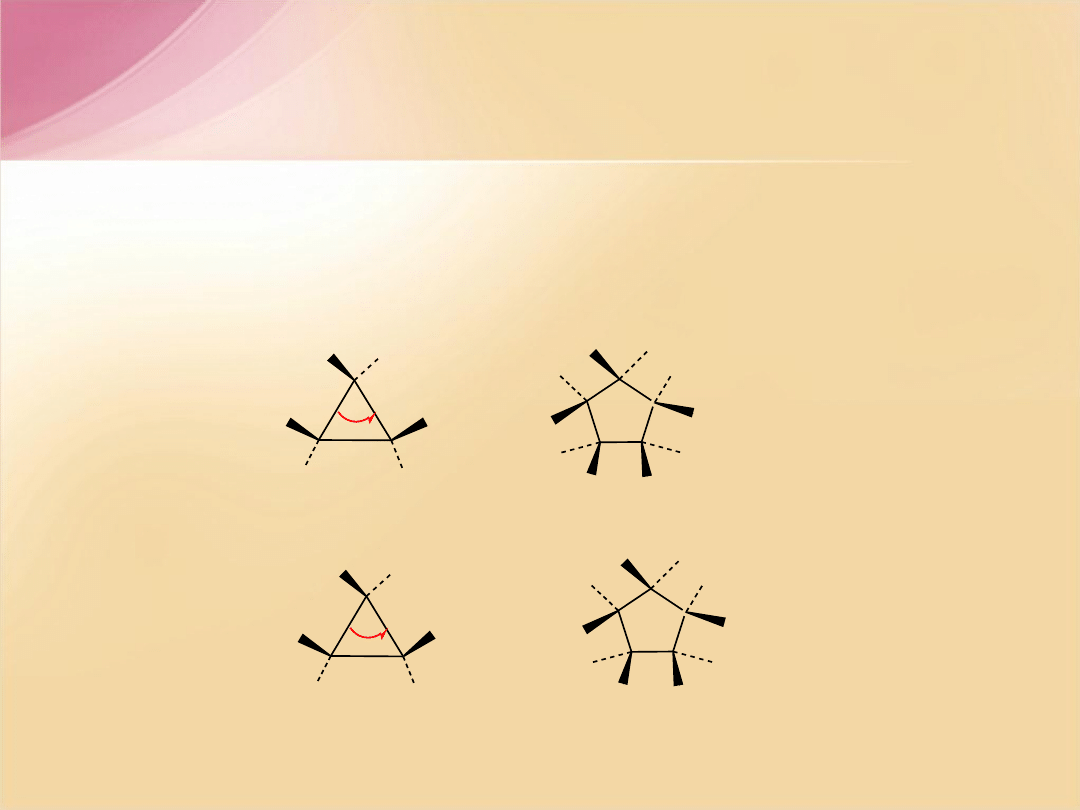
W cząsteczkach możemy wyróżnić trzy rodzaje naprężeń:
-
naprężenia kątowe
- naprężenia steryczne
- naprężenia torsyjne
Naprężenia kątowe
– naprężenia pojawiające się wtedy, kiedy kąty
wiązań pojedynczych C-C-C znacząco odbiegają od wartości
kąta tetraedrycznego 109
o
.
Naprężenia steryczne
– powstają w cząsteczce, gdy dwie grupy
znajdują się zbyt blisko siebie i starają się zająć tę samą przestrzeń.
Odpowiadają one m.in. za większą trwałość izomerów
trans
w porównaniu
z
cis
czy pochodnych cykloheksanu z podstawnikami ekwatorialnymi
w porównaniu z aksjalnymi.
Naprężenia torsyjne
– naprężenia w cząsteczce wywołane oddziaływaniem
(odpychaniem się) dwóch podstawników związanych z sąsiednimi atomami
węgla znajdujących się w konformacji naprzeciwległej. Naprężenia torsyjne
osiągają maksimum przy wartości kąta dwuściennego równej 0
o
.
Jest ono przyczyną mniejszej trwałości konformacji łodziowej
cykloheksanu w porównaniu z konformacją krzesłową.

Ładunki formalne i moment dipolowy
Ładunek formalny –
parametr związany z polarnością wiązania i
momentem dipolowym. Ładunek formalny na atomie równy jest liczbie
elektronów walencyjnych w obojętnym, wyizolowanym atomie pomniejszonej
o liczbę elektronów „posiadanych” przez ten atom w cząsteczce.
Ładunek
formalny
połowa elektronów
wiążących
liczba elektronów
walencyjnych
-
-
liczba elektronów
niewiążących
=
C
H
N
nitrometan
H
H
O
O
+1
-1
N
elektrony walencyjne atomu azotu = 5
elektrony wi
ążące atomu azotu = 8
elektrony niewi
ążące atomu azotu = 0
ładunek
formalny
=
5
-
8
2
-
0
=
+1
O
elektrony walencyjne atomu tlenu = 6
elektrony wi
ążące atomu tlenu = 2
elektrony niewi
ążące atomu tlenu = 6
ładunek
formalny
=
6
-
2
2
-
6
=
-1
Moment dipolowy
Średnią polarność cząsteczki
można zmierzyć ilościowo i nosi
ona nazwę momentu dipolowego.
= 1,87 D
C
Cl
H
H
H
CH
3
Cl
= 1,85 D
O
H
H
H
2
O
= 1,47 D
N
H
H
H
NH
3
= 0 D
C
H
H
H
H
CH
4
= 0 D
C
Cl
Cl
Cl
Cl
CCl
4
= Q
x
r [
D
]
-
moment dipolowy
Q -
wiel
kość ładunku na krańcu dipola cząsteczkowego
r -
odleg
łość między ładunkami
Momenty dipolowe są wyrażane w debajach [D].
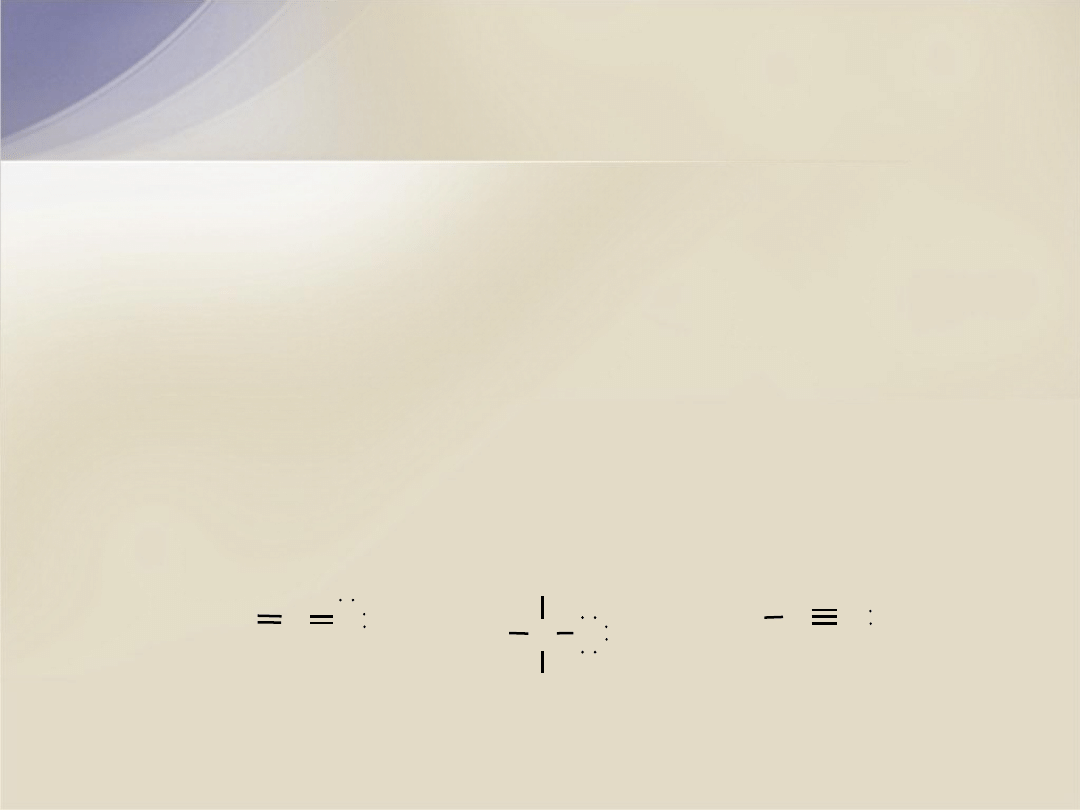
Pytania
1. Chlorowanie rodnikowe pentanu nie jest efektywną metodą
otrzymywania chlorku pentylu. W przeciwieństwie do tego
chlorowanie 2,2-dimetylopropanu jest dobrą metodą syntezy
chlorku neopentylu. Wyjaśnij dlaczego?
3. Przypisz ładunki formalne atomom w każdej z następujących
cząsteczek:
2. Dekalina (
bicyklo[4.4.0]dekan
) jest węglowodorem o wzorze
sumarycznym C
10
H
18
i występuje w postaci dwóch izomerów.
Jakie to są izomery? Podaj ich wzory strukturalne i konformacyjne.
a.
H
2
C
N
N
b.
H
3
C N
c.
CH
3
N
C
CH
3
CH
3
O

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
Alkany i cykloalkany, chemia, chemia organiczna
ALKANY I CYKLOALKANY
14b Węglowodory alifatyczne alkany i cykloalkany
Alkany (2)
cykloalkeny
Alkany(2)
Alkany 3 id 57982 Nieznany (2)
Alkany, Szkoła
ściągi chemia szereg homologiczny alkany, alkeny, alkiny
I ALKANY
ALKANY
alkany i spółka b dobree notatki
alkany liniowe
Alkany
CYKLOALKANY
Alkany nie reag, CHEMIA, Chemia organiczna
Alkany 2
chorg w 5 cykloalkany
więcej podobnych podstron