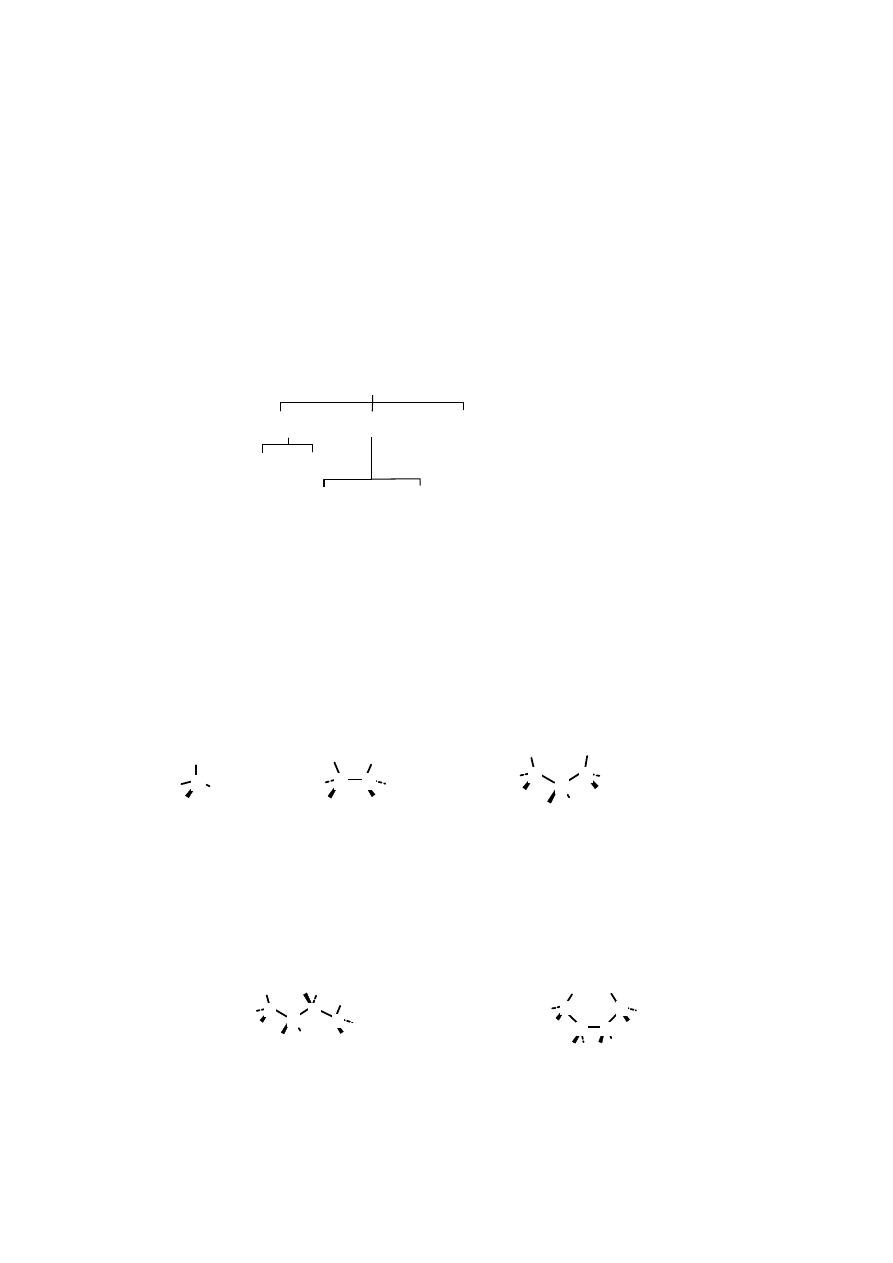
1
A L K A N Y
glowodory, czyli po czenia zawieraj ce wy cznie atomy w gla i wodoru (C
n
H
m
) uwa ane
si za zwi zki macierzyste substancji organicznych, tzn. e mo na z nich wyprowadzi wszystkie
inne zwi zki organiczne, które mog by traktowane jako pochodne w glowodorów.
glowodory dziel si na alifatyczne (
cuchowe), cykliczne i aromatyczne. Po ród
alifatycznych i cyklicznych wyró nia si
glowodory nasycone, czyli alkany lub cykloalkany
oraz nienasycone, a po ród nich alkeny (w glowodory z podwójnym lub podwójnymi
wi zaniami) i alkiny (w glowodory z potrójnym lub potrójnymi wi zaniami) i odpowiednio
cykloalkeny i cykloalkiny.
alifatyczne cykloalifatyczne
GLOWODORY
alkany
(w. nasycone)
w. nienasycone w. aromatyczne
(areny)
alkeny alkiny
Rys. 2.1. Podzia w glowodorów
Alkany, czyli w glowodory nasycone o ogólnym wzorze C
n
H
2n+2
dziel si na w glowodory
nasycone prosto
cuchowe (alifatyczne, inaczej normalne dawniej znane jako parafiny),
glowodory rozga zione (izoalkany lub izoparafiny) oraz
glowodory pier cieniowe
(cykloalkany, cykloalifatyczne, dawniej zwane naftenami). Wszystkie atomy C maj w nich
hybrydyzacj sp
3
.
Alkany prosto
cuchowe nie s podobne do rozci gni tej nitki czy raczej prostego drutu
kolczastego ze stercz cymi jak kolce atomami wodoru. Tetragonalny k t pomi dzy wi zaniami
atomu w gla sp
3
wymusza zygzakowaty uk ad atomów C, a mo liwo swobodnego obrotu
wokó wi zania C
−
C powoduje, e cz steczki mog wyst powa w ró nej konformacji, tzn.
przyjmuj ró ne kszta ty.
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
C
C
C
C
C
C
metan,
CH
4
etan,
CH
3
CH
3
propan,
CH
3
CH
2
CH
3
Zarówno
etan
, jak i
propan
mog wyst powa w konformacjach naprzeciwleg ej i
naprzemianleg ej oraz po rednich. Wraz ze wzrostem d ugo ci
cucha w glowodorowego
ro nie mo liwo przyjmowania przez cz steczk jeszcze bardziej zró nicowanych kszta tów.
Taka ró norodno kszta tów wyst puje w roztworze i w stanie gazowym, przy czym najwi ksza
jest populacja konformerów najtrwalszych. W stanie krystalicznym cz steczki przyjmuj zwykle
jednolity kszta t.
H H H H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
C
C
C
C
C
C
C
C
butan,
CH
3
CH
2
CH
2
CH
3
w konformacji naprzemianleg ej (antiperiplanarnej) naprzeciwleg ej

2
Zwykle, pisz c, np. schematy reakcji nie ma potrzeby przedstawia wzorów w tak rozbudowanej
formie, korzystamy wówczas z zapisów uproszczonych; np. dla
n-heksanu
:
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
C
6
H
14
CH
3
-CH
2
-CH
2
-CH
2
-CH
2
-CH
3
CH
2
(CH
2
)
4
CH
3
H H H H H H
I I I I I I
H-C-C-C-C-C-C-H
I I I I I I
H H H H H H
Rys. 2. 2. Uproszczone formy zapisu wzoru
heksanu
Wszystkie zwi zki organiczne ró ni ce si od innych jednostk
–CH
2
– nazywaj si
homologami. Homologi oczywi cie nale zawsze do tej samej grupy zwi zków. Wszystkie
alkany s homologami metanu i ka dego innego alifatycznego w glowodoru nasyconego.
Izolkany
– w glowodory nasycone rozga zione
W w glowodorach rozga zionych jeden lub wi cej atomów w gla czy si z wi cej ni z
jednym atomem w gla, w wyniku czego w takim miejscu
cucha w glowodorowego tworzy si
rozga zienie:
C
C
C
C
C
C
C
C
C
C
C
C
Rys. 2. 3.
cuch zawieraj cy rozga zienia; dla uproszczenia podane s tylko wi zania C-C
Nomenklatura (nazewnictwo) alkanów
Dla pierwszych czterech alkanów – od C
1
÷
C
4
u ywa si nazw zwyczajowych:
metan etan propan butan
Nazwy alkanów od C
5
wzwy tworzy si poprzez dodanie ko cówki „n” do liczebników greckich
lub aci skich, np.:
pentan
(5);
heksan
(6);
heptan
(7),
oktan
(8);
nonan
(9);
dekan
(10);
undekan
(11);
dodekan
(12);
tridekan
(13);
tetradekan
(14) ...
ejkozan
(20);
henejkozan
(21);
dokozan
(22);
trikozan
(23) ...
triakontan
(30);
hentriakontan
(31);
dotriakontan
(32) ...
Wy ej podane nazwy odnosz si do alkanów prosto
cuchowych, czyli normalnych. Je eli
chcemy zaznaczy ten fakt to nazw poprzedzamy literk „n-„ pisan kursyw , np.:
n-butan
,
n-pentan
czy
n-nonan
. Przedrostek „n-„ mo e równie poprzedza wzór sumaryczny, np.:
n-
C
4
H
10
,
n-C
5
H
12
czy
n-C
9
H
20
.
CH
3
CH
2
CH
2
CH
3
CH
3
(CH
2
)
3
CH
3
CH
3
(CH
2
)
7
CH
3
butan (n-butan) pentan (n-pentan) nonan (n-nonan)

3
W
glowodorach rozga zionych podajemy nazwy
cuchów bocznych, które poprzedzaj
lokanty, czyli numery atomów w gla
cucha g ównego, z którymi zwi zane s
cuchy
boczne, np. nazwa
2-metylopropan
oznacza, e przy drugim atomie w gla propanu znajduje si
reszta metylowa, czyli CH
3
:
C
H
3
CH CH
3
CH
3
2-metylopropan
1
2
3
Izomery w glowodorów zawieraj cych do 5 atomów w gla mog by rozró niane za pomoc
specjalnych przedrostków: izo-, sec-, czy neo-, w skrócie i-, s- lub t-. Skrót izo- oznacza izomer
alkanu normalnego, sec- lub tert- odpowiednio obecno drugo- lub trzeciorz dowego atomu
gla, a neo-, „nowy” w stosunku do poprzednio znanego.
CH
3
CH
3
CH
2
CH
2
CH
3
CH
3
CHCH
3
butan
(n-butan)
izobutan
(2-metylobutan)
CH
3
CH
3
CCH
3
CH
3
CH
3
CHCH
2
CH
3
CH
3
CH
3
(CH
2
)
3
CH
3
pentan (n-pentan) izopentan (2-metylobutan) neopentan
(2,2-dimetylopropan)
Reszta alkanu po formalnym oderwaniu jednego atomu wodoru nosi nazw alkilu lub grupy
(reszty alkilowej) – to nie jest rodnik! Rodnik zawiera niesparowany elektron; alkil mo e by
rodnikiem je eli wyst puje w nim pojedynczy elektron, np.:
.
CH
3
–
rodnik metylowy
.
Nazw alkilu tworzy si z nazwy alkanu poprzez zamian przyrostku
„-an” na „-yl” lub „-il” (po spó
oskach g,k i l):
metyl
(CH
3
−
) od metanu,
etyl
(CH
3
CH
2
−
) od etanu,
propyl
(CH
3
CH
2
CH
2
−
) od propanu,
butyl
(CH
3
(CH
2
)
2
CH
2
−
) od
butanu,
izobutyl
[(CH
3
)
2
CHCH
2
−
] od izobutanu,
tert-butyl
od [(CH
3
)
3
C
−
] od tert-butylu,
I
pentyl
(CH
3
CH
2
CH
2
CH
2
CH
2
−
) od pentanu (nie zaleca si stosowanie dawnej nazwy
amyl
)
W nazwie
dekan
spó
oska „k” zostaje zamieniona na „c”, np.
decyl
(CH
3
(CH
3
)
8
CH
2
−
) od dekanu,
undecyl
(CH
3
(CH
3
)
9
CH
2
−
) od undekanu
Nomenklatura systematyczna wg IUPAC
Jednolite zasady nazywania zwi zków organicznych s bardzo wa ne, poniewa trzeba
jednoznacznie nazywa miliony indywiduów chemicznych. Tworzenie zasad nazewnictwa
(nomenklatury) zosta o powierzone Mi dzynarodowej Unii Chemii Czystej i Stosowanej, w
skrócie IUPAC (ang. International Union of Pure and Appied Chemistry).

4
Propozycja ujednolicenia zasad nazewnictwa zwi zków organicznych zosta a wysuni ta ju w
1892 r. w Genewie, pó niej rozszerzona w 1930 r. w raporcie Komitetu Reformy S ownictwa
Chemii Organicznej przy Mi dzynarodowej Unii Chemii (IUP). Nad zasadami nomenklatury
zwi zków organicznych IUPAC pracuje w sposób ci
y. W Polsce Polskie Towarzystwo
Chemiczne (PTChem) powo
o w 1974 r. Komisj Nomenklaturow Chemii Organicznej,
której zadaniem jest dostosowanie polskich nazw do zasad IUPAC. Najwa niejsze ustalenia tej
Komisji zawarte s w opracowaniach pt.: Nomenklatura zwi zków organicznych, PTChem,
Warszawa 1992 i Przewodnik do nomenklatury zwi zków organicznych, PTChem, Warszawa
1994. Opublikowano te zalecenia tej komisji dotycz ce nazewnictwa wybranych grup
zwi zków, w tym w glowodanów, steroidów, rodników i jonów.
W nazwie zwi zku organicznego wyró nia si trzy cz ony
PRZEDROSTEK - RDZE - PRZYROSTEK
okre la: miejsce,liczb i liczb atomów C symbole grup funkcyjnych
nazw podstawnika (ów) w
cuchu g ównym
CH
3
-CH-CH-CH
2
-CH-CH
2
-OH
H
3
C
CH
2
CH
3
CH
3
6 5 4 3 2 1
rdze
grupa funkcyjna
podstawniki
lokanty
4-etylo-2,5-dimetyloheksa-1-ol
Nazwy podstawników znajduj si w przedrostku, a symbole grup funkcyjnych w przyrostku.
Nomenklatura alkanów rozga zionych wg IUPAC
Tworzenie nazwy rozga zionego alkanu rozpoczyna si od identyfikacji najd
szego
cucha,
który jako
cuch g ówny b dzie podstaw nazwy rdzenia.
CH
2
-CH
2
-CH
2
-CH
2
-CH
3
CH
3
-CH
2
-CH-CH
2
-CH
2
-CH
3
CH
2
-CH
2
-CH
2
-CH
2
-CH
3
1 2 3 4 5 6
4 5 6 7 8
CH
3
-CH
2
-CH-CH
2
-CH
2
-CH
3
1 2 3
A
B
heksan oktan
A
i
B
nieprawid owo dobrane
cuchy g ówne
CH
3
-CH
2
-CH-CH
2
-CH
2
-CH
3
CH
2
-CH
2
-CH
2
-CH
2
-CH
3
4 3 2 1
5 6 7 8 9
C
prawid owo wybrany
cuch g ówny –
nonan
Rys. 2.4. Prawid owa nazwa w glowodoru
4-etylononan
5
Lokanty (liczby okre laj ce po
enie podstawników w
cuchu – numery atomów) nale y tak
przypisywa , eby podstawnik (grupa funkcyjna) otrzyma mo liwie najni sz warto . W
powy szym wzorze
C
, w którym numeracja atomów w gla jest prawid owa,
etyl
znajduje si
przy czwartym atomie w gla – lokant 4. Gdyby numeracj zacz
od drugiego ko ca, to
etyl
by by zwi zany z szóstym atomem w gla –
lokant 6
. Poniewa 4<6, to prawid owa nazwa tego
glowodoru brzmi
4-etylononan
, a nie
6-etylononan
.
Je eli w cz steczce wyst puj
rozga zienia drugiego i wy szych rz dów (rozga zienia z
rozga zie ), to te cz ci nazw podajemy w nawiasie lub kolejnych nawiasach, gdy rozga zie
jest wi cej:
H
3
C
CH
3
-CH-CH
3
CH
3
2 1
CH
3
-CH
2
-CH-CH
2
-CH
2
-CH-CH
2
-CH
2
-CH-CH
2
CH
2
CH
2
-CH
3
H
3
C-CH-CH
2
-CH
2
CH-CH
2
-CH
3
CH
3
1 2 3 4 5 6 7 8
10 11 12 13
9
2
2 3
1
1
3
3-(1,1-dimetyloetylo)-6-(1-metylopropylo)-9-(3-metylobutylo)tridekan
Dla prostszych podstawników przyj to nazwy bez lokantów:
CH
3
-C-
CH
3
CH
3
CH
3
-CH-CH
3
CH
3
-CH-CH
2
-CH
3
CH
3
-CH-CH
2
-
CH
3
izopropyl
(
i-Pr
)
sec-butyl
(
sec-Bu izobutyl (izo-Bu
tert-butyl
lub
lub
s-Bu
)
lub
i-Bu
)
t-butyl, (t-Bu)
CH
3
-CH-CH
2
-CH
2
-
CH
3
CH
3
-C-CH
2
-
CH
3
CH
3
CH
3
-CH
2
-C-
CH
3
CH
3
izopentyl neopentyl
tert-pentyl
Stosuj c uproszczone nazwy krótkich rozga zionych grup alkilowych powy ej omawiany alkan
otrzymuje równie uproszczon nazw :
H
3
C
CH
3
-CH-CH
3
CH
3
2 1
CH
3
-CH
2
-CH-CH
2
-CH
2
-CH-CH
2
-CH
2
-CH-CH
2
CH
2
CH
2
-CH
3
H
3
C-CH-CH
2
-CH
2
CH-CH
2
-CH
3
CH
3
1 2 3 4 5 6 7 8
10 11 12 13
9
2
2 3
1
1
3
3-tert-butylo-6-sec-butylo-9-izopentylotridekan

6
Je eli we wzorze alkanu znajduje si kilka
cuchów bocznych, to atomy w gla w
cuchu
nale y tak ponumerowa , eby pierwsze rozga zienie otrzyma o najni szy z mo liwych
lokantów:
CH
2
-CH
2
-CH
3
CH
3
5 6 7
CH
3
-CH
2
-CH-CH-CH
3
4
3
CH
2
2
1
CH
2
-CH
2
-CH
3
CH
3
3 2 1
CH
3
-CH
2
-CH-CH-CH
3
4
5
CH
2
6
7
nieprawid owa
prawid owa
pierwsze rozga zienie
przy C4
pierwsze rozga zienie
przy C3
numeracja atomów C (przypisanie lokantów)
3-etylo-4-metyloheptan
Nazwy podstawników (
cuchów bocznych) zajmuj w nazwie zwi zku miejsca zgodnie z
kolejno ci alfabetyczn , przy czym bierze si pod uwag pierwsz liter podstawnika, a nie
liczebnika okre laj cego liczb tych podstawników, czy rz dowo atomów C, tzn.
etyl
b dzie
przed
dimetylem
, a
tert-butyl
przed
etylem
:
H
3
C-CH
2
-CH-CH-CH-CH
2
-CH
2
-CH-C(CH
3
)
3
CH
2
-CH
2
-CH
2
-CH
2
-CH
3
CH
3
5 6 7
9 10 11 12 13
8
2 3
4
1
CH
2
-CH
3
CH
3
8-tert-butylo-4-etylo-3,5-dimetylotridekan
Lokanty w prawid owo napisanej nazwie zwi zku umieszcza si przed nazw podstawnika. Po
lokancie lub przed i po, je eli znajduje si wewn trz nazwy, umieszcza si my lnik –
8-
, lub
-4-
.
Kolejne lokanty rozdziela si przecinkiem (
-3,5-
), a liczb takich samych podstawników okre la
si liczebnikiem aci skim (
di-
,
tri-
,
tetra-
,
penta-
,
heksa
-
, itd.).
ród a alkanów
ropa naftowa (du a ró norodno , od gazowych poprzez ciek e do sta ych);
gaz ziemny (metan – gaz suchy, metan + etan, propan i butan – gaz mokry);
hydrat metanu;
upki bitumiczne (zawieraj 10-15% zwi zków organicznych, wydobywa si je przez
wytlewanie);
produkty wytlewania w gla (niskotemperaturowa piroliza w gla kopalnego);
synteza chemiczna (dowolne w glowodory, stosowana w przemy le)
Frakcje ropy naftowej (tw.
o
C, zawarto atomów C w cz steczkach)
eter naftowy (30-40, C
5
-C
6
);
ligroina lub benzyna lekka (60-100, C
6
-C
7
)
benzyna lub gazolina (40-200, C
5
-C
10
); nafta lub paliwo odrzutowe (175-320, C
11
-C
18
)
olej nap dowy (paliwo dieslowe); olej lekki (o. opa owy) (>275, C
15
-C
25
)
mazut;
oleje smarowe (trudno lotne sk adniki); wosk parafinowy lub wazelina
asfalt lub gudron; koks naftowy

7
Emisja metanu (szacunkowa, mln ton)
Tabela 2.1.
ród a naturalne
ród a antropologiczne
torfowiska
i
mokrad a 100
byd o
i
inne
prze uwacze 75
oceany,
morza
i
jeziora 30
pola
ry owe
70
termity 30
przetwarzanie
biomasy 60
tundra
5
wysypiska
mieci
i
cieki 60
kopalnictwa
w glowe
30
gaz
ziemny
i
ropa
naftowa
(wydobycie i transport)
30
razem
165 (34%)
325 (66%)
CZNIE 490 mln ton
Hydrat metanu
Szcz tki organiczne s cz sto przetwarzane przez mikroorganizmy w
metan
. Ten proces zachodzi
w warunkach beztlenowych, np. na dnach zbiorników wodnych, takich jak stawy, mokrad a,
jeziora, morza i oceany. Na terenach podmok ych wydobywa si w postaci tzw. gazu b otnego.
Pod wysokim ci nieniem, np. na dnach oceanów na g boko ciach kilkuset metrów (w obszarach
umiarkowanych poni ej 500 m, w morzach arktycznych znacznie p ycej) CH
4
tworzy z wod
metastabilny, podobny do lodu
hydrat CH
4
.
6H
2
O
. Ocenia si , e z
a hydratu metanu zawieraj
oko o 15 mld ton metanu, tj. wi cej zwi zanego w gla ni z
a gazu ziemnego, ropy naftowej i
gla kamiennego razem wzi te. Pierwsz grudk hydratu metanu wydobyto na powierzchni z
dna oceanu w 1980 r., a dopiero w 1996 r. uda o si zgromadzi w termosach oko o 50 kg tej
substancji i podda j gruntownym badaniom.
Leki wzrost temperatury wody nad z
em
hydratu metanu
powoduje jego rozk ad i uwalnianie
gazowego
metanu
, który porywa ze sob kawa ki hydratu, przyspieszaj c jego rozk ad. Z 1 cm
3
hydratu metanu
wydobywa si 164 cm
3
gazowego
metanu
. Udokumentowano w druj ce ku
powierzchni bloki hydratu wielko ci samochodu. Gwa towny rozk ad du ych ilo ci hydratu
metanu mo e spowodowa ogromne fale tsunami. Oko o 8000 lat temu 5 600 km
3
brzegu
Norwegii osun o si do morza przypuszczalnie z powodu destabilizacji hydratu metanu
cementuj cego przybrze ne dno.
W wielu miejscach na dnach mórz i oceanów znajduj si ogromne kratery o powierzchni
kilkudziesi ciu km
2
i g boko ci kilkudziesi ciu metrów, powsta e w wyniku wybuchowego
rozk adu du ych pok adów hydratu metanu. Hydrat metanu jest równie istotn przyczyn
zwi kszania efektu cieplarnianego, poniewa metan jest 20 razy aktywniejszy ni CO
2
w
poch anianiu ciep a. S przypuszczenia, e okresowe, znaczne ocieplenia na ziemi mog y by
spowodowane uwolnieniem do atmosfery du ych ilo ci metanu z jego hydratu.
Hydrat metanu jest palny. Pali si czerwonym p omieniem, a po spaleniu pozostaje woda. Ma
budow klastratu, zawieraj cego cz steczk metanu otoczonego 6 cz steczkami wody. W
hydracie obok metanu wyst puje w niewielkich ilo ciach siarkowodór (1-2%), etan i amoniak.
a hydratu metanu zasiedlone s mikroorganizmami, które przetwarzaj metan w CO
2
,

8
czerpi c z tego energi
yciow . Z CO
2
wytwarza si w glan wapnia inkrustuj cy z
a hydratu.
Zalegaj ce na dnach mórz i oceanów ska y w glanowe maj cz ciowo to samo pochodzenie.
Obecne mo liwo ci technologiczne nie pozwalaj na przemys owe pozyskiwanie metanu ze z
jego hydratu. ( wiat Nauki, 2000 (02) str. 38-47, (04) str. 13-14.
Synteza alkanów
Uwodornienie alkenów lub alkinów
kat. (Pt,Pd lubNi) kat.
C
n
H
2n
+ H
2
→
C
n
H
2n+2
C
n
H
2n-2
+ 2 H
2
→
C
n
H
2n+2
Hydroliza zwi zków Grignarda
eter HOH
CH
3
Cl + Mg
→
CH
3
MgCl
→
CH
4
chlorek metylu chlorek metylomagnezowy metan
Redukcja halogenków alkilowych
kat.
C
n
H
2n+1
Cl + H
2
→
C
n
H
2n+2
+ HCl C
n
H
2n+1
Cl + Zn + H
+
→
C
n
H
2n+2
+ Zn
+
+ Cl
-
Reakcja Wurtza
2 C
4
H
10
Cl + 2 Na
→
C
8
H
18
+ 2 NaCl
chlorek n-butylu
n-oktan
Wykorzystanie odczynników Gilmana
C
3
H
7
Cl + 2 Li
→
C
3
H
7
Li + LiCl
propylolit
C
6
H
13
Cl
2 C
3
H
7
Li + CuI
→
(C
3
H
7
)
2
CuLi
→
C
9
H
20
+ C
3
H
7
Li + LiCl
propylolit dipropylomiedzian(I) litu nonan
(odczynnik Gilmana)
Redukcja aldehydów i ketonów
a/ reakcja Clemmensena
b/ reakcja Wolffa-Ki nera
H
+
/HOH KOH
RCOR + Zn(Hg)
→
RCH
2
R
RCOR + H
2
NNH
2
→
RCH
2
R + N
2
+ HOH

9
ciwo ci fizyczne alkanów
Temperatura wrzenia (tw.)
Alkany od C
1
÷
C
4
i rozga ziony
neopentan
– (CH
3
)
4
C – s gazami w temperaturze pokojowej;
ich tw. s nast puj ce [
o
C]:
metan
−
-162;
etan
−
-88,5;
propan
−
-42;
izobutan
−
-12;
butan
– 0;
neopentan
– 9, 5
Alkany od
n-pentanu
(tw. 36
o
C) i
izopentanu
(tw. 28
o
C) do
n-hepta-dekanu
(tw. 302
o
C, a tt.
22
o
C) s cieczami. Rozga zienia obni aj temperatur wrzenia izomerów.
Za wyj tkiem kilku ni szych alkanów temperatury wrzenia w glowodorów zwi kszaj si o
oko o 20
÷
30
o
C przy wzro cie
cucha o grup CH
2
.
Temperatura topnienia alkanów ro nie wraz z ich mas cz steczkow , ale nie tak regularnie jak
temperatura wrzenia. Rozga zienia obni aj tt. izomerów. Równie domieszki innych zwi zków
obni aj tt. w glowodorów. Od
n-oktadekanu
(tt. 28
o
C) zaczynaj si cia a sta e. Sta e
glowodory to parafina, a wy sze ciek e – olej parafinowy.
Temperatury topnienia i wrzenia wybranych alkanów Tabela 2.2.
Nazwa alkanu
Wzór
tt. [
o
C]
tw.
[
o
C]
metan
CH
4
-183
-162
etan
CH
3
CH
3
-172
-88,5
propan
CH
3
CH
2
CH
3
-187
-42
n-butan
CH
3
(CH
2
)
2
CH
3
-138
0
izobutan
(CH
3
)
2
CHCH
3
-159
-12
n-pentan
CH
3
(CH
2
)
3
CH
3
-130
36
izopentan
(CH
3
)
2
CHCH
2
CH
3
-160
28
neopentan
(CH
3
)
4
C
-17
9,5
n-heksan
CH
3
(CH
2
)
4
CH
3
-95
69
izoheksan
(CH
3
)
2
CH(CH
2
)
2
CH
3
-154
60
3-metylopentan
CH
3
CH
2
CH(CH
3
)CH
2
CH
3
-118
63
2,2-dimetylobutan
(CH
3
)
3
CCH
2
CH
3
-98
50
2,3-dimetylobutan
(CH
3
)
2
CHCH(CH
3
)
3
-129
58
n-heptan
CH
3
(CH
2
)
5
CH
3
-90,5
98
n-oktan
CH
3
(CH
2
)
6
CH
3
-57
126
n-nonan
CH
3
(CH
2
)
7
CH
3
-54
151
n-dekan
CH
3
(CH
2
)
8
CH
3
-30
174
n-undekan
CH
3
(CH
2
)
9
CH
3
-26
196
n-dodekan
CH
3
(CH
2
)
10
CH
3
-10
216
n-tridekan
CH
3
(CH
2
)
11
CH
3
-6
234
n-tetradekan
CH
3
(CH
2
)
12
CH
3
5,5
252
n-pentadekan
CH
3
(CH
2
)
13
CH
3
10
266
n-heksadekan
CH
3
(CH
2
)
14
CH
3
18
280
n-heptadekan
CH
3
(CH
2
)
15
CH
3
22
292
n-oktadekan
CH
3
(CH
2
)
16
CH
3
28
308
n-nonadekan
CH
3
(CH
2
)
17
CH
3
32
320
n-ejkozan
CH
3
(CH
2
)
18
CH
3
36
220
30mmHg

10
Rozpuszczalno
Alkany s bardzo hydrofobowe, nie mieszaj si z wod , nie s zwil ane przez wod i s w niej
nierozpuszczalne. atwo rozpuszczaj si w niepolarnych, niskopolarnych i redniopolarnych
rozpuszczalnikach organicznych. W metanolu rozpuszczaj si w ograniczonym zakresie; przy
wi kszych st eniach nast puje rozdzielenie si warstw. W etanolu ni sze alkany rozpuszczaj
si
atwo, wy sze s abiej. Mieszanki paliwowe zawieraj ce etanol jako dodatek (biopaliwo)
rozwarstwiaj si pod wp ywem wody, dlaczego?
sto
sto alkanów waha si oko o 0,8 g/cm
3
, s wi c l ejsze od wody.
Palno
Wszystkie w glowodory, a wi c i alkany s
atwopalne. Gazowe w glowodory i pary
glowodorów tworz mieszanki wybuchowe z powietrzem.
Zapach
Gazowe i lotne ciek e alkany maj zapach benzynowego rozpuszczalnika do farb i lakierów.
Benzyna – paliwo silnikowe ma zapach zmieniony obecno ci dodatków uszlachetniaj cych.
Sta e i wysokowrz ce ciek e w glowodory s bez zapachu i bez smaku.
ciwo ci chemiczne alkanów
(reaktywno )
Alkany s ma o reaktywne. W pewnych warunkach mog jednak reagowa gwa townie.
Reakcje alkanów:
spalanie;
z fluorem reaguj wybuchowo (nawet w ciemno ciach i w niskich temperaturach);
chlorowanie i bromomowanie wymaga inicjacji;
rozk adaj si pod wp ywem wysokiej temperatury (piroliza, kraking, izomeryzacja),
sulfonowanie, nitrowanie,
wchodz tak e w reakcj z bardzo reaktywnymi odczynnikami, takimi jak HF
.
SbF
5
czy
FSO
3
.
SbF
5
(kwas magiczny).
Spalanie
C
n
H
2n+2
+ O
2
(nadmiar)
→
n CO
2
+ (n + 1) HOH
n-C
5
H
12
+ 8 O
2
→
5 CO
2
+ 6 HOH - 3 538 kcal
Pó spalanie
CH
4
+ O
2
+ HOH
→
2 CO + H
2
gaz syntezowy
Zamiast metanu u ywa si olei odpadowych, wy szych frakcji naftowych, mazutu, asfaltu, a nawet w gla
kamiennego czy koksu.
Niepe ne spalanie
CH
4
+ 1,5 O
2
→
HCOOH + HOH
kwas mrówkowy

11
4 CH
4
+ O
2
→
C
2
H
2
+ 2 CO + 7 H
2
etyn
(g ówna frakcja)
Bromowanie
CH
3
CH
2
CH
3
+ Br
2
h
ν
lub
∆
CH
3
CHBrCH
3
+ HBr
Kraking termiczny
450
o
C
RCH
2
CH
2
CH
2
CH
2
CH
3
→
RCH
2
CH
3
+ CH
2
=CHCH
3
katalizator glinokrzemianowy
Hydrokraking
450
o
C
C
14
H
30
+ H
2
→
C
9
H
20
+ CH
4
+ C
2
H
6
+ C
3
H
8
+ ..........
15 Mpa, kat. glinokrzem
.
CH
3
CH
3
CH
3
CH
3
(CH
2
)
5
CH
3
90-120
o
C
2 Mpa, AlCl
3
CH
3
-CH-CH-CH
3
n-heptan
2,2,3-trimetylobutan
Izomeryzacja
CH
3
CH
2
CH
3
+ HNO
3
CH
3
CH
2
CH
2
NO
2
(25%)
+
CH
3
CHNO
2
CH
3
(40%)
+
CH
3
CH
2
NO
2
(10%)
+
CH
3
NO
2
(25%)
Nitrowanie
1-nitropropan
2-nitropropan
nitroetan
nitrometan
Chlorosulfonowanie
15-35
o
C 80
o
C
Alk-H + SO
2
+ Cl
2
→
Alk-SO
2
Cl
→
Alk-SO
3
Na
- HCl NaOH/HOH
mersole mersolany
Sulfoutlenianie
25-30
o
C
C
n
H
2n+1
CH
2
CH
2
C
m
H
2m+1
+ SO
2
+ 0,5 O
2
→
C
n
H
2n+1
CHCH
2
C
m
H
2m+1
h
ν
, 300 nm
I
SO
3
kwas alkanosulfonowy
12
Cykloalkany
(w glowodory alicykliczne)
cuchy w glowodorowe mog zamyka si w pier cienie tworz c zwi zki cykliczne.
Cykloalkany niepodstawione z
one s z powtarzaj cych si elementów –CH
2
-, tak wi c ich
wzór sumaryczny mo na przedstawi jako (CH
2
)
n
lub C
n
H
2n
, przy czym literk „c” zaznaczmy,
e s to zwi zki cykliczne: c(CH
2
)
n
. Cz sto przedstawiane s one za pomoc wieloboków
foremnych:
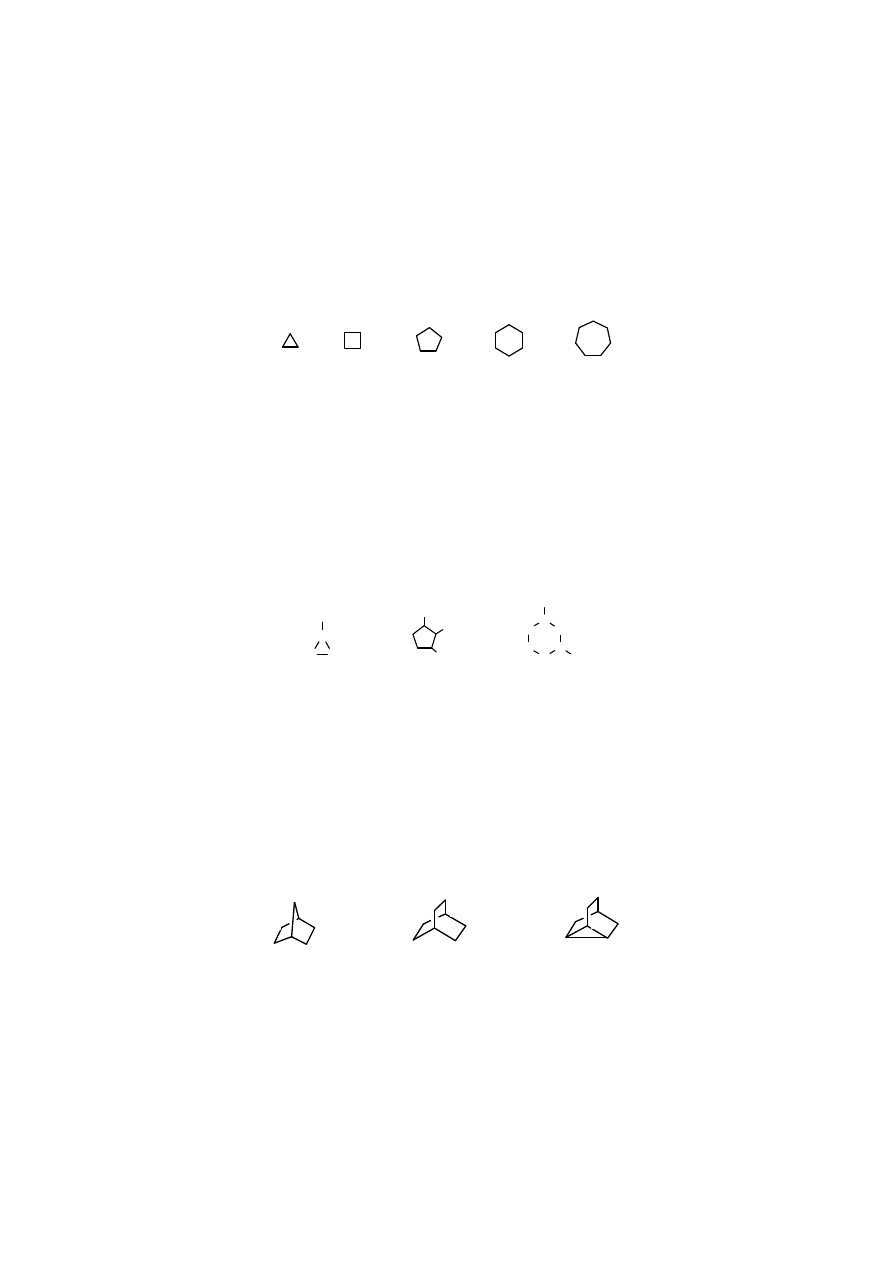
cyklopropan cyklobutan cyklopentan cykloheksan cykloheptan
Rys. 2. 5. Wzory cykloalkanów; w ka dym w le znajduje si element –CH
2
–
Nomenklatura
Nazwy cykloalkanów tworzy si od nazw alkanów zawieraj cych tak sam liczb atomów
gla przez dodanie przedrostku „cyklo”, np.
cyklopropan
,
cyklobutan
, ...
cyklodekan
, itd. W
nazwie wymienia si podstawniki przy czone do pier cienia zaznaczaj c miejsca przy cze
mo liwie najni szymi lokantami, przy czym suma lokantów powinna przyjmowa najni sz z
mo liwych warto :
CH
2
CH
C
H
2
CH
3
C
H
2
C
H
2
C
H
2
C
H
CH
2
C
H
C
4
H
9
C
2
H
5
CH
3
C
2
H
5
C
3
H
7
metylocyklopropan 2-etylo-1-metylo-3- 1-butylo-3-etylo-
-propylocyklopentan cykloheksan
Znane s cykloalkany dicykliczne i policykliczne. Ich nazwy zaczynaj si od podania liczby
pier cieni: bicyklo-, tricyklo-, itd. Nast pnie w nawiasach kwadratowych podaje si liczby
atomów w gla (oddzielone kropkami, np. [2.2.1]) w poszczególnych mostkach, tj.
cuchach
glowych od mostka do mostka (pomi dzy atomami przyczó kowymi), po czym znajduje si
nazwa rdzenia wynikaj ca z liczby atomów w gla tworz cych cz steczk :
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
1
2
3
4
5
6
7
8
bicyklo[2.2.1]heptan bicyklo[2.2.2]oktan tricyklo[2.2.2.0
2,6]
heptan
(
norbornan
) (
nortricyklan
)
Uk ad numeruje si zaczynaj c od jednego atomu przyczó kowego, przez najd
szy mostek do
drugiego atomu przyczó kowego, nast pnie z powrotem do pierwszego atomu przyczó kowego
przez kolejny najd
szy jeszcze nie numerowany mostek; te dwa mostki s uznawane za g ówny
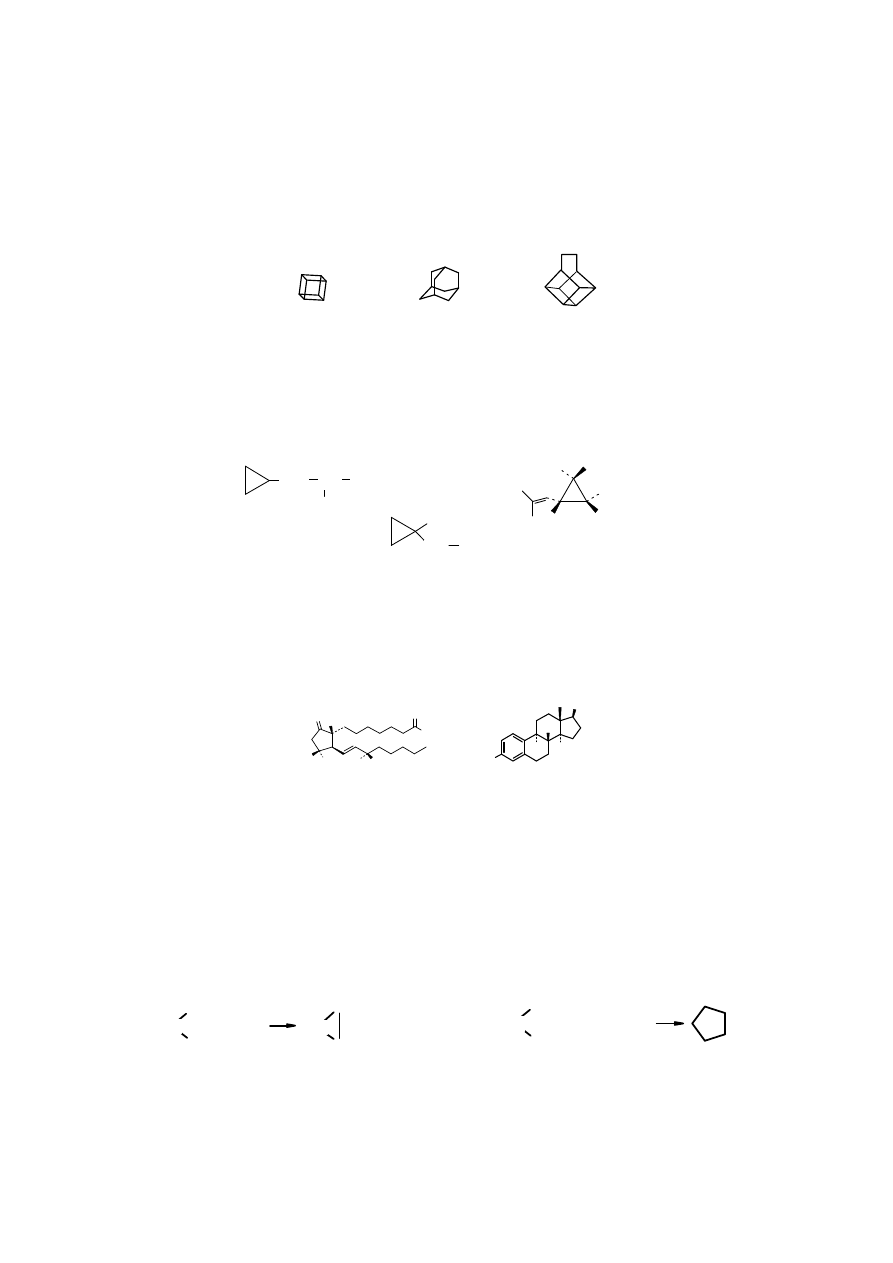
13
pier cie uk adu (na Rys. od C1-C6). Nazw ko czy przypisanie lokantów kolejnemu mostkowi
– 0
2,6
. Dla tego mostka numeracj zaczyna si te od pierwszego atomu przyczó kowego.
Zwi zki policykliczne s tak fascynuj ce, e zsyntezowano wiele specyficznych struktur, których
nazwy oddaj ich kszta t, np.:
kuban adamantan basketan
Wyst powanie i otrzymywanie
Cykliczne alkany raczej nie wyst puj w naturze, natomiast w wielu zwi zkach naturalnych
znajduj si alicykliczne ugrupowania:
CH
3
H
H
C
H
3
COOH
COOH
NH
2
CH
2
CH
COOH
NH
2
CH
hipoglicyna A
kwas chryzantemowy
wyst puje w owocach
kw. 1-aminocyklopropano-
naturalny pestycyd
karboksylowy
, prekursor etenu,
czynnika przyspieszaj cego
dojrzewanie owoców
Pi ciocz onowe pier cienie znajduj si w prostaglandynach (hormonach tkankowych) i
hormonach p ciowych, np. w
estrodiolu
:
OH
O
OH
H
H
OH
H
O
O
H
H
OH
H
H
Rys. 1.
Prostaglandyna E
1
(PGE
1
)
estradiol
Otrzymywanie cykloalkanów
Naj atwiej otrzymuje si pi ciocz onowe i sze ciocz onowe cykliczne zwi zki organiczne, w tym
cykloalkany. Zarówno mniejsze (trój- i czterocz onowe), jak i wi ksze (od siedmiocz onowego w
wzwy ) powstaj z mniejsza wydajno ci .
Cyklizacja dihalogenoalanów
(eliminacja halogenów z oligometylenów za pomoc metali)
CH
2
Cl
CH
2
Cl
CH
2
CH
2
H
2
C
H
2
C
+ Zn
CH
2
-CH
2
-Br
CH
2
-CH
2
-Br
H
2
C
+
2
Na
1,3-dichloropropan
cyklopropan 1,5-dibromopentan
cyklopentan
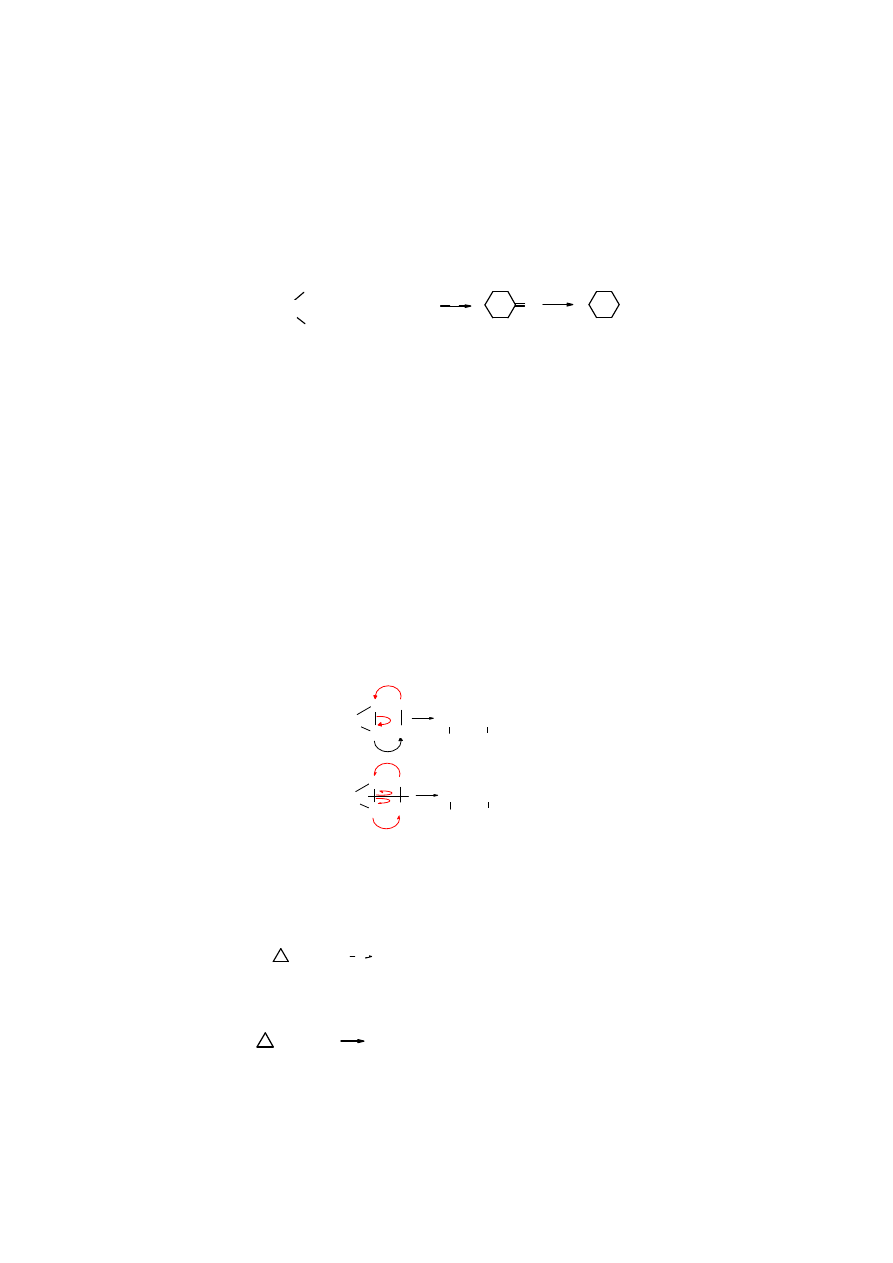
14
Znane s sposoby otrzymywania pochodnych cykloalkanów, które nast pnie mo na
przeprowadzi w w glowodory. Sole wapniowe kwasów 1,6-heksanowego lub 1,7-heptanowego
w trakcie dekarboksylacji przekszta caj c si w odpowiednie ketony. Ketony redukuje si do
alkanów znanymi metodami, np. metod Clemmensena). W ten sposób nie da si otrzyma trój-
ani czterocz onowych pier cieni.
CH
2
-CH
2
-COO
CH
2
-CH
2
-COO
O
H
2
C
-
-
Ca
2+
Zn(Hg)
+
H
3
O
∆
pimelinian wapnia cykloheksanon cykloheksan
ciwo ci fizyczne
Cyklopropan
i
cyklobutan
w temperaturze pokojowej s gazami; ich temperatury wrzenia
wynosz odpowiednio – 33,3 i 12,9
o
C. Od
cyklopentanu
do
cyklodekanu
to ciecze, a wy sze
cia a sta e. Podobnie jak alkany s hydrofobowe, tworz mieszanki wybuchowe z powietrzem i
nale do substancji atwopalnych.
ciwo ci chemiczne
Cyklopropan
Cyklopropan
i
cyklobutan
ró ni si reaktywno ci od wy szych homologów cykloalkanów.
ciwo ci chemiczne od
cyklopentanu
wzwy s bardzo zbli one do alkanów, natomiast
cyklopropan
i
cyklobutan
zachowuj si w niektórych reakcjach jak zwi zki nienasycone, tzn.
ulegaj reakcjom addycji z równoczesnym otwarciem pier cienia:
Y
Y
CH
2
-CH
2
CH
2
Z
Y
CH
2
-CH
2
CH
2
Z
Y
H
2
C
CH
2
CH
2
Z
addycja
elektrofilowa
addycja
rodnikowa
H
2
C
CH
2
CH
2
Z
Rys. 2.6. Addycja do cyklopropanu z równoczesnym rozerwaniem pier cienia mo e biec mechanizmem
elektrofilowym, np. z Cl
2
/FeCl
3
lub rodnikowym, np. z chlorem czy bromem w obecno ci wiat a
Do rodnikowego przy czenia bromu dochodzi pod wp ywem wiat a:
+ Br
2
h
ν
Br-CH
2
-CH
2
-CH
2
-Br
1,3-dibromopropan
Elektrofilowe przy czenie chloru dokonuje si w obecno ci chlorku elaza:
+ Cl
2
FeCl
3
Cl-CH
2
-CH
2
-CH
2
-Cl
1,3-dichloropropan
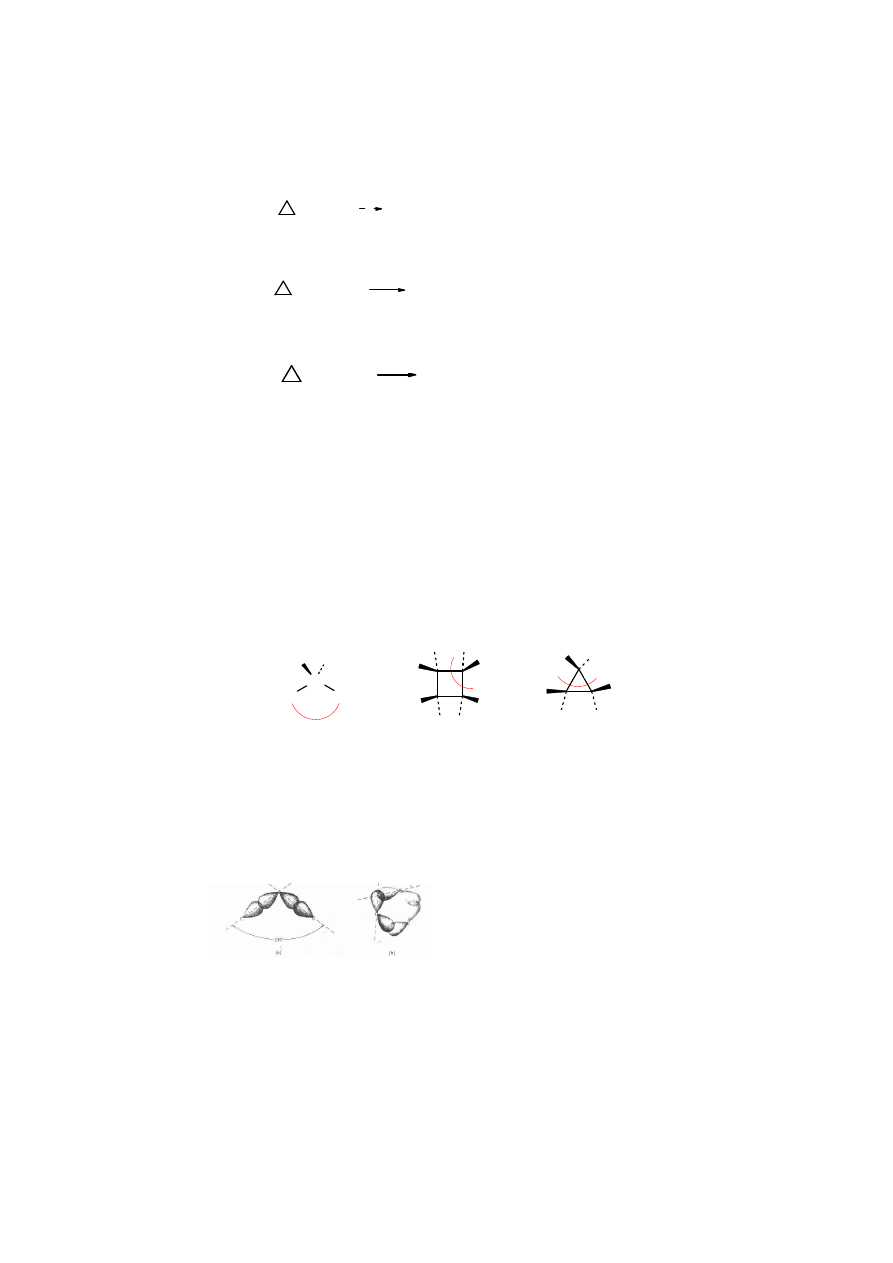
15
Addycja jodowodoru nast puje w podwy szonej temperaturze:
+ HI
∆
I-CH
2
-CH
2
-CH
2
-I
1,3-dijodopropan
Cyklopropan
rozrywa si równie pod wp ywem kwasu siarkowego:
+ H
2
SO
4
CH
3
-CH
2
-CH
2
-OH
n-propanol
st
ony
Uwodornienie
cyklopropanu
równie otwiera pier cie :
+ H
2
CH
3
-CH
2
-CH
3
80
o
C
Ni
n-propan
Cyklobutan
jest mniej aktywny w tego typu reakcjach, nie ulega rozerwaniu pod wp ywem
chloru, bromu ani halogenowodorów. Jego uwodornienie nast puje dopiero w temperaturze
120
o
C. Jeszcze mniej reaktywne s wy sze cykloalkany;
cyklopentan
otwiera si w reakcji z
wodorem dopiero powy ej 300
o
C.
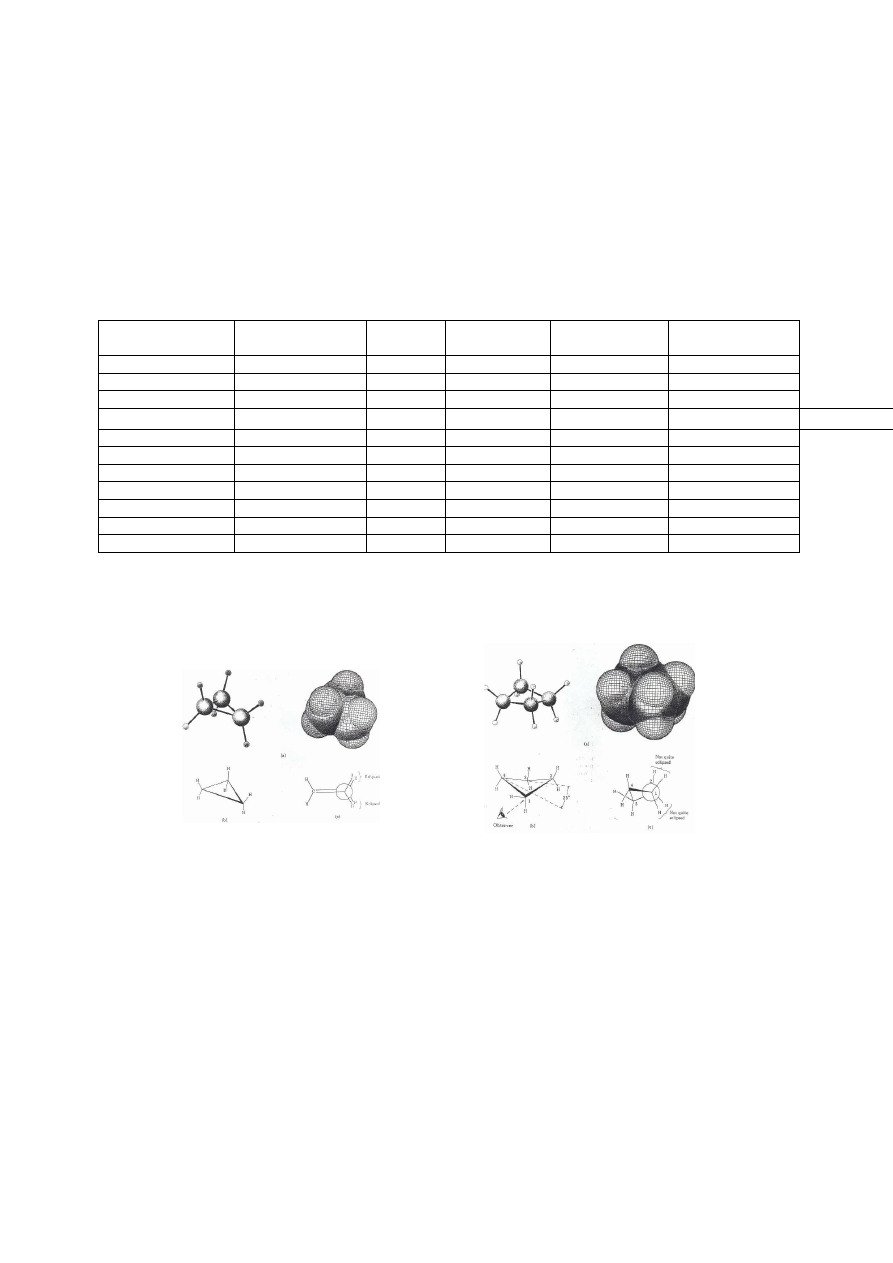
Jaka jest przyczyna takich ró nic w reaktywno ci podobnych zwi zków? Wed ug starszej
hipotezy utworzenie pier cieni trój- i czterocz onowych wymaga zniekszta cenia wi za ,
wygi cia ich w taki sposób, e k t tetraedryczny (109,5
o
), typowy dla atomów C
zhybrydyzowanych sp
3
, zostaje zmniejszony odpowiednio do 60
o
lub 90
o
. Taka zmiana wymaga
energii, o warto której zmniejsza si energia wi za . Obrazowo takie wi zania nazywane s
napr onymi (od napr onej spr yny). Os abione wi zania atwiej ulegaj rozerwaniu, a do
uwolnionych atomów C przy cza si reagent.
H
H
H
H
H
H
60
o
H
H
H
H
H H
H
H
90
o
C
H
3
CH
3
H
H
C
109,5
o
Rys. 2. 7. Utworzenie mniejszych pier cieni wymaga zmniejszenia k ta tetraedrycznego pomi dzy wi zaniami C
−
C,
a to obni a energi tych wi za
Zgodnie z teori orbit molekularnych (MO) w ma ych pier cieniach energia wi za C
−
C jest
mniejsza poniewa orbitale atomowe tworz ce wi zanie
σ
nie nak adaj si osiowo, lecz pod
pewnym pod k tem, a tym samym stopie na
enia (ca ka pokrycia) jest mniejsza.
Rys. 2. 8. Osiowe nak adanie si orbital sp
3
(a) i pod zmniejszonym k tem w cyklopropanie (b)
Energia wewn trzna
cyklopropanu
obliczona na podstawie ciep a spalania jest o 8,8
kcal/równowa nik –CH
2
– wy sza ni w strukturze ca kowicie beznapi ciowej –
cykloheksanie
czy w alkanach alifatycznych. Ze spalanie równowanika –CH
2
– niezale nie z jakiego
glowodoru pochodzi uzyskuje si mol CO
2
i mol HOH, ró nica warto ci wydzielonego ciep a
16
spalania (
∆
H) odzwierciedla energi wewn trzn cz steczki ulegaj cej spalaniu. Im wi ksza
warto
∆
H, tym mniejsza energia wewn trzna cz steczki (zwi zek bardziej stabilny), a to
oznacza, e wi zania C-C (g ównie) s silniejsze.
–CH
2
– + 3/2 O
2
→
CO
2
+ HOH + ciep o
(
∆
H
CH2
dla uk adu beznapi ciowego = 157,4 kcal)
Tabela 2.3.
Alkan
wzór
∆
H,
kcal/mol
∆
H
CH2
,
kcal/mol
∆
H
CH2
– 157,4
Ró nica energii
wew. kcal/mol
cyklopropan
c(CH
2
)
3
499,8 166,6
9,2
27,6
cyklobutan
c(CH
2
)
4
655,8 163,9
6,5
26,0
cyklopentan
c(CH
2
)
5
793,6 158,7
1,3
6,5
cykloheksan
c(CH
2
)
6
944,5 157,4
0
0
n-heksan
CH
3
(CH
2
)
4
CH
3
944,4 157,4
0
0
cykloheptan
c(CH
2
)
7
1108
158,3
0,9
6,3
cyklooktan
c(CH
2
)
8
1268,8 158,6
1,2
9,6
cyklononan
c(CH
2
)
9
1428,3 158,7
1,3
11,7
cyklodekan
c(CH
2
)
10
1586
158,6
1,2
12,0
cyklopentadekan
c(CH
2
)
15
2362
157,5
0,1
~ 0
cykloheptadekan
c(CH
2
)
17
2672
157,2
-0,2
~ 0
Konformacja
cyklopropanu
jest ustalona i nie ulega przemianom podobnym jak zwi zkach
cuchowych, gdzie mo liwy jest swobodny obrót wokó pojedynczych wi za C
−
C. W
cyklopropanie
obrót wokó takiego wi zania spowodowa by jego rozerwanie.
Rys. 2. 9. Modele cz steczki
cyklopropanu
(a) i jej Modele cz steczki cyklobutanu (a) i jej rzuty. Konformacja
rzuty (b i c). U
enie atomów wodoru na s siadu- cz steczki
cyklobutanu
jest ustalona. Atomy wodoru na
cych atomach w gla jest naprzeciwleg e (c); s siaduj cych atomach w gla uk adaj si naprzemianlegle
W
cyklopentanie
t wewn trzny pi cioboku foremnego (108
o
) ma warto zbli on do warto ci
ta tetraedrycznego, tak wi c p aska cz steczka
cyklopentanu
powinna by bez napi ciowa.
Jednak ciasno upakowane atomy w cz steczce cyklopentanu odpychaj si , deformuj j . Przez
to nie jest ona zupe nie p aska, ale za to energia wewn trzna cyklopentanu jest tylko o 1,3
kcal/równowa nik –CH
2
– wy sza ni w strukturach ca kowicie beznapi ciowych.
Cykloheksan
ciwo ciami chemicznymi przypomina raczej alkany alifatyczne ni ni sze
cykloalkany. Jego pier cie nie jest p aski. Dzi ki mo liwo ci zachowania swobodnego obrotu

17
wokó wi za C
−
C cz steczka przyjmuje konformacje zapewniaj ce k t tetraedryczny pomi dzy
wi zaniami poszczególnych atomów w gla. Takich konformacji mo e by bardzo du o. Po ród
nich wyró nia si konformacje kra cowe: krzes ow , pó krzes ow , ódkow i skr conej ódki.
Ró ni si one trwa
ci . Najbardziej trwa a (o najni szej energii) jest konformacja
ódkowa (schemat). Rzeczywista cz steczka
cykloheksanu
jest mieszanin konformerów
cych w stanie równowagi dynamicznej. Udzia ich w ca ej populacji jest proporcjonalny do
ich trwa
ci. Przej cie pomi dzy poszczególnymi konformerami dokonuje si poprzez obrót
wokó C
−
C wi za .
Schemat 2. 10. Zale no energii potencjalnej cykloheksanu od konformacji cz steczki
Wzór szkieletu w glowego konformeru krzes owego
cykloheksanu
przedstawiany jest tak jak na
schemacie lub (cz ciej) w uk adzie przypominaj cym krzes o z oparciem i podnó kiem:
Rys. 2. 11. Schematycznie przedstawiony szkielet w glowy cz steczki cykloheksanu w konformacji krzes owej
Rys. 2. 12 Modele cz steczki cykloheksanu Rys. 2. 13. W cz steczce
cykloheksanu
mo na wyró ni
dwa elementy n-butanowe o konformacji synklinalnej:
C6, C1, C2, C3 i drugi C3, C4, C5 i C6.
Warto zwróci uwag na dwie po ówki cz steczki
cykloheksanu
, maj one taka sam
konformacj jak konformer synklinalny
n-butanu
. Jest to widoczne na rysunku:
Atomy wodoru zwi zane z tym samym atomem w gla w cz steczce cykloheksanu nie s
równocenne; wi zanie jednego jest osiowe (równoleg e do pionowej osi cz steczki), a drugiego
jest lekko odchylone od p aszczyzny cz steczki. Ten pierwszy atom wodoru nazywa si
aksjalnym, za ten drugi ekwatorialnym. W cz steczce cykloheksanu znajduje si 6 aksjalnych i
6 ekwatorialnych atomów wodoru.

18
H
H
H
H
H
H
H
H
H
H
H
H
cz steczki
aksjalny
ekwatorialny
Rys. 2. 14. Aksjalne i ekwatorialne atomy wodoru
Wi kszy podstawnik ni atom wodoru (np. metyl) zajmuj cy pozycj aksjaln odpycha si
wzajemnie nawet z atomami wodoru, przez co konformer, w którym wi kszy podstawnik
zajmuje pozycj aksjaln jest mniej trwa y od tego z du ym podstawnikiem w pozycji
ekwatorialnej. Oba konformery znajduj si w równowadze dynamicznej.
CH
3
H
H
H
H
H
H
H
H
H
H
H
CH
3
H
H
H
H
H
H
H
H
H
H
H
Rys. 2. 15. Równowaga dynamiczna pomi dzy konformerami krzes owymi z grup metylow w po
eniu
aksjalnym (a) i ekwatorialnym (e)
Du y podstawnik w pozycji akcjalnej odpycha si równie z grup –CH
2
– przy C3. Jest to
podobny destabilizuj cy uk ad jak w synklinalnej konformacji
n-butanu
.
CH
3
C
H
3
CH
3
CH
3
1
2
3
4
5
6
1
3
5
6
grupa metylowa aksjalnie
n-butan
w konformacji
zwi zana z
cykloheksanem
synklinalnej
CH
3
C
H
3
CH
3
CH
3
1
2
3
4
5
6
1
3
5
6
grupa metylowa ekwatorialnie
n-butan
w konformacji
zwi zana z
cykloheksanem
naprzemianleg ej
Rys. 2. 16. Porównanie konformacji cz steczek
cykloheksanu
i
n-butanu
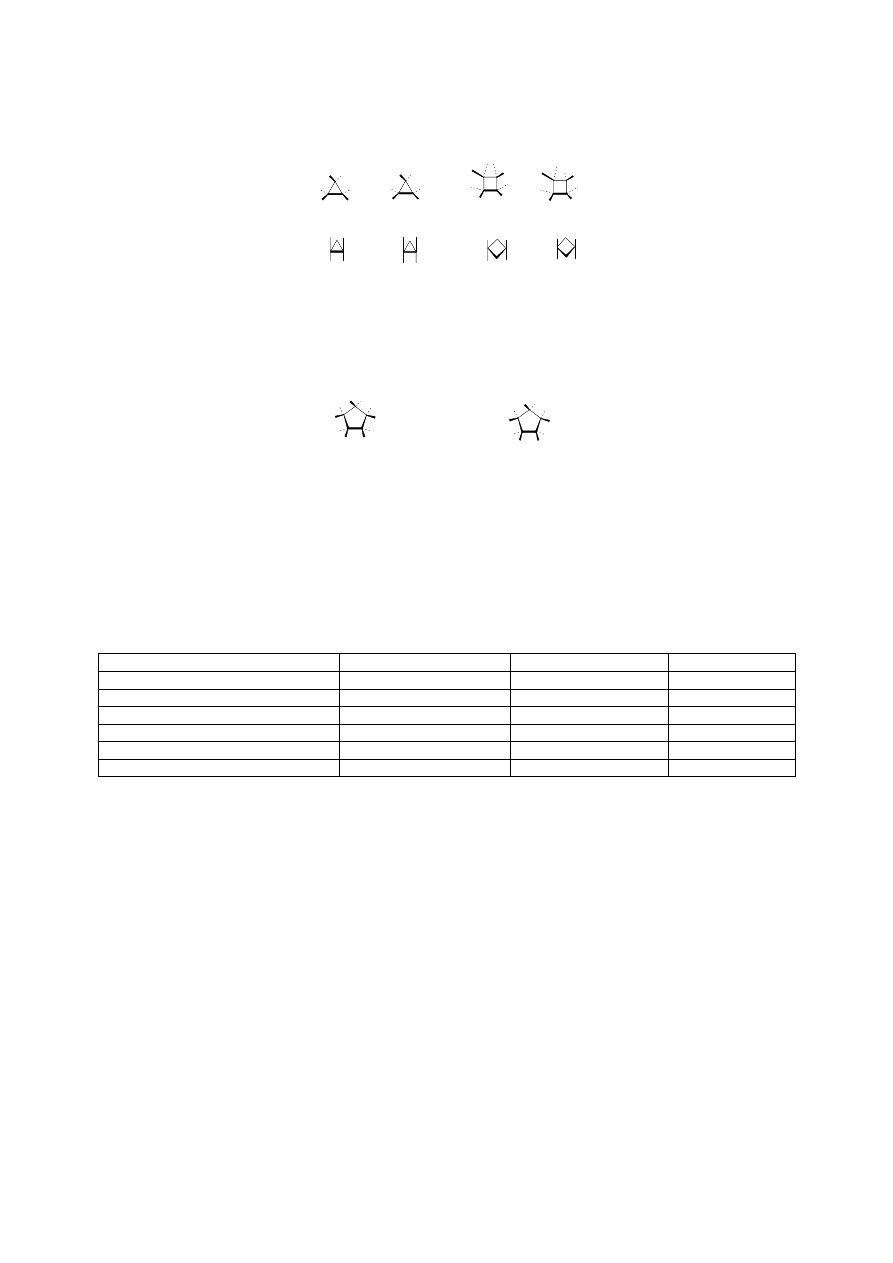
Izomeria cis-trans dipodstawionych cykloalakanów
Dipodstawione cykloalkany niezale nie od wielko ci pier cienia mog wyst powa w postaci
dwóch izomerów cis lub trans. W izomerze cis oba podstawniki znajduj si po tej samej stronie
pier cienia, a w trans po stronach przeciwnych. W pier cieniach p askich (3-5 cz onowych) nie
ma problemu z okre leniem izomeru.
19
H
C
H
3
H
CH
3
H
H
C
H
3
H
CH
3
H
C
H
3
H
H
H
CH
3
C
H
3
H
H
H
CH
3
H
H CH
3
H
H
CH
3
H
H CH
3
H
CH
3
H
3
C
H
3
C
H
3
C
H
3
C
1,2-dimetylocyklopropan 1,3-dimetylocyklobutan
cis trans cis tras
Rys. 2. 17. Stereoizomery
1,2
-
dimetylocyklopropanu
i
1,2
-
dimetylocyklobutanu
H
CH
3
H
H
H
H
H
H
C
H
3
H
H
H
H
H
H
H
H
H
C
H
3
CH
3
cis-1,2-dimetylocyklopentan
trans-1,2-dimetylocyklopentan
tw. [
o
C] 99,5 91,9
Rys. 2. 18. Stereoizomery
1,2-dimetylocyklopentanu
Stereoizomery cis-trans s ró nymi zwi zkami, ró ni si w
ciwo ciami fizycznymi i
chemicznymi. W tabeli 1. podane s temperatury wrzenia i topnienia czterech izomerów
dimetylocykloheksenu
i dwóch izomerów
1,2-dichlorocykloheksenu
.
Wybrane w
ciwo ci fizyczne niektórych dipodstawionych izomerów cykloheksanu Tabela. 2. 3.
Pochodne cykloheksanu
Stereoizomer
tt. [
o
C]
tw. [
o
C]
1,2-dimetylo-
cis
-50
130
1,2-dimetylo-
trans
-89
124
1,3-dimetylo-
cis
76
120
1,3-dimetylo-
trans
-90
123
1,2-dichloro-
cis
-6
93
22 a
1,2-dichloro-
trans
-7
75
16 a
a
– ci nienie w mm s upa Hg, przy jakim oznaczono temperatur wrzenia
Cz steczka
cykloheksanu
nie jest p aska, dlatego te zaliczenie jego dipochodnych do izomeru
cis lub trans mo e pocz tkowo sprawia trudno ci. Jako odniesienie trzeba bra p aszczyzn
pier cienia przechodz
przez jego rodek – p aszczyzn prostopad do pionowej osi
cz steczki. W pochodnych
dicykloheksanu
rozró nia si takie, w których podstawnik
przy czony jest akcjalnie (a) lub ekwatorialnie (e). Dipodstawione pochodne cykloheksanu
mog by zatem zwi zane w sposób a,a lub e,e (izomery trans) oraz a,e lub e,a (izomery cis).
Izomery a,a i e,e s z sob w stanie równowagi dynamicznej, podobnie jak izomery a,e i e,a.
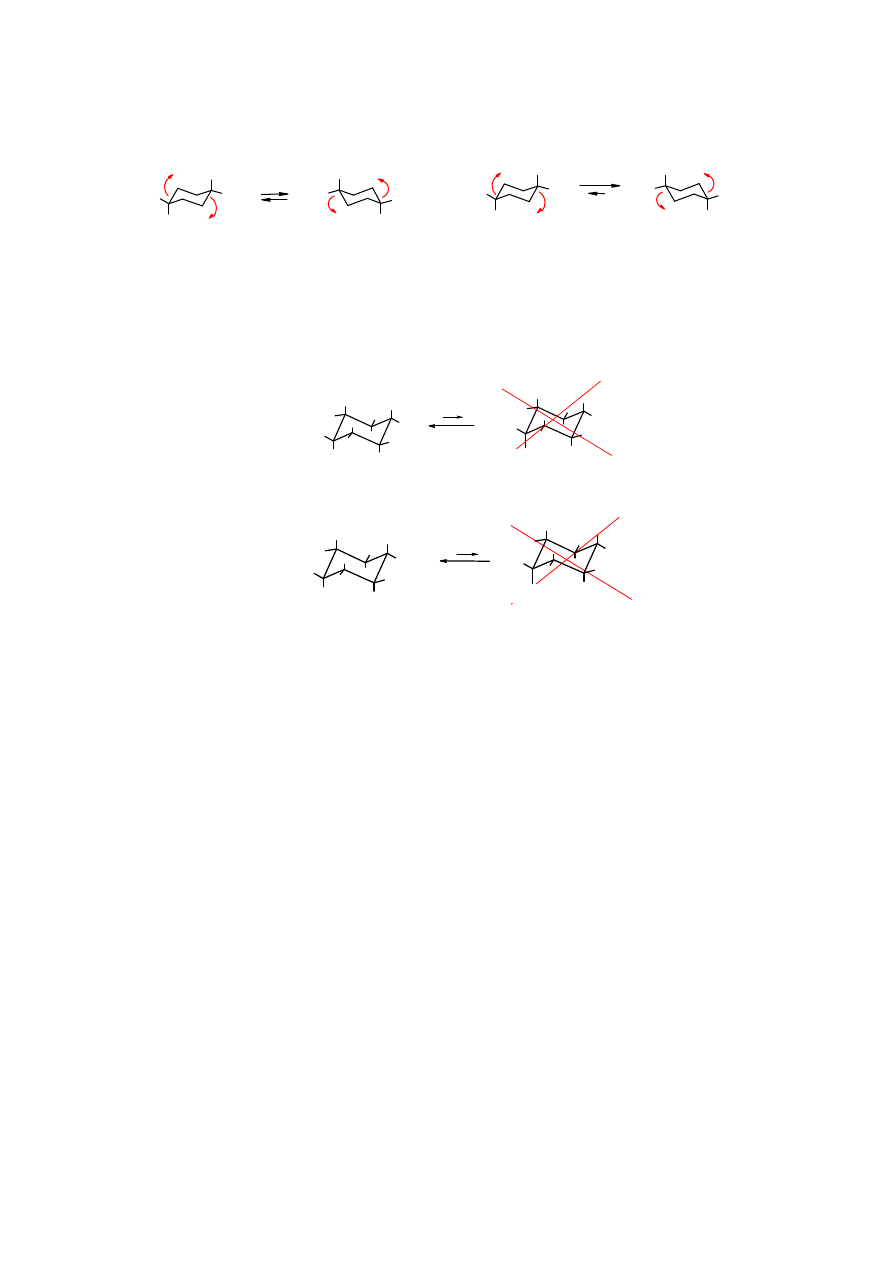
20
H
CH
3
H
CH
3
CH
3
H
H
C
H
3
H
CH
3
CH
3
H
H
CH
3
H
C
H
3
cis-1,4-dimetylocykloheksan
konformer
a,e (aksjalno-ekwatorialny) e,a (ekwatorialno-aksjalny)
trans-1,4-dimetylocykloheksan
konformer
a,a (diaksjalny) e,e (diekwatorialny)
Rys. 2. 19. Równowaga konformacyjna dipochodnych cykloheksanu
Du e podstawniki, takie jak brom czy tert-butyl z regu y zajmuj pozycje ekwatorialn ,
wymuszaj c w ten sposób konformacj pier cienia cykloheksanowego.
CH
3
H
H
H
H
H
H
H
(CH
3
)
3
C
H
H
H
H
H
H
H
H
CH
3
H
H
H
H
H
(CH
3
)
3
C
cis: ekwatorialno-akcjalna akcjalno-ekwatorialna
H
H
H
H
H
H
CH
3
H
(CH
3
)
3
C
H
H
H
CH
3
H
H
H
H
H
H
H
H
H
H
(CH
3
)
3
C
trans: ekwatorialno-ekwaterialna akcjalno-aksjalna
Rys. 2. 20. Stabilna konformacja
1-tert-butylo-4-metylocykloheksanu
Wyszukiwarka
Podobne podstrony:
Alkany (2)
Alkany 3 id 57982 Nieznany (2)
Alkany, Szkoła
ściągi chemia szereg homologiczny alkany, alkeny, alkiny
I ALKANY
ALKANY
alkany i spółka b dobree notatki
Alkany i cykloalkany(1)
alkany liniowe
Alkany
Alkany nie reag, CHEMIA, Chemia organiczna
Alkany 2
2 Alkany
Alkany (1)
alkany alkeny alkiny id 57988 Nieznany
Alkany, alkeny, alkiny i SE do aromatu
alkany
Alkany, sciągi, chemia
alkany
więcej podobnych podstron