2. A L K A N Y
A. Kołodziejczyk Gdańsk 2010.02
2.1 Wprowadzenie
Węglowodory, czyli połączenia zawierające wyłącznie atomy węgla i wodoru (CnHm) uważane się za związki macierzyste substancji organicznych, tzn. że można z nich wyprowadzić wszystkie inne związki organiczne, które mogą one być traktowane jako pochodne węglowodorów.
Węglowodory dzielą się na alifatyczne (łańcuchowe), cykliczne i aromatyczne.
Węglowodory alifatyczne i cykliczne dzielą się na węglowodory nasycone (zawierające jedynie pojedyncze wiązania pomiędzy atomami węgla: C−C), czyli alkany lub cykloalkany oraz nienasycone, a pośród nich są alkeny (węglowodory z podwójnym lub podwójnymi wiązaniami: C=C) i alkiny (węglowodory z potrójnym lub potrójnymi wiązaniami: C≡C) i odpowiednio cykloalkeny i cykloalkiny.
Alkany, czyli węglowodory nasycone o ogólnym wzorze CnH2n+2 dzielą się na węglowodory nasycone prostołańcuchowe (alifatyczne, inaczej normalne dawniej znane jako parafinami),
węglowodory rozgałęzione (izoalkany lub izoparafiny)
oraz węglowodory pierścieniowe (cykloalkany, w. cykloalifatyczne, dawniej zwane naftenami).
Wszystkie atomy C w alkanach mają hybrydyzację sp3.
2.2 Alkany prostołańcuchowe
Chociaż w cząsteczkach alkanów prostołańcuchowych atomy węgla powiązane są z sobą szeregowo, to utworzone w ten sposób łańcuchy nie są podobne do rozciągniętej nitki czy raczej prostego drutu kolczastego ze sterczącymi jak kolce atomami wodoru.
Tetragonalny kąt pomiędzy wiązaniami atomu węgla sp3 wymusza zygzakowaty układ atomów C, a możliwość swobodnego obrotu wokół wiązania C−C powoduje, że cząsteczki mogą występować w różnej konformacji, tzn. przyjmują różne kształty.
Zarówno etan, jak i propan mogą występować w konformacjach naprzeciwległej i naprzemianległej oraz pośrednich. Wraz ze wzrostem długości łańcucha węglowodorowego rośnie możliwość przyjmowania przez cząsteczkę jeszcze bardziej zróżnicowanych kształtów. Taka różnorodność kształtów występuje w roztworze i w stanie gazowym, przy czym największa jest populacja konformerów najtrwalszych. W stanie krystalicznym cząsteczki przyjmują zwykle jednolity kształt.
Zwykle, pisząc, np. schematy reakcji nie ma potrzeby przedstawiać wzorów w tak rozbudowanej formie, korzystamy wówczas z zapisów uproszczonych; np. dla n-heksanu:
Można również wzór węglowodoru przedstawić w formie szkieletowej.
Wszystkie związki organiczne różniące się od innych jednostką -CH2- nazywają się homologami. Homologi oczywiście należą zawsze do tej samej grupy związków. Wszystkie alkany są homologami metanu i każdego innego alifatycznego węglowodoru nasyconego.
2.3 Izoalkany - węglowodory nasycone rozgałęzione
W węglowodorach rozgałęzionych jeden lub więcej atomów węgla łączy się z więcej niż z dwoma atomami węgla, w wyniku czego w takim miejscu łańcucha węglowodorowego tworzy się rozgałęzienie:
Łańcuch węglowy alkanu zawierający rozgałęzienia; dla uproszczenia podane są tylko wiązania C-C
2.4 Nomenklatura (nazewnictwo) alkanów
Dla pierwszych czterech alkanów - od C1-C4 używa się nazw zwyczajowych.
metan etan propan butan
Nazwy alkanów od C5 wzwyż tworzy się poprzez dodanie końcówki „n” do liczebników greckich lub łacińskich, np.:
pentan (5); heksan (6); heptan (7); oktan (8); nonan (9); dekan (10); undekan (11); dodekan (12); tridekan
(13); tetradekan (14) ... ejkozan (20); henejkozan (21); dokozan (22); trikozan (23) ...
triakontan (30); hentriakontan (31); dotriakontan (32) ...
Wyżej podane nazwy odnoszą się do alkanów prostołańcuchowych, czyli normalnych. Jeżeli chcemy zaznaczyć ten fakt to nazwę poprzedzamy literką „n-„ pisaną kursywą, np.: n-butan, n-pentan czy n-nonan. Przedrostek „n-„ może również poprzedzać wzór sumaryczny, np.: n-C4H10, n-C5H12 czy n-C9H20.
CH3CH2CH2CH3 CH3(CH2)3CH3 CH3(CH2)7CH3
butan (n-butan) pentan (n-pentan) nonan (n-nonan)
W węglowodorach rozgałęzionych podajemy nazwy łańcuchów bocznych, które poprzedzają lokanty, czyli numery atomów węgla łańcucha głównego, z którymi związane są łańcuchy boczne, np. nazwa 2-metylopropan oznacza, że przy drugim atomie węgla propanu znajduje się reszta metylowa, czyli CH3.
Węglowodory rozgałęzione są izomerami węglowodorów normalnych.
Heksan może występować w postaci 5 izomerów konstytucyjnych, oktan ma ich 18, a dekan aż 75. Wraz ze wzrostem liczby atomów węgla w łańcuchu, liczba możliwych izomerów węglowodorów gwałtownie wzrasta.
Izomery węglowodorów zawierających do 5 atomów węgla mogą być rozróżniane za pomocą specjalnych przedrostków: izo-, sec-, tert- czy neo-, w skrócie i-, s- lub t- (neo- nie ma skrótu). Skrót izo- oznacza izomer alkanu normalnego, sec- lub tert- odpowiednio obecność drugo- lub trzeciorzędowego atomu węgla, a neo- „nowy” w stosunku do poprzednio znanego.
Heksan może występować w postaci 5 izomerów konstytucyjnych, oktan ma ich 18, a dekan aż 75. Wraz ze wzrostem liczby atomów węgla w łańcuchu, liczba możliwych izomerów węglowodorów gwałtownie wzrasta.
Reszta alkanu po formalnym oderwaniu jednego atomu wodoru nosi nazwę alkilu lub grupy (reszty) alkilowej - to nie jest rodnik! Rodnik zawiera niesparowany elektron; reszta alkilowa może być rodnikiem, jeżeli występuje w nim pojedynczy elektron, np.: .CH3 - rodnik metylowy.
Nazwę alkilu tworzy się z nazwy alkanu poprzez zamianę przyrostku „-an” na „-yl” lub „-il” (po spółgłoskach g, k i l): metyl (CH3-) od metanu, etyl (CH3CH2-) od etanu, propyl (CH3CH2CH2-) od propanu, izopropyl (CH3CHCH3) także od propanu, butyl (CH3(CH2)2CH2-) od butanu,
I
izobutyl [(CH3)2CHCH2-] od izobutanu, tert-butyl [(CH3)3C-] także od izobutanu, pentyl (CH3CH2CH2CH2CH2-) od pentanu (nie zaleca się stosowanie dawnej nazwy amyl).
W nazwie dekan spółgłoska „k” zostaje zamieniona na „c”, np.
decyl (CH3(CH3)8CH2−) od dekanu, a undecyl (CH3(CH3)9CH2−) od undekanu.
2.5 Nomenklatura systematyczna wg IUPAC
Jednolite zasady nazywania związków organicznych są bardzo ważne, ponieważ trzeba tak jednoznacznie nazywać miliony indywiduów chemicznych, żeby przynajmniej specjalista był w stanie zorientować się o jaki związek chodzi. Tworzenie zasad nazewnictwa (nomenklatury) zostało powierzone Międzynarodowej Unii Chemii Czystej i Stosowanej, w skrócie IUPAC (ang. International Union of Pure and Appied Chemistry).
Propozycja ujednolicenia zasad nazewnictwa związków organicznych została wysunięta już w 1892 r. w Genewie, później rozszerzono ją w 1930 r. w raporcie Komitetu Reformy Słownictwa Chemii Organicznej przy Międzynarodowej Unii Chemii (IUP). Nad zasadami nomenklatury związków organicznych IUPAC pracuje w sposób ciągły. W Polsce Polskie Towarzystwo Chemiczne (PTChem) powołało w 1974 r. Komisję Nomenklaturową Chemii Organicznej, której zadaniem jest dostosowanie polskich nazw do zasad IUPAC. Najważniejsze ustalenia tej Komisji zawarte są w opracowaniach pt.: Nomenklatura związków organicznych, PTChem, Warszawa 1992 i Przewodnik do nomenklatury związków organicznych, PTChem, Warszawa 1994. Opublikowano też zalecenia tej komisji dotyczące nazewnictwa wybranych grup związków, w tym węglowodanów, steroidów, rodników i jonów.
W nazwie związku organicznego wyróżnia się trzy człony
PRZEDROSTEK - RDZEŃ - PRZYROSTEK
określa: miejsce, liczbę i liczbę atomów C symbole grup funkcyjnych
nazwę podstawnika (ów) w łańcuchu głównym
Nazwy podstawników znajdują się w przedrostku, a symbole grup funkcyjnych w przyrostku.
2.5.1 Nomenklatura alkanów rozgałęzionych wg IUPAC
Tworzenie nazwy rozgałęzionego alkanu rozpoczyna się od rozpoznania najdłuższego łańcucha, który jako łańcuch główny będzie podstawą nazwy rdzenia.
heksan oktan
A i B nieprawidłowo dobrane łańcuchy główne
Prawidłowa nazwa węglowodoru 4-etylononan
Lokanty (liczby określające położenie podstawników w łańcuchu - numery atomów) należy tak przypisywać, żeby podstawnik (grupa funkcyjna) otrzymał możliwie najniższą wartość. W powyższym wzorze C, w którym numeracja atomów węgla jest prawidłowa, etyl znajduje się przy czwartym atomie węgla i otrzymuje lokant 4, wobec czego prawidłowa nazwa tego węglowodoru brzmi 4-etylononan. Gdyby numerację zacząć od drugiego końca, to etyl byłby związany z szóstym atomem węgla; lokant 6 jest nieprawidłowy, ponieważ 6>4.
Jeżeli w cząsteczce występują rozgałęzienia drugiego i wyższych rzędów (rozgałęzienia z rozgałęzień), to te części nazw podajemy w nawiasie lub kolejnych nawiasach.
Dla prostszych podstawników przyjęto nazwy bez lokantów.
Stosując uproszczone nazwy krótkich rozgałęzionych grup alkilowych powyżej omawiany alkan można nazwać krócej.
Jeżeli we wzorze alkanu znajduje się kilka łańcuchów bocznych, to atomy węgla w łańcuchu należy tak ponumerować, żeby pierwsze rozgałęzienie otrzymało najniższy z możliwych lokantów:
numeracja atomów C (przypisanie lokantów) 3-etylo-4-metyloheptan
Nazwy podstawników (łańcuchów bocznych) zajmują w nazwie związku miejsca zgodnie z kolejnością alfabetyczną, przy czym bierze się pod uwagę pierwszą literę podstawnika, a nie liczebnika określającego liczbę tych podstawników, czy rzędowość atomów C, tzn. etyl będzie przed dimetylem, a tert-butyl przed etylem.
Lokanty w prawidłowo napisanej nazwie związku umieszcza się przed nazwą podstawnika. Po lokancie lub przed i po, jeżeli znajduje się wewnątrz nazwy, umieszcza się myślnik: 8-, lub -4-. Kolejne lokanty rozdziela się przecinkiem (-3,5-), a liczbę takich samych podstawników określa się liczebnikiem łacińskim (di-, tri-, tetra-, penta-, heksa-, itd.).
2.6 Źródła alkanów
ropa naftowa (duża różnorodność, od gazowych poprzez ciekłe do stałych);
gaz ziemny (metan - gaz suchy, metan + etan, propan i butan - gaz mokry);
hydrat metanu;
łupki bitumiczne (zawierają 10-15% związków organicznych, wydobywa się je przez wytlewanie);
produkty wytlewania węgla (niskotemperaturowa piroliza węgla kopalnego);
synteza chemiczna (dowolne węglowodory; stosowana w przemyśle)
2.7 Frakcje ropy naftowej (tw. oC, zawartość atomów C w cząsteczkach)
eter naftowy (30-40, C5-C6); ligroina lub benzyna lekka (60-100, C6-C7)
benzyna lub gazolina (40-200, C5-C10); nafta lub paliwo odrzutowe (175-320, C11-C18)
olej napędowy (paliwo dieslowe); olej lekki (o. opałowy) (>275, C15-C25)
mazut; oleje smarowe (trudno lotne składniki); wosk parafinowy lub wazelina
pozostałość - asfalt lub gudron (z ros.) i koks naftowy, który jest produktem pirolizy pozostałości po destylacji.
W rafineriach, w zależności od popytu, przekształca się jedne frakcje w drugie. Najczęściej, wysokocząsteczkowe węglowodory w procesie krakingu przeprowadza się w nisko- lub średniocząsteczkowe, ponieważ największe zapotrzebowanie jest na benzynę i olej napędowy.
Emisja metanu (szacunkowa, mln ton) Tabela 2.1.
źródła naturalne źródła antropologiczne
torfowiska i mokradła 100 bydło i inne przeżuwacze 75
oceany, morza i jeziora 30 pola ryżowe 70
termity 30 przetwarzanie biomasy 60
tundra 5 wysypiska śmieci i ścieki 60
kopalnictwa węglowe 30
gaz ziemny i ropa naftowa
(wydobycie i transport) 30
razem 165 (34%) 325 (66%)
ŁĄCZNIE 490 mln ton
Szacuje się, że naturalne źródła wytwarzają około rocznie 300 mln ton metanu, z czego znaczna część zostaje zmagazynowana w postaci hydratu metanu.
2.8 Hydrat metanu
Szczątki organiczne są często przetwarzane przez mikroorganizmy w metan. Ten proces zachodzi w warunkach beztlenowych, np. na dnach zbiorników wodnych, takich jak stawy, mokradła, jeziora, morza i oceany. Na terenach podmokłych wydobywa się on w postaci tzw. gazu błotnego.
Pod wysokim ciśnieniem, np. na dnach oceanów na głębokościach kilkuset metrów (w obszarach umiarkowanych poniżej 500 m, w morzach arktycznych znacznie płycej) CH4 tworzy z wodą metastabilny, podobny do lodu hydrat CH4.6H2O. Ocenia się, że złoża hydratu metanu zawierają około 15 mld ton metanu, tj. więcej związanego węgla niż złoża gazu ziemnego, ropy naftowej i węgla kamiennego razem wzięte. Pierwszą grudkę hydratu metanu wydobyto na powierzchnię z dna oceanu w 1980 r., a dopiero w 1996 r. udało się zgromadzić w termosach około 50 kg tej substancji i poddać ją gruntownym badaniom.
Lekki wzrost temperatury wody nad złożem hydratu metanu powoduje jego rozkład i uwalnianie gazowego metanu, który porywa ze sobą kawałki hydratu, przyspieszając jego rozkład. Z 1 cm3 hydratu metanu wydobywa się 164 cm3 gazowego metanu. Udokumentowano wędrujące ku powierzchni bloki hydratu wielkości samochodu. Gwałtowny rozkład dużych ilości hydratu metanu może spowodować ogromne fale tsunami. Około 8000 lat temu 5 600 km3 brzegu Norwegii osunęło się do morza przypuszczalnie z powodu destabilizacji hydratu metanu cementującego przybrzeżne dno.
W wielu miejscach na dnach mórz i oceanów znajdują się ogromne kratery o powierzchni kilkudziesięciu km2 i głębokości kilkudziesięciu metrów, powstałe w wyniku wybuchowego rozkładu dużych pokładów hydratu metanu. Hydrat metanu jest również istotną przyczyną zwiększania efektu cieplarnianego, ponieważ metan jest 20 razy aktywniejszy niż CO2 w pochłanianiu ciepła. Są przypuszczenia, że okresowe, znaczne ocieplenia na ziemi mogły być spowodowane uwolnieniem do atmosfery dużych ilości metanu z jego hydratu.
Hydrat metanu jest palny. Pali się czerwonym płomieniem, a po spaleniu pozostaje woda. Ma budowę klastratu, zawierającego cząsteczkę metanu otoczonego 6 cząsteczkami wody. W hydracie obok metanu występuje w niewielkich ilościach siarkowodór (1-2%), etan i amoniak. Złoża hydratu metanu zasiedlone są mikroorganizmami, które przetwarzają metan w CO2, czerpiąc z tego energię życiową. Z CO2 wytwarza się węglan wapnia inkrustujący złoża hydratu. Zalegające na dnach mórz i oceanów skały węglanowe mają częściowo to samo pochodzenie.
Obecne możliwości technologiczne nie pozwalają na przemysłowe pozyskiwanie metanu ze złóż jego hydratu. (Świat Nauki, 2000 (02) str. 38-47, (04) str. 13-14.
2.9 Wykorzystanie alkanów
Metan - główny składnik gazu ziemnego stanowi jeden z najważniejszych nośników energii, jest też szeroko wykorzystywany w przemyśle między innymi do produkcji amoniaku (nawozów syntetycznych), wodoru, etenu, etynu i wielu innych masowych produktów. Eten jest organicznym surowcem chemicznym produkowanym na największa skalę (kikadziesiąt mln ton rocznie).
Mieszanina propanu i butanu znana pod popularną nazwą - gaz płynny, gdyż pod wpływem podwyższonego ciśnienia łatwo ulega skropleniu i może być w tej postaci transportowana i przechowywana w niskociśnieniowych butlach. Propan/butan stosowany jest jako źródło ciepła w gospodarstwach domowych gospodarczych, do których nie ma przeprowadzonych gazociągów, również jako paliwo samochodowe, co jest korzystne, ponieważ w spaliny silników napędzanych tą mieszanką zawierają mało szkodliwych składników. Oba węglowodory stanowią cenny surowiec do wytwarzania ważnych półproduktów przemysłu chemicznego, np. propenu, butenów i buta-1,3-dienu.
Pentany do dekanów są głównymi składnikami benzyny, popularnego paliwa samochodowego zasilającego silniki iskrowe. Najwięcej znajduje się w niej heptanów i oktanów. Jakość benzyny jako paliwa (jej odporność przeciwstukową) określa się za pomocą liczby oktanowej. Złe właściwości przeciwstukowe wykazują n-alkany, znacznie lepsze izoalkany (alkany rozgałęzione), cykloalkany i areny. Za wzorzec paliwa niskooktanowego przyjęto n-heptan i jemu przypisano wartość 0, a izooktanowi - 2,2,4-trimetopentanowi - wartość 100; w czasach, kiedy tworzono pojęcie liczby oktanowej ten węglowodór miał najlepsze właściwości przeciwstukowe. Liczba oktanowa jest to wartość określająca właściwości danej benzyny, zapewniającej podobne właściwości przeciwstukowe, jak odpowiednia mieszanka n-heptanu i izooktanu, np. benzyna 90-oktanowa zapewnia pracę silnika, jak paliwo składające się z 90% izooktanu i 10% n-heptanu. Później poznano węglowodory o liczbie oktanowej wyższej niż 100. Znane są też i stosowane substancje, które jako dodatki do benzyny podwyższą jej liczbę oktanową. Mieszanina heksanów i heptanów, tzw. benzyna lekka lub benzyna ekstrakcyjna służy jako rozpuszczalnik, np. do rozcieńczania farb olejnych.
W skład nafty, najważniejszej frakcji ropy naftowej w erze Łukaszewicza, wchodzą przede wszystkim węglowodory C11 - C18. Nafta straciła na znaczeniu na rzecz benzyny w czasie, kiedy na dużą skalę zaczęto produkować samochody z silnikami iskrowymi, natomiast w drugiej połowie XX w. jej rola znów wzrosła, ponieważ stała się paliwem zasilającym silniki odrzutowe.
Trochę wyżej wrzące węglowodory (C15-C25) występują w oleju napędowym (w tzw. dieselu) i oleju opałowym. Są to te same frakcje ropy naftowej, różnica polega na tym, że olej napędowy zawiera dodatki uszlachetniające, podnoszące jego walory użytkowe. Jakość oleju napędowego określa liczba cetanowa - oznaczająca udział cetanu (n-heksadekanu) w danym paliwie. Paliwo składające się z czystego cetanu ma liczbę cetanową równą 100. Dodatkami do oleju napędowego są substancje, które podwyższają liczbę cetanową paliwa, a także przeciwdziałają korozji, mają właściwości myjące i inne. Olej opałowy stosowany jest piecach grzewczych.
Składnikami mazutu są węglowodory jeszcze wyżej wrzące niż te, które występują w oleju napędowym. Służy on jako paliwo zasilające niskoobrotowe silniki wysokoprężne (w siłowniach okrętowych), a także do opalania kotłów parowych.
Oleje smarowe oparte na składnikach „mineralnych” - pochodzących z ropy naftowej - zawierają wysokowrzące frakcje węglowodorowe C15-C50. Syntetyczne oleje smarowe otrzymuje się zarówno na bazie syntetycznych węglowodorów, jak i innych związkach otrzymywanych na drodze syntezy.
Wazelina, wosk parafinowy i parafina stanowią mieszaninę stałych węglowodorów. Wazelina ma półpłynną konsystencję. Olej parafinowy jest oczyszczoną mieszaniną ciekłych, wysokolotnych węglowodorów.
Asfalt (gudron) to pozostałości po oddestylowaniu lotnych składników ropy naftowej. Alkany nie są głównymi składnikami tej frakcji.
2.10 Synteza alkanów
2.10.1 Uwodornienie alkenów lub alkinów
kat. (Pt,Pd lubNi) kat.
CnH2n + H2 _____→ CnH2n+2 CnH2n-2 + 2 H2 ___→ CnH2n+2
2.10.2 Hydroliza związków Grignarda
eter HOH
CH3Cl + Mg _→ CH3MgCl __→ CH4
chlorek metylu chlorek metylomagnezowy metan
2.10.3 Redukcja halogenków alkilowych
kat.
CnH2n+1Cl + H2 _→ CnH2n+2 + HCl CnH2n+1Cl + Zn + H+ → CnH2n+2 + Zn2+ + Cl-
2.10.4 Reakcja Würtza
2 C4H9Cl + 2 Na _→ C8H18 + 2 NaCl
chlorek n-butylu n-oktan
2.10.5 Wykorzystanie odczynników Gilmana
C3H7Cl + 2 Li _→ C3H7Li + LiCl
chlorek propylu propylolit
C6H13Cl
2 C3H7Li + CuI _→ (C3H7)2CuLi _→ C9H20 + C3H7Li + CuCl
propylolit dipropylomiedzian(I) litu nonan
(odczynnik Gilmana)
2.10.6 Redukcja aldehydów i ketonów
a/ reakcja Clemmensena b/ reakcja Wolffa-Kiżnera
H+/HOH KOH
RCOR' + Zn(Hg) __→ RCH2R' RCOR' + H2NNH2 __→ RCH2R' + N2 + HOH
aldehyd lub keton alkan aldehyd lub keton hydrazyna alkan
2.11 Właściwości fizyczne alkanów
2.11.1 Temperatura wrzenia (tw.)
Alkany od C1-C4 i neopentan (węglowodór rozgałęziony) - (CH3)4C - są gazami w temperaturze pokojowej; ich tw. wynoszą odpowiednio [oC]:
metan − -162; etan − -88,5; propan − -42; izobutan − -12; butan - 0; neopentan - 9, 5
Alkany od n-pentanu (tw. 36oC) i izopentanu (tw. 28oC) do n-heptadekanu (tw. 302oC, a tt. 22oC) są cieczami. Rozgałęzienia obniżają temperaturę wrzenia izomerów.
Za wyjątkiem kilku niższych alkanów temperatury wrzenia węglowodorów zwiększają się o około 20-30oC przy wzroście łańcucha o grupę CH2.
2.11.2 Temperatura topnienia
Temperatura topnienia alkanów rośnie wraz z ich masą cząsteczkową, ale nie tak regularnie jak temperatura wrzenia. Rozgałęzienia obniżają tt. izomerów. Również domieszki innych związków obniżają tt. węglowodorów. Od n-oktadekanu (tt. 28oC) zaczynają się ciała stałe. Stałe węglowodory to parafina, a wyższe ciekłe - olej parafinowy.
Temperatury topnienia i wrzenia wybranych alkanów Tabela 2.2.
Nazwa alkanu |
Wzór |
tt. [oC] |
tw. [oC] |
metan |
CH4 |
-183 |
-162 |
etan |
CH3CH3 |
-172 |
-88,5 |
propan |
CH3CH2CH3 |
-187 |
-42 |
n-butan |
CH3(CH2)2CH3 |
-138 |
0 |
izobutan |
(CH3)2CHCH3 |
-159 |
-12 |
n-pentan |
CH3(CH2)3CH3 |
-130 |
36 |
izopentan |
(CH3)2CHCH2CH3 |
-160 |
28 |
neopentan |
(CH3)4C |
-17 |
9,5 |
n-heksan |
CH3(CH2)4CH3 |
-95 |
69 |
izoheksan |
(CH3)2CH(CH2)2CH3 |
-154 |
60 |
3-metylopentan |
CH3CH2CH(CH3)CH2CH3 |
-118 |
63 |
2,2-dimetylobutan |
(CH3)3CCH2CH3 |
-98 |
50 |
2,3-dimetylobutan |
(CH3)2CHCH(CH3)3 |
-129 |
58 |
n-heptan |
CH3 (CH2)5CH3 |
-90,5 |
98 |
n-oktan |
CH3 (CH2)6CH3 |
-57 |
126 |
n-nonan |
CH3 (CH2)7CH3 |
-54 |
151 |
n-dekan |
CH3 (CH2)8CH3 |
-30 |
174 |
n-undekan |
CH3 (CH2)9CH3 |
-26 |
196 |
n-dodekan |
CH3 (CH2)10CH3 |
-10 |
216 |
n-tridekan |
CH3 (CH2)11CH3 |
-6 |
234 |
n-tetradekan |
CH3 (CH2)12CH3 |
5,5 |
252 |
n-pentadekan |
CH3 (CH2)13CH3 |
10 |
266 |
n-heksadekan |
CH3 (CH2)14CH3 |
18 |
280 |
n-heptadekan |
CH3 (CH2)15CH3 |
22 |
292 |
n-oktadekan |
CH3 (CH2)16CH3 |
28 |
308 |
n-nonadekan |
CH3 (CH2)17CH3 |
32 |
320 |
n-ejkozan |
CH3 (CH2)18CH3 |
36 |
22030mmHg |
|
|
|
|
2.11.3 Rozpuszczalność
Alkany są bardzo hydrofobowe, nie mieszają się z wodą, nie są zwilżane przez wodę i są w niej nierozpuszczalne. Łatwo rozpuszczają się w niepolarnych, niskopolarnych i średniopolarnych rozpuszczalnikach organicznych. W metanolu rozpuszczają się w ograniczonym zakresie; przy większych stężeniach następuje rozdzielenie się warstw. W etanolu niższe alkany rozpuszczają się łatwo, wyższe słabiej.
Pytanie: dlaczego mieszanki paliwowe zawierające etanol jako dodatek (biopaliwo) rozwarstwiają się pod wpływem wody?
2.11.4 Gęstość
Gęstość alkanów waha się około 0,8 g/cm3, są więc lżejsze od wody.
2.11.5 Palność
Wszystkie węglowodory, a więc i alkany są łatwopalne. Gazowe węglowodory i pary węglowodorów tworzą mieszanki wybuchowe z powietrzem.
2.11.6 Zapach
Gazowe i lotne ciekłe alkany mają zapach benzynowego rozpuszczalnika do farb i lakierów. Benzyna - paliwo silnikowe ma zapach zmieniony obecnością dodatków uszlachetniających. Stałe i wysokowrzące ciekłe węglowodory są bez zapachu i bez smaku.
2.12 Właściwości chemiczne alkanów (reaktywność)
Alkany są mało reaktywne, ponieważ ich cząsteczki nie zawierają reaktywnych grup funkcyjnych. Ich jedyne wiązania C-C i C-H są odporne na rozerwanie; ich rozerwanie wymaga dostarczenia odpowiednio 88 i 104 kcal/mol. W pewnych warunkach mogą jednak reagować gwałtownie.
Reakcje alkanów
Gwałtowna reakcja z wydzieleniem dużej ilości ciepła i światła (płomieni) nazywana jest spalaniem. Takiej przemianie ulegają alkany z tlenem (również z tlenem z powietrza) po osiągnięciu temperatury zapłonu, w której zostaje pokonana energia aktywacji reakcji utlenienia. Alkany spalają się także w atmosferze fluoru lub chloru. Z fluorem, z uwagi na niewielką energię aktywacji alkany reagują wybuchowo, nawet w ciemnościach i w niskich temperaturach. Chlorowanie czy bromomowanie wymaga inicjacji w postaci podwyższonej temperatury, promieniowania lub nadtlenków.
Rozkładają się pod wpływem wysokiej temperatury (piroliza, kraking, izomeryzacja), ulegają
sulfonowaniu i nitrowaniu. Wchodzą także w reakcję z bardzo reaktywnymi odczynnikami, takimi jak HF.SbF5 czy FSO3.SbF5 (kwas magiczny).
2.12.1 Spalanie
CnH2n+2 + O2 (nadmiar) _→ n CO2 + (n + 1) HOH
n-C5H12 + 8 O2 _→ 5 CO2 + 6 HOH - 3 538 kcal
2.12.2 Półspalanie
CH4 + O2 + HOH _→ 2 CO + H2 gaz syntezowy
Zamiast metanu używa się też olejów odpadowych, wyższych frakcji naftowych, mazutu, asfaltu, a nawet węgla kamiennego czy koksu.
2.12.3 Niepełne spalanie
CH4 + 1,5 O2 _→ HCOOH + HOH kwas mrówkowy
4 CH4 + O2 _→ C2H2 + 2 CO + 7 H2 etyn (główna frakcja)
CH4 + O2 _→ 2 HOH + C (sadza)
2.12.4 Bromowanie
2.12.5 Piroliza
Alkany pod wpływem wysokiej temperatury rozkładają się na mniejsze cząsteczki w procesach nazywanych pirolizą, krakingiem lub hydrokrakingiem; mogą też w tych warunkach ulegać izomeryzacji.
Kraking termiczny
450oC
RCH2CH2CH2CH2CH3 _____→ RCH2CH3 + CH2=CHCH3
katalizator glinokrzemianowy
Hydrokraking
450oC
C14H30 + H2 _____→ C9H20 + CH4 + C2H6 + C3H8 + ..........
15 Mpa, kat. glinokrzem.
2.12.3 Nitrowanie, sulfonowanie
Alkany pod wpływem stężonego kwasu azotowego są przekształcane w nitroalkany. Reakcji towarzyszy degradacja cząsteczki na mniejsze fragmenty i utlenienie do CO2 i HOH.
Resztę sulfonową można wprowadzić w reakcji chlorosulfonowania (działania na alkany ditlenkiem siarki i chlorem), a następczej hydrolizie otrzymanych kwasów chlorosulfonowych, zwanych mersolami. Drugim sposobem otrzymywania kwasów alkanosulfonowych to reakcja alkanów z ditlenkiem siarki w obecności tlenu - sulfoutlenianie.
Chlorosulfonowanie
15-35oC 80oC
Alk-H + SO2 + Cl2 __→ Alk-SO2Cl __→ Alk-SO3Na mersolany
- HCl mersole NaOH/HOH
Sulfoutlenianie
25-30oC
CnH2n+1CH2CH2CmH2m+1 + SO2 + 0,5 O2 __→ CnH2n+1CHCH2CmH2m+1 kwas alkanosulfonowy
h, 300 nm I
SO3
Alkany wchodzą także w reakcję z bardzo reaktywnymi odczynnikami, takimi jak HF.SbF5 czy FSO3.SbF5 (kwas magiczny).
2.13 Cykloalkany (węglowodory alicykliczne)
Łańcuchy węglowodorowe mogą zamykać się w pierścienie tworząc związki cykliczne. Cykloalkany niepodstawione złożone są z powtarzających się elementów -CH2-, tak więc ich wzór sumaryczny można przedstawić jako (CH2)n lub CnH2n, przy czym literką „c” zaznaczmy, że są to związki cykliczne: c(CH2)n. Często przedstawiane są one za pomocą wieloboków foremnych.
W każdym węźle wzoru cykloalkanu znajduje się element -CH2-
2.13.1 Nomenklatura
Nazwy cykloalkanów tworzy się przez dodanie przedrostku „cyklo” do nazw alkanów, zawierających taką samą liczbę atomów węgla w pierścieniu, np. cyklopropan, cyklobutan, ... cyklodekan, itd. W nazwie wymienia się podstawniki przyłączone do pierścienia oznaczając miejsca przyłączeń możliwie najniższymi lokantami.
Znane są cykloalkany dicykliczne i policykliczne. Ich nazwy zaczynają się od podania liczby pierścieni: bicyklo-, tricyklo-, itd. Następnie w nawiasach kwadratowych podaje się liczby atomów węgla (oddzielone kropkami, np. [2.2.1]) w poszczególnych mostkach (pomiędzy atomami przyczółkowymi), tj. łańcuchów węglowych od węzła do węzła, po czym znajduje się nazwa rdzenia wynikająca z liczby atomów węgla tworzących cząsteczkę.
Atomy C w cząsteczce numeruje się zaczynając od atomu przyczółkowego, przez najdłuższy mostek do drugiego atomu przyczółkowego i dalej do pierwszego atomu przyczółkowego przez kolejny najdłuższy jeszcze nie numerowany mostek; te dwa mostki są uznawane za główny pierścień układu. Następnie numeruje się atomy C w drugim pierścieniu; dla tego mostka numerację zaczyna się też od pierwszego atomu przyczółkowego. W cząsteczkach tricyklicznych i wyższych nazwę kończy przypisanie lokantów kolejnemu mostkowi; trzeciemu dla tricyklicznej cząsteczki - 02,6.
Związki policykliczne są tak fascynujące, że zsyntezowano wiele specyficznych struktur, których nazwy oddają ich kształt.
2.13.2 Występowanie
Cykliczne alkany raczej nie występują w naturze, natomiast w wielu związkach naturalnych znajdują się alicykliczne ugrupowania, np. w aminokwasach.
Pięcioczłonowe pierścienie znajdują się w prostaglandynach (hormonach tkankowych), a pięcio- i sześcioczłonowe w sterydach, w tym w hormonach płciowych, np. w estradiolu. Układy cykliczne spotykane są powszechnie w terpenach i terpenoidach; jako przykłady mogą służyć -pinen czy gwajol.
2.13.3 Otrzymywanie cykloalkanów
Najłatwiejsze w syntezie są pięcio- lub sześcioczłonowe cykliczne związki organiczne, w tym cykloalkany. Zarówno mniejsze (trój- i czteroczłonowe), jak i większe (od siedmioczłonowego w wzwyż) powstają z mniejsza wydajnością.
Cyklizacja dihalogenoalanów
(eliminacja halogenów z halogenooligometylenów za pomocą metali)
1,3-dichloropropan cyklopropan 1,5-dibromopentan cyklopentan
Znane są sposoby otrzymywania pochodnych cykloalkanów, które następnie można przeprowadzić w węglowodory. Sole wapniowe kwasów 1,6-heksanowego lub 1,7-heptanowego w trakcie dekarboksylacji przekształcają się w odpowiednie ketony. Ketony redukuje się do alkanów znanymi metodami, np. metodą Clemmensena). W ten sposób nie da się otrzymać trój- ani czteroczłonowych pierścieni.
2.13.4 Właściwości fizyczne
Cyklopropan i cyklobutan w temperaturze pokojowej są gazami; ich temperatury wrzenia wynoszą odpowiednio -33,3 i 12,9oC. Cykloalkany od cyklopentanu do cyklodekanu występują w temperaturze pokojowej jako ciecze, a wyższe jako ciała stałe. Podobnie jak alkany są hydrofobowe, należą do substancji łatwopalnych, a z powietrzem tworzą mieszanki wybuchowe.
2.13.5 Właściwości chemiczne
Niższe cykloalkany różnią się reaktywnością od ich wyższych homologów. Właściwości chemiczne od cyklopentanu wzwyż są bardzo zbliżone do alkanów, natomiast cyklopropan i cyklobutan zachowują się w niektórych reakcjach jak związki nienasycone, tzn. ulegają reakcjom addycji z równoczesnym otwarciem pierścienia.
Addycja do cyklopropanu z równoczesnym rozerwaniem pierścienia może biec mechanizmem elektrofilowym, np. z Cl2/FeCl3 lub rodnikowym, np. z chlorem czy bromem w obecności światła.
Do rodnikowego przyłączenia bromu dochodzi pod wpływem światła.
Elektrofilowe przyłączenie chloru dokonuje się w obecności chlorku żelaza.
Addycja jodowodoru następuje w podwyższonej temperaturze.
Cyklopropan rozrywa się również pod wpływem kwasu siarkowego.
Uwodornienie cyklopropanu również otwiera pierścień.
Cyklobutan jest mniej aktywny w tego typu reakcjach, nie ulega rozerwaniu pod wpływem chloru, bromu ani halogenowodorów. Jego uwodornienie następuje dopiero w temperaturze 120oC. Jeszcze mniej reaktywne są wyższe cykloalkany; cyklopentan otwiera się w reakcji z wodorem dopiero powyżej 300 oC.
Przyczynę tak dużych różnic w reaktywności podobnych związków można wyjaśnić w sposób uproszczony: utworzenie pierścieni trój- i czteroczłonowych wymaga zniekształcenia wiązań, wygięcia ich w taki sposób, że kąt tetraedryczny (109,5o), typowy dla atomów C zhybrydyzowanych sp3, zostaje zmniejszony odpowiednio do 60o lub 90o. Taka zmiana wymaga energii, o wartość której zmniejsza się energia wiązań. Obrazowo wiązania te nazywane są naprężonymi (od naprężonej sprężyny). Osłabione wiązania łatwiej ulegają rozerwaniu, a do uwolnionych atomów C przyłącza się reagent.
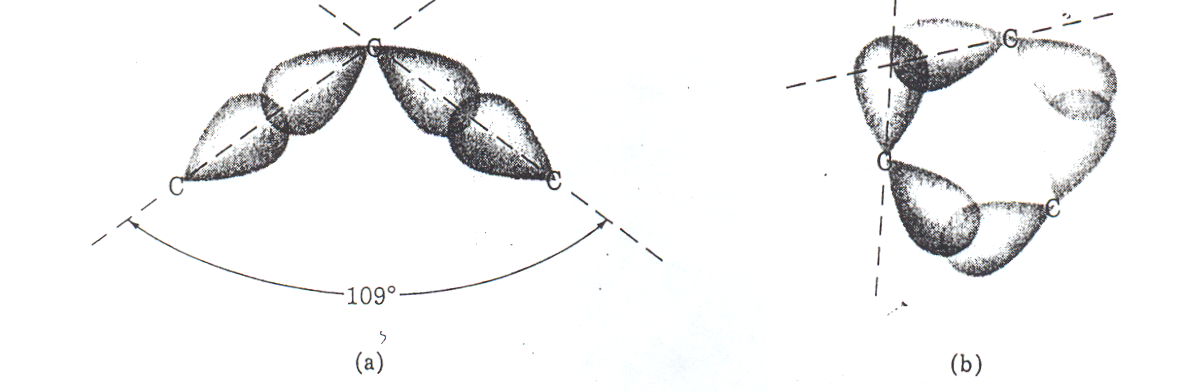
Natomiast zgodnie z teorią orbit molekularnych (MO) w małych pierścieniach energia wiązań C−C jest mniejsza ponieważ orbitale atomowe tworzące wiązanie σ nie nakładają się osiowo, lecz pod pewnym pod kątem, a tym samym stopień nałożenia (całka pokrycia) jest mniejsza.
a b
Rys. 2. 2. Osiowe nakładanie się orbitali sp3 a i pod zmniejszonym kątem w cyklopropanie b
Dodatkowym czynnikiem zmniejszającym stabilność cząsteczek cyklopropanu i cyklobutanu to naprzeciwległe ułożenie atomów wodoru.
Energia wewnętrzna cyklopropanu obliczona na podstawie ciepła spalania jest o 8,8 kcal/równoważnik -CH2- wyższa niż w strukturze całkowicie beznapięciowej - cykloheksanie czy w alkanach alifatycznych. Ze spalanie równoważnika -CH2- niezależnie z jakiego węglowodoru pochodzi uzyskuje się 1 mol CO2 i 1 mol HOH, a więc zawsze powinno wydzielić się tyle samo ciepła. Różnica wartości wydzielonego ciepła spalania (H CH2) wynika z różnej energii wewnętrznej cząsteczki ulegającej spalaniu - im mniejsza wartość H CH2, tym mniejszą energię wewnętrzną ma spalana cząsteczka (jest związkiem bardziej stabilnym), a to oznacza, że wiązania w tym związku (głównie C-C) są silniejsze.
-CH2- + 3/2 O2 _→ CO2 + HOH + HCH2
(HCH2 dla układu beznapięciowego = 157,4 kcal) Tabela 2.3.
Alkan |
wzór |
H, kcal/mol |
HCH2, kcal/mol |
HCH2 - 157,4 |
Różnica energii wew. kcal/mol |
cyklopropan |
c(CH2)3 |
499,8 |
166,6 |
9,2 |
27,6 |
cyklobutan |
c(CH2)4 |
655,8 |
163,9 |
6,5 |
26,0 |
cyklopentan |
c(CH2)5 |
793,6 |
158,7 |
1,3 |
6,5 |
cykloheksan |
c(CH2)6 |
944,5 |
157,4 |
0 |
0 |
n-heksan |
CH3(CH2)4CH3 |
944,4 |
157,4 |
0 |
0 |
cykloheptan |
c(CH2)7 |
1108 |
158,3 |
0,9 |
6,3 |
cyklooktan |
c(CH2)8 |
1268,8 |
158,6 |
1,2 |
9,6 |
cyklononan |
c(CH2)9 |
1428,3 |
158,7 |
1,3 |
11,7 |
cyklodekan |
c(CH2)10 |
1586 |
158,6 |
1,2 |
12,0 |
cyklopentadekan |
c(CH2)15 |
2362 |
157,5 |
0,1 |
~ 0 |
cykloheptadekan |
c(CH2)17 |
2672 |
157,2 |
-0,2 |
~ 0 |
2.13.6 Konformacja cykloalkanów
Konformacja cyklopropanu jest ustalona i nie ulega podobnym przemianom jak w związkach łańcuchowych, gdzie możliwy jest swobodny obrót wokół pojedynczych wiązań C−C. W cyklopropanie obrót wokół wiązania C-C może nastąpić w wyniku jego rozerwania.
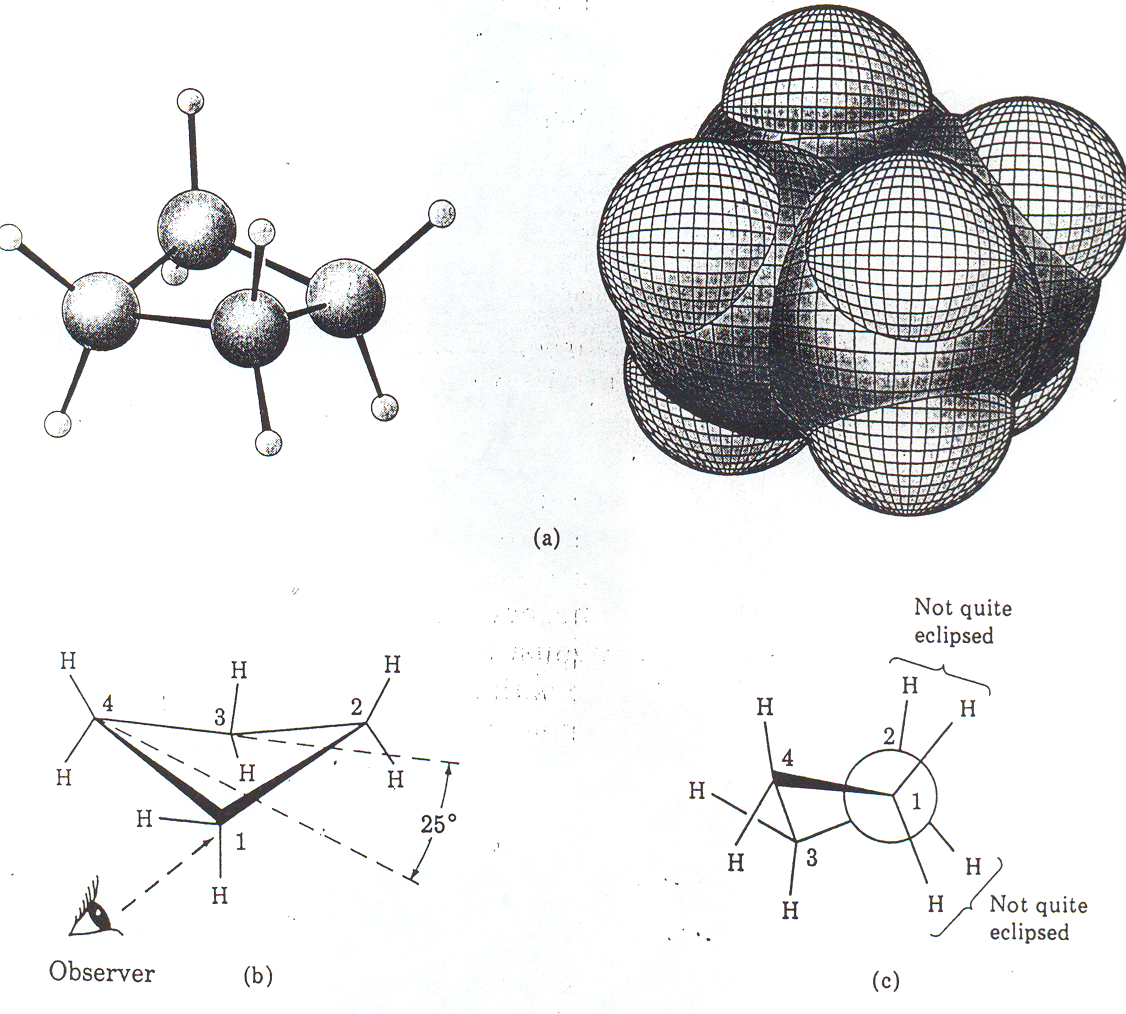
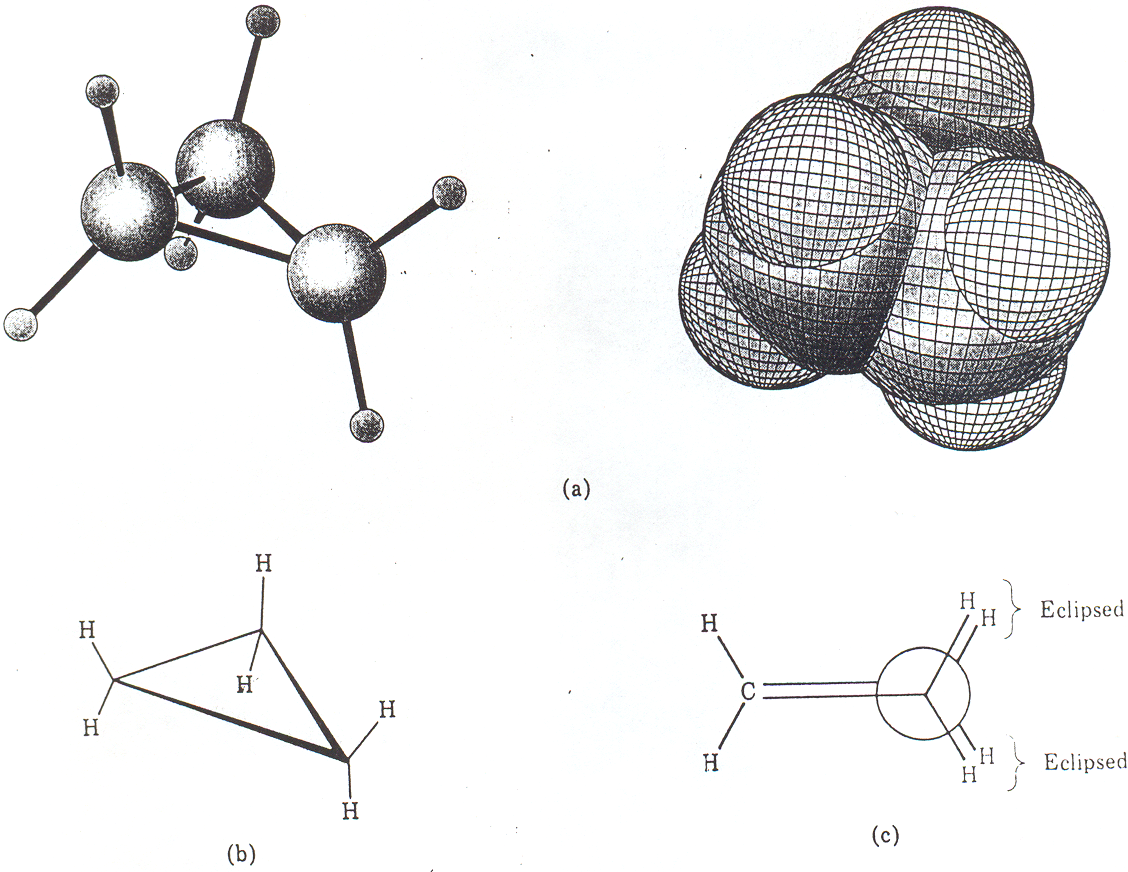
Rys. 2. 3 Modele cząsteczki cyklopropanu (a) i jej Rys. 2.4 Modele cząsteczki cyklobutanu (a) i jej rzuty.
rzuty (b i c). Ułożenie atomów wodoru na sąsiadu- Konformacja cząsteczki cyklobutanu jest ustalona. Atomy
jących atomach węgla jest naprzeciwległe (c) wodoru na sąsiadujących atomach węgla układają się
naprzeciwlegle
W rzeczywistej cząsteczce cyklobutanu kąt pomiędzy wiązaniami jest trochę mniejszy od 90o, równy jest 88o. To zmiana kąta zmniejsza napięcie wywoływane naprzeciwległym ułożeniem atomów wodoru.
Cyklopentan
W cyklopentanie kąt wewnętrzny pięcioboku foremnego (108o) ma wartość zbliżoną do wartości kąta tetraedrycznego, tak więc płaska cząsteczka cyklopentanu powinna być bez napięciowa. Jednak ciasno upakowane atomy w cząsteczce cyklopentanu odpychają się i lekko ją deformują. Przez to nie jest ona zupełnie płaska, ale za to energia wewnętrzna cyklopentanu jest tylko o 1,3 kcal/równoważnik -CH2- wyższa niż w strukturach całkowicie beznapięciowych.
Cykloheksan
Cykloheksan właściwościami chemicznymi przypomina raczej alkany alifatyczne niż niższe cykloalkany. Jego pierścień nie jest płaski. Dzięki możliwości zachowania w części swobodnego obrotu wokół wiązań C−C cząsteczka przyjmuje konformacje zapewniające kąt tetraedryczny pomiędzy wiązaniami poszczególnych atomów węgla. Takich konformacji może być bardzo dużo. Pośród nich wyróżnia się konformacje krańcowe: krzesłową, półkrzesłową, łódkową i skręconej łódki. Różnią się one trwałością.
2.13.6 Konformacja cykloheksanu
Najbardziej trwała (o najniższej energii) jest konformacja krzesłowa (schemat poniżej). Rzeczywista cząsteczka cykloheksanu jest mieszaniną konformerów będących w stanie równowagi dynamicznej. Udział ich w całej populacji jest proporcjonalny do ich trwałości. Przejście pomiędzy poszczególnymi konformerami dokonuje się poprzez obrót wokół wiązań C−C.

Schemat 2.1 Zależność energii potencjalnej cykloheksanu od konformacji cząsteczki
Projekcja szkieletu węglowego konformeru krzesłowego cykloheksanu przedstawiany jest tak, jak na schemacie obok lub (częściej) w układzie przypominającym krzesło z oparciem i podnóżkiem; z tego powodu ta konformacja zwykle nazywana jest konformacją krzesłową. Warto zapamiętać konformację pierścienia cykloheksanu, ponieważ jest bardzo popularną formą wielu cyklicznych związków organicznych. Podobną konformację przyjmują cząsteczki cukrów, cyklicznych terpenoidów, steroidów i wielu innych produktów naturalnych i syntetycznych.
Schematycznie przedstawiony szkielet węglowy cząsteczki cykloheksanu w konformacji krzesłowej
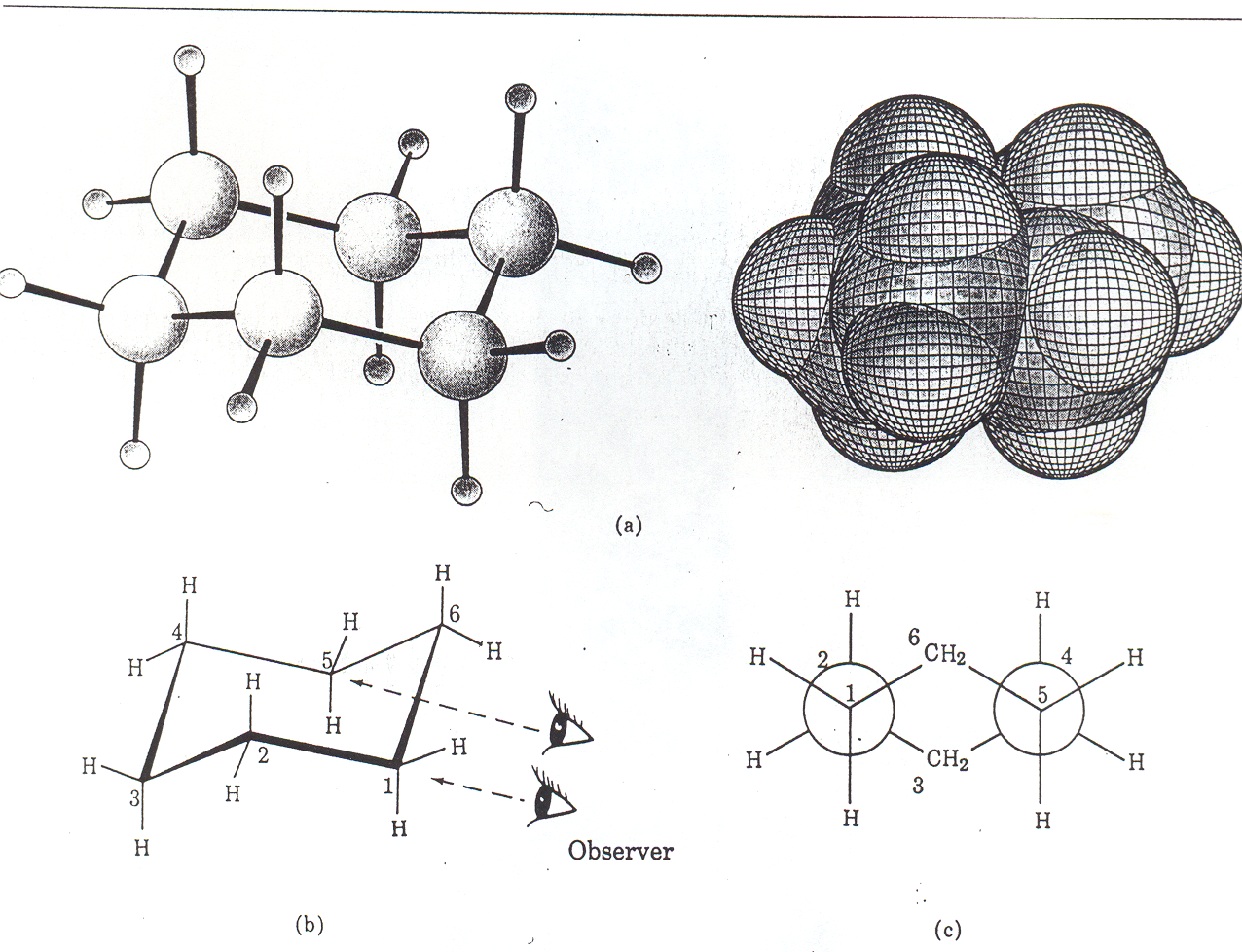
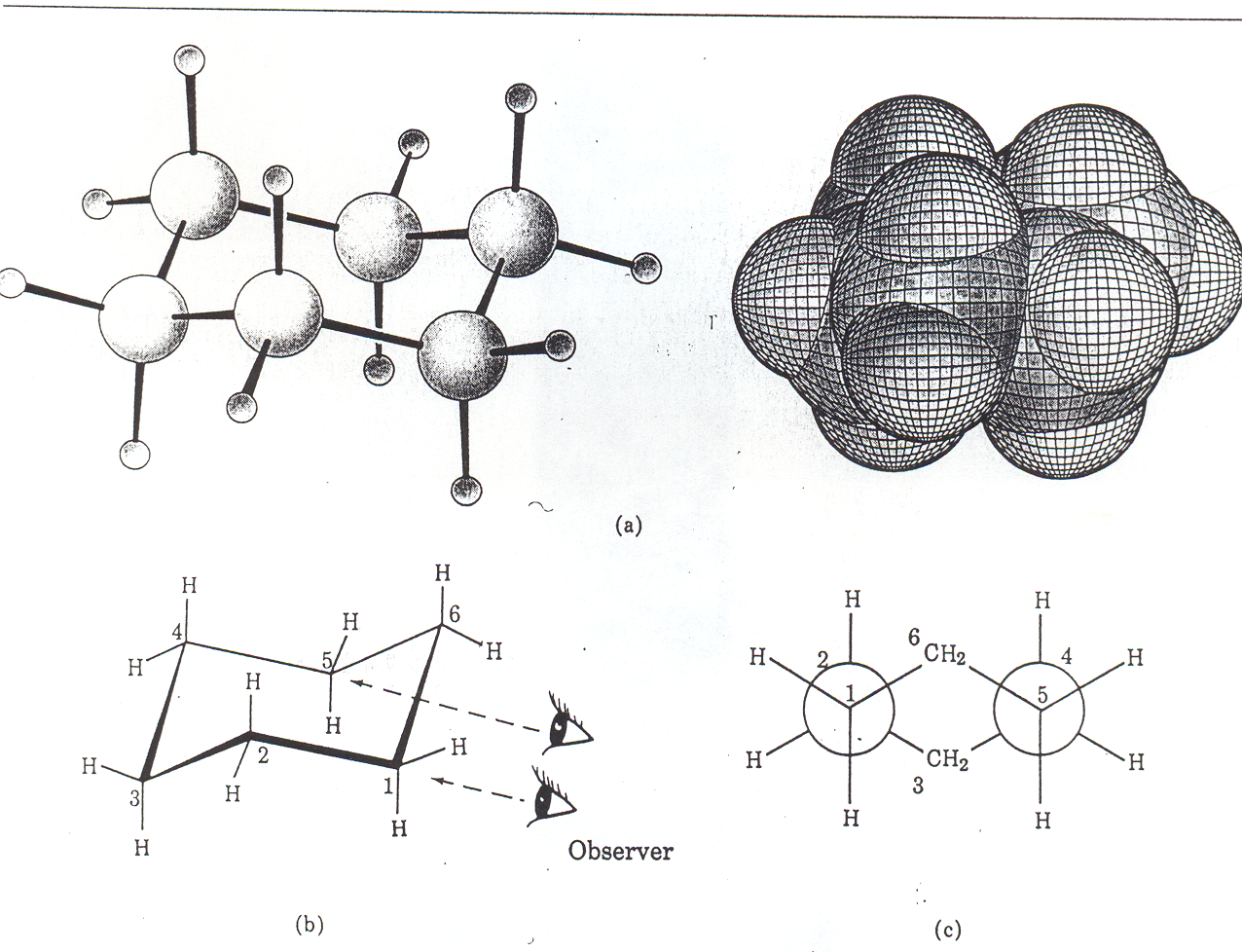
Rys. 2.5 Modele cząsteczki cykloheksanu Rys. 2.6 W cząsteczce cykloheksanu można wyróżnić
dwa elementy n-butanowe o konformacji synklinalnej:
C6, C1, C2, C3 i drugi C3, C4, C5 i C6.
Warto zwrócić uwagę na dwie połówki cząsteczki cykloheksanu, mają one taką samą konformację jak konformer synklinalny n-butanu. Jest to widoczne na rysunku powyżej.
Atomy wodoru związane z tym samym atomem węgla w cząsteczce cykloheksanu nie są równocenne; wiązanie jednego jest osiowe (równoległe do pionowej osi cząsteczki), a drugiego jest lekko odchylone od płaszczyzny cząsteczki. Ten pierwszy atom wodoru nazywa się aksjalnym, zaś ten drugi ekwatorialnym. W cząsteczce cykloheksanu znajduje się 6 aksjalnych i 6 ekwatorialnych atomów wodoru.
W przypadku, gdy pozycję aksjalną zajmuje większy podstawnik niż atom wodoru (np. metyl) dochodzi do wzajemnego odpychania się z innymi podstawnikami aksjalnymi, nawet jeżeli nimi są atomami wodoru. Z tego powodu konformer, w którym większy podstawnik zajmuje pozycję aksjalną jest mniej trwały od tego z dużym podstawnikiem w pozycji ekwatorialnej. Oba konformery znajdują się w równowadze dynamicznej.
Równowaga dynamiczna pomiędzy konformerami krzesłowymi z grupą metylową w położeniu aksjalnym (a) i ekwatorialnym (e)
Duży podstawnik w pozycji akcjalnej odpycha się również z grupą -CH2- przy C3. Jest to podobny destabilizujący układ jak w synklinalnej konformacji n-butanu.
grupa metylowa aksjalnie związana z cykloheksanem n-butan w konformacji synklinalnej
grupa metylowa ekwatorialnie związana z cykloheksanem n-butan w konformacji naprzemianległej
Porównanie konformacji cząsteczek cykloheksanu i n-butanu
2.13.7 Izomeria cis-trans dipodstawionych cykloalkanów
Dipodstawione cykloalkany niezależnie od wielkości pierścienia mogą występować w postaci dwóch izomerów cis lub trans. W izomerze cis oba podstawniki znajdują się po tej samej stronie pierścienia, a w trans po stronach przeciwnych. W pierścieniach płaskich (3-5 członowych) nie ma problemu z określeniem izomeru.
1,2-dimetylocyklopropan 1,3-dimetylocyklobutan
cis trans cis trans
Stereoizomery 1,2-dimetylocyklopropanu i 1,2-dimetylocyklobutanu
Stereoizomery 1,2-dimetylocyklopentanu
Stereoizomery cis/trans są różnymi związkami, różnią się właściwościami fizycznymi i chemicznymi. W tabeli 2.3 podane są temperatury wrzenia i topnienia czterech izomerów dimetylocykloheksenu i dwóch izomerów 1,2-dichlorocykloheksenu.
Wybrane właściwości fizyczne niektórych dipodstawionych izomerów cykloheksanu Tabela. 2. 3.
Pochodne cykloheksanu |
Stereoizomer |
tt. [oC] |
tw. [oC] |
1,2-dimetylo- |
cis |
-50 |
130 |
1,2-dimetylo- |
trans |
-89 |
124 |
1,3-dimetylo- |
cis |
-76 |
120 |
1,3-dimetylo- |
trans |
-90 |
123 |
1,2-dichloro- |
cis |
-6 |
9322 a |
1,2-dichloro- |
trans |
-7 |
7516 a |
a - ciśnienie w mm słupa Hg, przy jakim oznaczono temperaturę wrzenia
Cząsteczka cykloheksanu nie jest płaska, dlatego też ustalenie izomerii cis lub trans jego dipochodnych może początkowo sprawiać trudności. Potrzebne jest odniesienie do płaszczyzny uśrednionej - przechodzącej przez środek cząsteczki prostopadle do jej pionowej osi.
W pochodnych dicykloheksanu rozróżnia się takie, w których podstawnik przyłączony jest akcjalnie (a) lub ekwatorialnie (e). Zatem 1,2- i 1,4-dipodstawione pochodne cykloheksanu mogą być związane w sposób a,a lub e,e (izomery trans) oraz a,e lub e,a (izomery cis). Izomery a,a i e,e są z sobą w stanie równowagi dynamicznej, podobnie jak izomery a,e i e,a.
Rys. 2. 21. Równowaga konformacyjna 1,4-dipochodnych cykloheksanu
Odpowiednio należy ustalić izomerię pochodnych 1,3-.
Duże podstawniki, takie jak brom czy tert-butyl z reguły zajmują pozycje ekwatorialną, wymuszając w ten sposób konformację pierścienia cykloheksanowego.
cis: ekwatorialno-aksjalny nie aksjalno-ekwatorialny
trans: ekwatorialno-ekwaterialny nie aksjalno-aksjalny
Stabilne konformacje 1-tert-butylo-4-metylocykloheksanu
20
Wyszukiwarka
Podobne podstrony:
Alkany (2)
Alkany(2)
Alkany 3 id 57982 Nieznany (2)
Alkany, Szkoła
ściągi chemia szereg homologiczny alkany, alkeny, alkiny
I ALKANY
ALKANY
alkany i spółka b dobree notatki
Alkany i cykloalkany(1)
alkany liniowe
Alkany
Alkany nie reag, CHEMIA, Chemia organiczna
Alkany 2
Alkany (1)
alkany alkeny alkiny id 57988 Nieznany
Alkany, alkeny, alkiny i SE do aromatu
alkany
Alkany, sciągi, chemia
alkany
więcej podobnych podstron