
Oświadczenie kierującego pracą
Oświadczam, że praca dyplomowa magisterska studentki Joanny Czajki pt. Całkowity
potencjał antyoksydacyjny, wyznaczony metodą chromatograficzną, niektórych ziół i napoi
alkoholowych została przygotowana pod moim kierunkiem, stwierdzam, że spełnia ona warunki
przedstawienia jej w postępowaniu o nadanie tytułu zawodowego magistra.
Data
podpis kierującego pracą
Oświadczenie autora pracy
Świadoma odpowiedzialności prawnej oświadczam, że niniejsza praca dyplomowa
magisterska pt. Całkowity potencjał antyoksydacyjny, wyznaczony metodą
chromatograficzną, niektórych ziół i napoi alkoholowych została napisana przeze mnie
samodzielnie i nie zawiera treści uzyskanych w sposób niezgodny z obowiązującymi przepisami
(Ustawa z dnia 04.02.2004 r. o prawie autorskim i prawach pokrewnych: Dz. U. z 2006 r. nr 90,
poz. 631 z późniejszymi zmianami).
Oświadczam również, że przedstawiona praca nie była wcześniej przedmiotem procedur
związanych z uzyskaniem tytułu zawodowego w szkole wyższej.
Oświadczam ponadto, że niniejsza wersja jest identyczna z załączoną wersją
elektroniczną.
Data
podpis autora pracy

AKADEMIA PODLASKA
______________________________________________
WYDZIAŁ NAUK ŚCISŁYCH
Kierunek chemia
Joanna Czajka
Całkowity potencjał antyoksydacyjny, wyznaczony metodą
chromatograficzną, niektórych ziół i napoi alkoholowych
Praca magisterska napisana
w Katedrze Chemii Organicznej
pod kierunkiem
Prof. dr hab. Bronisława Krzysztofa Głoda
Siedlce, 2007

Total antioxidant potential, obtained using chromatographic assay,
of some herbs and alcoholic beverages
Słowa kluczowe:
- rodnik hydroksylowy
- całkowity potencjał antyoksydacyjny
- wysokosprawna chromatografia cieczowa
- kwas tereftalowy
- detekcja fluorescencyjna

Promotorowi
Panu prof. dr hab. Bronisławowi K. Głodowi
składam serdeczne podziękowania
za podjęcie trudu prowadzenia mojej pracy,
cenne uwagi oraz pomoc i życzliwość podczas
jej wykonywania

Panu mgr Pawłowi Piszczowi
składam podziękowania za wszelką
udzieloną pomoc przy wykonaniu tej pracy

6
______________________________________________
SPIS TREŚCI
1.2.2. Anionorodnik ponadtlenkowy, O
.............................................................................9
1.2.3. Rodnik nadhydroksylowy, HO
..................................................................................9
...........................................................................................10
OH .......................................................................................10
Metody oznaczania wolnych rodników i stresu oksydacyjnego. Całkowity potencjał

7
Porównanie CPA różnych klas produktów spożywczych ..............................................32

8
______________________________________________
1. CZĘŚĆ LITERATUROWA
1.1. Podstawowe
informacje o wolnych rodnikach
Tlen jest pierwiastkiem niezbędnym do życia, ale zarazem toksycznym [1, 2]. W
większości zużywany jest w komórkowych procesach energetycznych. Podczas jego redukcji
wytwarzane są reaktywne formy tlenu (ang. ROS – reactive oxygen species), do których zalicza
się wolne rodniki tlenowe, a także tlen singletowy i nadtlenek wodoru.
Wolne rodniki są to atomy, cząsteczki lub ich fragmenty bądź też jony posiadające
conajmniej jeden niesparowany elektron na powłoce walencyjnej, który nadaje im właściwości
paramagnetyczne [3]. Powstawanie ich związane jest z rozrywaniem wiązań w cząsteczkach lub
z przenoszeniem elektronów. Jedną z ważniejszych cech jest ich względnie wysoka reaktywność.
Wolne rodniki mogą być indukowane przez różne czynniki fizykochemiczne, do których
należą: promieniowanie jonizujące, ultrafioletowe, podczerwone i widzialne, a także reakcje
utleniania i redukcji. Głównymi źródłami powstawania jest autooksydacja związków
niskocząsteczkowych, a mianowicie: flawin, tioli, katecholamin, hydrochinonów oraz niektóre
reakcje enzymatyczne, do których zalicza się oksydazę ksantynową, oksydazę cytochromową P-
450 i b-5 systemu mikrosomalnego, dysmutazę ponadtlenkową stymulującą mitochondrialny
system transportu elektronów. Podczas tzw. wybuchu oddechowego rodniki mogą także
generować pobudzone komórki fagocytujące (makrofagi, monocyty i granulocyty) do
zwalczania infekcji [4]. W tym przypadku odgrywają one pozytywną rolę. Mogą wywoływać
jednak działanie kancerogenne przy długotrwałym ich wytwarzaniu (np. w przewlekłych stanach
zapalnych). Za najważniejszy generator wolnych rodników uchodzi mitochondrialny łańcuch
oddechowy [5].
Reaktywne formy tlenu w organizmie wytwarzane są w czasie:
- ekspozycji na wysokie ciśnienie tlenu oraz w czasie reperfuzji poischemicznej,
- działania związków chemicznych np. kancerogennych, pestycydów, antybiotyków
antracyklicznych, barwników azowych, ozonu, dymu papierosowego (nikotyny),

9
- rozrywania
wiązań pod wpływem energii zewnętrznej (np. promieniowanie α, β, γ, UV,
wyładowania elektryczne czy temperatura),
- zaburzeń procesów metabolicznych pojawiających się w wyniku: awitaminozy (brak witamin
A i E), procesów starzenia się organizmów, w stanach zapalnych,
- procesu fagocytozy i fotosyntezy, w reakcjach z udziałem cytochromów (komórki
fagocytujące (makrofagi, monocyty, granulocyty) podczas infekcji wytwarzają jony
ponadtlenkowe, nadtlenek wodoru i rodniki hydroksylowe w celu obrony organizmu),
- przebiegu
reakcji
enzymatycznych,
- procesów metabolicznych zachodzących w mitochondriach i mikrosomach,
- podczas peroksydacji wielonienasyconych kwasów tłuszczowych.
1.2. Tlen i produkty jego redukcji
Najprostszym rodnikiem (dokładnie birodnikiem w stanie trypletowym) jest tlen
atmosferyczny, którym oddychamy. Ma on względnie dużą reaktywność, ale jest ona
stosunkowo mała jak na rodnik.
1.2.1. Tlen singletowy
W stanie wzbudzonym tlen występuje w postaci singletu. Tworzy się m.in. w reakcjach
utleniania anionorodnika ponadtlenkowego żelazem (część reakcji Habera-Weissa) i
oksyalkoholem oraz w czasie nieenzymatycznej dysmutacji nadtlenku (utleniaczem w tej reakcji
jest rodnik nadhydroksylowy będący silnym utleniaczem). Komórkowym źródłem wzbudzonego
tlenu są: nieenzymatyczna peroksydacja lipidów, fagocytoza, reakcje katalizowane przez
peroksydazy.
1.2.2. Anionorodnik ponadtlenkowy, O
2
·-
Pierwszym produktem redukcji tlenu jest anionorodnik ponadtlenkowy (O
2
•-
) i jego
sprotonowana forma – rodnik nadhydroksylowy (HO
2
•
), który jest znacznie bardziej reaktywny.
Rodnik ponadtlenkowy może być zarówno utleniaczem jak i reduktorem [6]. W
rozpuszczalnikach niepolarnych jest silną zasadą i nukleofilem [7], zaś w roztworach wodnych
działa jak silny czynnik redukujący oddając swój dodatkowy elektron, bądź jako słaby czynnik
utleniający ulegający redukcji do nadtlenku wodoru.
1.2.3. Rodnik nadhydroksylowy, HO
2
·
Rodnik nadhydroksylowy jest znacznie silniejszym utleniaczem niż anionorodnik
ponadtlenkowy. Przypuszcza się nawet [8], że układ rodników O
2
·-
/HO
2
·
odpowiedzialny jest za

szkodliwe działanie tlenu i uszkadzanie błon komórkowych. Charakteryzuje się długim czasem
życia, przez co może dyfundować do sąsiednich struktur komórkowych.
1.2.4. Nadtlenek wodoru, H
2
O
2
Nadtlenek wodoru powstaje w wyniku reakcji dysmutacji. Wytwarzany jest również
przez oksydazę L-aminokwasową i glikolanową. Jest najbardziej stabilną, pośrednią formą
redukcji tlenu do wody. Jako produkt redukcji tlenu cząsteczkowego, nie jest wolnym rodnikiem,
ponieważ nie posiada niesparowanych elektronów. Występuje w chloroplastach, mitochondriach,
siateczce śródplazmatycznej.
1.2.5. Rodnik hydroksylowy,
·
OH
Rodnik hydroksylowy jest wysoce reaktywny, a przez to reaguje tylko z cząsteczkami
znajdującymi się w najbliższym otoczeniu [9]. Wchodzi w reakcje z wieloma związkami
organicznymi (addycja, substytucja wolnorodnikowa, przenoszenie elektronów). Jest mało
ruchliwy, nie penetruje komórki.
Rodnik hydroksylowy powstaje podczas homolizy wiązania w cząsteczce wody pod
wpływem promieniowania jonizującego lub zgodnie z reakcją Fentona, która została opisana po
raz pierwszy w 1884 roku:
(1)
H
O
OH
Fe
O
H
Fe
-
3
2
2
2
•
+
+
+
+
=
+
Utleniony metal może być następnie zredukowany, co oznacza, że pełni on rolę katalizatora:
(2)
2
+
2
−
•
2
+
3
+
=
+
O
Fe
O
Fe
W sumie reakcję Fentona i ponadtlenkową redukcję metalu można przedstawić jako jedną
reakcję Habera-Weissa (1934r.):
(3)
•
•
+
+
=
+
OH
OH
O
O
H
O
-
2
2
2
-
2
Bez obecności katalizatora, czyli jonów metali przejściowych, ostatnia reakcja przebiega bardzo
wolno. Dodatek żelaza na plus drugim stopniu utlenienia znacznie ją przyspiesza. Żelazo na plus
trzecim stopniu utlenienia również może ją pośrednio katalizować, gdyż jest łatwo redukowalne
w organizmie.
1.2.6. Tlenek azotu, NO
W
organizmach
żywych tlenek azotu powstaje w procesie utleniania argininy do
cytruliny. Jest on neurotoksyczny, kancerogenny i może wytwarzać inne wolne rodniki. Po
przejściu z przeciwutleniacza do nadtlenoazotynu staje się silnym utleniaczem.
10

11
1.3. Wpływ wolnych rodników na komórki zwierzęce
Wolne rodniki w organizmach żywych atakują przede wszystkim lipidy, białka i materiał
genetyczny. W szczególny sposób narażone są na nie mitochondria i błony komórkowe, gdyż ich
uszkodzenie może doprowadzić do śmierci komórek [10].
1.3.1. Peroksydacja lipidów
Rodniki powstające z tlenu biorą udział w procesie przemiany lipidów. Termin
peroksydacja lipidów oznacza przemiany wywołane wpływem wolnych rodników na lipidy,
skutkiem czego, są różnego rodzaju produkty pośrednie o własnościach utleniających.
Produktami peroksydacji lipidów mogą być aldehydy, ketony czy hydroksynadtlenki, które
oddziaływują nie tylko na składniki komórek ale również na ich błony. Obecność ich wywołuje
zmiany ładunków na powierzchni błony oraz zmiany płynności błon. Dochodzi do pęcznienia,
czyli wzrostu objętości mitochondriów [11].
1.3.2. Wpływ na aminokwasy i białka
Wolne rodniki uszkadzają białka, czego skutkiem jest starzenie się komórki. Skóra staje
się sucha, stara i zwiotczała. Mięśnie słabną i tracą swoją sprężystość.
Podobne procesy
zachodzą wewnątrz organizmu, ale skutki są o wiele gorsze. Starzeje się cały organizm,
ponieważ starzeją się wszystkie komórki, których białko jest zaatakowane przez rodniki.
Efekty uszkodzeń struktury białek pod wpływem wolnych rodników można rozpatrywać
w trzech aspektach:
- modyfikacji
aminokwasów,
- fragmentacji
białek,
- agregacji
i
sprzęgania krzyżowego fragmentów peptydowych (powstawanie bityrozyny i
cystyny).
1.3.3. Wpływ na kwasy nukleinowe
Wolne rodniki oddziaływując z kwasami nukleinowymi mogą doprowadzić do
rozerwania łańcuchów lub modyfikacji zasad purynowych i pirymidynowych. Za powstawanie
tych uszkodzeń odpowiada w głównej mierze rodnik hydroksylowy, będący najsilniejszym
czynnikiem utleniającym w komórce, który z łatwością powoduje modyfikację cząsteczki kwasu
nukleinowego (modyfikacja zasad heterocyklicznych, rozrywanie wiązań fosfodiestrowych,
rozerwanie wiązań glikozydowych oraz uszkodzenie reszt pentozowych).
12
1.3.4. Działanie wolnych rodników na cały organizm
Wolne rodniki spełniają dużo korzystnych funkcji w organizmie. Są używane przez ciała
odpornościowe do niszczenia bakterii chorobotwórczych, utleniają substancje toksyczne. Tlenek
azotu i rodniki hydroksylowe wykorzystywane są w terapii nowotworów.
Z drugiej strony wolne rodniki uszkadzają DNA czyli kod genetyczny komórki. Prowadzi
to do powstawania komórek nowotworowych. Wywołują także wiele innych schorzeń, do
których można zaliczyć miażdżycę, chorobę Parkinsona, Alzheimera, raka itp.
W szczególny sposób na uszkodzenia wolnorodnikowe jest narażony mózg. Występują w
nim w dużych ilościach wielonienasycone kwasy tłuszczowe i żelazo, zaś w niewielkich
antyutleniacze.
1.4. Antyoksydanty, zmiatacze wolnych rodników
Organizmy
żywe (w tym człowiek) rozwinęły skomplikowany system obronny,
zabezpieczający przed szkodliwym działaniem wolnych rodników tlenowych, określany
systemem zmiataczy wolnych rodników tlenowych lub antyoksydacyjnym. Można je podzielić na
antyutleniacze enzymatyczne lub nieenzymatyczne [9].
1. Antyutleniacze enzymatyczne
a) System oksydaz mitochondrialnych,
b) Dysmutaza ponadtlenkowa (SOD) – wyróżnia się trzy rodzaje tego enzymu:
SOD1 (Cu,Zn-SOD) oraz SOD-2 i SOD-3 (obie zawierające Mn). Występuje w
zarówno w mitochondriach jak i cytozolu. Katalizuje dysmutację anionorodnika
ponadtlenkowego do nadtlenku wodoru, powodując spadek jego stężenia.
c) Peroksydaza glutationowa – w swoim składzie zawiera atom selenu, z tego
względu jest on błędnie uważany za antyutleniacz. Występuje w cytozolu i
mitochondriach. Redukuje hydronadtlenki organiczne i nadtlenek wodoru do
tlenu cząsteczkowego i wody.
d) Katalaza – jest reaktywna w peroksyzomach, obniża stężenie nadtlenku wodoru.
Okazało się, że osłabienie funkcji SOD i katalazy prowadzi do szybkiego
starzenia się komórek.
e) Ceruloplazmina – miedzioproteina o niebieskiej barwie występująca w surowicy
krwi. Katalizuje ona utlenianie jonów żelaza, przez co zapobiega wytwarzaniu
rodników hydroksylowych, likwiduje anionorodnik ponadtlenkowy [9]. Jest
enzymem zewnątrzkomórkowym o działaniu podobnym do SOD.

13
2. Antyutleniacze nieenzymatyczne
a) Witamina E i beta-karoten – najsilniejszym fizjologicznym antyoksydantem,
działającym w błonach komórkowych oraz lipoproteinach osocza jest witamina E.
Za główną biologiczną rolę witaminy E uważa się redukcję wolnych rodników
oraz zapobieganie peroksydacji nienasyconych kwasów tłuszczowych. Witamina
E i beta-karoten chronią płuca przed dymem tytoniowym, ponieważ usuwają NO
2
˙
[10].
b) Witamina C (kwas askorbinowy) – jest reduktorem zaangażowanym w reakcje
hydroksylacji (tworzenie hydroksyproliny w kolagenie), chelatuje metale, w tym
żelazo oraz chroni witaminy A i E przed utlenianiem. Reaguje z wolnymi
rodnikami w cytoplazmie i zewnątrzkomórkowo. Reagując z rodnikiem
hydroksylowym, ponadtlenkowym i tlenem singletowym, utrzymuje potencjał
oksydoredukcyjny komórek.
c) Kwas moczowy – jest inhibitorem peroksydacji lipidów, wchodzi w reakcje z
oksydantami, jak również wiąże jony żelaza. Jest końcowym produktem
metabolizmu puryn.
d) Chelatory metali (transferyna, mioglobina, laktoferyna, hemoglobina) – ich
mechanizm działania polega na zapobieganiu katalizowania reakcji utleniania
przez żelazo i miedź. Można do nich zaliczyć też poliaminy biogenne.
e) Glutation – jest jednym z głównych niskocząsteczkowych czynników obrony
przed działaniem wolnych rodników tlenowych. Występuje w wysokich
stężeniach we wszystkich komórkach eukariotycznych.
f) Koenzym Q
10
(ubichinon) – występuje w cytoplazmie w połączeniu z
lipoproteinami oraz w wewnętrznej błonie mitochondrialnej, w mitochondrialnym
układzie oddychania. Zapobiega przed utlenianiem lipidów.
g) Fito-związki – zmiatacze rodników o pochodzeniu roślinnym (flawonoidy,
antocyjany, proantocyjany, pytoestrogeny, polifenole) posiadające właściwości
antyoksydacyjne [12].
1.5. Metody oznaczania wolnych rodników i stresu oksydacyjnego. Całkowity
potencjał antyoksydacyjny
W literaturze opisanych jest wiele metod oznaczania zarówno wolnych rodników [13-20]
jak i antyoksydantów [13, 20-23]. W organizmach żywych zachodzi wiele przemian, w wyniku
których dochodzi do wytworzenia wolnych rodników o różnej trwałości i reaktywności. Istnieje

14
więc potrzeba oznaczania sumarycznej ilości tych rodników lub stresu oksydacyjnego, który
wywołują [18, 24-27]. Stężenia antyoksydantów zmieniają się podczas powstawania zmian
patologicznych, które są spowodowane z jednej strony ich zużywaniem się podczas reakcji z
wolnymi rodnikami, z drugiej zaś akcją obronną organizmu. Często oznaczanie sumarycznego
stężenia wszystkich antyoksydantów pozwala na lepszą ocenę poziomu mocy antyoksydacyjnej
badanego układu, niż oznaczanie stężenia poszczególnych antyoksydantów każdego z osobna
[28-37].
Wolne rodniki w swej budowie zawierają niesparowane elektrony, co nadaje im
właściwości paramagnetyczne. Dlatego też pomiar oddziaływania próbki z polem
magnetycznym dostarcza informacji o sumarycznej ilości wolnych rodników w niej zawartych.
Taki pomiar można wykonać przy użyciu wagi tzw. aparatu Gouy’a [38, 39]. Na oznaczaniu
własności paramagnetycznych próbki oparte są również pomiary elektronowego rezonansu
paramagnetycznego (EPR).
Rodniki mogą być także wytwarzane pod wpływem działania na niektóre związki
promieniowania elektromagnetycznego. W przypadku odwrotnej reakcji, np. rekombinacji
rodników lipidowych dochodzi wówczas do wydzielenia kwantu promieniowania
elektromagnetycznego tzn. chemiluminescencji. Metoda pomiaru chemiluminescencji pozwala
na badanie niestabilnych rodników lipidowych, możliwych nawet w do bezpośredniej analizy
żywym organizmie [40].
Z chemicznego punktu widzenia wolne rodniki są, z reguły, utleniaczami, z kolei
antyoksydanty są reduktorami. Dlatego możliwe jest ich oznaczanie (w tym, ich sumarycznego
stężenia i całkowitego potencjału antyoksydacyjnego) metodami elektrochemicznymi [43].
Oznaczanie stresu oksydacyjnego jest również możliwe za pomocą analizy niektórych
związków naturalnie występujących w komórkach. Do tej grupy zalicza się oznaczanie
sumarycznego stężenia tioli [44, 45], stosunek stężeń glutationu do jego postaci utlenionej [46,
47] jak również kwasu askorbinowego do dehydroaskorbinowego [48]. Rodniki wchodzą w
reakcje prawie ze wszystkimi związkami aktywnymi biologicznie. Do wyznaczenia stopnia
uszkodzenia związków służą produkty reakcji.
Inna metoda polega na dodaniu do badanego układu związku, który tworzy trwały
rodnik, możliwy do
oznaczeń przy pomocy dowolnej metody analitycznej, np. elektronowego
rezonansu paramagnetycznego bądź fotometrii [41, 42].
Stężenie rodników hydroksylowych, które są najbardziej reaktywne spośród wszystkich
rodników, jest przybliżoną miarą całkowitego stresu oksydacyjnego. Ponieważ rodniki te
są
wyjątkowo nietrwałe do ich oznaczania stosuje się metodę pułapki spinowej. Oznaczanie tą
metodą polega na wprowadzeniu względnie nietoksycznych związków aromatycznych do
materiału biologicznego, a następnie oznaczeniu produktów ich reakcji z rodnikiem

15
hydroksylowym. Jako pułapkę spinową stosuje się naturalnie występująca fenyloalaninę, kwas
tereftalowy [45] lub egzogenne pochodne aspiryny [2, 15]. Oznaczanie produktów odbywa się
głównie na drodze chromatograficznej.
W literaturze można odnaleźć następujące określenia na sumaryczne stężenie wszystkich
antyoksydantów w badanym układzie: TRAP – total redox antioxidant potential, TRAP – total
peroxyl radical trapping antioxidant parametr, FRAP – ferric reducing ability of plasma, ORAC
– oxygen radical absorbance capacity, TEAC – Trolox-equivalent antioxidant capacity, TAC –
total antioxidant capacity oraz TAR – total antioxidant reactivity [29, 34]. W tej pracy będę
stosowała termin całkowity potencjał antyoksydacyjny, w skrócie CPA.
Pomiar CPA znacznie się rozwinął w odniesieniu do badania zdolności
antyoksydacyjnych skomplikowanych próbek biologicznych (surowica czy osocze krwi) [29-37].
Jedna z metod, FRAP, opiera się na redukcji żelaza przez składniki surowicy oraz na
fotometrycznym pomiarze wytworzonych trwałych rodników [32, 44].
Inna metoda, tzw. TRAP, polega na badaniu rodników peroksylowych, które powstają
wskutek termicznego rozpadu związków diazowych. Monitoruje się je za pomocą detektora,
czyli takiego związku, który w wyniku reakcji z rodnikiem będzie zmieniał swoje właściwości
fizykochemiczne, łatwe do oznaczania. Efekt ten można zaobserwować poprzez zmianę sygnału
luminescencyjnego [33], fluorymetrycznego [29, 51] lub fotometrycznego [31, 35]. Miarą
potencjału antyoksydacyjnego jest przesunięcie w czasie krzywej obrazującej zmiany stężenia
detektora lub produktu jego reakcji, w czasie. Przesunięcie to jest spowodowane tym, że zawarte
w próbce antyoksydanty nie dopuszczają do reakcji detektora z rodnikiem. Warunkiem tej
metody jest, aby reakcja próbki z rodnikiem była znacznie szybsza od analogicznej reakcji
detektora.
Do pomiaru CPA mogą być również zastosowane metody chromatograficzne. Układ
pomiarowy zawiera wtedy próbkę biologiczną bądź badany związek oraz detektor (np. kwas p-
hydroksybenzoesowy) [52] pełniący rolę pułapki spinowej. Rodniki hydroksylowe generowane
są w reakcji analogicznej do reakcji Fentona [49, 50]. Są one zmiatane przez detektor jak i przez
badaną próbkę. W przypadku, gdy próbka charakteryzuje się większą reaktywnością z rodnikami
niż detektor, wówczas nastąpi zmniejszenie wysokości piku chromatograficznego produktu
reakcji detektora z rodnikiem. Można w ten sposób porównać moc zmiatania rodników
hydroksylowych przez różne próbki. Zmniejszenie to jest zależne od mocy jak i stężenia
antyoksydanta (Rys. 1).
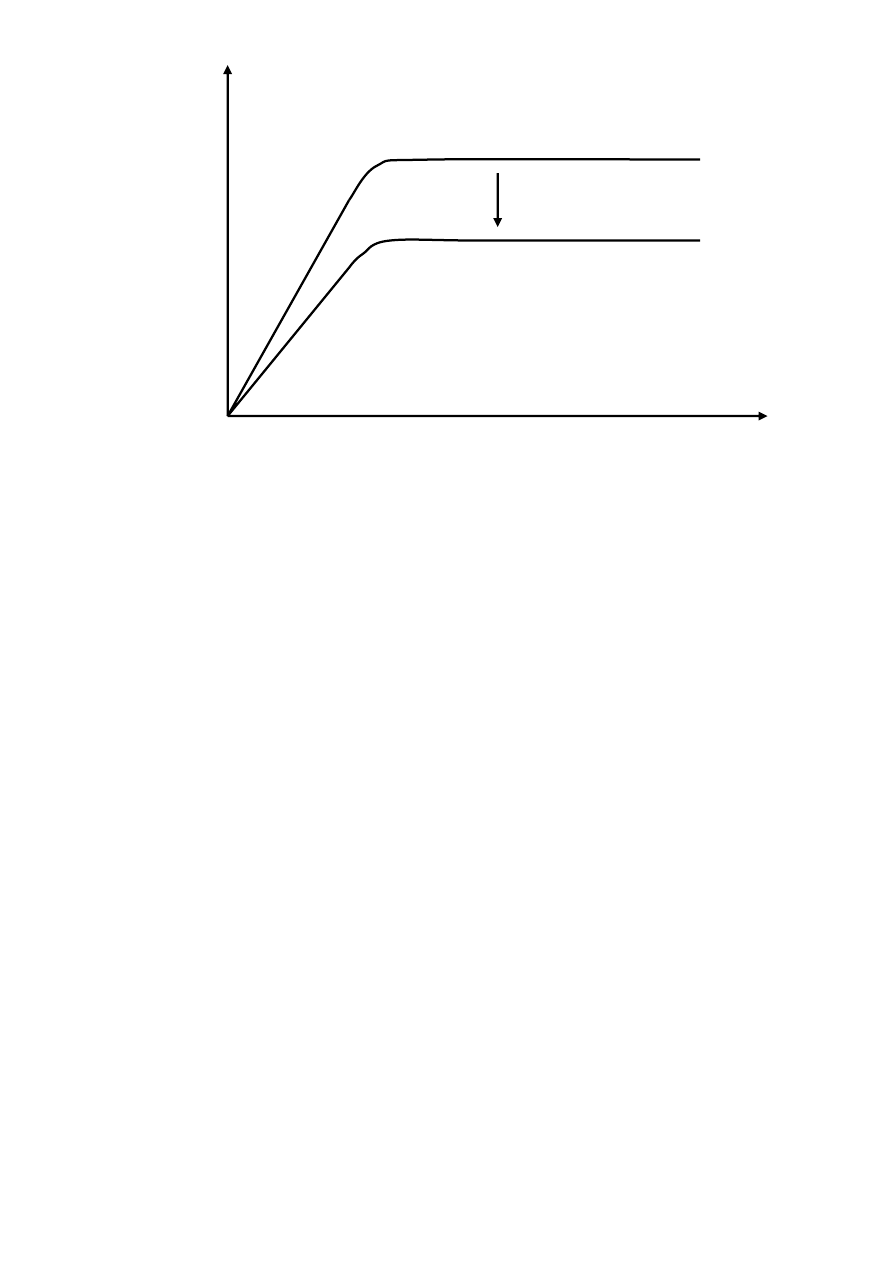
odniesienie
próbka
czas
st
ęż
enie
•
OH
Rys.1. Schemat pomiaru całkowitego potencjału antyoksydacyjnego metodą chromatograficzną.
1.6. Właściwości naturalnych antyoksydantów
W ostatnich latach duże zainteresowanie wzbudzają naturalne antyoksydanty zawarte w
roślinach. Należą do nich polifenole, a w szczególności flawonoidy i antocyjany. Związki te,
występujące w wielu owocach, warzywach, herbacie i ziołach, wykazują silne właściwości
antyoksydacyjne [57]. Szczególnie dużo antocyjanów zawartych jest w aronii czarnej (Aronia
melanocarpa) [57, 58], bzie czarnym (Sambucus nigra) czy korze sosny śródziemnomorskiej
(Pinus pinaster). Żółte i czerwone zabarwienie kwiatów pochodzi często od flawonoidów, z
kolei czerwono-fioletowe barwy jagód od antocyjanów.
16

17
2. CEL PRACY
W literaturze opisane są metody oznaczania rodników hydroksylowych z zastosowaniem
fenyloalaniny, kwasu salicylowego, a także kwasu p-hydroksybenzoesowego, jako pułapek
spinowych. Produkty reakcji tych związków z rodnikami oznaczane były za pomocą HPLC z
detekcją elektrochemiczną. Te same związki były zastosowane do oznaczania CPA (w tym
przypadku rodniki hydroksylowe były generowane w układzie pomiarowym). Ostatnio okazało
się, że do oznaczania rodników hydroksylowych można zastosować kwas tereftalowy.
Produktem reakcji był wówczas kwas hydroksytereftalowy oznaczany za pomocą HPLC z
detekcją fluorescencyjną [53, 54].
Celem pracy było:
- zbadanie
możliwości zastosowania kwasu tereftalowego do oznaczania CPA (z
zastosowaniem detekcji fluorescencyjnej),
- zbadanie
właściwości antyoksydacyjnych napoi alkoholowych i bezalkoholowych,
naparów herbat i ziół oraz soków.

18
______________________________________________
3. CZĘŚĆ EKSPERYMENTALNA
3.1. Odczynniki
Podczas pracy stosowałam następujące odczynniki:
-
kwas tereftalowy (TFA); Sigma-Aldrich, Niemcy,
-
bufor fosforanowy w soli fizjologicznej PBS (Phosphate Buffered Saline) w
tabletkach; Sigma-Aldrich, Niemcy,
- siarczan
(VI)
żelaza (II); Sigma-Aldrich, Niemcy,
-
fosforan sodowy jednozasadowy cz.d.a.; POCh, Polska,
-
fosforan potasowy dwuzasadowy cz.d.a.; POCh, Polska,
-
wodorotlenek sodu cz.d.a., Chempur, Polska,
-
3% woda utleniona; Infarm, Polska,
-
alkohol etylowy; POCh, Polska.
Próbki napoi alkoholowych, herbat, ziół i soków zostały zakupione w najbliższym
supermarkecie. W pracy stosowałam wodę destylowaną.
3.2. Aparatura
Pomiary chromatograficzne były wykonywane za pomocą zestawu do wysokosprawnej
chromatografii cieczowej (HPLC) firmy Knauer (Niemcy) składającego się z:
- pompy
dwutłokowej Smartline 1000 o zakresie przepływu 0,001-50 ml/min,
- interfejsu
z
degazerem, Smartline Manager 500,
-
dozownika o objętości pętli 20 μl,
- mieszalnika,
-
kolumny analitycznej RP-18 5μm, 250x3 mm śred. wew., Hypersil, Wielka
Brytania,
-
termostatu Smartline 400 o zakresie temperatur 5-85° C,
-
detektora DAD UV-Vis Smartline 2600 do oznaczania TFA,

19
- detektora fluorescencyjnego RF-10AXL do oznaczania kwasu
hydroksytereftalowego (HTFA), Schimadzu, Japonia,
- komputera.
pH buforu było mierzone pehametrem CP – 251 (Elmetron, Polska) kalibrowanym przed
każdym pomiarem dwoma roztworami wzorcowymi o pH 7,0 i 4,0.
3.3. Metody pomiarowe
3.3.1. Przygotowywanie próbek
Substancje użyte do analizy nie były wstępnie oczyszczane. Roztwory przygotowywane
były poprzez rozpuszczenie naważek w wodzie destylowanej. Przechowywane były one w
lodówce do jednego tygodnia. Stężenia wyjściowe związków do reakcji wynosiły 10 mM.
3.3.2. Stosowane antyoksydanty
Podczas pracy badałam CPA napoi alkoholowych, naparów herbat i ziół oraz napoi i
soków. Napoje alkoholowe zostały podzielone na dwie grupy, tj. wysokoprocentowe napoje
alkoholowe (wódki, likiery, brandy itp.) i niskoprocentowe napoje alkoholowe (wina, piwa,
wermuty itp.).
Wysokoprocentowe napoje alkoholowe (około 40%):
- wódka
Borovicka (Słowacja),
- whisky
Ballantines (Irlandia),
- brandy
Grand Cavalier (Łotwa),
- nalewka
Czarny Balsam (Łotwa),
- nalewka
Unicum (Węgry),
- likier
Krupnik (Polska),
- likier
Bylinna (Czechy),
- likier
Malibu (Polska),
- gin
Gordon’s (Wielka Brytania).
Wszystkie były rozcieńczane wodą destylowaną 20-krotnie.
Niskoprocentowe napoje alkoholowe (około 5-15%):
Wśród nich wyróżniamy piwo Grafen Walder Strong (Niemcy), a także wina:
białe: półwytrawne Blanc de Blanc (Bułgaria), wytrawne Chardonnay (Węgry),
różowe: półwytrawne Melnik Rose (Bułgaria), gazowane Spurmante Roso
(Włochy),

20
czerwone: słodkie Pierre Chalain (Francja), słodkie Commandaria (Cypr),
półsłodkie Pamid ((Bułgaria), półsłodkie Kadarka (Bułgaria), słodkie
Kadarka (Mołdawia), wytrawne Bordeaux (Francja), wermut Martini
(Włochy).
Wszystkie były rozcieńczane 10-krotnie wodą destylowaną.
Napary
ziół i herbat (biała, zielona, czerwona, czarna, żeńszeniowa i kawa żołędziowa)
przygotowane były poprzez rozpuszczenie naważki 1g, a następnie parzone przez 15 minut w 10
ml gotującej się wody destylowanej. Następnie były sączone przez sączek membranowy
(Milipore, USA).
Napoje i soki: Gingers beer (Polska), karob (Cypr), ocet winny (Włochy), sok z czarnego
bzu (Polska) czy sok z brzozy (Polska) były przed badaniami rozcieńczane 10-krotnie wodą
destylowaną.
3.3.3. Wytwarzanie rodników i ich reakcja z antyoksydantami
Układ pomiarowy zawierał próbkę (roztwór napoju alkoholowego lub naparu z herbaty)
oraz detektor (kwas tereftalowy), który pełnił rolę pułapki spinowej. Rodniki hydroksylowe były
generowane w reakcji Fentona w obecności żelaza na plus drugim stopniu utlenienia, buforu
fosforanowego i nadtlenku wodoru
Fe
2+
+ H
2
O
2
= Fe
3+
+ OH
-
+ OH
·
.
Zarówno detektor (Rys. 2) jak i badana próbka zmiatały wygenerowane w ten sposób rodniki. W
przypadku, kiedy próbka odznaczała się większą reaktywnością z rodnikami niż detektor
wysokość piku chromatograficznego produktu reakcji detektora z rodnikiem
(kwasu hydroksyl-
tereftalowego) była mniejsza niż układu bez próbki. Wynikiem pomiaru była więc różnica pola
powierzchni przed i po dodaniu próbki. Reakcję przeprowadzano poprzez dodanie do naczynka
roztworów:
- 500
μl buforu fosforanowego pH = 7,4, o stężeniu c = 0,02 M,
- 100
μl 10 mM TFA,
- 100
μl 0,3% H
2
O
2,
- wody
destylowana,
-
próbki (sumaryczna objętość próbki i wody destylowanej wynosiła 200 µl),
- 100
μl 10 mM FeSO
4.
Fe (II) dodawane było na samym końcu, ponieważ inicjowało ono reakcję. Po jego dodaniu
mierzony był czas 7 minut, po którym otrzymany roztwór był wstrzykiwany na kolumnę. Czas
ten wyznaczony był eksperymentalnie z pomiarów koleżanki Katarzyny Czajki, która prowadziła
równolegle badania w ramach swojej pracy magisterskiej.
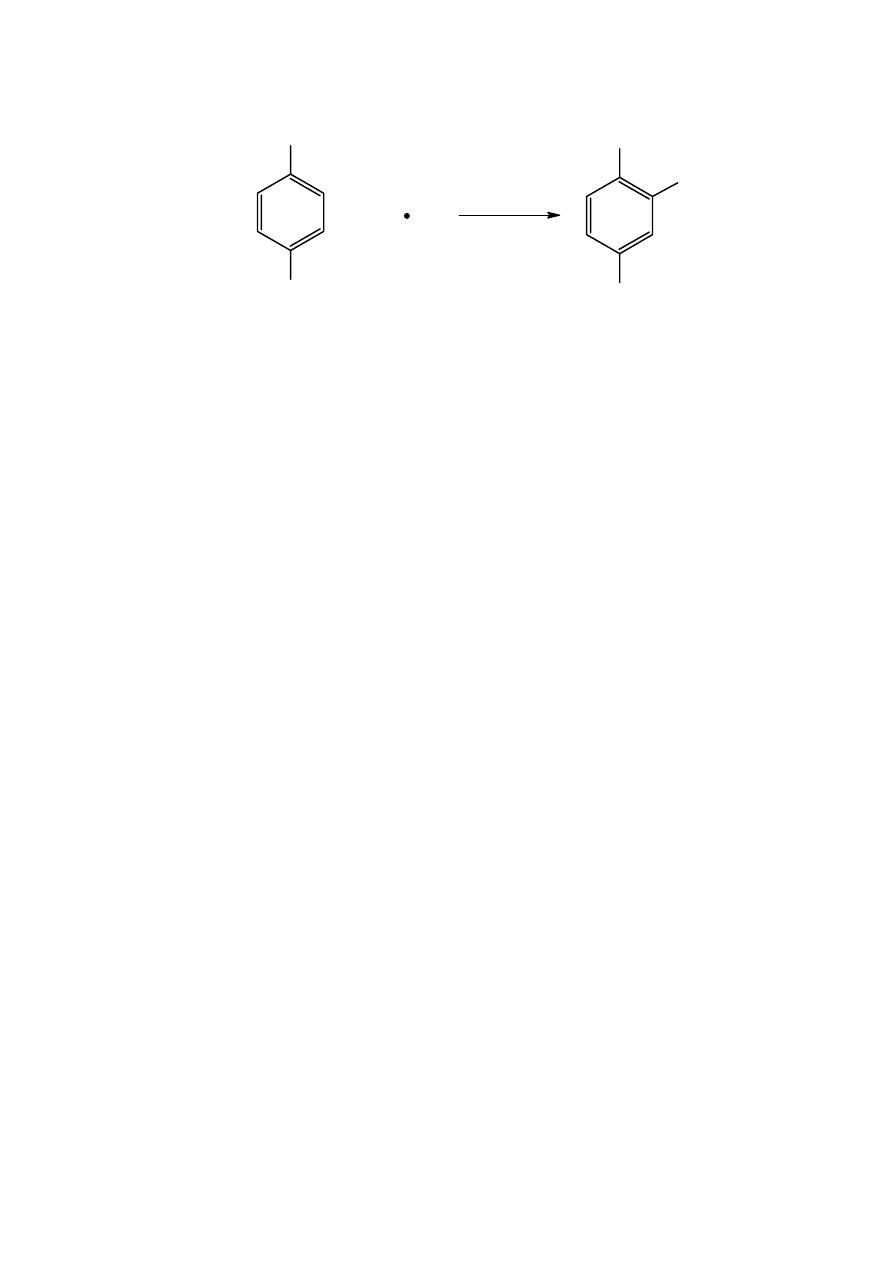
TFA +
•
OH = HTFA
COOH
COOH
+
OH
COOH
COOH
OH
Rys. 2. Reakcja pułapkowania rodnika hydroksylowego kwasem tereftalowym, w wyniku której
powstaje kwas hydroksytereftalowy.
3.3.4. Warunki rozdziału chromatograficznego
Warunki chromatograficznego oznaczania kwasu hydroksytereftalowego (HTFA) zostały
wyznaczone eksperymentalnie. Pomiary przeprowadzane były w temperaturze 18°C, w układzie
faz odwróconych przy przepływie fazy ruchomej 0,7 ml/min. Fazą ruchomą był bufor
fosforanowy o pH 6,6. Przed rozpoczęciem pracy kolumna była stabilizowana fazą ruchomą
przez pół godziny. Za pomocą strzykawki wprowadzana była do dozownika próbka o objętości
powyżej 20 μl, która następnie trafiała na kolumnę. Sygnał wyjściowy detektora
fluorescencyjnego pracującego przy długości fali wzbudzenia 312 nm i fali emisji 428 nm był
monitorowany w sposób ciągły przez komputer. Każda próbka była badana trzykrotnie, a
wynikiem ostatecznym była średnia z tych pomiarów. Dla każdej średniej obliczone zostało
odchylenie standardowe (SD), które zaznaczono na wykresach.
Bufor fosforanowy o pH 6,6, stosowany jako faza ruchoma przygotowany, był przez
zmieszanie 312,5 ml 0,2 M NaH
2
PO
4
i 187,5 ml 0,2 M K
2
HPO
4
. Całość dopełniano wodą
destylowaną do 1 litra. pH buforu mierzone było za pomocą pehametru. Ewentualne różnice w
żądanym pH były korygowane dodatkiem jednego z roztworów składowych.
W pracy przetestowane zostały dwa sposoby wyrażania miary CPA. Pierwszym była
różnica pola powierzchni piku HTFA otrzymanego bez próbki w mieszaninie reakcyjnej i pola w
obecności próbki o stężeniu końcowym wynoszącym dla wysokoprocentowych napoi
alkoholowych 200 µl/l, niskoprocentowych napoi alkoholowych, soków i napoi
bezalkoholowych 500 µl/l oraz naparów herbat 0,5 g/l. Drugą miarą CPA było nachylenie
zależności różnic podanych pól powierzchni od stężenia próbki. Gdy próbka zbyt silnie zmiatała
rodniki hydroksylowe wówczas CPA nie zależało od jej stężenia. W takich przypadkach
stosowane były bardziej rozcieńczone roztwory, a wyniki były przeliczane na podane stężenia,
zakładając liniową zależność CPA od stężenia dla małych jego wartości.
21
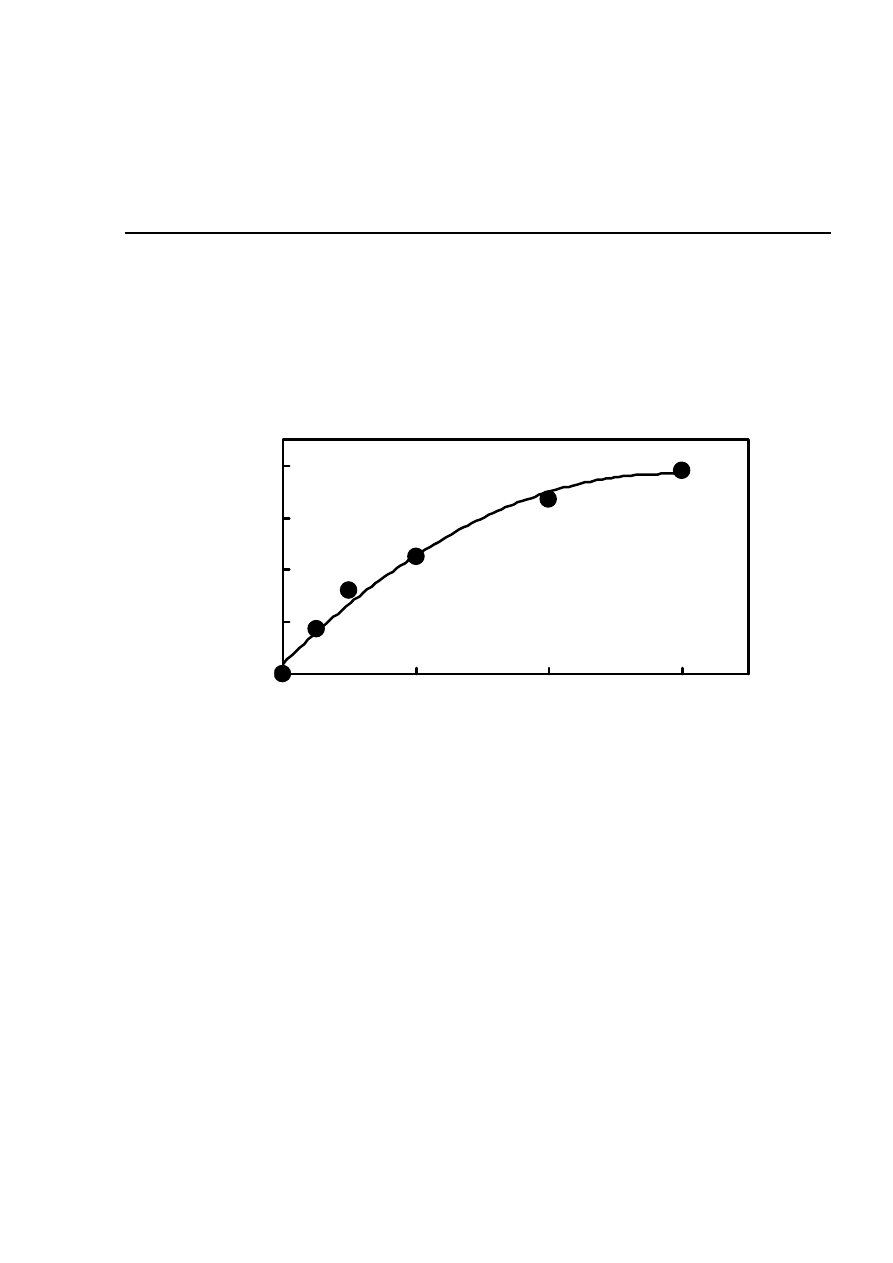
4. WYNIKI
4.1. Wpływ stężenia próbki na zmianę powierzchni piku
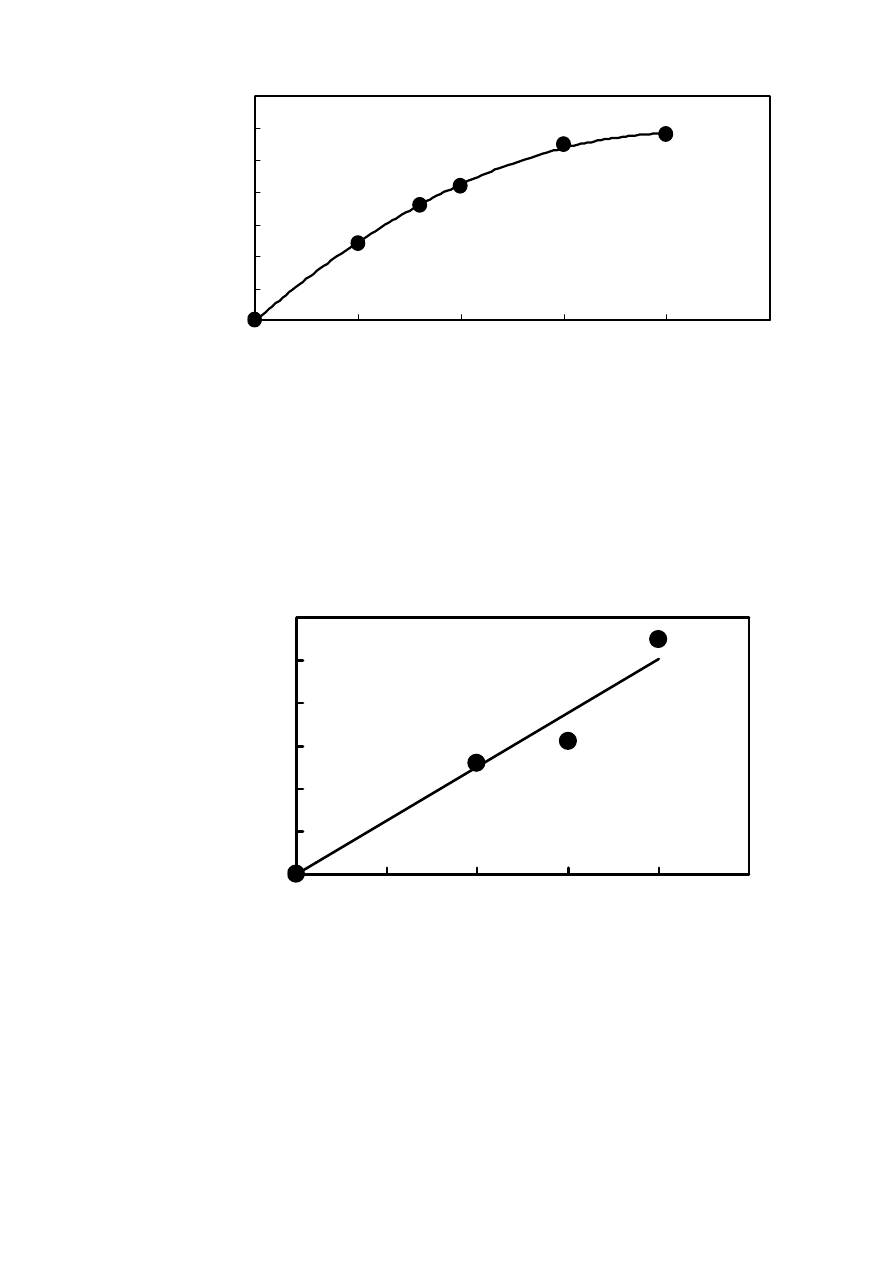
0
20
40
60
80
0
2000
4000
6000
c [
μl/l]
zm
ia
n
a
pol
a pow
ie
rz
ch
ni
pi
ku
[μ
V*
m
in
]
Rys. 3. Wpływ stężenia wina czerwonego Pierre Chalain na zmianę pola powierzchni piku
HTFA. Warunki chromatograficzne: kolumna RP-18 - Hypersil 5 μm, 250x3 śred. wew.,
temperatura 18° C, szybkość przepływu 0,7 ml/min, detektor fluorescencyjny o długość fali
wzbudzenia λ=312nm, emisji λ=428nm, faza ruchoma 100% bufor fosforanowy o pH=6,6 i
stężeniu 0,1 M.
22
0
10
20
30
40
50
60
70
0
500
1000
1500
2000
2500
c [
μl/l]
zm
ia
na
po
la
pow
ie
rz
c
hni
pi
k
u
[μ
V*
m
in
]
Rys. 4. Wpływ stężenia
wina różowego Spurmante Roso na zmianę pola powierzchni piku HTFA.
Warunki chromatograficzne jak na Rys. 3.
y = 0,1259x
R
2
= 0,9554
0
10
20
30
40
50
60
0
100
200
300
400
500
c [
μl/l]
zm
ia
na
pol
a
pow
ie
rz
c
hni
pi
k
u
[μ
V*
m
in]
Rys. 5. Wpływ stężenia 40% roztworu alkoholu etylowego na zmianę pola powierzchni piku
HTFA. Warunki chromatograficzne jak na Rys. 3.
czy to był to czysty alkohol?
23
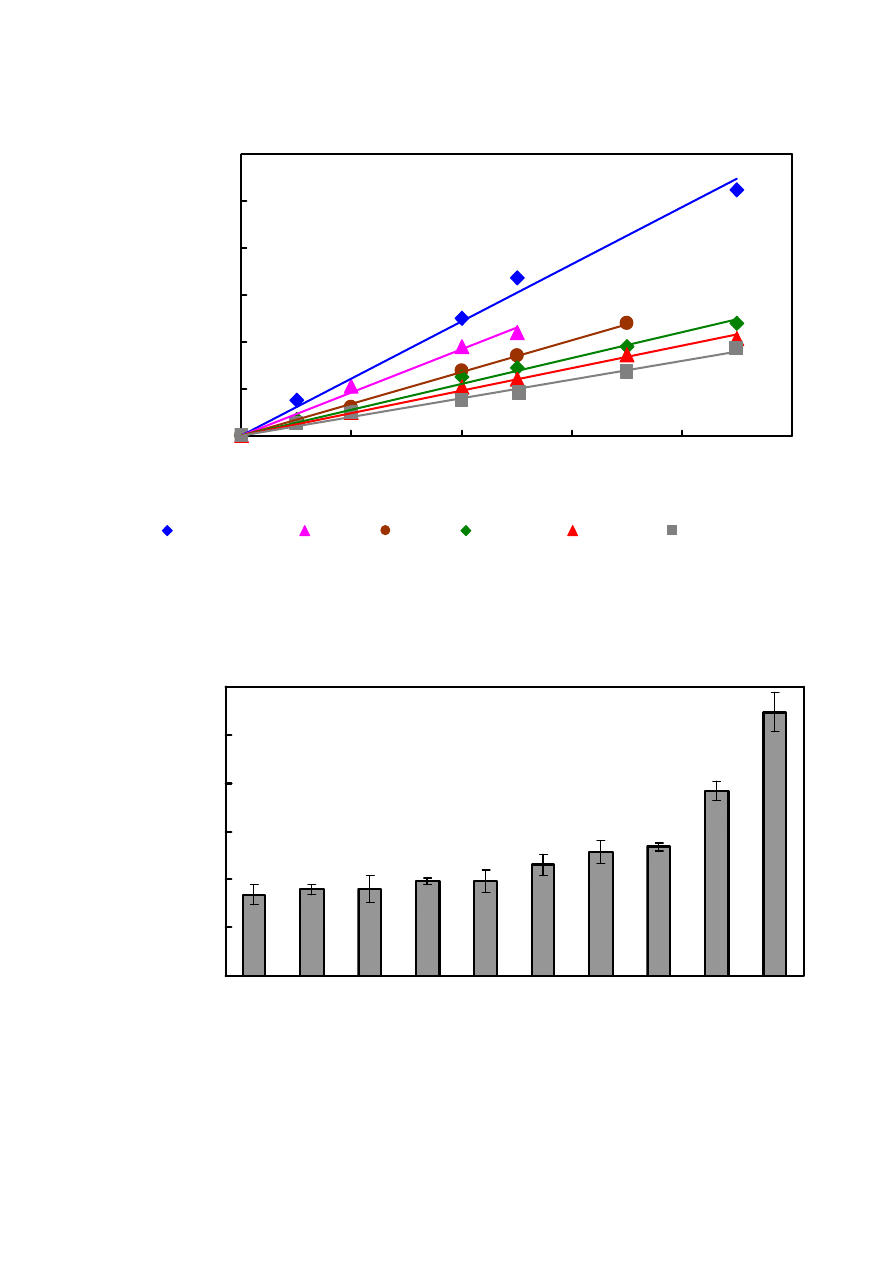
4.2. CPA wysokoprocentowych napoi alkoholowych
0
20
40
60
80
100
120
0
100
200
300
400
500
c [
μl/l]
zm
ia
na
po
la
po
w
ie
rz
c
hn
i p
ik
u
[μ
V*
m
in
]
Czarny Balsam
Unicum
Bylinna
Ballantines
Borovicka
Grand Cavalier
Rys. 6.
Wpływ stężenia wysokoprocentowych napoi alkoholowych na zmianę pola powierzchni
piku HTFA. Warunki chromatograficzne jak na Rys. 3.
0
10
20
30
40
50
60
Gr
an
d Ca
va
lie
r
Go
rd
on
's
Kr
up
nik
Bo
ro
vi
ck
a
M
al
ibu
Ba
lla
nt
in
es
By
linn
a
Et
an
ol
Un
ic
um
Cz
ar
ny
B
als
am
CP
A [
μ
V*
m
in
]
Rys. 7. Wartości CPA wysokoprocentowych napoi alkoholowych o stężeniu 200 µl/l. Warunki
chromatograficzne jak na Rys. 3.
24
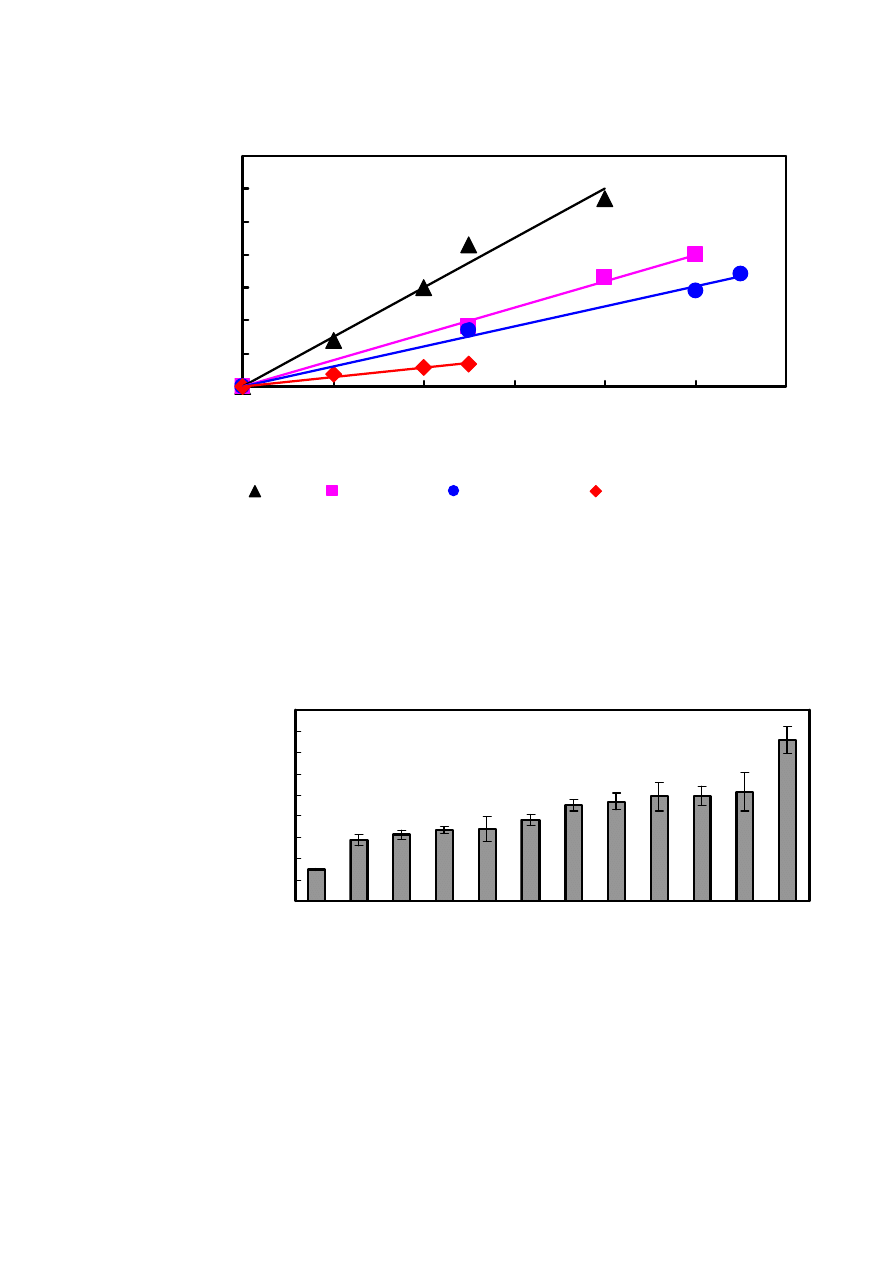
4.4. CPA niskoprocentowych napoi alkoholowych
0
10
20
30
40
50
60
70
0
200
400
600
800
1000
1200
c [
μl/l]
zm
ia
na
pol
a
pow
ie
rz
c
hni
pi
k
u
[μ
V
*mi
n
]
Martini
Melnik Rose
Blanc de Blanc
Grafen Walder Strong
Rys. 8. Wpływ stężenia niskoprocentowych napoi alkoholowych na zmianę pola powierzchni piku
HTFA. Warunki chromatograficzne jak na Rys. 3.
0
5
10
15
20
25
30
35
40
45
Gr
afe
n Wa
ld
er
St
ro
ng
Ch
ard
on
nay
Bla
nc
d
e
Bl
an
c
Pi
err
e C
ha
la
in
Pa
mi
d
Me
ln
ik
Ro
se
Sp
ur
m
ant
e Ro
so
Ka
da
rk
a M
Ka
da
rk
a B
Co
m
ma
nd
ar
ia
Bo
rd
eau
x
Ma
rti
ni
CPA [
μ
V
*mi
n
]
Rys. 9. Wartości CPA niskoprocentowych napoi alkoholowych o stężeniu 500 μl/l. Warunki
chromatograficzne jak na Rys. 3.
25
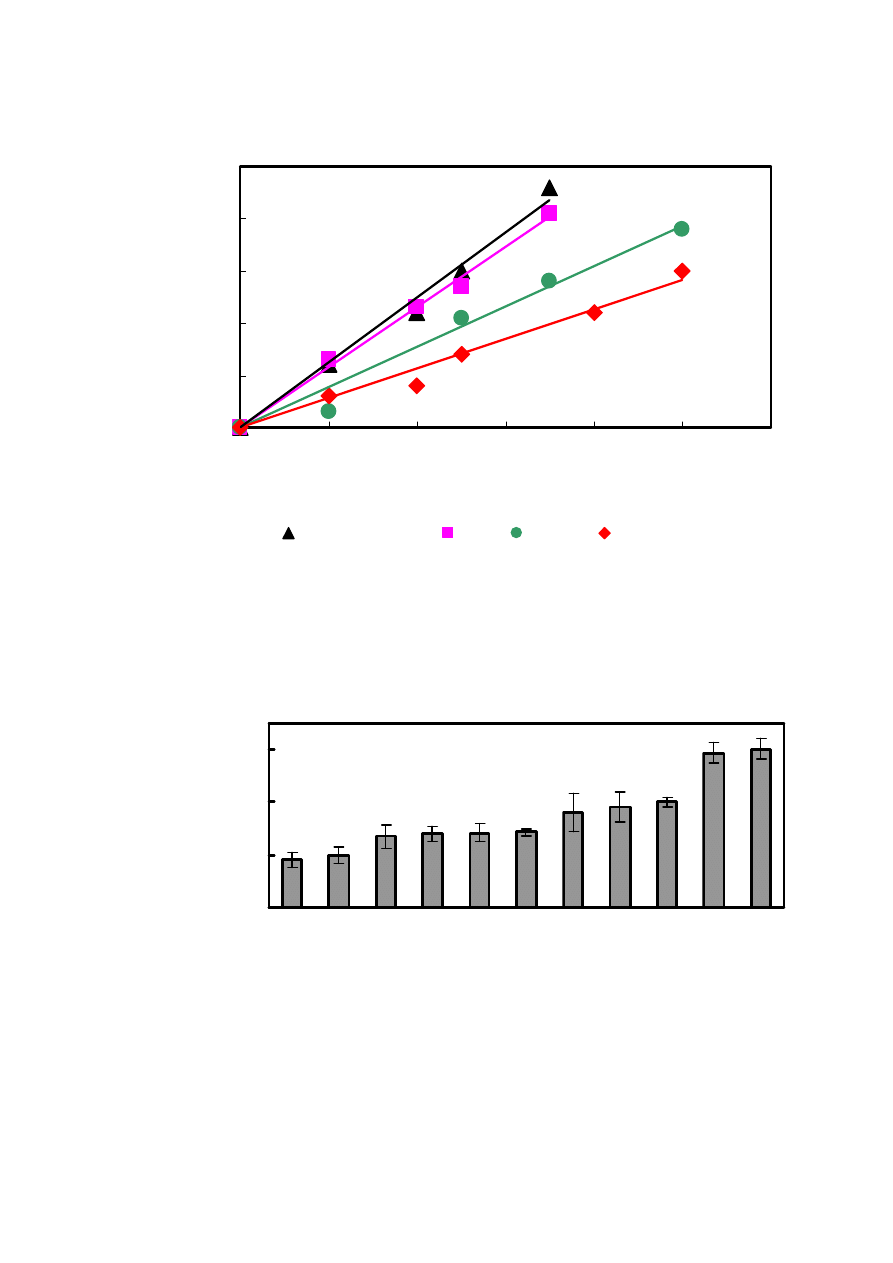
4.5. CPA naparów ziołowych
0
10
20
30
40
50
0
0,2
0,4
0,6
0,8
1
1,2
c [g/l]
zm
ia
na
pol
a
pow
ie
rz
c
hni
pi
k
u
[μ
V*
m
in]
Zielona chińska
Biała
Czarna
Żeńszeniowa
Rys. 10. Wpływ stężenia herbat na zmianę pola powierzchni piku HTFA. Warunki
chromatograficzne jak na Rys. 3.
0
10
20
30
In
dia
ek
sp
re
so
wa
Pu
-E
rh
c
hi
ńs
ka w
iś
ni
ow
a
Że
ńs
ze
ni
ow
a
M
ar
oc
co
e
ksp
re
sow
a
Ea
rl G
re
y e
ksp
re
so
wa
Cz
erw
on
a
Ka
w
a
żo
łę
dz
io
wa
Zie
lo
na
mi
ęt
ow
a
Cz
ar
na
Bi
ał
a
Zi
el
ona
c
hi
ńsk
a
CP
A [
μ
V*
m
in
]
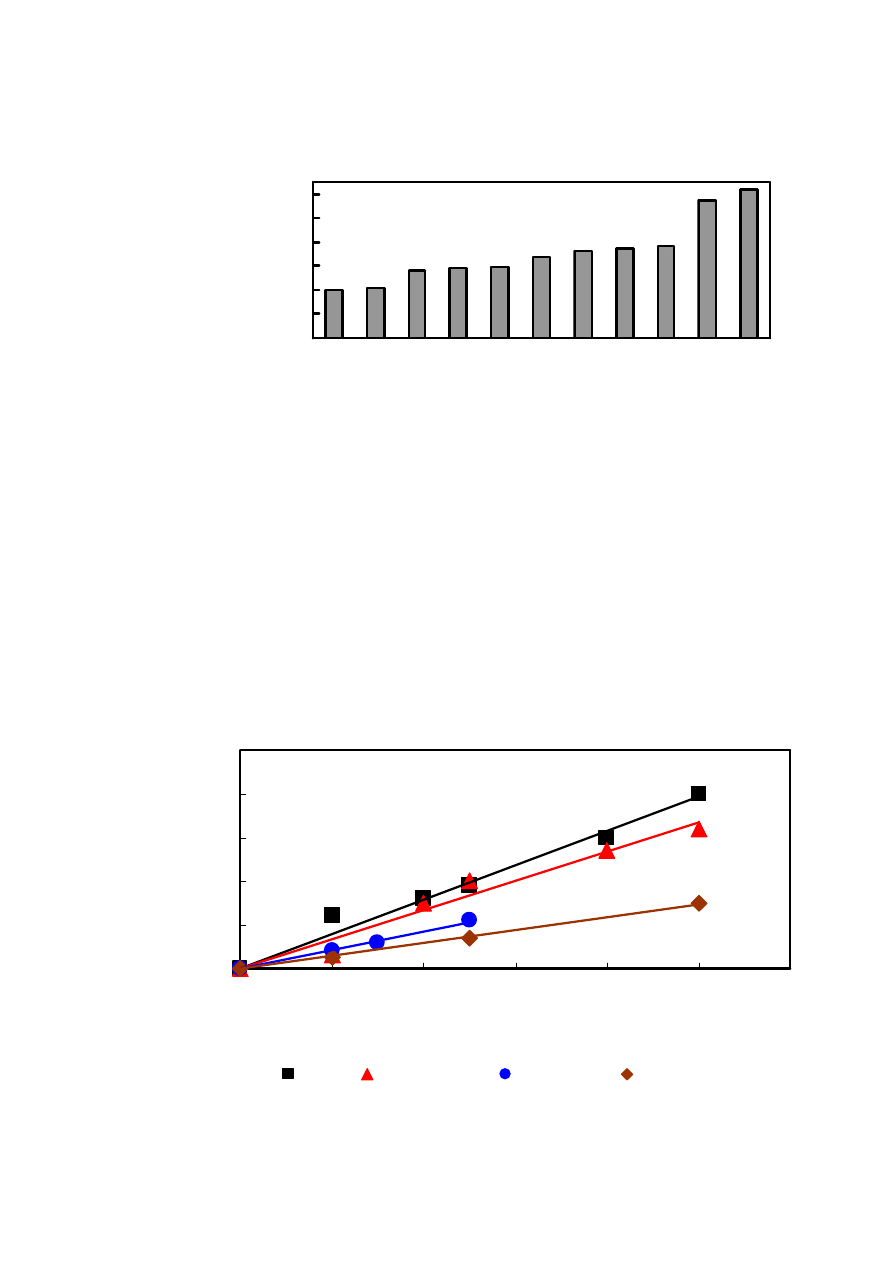
Rys. 11. CPA naparów ziołowych o stężeniu 0,5 g/l. Warunki chromatograficzne jak na Rys. 3.
26
0
10
20
30
40
50
60
In
di
a ek
spr
es
owa
Pu
-Er
h c
hi
ńs
ka
wi
śni
ow
a
Cze
rwo
na
Że
ńs
zen
io
wa
Ma
roc
co e
ks
pr
es
ow
a
Ea
rl G
rey
e
ksp
re
sow
a
Zi
elo
na m
ię
to
wa
Ka
wa
żo
łę
dz
io
wa
Cz
ar
na
Bia
ła
Zi
elo
na c
hi
ńs
ka
CP
A [
μ
V*
m
in
*l
/μ
g]
Rys. 12. CPA, wyrażone jako nachylenia krzywej…, naparów ziołowych o stężeniu 0,5 g/l.
Warunki chromatograficzne jak na Rys. 3. Czy jednostki są ok.?
4.6. CPA soków i napoi bezalkoholowych
0
10
20
30
40
50
0
200
400
600
800
1000
1200
c [
μl/l]
zm
ia
na
pol
a
pow
ie
rz
c
hni
pi
k
u [
μ
V*
m
in]
Karob
Sok z brzozy
Ocet winny
Gingers beer
Rys. 13. Wpływ stężenia soków i napoi bezalkoholowych na zmianę pola powierzchni piku
HTFA. Warunki chromatograficzne jak na Rys. 3.
27
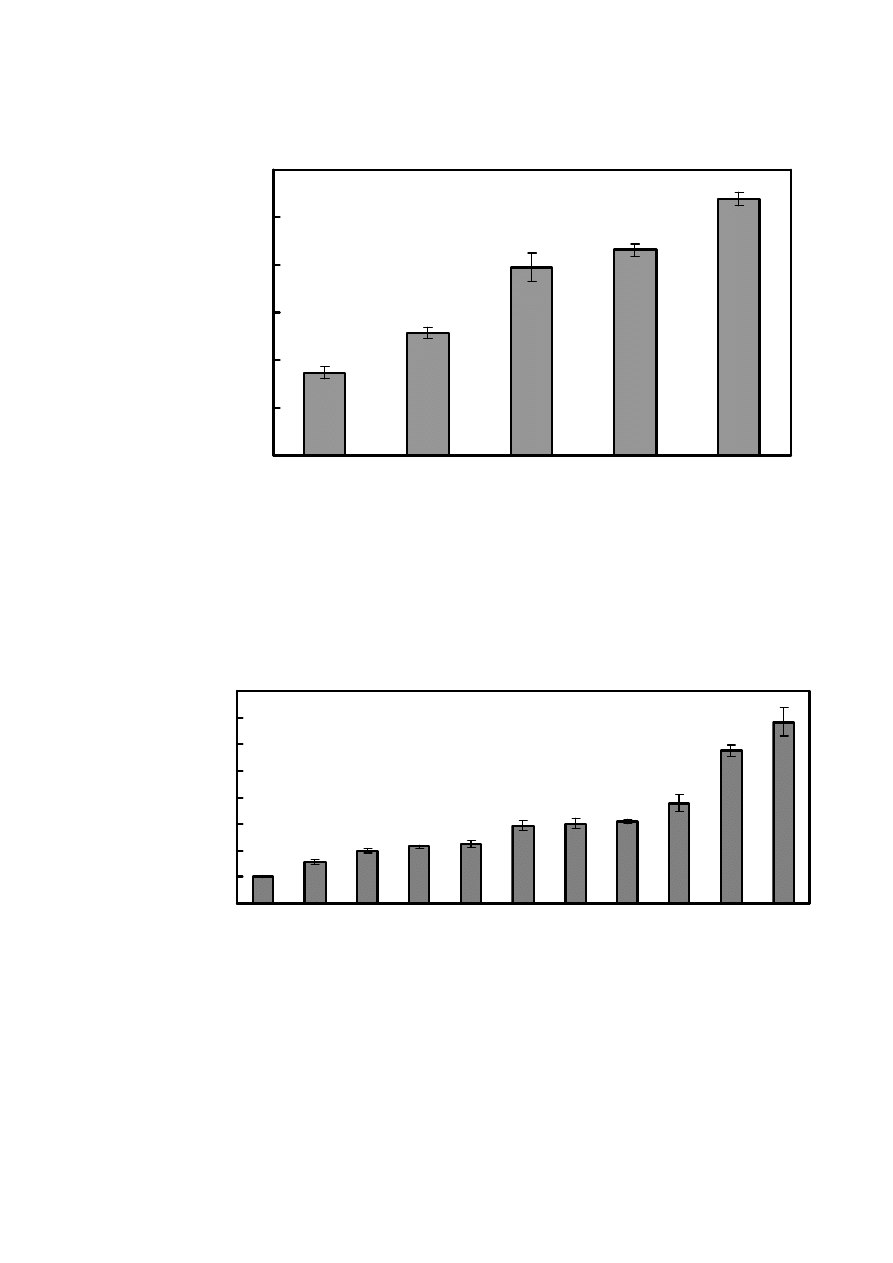
0
4
8
12
16
20
24
Gingers
beer
Ocet winny
Sok z
brzozy
Sok z
czarnego
bzu
Karob
CP
A [
μ
v*m
in
]
Rys. 14. Wartości CPA dla soków i napoi o stężeniu 500 µl/l. Warunki chromatograficzne jak na
rys. 3.
4.7. Porównanie
różnych CPA
0
10
20
30
40
50
60
70
80
Oc
et
wi
nn
y
Bl
anc
d
e
Bl
an
c
He
rb
. cz
arn
a
Ka
ro
b
Sp
urm
an
te
R
os
o
He
rb
. b
ia
ła
He
rb
. z
ie
lo
na
c
hi
ńsk
a
Et
an
ol
Ma
rti
ni
Uni
cum
Cza
rn
y
Ba
ls
am
CP
A [
μ
V*
m
in
]
Rys. 15. Porównanie wartości CPA różnych próbek. Warunki chromatograficzne jak na
rys. 3. Nie można porównywać wielkości o różnych mianach. Można porównywać tylko próbki o
tym samym stężeniu.
28

29
5. DYSKUSJA
WYNIKÓW
5.1. Wpływ stężenia próbki na zmianę powierzchni piku
Na Rys. 3 i 4 przedstawiłam zależności zmiany pola powierzchni piku HTFA od stężenia
dla dwóch wybranych zmiataczy rodników hydroksylowych (podobne wykresy uzyskałam dla
wszystkich badanych próbek). Wynika z nich, że stężenie dodawanej próbki na początku ma
istotny wpływ na zmianę powierzchni piku. W pewnym zakresie zależność ta jest liniowa,
następnie ulega zakrzywieniu i przyjmuje praktycznie stałą wartość. Oznacza to, że przy dużym
stężeniu próbki wszystkie wygenerowane rodniki z nią przereagowują. Uzyskana na krzywej
kalibracyjnej asymptota oznacza brak piku chromatograficznego HTFA na chromatogramie.
Zarówno z powyższych rysunków, jak i z Rys. 5, 6, 8, 10 i 13, wynika, że w małym zakresie
stężeń powyższe krzywe kalibracyjne są liniowe. W celu porównywania różnych próbek
pracowałam w zakresie liniowym, co jest przedstawione na wykresach.
5.2. CPA wysokoprocentowych napoi alkoholowych
Wartości całkowitego potencjału antyoksydacyjnego wysokoprocentowych napoi
alkoholowych przedstawione zostały na Rys. 7. Okazało się, że najsilniejszymi własnościami
antyoksydacyjnymi charakteryzowała się Łotewska nalewka Czarny Balsam (podać oryginalną
nazwę). Drugim z kolei był Węgierski Unicum, a następnie Bylinna, Ballantines, Malibu,
Borovicka, Krupnik, Gordon’s oraz Grand Cavalier. W celu odróżnienia udziału w CPA udziału
antyoksydantów (głównie polifenoli) od etanolu w pracy przebadałam także CPA samego
etanolu (Rys. 5). Okazało się, że jest on zmiataczem wolnych rodników (Rys. 7). Wprawdzie
napoje alkoholowe o najsilniejszych własnościach antyoksydacyjnych (Czarny Balsam, Unicum)
charakteryzowały się znacznie większymi wartościami CPA niż czysty alkohol etylowy o tym
samym stężeniu, tym nie mniej istnieje wyraźna korelacja między stężeniem etanolu, a CPA.
Wynik ten nie będzie zaskakujący, jeśli zdamy sobie sprawę z tego, że stężenie poszczególnych

30
antyoksydantów jest na poziomie od ppb do ppm, podczas gdy stężenie etanolu waha się w
granicach 25-45%. Należy w tym miejscu zaznaczyć, że nadmiar etanolu w organizmie
człowieka prowadzi do wzrostu stężenia wolnych rodników [
60
], co jest spowodowane jego
autooksydacją do aldehydu octowego. Z drugiej strony z badań tych wynika, że często
składnikiem wielu ekstraktów ziołowych jest właśnie etanol.
5.3. CPA niskoprocentowych napoi alkoholowych
Współcześnie, w świetle badań dotyczących związku między trybem życia i spożyciem
wina, a wskaźnikiem umieralności, znamienna zdaje się być teoria o nieocenionym wpływie
tego, jak się odżywiamy i jaki prowadzimy tryb życia.
Korzyści płynące z picia szklanki
czerwonego wina dziennie zostały odkryte w minionej dekadzie kiedy zaczęto się zastanawiać
nad tzw. "francuskim paradoksem" - mimo wysokocholesterolowej diety Francuzi mieli niski
wskaźnik zachorowalności na choroby układu krążenia. Badania wykazywały, że związane jest
to ze spożywaniem przez nich właśnie czerwonego wina w codziennej diecie [55].
Niezwykłe właściwości wina są spowodowane obecnością składników
przeciwutleniających, a głównie polifenoli, w tym flawonoidów, w tym antocyjanów, a także
resweratrolu. Posiadają one zdolność niszczenia wolnych rodników, które to, jak już
wspomniałam, przyspieszają proces starzenia się organizmu czy też wpływają na powstawanie
różnych chorób. Związki polifenolowe stanowią dużą grupę związków szeroko
rozpowszechnionych wśród roślin. Występują w wielu warzywach, owocach, herbacie,
czekoladzie, a także w dużych ilościach w skórce winogron. Polifenole z wina wykazują silne
działanie antyoksydacyjne. Hamują utlenianie wielonienasyconych kwasów tłuszczowych [56],
wiążą jony żelaza i miedzi, co przeszkadza powstawaniu wolnych rodników. Stężenie polifenoli
w winach zależy od jego rodzaju. W czerwonym winie znajduje się znacznie więcej tych
związków niż w winie białym. Spowodowane to jest nie tylko gatunkiem winorośli, ale także
różnymi procesami wyrobu. Czerwone wino powstaje jako produkt fermentacji całych owoców,
zaś wino białe z fermentacji soku. Za zabarwienie czerwonego wina odpowiadają antocyjany i
resweratrol. Spożywanie czerwonego wina w umiarkowanych ilościach może być skutecznym
zabiegiem wspomagającym w zapobieganiu chorobie wieńcowej serca.
Badanie całkowitego potencjału antyoksydacyjnego niskoprocentowych napoi
alkoholowych potwierdziło, że wina czerwone są najlepszymi zmiataczami rodników
hydroksylowych. Z kolei najsłabszym zmiataczem okazało się piwo Grafen Walder Strong,
mające niską zawartość alkoholu. Ponownie okazało się, że CPA jest skorelowane ze stężeniem
etanolu w próbce. Wina białe mają dużo niższą moc zmiatania rodników
•
OH w stosunku do win
czerwonych i różowych. Najwyższymi wartościami CPA charakteryzował się wermut, wino

31
zawierające w swym składzie ekstrakt z piołunu oraz inne przyprawy ziołowo-korzenne tj.
szałwię, goździki, kolendrę i gałkę muszkatołową.
5.4. CPA ziół
W ostatnich
latach obserwuje się wzrost zainteresowania naturalnymi antyoksydantami,
zwłaszcza barwnikami roślinnymi – flawonoidami. Najczęściej występują one jako żółte
barwniki rozpuszczone w soku komórkowym w kwiatach, liściach, rzadziej w owocach, korze
czy drewnie. Do grupy flawonoidów zalicza się m.in. flawony, flawanony, antocyjany,
flawonole i flawonony. Związki te, występujące w wielu herbatach i ziołach, są silnymi
antyutleniaczami [57]. Prozdrowotne właściwości herbaty są znane już od ponad czterech
tysięcy lat. Zapoczątkowane zostało przez cesarza Chin Szen Nung któremu, według legendy,
wpadł do wody listek herbaty. W Europie zdrowotne jej działanie poznano około XVI wieku.
Wśród herbat wyróżniamy białą, zieloną, czerwoną i czarną. Każdą z nich charakteryzuje
odmienny sposób przetwarzania.
Herbata biała i zielona należą do herbat niepoddanych procesowi fermentacji. Herbata
biała powstaje z młodych pąków liści, które jeszcze nie zdążyły się rozwinąć. Poddaje się je
tylko procesowi więdnięcia i suszenia, nie praży się ich ani nie zwija. Z kolei świeżo zebrane
liście herbaty zielonej pozostawia się do przeschnięcia i poddaje obróbce cieplnej co
powstrzymuje fermentację. Dzięki zastosowaniu takiej obróbki liście zachowują zielony kolor, a
także cenne właściwości lecznicze.
Herbata czerwona (pu-erh) przechodzi dodatkowy proces fermentacji i leżakowania. Jej
charakterystyczną cechą jest bardzo silny zapach i smak. Czarną herbatę otrzymuje się w wyniku
czterech procesów: więdnięcia, skręcania, fermentacji i suszenia.
CPA różnych ziół, w tym wspomnianych herbat, przedstawione zostały na Rys. 11.
Okazało się, że rodniki hydroksylowe najsilniej są zmiatane przez napar herbaty zielonej. Jej
najsilniejsze właściwości antyoksydacyjne wynikają z obecności związków z grupy
flawonoidów w niej występujących. Słabszymi zmiataczami rodników hydroksylowych okazały
się napary herbaty białej i czarnej, jak również z kawy żołędziowej, która została zaliczona do
ziół. Najsłabszymi własnościami antyoksydacyjnymi wyróżniają się napary z herbat
ekspresowych i herbaty żeńszeniowej.
Miarą CPA w moich pomiarach była różnica pola powierzchni piku HTFA bez obecności
próbki oraz przy jej dodatku. W przypadku naparów ziołowych przetestowałam możliwość
zastosowania nachylenia krzywej zależności zmiany powierzchni piku HTFA, bez i z próbką, od
stężenia próbki (Rys. 12). Okazało się, że w obu przypadkach (Rys. 11 i 12) otrzymałam
analogiczne względne wartości, co wynika zresztą z własności zależności liniowej.

32
Z danych literaturowych wiadomo, że ekstrakty ziołowe, w tym zielona herbata, aronia i
imbir były badane metodą
fluorymetryczną [59]. Wynika z nich, że napar z zielonej herbaty jest
najsilniejszym antyoksydantem w stosunku do rodników hydroksylowych, peroksylowych i
nadtlenoazotynu. Spowodowane jest to wysokim stężeniem flawonoidów w niej występujących.
Badania te potwierdziły się również przy zastosowaniu detekcji fluorescencyjnej w stosunku do
rodników hydroksylowych.
5.5. CPA soków i napoi
Kolejnymi próbkami jakie przebadałam były soki i napoje (Rys. 14). Wśród nich na
szczególną uwagę zasługuje karob, który ma największy CPA spośród badanych substancji.
Karob inaczej zwany szarańczynem strąkowym występuje w regionie śródziemnomorskim.
Rozwijające się strąki karobu (zwane chlebem Świętojańskim) wyglądem przypominają zielone,
lecz bardzo szerokie strąki fasoli, dojrzewając stają się ciemnobrązowe. Zarówno nasiona jak i
strąki są jadalne. Karob w smaku przypomina osłodzone kakao, dlatego też jest używany jako
jego substytut, głównie ze względu na bardzo niską zawartość tłuszczu, hipoalergiczność i brak
kofeiny.
Mające niższe CPA, ale równie dobrze zmiatające rodniki hydroksylowe są soki z
czarnego bzu i brzozy. W dalszej kolejności występuje ocet winny, zaś na samym końcu napój
korzenny Gingers beer.
5.6. Porównanie CPA różnych klas produktów spożywczych
Rys. 15 przedstawia zestawienie niektórych związków spośród przebadanych i ich wpływ
na CPA. Najwyższa wartość potencjału przypada dla wysokoprocentowego napoju
alkoholowego Czarny Balsam, później Unicum. Następnym mocnym zmiataczem rodników
hydroksylowych jest czerwony wermut Martini, napary z herbat i karob. Najsłabsze właściwości
antyoksydacyjne ma wino białe i ocet winny.

33
______________________________________________
6. WNIOSKI
1.
Kwas tereftalowy może być użyty do oznaczania całkowitego potencjału
antyoksydacyjnego z zastosowaniem HPLC z detekcją fluorescencyjną.
2.
Zaletą metody, w stosunku do metod opisanych w literaturze jest jej odniesienie do
rodnika hydroksylowego. Ponieważ jest to najbardziej reaktywny rodnik, dlatego wydaje
się sensowne, aby właśnie w stosunku do niego wykonywać pomiary CPA. Porównanie
wartości CPA mierzonych w stosunku do różnych rodników pozwala na zbadanie
selektywności działania poszczególnych antyoksydantów.
3.
Niektóre napoje alkoholowe mają silne właściwości antyoksydacyjne, zależne m.in. od
stężenia alkoholu etylowego.
4. Spośród zbadanych ziół najsilniejszymi własnościami antyoksydacyjnymi
charakteryzował się napar z zielonej herbaty. Prawdopodobnie spowodowane jest to tym,
że herbata czerwona i czarna tracą część antyoksydantów (flawonoidów) podczas procesu
obróbki (fermentacji).

34
______________________________________________
7. STRESZCZENIE
W pracy badano całkowity potencjał antyoksydacyjny (CPA) metodą chromatograficzną
z zastosowaniem kwasu tereftalowego jako detektora i detekcji fluorescencyjnej. Rodniki
hydroksylowe generowane były w reakcji Fentona w obecności żelaza na plus drugim stopniu
utlenienia, buforu fosforanowego i nadtlenku wodoru. Pomiary CPA wykonano na próbkach
napoi alkoholowych i bezalkoholowych, soków, naparów herbat i ziół w odpowiednich
stężeniach. Zarówno detektor jak i badana próbka zmiatały wygenerowane rodniki
hydroksylowe. W przypadku kiedy próbka odznaczała się większą reaktywnością z rodnikami,
powodowało to zmniejszenie wysokości piku chromatograficznego produktu reakcji detektora z
rodnikiem. Całkowity potencjał antyoksydacyjny wyznaczany był z różnicy pola powierzchni
piku pochodzącego od kwasu hydroksytereftalowego (HTFA) bez próbki i pola powierzchni
piku z zastosowaną próbką.

35
8.
AKRONIMY I SKRÓTY
CPA
Całkowity Potencjał Antyoksydacyjny
DAD
matryca fotodiodowa
DNA
kwas dezoksyrybonukleinowy
FRAP
Ferric Reducing Ability of Plasma
HPLC
wysokosprawna chromatografia cieczowa (High Performance Liquid
Chromatography)
HTFA
kwas hydroksytereftalowy (hydroxytereftalic acid)
ORAC
Oxygen Radical Absorbance Capacity
PBS
bufor fosforanowy (phosphate buffered saline)
pHBA
kwas p-hydroksybenzoesowy
ROS
reaktywne formy tlenu (Reactive Oxygen Species)
SD
odchylenie standardowe
SOD
dysmutaza ponadtlenkowa (Super Oxide Dysmutase)
TAC
Total Antioxidant Capacity
TAR
Total Antioxidant Reactivity
TEAC
Trolox-Equivalent Antioxidant Capacity
TFA
kwas tereftalowy (tereftalic acid)
TRAP
Total Peroxyl Radical Trapping Antioxidant Parameter
TRAP
Total Redox Antioxidant Potential
UV
promieniowanie ultrafioletowe
Wolne rodniki i reaktywne formy tlenu
O
2
·-
anionorodnik ponadtlenkowy
HO
·
rodnik hydroksylowy
HO
2
·
rodnik nadhydroksylowy
H
2
O
2
nadtlenek wodoru (woda utleniona)
NO
tlenek azotu

36
9. PIŚMIENNICTWO
1.
Richards D.A., J.Chromatogr., 175(1979)293.
2.
Głód B.K., Czapski G.A., Haddad P.R., TrAC, Trends Anal. Chem., 19(2000)492.
4.
Slater T.F., J. Biochem. 222(1984)1.
5.
Babior B.M., J. Clin. Invest., 73(1984)599.
6.
Boveris A., Oshino N., Chance B.,
Biochem. J., 128(1972)617.
7.
Bielski B.H.J., Photochem. Photobiol., 28(1978)645.
8.
Purrington S.T., Kenion G.B., J. Chem. Soc., Chem. Commun., 120(1982)732.
9.
Fridovich I., Arch. Biochem. Biophys., 247(1986)1.
10.
Bartosz G., Druga Twarz Tlenu, PWN, Warszawa 2003.
11.
Głód B.K., Strosznajder J., Wolne rodniki w starzeniu się mózgu i innych procesach
biologicznych, w Mózg a starzenie (Mossakowski M.J., Strosznajder J., red.), Oświata
UN-O, Warszawa 2001.
12.
Sohal R.S., Mitochondria and Free Radicals in Neurodegenerative Diseases, Beal M.F.
Howell N., Bodis-Wollner I., red., Willey-Liss Inc., 1997.
13.
Rice-Evans C.A., Miller N.J., Paganga G., Free Rad. Biol. Med. 7(1996)933.
14.
Osborne P.G., Yamamoto K., J. Chromatogr. B., 707(1998)3.
15.
Halliwell B., Kaur H., Ingelman-Sundeberg M., Free Radical Biol. Med., 10(1991)439.
16.
Głód B.K., Neurochem. Res.,22(1997)1237.
17.
Głód B.K., Czapski G.A.,Haddad P.R., TRAC, Trends Anal. Chem., 19(2000)492.
18.
Glód B.K., Grieb P., Chem. Anal. (Warsaw), 47(2002)399.
19.
Rehman A., Whiteman M., Halliwell B., British J. Pharmacol., 122(1997)1702.
20.
Ellis A., Adatia I., Yazdanpanah M., Makela S.K., Clin. Biochem., 31(1998)195.
21.
Lin T-K. and Lai C-C., J. Chromatogr., 227(1982)369.
22.
Głód B.K., Hilgier W., Strosznajder J., Albrecht J., Chem. Anal.(Warsaw), 45(2000)27.
23.
Abuja P.M., Albertini R., Clin. Chim. Acta, 306(2001)1.
24.
Ghiselli A., Serafini M., Maiani G., Azzini E., Ferro-Luzzi A., Free Rad. Biol. Med.,
18(1995)29.
25.
Carlberg M., J. Neurosci. Meth., 52(1994)165.

37
26.
Kostner K., Bayai S., Jansen M., Khoschsorur G., Horl W.H., Maurer G., Winklhofer-
Roob B., Derfler K., Clin. Chim. Acta, 288(1999)21.
27.
Waterfall A.H., Singh G., Fry J.R., Marsden C. A., Neurosci. Lett., 200(1995)69.
28.
Acworth I.N., Bailey B., The Handbook of Oxidative Metabolism, ESA Inc. 1995.
29.
Rice-Evans C.A., Free Rad. Res., 33(2000)59.
30.
Valkonen M., Kuusi T., J. Lipid Res., 38(1997)823.
31.
Miller N.J., Rice-Evans C., Davies M.J., Gopinathan V., Milner A., Clin. Scie.,
84(1993)407.
32.
Lissi E., Salim-Hanna M., Pascual C., del Castillo M.D., Free Rad. Biol. Med.,
18(1995)153.
33.
Ghiselli A., Serafini M., Natella F., Saccini C., Free Rad. Biol. Med., 29(2000)1106.
34.
Tubaro F., Ghiselli A., Rapuzzi P., Maiorino M., Ursini F., Free Rad. Biol. Med.,
24(1998)1228.
35.
Krasowska A., Rosiak D., Szkapiak K., Łukasiewicz M., Curr. Topics Biophys.,
24(2000)89.
36.
Wang H., Joseph J.A., Free Rad.Biol. Med., 27(1999)612.
37.
Genser D., Kang M-H., Vogelsang H., Elmadta I., Europ. J. Clin. Nutrit., 53(1999)676.
38.
Tsai E.C., Hirsh I.B., Brunzel J.D., Chait A., Diabetes, 43(1994)1010.
39.
Głód B.K., Kowalski C., Pol. J. Food Nutrit. Sci., (2004)2328.
40.
Kowalski C., Głód B.K., Wolne rodniki i antyoksydanty: Ich rola w funkcjonowaniu
organizmu, metody oznaczania oraz występowanie w ziołach: [w] Immunomodulacja:
nowe możliwości w ochronie zdrowia, Siwicki K., Skopińska-Różewska E., Świderski F.,
red., Edycja, Warszawa 2004, str. 63-74.
41.
Aspen A., Lissi E.A., J. Protein Chem., 20(2001)479.
42.
Tarpey M.M., Fridovich I., Circ. Res., 89(2001)224.
43.
Chevion S., Berry E. M., Kitrossky N., Kohen R., Free Rad. Biol. Med., 22(1997)411.
44.
Kohen R., Vellaichamy E., Hrbac J., Gati I., Tirosh O., Free Rad. Biol. Med.,
28(2000)547.
45.
Bald E., w The XXVI
th
Sci. Symp. “Chromatogr. Med. Invest. Org. Comp.”, Katowice-
Szczyrk 5-6.06.2002.
46.
O’Gara C., Maddipati K., Marnett L., Chem. Res. Toxicol., 2(1989)295.
47.
Asensi M., Sastre J., Pallardo F.V., Lloret A., Lehnor M., Asuction J.G., Met. Enzymol.,
295(1999)267.
48.
Miltor K.P., Dzialosynski T., Sanford S.E., Trevithicle J.R., Curr. Eye Res.,
16(1997)564.
49.
Diplock A.T., Free Rad. Res., 33(2000)521.

38
50.
Floyd R.A., Watson J.J., Wong P.K., J. Biochem. Biophys. Meth. 10(1984)221.
51.
Tabner B.J., Turnbull S., El-Agnaf O.M.A., Allsop D., Free Rad. Biol. Med.,
32(2002)1076.
52.
Niki E., Saito M., Yoshikawa Y., Yamamoto Y., Kamiya Y., Bull. Chem. Soc. Jpn.,
59(1986)471.
53.
Ste-Marie El., Boismenu D., Vachon L., Montogomary J., Anal. Biochem. , 241(1996)67.
54.
Barreto J.C., Smith G.S., Strobel N.H.P., McQuillin P.A., Miller T.A., Pharmac. Letters,
56(1995)90.
55.
Linxiang L., Abe Y., Nagasawa Y., Kudo R., Usui N., Imai K., Mashino T., Mochizuki
M., Miyata N., Biomed. Chromatogr., 2004.
56.
Sun AY., Symonyi A., Sun G.Y., Free Rad. Biol. Med., 32(2002)314.
57.
Helpern M.J., Dahlgren A.L., Laakso I., J. Int. Med. Res., 26(1998)171.
58.
Tsuda T., Horio F., Osawa T., BioFactors, 13(2000)133.
59.
Xu H.X., Lee S.F., Phytoter. Res., 15(2001)39.
60.
Głód B.K., Konior A., Tłuszcze jadalne, t.41, nr 3-4, (2006)282.
61.
Novitskiy G., Traore K., Wang L., Trush M.A., Mezey E., Alcohol Clin. Exp. Res.,
30(2006)1429.
Document Outline
- SPIS TREŚCI
- 1. CZĘŚĆ LITERATUROWA
- 1.1. Podstawowe informacje o wolnych rodnikach
- 1.2. Tlen i produkty jego redukcji
- 1.3. Wpływ wolnych rodników na komórki zwierzęce
- 1.4. Antyoksydanty, zmiatacze wolnych rodników
- 1.5. Metody oznaczania wolnych rodników i stresu oksydacyjnego. Całkowity potencjał antyoksydacyjny
- 1.6. Właściwości naturalnych antyoksydantów
- 2. CEL PRACY
- 3. CZĘŚĆ EKSPERYMENTALNA
- 4. WYNIKI
- 5. DYSKUSJA WYNIKÓW
- 6. WNIOSKI
- 7. STRESZCZENIE
- 8. AKRONIMY I SKRÓTY
- 9. PIŚMIENNICTWO
Wyszukiwarka
Podobne podstrony:
Całkowity potencjał antyoksydacyjny wyznaczony metodą chromatograficzną niektórych ziół i napoi alko
Na czym polega metoda chromatografii bibułowej, kosmetologia, chemia kosmetyczna
Oznaczanie składu metodami chromatografii gazowej 1
Identyfikacja cukrów metodą chromatografii bibułowej
4) Odsalanie roztworu białka metodą chromatografii sita molekularnego
OKRE LENIE POTENCJA U ANTYOKSYDACYJNEGO
Analiza gazów energetycznych metodą chromatografii gazowej
Ćw. 5 Rozdział metodą chromatografii bibułowej - sprawozdanie, Chemia ogólna i nieorganiczna
Oznaczanie składu metodami chromatografii gazowej, AKADEMIA GÓRNICZO - HUTNICZA
Odsalanie roztworu białka metoda chromatografii sita molekularnego
29. Wyznaczanie współczynnika podziału Nernsta metodą potencjometryczną, chemia fizyczna
29 Wyznaczanie współczynnika podziału Nernsta metodą potenc
więcej podobnych podstron