
ZWIĄZKI KOMPLEKSOWE
Znaczna większość związków chemicznych jest związkami kompleksowymi.
Występujące w nich wiązanie koordynacyjne, które posiada następujące własności
1. tworząca je para elektronów pochodzi od jednego atomu – donoru
2. akceptor uzupełnia ostatnią powłokę elektronową do konfiguracji najbliższego gazu
szlachetnego
3. donor uzyskuje ładunek dodatni, akceptor uzyskuje ładunek ujemny
4. donorami elektronów są atomy lub jony z przynajmniej jedną wolną parą elektronów,
np, tlen siarka, jon chlorkowy
5. akceptorami zazwyczaj są jony wodoru oraz atomy mające lukę oktetową.
Wiązanie to łączy elementy strefy wewnętrznej związku kompleksowego – jon centralny
(centrum koordynacji) i otaczające go ligandy, którymi mogą być:
•
związki proste, obdarzone jedną wolną para elektronów, np. NH
3
, H
2
O, CO, CN
-
, Cl
-
•
związki mogące dostarczać dwie lub więcej par elektronów niezbędnych do
utworzenia wiązania koordynacyjnego – ligandy chelatowe (kleszczowe)
Kompleksy chelatowe charakteryzują się znacznie większą trwałością niż kompleksy
zawierające ligandy proste. Jednym z nich jest należący do tzw. kompleksonów sól sodowa
kwasu etylenodiaminotetraoctowego (EDTA, komplekson II). Podobnie, jak inne związki z
tej grypy charakteryzuje się:
•
dużą trwałością w stanie stałym i roztworach wodnych
•
łatwą rozpuszczalnością w wodzie
•
tworzeniem stosunkowo trwałych kompleksów chelatowych z prawie wszystkimi
metalami wielowartościowym
•
powstałe kompleksy są bezbarwne jeśli sam metal nie ma właściwości
chromoforowych (Fe, Cr, Cu, Ni)
•
z jonami metali wielowartościowych, niezależnie od ich wartościowości, reaguje w
stosunku 1:1
Me
n+
+ H
2
Y
2
- + 2H
2
O
⇆ MY
(n-4)
+ 2H
3
O
+
•
dla kationu czterowartościowego powstały kompleks jest chelatem wewnętrznym z
zerowym ładunkiem elektrycznym
•
równowaga reakcji kompleksowania zależy od pH roztworu, pozwala na łatwe
sterowanie przebiegiem reakcji
•
zdolność do tworzenia kompleksów chelatowych z metalami zależy od pH roztworu
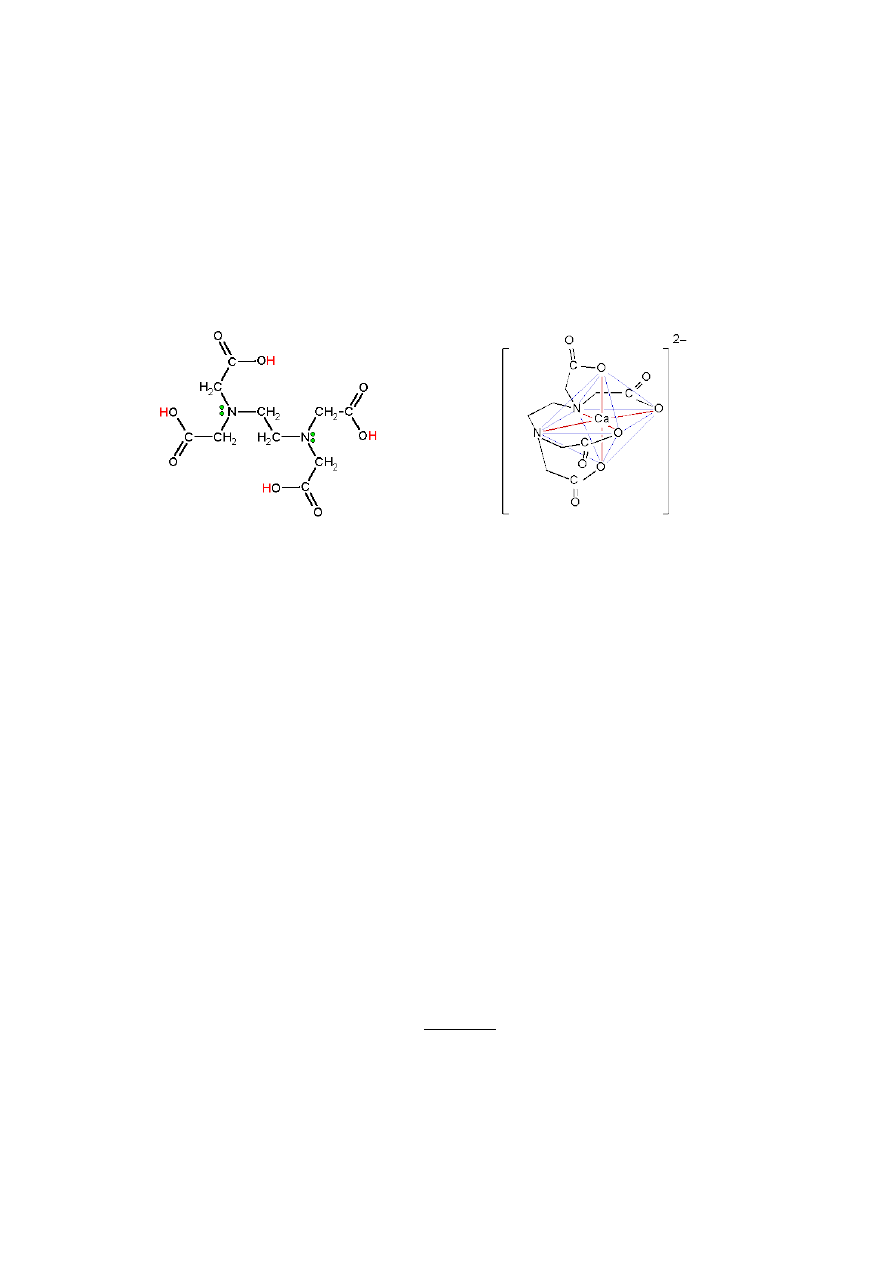
EDTA Kleszczowy kompleks utworzony przez
EDTA i jony wapniowe.
Związki kompleksowe podlegają, podobnie jak wszystkie inne związki prawu działania mas.
Ogólna reakcja tworzenia związków kompleksowych ma postać:
M + n L
⇄ ML
n
M – atom centralny (metal)
L – ligand
ML
n
– kompleks
stała równowagi reakcji tworzenia kompleksu, nazywana stałą trwałości
β =
n
n
]
L
][
M
[
]
ML
[
reakcja rozpadu kompleksu:
ML
n
⇄ M + n L

zdefiniowana jest przez stałą nietrwałości:
K =
β
1
=
]
ML
[
]
L
][
M
[
n
n
Trwałość kompleksu wzrasta wraz z obniżaniem się wartości stałej nietrwałości. W praktyce.
dla oznaczenia trwałości związku kompleksowego stosuje się parametr pK
pK =
−
log(K) =
−
log(
β
1
)
Im większa jest wartość pK, tym trwalszy jest kompleks.
CHARAKTERYSTYCZNE REAKCJE ZWIĄZKÓW KOMPLEKSOWYCH
Tworzenie kompleksu polega na zastępowaniu jednego ligandu przez drugi ligand, o
większej zdolności kompleksotwórczej w stosunku do danego atomu centralnego.
Metale takie jak miedź
czy wapń w roztworze wodnym znajdują się w postaci
akwakompleksów czyli hydratów: Cu(H
2
O)
4
2+
, Ca(H
2
O)
6
2+
a nie w postaci wolnych jonów.
Cząsteczki wody w sferze koordynacyjnej metalu są zastępowane odpowiednimi ligandami.
Przykład – tworzenie się kompleksu aminamiedzi(II) przez stopniową eliminację
cząsteczek wody z akwakompleksu
1. [Cu(H
2
O)
4
]
2+
+ NH
3
[Cu(H
2
O)
3
NH
3
]
2+
+ H
2
O
2. [Cu(H
2
O)
3
NH
3
]
2+
+ NH
3
[Cu(H
2
O)
2
(NH
3
)
2
]
2+
+ H
2
O
3. [Cu(H
2
O)
2
(NH
3
)
2
]
2+
+ NH
3
[Cu(H
2
O)(NH
3
)
3
]
2+
+ H
2
4. [Cu(H
2
O)(NH
3
)
3
]
2+
+ NH
3
[Cu(NH
3
)
4
]
2+
+ H
2
O
Do najważniejszych reakcji jakim ulegają związki kompleksowe należą:
a) reakcje podstawienia, w których nie zmienia się liczba koordynacyjna metalu.
[Co(NH
3
)
5
CO
3
]
+
+ 2HF [Co(NH
3
)
5
F]
2+
+ F
-
+ CO
2
+ H
2
O
b) reakcje związane ze zmianą stopnia utlenienia, np. substytucji utleniającej
2[Co(H
2
O)
6
]Cl
2
+ 2NH
4
Cl + 10NH
3
+ H
2
O
2
2[Co(NH
3
)
6
]Cl
3
+ 14 H
2
O
c) reakcje przyłączania, w których wzrasta liczba koordynacyjna metalu.
Zn(CN)
2
+ 2CN
-
[Zn(CN)
4
]
2-

Przy tworzeniu nazwy związku kompleksowego należy kierować się regułami
ustalonymi przez IUPAC (Międzynarodowa Unia Chemii Czystej i Stosowanej):
- nazwę kompleksu tworzy się dodając do nazwy jonu centralnego przedrostki określające
ilość i rodzaj ligandu
-w nazwie jonu kompleksowego wymienia się najpierw ligandy, a na końcu atom centralny
- stopień utlenienia atomu centralnego zaznacza się cyfrą rzymską w nawiasie na końcu
nazwy, np. siarczan tetraaminamiedzi(II) [Cu(NH
3
)
4
]SO
4
- kompleksy o ładunku ujemnym (aniony kompleksowe) mają do nazwy anionu centralnego
dodaną końcówkę –an np. tetrachloromiedzian(II) potasu K
2
[CuCl
4
]
- w kompleksach kationowych i zawierających obojętne cząstki podajemy nie zmienioną
nazwę pierwiastka np. chlorek tetraakwadichlorochromu(III) [Cr(H
2
O)
4
Cl
2
]Cl
- do najczęściej stosowanych ligandów należą:
- amina -NH
3
,
- hydrokso OH
-
- akwa H
2
O
- karbonyl CO
- bromo Br
-
- okso O
2-
- chloro Cl
-
- tio S
2-
- cyjaniano CNO
-
- tiocyjaniano CNS
-
- cyjano CN
-
- tiosiarczano S
2
O
3
2-
- fluoro F
-
- liczbę ligandów przedstawia się za pomocą przedrostków:
- dla ligandów prostych: mono, di, tri, tetra, penta, heksa
np. chlorek tetraaminakadmu(II) [Cd(NH
3
)
4
]Cl
2
- dla ligandów złożonych: bis, tris, tetrakis, pentakis
np. tris(tetraoksosiarczan) bis(heksaaminakobaltu) [Co(NH
3
)
6
]
2
(SO
4
)
3
- nazwy ligandów anionowych mają końcówkę -o,
np. cyjano - heksacyjanożelazian(III) potasu K
3
[Fe(CN)
6
]
- rodniki węglowodorowe mają ogólnie przyjęte skróty Me- metyl, Et – etyl, Ph – fenyl,
en- etylenodiamina np. tetrafenyloboran(III) potasu K[B(Ph)
4
]
- przedrostki w nawiasie są stosowane, jeśli nazwa ligandu zawiera już jeden z przedrostków
np. bromek tri(etylenodiamino)platyny(IV) [Pt(en)
3
]Br
4
- kolejność ligandów jest zgodna z kolejnością alfabetyczną bez uwzględnienia przedrostków
określających liczbę ligandów każdego typu występujących w sferze koordynacyjnej.
- w nawiasie, na końcu nazwy zamiast stopnia utlenienia (podawanego cyframi rzymskimi)
można umieścić znak ładunku całego jonu oraz ładunek (podawany cyframi arabskimi)
np.: K
3
[Co(CN)
6
]
heksacyjanokobaltan(III)potasu,
heksacyjanokobaltan(3+) potasu,
heksacyjanokobaltan tripotasu,
Sfera
zwenetrzna
,
wewnetrzna
,
K
3
[
Fe
(
CN
)
6
]
potasu
cyjano
heksa
jon centralny
ligandy
liczba ligandów
heksacyjanozelazian(III) potasu
.
zelazian(III)
.
Przykładowe wzory i nazwy związków i jonów kompleksowych:
[Co(H
2
O)
6
](NO
3
)
2
azotan(V) heksaakwakobaltu(II)
[Co(CO
3
)(NH
3
)
4
]NO
3
azotan(V) tetraaminawęglanokobaltu(III)
[CoCl(NH
3
)
4
(H
2
O)]
2+
kation akwatetraaminachlorokobaltu(III)
[CoCl(NH
3
)
5
]Cl
2
chlorek pentaaminachlorokobaltu(III)
K
3
[Fe(SCN)
6
]
heksatiocyjanianożelazian(III)potasu
[Fe(edta)]
–
anion etylenodiaminatetraoctanożelazianowy(III)
[Cr(OH)(H
2
O)
5
]
2+
kation pentaakwahydroksochromu(III)
[CrCl
2
(H
2
O)
4
]Cl
chlorek tetraakwadichlorochromu(III)
[Cu(NH
3
)
4
]SO
4
siarczan(VI) tetraaminamiedzi(II)
[Cd(en)
2
]Cl
2
chlorek bis1,2-diaminoetanokadmu(II)
Na
3
[Cu(CN)
4
]
tetracyjanomiedzian(I)sodu,
Na
3
[Ag(S
2
O
3
)
2
]
tiosiarczanosrebrzan(I)sodu,
[Cu(H
2
O)
6
]SO
3
siarczan(IV)heksaakwamiedzi(II),
K
4
[NiF
6
]
heksafluoroniklan(II)sodu,
[Cu(NH
3
)
4
]SO
4
siarczan(VI) tetraaminamiedzi(II)

Doświadczenie 1
Otrzymywanie soli o kompleksowym kationie
1. Do 2 probówek wprowadzić około 2cm
3
0,25 mol/dm
3
roztworu CoCl
2
i NiCl
2
.
2. Do każdego z roztworów dodać około 1cm
3
0,1 mol/dm
3
roztworu NaOH do
wytrącenia się osadu soli. Wytrąci się osad chlorku wodorotlenku kobaltu(II) i chlorku
wodorotlenku niklu(II). Obserwować osad i zmianę barwy roztworów.
3. Następnie do każdej z probówek dodać powoli ostrożnie około 2 cm
3
stężonego
amoniaku. W przypadku soli kobaltu następuje rozpuszczenie osadu i powstaje
roztwór wodorotlenku heksaaminakobaltu(II) o różowej barwie, związek nietrwały
przechodzący w wodorotlenek heksaaminakobaltu(III) o barwie brunatnej. Sole niklu
tworzą klarowny roztwór wodorotlenku heksaaminaniklu(II) barwy niebieskiej.
Doświadczenie 2
Otrzymywanie soli o kompleksowym anionie
1. Do probówki wlać 1cm
3
roztworu CoCl
2
, 1cm
3
roztworu KSCN
i 2cm
3
acetonu. W wyniku reakcji powstaje związek kompleksowy - tetrakis
(tiocyjaniano) kobaltan(II) potasu, barwy ciemnoniebieskiej, nietrwały w roztworach
wodnych.
2. Do probówki zawierającej 1cm
3
roztworu FeCl
3
dodawać kroplami roztwór KSCN do
zmiany zabarwienia, dodać niewielki nadmiar odczynnika obserwując intensywność
barwy. Zmiana w intensywności związana jest z powstawaniem nowych jonów
zespolonych. W reakcji powstaje heksakis (tiocyjaniano) żelazian(III) potasu.
3. Do probówki zawierającej 1cm
3
roztworu FeCl
3
dodawać kroplami
heksacyjanożelazian(II) potasu K
4
[Fe(CN)
6
]. Wytrąca się ciemnoniebieski,
bezpostaciowy osad błękitu pruskiego Fe
4
[Fe(CN)
6
]
3
.

Doświadczenie 3
Zastąpienie ligandów Cl
-
przez H
2
O
1. Suchą zlewkę o pojemności 50cm
3
wytarować na wadze analitycznej i odważyć 0,5 g
soli CoCl
2
..
2. Do zlewki zawierającej naważkę soli wlać 10 cm
3
alkoholu etylowego doprowadzając
do całkowitego rozpuszczenia soli.
3. Do 2 probówek pobrać po 3 cm
3
przygotowanego powyżej alkoholowego roztworu
CoCl
2
. Do każdej probówki dozować kroplami za pomocą pipety Pasteura wodę
destylowaną (5-10 kropli). Wstrząsając delikatnie probówką spowodować
wymieszanie roztworu. Obserwować barwę roztworu.
4. Do jednej z probówek dodać ostrożnie kroplami stężony HCl aż do zmiany barwy
roztworu (10-15 kropli).
5. Drugą probówkę z roztworem ogrzać nad płomieniem palnika obserwując zmianę
barwy.
Doświadczenie 4
Reakcje kompleksowe jonów Cu
2+
z różnymi ligandami
A. Reakcja CuSO
4
z amoniakiem
1. Do zlewki o pojemności 50 cm
3
wlać 5 cm
3
stężonego amoniaku i 5 cm
3
wody
destylowanej. Roztwór wymieszać bagietką. Następnie czystą i suchą łyżeczką
pobrać ze słoiczka bezwodny siarczan(VI) miedzi(II) i powoli wsypać
kryształki do przygotowanego roztworu amoniaku. Nie mieszać! obserwować
zachodzącą reakcję.
2. Do drugiej zlewki o pojemności 50 cm
3
wlać około 10 cm
3
0,25 mol/dm
3
roztworu CuSO
4
. Następnie dozować za pomocą pipety Pasteura stężony
amoniak w takiej ilości, aby początkowo wytrącony hydroksosiarczan
miedzi(II) rozpuścił się w nadmiarze odczynnika tworząc klarowny roztwór
barwy szafirowej.
3. Z przygotowanego powyżej roztworu pobrać po 3 cm
3
do dwóch probówek.
Do pierwszej probówki dozować kroplami 2 mol/dm
3
roztwór H
2
SO
4
do
zmiany zabarwienia. Do drugiej probówki dodać 3-4 krople roztworu Na
2
S.
A. Reakcja jonów Cu
2+
z jonami [Fe(CN)
6
]
4-
1. Do probówki wlać 3 cm
3
0,25 mol/dm
3
roztworu CuSO
4
2. Następnie kroplami dozować roztwór heksacyjanożelazianu (II) potasu do
wytrącenia się trudnorozpuszczalnego czerwono-brunatnego osadu
heksacyjanożelazianu(II) miedzi.
C. Reakcja jonów Cu
2+
z jonami Cl
-
1. Do probówki wlać 3 cm
3
0,25 mol/dm
3
roztworu CuSO
4
.
2. Następnie do roztworu dodać szczyptę NaCl. Probówkę wstrząsać powodując
rozpuszczenie się stałej soli.
3. Tak przygotowany roztwór ogrzać nad płomieniem palnika do zmiany barwy.
Po lekkim wystudzeniu probówkę wstawić do łaźni z lodem obserwując
zmianę barwy.
Doświadczenie 5
Przykłady kompleksów chelatowych
Sole wewnętrznie zespolone są przykładem kompleksów chelatowych. Ligandami w
tym przypadku są związki organiczne. Kompleksy chelatowe charakteryzują się znacznie
większą trwałością niż kompleksy z ligandami prostymi.
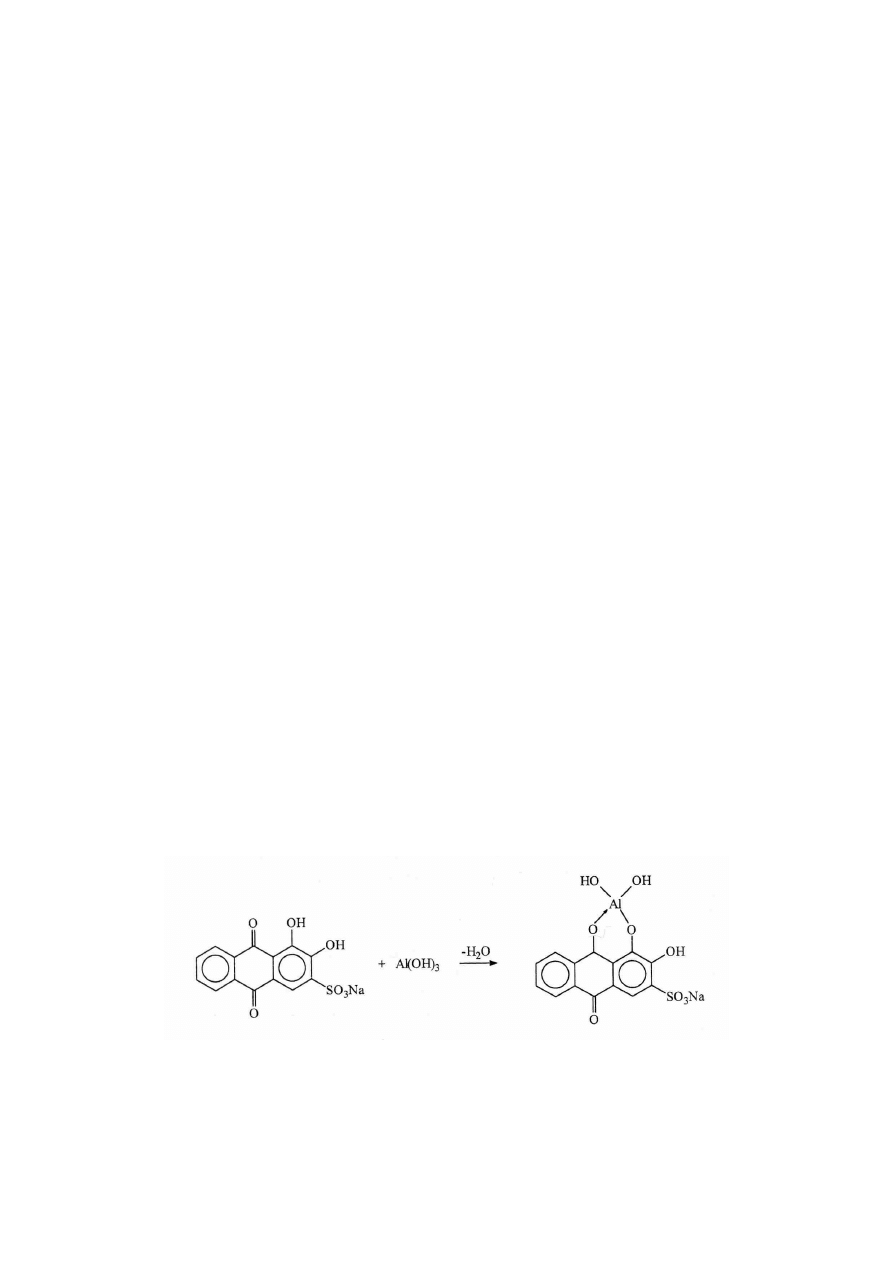
A. Alizarynosulfonian sodu (alizaryna S) tworzy związek kompleksowy z jonami
glinu
w środowisku amoniakalnym.
1. Do probówki wlać 2 cm
3
roztworu AlCl
3
.
2. Następnie dodać kroplami roztwór amoniaku do wytrącenia osadu Al(OH)
3
i
kilka kropli roztworu alizaryny S.
AlCl
3
+ 3NH
4
OH = Al(OH)
3
+ 3NH
4
Cl
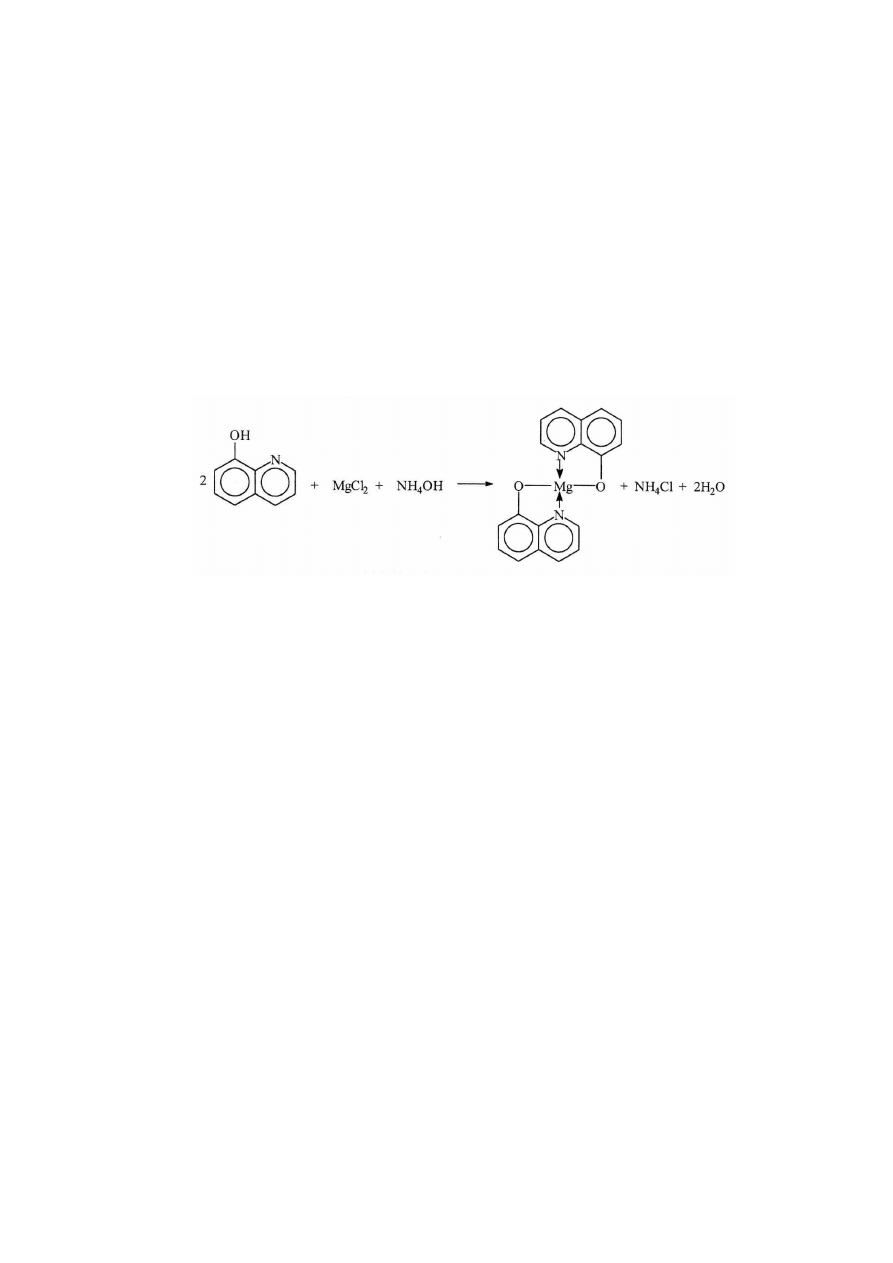
B. Ortohydroksychinolina tworzy związek kompleksowy z jonami magnezu w
środowisku amoniakalnym (pH 9,5 -12,5).
1. Do probówki zawierającej 1cm
3
roztworu MgCl
2
dodawać kroplami roztwór
NH
4
OH do momentu powstania osadu Mg(OH)
2
.
2. Następnie dodać kilka kropli roztworu ortohydroksychinoliny, aż wypadnie
żółty osad soli wewnętrznie zespolonej.
Opracowanie wyników:
1. W każdym przeprowadzonym doświadczeniu należy obserwować barwy roztworów
przed i po reakcji. Barwy zaznaczyć przy odpowiednim związku w zapisie równania
reakcji.
2. Do każdego doświadczenia należy napisać równania reakcji otrzymywania związków
kompleksowych.
3. Każdy związek kompleksowy musi być opisany nazwą systematyczną.
4. Wyjaśnić pojęcia: liczba koordynacyjna, ligand, stał trwałości i nietrwałości jonu
kompleksowego, ligand chelatowy, sole wewnętrznie zespolone.
5. Podaj wzory sumaryczne, nazwy systematyczne i zastosowanie w jakościowej analizie
chemicznej następujących związków: - odczynnik Nesslera
- błękit pruski
- błękit Turnbulla
- odczynnik Schweitzera
Wyszukiwarka
Podobne podstrony:
zwiazki kompleksowe 3 id 593625 Nieznany
analiza zwiazkow organiczna id Nieznany (2)
BCh Budowa zwiazkow id 81937 Nieznany (2)
prawo pracy zwiazki zawodow id Nieznany
Kompletna sciaga id 243140 Nieznany
11 Zwiazki kompleksowe Nieznany (2)
Budowa atomu i zwiazki kompleks Nieznany (2)
analiza zwiazkow organiczna id Nieznany (2)
zwiazki kompleksowe 2
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
więcej podobnych podstron