
Związki kompleksowe
Palak Ewa
Studentka I roku
chemii
Czym się charakteryzują
związki kompleksowe?
Istota związków kompleksowych
Związek nieorganiczny, którego cząsteczka zawiera kilka atomów otaczających
jeden lub więcej atomów metalu, nosi nazwę związku kompleksowego lub
związku koordynacyjnego.
[Cd(NH
3
)
4
]
2+
, [Fe(CN)
6
]
4-
Idea związków kompleksowych rozwinęła sie w wyniku spostrzeżenia, że związek
metalu przejściowego jak CrCl
3
może przyłączyc inne związki, jak np. amoniak,
tworząc bardziej złożone pochodne, które nazwano związkami
koordynacyjnymi.
A zatem np. mozliwe jest powstawanie CrCl
3
*3NH
3
, CrCl
3
*4NH
3
, CrCl
3
*5NH
3
i
CrCl
3
*6NH
3
. Niewiela wiadomo, jaka jest droga powstawania tych kompleksów.
Przedstawienie za pomocą kropki (*) oznacza po prostu, że w pewien nie
określony sposób 3, 4, 5 lub 6 moli NH
3
może przyłączyć sie do 1 mola CrCl
3
.
Charakterystyki ciąg
dalszy...
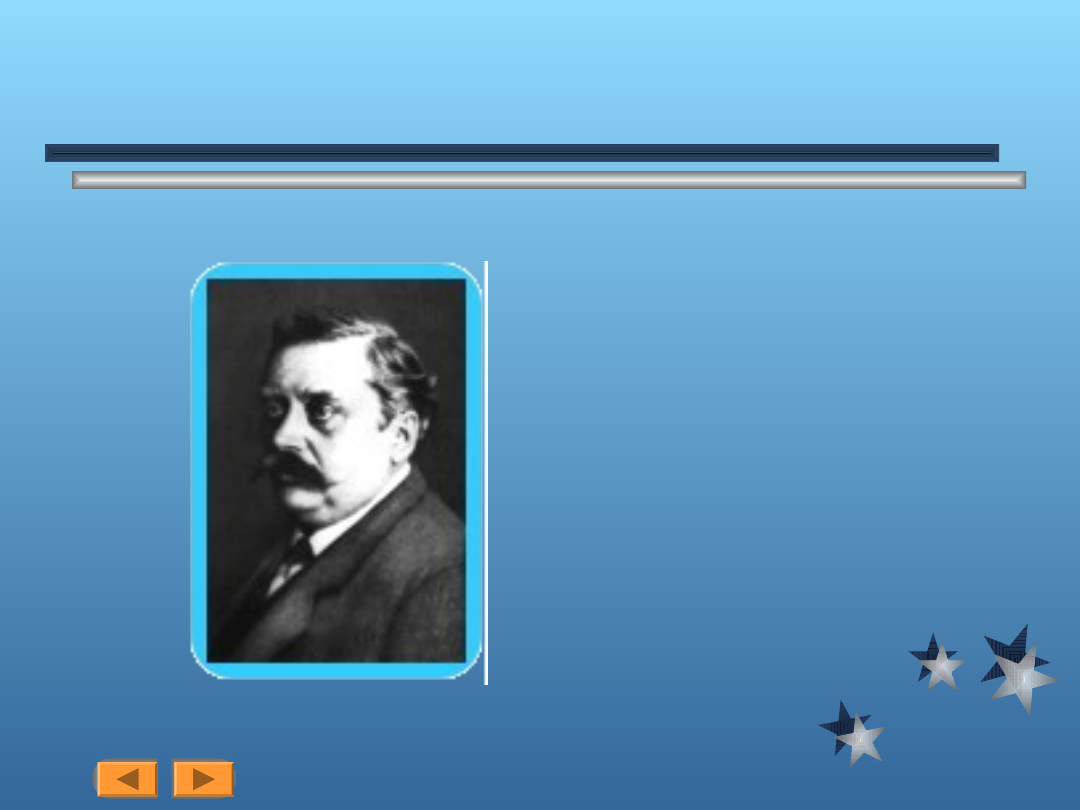
Z początkiem lat 1900 szwajcarski
chemik Alfred Werner prowadził
obszerne badania nad tymi związkami i
doszedł do wniosku, że zawierają one
centralny atom metalu (Cr) otoczony
silnie związaną pierwszą warstwą
atomów i cząsteczek (tzw. pierwszą
warstwą koordynacyjną) i drugą warstwą
(drugą warstwą koordynacyjną), która
jest związana swobodnie. W wyniku tych
pionerskich dociekań Werner został
nazwany ojcem chemii koordynacyjnej.
Zgodnie ze współczesną teorią w
związku kompleksowym wyróżnia się
atom centralny i cząsteczki
koordynowane zwane ligandami.
Atomy centralne to najczęściej kationy
pierwiastków przejściowych, np. Ag
+
,
Cu
2+
, Al
3+
, Zn
2+
itp..
Typy ligandów:
Ligandami są drobiny o charakterze donorowym, tj. aniony proste i złożone oraz
cząsteczki elektrycznie obojętne, zawierające co najmniej jeden atom mający
wolne pary elektronowe.
Przykładem ligandów są
aniony proste i złożone OH
-
, F
-
, Cl
-
, CN
-
cząsteczki zawierające wolne pary elektronowe: NH
3
, H
2
O, aminy, kwasy
organiczne, aminokwasy.
Ligandy oddające jedną pare elektronową noszą nazwe ligandów
jednokleszczowych lub jednofunkcyjnych. Przykładem jest cząsteczka
amoniaku NH
3
.
Ligandy zawierające dwa lub wiecej atomów, z których każdy moze jednocześnie
utworzyc dwuelektronowe wiązanie donorowe z tym samym atomem metalu,
noszą nazwę ligandów wielokleszczowych (wielofunkcyjnych) lub
chelatowych, gdyż chwytają one niejako kation miedzy dwa lub wiecej atomów
donorowych.
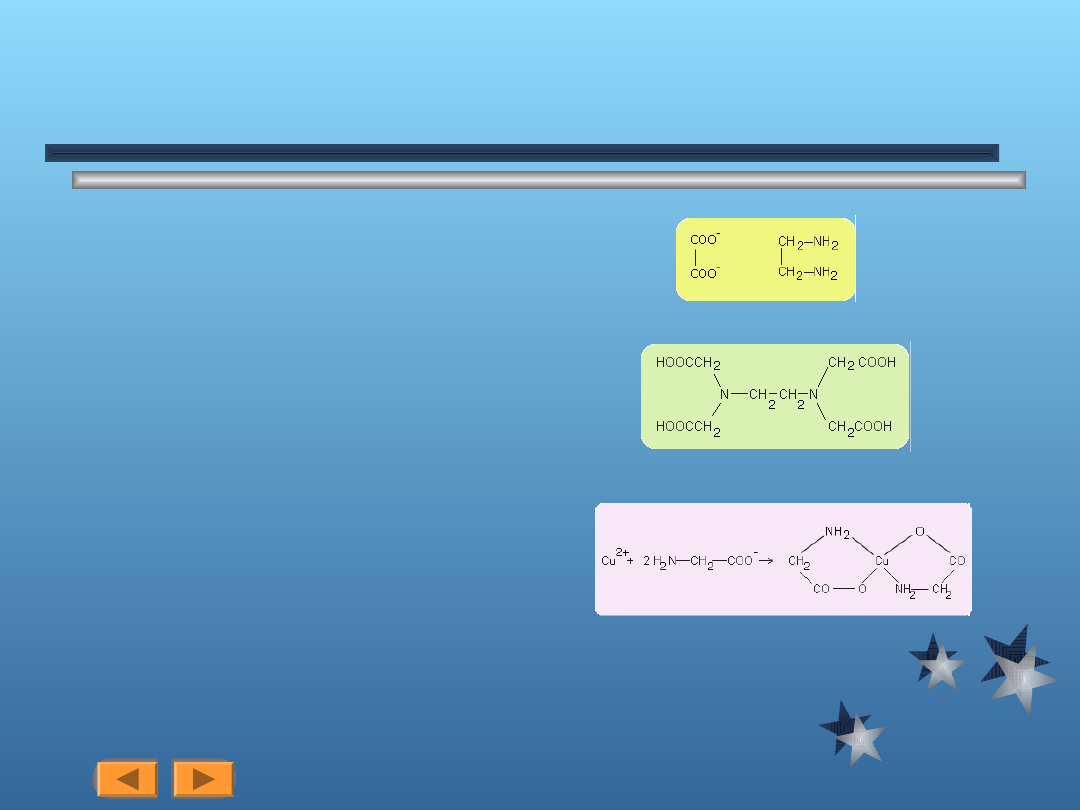
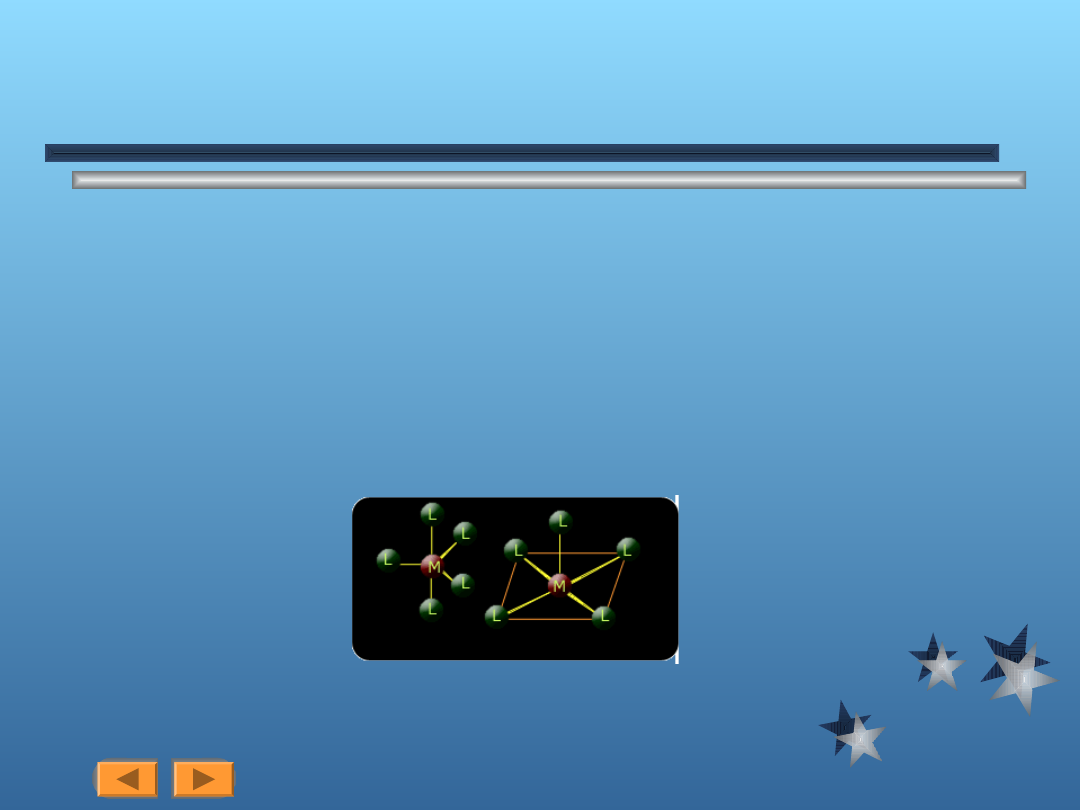
Strtuktura ligandów
Ligandy dwukoordynacyjne, np.
rysunek 1
Ligandy trój, cztero, a nawet
sześciokoordynacyjne, przykład - kwas
etylenodwuaminoczterooctowy
rysunek 2
Zwiazek kompleksowy chelatowy (chelat)
rysunek 3
Liczba ligandów otaczających
bezpośrednio jon centralny nazywa
się liczbą koordynacyjną i zwykle
wynosi 2, 4, 6, 8.
Ponieważ ładunek drobiny kompleksowej
jest algebraiczną sumą ładunków jonu
centralnego oraz ligandów, więc może ona
być kationem [Cu(NH
3
)
2
]
+
lub anionem
[Zn(CN)
4
]
2-
lub cząsteczką elektrycznie
obojętną Ni(CO)
4
, PtCl
2
(NH
3
)
2
.
Natura wiązania
Naturę wiązania miedzy jonem centralnym i ligandami wyjaśniają dwie teorie.
teoria pola krystalicznego - tłumaczy tworzenie sie drobin kompleksów oddziaływaniami
elektrostatycznymi miedzy elektronami odsadzającymi podpowłoki typu d atomu
centralnego a elektronami ligandu.
teoria pola ligandów - traktuje wiązanie między drobiną ligandu i jonem centralnym jako
zlokalizowane wiązanie koordynacyjne utworzone w wyniku nakrywania sie orbitali
atomowych ligandów obsadzonych wolnymi parami elektronowymi. Strukturę drobin
kompleksów wyjaśnia sie odpowiednią hybrydyzacją orbitali atomowych jonu
centralnego. (w tworzeniu hybryd uczestniczą orbitale typu s i p powłoki zewnętrznej
oraz typu d powłoki poprzedniej )
Najprościej możemy powiedzieć, że poprzez utworzenie wiązania struktury elektronowe
pierwiastków upodabniją się do najbliższych gazów szlachetnych. Przykładem jest
tworzenie kompleksu [Zn(NH
3
)
4
]
2+
, który powstaje w wyniku przyłączenia do kationu
cynkowego Zn
2+
czterech cząsteczek amoniaku NH
3
. Dlaczego czterech cząsteczek NH
3
.
Otóż kation cynkowy Zn
2+
ma 28 elektronów. Po przyłączeniu czterech par elektronowych
z czterech cząsteczek amoniaku uzyskuje on konfigurację elektronową kryptonu
36
Kr.
Zn
2+
+ 4NH
3
--> [Zn(NH
3
)
4
]
2+
Zatem liczba koordynacyjne dwudodatniego jonu cynkowego wynosi cztery.
Gdzie występuje wiązanie
koordynacyjne?(przykłady)
W związkach kompleksowych wiązania koordynacyjne występują pomiędzy metalem a
koordynowaną cząsteczką lub jonem ujemnym. Wiadomo jest również, ze liczba elektronów
dookoła centrum koordynacji jest równa liczbie elektronów w atomie najbliższego, cięższego gazu
szlachetnego (patrz przykład z Zn
2+
).
Ale są związki, w których podana reguła nie obowiązuje. Przykładem jest [Ag(NH
3
)
2
]
+
W związkach kompleksowych zaobserwowano także inną prawidłowość wykazującą jednak
również odstępstwa a mianowicie.
do jonów jednododatnich przyłączają się dwa ligandy
do jonów dwudodatnich - cztery
do jonów trójdodatnich - sześć.
Poniżej podano zgodnie z tą reguła, przykłady niektórych kationów zespolonych.
[Cu(NH
3
)
2
]
+
, [Cu(NH
3
)
4
]
2+
, [Co(NH
3
)
6
]
3+
[Ag(NH
3
)
2
]
+
, [Zn(NH
3
)
4
]
2+
, [Cr(NH
3
)
6
]
3+
[Au(NH
3
)
2
]
+
, [Cd(NH
3
)
4
]
2+
oraz anionów zespolonych
[AgCl
2
]
-
, [Zn(CN)
4
]
2-
, [Al(OH)
6
]
3-
[Ag(CN)
2
]
-
, [Zn(OH)
4
]
2-
, [Fe(CN)
6
]
3-
Jak wyliczyć liczbę
koordynacyjną?
Ponieważ jednym z ligantów może być cząsteczka wody, więc kationy metali
przejściowych w roztworze wodnym są w rzeczywistości akwakompleksami,
dlatego w roztworach wodnych wewnętrzna strefa koordynacyjna utworzona jest
z cząsteczek wody, które mogą być zastąpione silniej wiążącym ligandem.
Zastąpienie cząsteczek wody przez inne liganty nie musi byc całkowite. Na
przykład kation Cr
3+
, w zależności od warunków, tworzy jony kompleksowe
[Cr(H
2
O)
6
]
3+
, [CrCl(H
2
O)
5
]
3+
oraz [CrCl
2
(H
2
O)
4
]
3+
Dla roztworów wodnych liczbę koordynacyjną określa się liczbę przyłączonych
ligandów z pominięciem cząsteczek wody.
W jonach kompleksowych, np. [Fe(H
2
O)
5
NCS]
2+
i [Fe(H
2
O)(NCS)
5
]
2-
liczba
koordynacyjna wynosi odpowiednio 1 i 5 a ogólna liczba koordynacyjna ma
wartość 6
Struktura elektr. metali
przejściowych a zdolność
tworzenia kompleksów
Powstawanie związków kompleksowych stanowi szczególnie ważną część chemii metali
przejściowych. Szczególną cechą struktury elektronowej metali przejściowch, która prowadzi
do tworzenia ich trwałych kompleksów, jest zdolność do tworzenia wiązań przez orbitale d, jak
również orbitale s i p.
I tak w pierwiastkach od potasu do kryptonu elektrony zewnętrzne mogą zajmowac pięć
orbitali 3d, orbital 4s oraz trzy orbitale 4p. W następnych szeregach metali przejściowych
dostępne orbitale są podobne, lecz główna liczba kwantowa wzrasta o 1 lub 2.
Orbitale d metali przejściowych zdolne są do hybrydyzacji z orbitalami s oraz trzema
orbitalami p powłoki walencyjnej, z utworzeniem orbitali wiążących. W zależności od ilości
elektronów orbitali d uzyskujemy różne hybrydy. Dwoma powszechnie stosowanymi zestawami
hybryd są: dsp
2
i d
2
sp
3
.
Jeżeli nie ma wolnych orbitali d, mogą się tworzyć orbitale wiążące typu sp
3
, sp
2
i sp (patrz
kwantowa teoria wiązań).
W zależności od rodzaju hybryd biorących udział w tworzeniu kompleksu uzyskujemy różne
rodzaje struktur cząsteczek.
sp - liniowa
sp
2
- trygonalna
sp
3
- tetraedryczna
dsp
2
- kwadratowa płaska
d
2
sp
3
- oktaedryczna
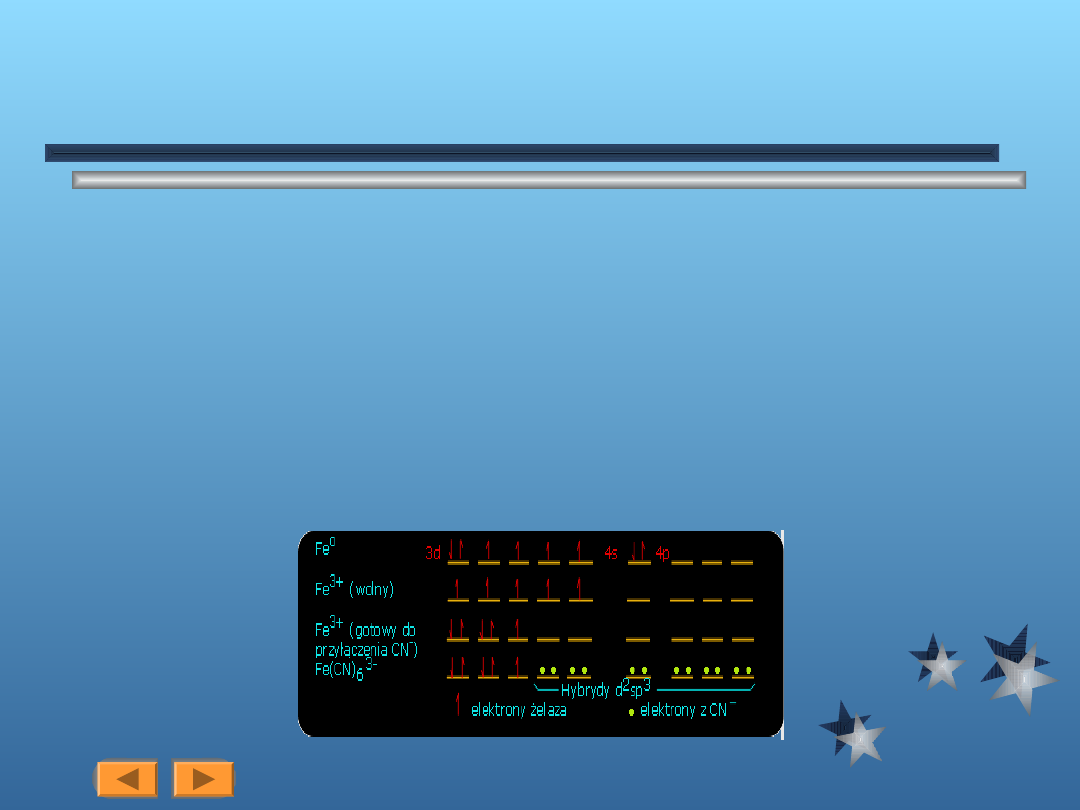
Przykłady
Geometria oktaedryczna Przykładem jest kompleks [Fe(CN)
6
]
3-
. Tworzenie sie
takiego kompleksu możemy przedstawić następująco:
Żelazo (z = 26) ma konfiguracje elektronową 1s
2
2s
2
p
6
3s
2
p
6
d
6
4s
2
. Aby utworzył
sie jon Fe
3+
, należy pozbyć się dwóch elektronów 4s i jednego z elektronów 3d.
Uwalnia to pięć elektronów w pięciu orbitalach 3d. Aby związać jon CN
-
,
będziemy potrzebowć dwóch orbitali d, jednego 4s i trzech orbitali 3p. Uzyskamy
to poprzez wtłoczenie wszystkich elektronów 3d
5
do trzech orbitali. Mamy wtedy
sześć wolnych orbitali gotowych do przyłączenia CN
-
. Każdy jon CN
-
lokuje parę
elektronów w dostępny orbital żelaza i w ten sposób powstaje wiązanie
kowalencyjne. Cały kompleks zespala się razem, ponieważ następuje podział
elektronów między orbital zhybrydyzowany d
2
sp
3
i niektóre orbitale cyjanku.
Rodzaje geometrii:
Urok powyższego zobrazowania polega na tym, że pokazuje ono iż w kompleksie
[Fe(CN)
6
]
3-
powinien być jeden elektron niesparowany. Rzeczywiście pokrywa sie to z
obserwacją paramagnetyzmu kompleksu. Chociaż Fe
3+
ma pięć niesparowanych
elektronów, Fe(CN)
63-
ma tylko jeden. Pierwszy zwany jest elektronem
wysokospinowym, a ostatni - niskospinowym.
Geometria tetraedryczna Przykładem może być jon cynku Zn
2+
(1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
), który ma dziesięć elektronów na zewnątrz powłoki elektronowej argonu. Mogą
one zajmować parami pięć orbitali 3d (konfiguracja d
10
), pozostawiając orbital 4s oraz
trzy orbitale 4p zdolne do hybrydyzacji z utworzeniem czterech orbitali wiążących o
symetrii tetraedrycznej. Stwierdzono doświadczalnie, ze dwudodatni jon cynku ma
rzeczywiście liczbę koordynacyjną cztery i tworzy kompleksy, w ktorych cztery atomy
lub grupy atomów z nim związane rozmieszczone są w narożach czworościanu.
Do jonów kompleksowych tego typu należą; [Zn(OH)
4
]
2-
, [Zn(NH
3
)
4
]
2+
i [Zn(CN)
4
]
2-
.
Geometria płaskokwadratowa Przykładem jest [Ni(CN)
4
]
2-
, kompleks pochodzący od
Ni
2+
(1s
2
2s
2
p
6
3s
2
p
6
d
8
4s
2
) w którym wszystkie osiem elektronów d jest wciśnietych w
cztery orbitale d, zwalniając jeden orbital d dla utworzenia hybryd dsp
2
.
Kompleksy płaskokwadratowe są najbardziej rozpowszechnione dla atomów metalu o
konfiguracji d
8
. Takim metalem jest Ni.
Liczby koordynacyjne a
budowa
Istnieje określony związek między geometrią cząsteczki a liczbą koordynacyjną. Poniżej przedstawione będą
najczęściej występujące liczby koordynacyjne i odpowiadające im typowe struktury cząsteczek.
Liczba koordynacyjna 2
Liczba ta występuje rzadko, głównie w przypadku kationów Cu
+
, Ag
+
i Au
+
, a także Hg
2+
. Struktura cząsteczki
jest liniowa.
[H
3
N-Ag-NH
3
]
+
, [NC-Ag-CN]
-
i [Cl-Au-Cl]
-
Kompleksy takie z reguły przyłączają dalsze ligandy, np.
[Cu(CN)
2
]
-
+ 2CN
-
---> [Cu(CN)
4
]
3-
Liczba koordynacyjna 3
W przypadku kompleksów o liczbie koordynacyjnej 3 najważniejsza jest struktura trójkątna płaska i
struktura piramidy trygonalnej. Przykłady to płaskie kompleksy HgI
3-
i [Cu(CN)
3
]
2-
oraz piramidalny kompleks
SnCl
3-
.
Liczba koordynacyjna 4
Jest to jedna z najważniejszych liczb koordynacyjnych, której odpowiadają struktury: tetraedryczna lub
kwadratowa płaska. Dominują kompleksy tetraedryczne, tworzone prawie wyłącznie przez metale
nieprzejściowe i metale przejściowe nie znajdujące sie w pobliżu prawej strony bloku d.
Jako przykłady struktur tetraedrycznych można wymienić; Li(H
2
O)
4+
, BeF
42-
, BH
4-
, AlCl
4-
i Ni(CO)
4
.
Struktura tetraedryczna występuje najczęściej dla konfiguracji elektronów walencyjnych d
0
lub d
10
.
Kwadratowa konfiguracja płaska jest charakterystyczna dla konfiguracji elektronowej d
8
. Występuje to zwykle
dla kompleksów jonów Ni
2+
, Pd
2+
, Pt
2+
, Rh
+
, Ir
+
i Au
3+
, a także dla kompleksów jonu d
9
, Cu
2+
.
.
L.k.=5
Liczba koordynacyjna 5
ta liczba koordynacyjna występuje rzadziej niż liczby 4 i 6, ma jednak istotne znaczenie. Dwie
najbardziej symetryczne odpowiadające jej struktury to bipiramida trygonalna i piramida
tetragonalna
Te dwie struktury zwykle nieznacznie różnią się energią; każda z nich może przekształcic się w
pozostałą w wyniku zmian kątów między wiązaniami. Ze względu na to struktury wielu
kompleksów o liczbie koordynacyjnej 5 nie pokrywają się dokładnie z jedną z wymienionych
struktur, lecz kompleksy te mają pewną strukturę pośrednią.
Interesującym przykładem występowania dwóch struktur o liczbie koordynacyjnej 5 jest jon
[Ni(CN)
5
]
3-
, tworzący sól krystaliczną, w której wykryto obydwie struktury.
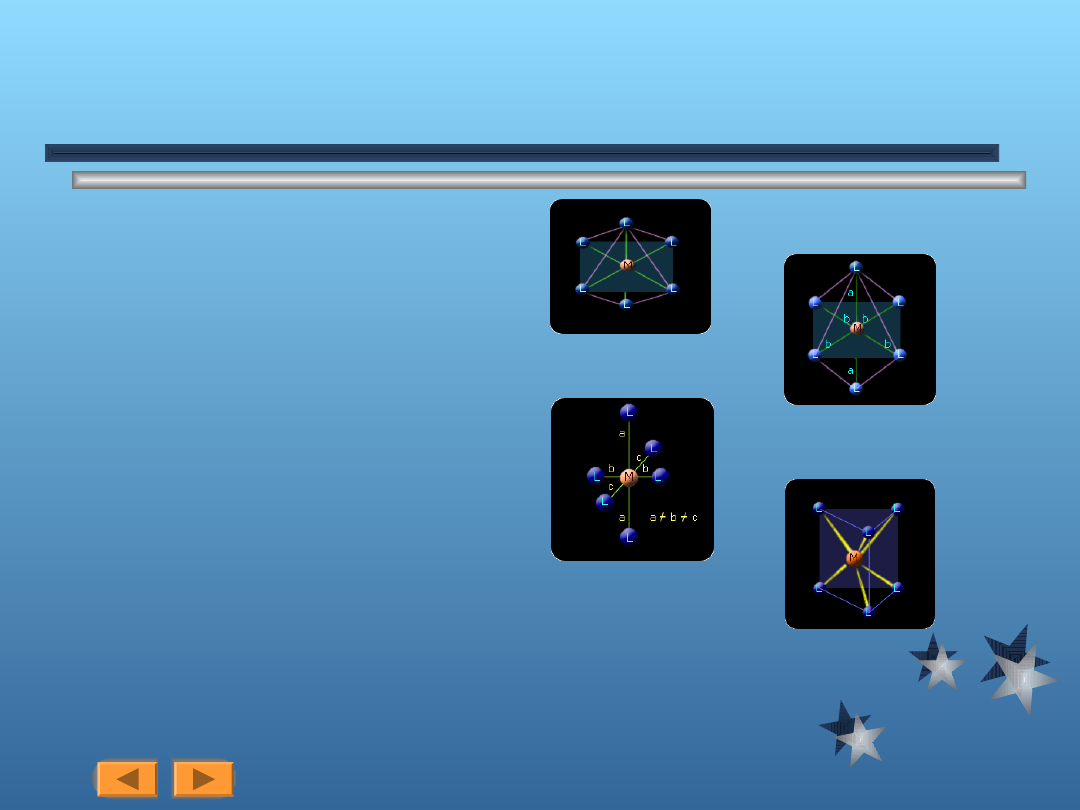
L.k.=6
Jest to liczba niezwykle ważna, gdyż prawie wszystkie
kationy tworzą kompleksy o liczbie koordynacyjnej 6.
Praktycznie wszystkie te kompleksy mają identyczny
kształt ośmiościanu (struktura oktaedryczna).
Praktycznie z uwagi na różnorodność ligandów nie może
być zachowana idealna symetria ośmiościanu. Obserwuje
się wtedy odkształcenia na osi wiązan ligand-atom
centralny, co polega na wydłużaniu lub skracaniu wiązań.
Skrócenie lub wydłużenie jednej osi L-M-L w stosunku do
dwóch pozostałych nosi nazwę odkaształcenia
tetragonalnego, natomiast całkowite zniszczenie
równości osi to odkształcenie rombowe
Odkształcenie tetragonalne (rys)
Odkszatałcenie rombowe (rys)
Bardzo nieliczne są przypadki, gdy sześć ligantów
znajduje się w narożach słupa trygonalnego (rysunek
niżej). Słup jest powiązany w prosty sposób z
ośmiościanem: jeżeli trókątna ściana ośmiościanu
zostanie obrócona o 60
o
względem ściany przeciwległej,
powstanie słup.
Ośmiościan jest trwalszą strukturą niz słup, co jest
uwarunkowane przynajmniej dwiema przyczynami.
najbardziej oczywisty jest czynnik przestrzenny: w
ośmiościanie ligandy są bardziej oddalone od siebie niż w
słupie dla dowolnej danej odległości M-
Lw większości
przypadków jon metalu tworzy mocniejsze wiązania z
oktaedrycznymi ligandami.
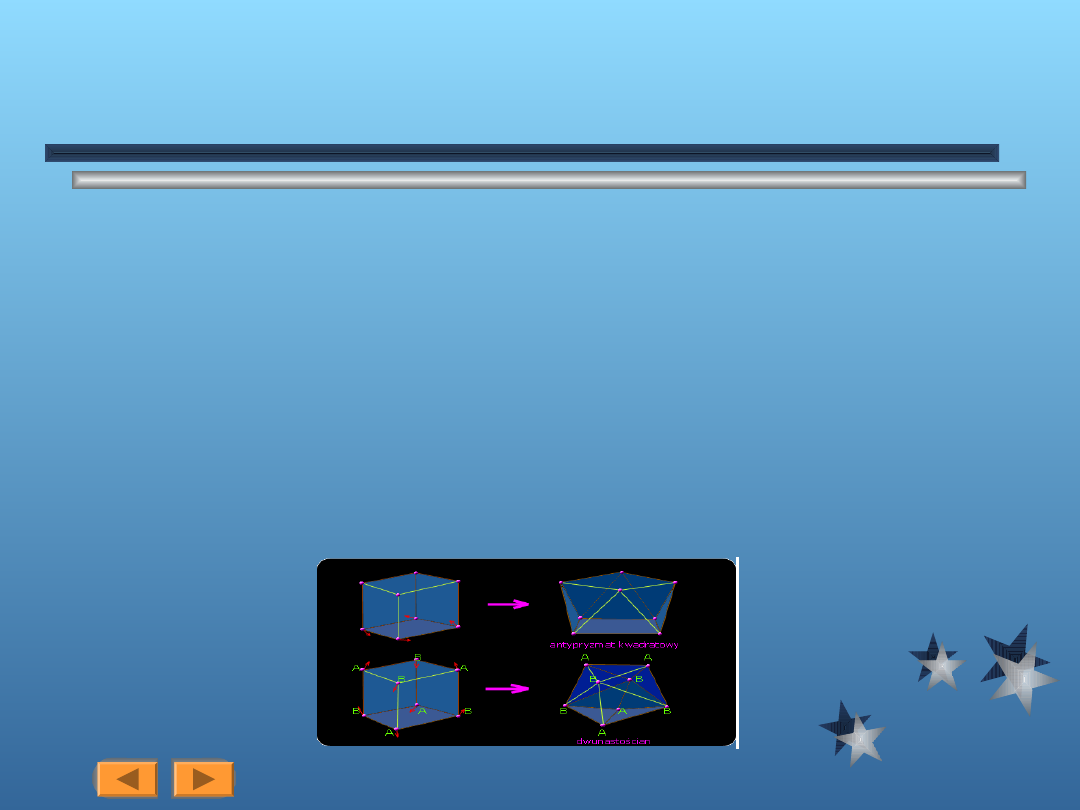
L.k.=7,8,9
Liczby koordynacyjne 7, 8 i 9 występują nierzadko w przypadku niektórych wiekszych
kationów. Każdemu z takich przypadków odpowiada kilka możliwych struktur, nie różniących
sie na ogół znacznie trwałością. Kompleksy o dużych liczbach koordynacyjnych nie są wiec z
reguły sztywne stereochemicznie.
Liczbie koordynacyjnej 7 odpowiadają trzy różne regularne struktury:
bipiramida pentagonalna
konfiguracja wyprowadzona z ośmiościanu przez zwiększenie jednej ściany dla pomieszczenia
siódmego ligandu
konfiguracja wyprowadzona w podobny sposób ze słupa trygonalnego
Liczbie koordynacyjnej 8 odpowiadają także trzy ważne struktury:
sześcianu - występuje rzadko
antypryzmatu kwadratowego - powstaje w wyniku zniekształcenia sześcianu (rys)
dwunastościanu - powstaje w wyniku zniekształcenia sześcianu
Licznie koordynacyjnej 9 odpowiada jedna symetryczna konfiguracja słupa trygonalnego
Izomeria związków
kompleksowych
Izomeria w związkach kompleksowych podobnie jak i wielu innych związków
chemicznych, istnienie w wyniku istnienia przyczyn jej powstawania. Na fakt
istnienia izomerii składają się;
różne położenie ligandów w strukturze związku
istnienie różnych sposobów połączeń ligand - atom centralny.
Wśród związków kompleksowych znane są następujące rodzaje izomerii:
izomeria geometryczna
izomeria optyczna
izomeria jonowa
izomeria wiązaniowa
izomeria koordynacyjna
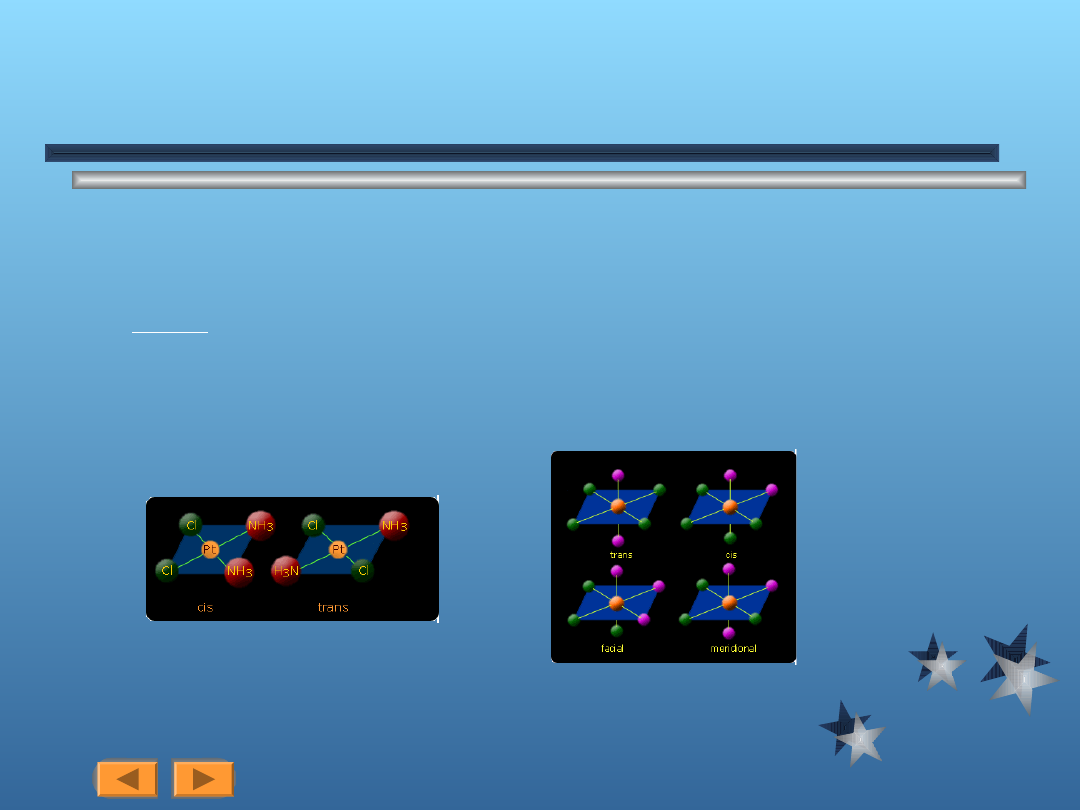
Izomeria geometryczna
Izomeria geometryczna
Przykładem istnienia izomerii geometrycznej jest fakt istnienia izomerii cis i trans dla struktur
kwadratowych i oktaedrycznych.(rys na lewo)
Przykład - kompleks [Pt(NH
3
)
2
Cl
2
]
Jest to jeden z najprostszych przykładów izomerii związków kompleksowych.
Przykładami innych ważnych rodzajów izomerii optycznej dla struktur oktaedrycznych są
podobnie jak dla struktur kwadratowych izomeria cis i trans dla związku ML
4
X
2
oraz izomeria
facjalna i meridionalna dla związku ML
3
X
3
.
Izomeria optyczna
Zgodnie z definicją izomerami optycznymi są cząsteczki, które mają się do siebie tak, jak
obraz i jego zwierciadlane odbicie. Takie cząsteczki nazywane są enacjomerami. Enacjomery
różnią się pod wzgledem skręcalności optycznej.
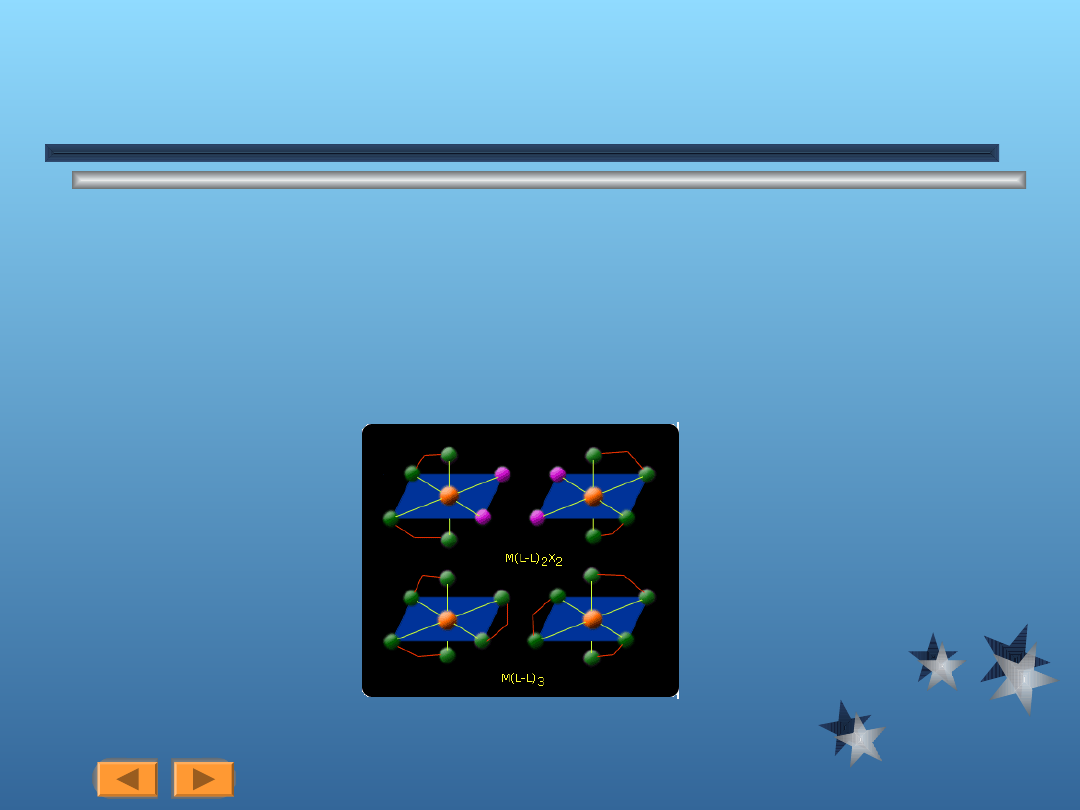
Taką właściwość posiadają pewne typy kompleksów oktaedrycznych. Do najważniejszych
enancjomerów oktaedrycznych należą kompleksy zawierające dwa lub trzy ligandy
kleszczowe, tj. typu M(L-L)
2
X
2
oraz kompleksy typu M(L-L)
3
. Przykłady na rysunkach poniżej.
Izomeria jonowa
Istnieją przypadki, gdy związki kompleksowe mają jednakowy wzór empiryczny,
lecz różnią się położeniem anionów, które mogą występować jako ligandy w
kompleksowym kationie lub stanowić przeciwjony w sieci krystalicznej. Izomery
takie tworzą w roztworze różne jony, zgodnie równaniami.
[Co(NH
3
)
4
Cl
2
]NO
2
---> [Co(NH
3
)
4
Cl
2
]
+
+ NO
2-
[Co(NH
3
)
4
Cl(NO
2
)]Cl ---> [Co(NH
3
)
4
Cl(NO
2
)]
+
+ Cl
-
Kolejnym przykładem występowania izomerii jonowej jest substancja o składzie
CrCl
3
*6H
2
. Izomerami w tym przypadku są;
[Cr(H
2
O)
6
]Cl
3
, koloru fioletowego
[Cr(H
2
O)
5
Cl]Cl
2
*H
2
O, koloru zielonego
[Cr(H
2
O)
4
Cl
2
]Cl*2H
2
O, koloru zielonego
Izomeria wiązaniowa i
koordynacyjna
Izomeria wiązaniowa
Niektóre ligandy mogą łączyć się z atomem centralnym w więcej niż jeden
sposób i często można wyodrębnić izomeryczne kompleksy różniące się
kolejnością powiązania atomów. Przykładem takiego ligandu jest SCN
-
, w którym
atomem donorowym może być S lub N oraz sulfotlenek R
2
S=O; w tym przypadku
donorem może być s lub O. Ligand zdolny do wiązania się w dwojaki sposób
można nazywać ligandem ambichelatowym.
Izomeria koordynacyjna
w związkach zawierających kompleksowy kation i kompleksowy anion
rozmieszczenie ligandów może być różne, występują więc izomery. Przykładem
są;
[Co(NH
3
)
6
][Cr(CN)
6
] i [Cr(NH
3
)
6
][Co(CN)
6
]
[Cr(NH
3
)
6
][Cr(SCN)
6
] i [Cr(NH
3
)
4
(SCN)
2
][Cr(NH
3
)
2
(SCN)
4
]
Nazewnictwo związków
kompleksowych
Nazwy jonów kompleksowych lub związków kompleksowych tworzy się przez:
podanie liczby ligandów
podanie nazw ligandów w kolejności alfabetycznej
podanie nazwy jonu centralnego (w przypadku katoinu) lub atomu centralnego
(w przypadku kompleksu obojętnego)
podanie stopnia utlenienia jonu centralnego (za pomocą cyfr rzymskich) lub
atomu centralnego (przez 0)
Przykład
Kompleks obojętny: [PtCl
2
(NH
3
)
2
] - diaminadichloroplatyna(II)
Związek kompleksowy z anionem kompleksowym: Na
3
[Ag(S
2
O
3
)
2
] -
bis(tiosiarczano)srebrzan(II)sodu
Nazwy niektórych ważniejszych ligandów: - H
2
O (akwa), NH
3
(amina), CO
(karbonyl), S
2
O
32-
(tiosiarczano), CN
-
(cyjano), F
-
(fluoro), Cl
-
(chloro), SO
42-
(siarczano).

:) KONIEC
PREZENTACJI:)
To już jest wszystko, co
powinieneś wiedzieć o
związkach kompleksowych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 6 związki kompleksowe
Cw2 Zwiazki kompleksowe
otrzymywanie i właściwości związków kompleksowych
7 Związki kompleksowe
Sprawozdanie z ChOiA zwiazki kompleksowe ćw 3
Sprawozdanie NR 5 związki kompleksowe
Zwiazki kompleksowe
wykład 10 związki kompleksowe
Związki kompleksowe (kompleksy, związki koordynacyjne
Analiza związków kompleksowych ćwiczenie
Budowa atomu i związki kompleksowe
związki kompleksowe
Związki kompleksowe kobaltu
Związki kompleksowe, AGH różne, chemia wykłady
Mechanizmy reakcji związków kompleksowych
zwiazki kompleksowe 3 id 593625 Nieznany
Związki kompleksowe
więcej podobnych podstron