
1
1
Materiały internetowe
• www.tutor-
homework.com/Chemistry_Help/Chemi
stry_II_Notes/chapter_19.ppt

2
2
Związki kompleksowe
•
Zmieszajmy roztwory wodne FeCl
2
(1 mol) i
KCN (6 moli) - powstaje roztwór barwy
żółtej, który nie wykazuje reakcji na
kationy Fe
2+
.
•
D l a c z e g o?
•
Fe
2+
+ 6CN
-
= [Fe(CN)
6
]
4-
•
Jest to bardzo trwały jon, zwany
kompleksowym, o strukturze
oktaedrycznej.
•
Ten jon kompleksowy może utworzyć sól
K
4
Fe(CN)
6
, którą można wydzielić z
roztworu.

3
3
Związki kompleksowe
• Metale przejściowe są kwasami Lewisa
Tworzą kompleksy / jony kompleksowe
Fe
3+
(aq) + 6CN
-
(aq) Fe(CN)
63-
(aq)
Ni
2+
(aq) + 6NH
3
(aq) Ni(NH
3
)
62+
(aq)
• Kompleks zbudowany jest z jonu centralnego i
połączonych z nim (otaczających go)
cząsteczek lub anionów
• Kwas Lewisa = metal/jon metalu = środek
koordynacji
• Zasada Lewisa = ligand = cząsteczki/jony
tworzące kompleks z metalem/jonem metalu

4
4
Związki kompleksowe
Związki zawierające jeden
lub więcej kompleksów
[Co(NH
3
)
6
]Cl
3
[Cu(NH
3
)
4
][PtCl
4
]
[Pt(NH
3
)
2
Cl
2
]

5
5
Związki kompleksowe
• Sfera koordynacyjna
– Metal (jon metalu) i otaczające go ligandy
• Liczba koordynacyjna
– Liczba jonów otaczających jon centralny lub
liczba atomów będących donorami pary
elektronowej, związanych z jonem centralnym
Najbardziej pospolita = 4, 6
Wynika z własności ligandów
Większe ligandy preferują niższą
liczbę koordynacyjną

6
6
Związki kompleksowe
• Ładunek kompleksu = suma ładunków
jonu centralnego i ligandów
[ Fe(CN)
6
]
3-
+
3
6(-1)
Zerowy ładunek związku kompleksowego =
suma ładunków jonu centralnego, ligandów
i jonów ze sfery zewnętrznej
Zerowy ładunek związku kompleksowego =
suma ładunków jonu centralnego, ligandów
i jonów ze sfery zewnętrznej
[Co(NH
3
)
6
]Cl
2
[Co(NH
3
)
6
]Cl
2
+
2
6(0) 2(-
1)

7
7
Ligandy
Klasyfikowane ze
względu na liczbę
atomów donorowych
jednomiejscowe = 1
H
2
O, CN
-
, NH
3
, NO
2-
, SCN
-
,
OH
-
, X
-
(halogenki),
CO, O
2-

8
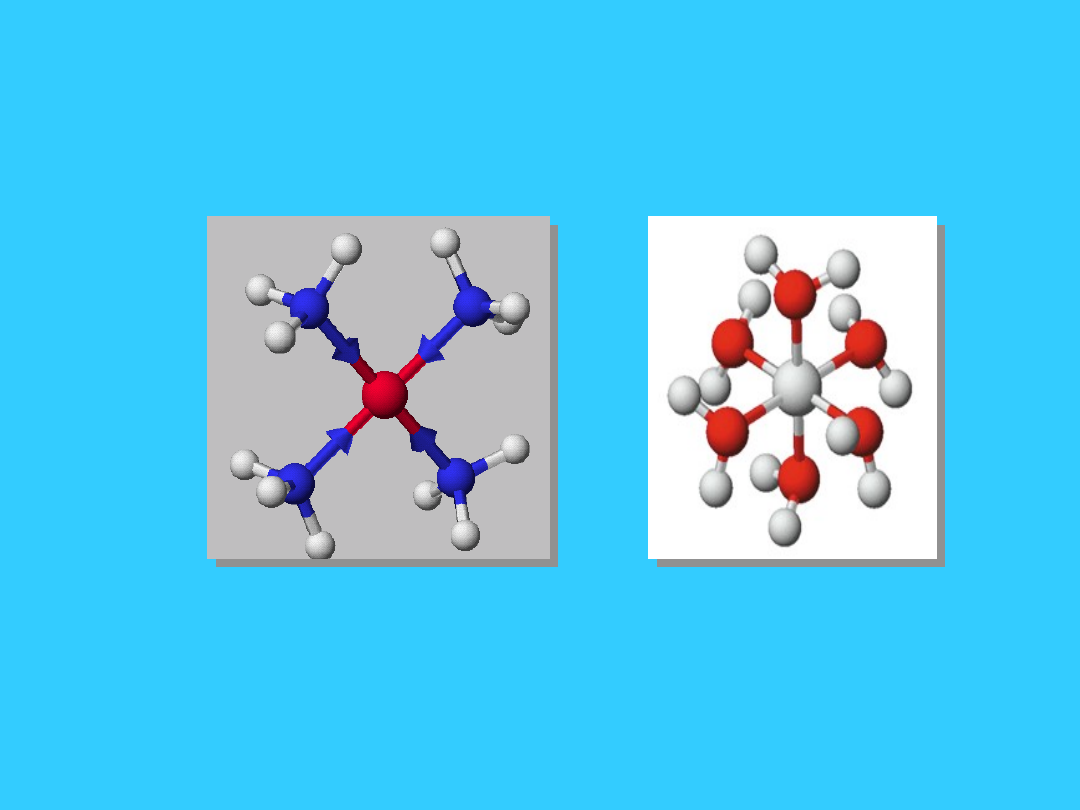
8
Ligandy
chelatowe (kleszczowe)
dwukleszczowe = 2
czterokleszczowe = 4
sześciokleszczowe = 6
wielokleszczowe = 2 lub
więcej atomów
donorowych
9
9
Przykłady kompleksów z
ligandami
jednomiejscowymi
[Cu(NH
[Cu(NH
3
3
)
)
4
4
]
]
2+
2+
[Co(H
2
O)
6
]
2+
[Co(H
2
O)
6
]
2+
10
10
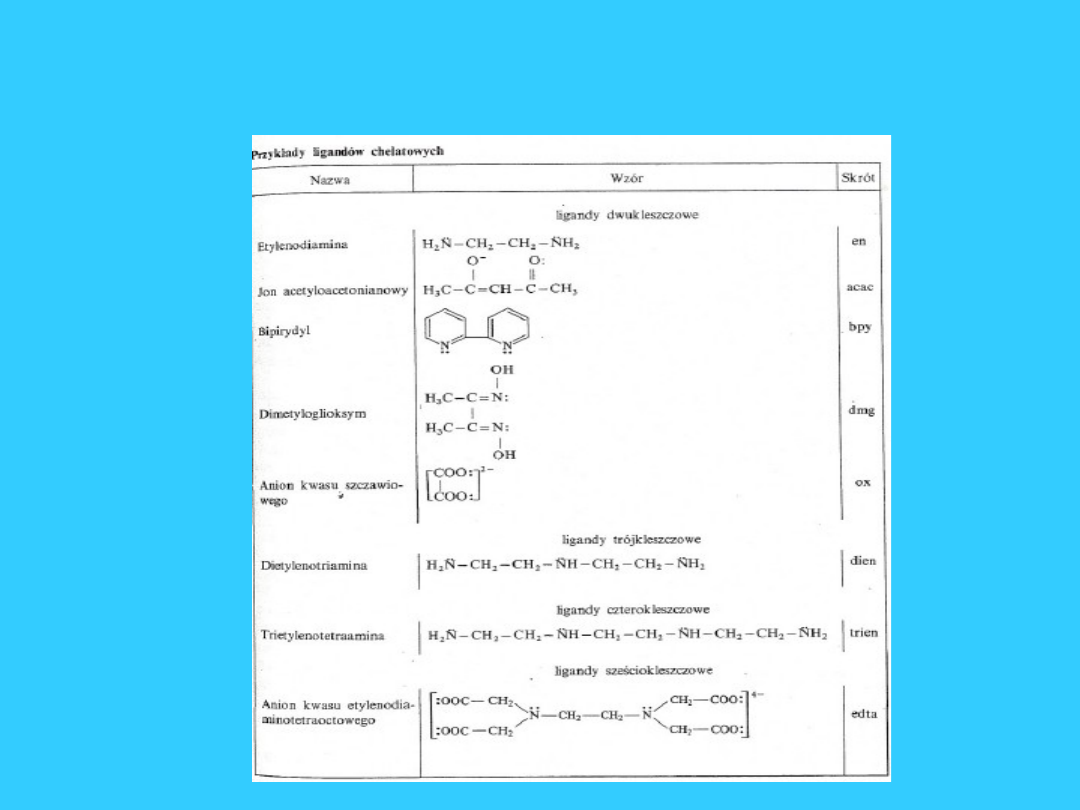
Ligandy kleszczowe

11
11
Ligandy kleszczowe
C
C
O
O
O
O 2-
CH
2
H
2
N
CH
2
NH
2
jon
szczawianow
y
Ethylenodiamina
(en)
*
*
*
*
12
12
EDTA – ligand
sześciokleszczowy
CH
2
N
CH
2
CH
2
C
C
CH
2
N
CH
2
CH
2
C
C
O
O
O
O
O
O
O
O
*
*
*
*
*
*
13
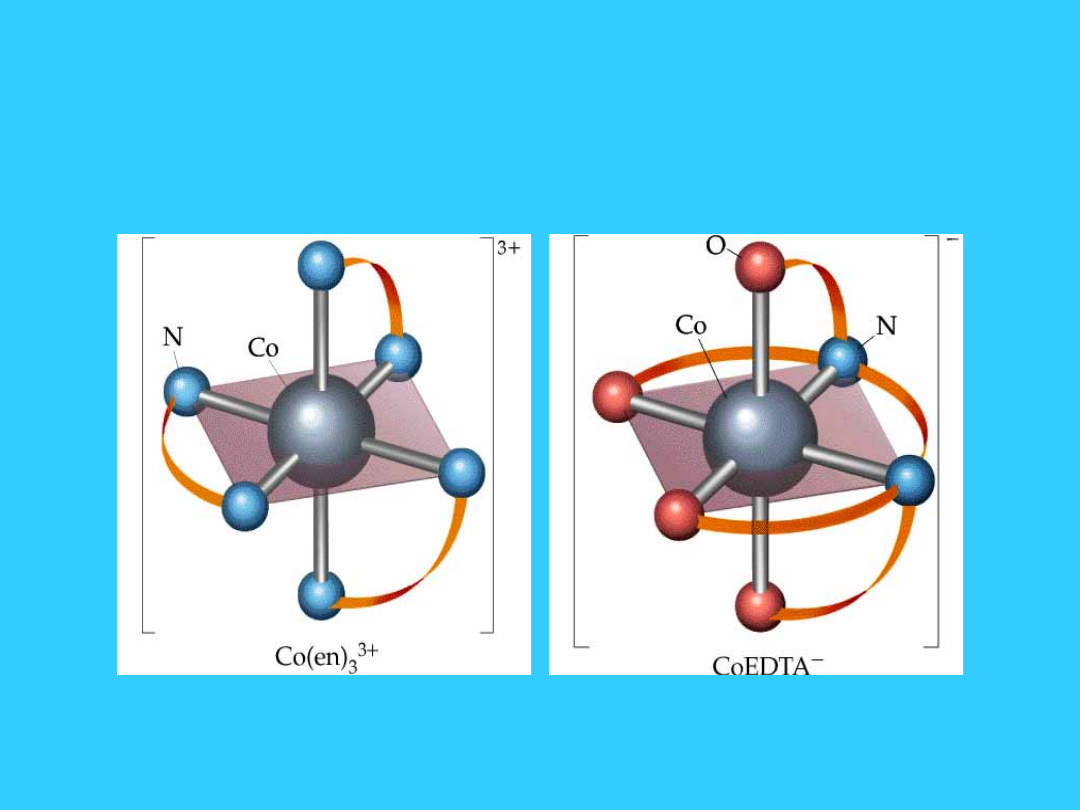
13
Przykłady kompleksów
chelatowych
14
14
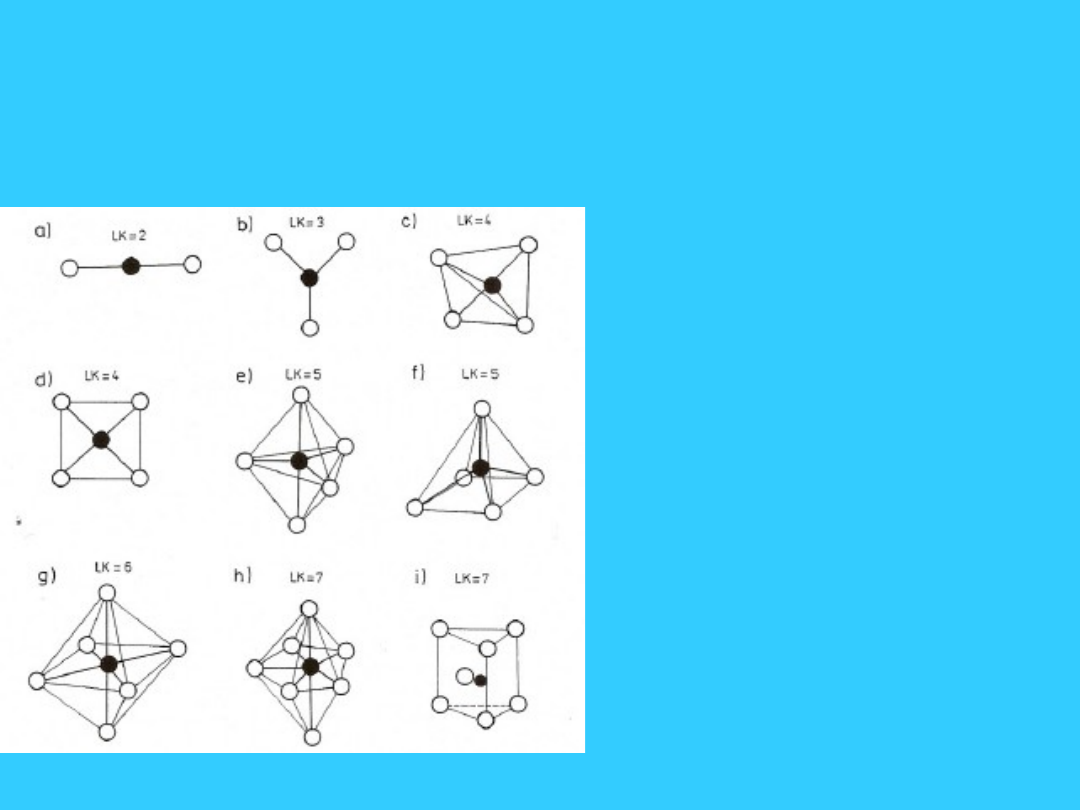
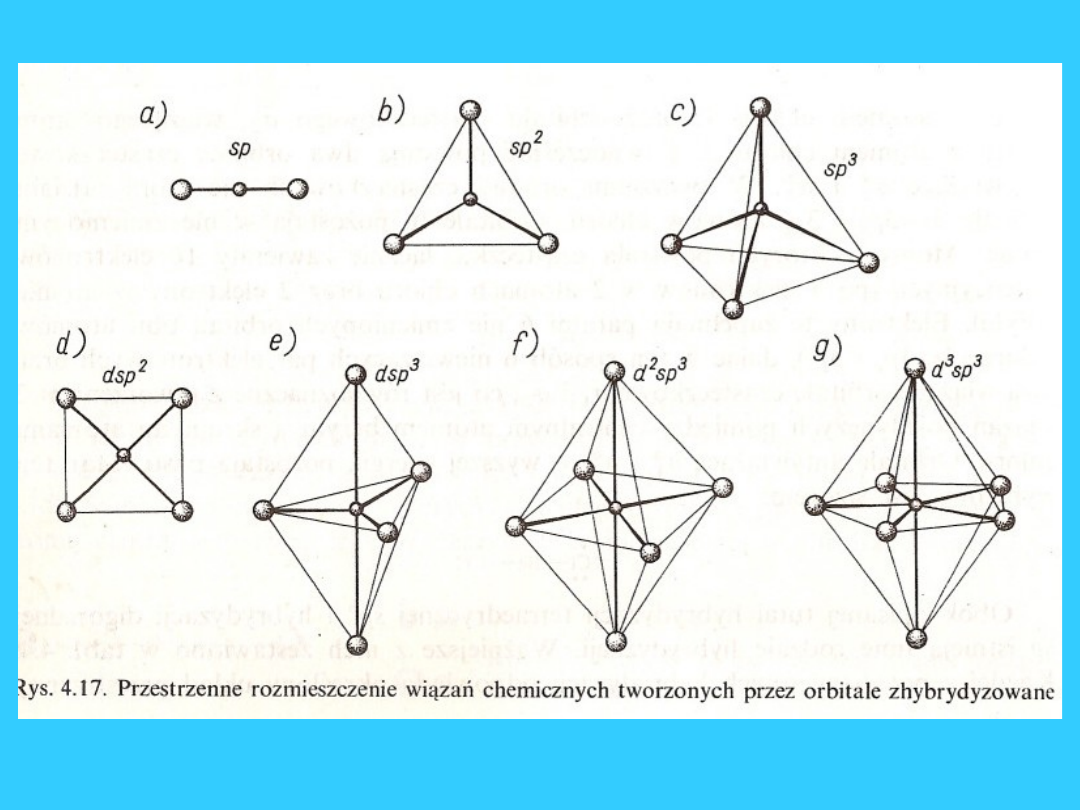
Liczba koordynacji i
przestrzenne rozmieszczenie
ligandów
l.k. = 2 liniowa
[Ag(NH
3
)
2
]
+
l.k. = 2 liniowa
[Ag(NH
3
)
2
]
+
l.k. = 4 tetraedr
[Zn(NH
3
)
4
]
2+
, [FeCl
4
]
-
l.k. = 4 tetraedr
[Zn(NH
3
)
4
]
2+
, [FeCl
4
]
-
l.k. = 4 płaska kwadratowa
[Ni(CN)
4
]
2-
l.k. = 4 płaska kwadratowa
[Ni(CN)
4
]
2-
l.k. = 6 oktaedr
[Co(CN)
6
]
3-
, [Fe(en)
3
]
3+
l.k. = 6 oktaedr
[Co(CN)
6
]
3-
, [Fe(en)
3
]
3+
15
15
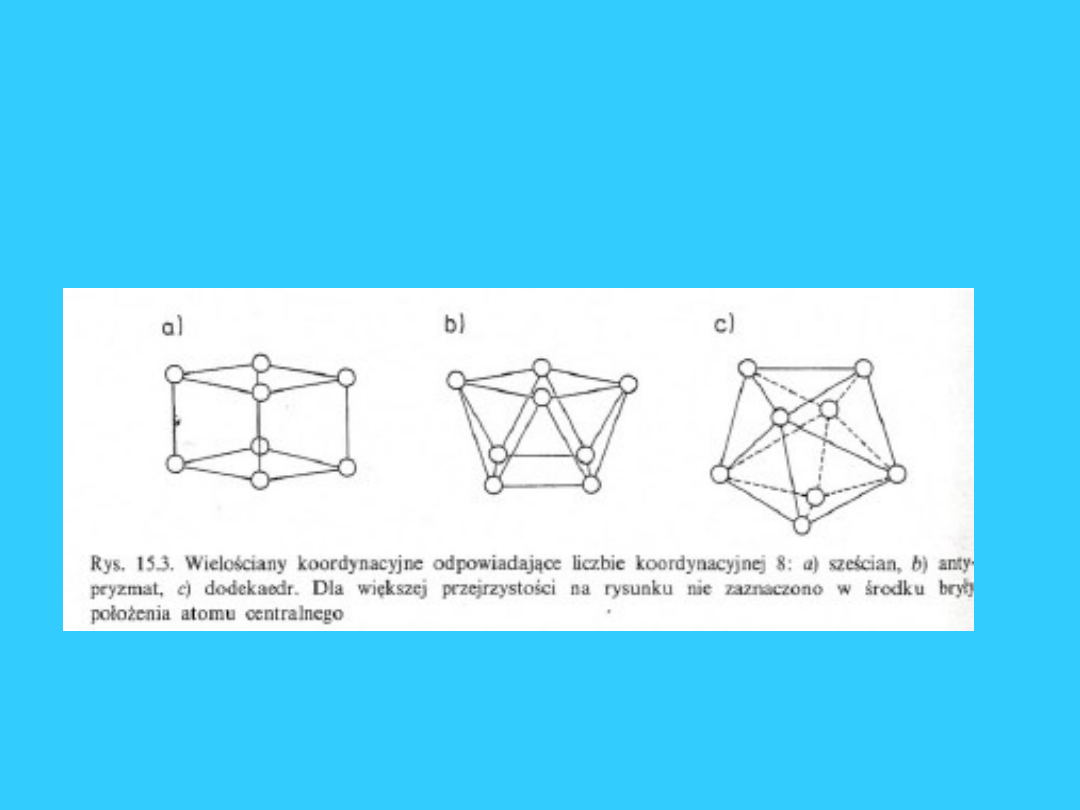
Liczba koordynacji i
przestrzenne rozmieszczenie
ligandów
16
16
Związki kompleksowe

17
17
Nomenklatura: Zasady
IUPAC
• 1) Pełna nazwa - najpierw nazwa ligandów a
potem nazwa jonu centralnego; we wzorze -
odwrotnie: tetrakarbonylnikiel - Ni(CO)
4
• 2) Stopień utlenienia centralnego atomu
podaje się umieszczając po nazwie
kompleksu cyfrę rzymską w nawiasie
okrągłym,np. [Cu(NH
3
)
4
]
2+
- jon
tetraaminamiedzi(II)
• 3) W przypadku kompleksów anionowych do
nazwy atomu centralnego dodaje się
końcówkę - an, np. [Fe(CN)
6
]
4-
- jon
heksacyjanożelazianowy(II)

18
18
Nomenklatura: Zasady
IUPAC
• 4) Ligandy wymienia się w kolejności
alfabetycznej [CoCl
2
(NH
3
)
4
]
+
- jon
tetraaminadichlorokobaltu(III)
• 5) Ligandy anionowe mają końcówkę – o, np. Cl
-
-
chloro, OH
-
- hydrokso. Dla wody przyjmujemy
nazwę akwa, amoniaku - amina, tlenku węgla -
karbonyl, tlenku azotu - nitrozyl.
• 6) Dla oznaczenia liczby ligandów ożywa się
przedrostków greckich mono-, di-, tri-, tetra-,
itd.. Przedrostek mono- jest opuszczany. W
przypadku ligandów o bardziej skomplikowanej
budowie nazwę liganda ujmuje się w nawias,
przed którym stawia się określenie bis-, tris-,
tetrakis (dwa, trzy, cztery, itd..).
19
19
Nomenklatura: Zasady
IUPAC
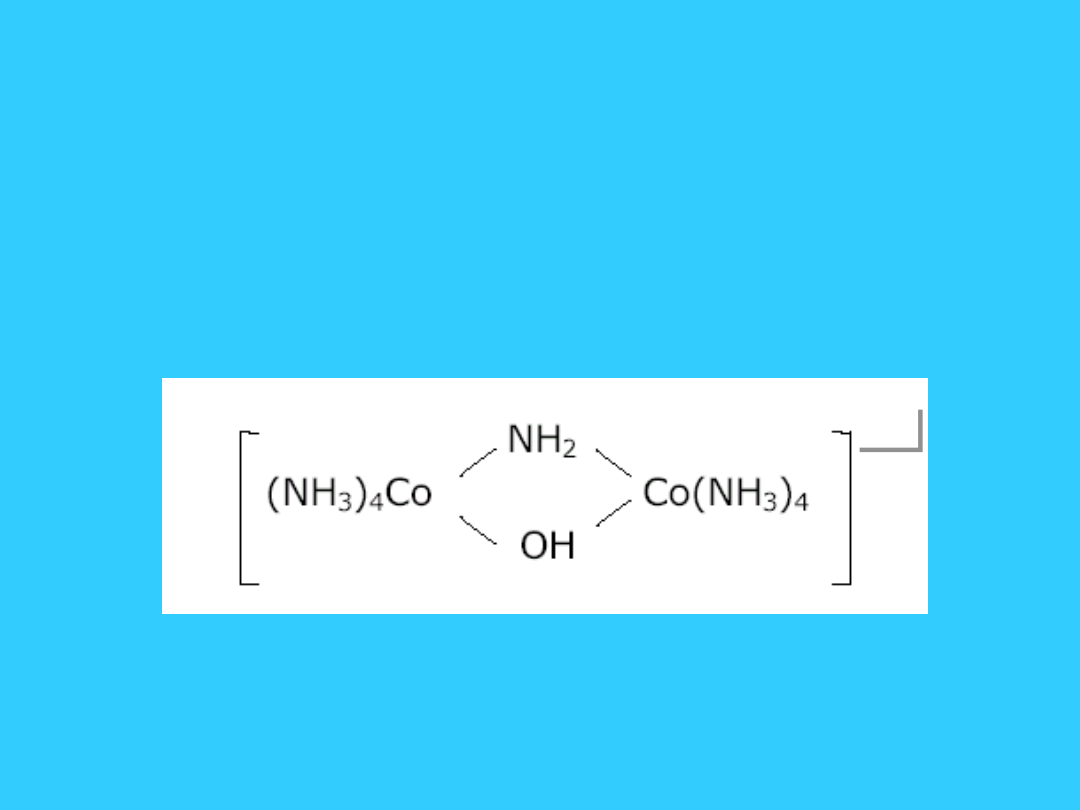
• 7) Jeżeli w kompleksie pojawia się
grupa mostkowa to poprzedza się ją
literą grecką - np.
• - jon -amido--hydrokso-
bis[tetraamina-kobaltu(III)
4+
4+

20
20
Nazwy ligandów

21
21
Nazwy i wzory niektórych
kompleksów

22
22
Izomeria związków
kompleksowych
• Izomeria - występowanie substancji o takim
samym składzie chemicznym, różniących się
jednak strukturą cząsteczki, a co za tym idzie
także własnościami chemicznymi.
• Rozróżniamy dwa rodzaje izomerii związków
kompleksowych:
izomerię strukturalną
oraz
stereoizomerię
.
• Izomeria strukturalna
- izomery mają ten
sam sumaryczny skład chemiczny, wykazują
natomiast odmienny skład jonów
kompleksowych.
• Stereoizomeria
- atom centralny otoczony
jest we wszystkich izomerach takimi samymi
ligandami, są one jednak w stosunku do siebie
ułożone w różny sposób.

23
23
Izomeria strukturalna
Izomeria jonowa
Izomeria jonowa
[Co(NH
[Co(NH
3
3
)
)
5
5
Br]SO
Br]SO
4
4
siarczan pentaaminabromokobaltu(III) -
siarczan pentaaminabromokobaltu(III) -
fioletowy
fioletowy
[Co(NH
[Co(NH
3
3
)
)
5
5
(SO
(SO
4
4
)]Br–bromek
)]Br–bromek
pentaaminasiarczanokobaltu(III) –
pentaaminasiarczanokobaltu(III) –
czerwony
czerwony
Izomeria jonowa
Izomeria jonowa
[Co(NH
[Co(NH
3
3
)
)
5
5
Br]SO
Br]SO
4
4
siarczan pentaaminabromokobaltu(III) -
siarczan pentaaminabromokobaltu(III) -
fioletowy
fioletowy
[Co(NH
[Co(NH
3
3
)
)
5
5
(SO
(SO
4
4
)]Br–bromek
)]Br–bromek
pentaaminasiarczanokobaltu(III) –
pentaaminasiarczanokobaltu(III) –
czerwony
czerwony
Jak te związki reagują z BaCl
Jak te związki reagują z BaCl
2
2
i AgNO
i AgNO
3
3
?
?
[Co(NH
[Co(NH
3
3
)
)
5
5
Br]SO
Br]SO
4
4
= [Co(NH
= [Co(NH
3
3
)
)
5
5
Br]
Br]
2+
2+
+ SO
+ SO
4
4
2-
2-
SO
SO
4
4
2-
2-
+ Ba
+ Ba
2+
2+
= BaSO
= BaSO
4
4
(biały osad)
(biały osad)
[Co(NH
[Co(NH
3
3
)
)
5
5
SO
SO
4
4
]Br = [Co(NH
]Br = [Co(NH
3
3
)
)
5
5
SO
SO
4
4
]
]
+
+
+ Br
+ Br
-
-
Br
Br
-
-
+ Ag
+ Ag
+
+
= AgBr (żółty osad)
= AgBr (żółty osad)
Jak te związki reagują z BaCl
Jak te związki reagują z BaCl
2
2
i AgNO
i AgNO
3
3
?
?
[Co(NH
[Co(NH
3
3
)
)
5
5
Br]SO
Br]SO
4
4
= [Co(NH
= [Co(NH
3
3
)
)
5
5
Br]
Br]
2+
2+
+ SO
+ SO
4
4
2-
2-
SO
SO
4
4
2-
2-
+ Ba
+ Ba
2+
2+
= BaSO
= BaSO
4
4
(biały osad)
(biały osad)
[Co(NH
[Co(NH
3
3
)
)
5
5
SO
SO
4
4
]Br = [Co(NH
]Br = [Co(NH
3
3
)
)
5
5
SO
SO
4
4
]
]
+
+
+ Br
+ Br
-
-
Br
Br
-
-
+ Ag
+ Ag
+
+
= AgBr (żółty osad)
= AgBr (żółty osad)
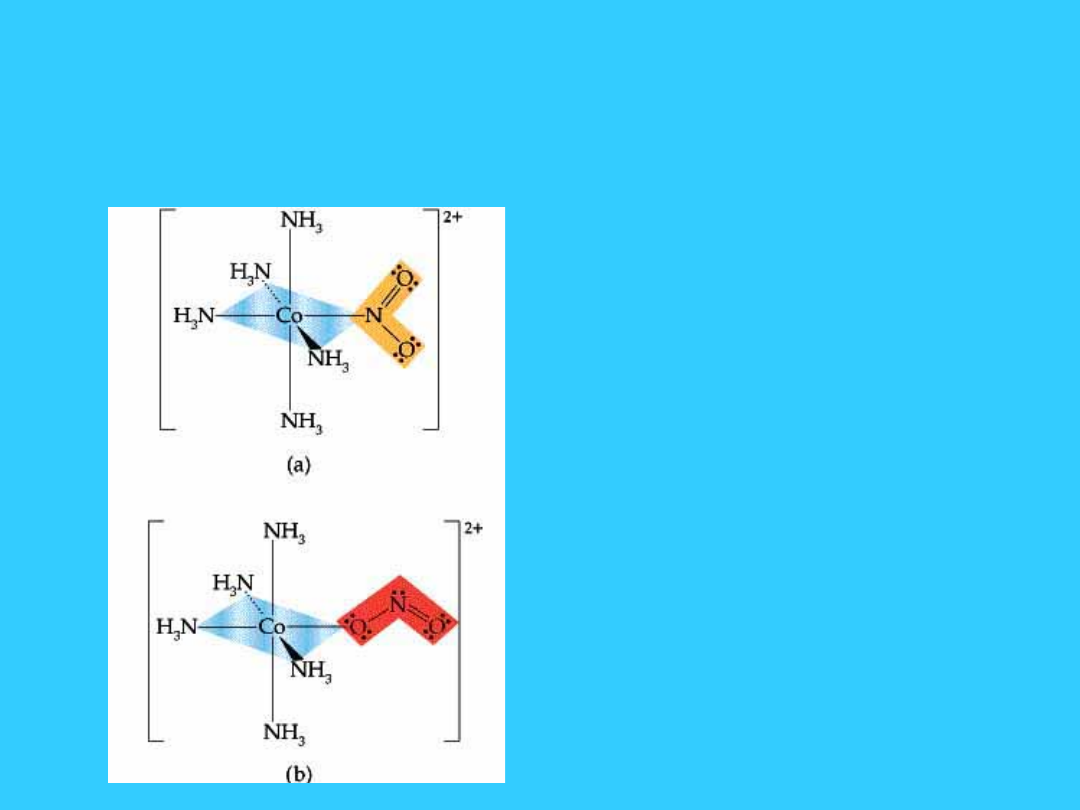
24
24
Izomeria strukturalna -
izomeria wiązaniowa
• Ligand może łączyć się
z atomem centralnym
za pośrednictwem
dwóch różnych atomów
• a) jon
pentaamina(nitrito-
N)kobaltu(II)
• b) jon
pentaamina(nitrito-
O)kobaltu(II)

25
25
Izomeria strukturalna -
izomeria hydratacyjna
• [Cr(H
2
O)
6
]Cl
3
fioletowy
• 3Cl
-
+ 3Ag
+
= 3AgCl
• [Cr(H
2
O)
5
Cl]Cl
2
×H
2
O niebieski
• 2Cl
-
+ 2Ag
+
= 2AgCl
• [Cr(H
2
O)
4
Cl
2
]Cl×2H
2
O zielony
• Cl
-
+ Ag
+
= AgCl
• różne produkty odwodnienia - oddawanie
cząsteczek wody spoza sfery
koordynacyjnej

26
26
Izomeria strukturalna -
izomeria koordynacyjna
• Kation i anion w związku koordynacyjnym
są kompleksami:
•
[Cr(NH
3
)
6
][Co(CN)
6
-heksacyjanokobaltan(III)
heksaaminachromu(III)
•
[Co(NH
3
)
6
][Cr(CN)
6
]-
heksacyjanochromian(III)
heksaaminakobaltu(III)

27
27
Stereoizomeria
• Różne rozmieszczenie ligandów wokół jonu
centralnego. Występuje w przypadku gdy liczba
koordynacji wynosi co najmniej 4 i nie pojawia
się nigdy jeżeli ligandy są takie same.
• Izomeria optyczna - dwie odmiany odznaczające
się zdolnością skręcania płaszczyzny polaryzacji
światła przechodzącego przez tę substancję.
Obydwie odmiany skręcają płaszczyznę
polaryzacji o taki sam kąt ale w przeciwnych
kierunkach (odmiana prawo- i lewoskrętna).Taką
własność wykazują kompleksy nie mające żadnej
płaszczyzny symetrii ani środka symetrii.
• Izomeria geometryczna - stereoizomery
zawierają przynajmniej jedna płaszczyznę
symetrii lub środek symetrii i nie są aktywne
optycznie.
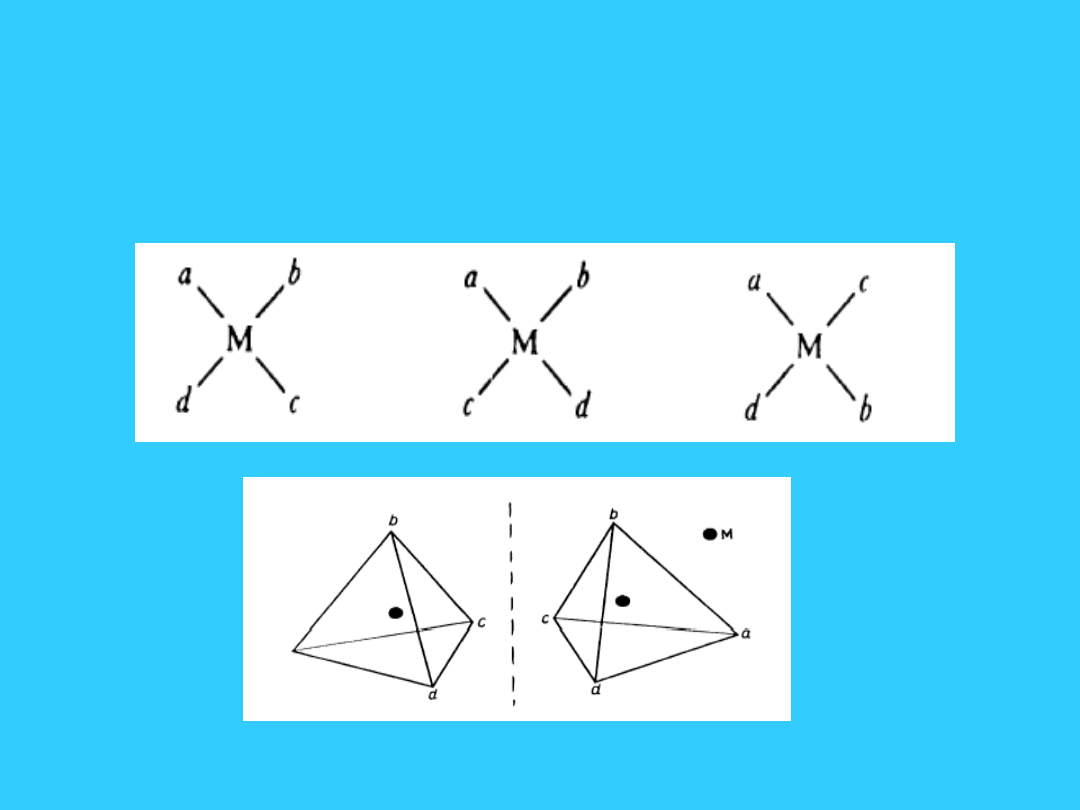
28
28
Stereoizomeria -
kompleksy Mabcd
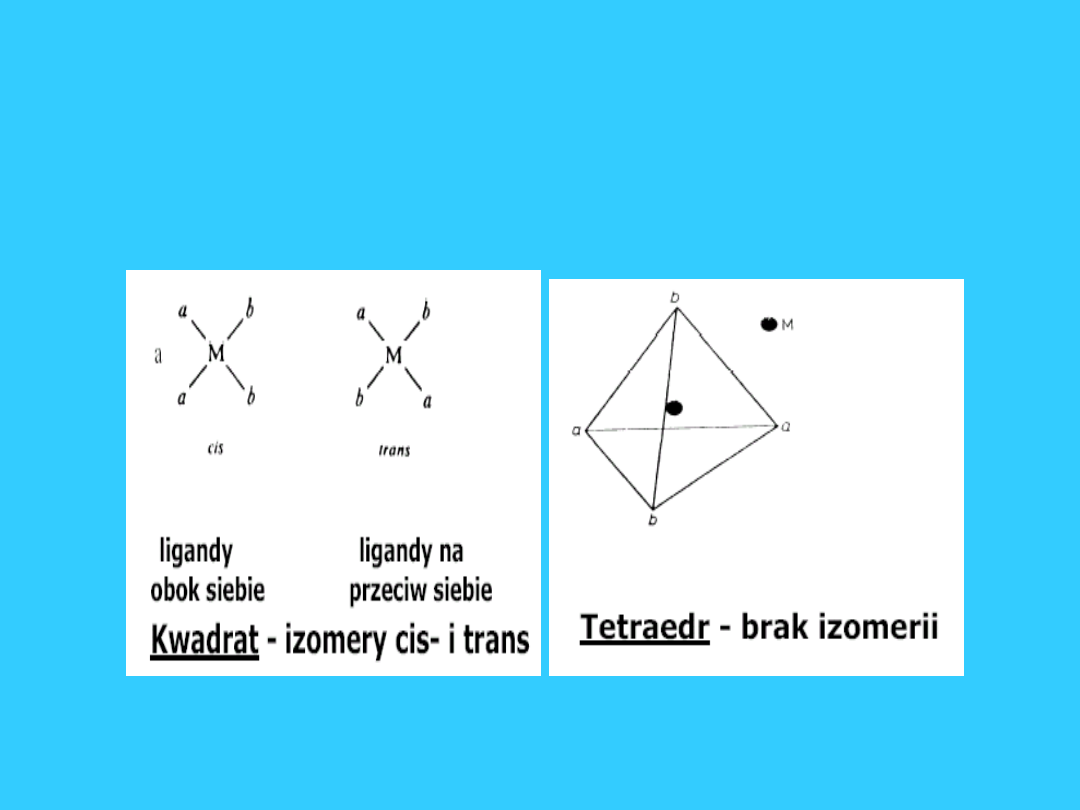
29
29
Stereoizomeria -
kompleksy Ma
2
b
2
30
30
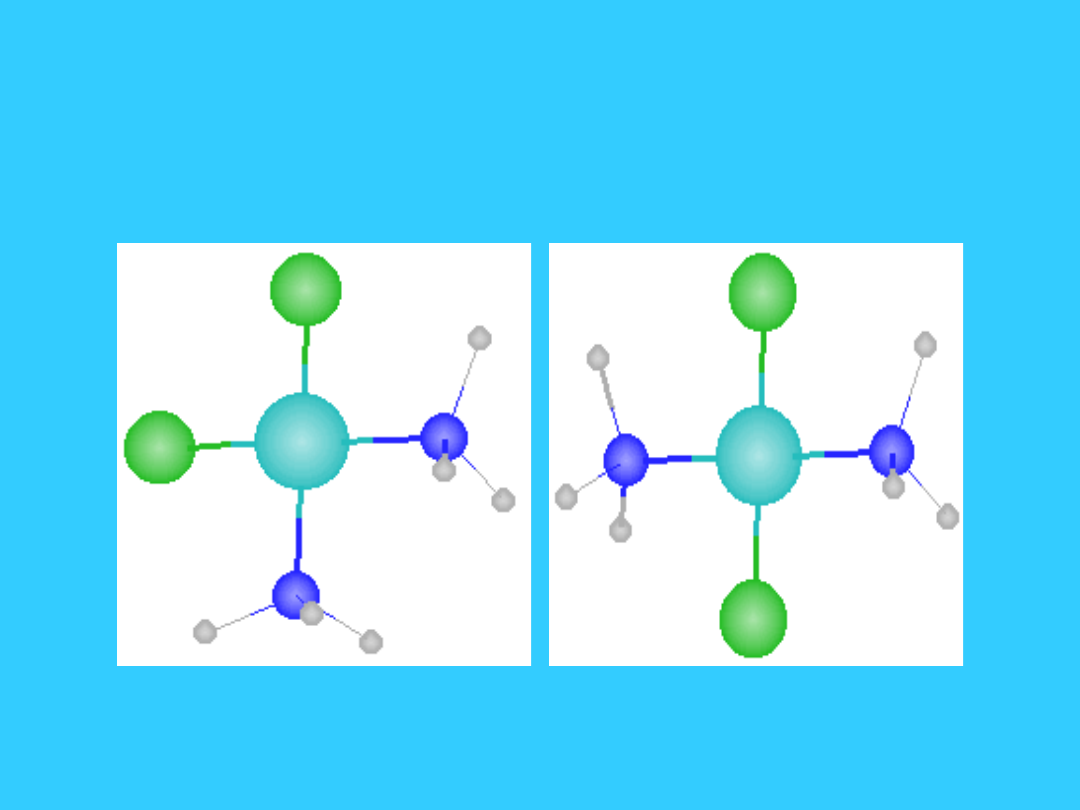
Izomeria geometryczna
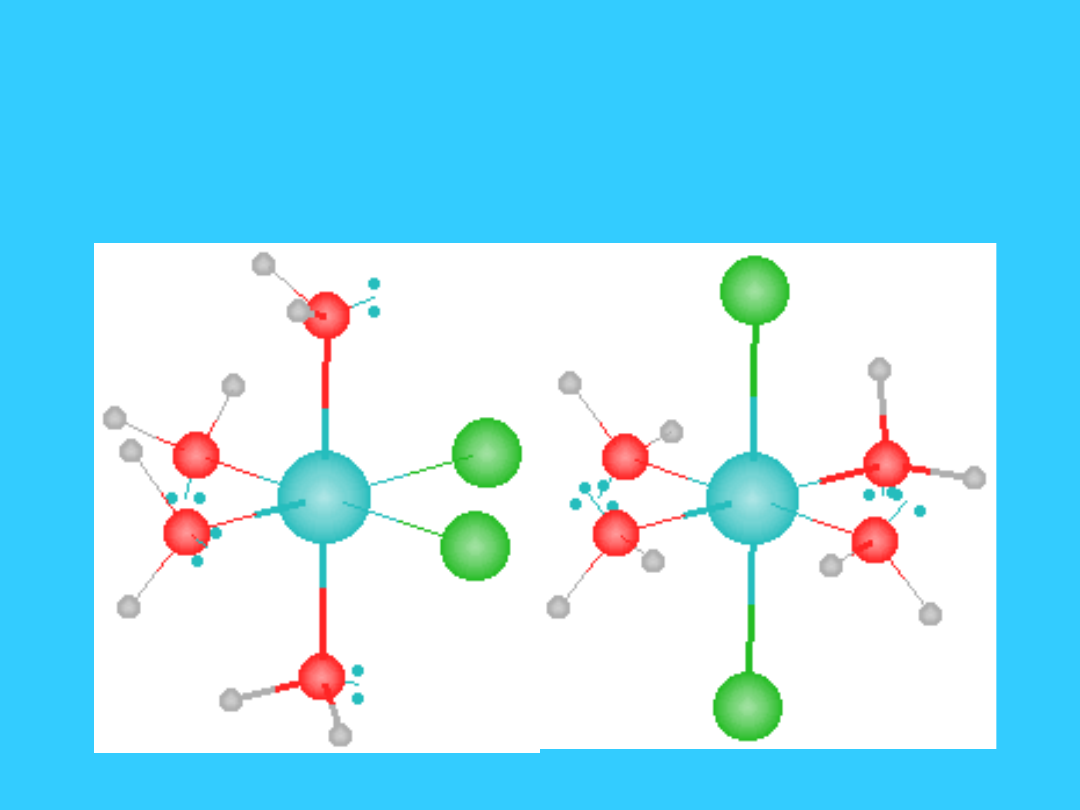
cis
izomer
trans
izomer
Pt(NH
3
)
2
Cl
2
31
31
Izomeria geometryczna
[Co(H
2
O)
4
Cl
2
]
+
cis izomer -
fioletowy
trans izomer -
zielony
32
32
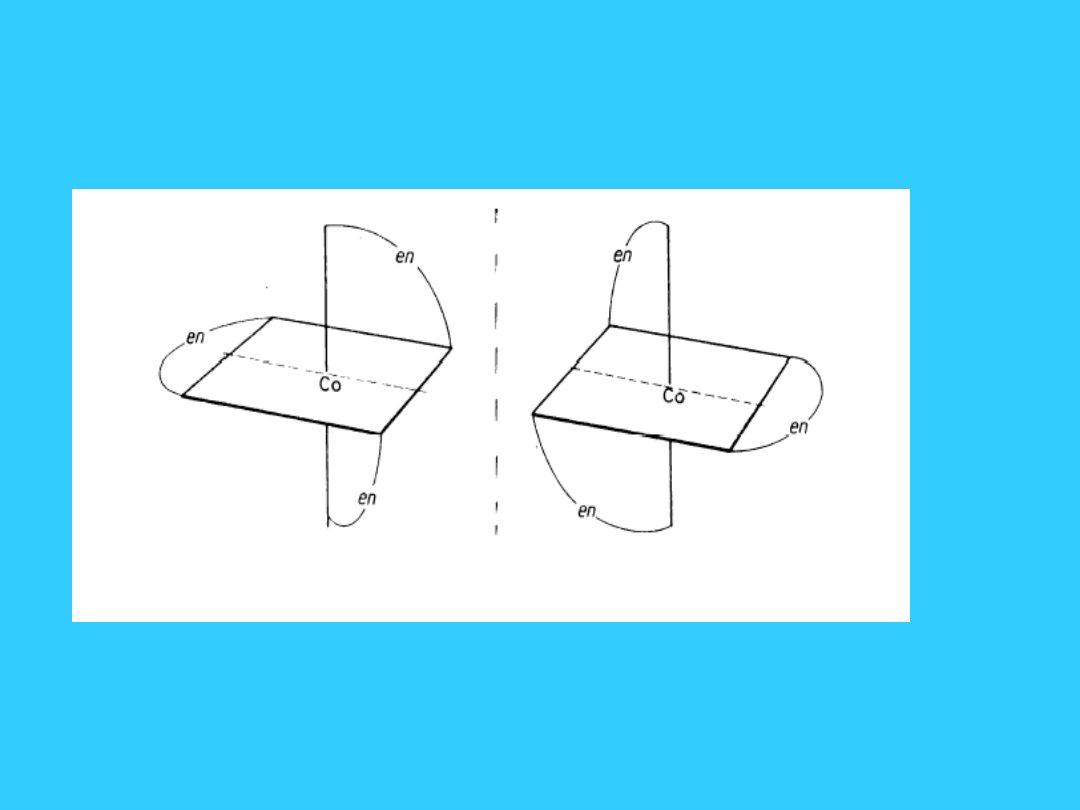
Izomeria optyczna
•
kompleks chelatowy
tris(etylenodiamina)kobaltu(III) - dwa
izomery optyczne

33
33
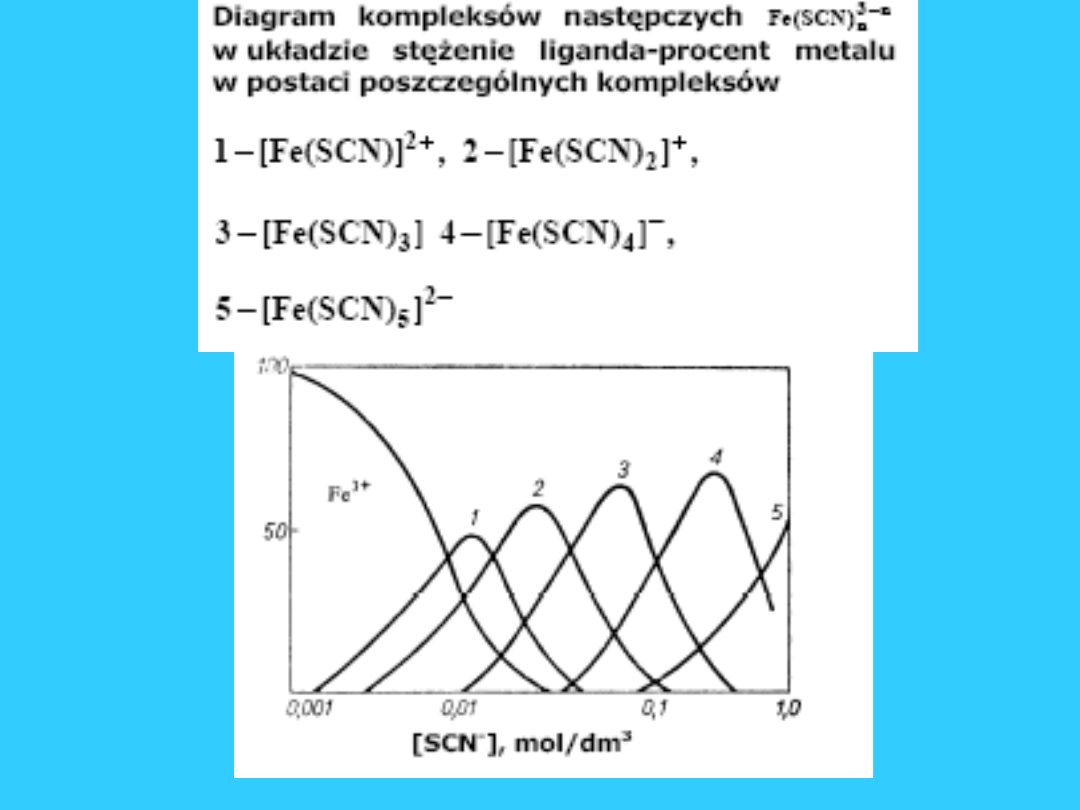
Równowagi w roztworach
wodnych związków
kompleksowych

34
34
Równowagi w roztworach
wodnych związków
kompleksowych

35
35
Równowagi w roztworach
wodnych związków
kompleksowych
36
36

37
37
Trwałość kompleksów
chelatowych

38
38
Trwałość kompleksów
chelatowych
Ni(H
2
O)
6
2+
+ 6NH
3
= Ni(NH
3
)
6
2+
+ 6H
2
O
log
6
= 8.6
Ni(H
2
O)
6
2+
+ 3NH
2
CH
2
CH
2
NH
2
= Ni(en)
3
2+
+
6H
2
O log
3
= 18.3
-RTlnK = G
0
= H
0
- TS
0

39
39
Własności kompleksów
metali przejściowych
– zazwyczaj posiadają kolor zależny od rodzaju
liganda i jonu centralnego
– wiele z nich ma własności paramagnetyczne
» ze względu na niesparowane elektrony d
» stopień paramagnetyzmu zależy od
liganda
•[Fe(CN)
6
]
3-
posiada jeden niesparowany
elektron
•[FeF
6
]
3-
posiada 5 niesparowanych
elektronów

40
40
Teoria pola krystalicznego
– Model wiązania w związkach
kompleksowych metali przejściowych
» wiązanie pomiędzy centralnym
kationem należącym do grupy
przejściowej, a ligandami jest
wiązaniem jonowym
» rozpatruje wpływ pola ujemnych
ligandów otaczających kation na
energię jego orbitali d
– Ligandy = punktowe ładunki ujemne
oddziaływujące elektrostatycznie z
jonem centralnym
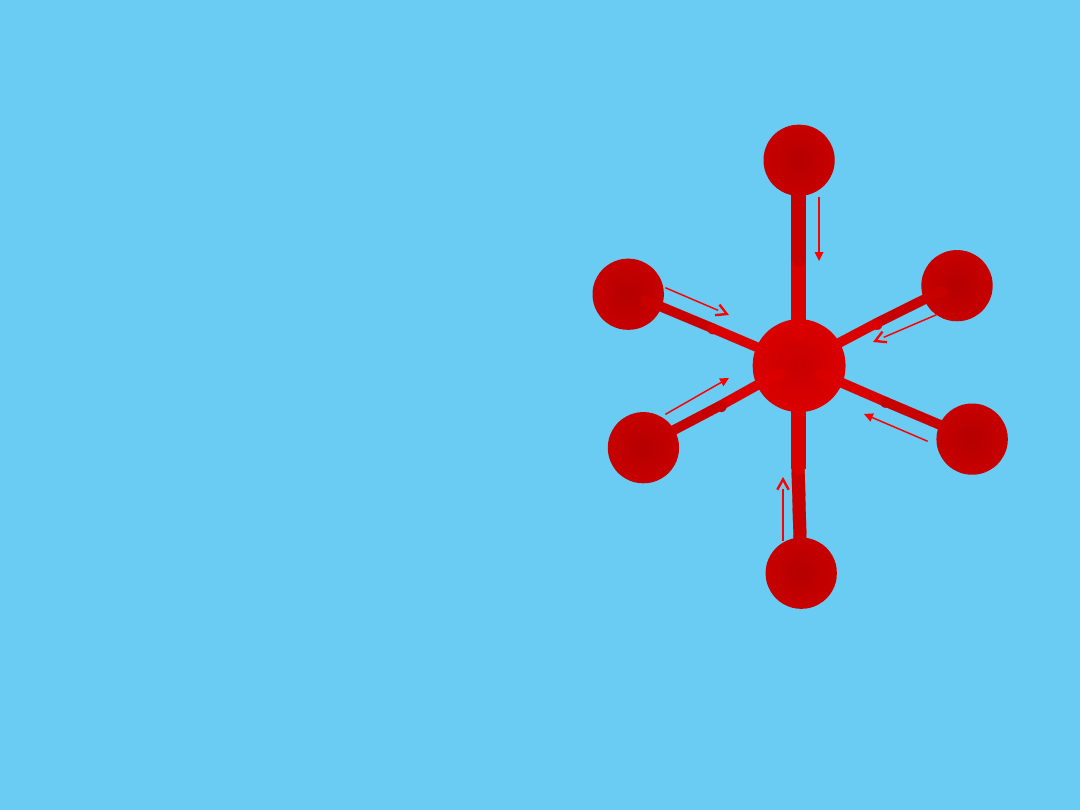
Ligandy zbliżają się do kationu
centralnego wzdłuż dodatnich i
ujemnych kierunków osi x, y, z
(-) Ligandy
przyciągane przez (+)
jon metalu;
oddziaływanie
zapewnia stabilność
Pole oktaedryczne
Oddziaływanie
odpychające
elektronów orbitali d i
(–) ligandów; powoduje
wzrost energii
potencjalnej orbitali d
+
-
-
-
-
-
-
Teoria pola krystalicznego
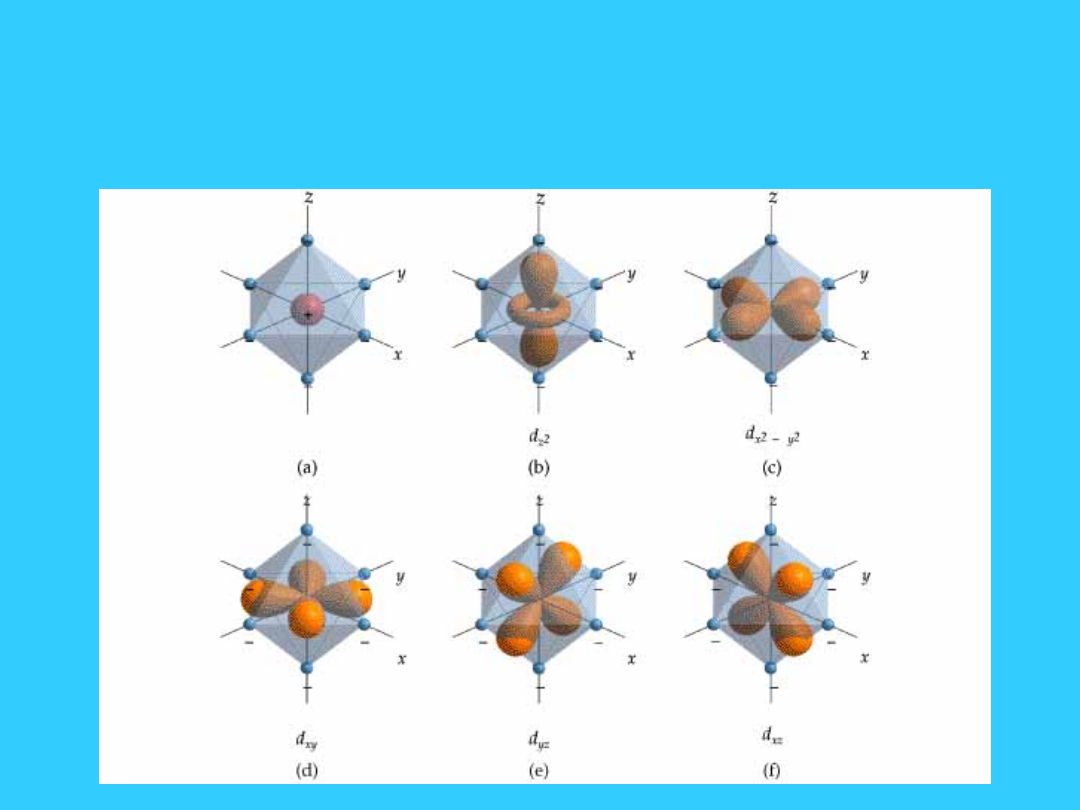
42
42
Oktaedryczne pole
krystaliczne

45
45
_ _
_ _
_
d
z
2
d
y
z
d
x
z
d
x
y
d
x
2
- y
2
_ _ _ _ _
Izolowan
y kation
metalu
orbitale
d
kation metalu w
otoczeniu
oktaedrycznym
E
poziomy
energetyczne
orbitali d
Oktaedryczne pole
krystaliczne
e
g
e
g
t
2g
t
2g
symbol g oznacza środek symetrii
symbol g oznacza środek symetrii
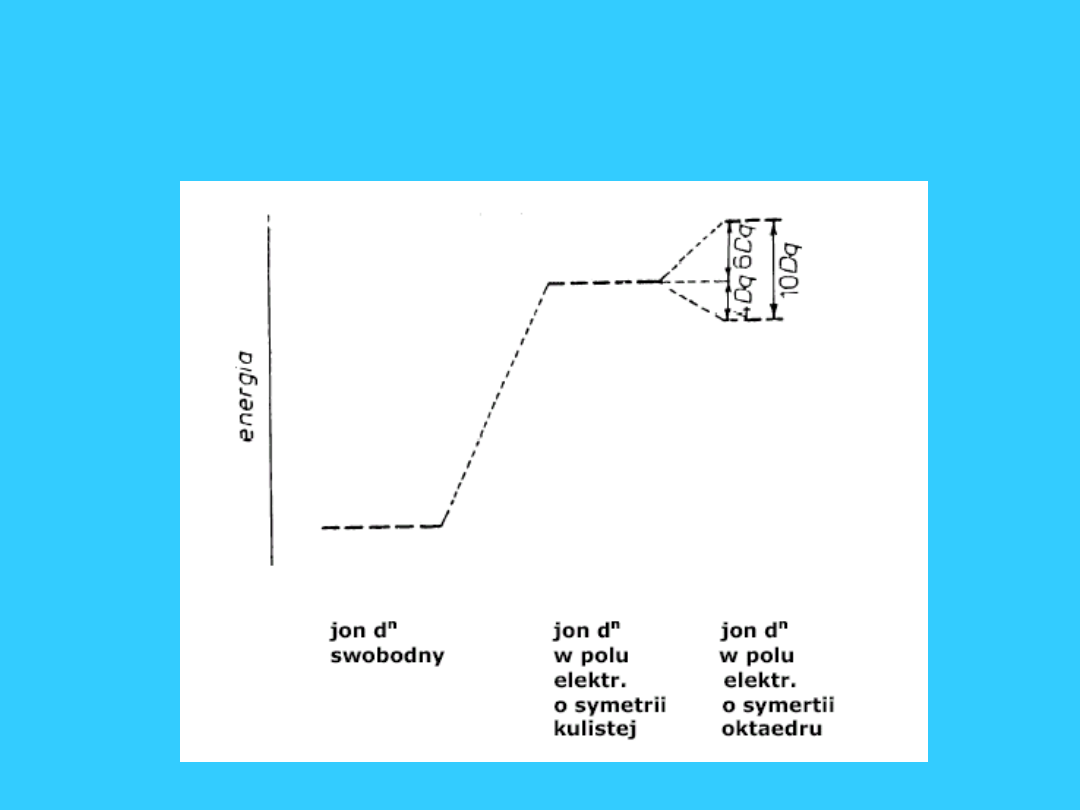
46
46
Oktaedryczne pole
krystaliczne
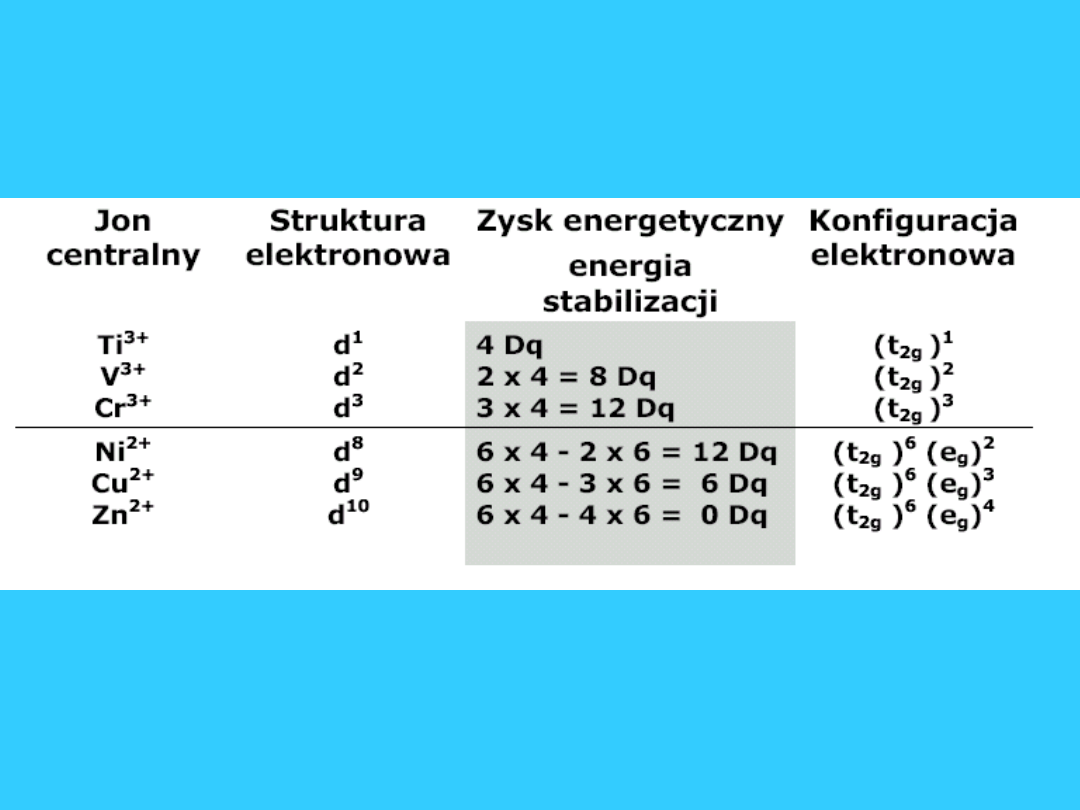
47
47
Oktaedryczne pole
krystaliczne
Konfiguracja dla struktur d
4
- d
7
zależy od
wartości 10 Dq. Wartość ta zależy od natężenia
pola elektrycznego wytwarzanego przez ligandy.
Im silniejsze pole tym większe rozszczepienie
orbitali d
Konfiguracja dla struktur d
4
- d
7
zależy od
wartości 10 Dq. Wartość ta zależy od natężenia
pola elektrycznego wytwarzanego przez ligandy.
Im silniejsze pole tym większe rozszczepienie
orbitali d

48
48
Szereg spektrochemiczny
[Fe(CN)
6
]
3-
posiada jeden niesparowany elektron
[FeF
6
]
3-
posiada 5 niesparowanych elektronów
[Fe(CN)
6
]
3-
posiada jeden niesparowany elektron
[FeF
6
]
3-
posiada 5 niesparowanych elektronów

49
49
Konfiguracja elektronowa
kompleksów metali
przejściowych
• Obsadzanie orbitali d zależy od
parametru (10D) i energii
sparowywania elektronów, P
– Jeżeli
> P
(
silne pole ligandów)
» najpierw następuje sparowywanie
elektronów na niższym poziomie (t
2g
)
– Jeżeli
< P
(
słabe pole ligandów
pole ligandów)
» elektrony obsadzają pojedynczo wszystkie
orbitale d
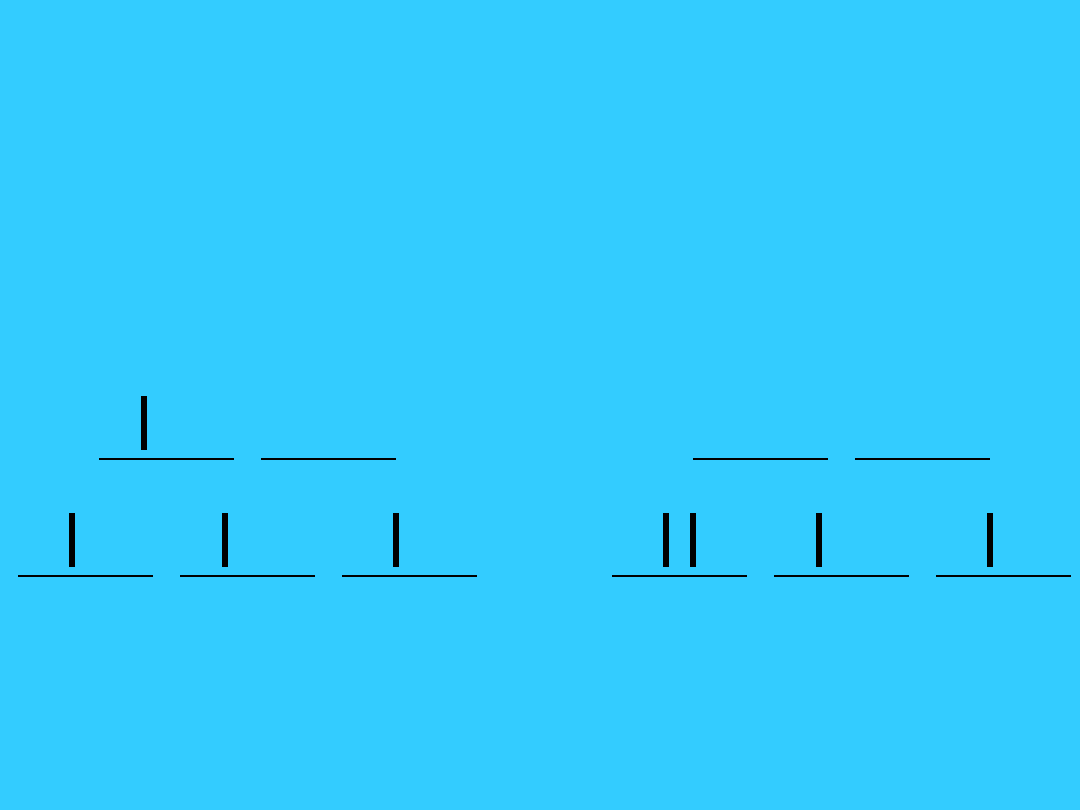
50
50
Konfiguracja elektronowa
kompleksów metali przejściowych
d
4
wysokospino
we
< P
niskospinow
e
> P
e
g
e
g
e
g
e
g
t
2g
t
2g
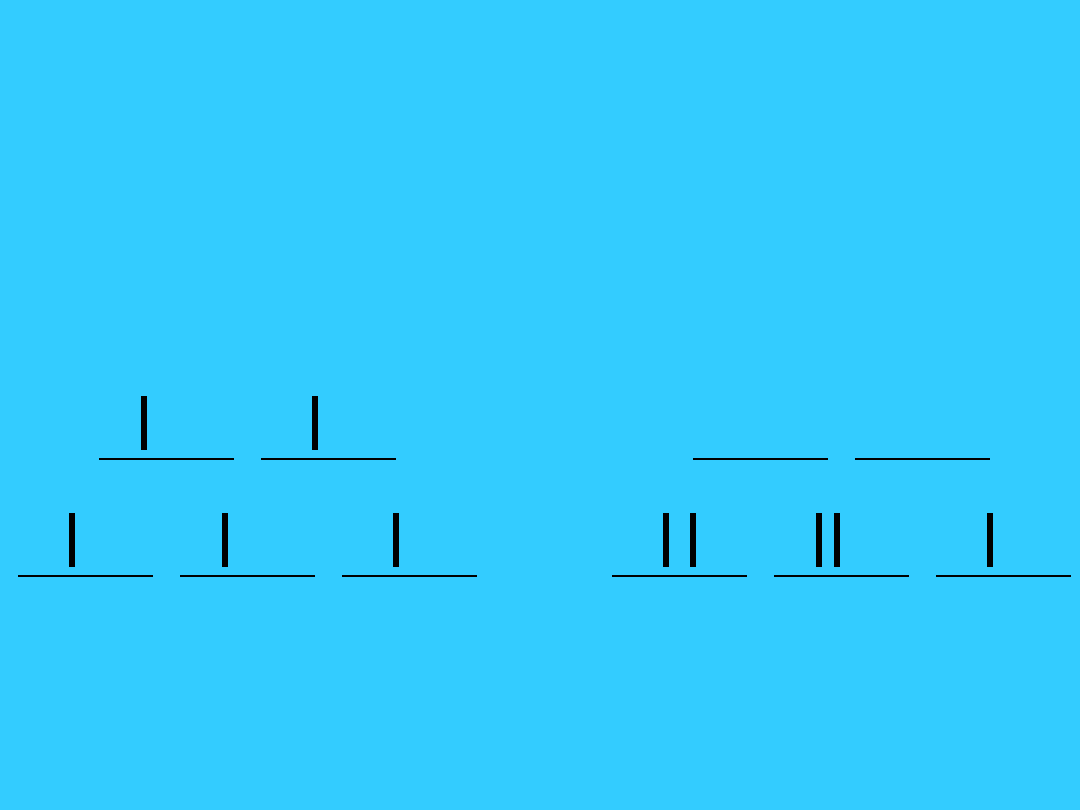
51
51
d
5
wysokospino
we
< P
niskospinow
e
> P
e
g
e
g
e
g
e
g
t
2g
t
2g
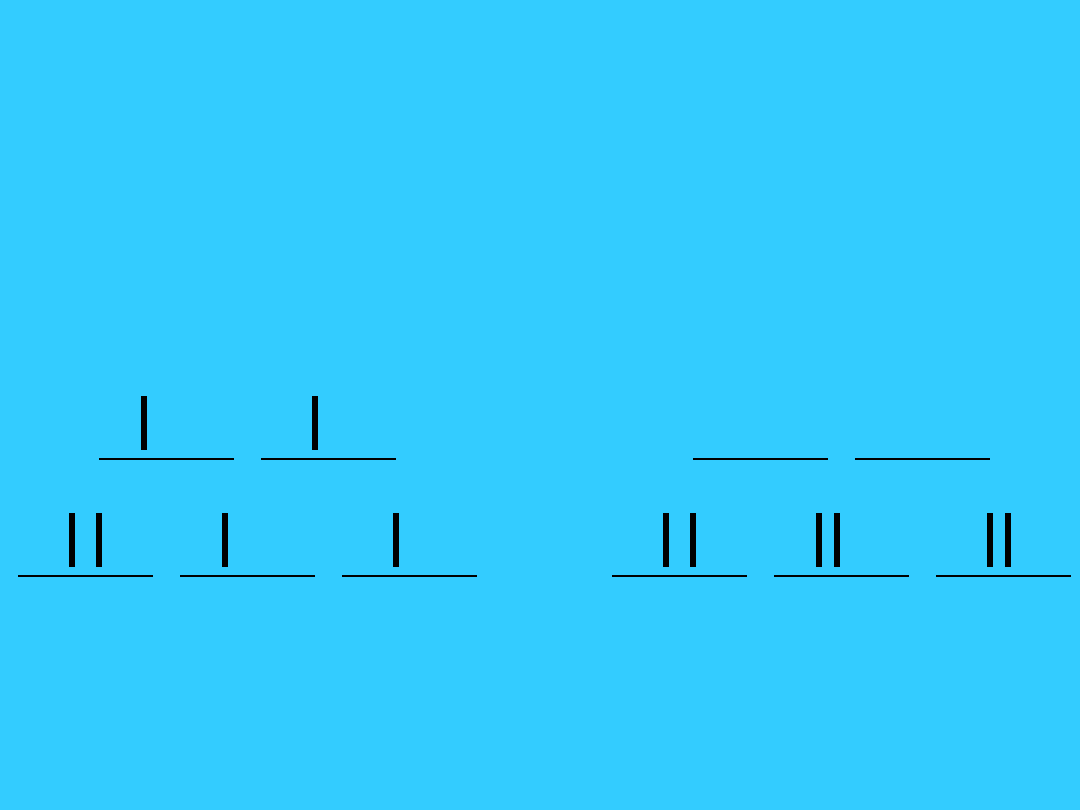
52
52
Konfiguracja elektronowa
kompleksów metali przejściowych
d
6
wysokospino
we
< P
niskospino
we
> P
e
g
e
g
e
g
e
g
t
2
g
t
2
g
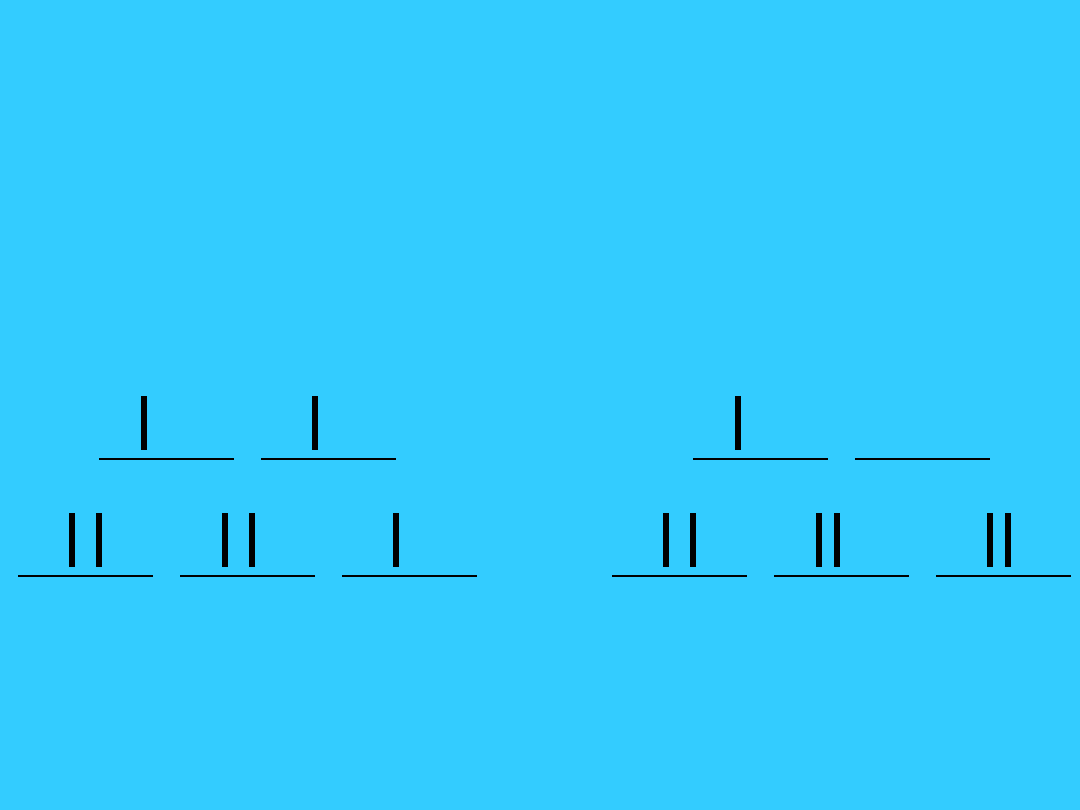
53
53
Konfiguracja elektronowa
kompleksów metali przejściowych
d
7
wysokospino
we
< P
niskospinow
e
> P
e
g
e
g
e
g
e
g
t
2g
t
2g
54
54
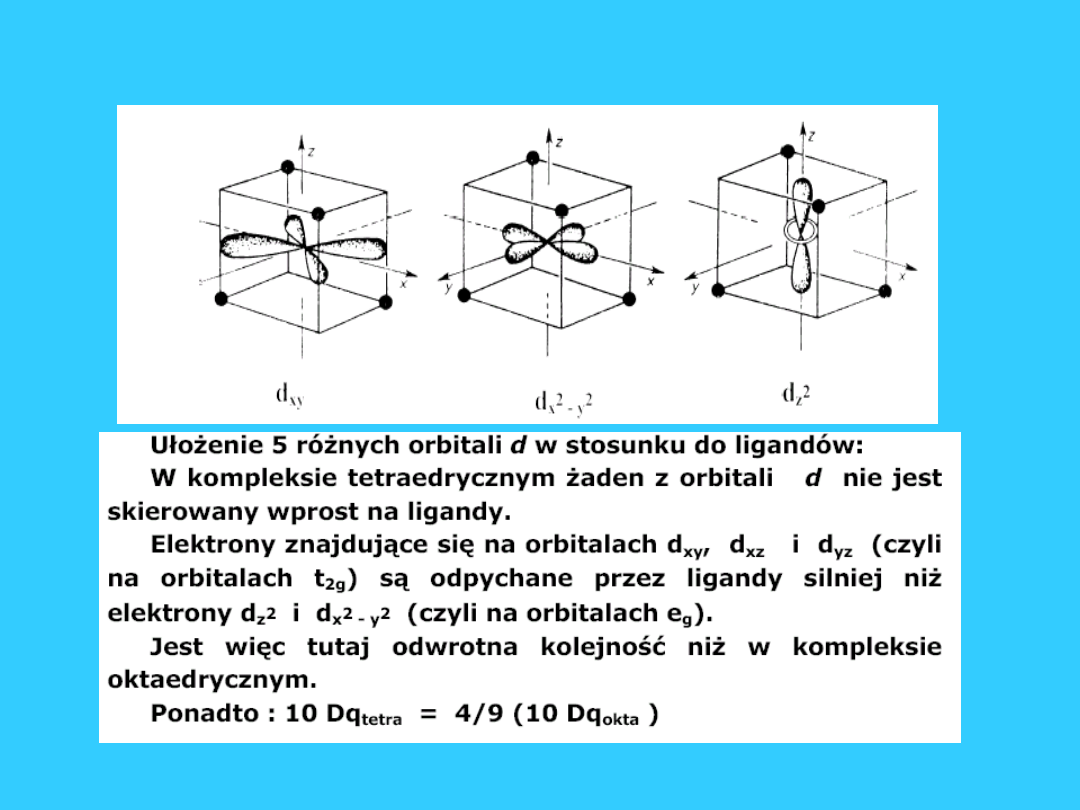
Tetraedryczne pole
krystaliczne
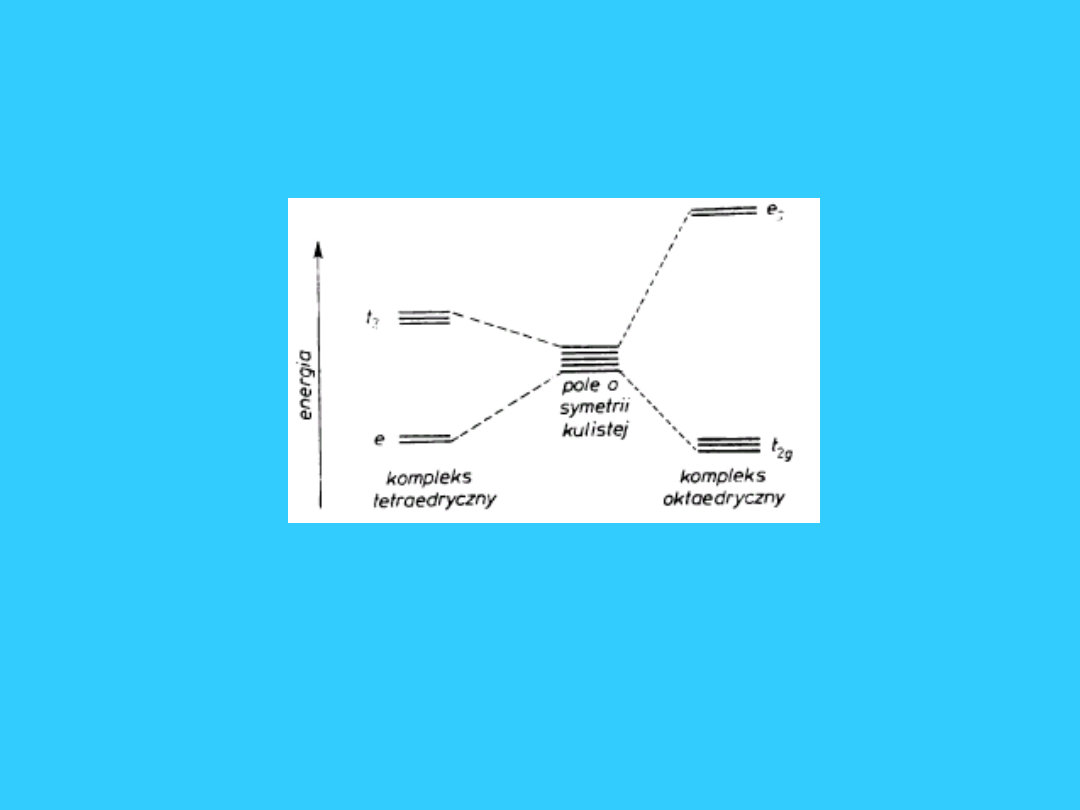
55
55
Tetraedryczne pole
krystaliczne

56
56
Kolory kompleksów metali
przejściowych
• Kolorowe kompleksy absorbują
promieniowanie w zakresie widzialnym
(400-700 nm). Promieniowanie nie
absorbowane jest transmitowane. Kolor
obserwowany jest uzupełniającym
kolorem w stosunku do koloru
zaabsorbowanego

57
57
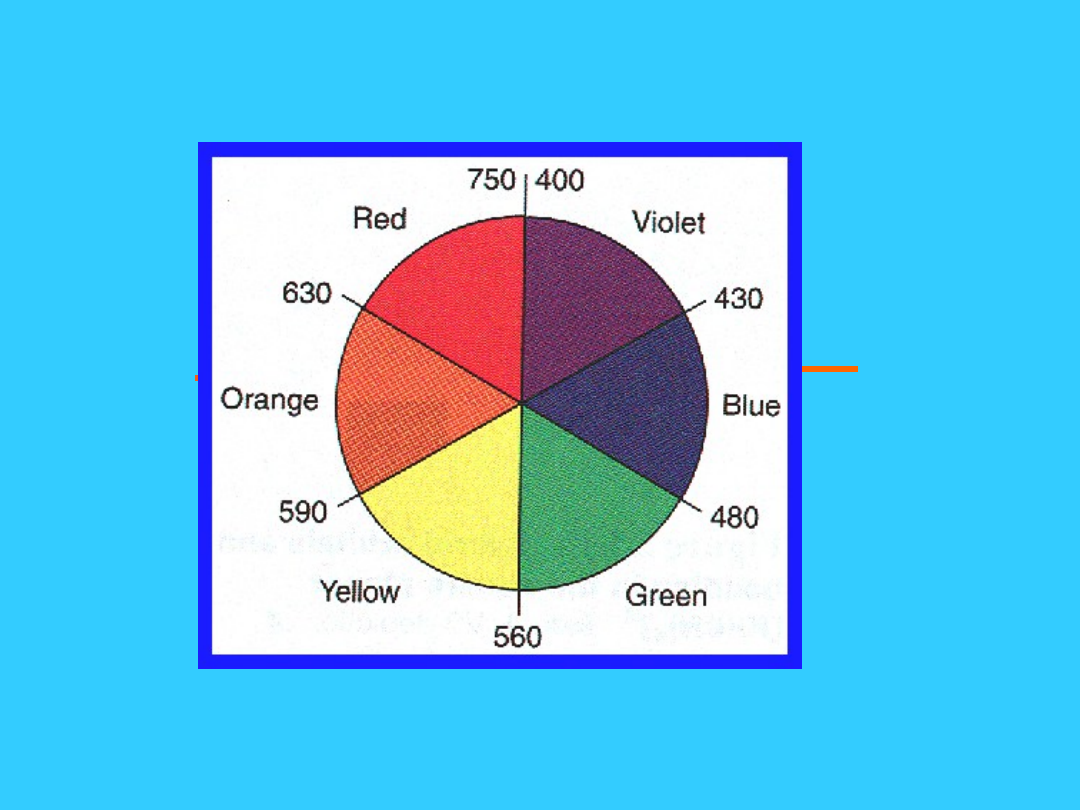
Światło widzialne
biały = wszystkie kolory (długości
fal)
400
nm
700
nm
długość fali, nm
wyższa
energia
niższa
energia
(Każda długość fali odpowiada
innemu kolorowi)
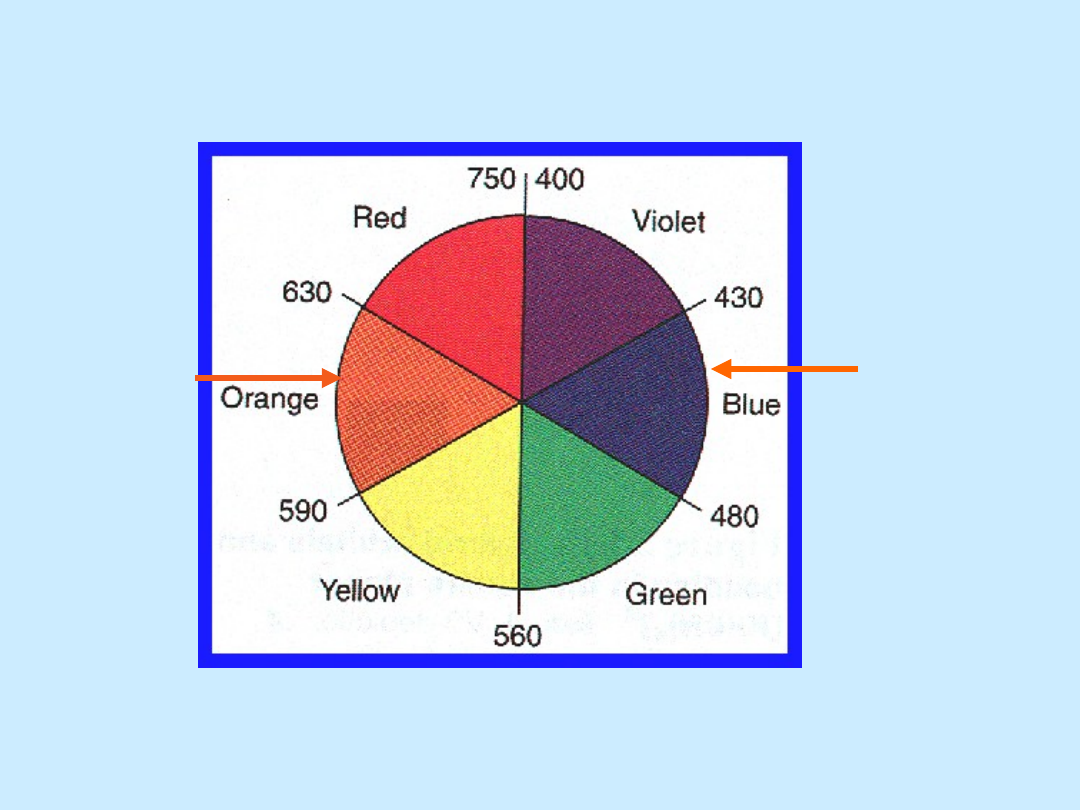
kolor
absorbo-
wany
kolor
obserw
o-wany

59
59
Kolory kompleksów metali
przejściowych
• Absosbcja promieniowania of UV-Vis przez
atom, jon, cząsteczkę:
– Następuje jeśli promieniowanie ma energię
potrzebną do przeniesienia elektronu ze stanu
podstawowego do stanu wzbudzonego
» t.j., z obritalu o niższej energii na orbital o
wyższej energii
» energia promieniowania zaabsorbowana =
różnica enegii stanu wzbudzonego i
podstawowego
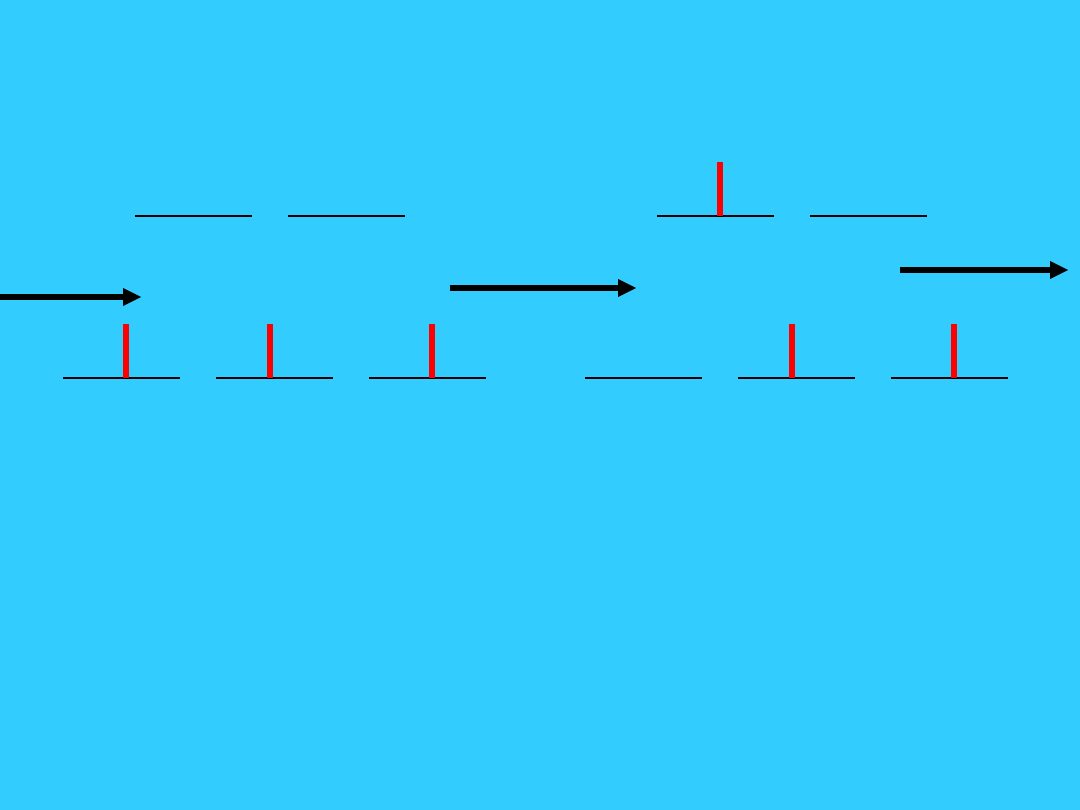
60
60
białe
świat
ło
Czerwone
światło
zaabsorbow
ane
Zielone
światło
obserwowa
ne
Dla kompleksów
metali przejściowych,
odpowiada energii
światła widzialnego.
Absorbcja
promieniowania
powoduje przejście
elektronu ze stanu
podstawowego do
stanu wzbudzonego
.
Kolory kompleksów metali
przejściowych

61
61
• Różne kompleksy mają różne kolory
ponieważ:
– Kolor światła zaabsorbowanego zależy od
» Im większe tym większa energia
promieniowania zaabsorbowanego
•Mniejsza długość fali
» Im mniejsze tym niższa energia
promieniowania zaabsorbowanego
•Większa długość fali
– wielkość zależy od:
» ligandów
» metalu
Kolory kompleksów metali
przejściowych
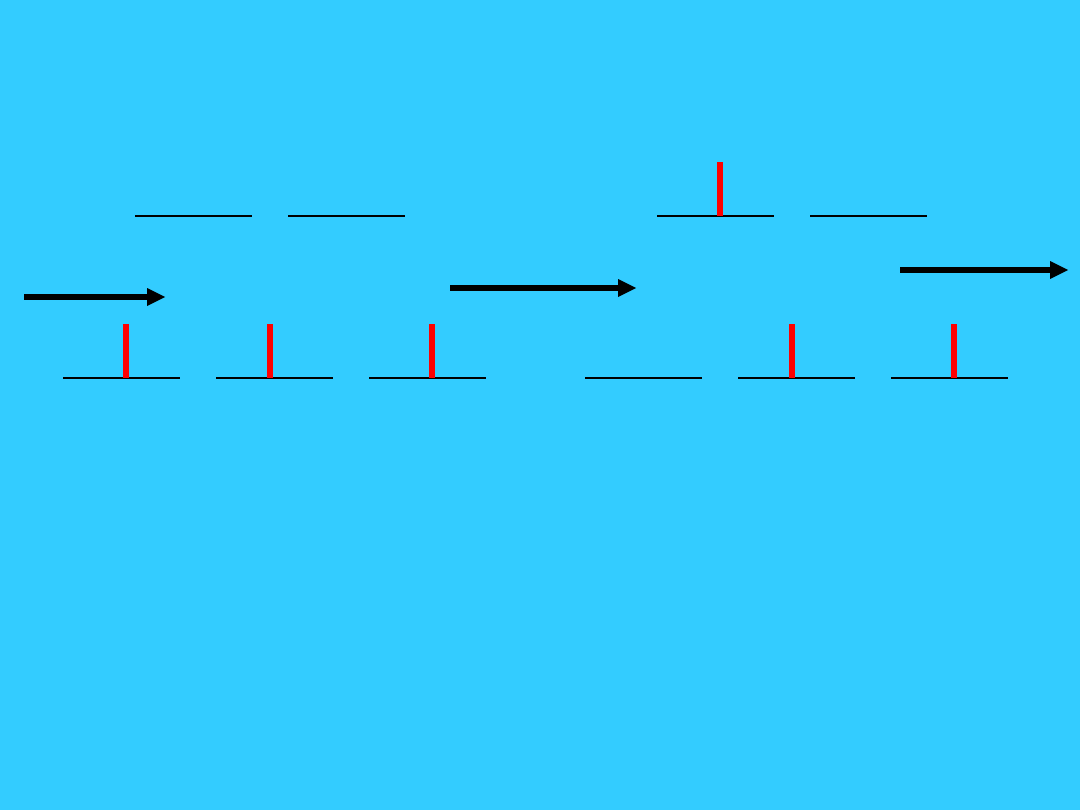
62
62
białe
światł
o
czerwone
światło
zaabsorbo
wane
(niższa
energia)
Zielone
światło
obserwow
ane
[M(H
2
O)
6
]
3+
Kolory kompleksów metali przejściowych
Kolory kompleksów metali przejściowych
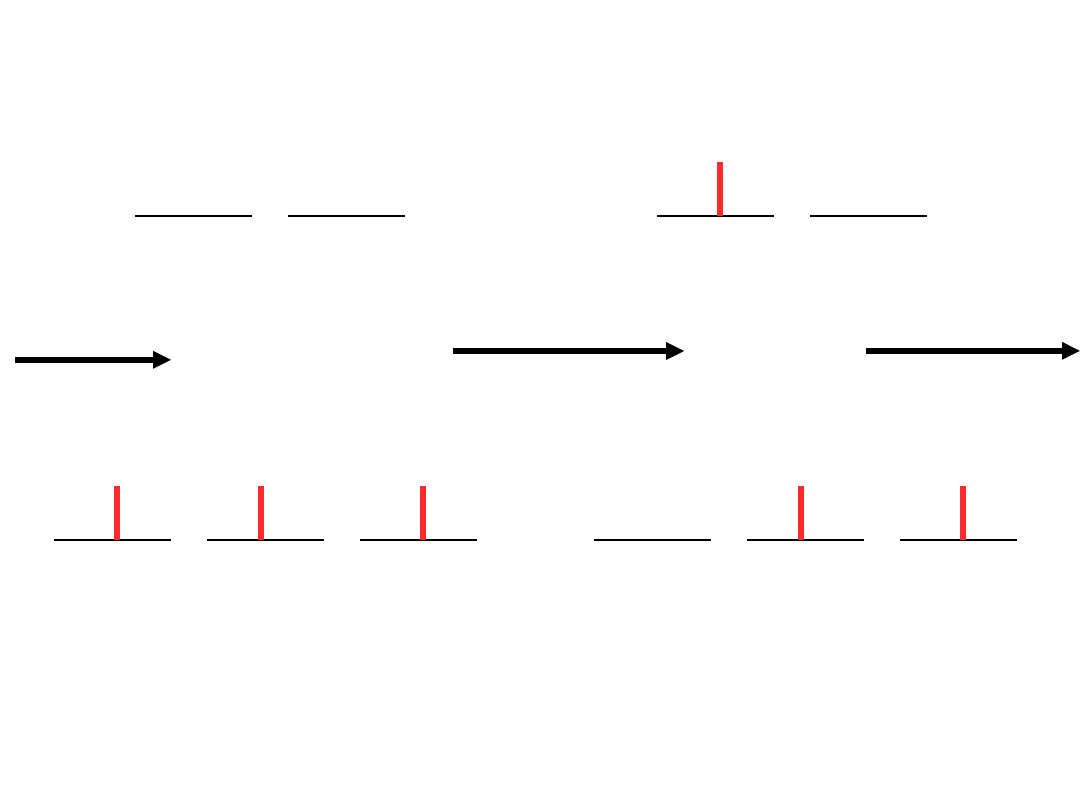
63
63
białe
świat
ło
Niebiesk
ie
światło
zaabsor
bowane
(wyższa
energia
)
Pomarańcz
owe światło
obserwowa
ne
[M(en)
3
]
3+
Kolory kompleksów metali
przejściowych
65
65
kolor
absorbo-
wany
kolor
obserw
o-wany
66
66
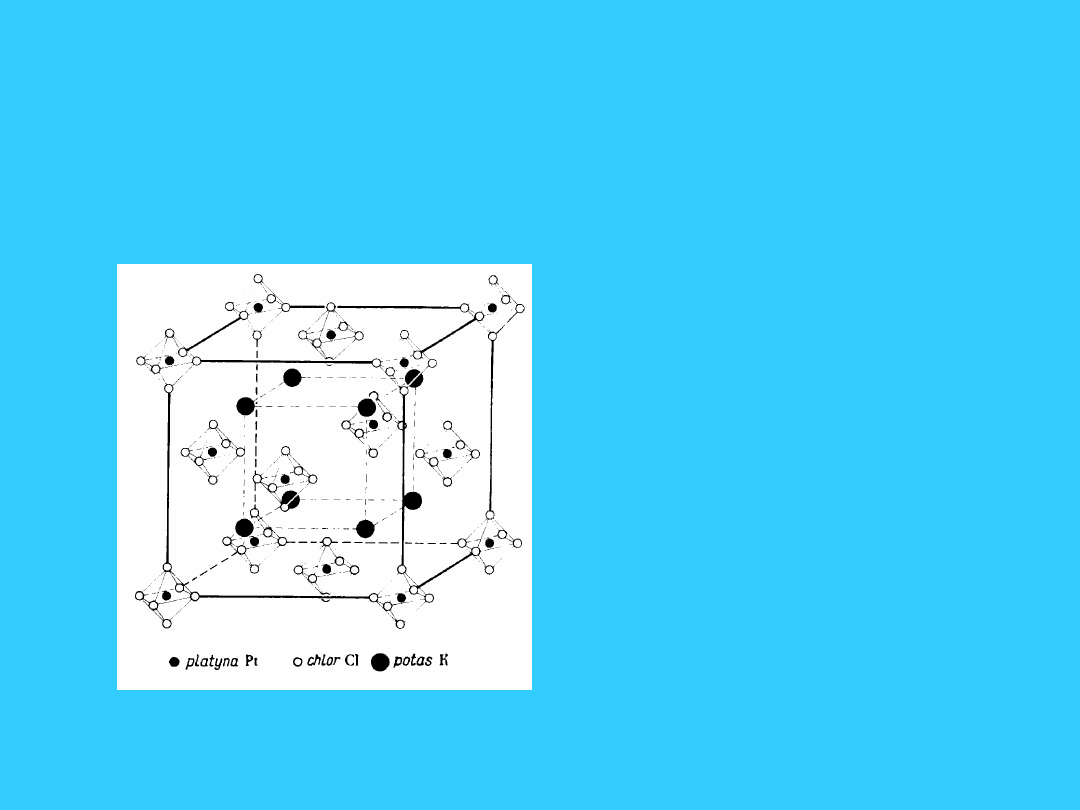
Komórki elementarne
związków kompleksowych
• związki
kompleksowe:
• K
2
PtCl
6
•
• K
+
PtCl
62-
• [Ni(NH
3
)
6
]Cl
2
• [Ni(NH
3
)
6
]
2+
Cl
-
• struktura
oktaedryczna
67
67
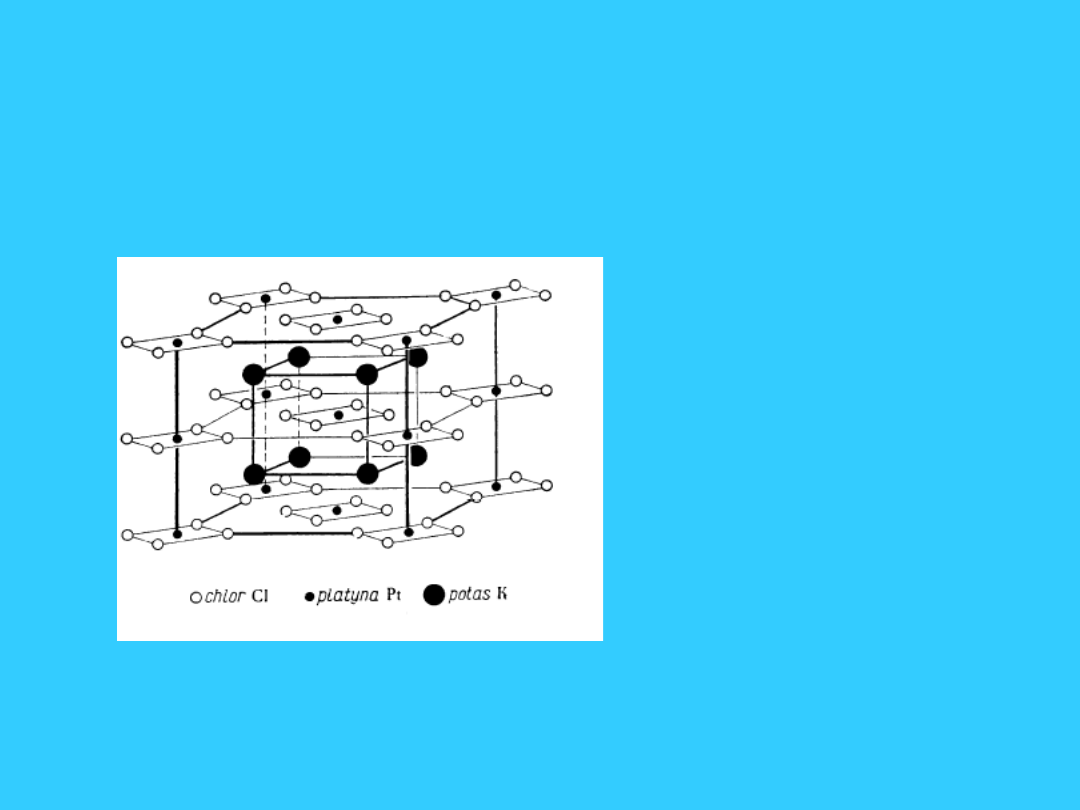
Komórki elementarne
związków kompleksowych
• związek
kompleksowy:
• K
2
PtCl
4
• struktura płaska
kwadratowa

68
68
69
69
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
Wyszukiwarka
Podobne podstrony:
Związki kompleksowe, AGH różne, chemia wykłady
Leszek wyklad10 zwiazki kompleksowe
ZWIĄZKI KOMPLEKSOWE, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
Psychologia ogólna Kulturowa psychologia rodziny Socha wykład 10 Modele zwiazku
wyklad 10 MNE
wyklad 10
Wyklady 10 12c PRCz
wyklad 10
zwiazki kompleksowe 2
Wyklad 10 Wypalenie zawodowe i jego konsekwencje
Wykład 10 dodatek
Wykład 8 10
25 Wyklad 1 Dlaczego zwiazki sa wazne
więcej podobnych podstron