Pożywki mikrobiologiczne
Pożywka
Cecha
Skład
Zdjęcie
Müller i
Kauffmann
Wybiórczo-namnażająca, izolacja
Salmonella Spp., hamuje rozwój
drobnoustrojów G+
Zieleo krystaliczna,
nowomycyna
(opcjonalnie)
Levine (EMB)
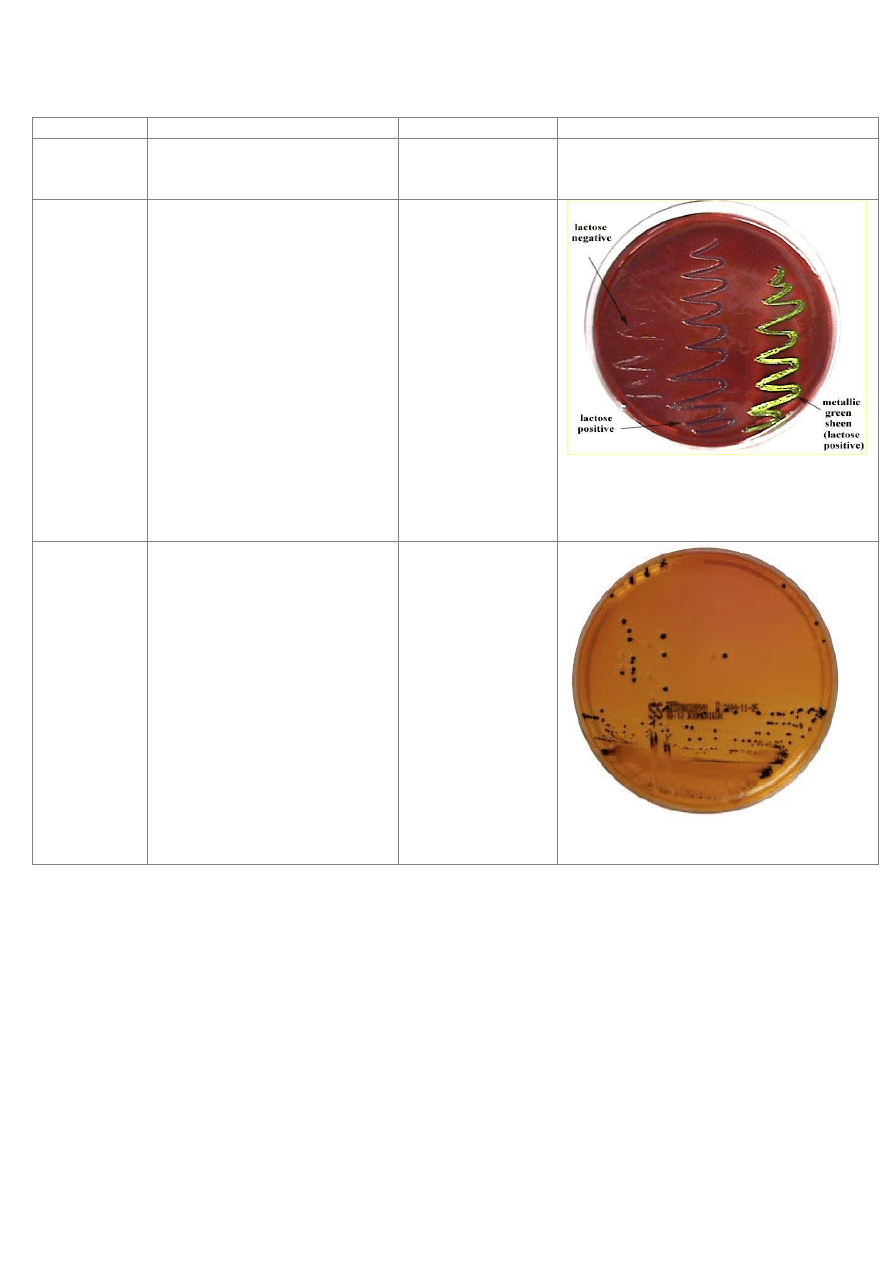
Podłoże wybiórczo-różnicujące dla
Enterobacteriaceae.
Drobnoustroje fermentujące
laktozę i sacharozę tworzą na tym
podłożu kolonie zabarwione na
kolor czerwono-fioletowy,
niekiedy z metalicznym,
zielonkawym połyskiem. Bakterie
nie fermentujące laktozy lub
fermentujące ją z opóźnieniem
tworzą kolonie przejrzyste lub
nieco opalizujące. Zahamowany
jest wzrost drobnoustrojów Gram-
dodatnich. Niektóre jednak z nich
(paciorkowce kałowe, drożdżaki)
wyrastad mogą jako drobne,
wypukłe, matowe kolonie.
czynnikiem
wybiórczym jest
błekit metylenowy,
czynnikiem
różnicującym jest
laktoza i sacharoza,
wskaźnikiem pH jest
eozyna.
Podłoże dla
Salmonella i
Shigella (S.S.)
Podłoże "SS" jako wybiórczo-
różnicujące używane jest do
izolowania pałeczek Salmonella i
Shigella z kału i innego materiału.
Pałeczki Shigella i Salmonella
tworzą kolonie przejrzyste i
bezbarwne. Podłoże hamuje w
dużym stopniu wzrost pałeczek
Eschericha coli, których kolonie
wybarwiają się na kolor różowy.
Drobnoustroje produkujące
siarkowodór tworzą kolonie z
czarnymi środkami. Podłoże
hamuje mgławicowy wzrost
pałeczek Proteus oraz Gram-
dodatnich drobnoustrojów.
składniki różnicujące
- chlorek sodowy,
tiosiarczan i
cytrynian sodowy
oraz barwniki
(czerwieo obojętna,
zieleo brylantowa).
Innymi składnikami
jest laktoza i
dezoksychloran sodu

Podłoże z
mannitolem i
solą wg
Chapmana
(MSA)
Podłoże wybiórczo różnicujące,
stosowana do hodowli
gronkowców. Wykorzystuje się w
niej fakt, że stafylokoki
(gronkowce) są w stanie rosnąd
przy wysokim stężeniu chlorku
sodu, w przeciwieostwie do
większości pozostałych bakterii. S.
aureus i S. saprophyticus
fermentują mannitol, natomiast S.
epidermidis nie (element
różnicujący pożywki). S. aureus
można odróżnid od saprohyticus
testem na koagulazę - po
wrzuceniu do krwi pierwszy ścina
osocze, drugi nie.
S. aureus - gronkowiec złocisty w
warunkach tlenowych i względnie
beztlenowych wzrasta w postaci
kolonii otoczonych żółtą strefą -
zmiana barwy podłoża z różowej
na żółtą jest wynikiem rozkładu
mannitolu i zakwaszeniu
środowiska. Podobnie zachowują
się niektóre szczepy
Staphylococcus saprophyticus,
wykazujące te właściwości w
warunkach tlenowych.
Staphylococcus epidermidis nie
rozkłada mannitolu i rośnie w
postaci białych kolonii nie
powodując zmiany barwy podłoża
Poza czynnikami
wzrostu (bulion,
pepton) agar zawiera
również NaCl
(zazwyczaj w
stężeniu 7,5% dla
zahamowania
wzrostu bakterii
innych niż
gronkowce),
mannitol oraz
czerwieo fenolową.
Podłoże
MacConkey'a
Agar MacConkeya (wybiórczo-
różnicujacy) różnicuje bakterie
Gram-ujemne na fermentujące
(Lac+) i niefermentujące laktozę
(Lac-). Te drobnoustroje, które
posiadają zdolnośd fermentacji
laktozy zawartej w agarze (np.
Escherichia coli, Klebsiella)
zakwaszają podłoże do pH < 6,8.
Prowadzi to do powstania
czerwonych/różowych kolonii.
Bakterie Lac- takie jak Salmonella
czy Shigella zużywają peptony.
Wytworzony podczas reakcji
amoniak podwyższa pH podłoża –
powstają białe/bezbarwne
kolonie.
Poprzez selekcjonowanie bakterii
Gram-ujemnych i różnicowanie
pomiędzy patogenami jelitowymi,
takimi jak Escherichia coli i
Zawiera sole kwasów
żółciowych, fiolet
krystaliczny (hamuje
wzrost bakterii
Gram-dodatnich),
neutralną czerwieo
(barwi
drobnoustroje
fermentujące
laktozę), laktozę i
peptony.
Salmonella, agar MacConkeya jest
wykorzystywany do diagnostyki
przyczyn biegunki.
Wariant podłoża, agar
MacConkeya z sorbitolem,
umożliwia izolację i różnicowanie
enteropatogennych serotypów E.
coli.
Endo
Jest słabo selektywnym,
różnicującym(wybiórczo-
różnicuącym) podłożem
przeznaczonym do izolowania i
różnicowania szczepów
Enterobacteriaceae i niektórych
innych pałeczek Gram-ujemnych z
grupy coli i E. coli z próbek
pochodzenia klinicznego i
nieklinicznego.
Laktoza , Siarczan
sodu,
Fosforan
dwupotasowy,
Fuksyna
Podłoże
Kliglera
Zastosowanie podłoża
Podłoże do izolowania pałeczek
jelitowych z pożywek wybiórczo –
różnicujących.
Rozkład glukozy przejawia się
zakwaszeniem
i
zażółceniem
wyjściowo łososiowego podłoża.
Jeżeli będzie rozkładana laktoza,
żółte zabarwienie obu części
utrzymuje się przez wiele godzin
Brak rozkładu cukrów wiąże się z
alkalizacją pożywki, która pogłębia
swoją
wyjściową
barwę
–
przyjmując kolor czerwony
Wytwarzanie w czasie fermentacji
cukrów dużych ilości CO
2
lub H
2
uwidacznia się przez rozerwanie
lub unoszenie podłoża.
Tworzenie się H
2
S z tiosiarczanu
zachodzi powoli w kwaśnym
środowisku słupka i powoduje
powstawanie nierozpuszczalnego
czarnego strątu siarczku żelaza.
Podłoże zawiera
między innymi
glukozę i laktozę (w
proporcji 1:10),
tiosiarczan i jony
żelaza, które są
wskaźnikiem
wytwarzania H
2
S,
oraz wskaźnik pH.
Podłoże
Sołtysa
Podłoże wybiórcze izoluje pałeczki
z grupy Salmonella. Kolonie
Salmonella typhi barwią się na
tym podłożu na kolor żółtawy.
Wzrost pałeczek Escherichia coli
jest częściowo zahamowany, a
kolonie wybarwiają się na kolor
ciemno - zielony.
Wzrost pałeczek Proteus jest
zahamowany. Jeżeli wyrosną
pojedyncze kolonie są zabarwione
intensywnie żółto.
Taurocholan
sodowy, Zieleo
brylantowa, Fuksyna
kwaśna, Czerwieo
obojętna,

Podłoże
Sabouraud
Podłoże służy do izolowania
chorobotwórczych drożdży i
grzybów.
Do silnie zanieczyszczonego
materiału można dodad jako
środka hamującego wzrost
ubocznej flory 20.000 jednostek
penicyliny lub 40.000 jednostek
streptomycyny na 1 litr podłoża
wyjałowionego i oziębionego do
50°C.
pepton) oraz
antybiotyki. Spośród
ostatnich najczęściej
dodawana jest
penicylina,
streptomycyna lub
chloramfenikol -
służą one do
zahamowania
wzrostu bakterii,
podobnie jak kwaśne
pH
Podłoże do
hodowli
dwoinek
Neissera wg
Roiron
Agar
czekoladowy
Nieselektywna pożywka specjalna,
na której mogą wyrosnąd
wybredne szczepy bakterii.
Wykorzystywana jest w
mikrobiologii przy podejrzeniu
zakażenia o etiologii Neisseria lub
Haemophilus.
Agar czekoladowy
składa się z:
peptonów
mąki kukurydzianej
K2HPO4
KH2PO4
zhemolizowanej
krwi, najczęściej
owcy
Podłoże
Mueller-
Hintona
Podłoże służy do oznaczania
wrażliwości drobnoustrojów na
antybiotyki i chemioterapeutyki.
Kazeina, skrobia

Podłoże
Columbia
Podłoże służy do hodowli i izolacji
drobnoustrojów G+ zarówno
mniej wymagających jak również o
dużych wymaganiach
wzrostowych.
NaCl, kolastyna,
kazeina, pepsyna,
krew
Podłoże
Löwensteina-
Jensena
ożywka używana do trudnej
hodowli prątków.
M.tuberculosis appears as
granular ,rough, dry colonies.
M.kansasii appears as smooth to
rough photochromogenic
colonies. M.gordonae appears as
smooth yellow- orange colonies.
M.avium appears as smooth,
colorless colonies. M.smegmatis
appears as wrinkled, creamy
white colonies.
Podłoże składa się
zazwyczaj wody
destylowanej, mąki
ziemniaczanej, L-
asparaginy (źródło
azotu), glicerolu
(źródło węgla) oraz
roztworu soli -
siarczanu magnezu,
cytrynianu
magnezowego i
fosforanu
jednopotasowego.
do roztworu dawana
jest masa jajowa.
Ostatnim
składnikiem jest
zieleo malachitowa -
większośd
drobnoustrojów
ginie w obecności
tego związku,
natomiast prątki są
oporne i wzrastają w
jego obecności.
Pożywka z
tioglikolanem
sodu
używane do hodowli bakterii
beztlenowych, zwłaszcza
przetrwalnikujących z grupy
Clostridium. Konieczne jest
przechowywanie w ciemnym
miejscu.
Pożywka składa się
wyciągu z drożdży,
cystyny i hydrolizatu
kazeiny. Tioglikolan
sodu odpowiada za
obniżenie potencjału
redox i umożliwia
przeżycie
beztlenowcom,
natomiast
rezazuryna (świeża)
pozwala na ocenę
tego potencjału. pH
podłoża wynosi 7,1.

API20N
Test API 20NE (bioMérieux) składa
się z 20 mikrostudzienek
zawierających odwodnione
substraty i podłoża tworzące
szereg biochemiczny, w skład
którego wchodzi 8 testów
powszechnie stosowanych, takich
jak: redukcja azotanów,
wytwarzanie indolu, fermentacja
glukozy, dehydrolaza argininy,
ureaza, hydroliza eskuliny,
hydroliza żelatyny,
-galaktozydaza oraz 12 testów
asymilacyjnych takich jak:
asymilacja glukozy, arabinozy,
mannozy, mannitolu, N–
acetyloglukozaminy, maltozy,
glukonianu, kaprynianu,
adypinianu, jabłczanu, cytrynianu,
octanu fenylu, które umożliwiają
określenie zdolności adaptacji
enzymatycznej badanych
drobnoustrojów.
Wyszukiwarka
Podobne podstrony:
pozywki, Mikrobiologia, Mikrobiologia
Pożywki mikrobiologiczne
Anal mikrob Konspekt2 Pozywki
mikrobiologia-1kolos, Pożywką nazywamy zestaw składników pokarmowych odpowiednio dobranych pod wzglę
Pożywki, Ochrona Środowiska pliki uczelniane, Mikrobiologia
Pozywki do hodowli drobnoustrojow, Mikrobiologia, Mikrobiologia
Pożywki hodowlane, Ratownicto Medyczne, MIKROBIOLOGIA
Mikrobiotyczna teoria rozwoju alergii rola probiotyków w
MIKROBIOLOGIA JAMY USTNEJ, WYKŁAD 3, 28 03 2013
praktyka skrypt mikrobiologia id 384986
MIKROBIOLOGIA (1)
OCENA MIKROBIOLOGICZNA PRODUKTO Nieznany
mikrobiologia zywnosci podstawy pracy w laboratorium
Mikrobiologia przewodnik
Mikrobiologia cwiczenia
więcej podobnych podstron