
Informacje
2
Pneumonologia i Alergologia
RJ-pAo-
Adres Redakcji: 01-138 Warszawa, ul. Płocka 26,
tel. (022) 43-12-108, fax. (022) 43-12408, e-mail: 3klinika@igichp.edu.pl
ZALECENIA
POLSKIEGO TOWARZYSTWA
FTYZJOPNEUMONOLOGICZNEGO
ROZPOZNAWANIA I LECZENIA
PRZEWLEKŁEJ OBTURACYJNEJ
CHOROBY PŁUC
(POChP)
Dokument opracował zespół w składzie:
Dr hab. med. prof. nadzw. ŚAM Jerzy Kozielski – przewodniczący
Prof. dr hab.med. Ryszarda Chazan
Prof dr hab. med. Dorota Górecka
Prof. dr hab.med. Karina Jahnz-Różyk
Prof. dr hab. med. Piotr Kuna
Prof. dr hab.med. Józef Małolepszy
Prof. dr hab.med. Władysław Pierzchała
Prof. dr hab. med. Michał Pirożyński
Prof. dr hab. med. Tadeusz Płusa
Prof. dr hab. med. Jan Marek Słomiński
Prof.dr hab. med. Paweł Śliwiński
Prof. dr hab. med. Jan Zieliński

Spis treści
Polska 2004/72
3
Spis Treści
Definicja...............................................................................................................................6
Epidemiologia ......................................................................................................................6
Etiopatogeneza i patofizjologia ...........................................................................................7
Rozpoznawanie ....................................................................................................................8
Badania czynnościowe płuc .................................................................................................9
Inne badania dodatkowe ......................................................................................................9
Stopnie zaawansowania choroby .......................................................................................10
Zaburzenia oddychania w czasie snu .................................................................................10
Różnicowanie ....................................................................................................................10
Historia naturalna choroby .................................................................................................11
Profilaktyka .......................................................................................................................12
Rola zaprzestania palenia ........................................................................................12
Metody ograniczenia nałogu palenia .......................................................................12
Ograniczenie szkodliwych
wpływów środowiska ..............................................................................................12
Szczepienia .............................................................................................................13
Leczenie stabilnej postaci choroby ....................................................................................13
Cholinolityki ...........................................................................................................13
Beta
2
-mimetyki ........................................................................................................14
Teofilina ...................................................................................................................15
Leczenie skojarzone ................................................................................................15
Kortykosteroidy .......................................................................................................15
Antybiotyki ..............................................................................................................16
Antyoksydanty i mukolityki ...................................................................................16
Aerozoloterapia .................................................................................................................17
Leczenie w zależności
od stopnia zaawansowania choroby ...................................................................................17
Postać łagodna .........................................................................................................17
Postać umiarkowana ................................................................................................17
Postać ciężka i bardzo ciężka ..................................................................................17
Leczenie tlenem .................................................................................................................17
Leczenie serca płucnego ....................................................................................................18
Operacyjne zmniejszenie objętości płuc ............................................................................18
Rehabilitacja ......................................................................................................................19
Leczenie zaostrzeń choroby ...............................................................................................19
Postępowanie ambulatoryjne ..................................................................................20
Postępowanie szpitalne ...........................................................................................20
Nieinwazyjne wspomaganie wentylacji
(NWW) ....................................................................................................................21
Inwazyjna wentylacja mechaniczna
(IWM) ......................................................................................................................21
Farmakoekonomika ............................................................................................................21
Jakość życia ......................................................................................................................22

4
Pneumonologia i Alergologia
Wprowadzenie
Content
Definition ............................................................................................................................ 6
Epidemiology ...................................................................................................................... 6
Pathogenesis & patophysiology ......................................................................................... 7
Diagnosis............................................................................................................................. 8
Lung function tests .............................................................................................................. 9
Other tests ........................................................................................................................... 9
Staging .............................................................................................................................. 10
Respiratory disturbances during sleep .............................................................................. 10
Differential diagnosis ........................................................................................................ 10
Natural history .................................................................................................................. 11
Prophylaxis ...................................................................................................................... 12
Role of smoking cessation ...................................................................................... 12
Methods of smoking cessation ............................................................................... 12
Minimazing noxious enviroment ............................................................................ 12
Vaccination ............................................................................................................. 13
Tretment of steady-state disease ....................................................................................... 13
Cholinolitics ........................................................................................................... 13
Beta2-agonists ........................................................................................................ 14
Theophyline ............................................................................................................ 15
Combination treatment ........................................................................................... 15
Corticosteroids ........................................................................................................ 15
Antibiotics ............................................................................................................... 16
Antioxidants & mucolytics .................................................................................... 16
Aerozolotherapy ................................................................................................................ 17
Treatment according to the stage ..................................................................................... 17
Mild COPD ............................................................................................................. 17
Moderate COPD ..................................................................................................... 17
Severe and very severe COPD ................................................................................ 17
Oxygen therapy ................................................................................................................. 17
Treatment of cor pulmonale .............................................................................................. 18
Lung volume resection surgery ......................................................................................... 18
Rehabilitation .................................................................................................................... 19
Treatment of exacerbations ............................................................................................... 19
Out-patient treatment .............................................................................................. 20
Hospital treatment .................................................................................................. 20
Noninvasive ventilation .......................................................................................... 21
Mechanical ventilation ........................................................................................... 21
Pharmacoeconomics ......................................................................................................... 21
Quality of life .................................................................................................................... 22

Polska 2004/72
5
Wprowadzenie
Wprowadzenie
Przewlekła obturacyjna choroba płuc (POChP) jest jednostką kliniczną, na którą składają się dwie do-
brze zdefiniowane choroby – przewlekłe zapalenie oskrzeli i rozedma płuc. Połączenie tych dwu chorób
pod nazwą POChP uwalnia lekarza od trudnego różnicowania ich wzajemnego udziału u pojedynczego
chorego.
POChP jest najczęstszą przewlekłą chorobą płuc, przyczyną znacznej absencji chorobowej i przedwcze-
snego inwalidztwa. Na POChP i jej powikłania umiera w Polsce ok. 15 000 osób rocznie.
Medyczna i społeczna waga problemu spowodowała, że wiele pneumonologicznych towarzystw nauko-
wych ustaliło zalecenia rozpoznawania i leczenia POChP. Uczyniły to między innymi American Thoracic
Society (ATS) (1995), European Respiratory Society (ERS) (1995), Société de Pneumonologie de Langue
Française (1996, 2003), Polskie Towarzystwo Ftizjopneumonologiczne (1997, 2002) oraz British Thoracic
Society (BTS) (1997).
Szybki postęp w medycynie, szczególnie w metodach leczenia, spowodował potrzebę uaktualnienia
zaleceń. ATS i ERS podjęły wspólne prace nad nowelizacją zaleceń ustalonych w 1995 roku, które zostały
opublikowane w 2004 roku. Także w Wielkiej Brytanii w 2004 r. opracowano aktualizację wytycznych
BTS z 1997 roku.
W 2001 r. ukazały się światowe wytyczne „GOLD” dotyczące rozpoznawania, leczenia i prewencji prze-
wlekłej obturacyjnej choroby płuc (1), uaktualnione w 2003 r. (2).
Ze względu na społeczną i medyczną wagę problemów związanych z POChP w Polsce, również Polskie
Towarzystwo Ftizjopneumonologiczne postanowiło zaktualizować własne zalecenia dotyczące tej choroby
z roku 2002 (3). Nowy dokument uwzględnia najnowsze osiągnięcia medycyny światowej w dziedzinie
POChP, a jednocześnie nawiązuje do krajowych realiów i rozwiązań.
Redagując zalecenia zespół kierował się zasadą, że mają być one skierowane do lekarzy pneumono-
logów i być pomocą w ich codziennej pracy. Stąd zwięzłość dokumentu oraz nacisk na część dotyczącą
postępowania leczniczego.
Mamy nadzieję, że publikowane zalecenia przyczynią się do lepszego rozpoznawania i leczenia, a także
profilaktyki POChP w Polsce.
Autorzy

6
Pneumonologia i Alergologia
Definicja
„Przewlekła
obturacyjna
choroba
płuc
(POChP) charakteryzuje się słabo odwracalnym,
postępującym zmniejszeniem przepływu powietrza
przez drogi oddechowe, które rozwija się u osób
mających zwykle objawy kliniczne przewlekłe-
go zapalenia oskrzeli (PZO) i/lub rozedmy płuc.
W badaniu spirometrycznym stosunek FEV
1
/FVC
jest mniejszy od 70%. Zmniejszenie przepływu
powietrza związane jest ze zmianami zapalnymi,
głównie w obrębie obwodowych dróg oddecho-
wych, które powodują ich zwężenie i są przyczyną
patologicznej przebudowy płuc. Zmiany te są wyni-
kiem reakcji płuc na dym tytoniowy, pyły i gazy.”
Definicja ta jest zbliżona do zaproponowanej
ostatnio przez grupę ekspertów Światowej Organi-
zacji Zdrowia i Narodowego Instytutu Serca, Płuc
i Krwi Stanów Zjednoczonych (GOLD) (1,3). Nie
uwzględnia ona „stadium 0” choroby zaproponowa-
nego przez GOLD. „Stadium 0” odpowiada znanej
definicji przewlekłego zapalenia oskrzeli i ma od-
rębny numer w obowiązującej na świecie klasyfika-
cji chorób (nr J41). Ostatnio wykazano, że w ciągu
15 lat obserwacji, POChP rozwinęła się u 20,5%
osób, którzy na początku znajdowali się w grupie 0
wg klasyfikacji GOLD i u 18,5% palących papiero-
sy nie mających wstępnie objawów ze strony ukła-
du oddechowego (różnica nieznamienna) (4).
POChP ma w tej klasyfikacji nr J44. Definicja
jest uzupełniona wymienieniem dwóch chorób,
które zgodnie z ugruntowaną wiedzą składają się
na POChP, oraz podkreśla główny czynnik wywo-
łujący chorobę w krajach rozwiniętych, jakim jest
palenie tytoniu.
PZO rozpoznaje się na podstawie stwierdzenia
przewlekłego kaszlu z odkrztuszaniem, utrzymu-
jącego się co najmniej przez 3 miesiące w roku
w ciągu ostatnich dwóch lat. Przed ustaleniem roz-
poznania PZO należy wykluczyć inne przyczyny
przewlekłego kaszlu. Rozedma płuc jest pojęciem
anatomicznym i oznacza trwałe powiększenie prze-
strzeni powietrznych położonych obwodowo od
oskrzelika końcowego spowodowane zniszczeniem
ścian pęcherzyków płucnych.
Epidemiologia
POChP jest istotnym problemem zdrowotnym
w wielu krajach, będąc piątą pod względem czę-
stości przyczyną zgonów. Badania populacyjne
wykazują, że – w zależności od kraju – POChP
dotyczy od 8% do 10% dorosłych powyżej 30 roku
życia. Z wyjątkiem Hiszpanii zachorowalność na
POChP wśród kobiet prawie dorównuje zachoro-
walności wśród mężczyzn. W Europie umieralność
z powodu tej choroby kształtuje się na poziomie od
ok.10/100 000 (Grecja, Francja, Hiszpania, Wielka
Brytania) do ok. 30-40/100 000 (Belgia, Dania,
Niemcy, Norwegia, Rosja, Rumunia, Szwecja i Wę-
gry). W Polsce, w latach 1999-2000, POChP była
przyczyną ok. 2,6% zgonów u mężczyzn, i 1,3%
zgonów u kobiet, a współczynniki zgonów kształ-
towały się na poziomie 19,6/100 000 (mężczyźni:
28,0/100 000; kobiety: 11,6/100 000).
Badania epidemiologiczne w Polsce dowodzą,
że objawy przewlekłego upośledzenia przepływu
powietrza w drogach oddechowych występują
u 8,5% mężczyzn i 4,9 % kobiet i że zapadalność
na POChP jest najczęściej związana z paleniem ty-
toniu (ryzyko względne u mężczyzn: 4,3 u kobiet:
2,3), rzadziej z wiekiem, a najrzadziej z zanie-
czyszczeniem powietrza w miejscu zamieszkania
lub w miejscu pracy (5). Najnowsze, ograniczone,
badania epidemiologiczne przeprowadzone w War-
szawie, wykazały, że wśród osób w wieku 41-72
lat POChP wykryto u 10,7 % badanych, w tym u
10,9% mężczyzn i 10,3% kobiet (6). Wśród palaczy
papierosów, którzy ukończyli 40 lat i ochotniczo
zgłosili się na badanie spirometryczne obturację
oskrzeli stwierdzono u 23 % (7).
Zanieczyszczenie powietrza w miejscu pracy
i zamieszkania mają jednak bardzo duże znaczenie,
jeżeli współwystępują jednocześnie z innymi czyn-
nikami ryzyka. Wśród innych czynników ryzyka
wymienia się niedobór α1-antytrypsyny, obciąże-
nie rodzinne, częste infekcje układu oddechowego
w dzieciństwie, atopię oraz nieswoistą nadreaktyw-
ność oskrzeli (5,8).
Pod koniec lat osiemdziesiątych wskaźniki ho-
spitalizacji z powodu POChP w Polsce osiągnęły
dla mężczyzn 34.4/10.000, a dla kobiet 17.9/10.000,
natomiast w roku 2001 współczynniki te wyniosły
odpowiednio 41.9/10.000 i 24.2/10.000. Warto pod-
kreślić, że współczynniki hospitalizacji były znacz-
nie wyższe u mężczyzn mieszkających na wsi niż
u mieszkańców miast (49.7 vs 37.1/10.000), pod-
czas gdy u kobiet nie obserwowano takiej różnicy
(23.6 vs 24.7/10.000). Opisane różnice hospitaliza-
cji mężczyzn zamieszkałych na wsi w porównaniu
Definicje, epidemiologia

Polska 2004/72
7
z mieszkańcami miast, wynikają z większego roz-
powszechnienia nałogu palenia tytoniu w populacji
mieszkańców wsi (9).
Etiopatogeneza i patofizjologia
Głównymi czynnikami etiopatogenetycznymi
choroby są palenie tytoniu i działanie środowisko-
wych czynników szkodliwych – pyłów i gazów
(ryc. 1). Badania epidemiologiczne dowodzą, że
wzrost w ciągu doby zanieczyszczeń powietrza
atmosferycznego pod postacią drobnego pyłu zale-
dwie o 10 μg/m
3
zwiększa o około 0,5-1,6% ogólną
dobową liczbę zgonów.
Za rozwój POChP odpowiedzialne są także
zanieczyszczenia powietrza w pomieszczeniach
mieszkalnych. Należą do nich głównie bierne pale-
nie tytoniu, zanieczyszczenia wynikające z opalania
mieszkań węglem lub gazem oraz gotowania posił-
ków w słabo wentylowanych pomieszczeniach.
Dobrze udokumentowany jest związek POChP
z narażeniem zawodowym na pyły organiczne
i nieorganiczne oraz na zanieczyszczenia gazami
drażniącymi (10,11).
Czynniki te prowadzą do przewlekłego procesu
zapalnego toczącego się w drogach oddechowych,
w miąższu płuc i naczyniach płucnych. Przewlekły
proces zapalny i towarzyszące mu zaburzenia rów-
nowagi między proteazami i antyproteazami oraz
stres oksydacyjny są przyczyną niszczenia miąższu
płuc i nieodwracalnych zmian w obrębie drobnych
dróg oddechowych. Zniszczenie miąższu płucnego
(zmniejszenie sprężystości płuc) oraz zmiany struk-
turalne w obrębie drobnych dróg oddechowych
prowadzące do ich zwężenia są głównymi przy-
czynami ograniczeń przepływu powietrza przez
drogi oddechowe. Na trwałe zmiany strukturalne
w obrębie obwodowych dróg oddechowych na-
kładają się elementy zmienne, jakimi są obrzęk,
hipersekrecja śluzu i skurcz mięśni gładkich, które
dodatkowo powodują wzrost oporu i utrudniają
przepływ powietrza.
Rozedma płuc – głównie środkowej części zrazi-
ka, powstaje w wyniku działania proteaz: neutrofi-
lowej elastazy, katepsyn i metaloproteinaz. Rzadką
przyczyną rozedmy płuc może być wrodzony nie-
dobór α1- antytrypsyny.
Zaawansowane zmiany strukturalne w obwodo-
wych oskrzelach i miąższu płucnym są przyczyną
zaburzeń wymiany gazowej, hipoksemii i hiper-
kapni.
Komórkami odgrywającymi istotną rolę w za-
inicjowaniu i podtrzymywaniu procesu zapalnego
w drogach oddechowych i, w mniejszym stopniu
– w płucach chorych na POChP są makrofagi, lim-
focyty CD8+ i neutrofile. Zwiększoną liczbę ma-
krofagów stwierdza się zarówno w centralnych, jak
i w drobnych drogach oddechowych oraz w miąż-
szu płuc (12,13). Zwiększoną liczbę limfocytów
CD8+ stwierdza się w wycinkach błony śluzowej
i miąższu płuc (13). Natomiast neutrofile wykazano
głównie w plwocinie i popłuczynach oskrzelowo-
pęcherzykowych (14).
Makrofagi wydają się odgrywać wiodącą rolę
w zapoczątkowaniu procesu zapalnego w POChP.
Pod wpływem dymu tytoniowego uwalniają one
interleukinę 8 i leukotrien B4 – czynniki chemotak-
tyczne dla neutrofilów. Natomiast limfocyty CD8+
są odpowiedzialne za przewlekanie się procesu za-
palenia. Wydzielają perforynę, granzym B i czynnik
martwicy nowotworu TNF-α, odpowiedzialne za
cytolizę i apoptozę komórek nabłonkowych pęche-
rzyków płucnych (15). Aktywne neutrofile biorące
udział w procesie zapalnym toczącym się w płucach
chorych na POChP uwalniają neutrofilową elastazę
i katepsyny, które odpowiedzialne są za hipersekre-
cję śluzu i destrukcję miąższu płuc.
Procesy te są odpowiedzialne za dwa główne
objawy POChP:
1. ograniczenie wydechowego przepływu po-
wietrza, spowodowane trwałym zwężeniem
drobnych dróg oddechowych i zniszczeniem
przyczepów przegród międzypęcherzykowych
do oskrzelików,
2. hipersekrecję śluzu, która klinicznie objawia
się kaszlem i odkrztuszaniem.
Trwałe zwężenie drobnych dróg oddechowych
i brak lub słaba odwracalność obturacji pod wpły-
wem leków rozszerzających oskrzela spowodowane
są włóknieniem okołooskrzelikowym, powstałym
w wyniku procesów niszczenia i gojenia. Procesy
te toczą się głównie w oskrzelikach o przekroju
mniejszym niż 2 mm. Kolejnym mechanizmem od-
powiedzialnym za zwężenie oskrzeli i ograniczenie
przepływu powietrza jest zmniejszenie sprężystości
płuc. Na te nieodwracalne zmiany nakładają się
dodatkowo elementy pogłębiające zaburzenia prze-
pływu – nacieki zapalne, obrzęk i skurcz mięśni
gładkich w ścianie oskrzeli oraz zaleganie śluzu
w ich świetle – które poddają się leczeniu, a ich
zminimalizowanie decyduje o efektach stosowanej
terapii.
Na wielkość obturacji drobnych dróg oddecho-
wych wpływają komponenty:
1. nieodwracalne (14,16)
• utrata sprężystości płuc,
• włóknienie okołooskrzelikowe,
Etiopatogeneza i patofizjologia

8
Pneumonologia i Alergologia
• hipertrofia i hiperplazja okrężnych mięśni
gładkich,
• hiperplazja komórek kubkowych
• hiperplazja gruczołów śluzowych
2. odwracalne
• dobowe zmiany napięcia mięśni oskrzeli,
• zwiększone napięcie mięśni oskrzeli,
• stan zapalny zwężający drogi oddechowe
i wywołujący skurcz mięśni oskrzeli,
• obrzęk błony śluzowej oskrzeli i hipersekre-
cja śluzu.
Odwracalne komponenty obturacji dróg od-
dechowych w POChP mają istotne implikacje
w leczeniu choroby. Schemat etiopatogenezy
POChP przedstawiono na ryc. 1.
Rozpoznawanie
Rozpoznanie choroby ustala się na podstawie
wywiadu, badania fizykalnego, badania spirome-
trycznego i badania radiologicznego klatki pier-
siowej. Dodatkowymi elementami pomocnymi w
ustaleniu rozpoznania są badania: gazometryczne
krwi, elektrokardiograficzne i echokardiograficzne.
Chory na POChP to zazwyczaj osoba po 40 roku
życia, paląca od wielu lat papierosy, czasami nara-
żona na zanieczyszczenia powietrza w środowisku,
która kaszle i odkrztusza plwocinę, głównie rano.
Dolegliwości te występują od wielu lat. Chory
zazwyczaj skarży się na postępującą z biegiem
lat duszność, która początkowo występuje tylko
podczas wysiłku. W końcowym okresie choroby
i podczas jej zaostrzeń duszność może być również
odczuwana w spoczynku.
Często dochodzi do zaostrzeń dolegliwości,
głównie w okresie zimy. Zaostrzenia cechuje na-
silenie duszności i kaszel z odkrztuszaniem więk-
szej niż zazwyczaj objętości plwociny. W okresie
zaostrzeń plwocina zwykle zmienia się ze śluzowej
na śluzowo-ropną lub ropną. W tym czasie często
u chorego występuje uczucie ucisku w klatce pier-
siowej, a osłuchowo stwierdza się szmer pęcherzy-
kowy z wydłużonym wydechem, furczenia i świsty.
Pojawiają się, i w miarę postępu choroby nasilają
się, objawy niewydolności krążenia. W zaawanso-
wanym okresie choroby chory często chudnie.
W badaniu fizykalnym stwierdza się, głównie
w okresie zaostrzeń, furczenia i świsty. W miarę
postępu choroby dominują cechy rozedmy płuc:
wdechowe ustawienie klatki piersiowej, bębenko-
wy odgłos opukowy i osłabienie szmeru oddecho-
wego pęcherzykowego. W zaawansowanej postaci
choroby widoczna jest praca dodatkowych mięśni
Ryc. 1. Etiopatogeneza POChP.
Rozpoznawanie

Polska 2004/72
9
oddechowych, zapadanie dolnych przestrzeni mię-
dzyżebrowych, wydech przez zwężone usta i sinica.
Mogą pojawić się zaburzenia neurologiczne zwią-
zane z niedotlenieniem i hiperkapnią.
Badania czynnościowe płuc
Badanie spirometryczne jest podstawowym
badaniem czynnościowym układu oddechowego
służącym rozpoznaniu POChP, określeniu stopnia
jej zaawansowania i ocenie rokowania. Spirometria
służy również do monitorowania przebiegu choroby
i oceny skuteczności prowadzonego leczenia.
Każda osoba paląca papierosy lub podająca w
wywiadzie przewlekły kaszel i odkrztuszanie plwo-
ciny, z ekspozycją bierną na dym tytoniowy i środo-
wiskowe czynniki narażenia układu oddechowego
powinna mieć wykonane badanie spirometryczne.
Celem badania spirometrycznego u osoby po-
dejrzanej o POChP jest potwierdzenie ograniczenia
rezerw wentylacyjnych płuc typu obturacyjnego.
Wartość diagnostyczną mają przede wszystkim:
natężona objętość wydechowa pierwszosekundo-
wa (FEV
1
), pojemność życiowa (VC) lub natężona
pojemność życiowa (FVC) i wyliczony wskaźnik
odsetkowy FEV
1
/VC lub FEV
1
/FVC. Podstawo-
wym kryterium diagnostycznym dla obturacji jest
obniżenie wskaźnika FEV
1
/VC (lub FEV
1
/FVC)
poniżej 70%.
Należy jednak pamiętać, że tak przyjęte kryte-
rium obturacji oskrzeli jest wielkością uproszczoną
i obarczoną błędem, ponieważ prawidłowa wielkość
wskaźnika FEV
1
/VC (lub FEV
1
/FVC) jest różna dla
kobiet i mężczyzn i zmienia się z wiekiem. Przy-
jęcie stałej wartości dolnej granicy normy dla tego
wskaźnika skutkuje fałszywie ujemnymi wynikami
w grupie ludzi młodych (poniżej 30 r.ż. u kobiet
i poniżej 45 r.ż. u mężczyzn), gdzie wg ERS dolna
granica normy wynosi ok. 71-74%, oraz fałszywie
dodatnimi wynikami u ludzi starszych (powyżej
65 r.ż.), gdzie dolna granica normy wynosi odpo-
wiednio 63-66% (17). Arbitralnie przyjęta wartość
FEV
1
/VC (lub FEV
1
/FVC) równa 70% jest w przy-
bliżeniu prawidłowa tylko dla osób w wieku 30-45
lat. Szczegółowa weryfikacja rozpoznania obturacji
oskrzeli w przypadku wątpliwości powinna być do-
konana w oparciu o odpowiednie wyliczenia (Aneks
1). Najczęściej stosowane i zalecane wartości należ-
ne opublikowane zostały w 1993 roku przez grupę
ekspertów ERS (17). W przypadkach, gdy nie jest
to możliwe (np. zalecenia ERS nie podają warto-
ści należnych dla FEV
1
/FVC) należy użyć innych
źródeł dla wartości należnych. Najbardziej aktualne
dane dotyczące wartości należnych dla wskaźnika
FEV
1
/FVC opublikowano w odniesieniu do popu-
lacji białych w Anglii i stosowanie tych wartości
należnych jest obecnie zalecane (18).
Stopień nasilenia obturacji oskrzeli ocenia się na
podstawie wielkości FEV
1
wyrażonej jako odsetek
wartości należnej. Oznaczenie FEV
1
pozwala zatem
określić stopień zaawansowania POChP.
Istotne dla rozpoznania choroby jest wykonanie
spirometrycznej próby rozkurczowej w stabilnym
okresie choroby. Próba polega na dwukrotnym
wykonaniu spirometrii: przed podaniem jakiego-
kolwiek leku rozszerzającego oskrzela i po 15-20
minutach od podania krótko działającego β2-mi-
metyku (salbutamol lub fenoterol). Wynik próby
u chorego na POChP jest zazwyczaj ujemny. Ozna-
cza to, że przyrost FEV
1
po podaniu β2-mimetyku
jest mniejszy niż 15% wartości wyjściowej i mniej-
szy niż 200 ml w wartościach bezwzględnych.
U pacjentów z niskimi wyjściowymi wartościami
FEV
1
, zwłaszcza w ciężkiej i bardzo ciężkiej po-
staci choroby w interpretacji próby rozkurczowej
można uwzględnić przyrost nie tylko FEV
1
ale
także FVC (17). Odwracalność zwężenia oskrzeli
oblicza się wg wzoru:
FEV
1
po inhalacji – FEV
1
przed inhalacją
FEV
1
przed inhalacją
x 100%
Inne badania dodatkowe
Radiogram klatki piersiowej może być prawi-
dłowy lub stwierdza się objawy rozdęcia płuc,
pola płucne są nadmiernie jasne, rysunek płucny
obwodowo od wnęk jest ubogi, a naczynia we wnę-
kach poszerzone. Czasami widoczne są zacienienia
okołooskrzelowe. Radiogram klatki piersiowej jest
również przydatny dla wykluczenia innych scho-
rzeń lub wskazuje na raka płuca, którego etiologia
jest podobna do POChP.
Badanie gazometryczne krwi powinno być wy-
konane u wszystkich chorych, u których FEV
1
jest
mniejsze niż 50% wartości należnej oraz u chorych
z cechami prawokomorowej niewydolności krą-
żenia. U chorych tych należy również wykonać
badanie morfologii krwi. Decyzję o potrzebie wy-
konania badania gazometrycznego może ułatwić
pulsoksymetria przezskórna. Stwierdzenie SaO
2
poniżej 92% jest wskazaniem do badania gazome-
trycznego krwi.
Badania EKG i USG serca nie są konieczne do
rozpoznania POChP, ale służą do potwierdzenia po-
wikłania choroby, jakim jest serce płucne.
Rozpoznawanie
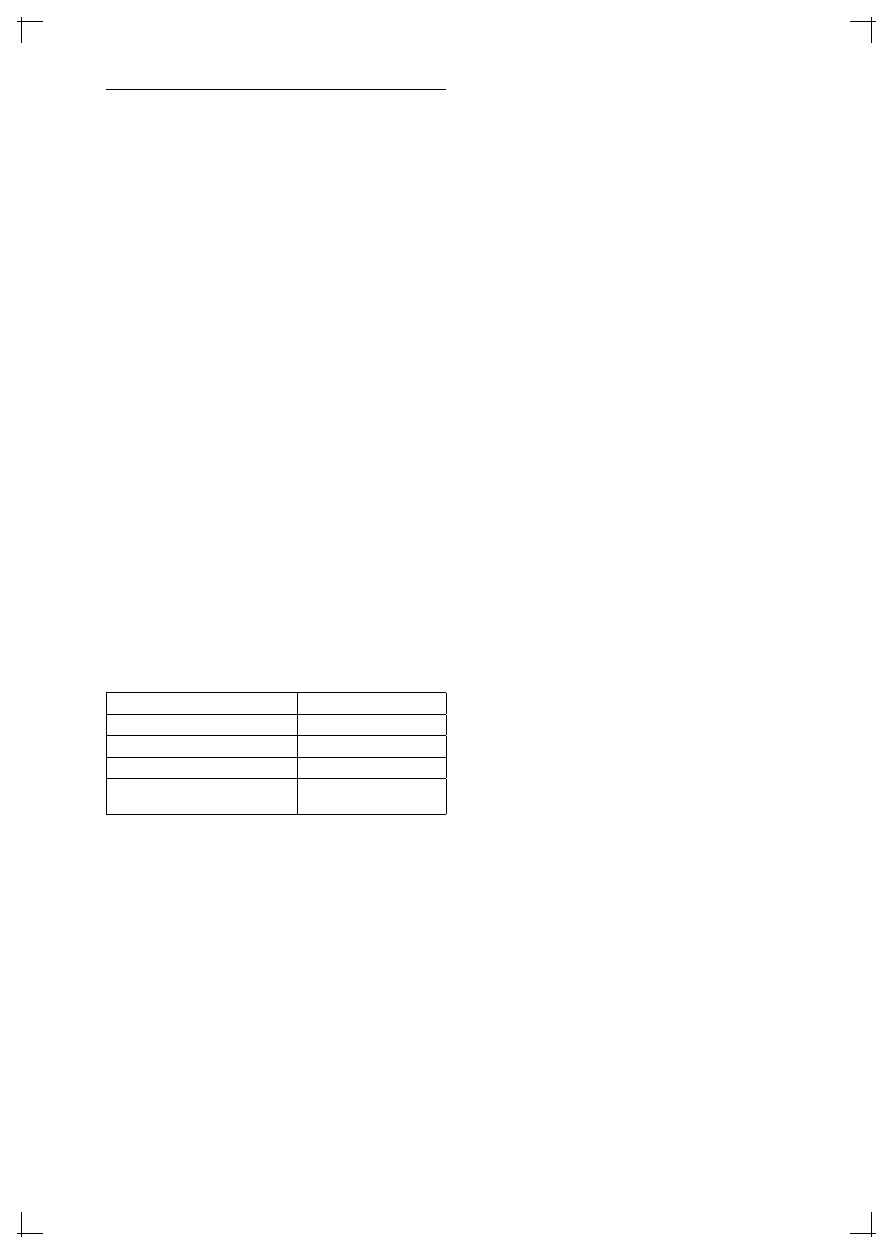
10
Pneumonologia i Alergologia
Stopnie zaawansowania choroby
Niezbędnym warunkiem rozpoznania choroby
jest badanie spirometryczne. Badanie to pozwala
również określić zaawansowanie choroby. Podział
choroby na stopnie zaawansowania ma aspekt
praktyczny, bowiem według niego podejmuje się
decyzje terapeutyczne.
Przyjęto podział choroby na cztery stopnie
zaawansowania (tabela 1). W każdym z nich wy-
stępuje ograniczenie przepływu powietrza przez
drogi oddechowe. Wyrazem tego ograniczenia jest
wskaźnik FEV
1
/FVC niższy niż 70%. Podział na
stopnie uzależniony jest od wartości FEV
1
w sto-
sunku do należnej normy. W stopniu I – łagodnej
postaci choroby, FEV
1
jest równe lub wyższe niż
80% wartości należnej, w stopniu II – umiarkowa-
nej postaci POChP, FEV
1
mieści się między 79%
a 50% wartości należnej, w stopniu III –ciężkiej po-
staci choroby, FEV
1
jest mniejsze niż 50% i równe
lub większe niż 30% wartości należnej. W bardzo
ciężkiej postaci choroby (stopień IV) FEV
1
jest
mniejsze niż 30% wartości należnej.
W postaci ciężkiej, a szczególnie bardzo ciężkiej,
często występują zaostrzenia choroby, cechy nie-
wydolności oddychania i serca płucnego.
Szczególnie nasilone i długie okresy hipoksemii
nocnej występują u chorych cechujących się
niewielką dusznością, skłonnością do obrzęków
i hiperkapnią (20). Nocna hipoksemia łączy się
z ryzykiem wystąpienia groźnych dla życia zabu-
rzeń rytmu serca (21).
Hipoksemię nocną można przewidzieć na pod-
stawie zachowania się PaO
2
i PaCO
2
w ciągu dnia,
a potwierdza się ją pulsoksymetrią. U chorych
z PaO
2
>60 mmHg w ciągu dnia nie zaleca się ru-
tynowego badania pulsoksymetrycznego w czasie
snu, z wyjątkiem osób z policytemią i/lub cechami
przewlekłego serca płucnego. U chorych leczonych
tlenem w domu, w stabilnym okresie choroby,
u których stwierdza się nocne zmniejszenia SaO
2
,
zaleca się zwiększenie przepływu tlenu w czasie
snu o 1 l/min w stosunku do wielkości przepływu
stosowanego w czasie czuwania. Postępowanie ta-
kie istotnie poprawia utlenowanie pacjenta w czasie
snu nie powodując nasilenia retencji CO
2
.
Różnicowanie
POChP należy różnicować głównie z astmą
oskrzelową. Podstawy różnicowania przedstawiono
w tabeli 2.
W ciężkich postaciach astmy przebiegających ze
stałą obturacją oskrzeli lub bardzo małą odwracal-
nością po leku rozszerzającym oskrzela różnicowa-
nie z POChP może okazać się bardzo trudne. Dużo
trudności różnicowo-diagnostycznych sprawiają
chorzy, u których na astmę nakładają się objawy
POChP. Są to zwykle chorzy na astmę, którzy pa-
lili lub nadal palą papierosy, jak również chorzy na
POChP i jednocześnie na astmę (chorzy na POChP
z dodatnimi testami skórnymi, chorzy z atopią,
u których astma ujawnia się późno).
Kilka innych chorób układu oddechowego wy-
maga różnicowania z POChP:
• rozstrzenie oskrzeli
• zarostowe zapalenie oskrzelików
• mukowiscydoza
• zatorowość płucna
• rak płuca
• gruźlica płuc
• zastoinowa niewydolność krążenia.
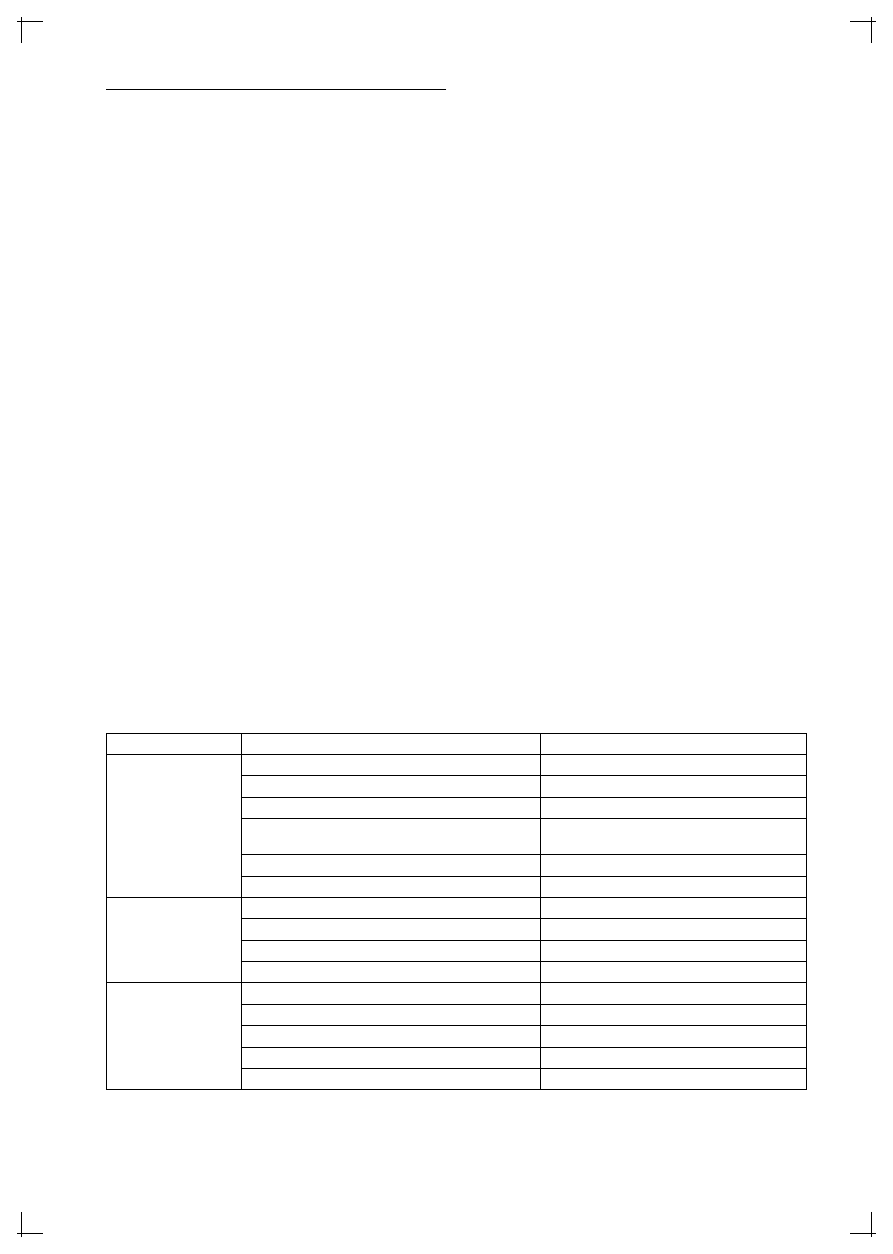
Tabela 1. Stopnie zaawansowania choroby.
Zawsze obecność obturacji – FEV
1
/FVC < 70%
Stopień zaawansowania
Kryteria spirometryczne
Stopień I (postać łagodna)
FEV
1
≥80% N
Stopień II (postać umiarkowana) 50% N≥FEV
1
<80% N
Stopień III (postać ciężka)
30% N≤FEV
1
<50%N
Stopień IV
(postać bardzo ciężka)
FEV
1
<30% N
Zaburzenia oddychania w czasie snu
U chorych na POChP w czasie snu, szczególnie
w fazie REM (szybkich ruchów gałek ocznych),
często występuje zmniejszenie ciśnienia parcjalne-
go tlenu w krwi tętniczej (PaO
2
) o 15-20 mm Hg.
Przyczyną tego stanu jest hipowentylacja pęche-
rzykowa i nasilenie zaburzeń stosunku wentylacji
do przepływu krwi w pęcherzyku płucnym (19).
Następstwa zmniejszenia PaO
2
w czasie snu zależą
od jego wielkości w czasie czuwania. U chorych
mających PaO
2
na stromej części krzywej dysocja-
cji oksyhemoglobiny (<60 mm Hg) zmniejszenie
PaO
2
powoduje istotne obniżenie wysycenia krwi
tętniczej tlenem (SaO
2
). Zmniejszenie SaO
2
ozna-
cza znaczne obniżenie transportu tlenu do tkanek.
Różnicowanie
Polska 2004/72
11
Historia naturalna choroby
POChP jest chorobą trwającą kilkadziesiąt lat. Za
jej początek uznaje się stwierdzenie zmniejszenia
stosunku FEV
1
/FVC poniżej 70% u osoby mającej
kliniczne cechy PZO i/lub rozedmy płuc. Grupą ry-
zyka rozwinięcia się choroby są palacze papierosów
i osoby narażone na środowiskowe zanieczyszcze-
nie powietrza mające przewlekły kaszel ze skąpym
odkrztuszaniem. Osoby te powinny mieć wykony-
wane badanie spirometryczne co 12 miesięcy.
Postęp choroby uwarunkowany jest szybkością
rocznego obniżania się FEV
1
. U osoby zdrowej
wynosi ona 20-30 ml rocznie i zaczyna się między
20 i 30 rokiem życia. U chorego na POChP rocz-
ny ubytek FEV
1
wynosi powyżej 40 ml i jest tym
większy, im choroba jest bardziej zaawansowana.
Nadprodukcja śluzu wiąże się z przyspieszonym
rocznym obniżaniem FEV
1
(22). Szybkość zmniej-
szania FEV
1
zależy również od częstości i długości
trwania zaostrzeń choroby. U niektórych chorych
roczny spadek FEV
1
jest większy niż 100 ml (23).
Po obniżeniu FEV
1
do około 50% wartości na-
leżnej pojawia się duszność wysiłkowa oraz można
zaobserwować dwa typy dalszego rozwoju klinicz-
nego choroby.
U chorych z prawidłowym napędem oddecho-
wym gazy krwi tętniczej utrzymują się w granicach
normy, przynajmniej w spoczynku. Dzieje się to
kosztem dużego wysiłku oddechowego i narastają-
cej z upływem lat duszności oraz znacznego upośle-
dzenia sprawności wysiłkowej. Chorzy ci umierają
zwykle w czasie zaostrzenia choroby, przebiegają-
cego z nasileniem niewydolności oddychania.
W drugiej grupie chorych, z obniżonym napę-
dem oddechowym, dość wcześnie pojawia się nie-
wydolność oddychania, początkowo hipoksemia,
a później hiperkapnia. Chorzy ci nie odczuwają
znacznej duszności i nieźle tolerują wysiłek fizycz-
ny. Po pewnym czasie rozwijają się u nich kliniczne
objawy serca płucnego. Chorzy ci umierają wśród
cech narastającej prawokomorowej niewydolności
krążenia. U wielu chorych obraz kliniczny łączy
cechy obu wymienionych grup (24). Obok wiel-
kości FEV
1
, która jest najczulszym wskaźnikiem
prognostycznym, także stopień nasilenia duszności,
stan odżywienia oraz wydolność fizyczna korelują
z przewidywaną długością życia (25).
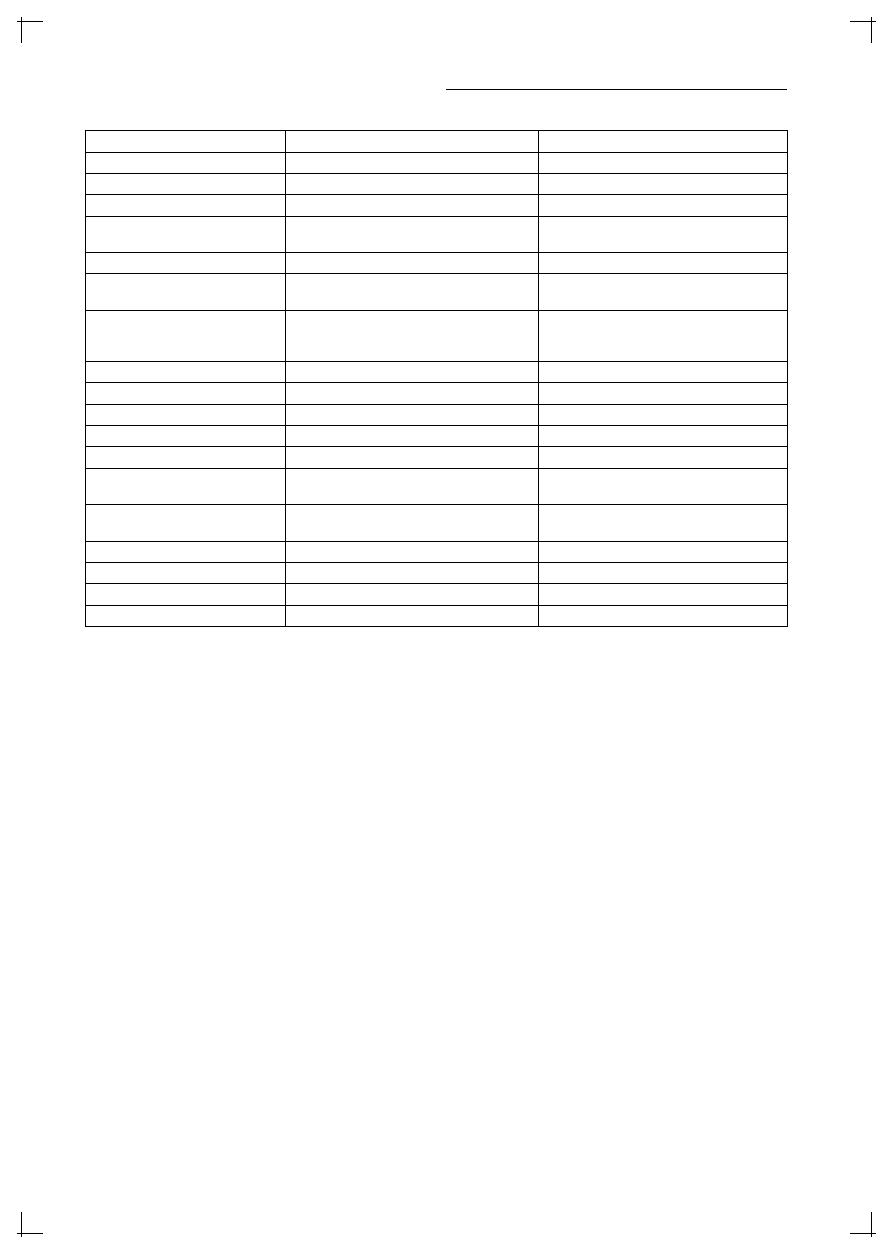
Tabela 2. Różnicowanie POChP i astmy oskrzelowej
Cecha
POChP
Astma
palenie tytoniu w wywiadzie
często
rzadko
wywiad rodzinny
czasem POChP w rodzinie, rzadko atopia
często astma lub atopia w rodzinie
początek choroby
zazwyczaj po 40 rż
zazwyczaj przed 40 rż
najczęstsze objawy
zazwyczaj codziennie: kaszel i stopniowo
nasilająca się duszność wysiłkowa
zazwyczaj okresowo:
duszność, suchy kaszel, świsty
nocna duszność
rzadko
często
główne czynniki wyzwalające
objawy
wysiłek fizyczny, zimne powietrze
alergeny, wysiłek fizyczny, zimne powie-
trze
spirometria
stale obniżone FEV
1
i FEV
1
/FVC wartości
te mogą się poprawiać w wyniku leczenia,
ale nigdy nie wracają do normy
w czasie objawów obniżone wartości FEV
1
i FEV
1
/FVC; możliwa norma w okresie
remisji lub w wyniku leczenia
próba rozkurczowa
przeważnie ujemna (ΔFEV1< 15%)
zazwyczaj dodatnia (ΔFEV1≥15%)
próba steroidowa
przeważnie ujemna
przeważnie dodatnia
dobowa zmienność PEF
zazwyczaj brak
często
pojemność dyfuzyjna płuc
prawidłowa lub obniżona w rozedmie
prawidłowa lub podwyższona
morfologia
policytemia
eozynofilia
gazometria
początkowo prawidłowa, w miarę postępu
choroby obniżenie PaO
2
i wzrost PaCO
2
zazwyczaj prawidłowe wartości,
lub umiarkowane obniżenie PaO
2
RTG klatki piersiowej
cechy rozedmy i nadciśnienia płucnego
prawidłowe lub cechy rozdęcia płuc
w okresie zaostrzenia
eozynofilia w badaniu plwociny
brak w okresie stabilnym
występuje
poziom α1-antytrypsyny
może być obniżony
prawidłowy
stężenie IgE w surowicy krwi
zazwyczaj prawidłowe
często podwyższone
EKG
obraz przeciążenia prawej komory
w okresie stabilnym zapis prawidłowy
Historia naturalna choroby

12
Pneumonologia i Alergologia
Profilaktyka
Rola zaprzestania palenia
Zaprzestanie palenia jest podstawą pierwotnej
i wtórnej profilaktyki choroby. Jest to metoda
o udowodnionej skuteczności zapobiegania postę-
powi choroby. W pierwszym roku po zaprzestaniu
palenia może dojść do poprawy FEV
1
, a następnie
tempo obniżania FEV
1
zbliża się do obserwowane-
go u osób niepalących (26). Nawet u osób z ciężką
obturacją oskrzeli zaprzestanie palenia jest korzyst-
ne, ponieważ zwolnienie obniżania FEV
1
przedłuża
życie (23).
Metody ograniczenia nałogu palenia
Spośród wielu działań antynikotynowych naj-
prostsza i powszechnie przyjęta jest metoda mini-
malnej interwencji, zwana też metodą „pięciu P”
(1).
i inhalatorze. Dostarczając do organizmu nikotynę
zapobiegają one objawom zespołu abstynencji,
jaki występuje u osób fizycznie uzależnionych od
nikotyny. Skuteczność takiej terapii jest dwukrotnie
wyższa niż stosowanie placebo (29). Od 20 do 30%
osób trwale porzuca nałóg na okres co najmniej
roku. Ostatnio stwierdzono, że skuteczny w od-
zwyczajaniu od nałogu palenia jest bupropion, lek
o działaniu antydepresyjnym, hamujący wychwyt
zwrotny dopaminy i noradrenaliny w ośrodkowym
układzie nerwowym (30% rocznego sukcesu u osób
palących) (30). U chorych na POChP skuteczność
leku jest mniejsza (31). Lek można stosować po
uwzględnieniu wszystkich przeciwwskazań.
Przed rozpoczęciem farmakoterapii konieczne
jest określenie stopnia uzależnienia od nikotyny za
pomocą testu Fagerströma. Wynik testu ≥7 punktów
świadczy o silnym uzależnieniu od nikotyny i wy-
maga rozpoczęcia leczenia najwyższymi dawkami
preparatów zawierających nikotynę lub rozważenia
wskazań do podania bupropionu (32). U palących
z wynikiem testu 4-6 p. leczenie należy wprowa-
dzić, jeśli palacz ma trudności z całkowitym zaprze-
staniem palenia lub wraca do nałogu.
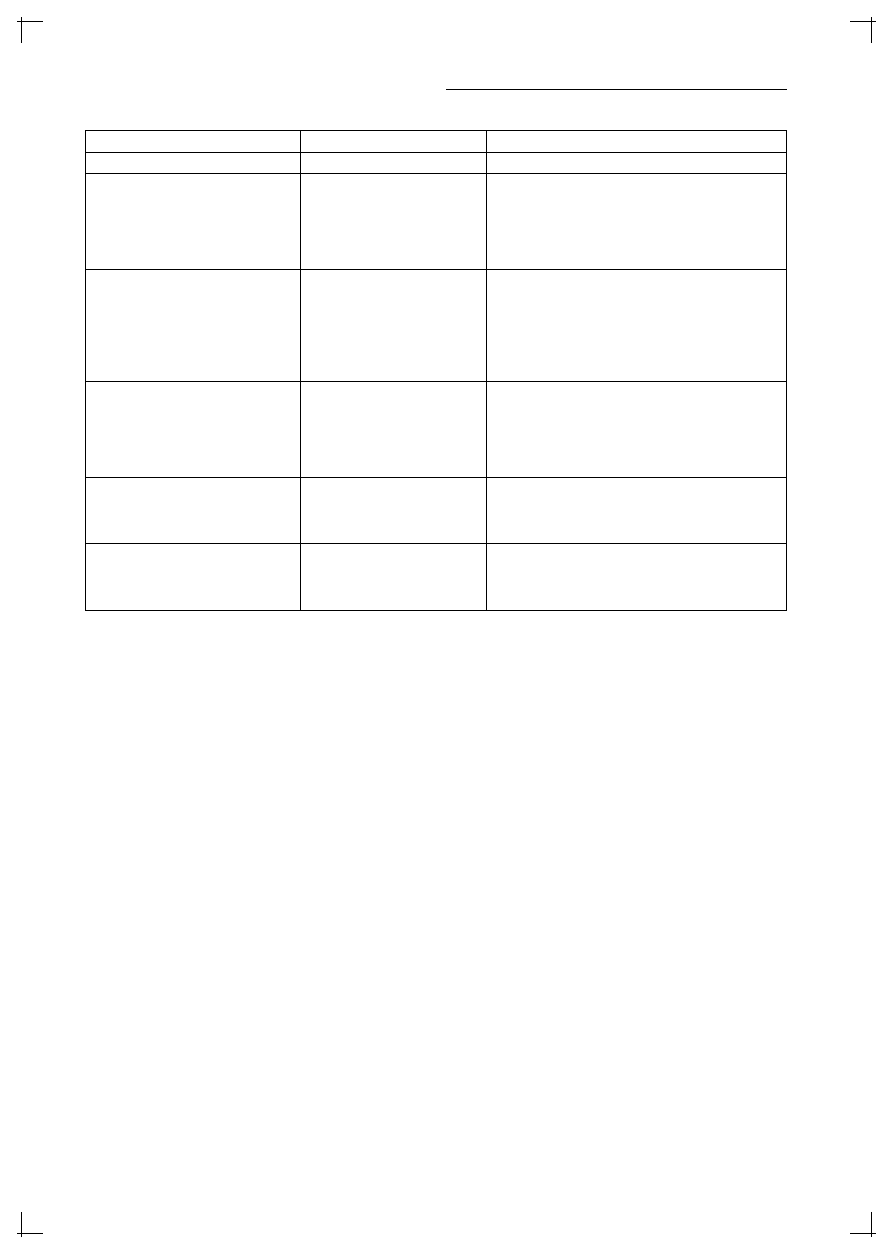
Przykłady leków stosowanych w terapii uzależ-
nienia od nikotyny podano w tabeli 3.
Ograniczenie szkodliwych wpływów środowiska
Chory na POChP nie powinien pracować ani
przebywać w środowisku zadymionym i zapylo-
nym. Podstawowym celem działań zapobiegaw-
czych, prowadzonych jako profilaktyka pierwotna
lub wtórna, jest zmniejszenie lub wyeliminowanie
narażenia na potencjalne szkodliwe zanieczyszcze-
nia powietrza.
Najważniejsze metody profilaktyczne:
1. Profilaktyka pierwotna
• popularyzacja oświaty zdrowotnej (uświa-
domienie szkodliwości czynników środowi-
skowych)
• przedsięwzięcia techniczne, zmniejszające
zapylenie powietrza przez wprowadzenie
bezpiecznych technologii produkcyjnych
• poprawa wentylacji pomieszczeń
• automatyzacja i hermetyzacja procesów
produkcyjnych.
2. Profilaktyka wtórna
• indywidualne środki ochronne, maski, heł-
my izolujące
• poprawa organizacji pracy: przerwy
w pracy, rotacja pracowników na szczegól-
nie narażonych stanowiskach.
1. Pytaj każdego pacjenta podczas każdej wizyty
o nałóg palenia
2. Poradź palaczowi tytoniu, by zaprzestał pale-
nia
3. Pamiętaj ocenić stan gotowości do zaprzesta-
nia palenia (test Schneidera, Aneks 2)
4. Pomóż palącemu
a. oceń stopień uzależnienia od nikotyny (test
Fagerströma, Aneks 3)
b. osobom uzależnionym przepisz leczenie
5. Przeprowadź wizyty kontrolne
Taka interwencja może spowodować, że około 2-
5% pacjentów trwale porzuci nałóg (27). Powinien
ją stosować każdy lekarz w kontaktach z każdym
palącym pacjentem. Zasada minimalnej interwencji
obowiązuje nawet wówczas, gdy pacjent nie ma ob-
jawów chorobowych i nie porusza tematu palenia w
rozmowie z lekarzem. Informację o paleniu i prze-
prowadzonej poradzie należy zanotować w łatwo
zauważalnym miejscu w dokumentacji lekarskiej.
Ostatnio wykazano, że palacze, u których wykry-
wa się obturację oskrzeli w czasie badań spirome-
trycznych i którzy mieli udzieloną poradę antyni-
kotynową, częściej porzucają palenie, niż palacze
z prawidłową czynnością płuc (28). Dlatego wska-
zane jest udzielanie krótkiej porady antynikotyno-
wej, popartej pokazaniem wyników tego badania
każdemu palaczowi podczas wizyty u lekarza.
Odchodzenie od nałogu ułatwia stosowanie
nikotynowej terapii zastępczej (NTZ). Lekami
o udowodnionej skuteczności są preparaty zawie-
rające nikotynę, w gumie do żucia lub plastrach
naskórnych. Ostatnio pojawiły się preparaty za-
wierające nikotynę w pastylkach podjęzykowych
Profilaktyka
Polska 2004/72
13
Szczepienia przeciwko grypie
Zaleca się szczepienia przeciwko grypie u cho-
rych na POChP z ciężkimi postaciami choroby,
zwłaszcza w starszych grupach wiekowych (33).
Większość obecnie używanych szczepionek
przeciwko grypie zawiera fragmenty części po-
włokowej wirusa. Są one zwykle szczepionkami
trójwalentnymi, tzn. skierowane są przeciwko dwu
podtypom wirusa grypy typu A oraz wirusom grypy
typu B. Szczepienia powinny być powtarzane co-
rocznie przed spodziewanym sezonem zachorowań
ze względu na zmienność antygenową wirusa i krót-
kotrwałość odpowiedzi immunologicznej. Skład
szczepów w szczepionce jest każdego roku dobiera-
ny w ten sposób, aby uodparniać przeciw szczepowi
spodziewanemu w następnym sezonie.
Wśród szczepionych młodych dorosłych częstość
zakażeń po szczepieniu spada o 60-80%, podczas
gdy wśród osób starszych częstość zachorowań ob-
niża się jedynie o 30%. Jednakże liczba zachorowań
na cięższe postacie grypy i śmiertelność z jej powo-
du zmniejsza się o 70%.
Szczepienia przeciwko Streptococcus pneumo-
niae
Streptococcus pneumoniae jest jedną z naj-
częstszych przyczyn zakażeń układu oddechowe-
go w wieku podeszłym. W Polsce dostępna jest
23-walentna szczepionka przeciw Streptococcus
pneumoniae obejmująca najczęściej występujące
w schorzeniach układu oddechowego i nerwowego
serotypy. Jednorazowe szczepienie można zalecać
u chorych na POChP po 65 roku życia (34).
Leczenie stabilnej postaci choroby
Podstawą leczenia chorych na POChP jest stoso-
wanie leków rozszerzających oskrzela. Stosuje się
trzy grupy leków: cholinolityki, leki β
2
-sympaty-
komimetyczne i pochodne teofiliny (1,35). Stoso-
wanie leków długo działających jest skuteczniejsze
i wygodniejsze od krótko działających.
Cholinolityki
Mechanizm działania
Leki cholinolityczne blokują receptory muskary-
nowe powodując:
• rozkurcz mięśni gładkich oskrzeli,
• zmniejszenie produkcji śluzu.
Dotychczas stosowane cholinolityki są niewy-
biórczymi antagonistami wszystkich grup recepto-
rów muskarynowych (M
1
, M
2
, M
3
). Leki tej grupy
zmniejszają patologiczne napięcie mięśni oskrzeli,
zapobiegają odruchowemu skurczowi oskrzeli
Tabela 3. Przykłady leków stosowanych w terapii uzależnienia od nikotyny
Nikotynowa terapia zastępcza
Postacie leku
Sposób podawania/dawki
Lecznicza guma do żucia
Zaprzestanie palenia następuje
w momencie rozpoczęcia leczenia
guma do żucia zawierająca 2
mg lub 4mg nikotyny
w 1 kostce
Dawki stosowane w zależności od stopnia uzależnie-
nia od nikotyny, 2 lub 4 mg co 2 godziny (maksy-
malnie 20 kostek/dz), przez 8 tygodni.
U osób silnie uzależnionych, (wynik testu Fager-
ströma ≥ 7 pkt.) leczenie zaczynać od gumy 4mg,
a następnie obniżać dawkę.
Plastry zawierające nikotynę
Zaprzestanie palenia następuje
w momencie rozpoczęcia leczenia
5, 10, 15 mg wchłaniane
przez 16 godzin/dobę,
10, 20, 30 cm
2
wchłaniane
przez 24 godziny/dobę,
Stosować plastry na suchą nie owłosioną skórę,
codziennie rano naklejając w innym miejscu przez
8 tygodni. Dawkowanie zależy od stopnia uzależnie-
nia. U osób silnie uzależnionych, (wynik testu Fager-
ströma ≥ 7 pkt.) rozpoczynać dawkowanie
od najwyższych dawek, następnie obniżać dawkę
po 4 i kolejnych 2 tygodniach.
Pastylki zawierające nikotynę
Zaprzestanie palenia następuje
w momencie rozpoczęcia leczenia
pastylki zawierające 2 mg
lub 4mg nikotyny
Dawki stosowane w zależności od stopnia uzależnie-
nia od nikotyny, 2 lub 4 mg co 2 godziny (maksy-
malnie 20 pastylek/dz), przez 8 tygodni.
U osób silnie uzależnionych, (wynik testu Fager-
ströma ≥ 7 pkt.) leczenie zaczynać od dawki 4mg,
a następnie obniżać dawkę.
Inhalator z kapsułkami zawierajacy-
mi nikotynę
Zaprzestanie palenia następuje
w momencie rozpoczęcia leczenia
kapsułki zawierające 10 mg
nikotyny
Po włożeniu kapsułki do inhalatora wdychać szybko
ok. 80 razy.
Maksymalnie używać 16 inhalacji dziennie
inne leki
Bupropion
Zaprzestanie palenia planuje się
dopiero w drugim tygodniu leczenia
tabletki 150 mg
Przez pierwsze 3 dni 150mg 1x dziennie, następnie
przez 7 tygodni 2xdz. 150mg. Koniecznie zachowy-
wać 8 godzinny odstęp między dawkami.
Leczenie stabilnej postaci POChP

14
Pneumonologia i Alergologia
wywołanemu pobudzeniem wolnych zakończeń
nerwowych I (irritant) i włókien C oraz zapobiegają
nocnej obturacji związanej z wagotonią.
Leki cholinolityczne, ze względu na mechanizm
działania – blokujący mediowany drogą nerwu
błędnego skurcz oskrzeli – oraz niewielkie działa-
nia niepożądane, są wskazane w leczeniu każdego
stadium POChP (36). Najczęściej stosuje się bro-
mek ipratropium i połączenie bromku ipratropium
z fenoterolem. Są to leki działające krótko, wyma-
gające stosowania 4 x na dobę (37). Dawkę ipratro-
pium można zwiększyć bezpiecznie do 4 x 120 μg.
Bezpieczeństwo tej dawki wynika z miejscowego
działania leku i niewielkich objawów niepożąda-
nych (36).
Wykazano, że nowy, długodziałający lek cho-
linolityczny (bromek tiotropium) stosowany
w jednorazowej dawce 18 μg/dobę wykazuje sil-
niejsze działanie od bromku ipratropium u chorych
na POChP (38,39). Lek poprawia istotnie drożność
oskrzeli, w porównaniu do placebo (40), nawet
u chorych z małą rozszerzalnością oskrzeli (41),
oraz zmniejsza rozdęcie płuc (42). Wyraźnie
zmniejsza duszność (41,42) i poprawia jakość życia
chorych (39,41). Wykazano również, że długotrwa-
łe stosowanie bromku tiotropium zmniejsza wystę-
powanie zaostrzeń POChP (43,44) oraz zmniejsza
liczbę i długość hospitalizacji (41).
Połączenie cholinolityku i β
2
-mimetyku krótko
działającego (45), leków o różnych mechanizmach
rozszerzających oskrzela, powoduje silniejszy
rozkurcz mięśni gładkich oskrzeli niż stosowanie
każdego z tych leków w monoterapii. Pozwala to
na obniżenie dawki β2-mimetyku, co zmniejsza
objawy niepożądane, przy zachowanym działaniu
rozszerzającym oskrzela.
Połączenie cholinolityku z β2-mimetykiem długo
działającym silniej rozszerza oskrzela niż takie po-
łączenie z lekiem działającym krócej (46).
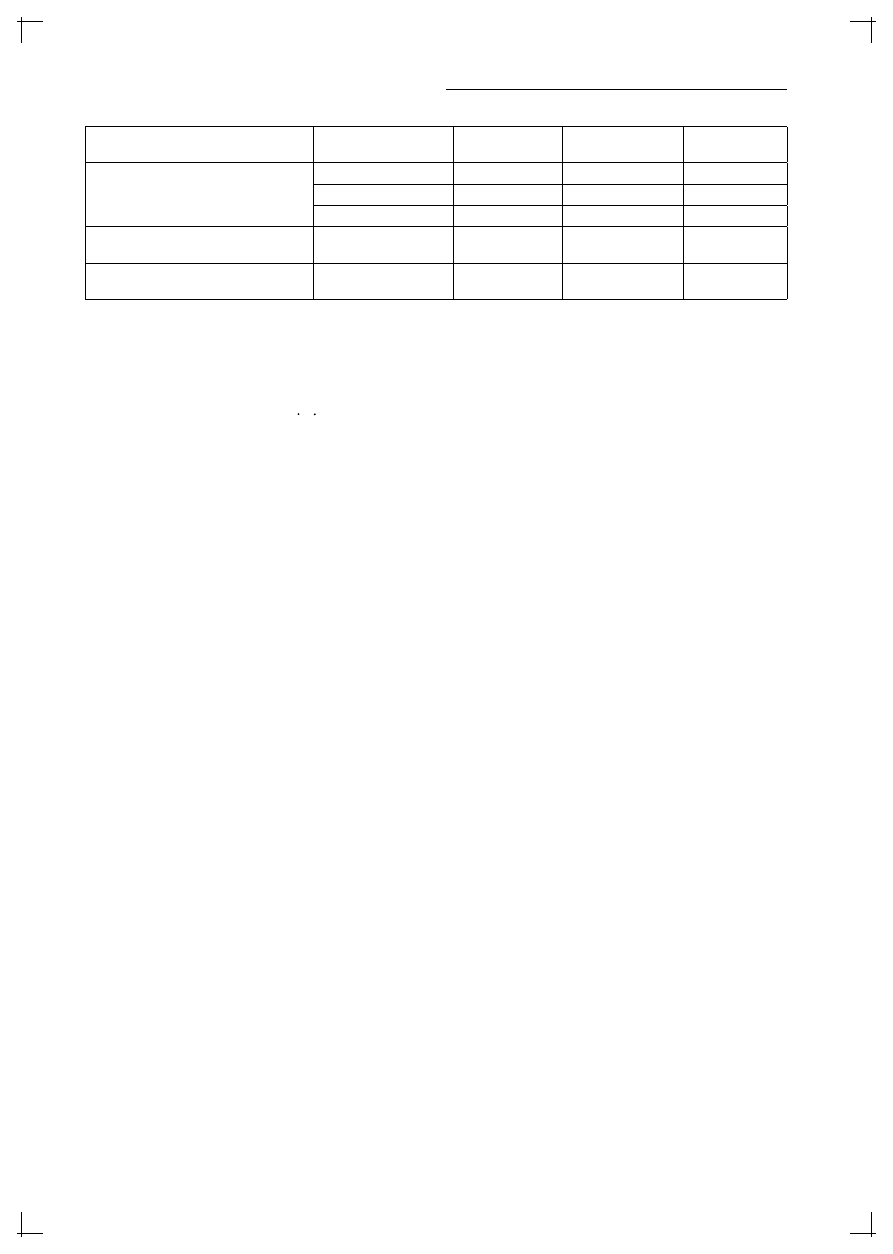
Leki cholinolityczne mają formę wziewną i po-
dawane są za pomocą inhalatorów indywidualnych
ciśnieniowych i proszkowych oraz nebulizatorów.
(Tab.4).
Objawy niepożądane występują wyjątkowo rzad-
ko:
• suchość w ustach
• zatrzymanie moczu
• napad jaskry (przy przedostaniu się leku do
gałki ocznej).
β
2
-sympatykomimetyki
Mechanizm działania
β
2
-mimetyki pobudzając receptory β
2
-adrener-
giczne działają na mięśnie gładkie jako funkcjo-
nalny agonista i zapobiegają skurczowi oskrzeli lub
go odwracają (47). Nasilają również oczyszczanie
rzęskowe, jeśli było zaburzone. Nie wpływają
jednak na przebieg przewlekłego zapalenia i nie
zmniejszają nadreaktywności oskrzeli. Stwierdzo-
no, że leki te zmniejszają przyleganie bakterii do
komórek nabłonka oddechowego, co może ograni-
czać skłonność do zaostrzeń choroby. β
2
-mimetyki
zmniejszają objawy, poprawiają tolerancję wysiłku
oraz jakość życia, co nie zawsze jest związane z po-
prawą wyników badań czynnościowych.
β-mimetyki różnią się między sobą (48):
• selektywnością w stosunku do receptora β
2
,
• zdolnością wiązania z receptorem β
2
,
• szybkością rozpoczęcia działania i czasem
jego trwania,
• siłą działania.
β
2
-mimetyki dzielą się na krótkodziałające – czas
działania wynosi 4-6 godzin, i długodziałające,
o czasie działania 10-12 godzin. Te z kolei dzielą
się na leki o szybkim początku działania oraz o
opóźnionym początku działania. Działanie β
2
-mi-
metyków jest zależne od zastosowanej dawki (49):
Przykłady podano w tabeli 5.
Krótkodziałające β
2
-mimetyki są bardziej sku-
teczne w czasie zaostrzeń choroby, natomiast
długodziałające – w zapobieganiu zaostrzeniom
(50,51).
Objawy niepożądane:
• Drżenie mięśniowe w wyniku pobudzenia
mięśniowych receptorów β
2
.
• Spoczynkowa tachykardia w wyniku pobu-
dzenia receptorów β
2
w przedsionku i jako
odruchowa reakcja na obwodowe rozszerzenie
naczyń przez receptory β
2
w naczyniach. Za-
burzenia rytmu serca występują rzadko.
Tabela 4. Najczęściej stosowane postacie leków cholinolitycznych i ich dawki
Sposób działania
Substancja czynna
Aerozol wziewny
(MDI) (μg)
Proszek do inhalacji
(DPI) (μg)
Roztwór do nebulizacji
(mg)
Krótkodziałające
Ipratropium
20
0,25
Długodziałające
Tiotropium
18
Leczenie stabilnej postaci POChP
Polska 2004/72
15
• Hipokaliemia w wyniku wzrostu wychwytu
potasu przez mięśnie szkieletowe oraz przesu-
nięcia potasu do wnętrza komórki.
• Spadek PaO
2
w wyniku pogłębienia dyspro-
porcji pomiędzy wentylacją pęcherzykową
a przepływem płucnym (VA/Q) z powodu roz-
szerzenia naczyń płucnych.
Teofilina
Teofilina, w postaci preparatów o powolnym
uwalnianiu, należy obok β
2
-mimetyków i leków
cholinolitycznych do podstawowych leków rozkur-
czowych stosowanych w POChP (52).
Mechanizm działania
Działanie teofiliny zależy od nieselektywnego
zahamowania fosfodiesteraz w wielu komórkach,
które prowadzi do wzrostu c-AMP (53). W konse-
kwencji teofilina:
• powoduje rozkurcz mięśni gładkich oskrzeli
w tym małego kalibru,
• wpływa na czynność granulocytów, makrofa-
gów i limfocytów,
• zmniejsza przesięk osocza,
• poprawia klirens śluzowo-rzęskowy,
• może zwiększać siłę skurczu mięśni oddecho-
wych,
• wzmaga wydzielanie adrenaliny.
Niedogodności stosowania
• Mała rozpiętość między dawką terapeutyczną i
toksyczną.
• Stężenie leku we krwi zależy od klirensu kre-
atyniny.
• Przy zahamowanym metabolizmie teofiliny
i obniżonym klirensie dawkę leku należy
zmniejszyć. Dotyczy to chorych z niewydol-
nością serca, hipoksemią i kwasicą oddecho-
wą, uszkodzeniem wątroby, podczas zakażeń
wirusowych, przy stosowaniu erytromycyny,
chinolonów, allopurinolu, ketokonazolu oraz
diety bogatowęglowodanowej i niskobiałko-
wej.
• Przy przyspieszonym metabolizmie teofiliny
lub zwiększonym klirensie dawkę leku trzeba
zwiększyć. Dotyczy to: dzieci, palaczy papie-
rosów, alkoholików, narkomanów, leczonych
riyfampicyną oraz podczas stosowania diety
bogatobiałkowej i ubogowęglowodanowej.
Objawy niepożądane zależą od stężenia leku we
krwi:
• 5-20 μg/ml – bóle głowy, bezsenność, nudno-
ści wymioty, refluks żołądkowo-przełykowy.
• 20-30 μg/ml – zaburzenia rytmu serca (rzadko
występują przy stężeniu nie przekraczającym
20 μg/ml).
• >35 μg/ml – drgawki, zatrzymanie krążenia.
Stosowanie teofiliny
W stopniu II , III i IV choroby zaleca się prepa-
raty o powolnym uwalnianiu teofiliny regularnie w
terapii skojarzonej z innym lekiem rozkurczowym,
zwłaszcza u chorych z hiperkapnią. Preparaty
o powolnym uwalnianiu stosuje się przewlekle 1x
lub 2x dziennie w tabletkach, w dawce od 200 do
350 mg.
Leczenie skojarzone lekami rozszerzającymi
oskrzela
Zalecana jest terapia skojarzona lekami rozsze-
rzającymi oskrzela. Połączenie dwóch lub trzech
leków rozkurczowych z różnych grup jest bardziej
efektywne od monoterapii. Można łączyć krótko-
działające β
2
-mimetyki z długo i krótko działający-
mi cholinolitykami, krótkodziałające β
2
-mimetyki
z teofiliną, długodziałające β
2
-mimetyki z długo
i krótko działającymi cholinolitykami i teofiliną
(54,55).
Kortykosteroidy
W leczeniu stabilnej postaci POChP nie zaleca
się stosowania kortykosteroidów systemowych
– doustnych ani domięśniowych. Liczne doniesie-
nia wskazują, iż przewlekłe stosowanie kortyko-
steroidów systemowych nie wpływa korzystnie na
przebieg choroby, a przyczynia się do występowa-
nia objawów niepożądanych – szczególnie miopatii
posteroidowej (56).
Leczenie stabilnej postaci POChP
Tabela 5. Najczęściej stosowane postacie leków β
2
-minetycznych i ich dawki
Sposób działania
Substancja czynna
Aerozol wziewny
(MDI) (μg)
Proszek do inhalacji
(DPI) (μg)
Roztwór do
nebulizacji (mg)
Krótkodziałające
Fenoterol
100 i 200
200 i 400
0,5 i 2,0
Salbutamol
100 i 200
2,5 i 5,0
Terbutalina
250
500
5,0 i 10,0
Długodziałający o szybkim początku
działania
Formoterol
12 oraz 9 i 4,5
Długodziałający o opóźnionym począt-
ku działania
Salmeterol
25
50
16
Pneumonologia i Alergologia
Kortykosteroidy wziewne
Wieloośrodkowe badania nad efektywnością
kortykosteroidów wziewnych wykazały, że regu-
larne stosowanie tych leków u chorych na POChP
nie zmniejsza rocznego spadku FEV
1
w porównaniu
z grupą kontrolną. Przewlekłe leczenie tymi leka-
mi jest uzasadnione tylko u pacjentów w postaci
umiarkowanej z potwierdzoną istotną poprawą spi-
rometryczną po ich próbnym zastosowaniu i u cho-
rych, u których FEV
1
jest mniejsze od 50% wartości
należnej i u których występują częste zaostrzenia
choroby wymagające stosowania antybiotyków
i kortykosteroidów systemowych (57-60).
U chorych na POChP w postaci umiarkowa-
nej zaleca się przed włączeniem kortykosteroidu
wziewnego wykonanie próby leczenia kortykoste-
roidem wziewnym trwającej od 6 tygodni do 3 mie-
sięcy w celu wyodrębnienia tych, którzy spełniają
kryteria dodatniego wyniku próby odwracalności
obturacji oskrzeli.
Próba odwracalności obturacji oskrzeli po korty-
kosteroidzie wziewnym
Próbę tę należy wykonać w okresie stabilnym
choroby, u chorego o ustalonym wyniku spiro-
metrii. Przed zastosowaniem kortykosteroidów
wziewnych należy wykonać próbę rozkurczową
z bronchodilatatorem (salbutamol 400 μg). Wartość
FEV
1
uzyskana po podaniu bronchodilatatora jest
wartością wyjściową, od której oblicza się wzrost
tej zmiennej po 6-12 tygodniach stosowania kor-
tykosteroidu wziewnego. Stosuje się flutikazon
w dawce 2x500 μg lub 2x600 μg budesonidu lub
3x500 μg beklometazonu. Próbę uważa się za do-
datnią, gdy następuje przyrost FEV
1
przynajmniej
o 200 ml i nie mniej niż 15% w stosunku do war-
tości wyjściowej. Stosując wziewny kortykosteroid
z inhalatora MDI należy podawać go przez spejser.
Antybiotyki
W stabilnej postaci choroby nie stosuje się anty-
biotyków.
Antyoksydanty i mukolityki
Leki mukolityczne (Tab. 6) poprawiają spraw-
ność aparatu rzęskowego, wydzielanie surfaktantu
i czynności obronne układu oddechowego (61,62).
Część mukolityków ma działanie antyoksydacyjne
i podawanie ich zmniejsza częstość zaostrzeń cho-
roby (63,64). Stosowanie leków mukolitycznych
można rozważyć w zaostrzeniach POChP, zwłasz-
cza gdy zaostrzenie jest spowodowane zakażeniem
dróg oddechowych (65).
W leczeniu przewlekłym należy stosować indy-
widualne wskazania. Korzyści z leczenia przewle-
kłego można się spodziewać u chorych na ciężką
postać POChP mających częste zaostrzenia choroby
oraz u osób, które nie zaprzestały palenia tytoniu
(66).
Tabela 6. Wykaz niektórych mukolityków
Nazwa chemiczna
Postać leku
Dawkowanie (dorośli)
Acetylocysteina
granulat po 100 i 200 mg,
doustnie 200 mg
kapsułki po 200mg,
3x dziennie, 600 mg 1x dziennie,
tabletki musujące po 100, 200, 600 mg,
600 mg 1x dziennie
roztwór do inhalacji, podawania dożylnego i do-
oskrzelowego 300 mg/3ml
wziewnie, dożylnie i dooskrzelowo 1amp
1-2x/dobę,
saszetki (100, 200mg)
tabletki musujące (600mg)
Bromheksyna
tabletki (8mg)
3 x 1 tabl.
tabletki (8mg),
3 x 1 tabl.
krople (0,2%, 30ml),
3x 20-40 kropli,
ampułki (4mg/2ml)
8-24mg/dobę dożylnie lub domięśniowo.
Ambroksol
syrop 15mg/5ml, 30mg/5ml
2 x 60 mg
krople 15mg/2ml
doustnie: 2 x 60mg, wziewnie: 2 x 30 mg
ampułki 15 mg/2ml
dożylnie: 3 x 1 ampułka
płyn do inhalacji 15 mg/2ml
wziewnie: 2 x 3 ml
tabletki
doustnie: 3 x 1 tabletka
Leczenie stabilnej postaci POChP

Polska 2004/72
17
Aerozoloterapia
Współczesne, różnorodne metody wytwarza-
nia aerozoli (pneumatyczna, ultradźwiękowa,
ciśnieniowa, proszkowa oraz dodatkowe techniki:
przedłużacze, wibro- i termoaerozole) pozwalają
na uzyskanie depozycji leku inhalowanego w miej-
scu toczącego się procesu chorobowego. Każda
z metod wytwarzania aerozoli winna być dobrana
indywidualnie do proponowanej terapii, jak rów-
nież do każdego chorego. Metoda wziewna służy do
rozpraszania wielu leków, np. środków rozkurcza-
jących oskrzela, przeciwzapalnych, mukolityków
oraz środków nawilżających.
Nowe, małe aparaty inhalacyjne, o uniwersal-
nej możliwości zasilania pozwalają na stosowanie
inhalacji nie tylko w warunkach szpitalnych czy
inhalatorniach, lecz również w domu chorego, jak
i w czasie podróży. Należy dążyć, aby sprzęt inha-
lacyjny (maseczka, nebulizator) był indywidualną
własnością chorego, co eliminuje konieczność sta-
łej dezynfekcji i sterylizacji (67).
Leczenie choroby
w zależności od stopnia zaawansowania
Podstawowym celem leczenia choroby jest spo-
wolnienie jej postępu. Zasadniczym elementem tego
postępowania jest skłonienie chorego do zaprzesta-
nia palenia papierosów. U niektórych chorych za-
hamowanie procesu chorobowego można osiągnąć
przez eliminację z ich środowiska pyłów, gazów
i par drażniących. W każdym stadium choroby na-
leży stosować postępowanie rehabilitacyjne. Przy
używaniu inhalatorów MDI zaleca się stosowanie u
chorych przystawki objętościowej (spejser).
Postępowanie z chorym w łagodnej postaci cho-
roby (I stopień)
U chorych z dusznością wysiłkową zaleca się do-
raźne stosowanie 1-2 wdechów krótkodziałających
leków rozszerzających oskrzela.
Postępowanie z chorym w umiarkowanej posta-
ci choroby (II stopień)
Leczenie lekami rozszerzającymi oskrzela po-
winno być regularne. Chory powinien stosować 4
razy na dobę od 2 do 4 wdechów leku cholinolitycz-
nego krótko działającego lub jedną dawkę na dobę
leku długo działającego. Może również stosować
β
2
-mimetyk krótko działający do 4 razy na dobę
po 1-2 wdechy, lub β
2
-mimetyk długo działający w
dawce 2 x na dobę 1 wdech. Można stosować połą-
czenie cholinolityku i β
2
-mimetyku. W przypadku
utrzymywania się dolegliwości wskazane jest dołą-
czenie do wyżej podanej terapii preparatów teofili-
ny w dawce nie przekraczającej 600 mg/dobę. Gdy
poprawa po lekach rozszerzających oskrzela jest
niezadowalająca, można dołączyć kortykosteroid
wziewny w średniej dawce 2 x dziennie 250-400 μg
u chorych, u których w próbie kortykosteroidowej
uzyskano poprawę parametrów spirometrycznych.
Postępowanie z chorym w ciężkiej i bardzo cięż-
kiej postaci choroby (III i IV stopień)
W tych stadiach zaawansowania zaleca się stoso-
wanie leków rozszerzających oskrzela w dawkach
maksymalnych. Lek cholinolityczny krótkodziała-
jący stosuje się 4 razy na dobę w dawce 4-6 wde-
chów. Pozostałe leki wziewne zaleca się stosować
się jak wyżej. Dawkę teofiliny można zwiększyć
do 700 mg/dobę uwzględniając jej działania nie-
pożądane. U chorych z dodatnim wynikiem pró-
by kortykosteroidowej lub u chorych z częstymi
zaostrzeniami choroby (2-3 razy w roku) zaleca
się stosowanie wziewnych glikokortykosteroidów
w dawce 1000-1200 μg/dobę.
We wstępnych badaniach stwierdzono, że prepa-
raty łączone zawierajace β
2
-mimetyk i glikokorty-
kosteroid są skuteczniejsze od tych leków stosowa-
nych w monoterapii (68,69).
U chorych w tych stadiach zaawansowania cho-
roby często występują wskazania do domowego
leczenia tlenem.
Leczenie tlenem
Niewydolność oddychania w przebiegu POChP
pojawia się najczęściej podczas zaostrzenia choro-
by. Należy rozważyć wtedy wskazania do leczenia
tlenem. Przed podaniem tlenu konieczne jest bada-
nie gazów krwi tętniczej. Na jego podstawie ustala
się potrzebę i sposób podawania tlenu. Wskazaniem
do podania tlenu jest PaO
2
<60 mm Hg. U chorego
z hipoksemią bez hiperkapni należy uzyskać wzrost
PaO
2
co najmniej do 65 mm Hg. Z reguły zaczyna
się od podawania tlenu przez cewnik donosowy przy
przepływie 2 l/min. Po dwóch godzinach ponownie
oznacza się PaO
2
i PaCO
2
. Jeśli podanie tlenu nie
spowodowało wzrostu PaCO
2
, a wzrost PaO
2
jest
niedostateczny, zwiększa się przepływ tlenu o 0,5-
-1 l/min. Szczególną ostrożność w leczeniu tle-
nem należy zachować u chorego z podwyższonym
PaCO
2
(zwłaszcza przy wartościach powyżej 55
mm Hg). U takiego chorego podanie nawet nie-
wielkich ilości tlenu może spowodować znaczną
retencję CO
2
, a nawet śpiączkę hiperkapniczną.
U chorego z hiperkapnią podawanie tlenu rozpo-
czyna się od przepływu 0,5-1 l/min. Narastająca
hiperkapnia może być przyczyną, dla której pod-
Leczenie POChP wg. stopnia zaawansowania

18
Pneumonologia i Alergologia
wyższenie PaO
2
do 65 mm Hg będzie niemożliwe.
Wówczas należy zaakceptować niższe PaO
2
(nawet
około 50 mm Hg), przy którym groźba nasilania się
hiperkapni jest mała.
Jeśli u chorego opuszczającego szpital po opa-
nowaniu zaostrzenia POChP nadal obserwuje się
hipoksemię, należy rozważyć potrzebę domowego
leczenia tlenem (DLT). Do DLT kwalifikują się
chorzy, u których w okresie wyrównania choroby
i przy optymalnym wykorzystaniu leczenia farma-
kologicznego utrzymuje się znaczna hipoksemia.
Kryteria kwalifikacji do DLT:
1. PaO
2
≤55 mm Hg
2. PaO
2
= 56-60 mm Hg, jeśli obecny jest jeden z
następujących objawów:
• radiologiczne cechy nadciśnienia płucnego,
• cechy przerostu prawej komory serca
w EKG,
• poliglobulia (Ht > 55%).
POChP jest jedyną przewlekłą chorobą płuc,
w której potwierdzono korzystne efekty DLT: sta-
bilizację nadciśnienia płucnego, redukcję poliglo-
bulii, poprawę stanu emocjonalnego i wydłużenie
życia. Te korzystne efekty ujawniają się, jeśli chory
oddycha tlenem co najmniej przez 15 godzin na
dobę. Dlatego też należy pacjenta stale zachęcać
do oddychania tlenem jak najdłużej w ciągu doby,
w tym koniecznie przez całą noc. W nocy hipokse-
mia może się znacznie pogłębiać. Stwierdzono, że
znaczne spadki utlenowania w czasie snu są przy-
czyną licznych zaburzeń rytmu serca, które mogą
być niebezpieczne dla życia (21). Podobnie znaczne
spadki utlenowania obserwuje się podczas wysiłku,
a nawet w czasie wykonywania codziennych czyn-
ności życiowych. Wykazano, że u ciężko chorych
wykonywanie podstawowych czynności jest przy-
czyną desaturacji, nawet gdy oddychają tlenem
przy przepływie zapewniającym dobre utlenowanie
w spoczynku (70).
W związku z tym w okresie aktywności fizycznej
chorego zaleca się zwiększanie przepływu tlenu
o 1 l/min w stosunku do przepływu ustalonego w
spoczynku. Jednocześnie udowodniono, że okre-
sowe zwiększenie przepływu tlenu o 1l/min nawet
u chorych ze znaczną hiperkapnią, ale będących
w stabilnym okresie choroby, nie powoduje istotnej
retencji CO
2
.
Leczenie serca płucnego
Jednym z głównych powikłań POChP jest serce
płucne (hipoksyjne nadciśnienie płucne) (71).
Rozwija się ono w trzech okresach: serce płucne
utajone, serce płucne wyrównane i serce płucne
niewyrównane, które cechuje się objawami za-
stoinowej niewydolności krążenia. Dwa pierwsze
okresy nie wymagają specjalnego leczenia. Należy
odpowiednio leczyć chorobę zasadniczą, aby nie
dopuścić do pojawienia się trzeciego okresu. Naj-
skuteczniejszym sposobem zapobiegania nasilaniu
się hipoksyjnego nadciśnienia płucnego jest domo-
we leczenie tlenem (72).
Pojawienie się obrzęków u chorego na POChP
jest zazwyczaj skutkiem nasilania się zaburzeń
wymiany gazów w płucach. Narastanie hipoksji
pęcherzykowej powodujące wzrost naczyniowe-
go oporu płucnego oraz kwasica oddechowa są
bezpośrednimi przyczynami zatrzymania wody
i sodu.
Najskuteczniejszym sposobem leczenia zdekom-
pensowanego serca płucnego jest stałe podawanie
tlenu oraz rozważne leczenie moczopędne. Należy
uzupełniać niedobór potasu i unikać leków zakwa-
szających (inhibitory anhydrazy węglanowej). Leki
rozszerzające naczynia powinny być stosowane
wyłącznie w niewydolności serca opornej na wyżej
sugerowane leczenie. Nie powinno się ich stosować
dla obniżenia ciśnienia w tętnicy płucnej. Leków
nasercowych o działaniu inotropowym nie stosuje
się rutynowo. Nadmierne przyspieszenie czynno-
ści serca można kontrolować małymi dawkami
β-adrenolityku (atenolol). Obniżenie wysokiego
(>55%) hematokrytu krwioupustem, z jednocze-
snym uzupełnieniem objętości krwi krążącej drob-
nocząsteczkowym dekstranem, może być pomocne
w przypadku opornej na leczenie niewydolności
serca oraz objawów utrudnienia przepływu krwi
przez ośrodkowy układ nerwowy.
Przyczyną wystąpienia niewydolności serca lub
zaostrzenia niewydolności oddychania może być
nawet niewielki zator tętnicy płucnej. Wydaje się,
że jest to powikłanie znacznie częstsze niż się je
rozpoznaje. U unieruchomionych chorych należy
stosować profilaktycznie drobnocząsteczkowe he-
paryny. U chorych z rozpoznanym zatorem tętnicy
płucnej stosuje się heparynę dożylnie we wlewie
ciągłym, ewentualnie leczenie fibrynolityczne.
Operacyjne zmniejszenie objętości płuc
Zabieg polega na wycięciu części miąższu
płucnego u chorych z nierównomiernie nasiloną
rozedmą płuc bez dużych pęcherzy rozedmowych.
Podczas operacji usuwa się około 25-30% najbar-
dziej zniszczonych brzeżnych części płuc. Wyboru
odpowiednich fragmentów do usunięcia dokonuje
się na podstawie wyników tomografii kompute-
rowej klatki piersiowej (73). W ciągu pierwszych
6 miesięcy po zabiegu obserwuje się zmniejszenie
objętości zalegającej, zwiększenie VC i FEV
1
, po-
Tlenoterapia, leczenie serca płucnego

Polska 2004/72
19
prawę tolerancji wysiłku, zmniejszenie duszności
wysiłkowej oraz wzrost PaO
2
. Poprawa utrzymuje
się przeciętnie przez 3 lata (74).
Wskazania do zabiegu (75):
1. kliniczne cechy rozedmy
2. wiek <70 lat
3. nierównomierna rozedma płuc zlokalizowana
w górnych płatach widoczna w tomografii
komputerowej
4. niska tolerancja wysiłku, bez poprawy po reha-
bilitacji oddechowej
5. czynność płuc i średnie ciśnienie w tętnicy
płucnej (PPA) określone następującymi para-
metrami:
• 20%< FEV
1
<50% normy i >0,5 l
• objętość zalegająca (RV) >250% normy
• całkowita pojemność płuc (TLC) >120%
normy
• RV/TLC >60%
• pojemność dyfuzyjna płuc dla tlenku węgla
(TLCO): 20%< TLCO <50% normy
• PaCO
2
<55 mm Hg (<50 mm Hg)
• PPA <35 mm Hg
Rehabilitacja
Podstawowym celem rehabilitacji jest zmniej-
szenie objawów choroby, poprawa jakości życia
oraz zwiększenie fizycznego i emocjonalnego
uczestnictwa w codziennej aktywności życiowej.
Rehabilitacja ma również poza medyczne cele,
takie jak poprawa sprawności i kondycji fizycznej,
walka ze społeczną izolacją chorych, przeciwdzia-
łanie depresji, przystosowanie do nowej sytuacji
życiowej, edukacja pacjenta i jego otoczenia
o chorobie. Wszyscy chorzy na POChP, niezależnie
od stadium choroby, odnoszą korzyści z ćwiczeń
fizycznych zarówno ze względu na polepszenie
tolerancji wysiłku, (76) jak i zmniejszenie obja-
wów duszności (77) i zmęczenia. Trening fizyczny
powinien trwać minimum 6-8 tygodni. Uważa się,
że korzyści utrzymują się do roku po zakończeniu
jednorazowego programu rehabilitacji. Korzyści
wynikające z prowadzenia zajęć rehabilitacyjnych
obserwowano niezależnie od miejsca, w którym się
odbywały: w szpitalu, ambulatorium czy w domu
pacjenta (78).
Rehabilitacja, czyli proces przywracania
w miarę prawidłowych funkcji organizmu chore-
go, oraz optymalizacja jego pozycji w środowisku
jest działaniem, które powinno być stosowane na
każdym etapie zaawansowania choroby. We wstęp-
nym okresie choroby należy przekonać pacjenta o
konieczności zaprzestania palenia tytoniu. W razie
wstępnego niepowodzenia poradnictwo antynikoty-
nowe należy prowadzić stale, przy każdym kontak-
cie z chorym.
Podstawowe elementy programu rehabilitacji
oddechowej to:
• rehabilitacja ruchowa i trening fizyczny (wy-
trzymałościowy i siłowy) (79)
• trening mięśni oddechowych (80)
• ćwiczenia oddechowe
• odżywianie
• psychoterapia
• edukacja pacjenta i jego rodziny
• wsparcie psychospołeczne
Należy przekazać choremu podstawowe wiado-
mości o jego chorobie oraz o sposobie działania
i spodziewanych efektach stosowanych leków, czy-
niąc go aktywnym, świadomym uczestnikiem dłu-
goletniego leczenia. Zespół leczący powinien być
dla chorego źródłem siły do dostosowania się do
choroby, poczucia bezpieczeństwa i optymistyczne-
go spojrzenia w przyszłość.
Po pojawieniu się duszności wysiłkowej należy
zachęcać chorych do kontynuowania wysiłków fi-
zycznych, aby nie dopuścić do wystąpienia błędne-
go koła następstw: duszność niechęć do wysiłku
zanik mięśni i upośledzenie wykorzystania przez
nie tlenu wzmożone zapotrzebowanie na tlen
zwiększony wysiłek oddechowy większa dusz-
ność.
Rehabilitację oddechową należy rozpocząć już
w 2-3 dobie zaostrzenia choroby, a koniecznie po
opanowaniu zaostrzenia, zmuszającego do leżenia
w łóżku. Konieczne jest prowadzenie intensywnego
kilkutygodniowego programu poprawy sprawności
fizycznej. Dwudziesto-, trzydziestominutowe ćwi-
czenia na stacjonarnym cykloergometrze lub 30-mi-
nutowe spacery przez 5 dni w tygodniu są prostym
sposobem przywrócenia podstawowej zdolności do
wysiłku, która powinna być podtrzymana kontynu-
owaniem regularnych wysiłków fizycznych. Nauka
odpowiedniej techniki oddychania łagodzi uczucie
duszności.
W końcowym stadium choroby pomoc rodziny,
najbliższego otoczenia, ochotnicza lub zinstytucjo-
nalizowana powinna umożliwić choremu godziwe
życie w domu.
Leczenie zaostrzeń
Zaostrzenie POChP określa się jako nagłe, cięż-
kie i/lub trwające ponad 24-godzinne pogorszenie
stanu chorego, wymagające zmian w dotychczaso-
wym programie leczenia (81). Przyczyny zaostrzeń
przedstawiono na ryc. 2.
OZOP, Rehabilitacja

20
Pneumonologia i Alergologia
Diagnostyka różnicowa zaostrzenia choroby po-
winna obejmować (82):
• zapalenie płuc
• zastoinową niewydolność krążenia (objawy
zdekompensowanego przewlekłego serca
płucnego lub zawał serca)
• odmę opłucnową
• zatorowość płucną
• ostre zaburzenia rytmu serca (pobudzenia
przedwczesne, częstoskurcz, migotanie przed-
sionków).
W leczeniu zaostrzeń należy uwzględnić:
• stopień ciężkości zaostrzenia
• stopień ciężkości stabilnej postaci choroby
przed zaostrzeniem
• odkrztuszanie ropnej plwociny.
Postępowanie ambulatoryjne
Leczenie ambulatoryjne można stosować u cho-
rych z łagodnym bądź umiarkowanym stopniem
ciężkości choroby, u których w okresie stabilnym
FEV
1
było powyżej 50% wartości należnej. Należy
zwiększyć dawki i/lub częstość przyjmowanych β2-
mimetyków, dodać inhalacje z bromku tiotropium
lub bromku ipratropium w dużych dawkach (jeżeli
chory do tej pory tego leczenia nie stosował) lub
zastosować nebulizację tych leków (jeżeli chory ma
w domu inhalator dyszowy z nebulizatorem). W po-
staci umiarkowanej można rozważyć krótkotrwałe
zastosowanie kortykosteroidów doustnie.
Antybiotykoterapia w zaostrzeniach POChP
W każdej postaci, gdy zwiększa się objętość
odkrztuszanej ropnej plwociny, należy podać an-
tybiotyk z uwzględnieniem antybiotykooporności
lokalnych szczepów Haemophilus influenzae,
Streptococcus pneumoniae, Moraxella catarrhalis
(antybiotykoterapia empiryczna) (83).
Leczenie wstępne zaostrzeń bakteryjnych powin-
no być prowadzone amoksycyliną lub amoksycyli-
ną z kwasem klawulanowym. W leczeniu alterna-
tywnym i skorygowanym stosuje się cefalosporynę
II generacji nowy makrolid lub fluorochinolon II
lub III generacji (84).
Postępowanie szpitalne
Chorzy, u których przed zaostrzeniem FEV
1
było mniejsze niż 50% wartości należnej, często
z objawami niewydolności oddychania i objawami
prawokomorowej niewydolności krążenia, podczas
zaostrzeń powinni być leczeni w szpitalu.
Wskazania do hospitalizacji
• znaczne nasilenie duszności, w szczególności
duszność spoczynkowa
• gorączka
• odkrztuszanie ropnej plwociny
• sinica, obrzęki
• choroby współistniejące
• nowo stwierdzone zaburzenia rytmu serca
• podeszły wiek (>65 r.ż.)
• brak skuteczności leczenia ambulatoryjnego
Postępowanie w szpitalu u chorego z ciężkim
zaostrzeniem
• ocena ciężkości objawów klinicznych
• ocena gazometrii i jej monitorowanie
• Rtg
• ocena przynajmniej PEF (jeżeli chory jest
zdolny do wykonania pomiaru)
• ocena EKG
• ocena podstawowych badań laboratoryjnych
• monitorowanie stężenia elektrolitów w suro-
wicy i bilansu płynów
Postępowanie lecznicze
• Kontrolowana tlenoterapia ciągła
• β2-mimetyk + cholinolityk w nebulizacji – sal-
butamol 2,5-5 mg + bromek ipratropium 250-
500 μg co 4 lub co 8 godzin w zależności od
Ryc. 2. Przyczyny zaostrzeń
POChP.
Leczenie zaostrzeń

Polska 2004/72
21
potrzeby; alternatywnie Berodual do inhalacji
20 kropli z płynem fizjologicznym (2,5 ml) w
nebulizacji w tych samych odstępach czaso-
wych
• teofilina we wlewie dożylnym, w dawce nie-
przekraczającej jednorazowo 300 mg. Należy
zachować szczególną ostrożność, gdy chory
stosował przewlekle doustne preparaty teofi-
liny. Jeśli jest to możliwe, należy oznaczyć
stężenie teofiliny w surowicy. Nie powinno
ono przekroczyć 20 μg/ml
• glikokortykosteroidy doustnie lub dożylnie w
przeliczeniu na prednizon 40 mg/dobę
• antybiotykoterapia dożylna zgodnie z wyżej
przedstawionymi zasadami
• drobnocząsteczkowa heparyna podskórnie
• leczenie współistniejących chorób (niewydol-
ności krążenia, zaburzeń rytmu)
Nieinwazyjne wspomaganie wentylacji (NWW)
W ostatnim dziesięcioleciu rozwinęła się nowa,
nieinwazyjna metoda wspomagania wentylacji płuc
i zwalczania niewyrównanej kwasicy oddechowej
(85). Wspomaganie wentylacji odbywa się przez
maskę nosową lub twarzową. Do NWW używa się
najprostszego, łatwego w obsłudze respiratora, naj-
częściej typu BiPAP.
Wskazaniem do rozpoczęcia NWW jest ciężka
hipoksemia i niewyrównana kwasica oddechowa-:
(86):
• PaO
2
(podczas oddychania tlenem) <50 mm Hg
• PaCO
2
>70 mm Hg
• pH <7,30.
Przeciwwskazania do NWW:
• niestabilność krążenia
• obfite odkrztuszanie i zaleganie wydzieliny w
drogach oddechowych
• zaburzenia świadomości.
NWW wdraża się bezpośrednio po przyjęciu
do szpitala i stwierdzeniu wskazań do jego zasto-
sowania lub po stwierdzeniu, że leczenie tlenem
powoduje nasilenie kwasicy oddechowej (87). Sto-
sowanie NWW nie jest łatwe. Wymaga cierpliwe-
go, wyszkolonego personelu i spędzenia z chorym
niekiedy kilku godzin, zanim leczenie to stanie się
skuteczne i akceptowane przez chorego. W ciągu
kilku pierwszych godzin stosowania NWW podej-
muje się decyzję o jego kontynuacji lub przejściu do
klasycznej wentylacji mechanicznej.
Inwazyjna wentylacja mechaniczna (IWM)
Inwazyjna wentylacja mechaniczna powinna
być stosowana u chorych z zaostrzeniem POChP,
u których istnieją przeciwwskazania do nieinwa-
zyjnej wspomaganej wentylacji (NWW) lub NWW
była nieskuteczna (88). Czynniki, które powinny
być brane pod uwagę przy podejmowaniu decyzji
o rozpoczęciu IWM u chorych w końcowym sta-
dium POChP, to potencjalna odwracalność czyn-
nika powodującego zaostrzenie, (89-93) decyzja
chorego wynikająca z jakości życia w okresie przed
zaostrzeniem oraz dostępność intensywnej opieki
medycznej.
Farmakoekonomika POChP
Dane z piśmiennictwa wskazują na wzrost kosz-
tów bezpośrednich i pośrednich leczenia POChP
(94-97). Koszty leczenia szpitalnego POChP wzra-
stają szybciej niż koszty ponoszone na leki (94,95).
W większości opracowań podkreśla się istotny
koszt leczenia zaostrzeń i hospitalizacji. Hospitali-
zacje stanowią 64% kosztów, leczenie ambulatoryj-
ne 11%, leki 9%, a tlenoterapia 16% (94).
Wykazano ścisłą korelację pomiędzy kosztami
a stopniem zaawansowania POChP. Najtańsze jest
leczenie bromkiem ipratropium i β
2
-mimetykiem
w I stopniu zaawansowania klinicznego (94,97).
Strategia leczenia powinna być ukierunkowana na
zapobieganie zaostrzeniom i konieczności hospita-
lizacji.
Wskazania do inwazyjnej wentylacji mechanicz-
nej są następujące:
• Duszność z użyciem dodatkowych mięśni od-
dechowych i paradoksalne ruchy przepony
• Częstość oddechów > 35/min.
• Zagrażająca życiu hipoksemia (PaO
2
< 40
mmHg podczas podawania tlenu)
• Znaczna kwasica (pH < 7,25) i hiperkapnia
(PaCO
2
> 70 mmHg)
• Zatrzymanie oddechu
• Śpiączka, zaburzenia świadomości
• Powikłania krążeniowe (niedociśnienie tętni-
cze, wstrząs, niewydolność krążenia)
• Powikłania ze strony innych układów (zabu-
rzenia metaboliczne, posocznica, zapalenie
płuc, zatorowość płucna, uraz ciśnieniowy
płuc, masywne nacieki płuc)
• Przeciwwskazane lub nieskuteczne NWW
Farmakoekomika POCHP

22
Pneumonologia i Alergologia
Jakość życia
Związek, jaki zachodzi w POChP pomiędzy
zwężeniem oskrzeli, dusznością i zdolnością wysił-
kową, jest znany, jednak nie ma między nimi prostej
zależności (98-100).
Dlatego skuteczność interwencji leczniczej
w POChP wymaga również zastosowania innych,
poza FEV
1
, wskaźników, które opisują stan zdrowia
chorego.
Najczęściej stosowanymi kwestionariuszami
swoistymi dla POChP są: Chronic Respiratory Qu-
estionnaire (CRQ) i St. George’s Respiratory Qu-
estionnaire (SGRQ). Dostępna jest polska wersja
kwestionariusza SGRQ (101).
Poprawę jakości życia (QL) chorych na POChP
stwierdzono po lekach rozszerzających oskrzela,
programach rehabilitacyjnych, domowym leczeniu
tlenem i nieinwazyjnej wentylacji mechanicznej.
Takimi są wskaźniki jakości życia wyliczone na
podstawie badań ankietowych (102-106).
Jakość życia

Polska 2004/72
23
Aneks 1
Dolna granica normy FEV1%VC dla mężczyzn i kobiet
w zależności od wieku (wg ERS)
Aneks 1
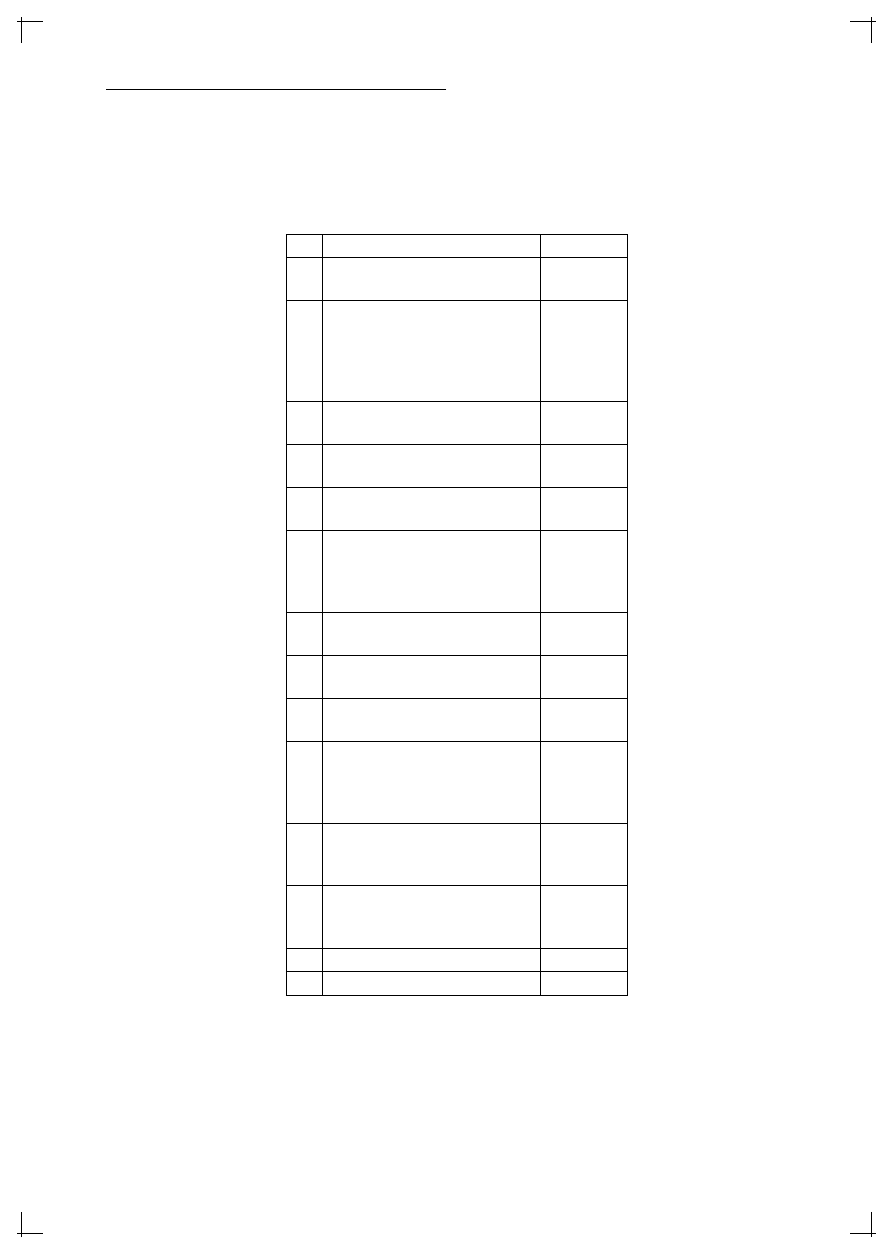
24
Pneumonologia i Alergologia
Aneks 2
Test motywacji do zaprzestania palenia tytoniu wg Schneider.
Proszę zaznaczyć jedną właściwą odpowiedź dla każdego pytania
Lp. Pytanie
Odpowiedź
1 Czy chcesz rzucić palenie
tytoniu?
TAK NIE
2
Czy decydujesz się na rzuce-
nie palenia tytoniu dla samego
siebie (zaznacz TAK), czy dla
kogoś innego, np. dla rodziny
(zaznacz NIE)
TAK NIE
3 Czy podejmowałaś/eś już pró-
by rzucenia palenia?
TAK NIE
4 Czy orientujesz się w jakich
sytuacjach palisz najczęściej? TAK NIE
5 Czy wiesz dlaczego palisz
tytoń?
TAK NIE
6
Czy mogłabyś/mógłbyś liczyć
na pomoc rodziny, przyjaciół
itp. gdybyś chciał/a rzucić
palenie?
TAK NIE
7 Czy członkowie twojej rodzi-
ny są osobami niepalącymi?
TAK NIE
8 Czy w miejscu, w którym pra-
cujesz, nie pali się tytoniu?
TAK NIE
9 Czy jesteś zadowolona/y ze
swojej pracy i trybu życia?
TAK NIE
10
Czy orientujesz się, gdzie i w
jaki sposób szukać pomocy,
gdybyś miał/a problemy z
utrzymaniem abstynencji?
TAK NIE
11
Czy wiesz, na jakie pokusy i
trudności będziesz narażony/a
w okresie abstynencji?
TAK NIE
12
Czy wiesz w jaki sposób
samemu sobie poradzić w
sytuacjach kryzysowych?
TAK NIE
Suma odpowiedzi TAK
Suma odpowiedzi NIE
Interpretacja wyników testu motywacji do zaprzestania palenia wg Schneider:
• przewaga odpowiedzi TAK oznacza istnienie motywacji do zaprzestania palenia,
• przewaga odpowiedzi NIE oznacza brak motywacji do zaprzestania palenia.
Aneks 2

Polska 2004/72
25
Aneks 3
Test uzależnienia od nikotyny wg Fagerströma
Proszę zaznaczyć jedną właściwą odpowiedź dla każdego pytania
Lp.
Pytanie
Odpowiedź
Punktacja
1
Jak szybko po przebudzeniu zapala Pan(Pani)
pierwszego papierosa?
a. do 5 min
3
b. w 6-30 min
2
c. w 31-60 min
1
d. po 60 min
0
2
Czy ma Pan(Pani) trudności z powstrzymaniem się
od palenia w miejscach, gdzie jest to zakazane?
tak
1
nie
0
3
Z którego papierosa jest Panu(Pani) najtrudniej
zrezygnować?
z pierwszego rano
1
z każdego następnego
0
4
Ile papierosów wypala Pan(Pani) w ciągu dnia?
a. 10 lub mniej
0
b. 11-20
1
c. 21-30
2
d. 31 i więcej
3
5.
Czy częściej pali Pan(Pani) papierosy w ciągu
pierwszych godzin po przebudzeniu
niż w pozostałej części dnia?
tak
1
nie
0
6.
Czy pali Pan (Pani) papierosy nawet wtedy,
gdy jest Pan (Pani) tak chory/a, że musi leżeć w łóżku?
tak
1
nie
0
Suma punktów
Aneks 3

26
Pneumonologia i Alergologia
PIŚMIENNICTWO
1. Małolepszy J: Światowa inicjatywa dotycząca przewle-
kłej obturacyjnej choroby płuc. Pol Arch Med Wewn 2001; 105
supl: 1-56.
2. Światowa strategia rozpoznawania, leczenia i prewencji
przewlekłej obturacyjnej choroby płuc. Med. Prakt., wyd. spe-
cjalne 7/2003
3. Rozpoznawanie i leczenie przewlekłej obturacyjnej
choroby płuc – zalecenia Polskiego Towarzystwa Ftizjopneu-
monologicznego. Pneumonol Alergol Pol.2002;70 suplement
2:2-42.
4. Vestbo J, Lange P.: Can GOLD stage 0 provide informa-
tion of prognostic value in chronic obstructive pulmonary dise-
ase?. Am J Respir Crit Care Med 2002; 166: 329-332.
5. Jędrychowski W, Maugeri U. Jędrychowska-Bianchi I. In
search for epidemiologic evidence on air quality and health in
children and adults. Center for Research and Studies in Biome-
dicine in Luxemburg. 2000, Krakow.
6. Pływaczewski R.Bednarek M.Jonczak L.Zieliński J. Cze-
stość występowania POCHP wśrod mieszkańcow prawobrzeż-
nej Warszawa. Pneum. Alerg. Pol. 2003, 71, 320-328
7. Zieliński J, Bednarek M. Early detection of COPD in
a high-risk population using spirometric screening. Chest.
2001;119:731-736.
8. Antó JM, Vermeire P, Sunyer J.: Chronic obstructive
pulmonary disease. Eur Respir Monogr 2000; 5, Monogr 15:
1-22.
9. Jędrychowski W, Wojtyniak B, Gorynski P.: Częstość
hospitalizacji z powodu POChP w Polsce. Przegląd Epidemio-
logiczny, w druku
10. Szafraniec K, Tęcza W, Jędrychowski W: Long-term and
short-term changes in air pollutants and mortality experience
among inhabitants in Cracow. Proceedings of International
Symposium on Health Effects of Particulate Matter in Ambient
Air . Prague, 23-25 April 1997.
11. Wojtyniak B, Piekarski T: Short term effect of air
pollution on mortality in Polish urban populations – what is
different?, J Epidemiol Community Health 1996; 50 (Suppl 1),
36-41.
12. Peleman RA, Rytila PH, Kips JC, i wsp.: The cellular
composition of induced sputum in chronic obstructive pulmo-
nary disease. Eur Respir J. 1999; 13: 839-843.
13. O’Shaughnessy TC, Ansari TW, Barnes NC, i wsp.:
Inflammation in bronchial biopsies of subjects with chronic
bronchitis: inverse relationship of CD8+ T lymphocytes with
FEV1. Am J Respir Crit Care Med. 1997; 155: 852-857.
14. Thompson AB, Daughton D, Robbins RA, i wsp.: Intra-
luminal airway inflammation in chronic bronchitis. Characteri-
zation and correlation with clinical parameters. Am Rev Respir
Dis 1989; 140: 1527-1537.
15. Liu AN, Mohammed AZ, Rice WR, i wsp.: Perforin
– independent CD8+ T-cell-mediated cytotoxicity of alveolar
epithelial cells is preferentially mediated by tumor necrosis fac-
tor-alpha: relative insensitivity to Fas ligand. Am J Respir Cell
Mol Biol 1999; 20: 849-858.
16. Matsuba K, Thurlbeck WM: The number and dimen-
sions of small airways in emphysematous lungs. Am J Pathol
1972; 67: 265-275.
17. Quanjer Ph.H., Tammeling GJ i wsp.. Lung volumes and
forced ventilatory flows. Official statement of the European
Respiratory Society. Eur.Respir.J. 1993; 6, supl. 16: 5-40.
18. Falaschetti E, Laiho J, Primatesta P, Purdon S. Prediction
equations for normal and low lung function from the Health
Survey for England. Eur Respir J. 2004;23:456-463.
19. Zieliński J, Koziej M, Mańkowski M: Zaburzenia oddy-
chania w czasie snu. Wydawnictwo Lekarskie PZWL, Warsza-
wa 1997; 129-133.
20. Pływaczewski R, Śliwiński P, Nowiński A, i wsp.: In-
cidence of nocturnal desaturation while breathing oxygen in
COPD patients undergoing long-term oxygen therapy. Chest
2000; 117: 679-683.
21. Skwarski K: Nocna hipoksemia i zaburzenia rytmu ser-
ca u chorych z przewlekłą obturacyjną chorobą płuc. Pol Arch
Med Wewn 1989; 81: 283-94.
22. Vestbo J, Prescott E, Lange P: Association of chronic
mucus hypersecretion with FEV1 decline and chronic obstruc-
tive pulmonary disease morbidity. Copenhagen City Heart Stu-
dy Group. Am J Respir Crit Care Med 1996; 153: 1530-1535.
23. Fletcher C, Peto R: The natural history of chronic airflow
obstruction. Br Med J 1977; 1: 1645-1648.
24. Burrows B, Kettel LJ, Niden AH, i wsp.: Patterns of car-
diovascular dysfunction in chronic obstructive lung disease. N
Engl J Med 1972; 286: 912-918.
25. Celli BR, Cote CG, Marin JM i wsp. The body-mass
index, airflow obstruction, dyspnea and exercise capacity index
in chronic obstructive pulmonary disease. Engl J Med 2004;
350: 1005-1012.
26. Anthonisen NR, Connett JE, Murray RP: Smoking and
lung function of Lung Health Study participants after 11 years.
Am J Respi Crit Care Med 2002; 166: 675-679.
27. West R, McNeill A, Raw M: Smoking cessation gu-
idelines for health professionals: an update. Thorax 2000; 55:
987-999.
28. Górecka D, Bednarek M, Nowiński A, Puścińska E,
Goljan A, Zieliński J: Diagnosis of airflow limitation combined
with smoking cessation advice increases stop smoking rate.
Chest 2003, 123, 1916-1923.
29. Silagy C, Mant D, Fowler G, Lancaster T: Nicotine re-
placement therapy for smoking cessation. (Cochrane Review)
Cochrane Library Issue 4, 2000; Oxford Update Software.
30. Jorenby DE, Leischow SJ, Nides MA, i wsp.: A control-
led trial of sustained-release bupropion, a nicotine patch or both
for smoking cessation. N Engl J Med 1999; 340: 685-691.
31. Tashkin DP, Kanner R, Bailey W, i wsp.: Smoking ces-
sation in patients with chronic obstructive pulmonary disease:
a double-blind, placebo-controlled, randomized trial. Lancet,
2001; 357: 1571-1575.
32. Górecka D: Nowe perspektywy leczenia uzależnienia od
nikotyny. Medipress Med. update 2000; supl. 7: 18-24.
33. Poole PJ, Chacko E, Wood-Baker RW, i wsp.: Influenza
vaccine for patients with chronic obstructive pulmonary dise-
ase (Cochrane Review). Cochrane Data base Syst Rev 2000;
CD002733.
34. Nichol KL, Baken L, Wuorenma J, i wsp.: The health
and economic benefits associated with pneumococcal vaccina-
tion of elderly persons with chronic lung disease. Arch Intern
Med 1999; 159: 2437 – 2442.
35. Calverley PM: Modern treatment of chronic obstructive
pulmonary disease. Eur Respir J 2001;18: suppl. 34. 60s-66s.
36. Ferguson GT, Cherniack RM: Management of chronic
obstructive pulmonary disease. N Engl J Med 1993; 328: 1017-
1022.
37. Rennard Sl, Serby CW, Ghafouri M, i wsp.: Extended
therapy with ipratropium is associated with improved lung
function in patients with COPD. A retrospective analysis of
data from seven clinical trials. Chest 1996; 110: 62-70.
38. van Noord JA, Bantje ThA, Eland ME i wsp. A rando-
Piśmiennictwo

Polska 2004/72
27
mized controlled comparison of tiotropium and ipratropium in
the treatment of chronic obstructive pulmonary disease. Thorax
2000, 55, 289-294.
39. Vincken W, van Noord JA, Greefhorst APM, i wsp.:
Improved health outcomes in patients with COPD during 1 yr’s
treatment with tiotropium. Eur Respir J 2002; 19: 209-216.
40. Casaburi R, Mahler DA, Jones PW i wsp. A long-term
evaluation of once-daily inhaled tiotropium in chronic obstruc-
tive pulmonary disease. Eur. Respir. J 2002, 19, 217-224.
41. Tashkin D, Kesten S. Long-term treatemnt benefits with
tiotropium in COPD patients with and without short-term bron-
chodilator responses. Chest 2003, 123, 1441-1449.
42. Celli B, ZuWallack R, Wang S et. al:. Improvment in re-
sting inspiratory capacity and hyperinflation with tiotropiumin
COPD patients with increased static lung volumes. Chest 2003,
124, 1743-1748.
43. Brusasco V, Hodder R, Miravitlles M i wsp.: Health
outcomes following treatment for six months with once daily
tiotropium compared with twice daily salmeterol in patients
with COPD. Thorax 2003, 58, 399-404.
44. Donohue JF, Menjoge S, Kesten S.: Tolerance to
bronchodilating effects of salmeterol in COPD. Respir Med.
2003;97:1014-20.
45. In chronic obstructive pulmonary disease, a combination of
ipratropium and albuterol is more effective than either agent alone.
Inhalation Aerosol Study Group. Chest 1994; 105: 1411-1419.
46. D’Urzo AD, De Salvo MC, Ramirez-Rivera A i wsp.: In
patients with COPD treatment with a combination of formo-
terol and ipratropium is more effective than a combination of
salbutamol and ipratropium. Chest 2001, 119, 1347-1356.
47. Ligett SB: Beta-2 adrenergic receptor pharmacogenetics.
Am J Respir Crit Care Med 2000; 161 3/2: S197-201.
48. Appelton S, Smith B, Veale A, Bara A.: Long-acting
beta-2 agonists for chronic obstructive airways disease. Co-
chrane Datebase Syst Rev 2002;2 CD 1104.
49. Hansel TT, Barnes PJ: New drugs for asthma allergy and
COPD w: Progress in Respiratory Research ed. v. 31. Bolliger
CT. Karget 2001.
50. Boyd G, Morice AH, Pounsford JC, i wsp.: An evalu-
ation of salmeterol in the treatment of chronic obstructive pul-
monary disease (COPD). Eur Respir J 1997;10:815-821.
51. Mahler DA, Donohue JF, Barbee RA, i wsp.: Efficacy
of salmeterol xinafoate in the treatment of COPD. Chest 1999;
115: 957-965.
52. Mc Kay SE, Howie CA, Thomson AH, i wsp.: Value
of theophylline treatment in patients handicapped by chronic
obstructive lung disease. Thorax 1993; 48: 227-232.
53. Grotendorst DC, Rabe K: Selective phosphodiesterase
inhibitors for the treatment of asthma and chronic obstructive
pulmonary disease. Curr Opin Allergy Clin Immunol. 2002; 2:
261-67.
54. Friedman M, Serby CW, Menjoge SS, i wsp.: Pharma-
coeconomic evaluation of a combination of ipratropium plus
albuterol compared with ipratropium alone and albuterol alone
in COPD. Chest 1999; 115: 635-641.
55. Van Noord JA, de Munck DRA, Bantje TA, i wsp.:
Long-term treatment of chronic obstructive pulmonary disease
with salmeterol and the additive effect of ipratropium. Eur Re-
spir J. 2000; 15: 878-85.
56. Decramer M, Stas KJ: Corticosteroid–induced my-
opathy involving respiratory muscles in patients with chronic
obstructive pulmonary disease or asthma. Am Rev Respir Dis
1992; 146: 800-802.
57. Pauwels RA, Lofdahl CG, Laitinen LA, i wsp.: Long
term treatment with inhaled budesonide in persons with mild
chronic obstructive pulmonary disease who continue smoking;
N Engl J Med; 1999; 340: 1948-1953.
58. Vestbo J, Sorensen T, Lange P, i wsp.; Long-term effect
of inhaled budesonide in mild and moderate chronic obstructive
pulmonary disease: a randomised controlled trial. Lancet 1999;
353: 1819-1823.
59. Burge PS, Calverley PMA, Jones PW, i wsp.: Rando-
mized, double blind, placebo controlled study of fluticasone
propionate in patients with moderate to severe chronic obstruc-
tive pulmonary disease; the ISOLDE trial. BMJ 2000; 320:
1297-303.
60. The Lung Health Study Research Group: Effect of in-
haled triamcinolone on the decline in pulmonary function in
chronic obstructive pulmonary disease. N Engl J Med 2000;
343: 1902-1909.
61. Kasielski M, Nowak D: Long-term administration of
N-acetylcysteine decreases hydrogen peroxide exhalation in
subjects with chronic obstructive pulmonary disease. Respir
Med 2001; 95: 448-456.
62. Barnes P: Chronic obstructive pulmonary disease. N
Engl J Med 2000; 343: 269-280.
63. Bridgeman MME, Marsden M, MacNee W, i wsp.:
Cysteine and glutathione concentrations in plasma and bron-
choalveolar lavage fluid after treatment with N-acetylcysteine.
Thorax 1991; 46: 39-42.
64. Decramer M, Dekhuijzen PN, Troosters T i wsp.: The
bronchitis randomized on NAC cost-utility study (BRONCUS):
hypothesis and design. Eur Respir J 2001; 17: 329-336.
65. Jahnz-Różyk K, Kucharczyk A, Chciałowski A i wsp.:
Wpływ leczenia wziewną postacią ambroksolu na objawy
kliniczne i wybrane parametry wentylacji u chorych hospi-
talizowanych z powodu zaostrzenia przewlekłej obturacyjnej
choroby płuc. Pol Merkuriusz Lek, 2001; 11: 239- 243.
66. Poole PJ, Black PN: Oral mucolytic drugs for exacer-
bations of chronic obstructive pulmonary disease: systematic
review. BMJ 2001; 322: 1271-1274.
67. Brocklebank DM, Ram F, Wright J, i wsp.: Comparison
of the effectiveness of inhaler devices in asthma and chronic
obstructive airways disease: a systematic review of the literatu-
re, Health Technol Assess 2001; 5, 26, 1-149.
68. Szafrański, W.Cukier A.Ramirez A.Menga G. et al:Ffficacy
and safety of budesonide/formoterol in the management of chronic
obstructive pulmonary disease,Eur.Resp.J.2003,21,75-81
69. Calverley Pauwels K., Vestboy J. i wsp.: For the TRI-
STAN study group. Combined salmeterol and fluticasone in the
treatment of chronic obstructive pulmonary disease: a randomi-
zed controlled trial.Lancet 2003,361;449-456.
70. Śliwiński P, Łagosz M, Górecka D, Zieliński J: The ade-
quacy of oxygenation in COPD patients undergoing long-term
oxygen therapy assessed by pulse oximetry at home. Eur Respir
J 1994; 7: 274-278.
71. Zieliński J: Przewlekłe serce płucne. Wyd. IV, PZWL,
Warszawa, 1996.
72. Zieliński J, Tobiasz M, Hawryłkiewicz I, i wsp.: Effects
of long-term oxygen therapy on pulmonary hemodynamics in
COPD patients. Chest 1998; 113: 65-70.
73. Flaherty KR, Kazerooni EA, Curtis JL, i wsp.: Short-term
and long-term outcomes after bilateral lung volume reduction sur-
gery: prediction by quantitative CT. Chest 2001; 119: 1337-1346.
74. Gelb AF, McKenna RJ Jr, Brenner M, i wsp.: Lung func-
tion 5 yr after lung volume reduction surgery for emphysema.
Am J Respir Crit Care Med 2001; 163: 1562-1566.
75. Hamacher J, Russi EW, Weder W: Lung volume reduc-
Piśmiennictwo

28
Pneumonologia i Alergologia
tion surgery: a survey on the European experience. Chest 2000;
117: 1560-1567.
76. Goldstein RS, Gort EH, Stubbing D, i wsp.:Randomised
controlled trial of respiratory rehabilitation. Lancet 1994; 344:
1394-1397.
77. O’Donnell DE, McGuire M, Samis L, i wsp.: The impact
of exercise reconditioning on breathlessness in severe chronic
airflow limitation. Am J Respir Crit Care Med 1995;152: 2005-
2013.
78. Troosters T, Gosselink R, Decramer M: Short and long-
term effects of outpatient rehabilitation in patients with chronic
obstructive pulmonary disease a randomized trial. Am J Med
2000; 109: 207-212.
79. Gosselink R, Troosters T, Decramer M: Peripheral mu-
scle weakness contributes to exercise limitation in COPD. Am
J Respir Crit Care Med 1996; 153: 976-980.
80. Smith K, Cook D, Guyatt GH i wsp.: Respiratory muscle
training in chronic airflow limitation: a meta – analysis. Am
Rev Respir Dis 1992; 145: 533-539.
81. Rodriguez-Roisin R; Toward a consensus definition for
COPD exacerbations. Chest 2000; 117(5 Suppl 2): 398S-401S.
82. Garcia-Aymerich J, Barreiro E, Farrero E, i wsp.: Pa-
tients hospitalized for COPD have a high prevalence of modi-
fiable risk factors for exacerbation (EFRAM study). Eur Respir
J 2000; 16: 1037-1042.
83. Sethi S: Infectious etiology of acute exacerbations of
chronic bronchitis. Chest 2000; 117 (5 Suppl 2): 380S-385S.
84. Hryniewicz W: Projekt Alexander, Polska Grupa Robo-
cza ds. Rekomendacji i Standardów Profilaktyki i Racjonalnej
Terapii Zakażeń, Warszawa 1999.
85. Hillberg RE, Johnson DC,: Noninvasive ventilation. N
Engl J Med 1997; 337: 1746-1752.
86. Brochard L, Mancebo J, Wysocki M i wsp.: Noninvasive
ventilation for acute exacerbations of chronic obstructive pul-
monary disease. N Engl J Med 1995; 333: 817-822.
87. Muir JF, Cuvelier A, Verin E i wsp.: Noninvasive mecha-
nical ventilation and acute respiratory failure: indications and
limitations. Monaldi Arch Chest Dis. 1997; 52: 56-59.
88. Pingleton SK: Invasive mechanical ventilation in exa-
cerbations of chronic obstructive pulmonary disease. Monaldi
Arch Chest Dis 1998; 53: 337-342.
89. Purro A, Appendini L, De Gaetano A, i wsp.: Physiolo-
gic determinants of ventilator dependence in long-term mecha-
nically ventilated patients. Am J Respir Crit Care Med 2000;
161: 1115-1123.
90. Nava S, Rubini F, Zanotti E, i wsp.: Survival and predic-
tion of successful ventilator weaning in COPD patients requ-
iring mechanical ventilation for more than 21 days. Eur Respir
J 1994; 7: 1645-1652.
91. Nevins ML, Epstein SK: Predictors of outcome for
patients with COPD requiring invasive mechanical ventilation.
Chest 2001; 119: 1840-1849.
92. Esteban A, Anzueto A, Alia I, i wsp.: How is mechanical
ventilation employed in the intensive care unit? An internatio-
nal utilization review. Am J Respir Crit Care Med 2000; 161:
1450-1458.
93. Croxton T.L., Weinman G.G., Senior R.: Clinical re-
search in chronic obstructive pulmonary disease, needs and
opportunities. Am. J. Respir. Crit. Care, 2003, 167, 1142-1149
94. Hilleman D.E., Pharm D., Dewan N. i wsp.: Pharmaco-
economic evaluation of COPD, Chest, 2000, 118, 1278-1285.
95. Jacobson L. Hertzman P., Lőfdahl C.G., i wsp. The
economic impact of asthma and COPD in Sweden in 1980 and
1991. Respir Med 2000; 94: 247 – 255.
96. Ramsey S.D., Sullivan S.D.: The burden of illness and
economic evaluation for COPD. Eur.Respir.J., 2003, 21, suppl
41, 29s-35s
97. Jubran A., Gross N., Ramsdell J.: Comparative costef-
fectiveness analysis of theophylline and ipratropium bromide
in chronic obstructive pulmonary disease. Chest, 1993, 103,
678-684.
98. Belman MJ: Exercise in patients with chronic obstructi-
ve pulmonary disease. Thorax 1993; 48: 936-946.
99. Singh SJ, Morgan MDL, Hardman AE, i wsp.: Compa-
rison of oxygen uptake during a conventional treadmill test and
the shuttle walking test in chronic airflow limitation. Eur Respir
J 1994;7: 2016-2020.
100. Jones PW, Baveystock CM, Littlejohns P: Relation-
ships between general health measured with the Sickness Im-
pact Profile and respiratory symptoms, physiological measures
and mood in patients with chronic airflow limitation. Am Rev
Respir Dis 1989; 140:1538-1543.
101. WHO Copenhagen Cart Glossary. Copenhagen 1989.
102. Guyatt GH, Townsend M, Pugsley SO, i wsp.: Bron-
chodilators in chronic air-flow limitation. Effect on airway
function, exercise capacity and quality of life. Am Rev Respir
Dis 1987; 135:1069-1074.
103. Wedzicha JA, Bestall JC, Garrod R i wsp.: Randomized
controlled trial of pulmonary rehabilitation in severe chronic
obstructive pulmonary disease patients, stratified with the MRC
dyspnoea scale. Eur Respir J 1998;12: 363-369.
104. Wijkstra PJ, Ten Vergert EM, van Altena R, i wsp.:
Long term benefits of rehabilitation at home on quality of life
and exercise tolerance in patients with chronic obstructive pul-
monary disease. Thorax 1995; 50: 824-828.
105. Ries AL, Kaplan RM, Limberg TM: Effects of pulmo-
nary rehabilitation on physiologic and psychological outcomes
patients with chronic obstructive pulmonary disease. Ann In-
tern Med 1995; 122: 823-832.
106. Meecham-Jones DJ, Paul EA, Jones PW, Wedzicha JA:
Nasal pressure support ventilation plus oxygen compared with
oxygen therapy alone in hypercapnic COPD. Am J Respir Crit
Care Med 1995; 152: 538-544.
Piśmiennictwo
Wyszukiwarka
Podobne podstrony:
Leczenie prostaty id 264608 Nieznany
leczenie azs id 264430 Nieznany
Leczenie bolu id 264432 Nieznany
miopatie leczenie diag id 30264 Nieznany
Leczenie prostaty id 264608 Nieznany
Przewlekla Obturacyjna POChP id Nieznany
Leczenie ran2 druk id 264631 Nieznany
Przewodnik po leczeniu ran 2 id Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
więcej podobnych podstron